El cáncer es la segunda causa de muerte por enfermedades crónicas no transmisibles a nivel mundial. Disímiles radiofármacos basados en biomoléculas (anticuerpos monoclonales y sus fragmentos) acopladas a radionúclidos han sido desarrollados con fines oncológicos. Sin embargo, presentaban inmunogenicidad en ocasiones, propiedades farmacocinéticas y tamaño inadecuados.
Impacto de la Hormona Somatostatina y sus Análogos Radiomarcados en el Diagnóstico de Tumores Malignos. Artículo Revisión.
Marlein Miranda Cona 1, Gilmara Pimentel González 2, Rolando Ravelo Silva 3 e Iraida Sánchez Monzón 4.
1. Licenciatura en Química. Master en Ciencias Radioquímicas.
2. Licenciatura en Química. Doctora en Ciencias Químicas.
3. Licenciatura en Radioquímica
4. Técnica en Radiofísica Médica
Centro: Laboratorio de Radiofarmacia, Departamento de Medicina Nuclear, Instituto Nacional de Oncología y Radiobiología.
Resumen
El cáncer es la segunda causa de muerte por enfermedades crónicas no transmisibles a nivel mundial. Disímiles radiofármacos basados en biomoléculas (anticuerpos monoclonales y sus fragmentos) acopladas a radionúclidos han sido desarrollados con fines oncológicos. Sin embargo, presentaban inmunogenicidad en ocasiones, propiedades farmacocinéticas y tamaño inadecuados.
Recientemente, la obtención y evaluación de unidades de reconocimiento molecular más pequeñas: PÉPTIDOS, ha cobrado creciente interés en el campo de la Oncología. Éstos poseen alta especificidad por su receptor, son fáciles de sintetizar y muestran rápido aclaramiento sanguíneo. La somatostatina, es una hormona peptídica que ejerce diversas acciones supresoras en el organismo. Han sido identificados cinco subtipos de receptores de la misma, sobre-expresados en numerosas lesiones malignas en comparación con los tejidos sanos. Sin embargo, dicha hormona no ha sido efectiva por su corto tiempo en circulación debido a la degradación enzimática y su diversidad de acción. Así, mediante ligeras modificaciones en su estructura fueron obtenidos diversos análogos de la somatostatina con mayor estabilidad in vivo y preservación de la actividad biológica de la molécula original. La Centelleografía de Receptores Peptídicos, método diagnóstico por imágenes, conjuga la sensibilidad y especificidad de los péptidos marcados para reconocer receptores sobre-expresados en tumores, con la sensibilidad de la Gammagrafía. Posibilita la visualización e identificación de tumores en estadios primarios, micro-metástasis distantes y lesiones ocultas que por métodos diagnósticos convencionales resulta muy difícil su detección. En este contexto, se han reportado exitosos resultados en el uso clínico de tales agentes radiomarcados en el diagnóstico precoz de algunos tumores malignos.
Palabras Clave: Cáncer, Péptidos, Somatostatina, Receptores, Centelleografía de Receptores Peptídicos, Radionúclido, Análogos de la Somatostatina marcados.
Summary
Malignant tumor diseases account for approximately one third of deaths worldwide. Nowadays, the development of new radiopharmaceutical agents for diagnosis of cancer, has gained a significant interest in the Oncology field. The most recent encouraging advance, is the use of small peptides, which are less immunogenic, can be synthesized easily, have high specificity to its receptor and favorable pharmacokinetic properties in vivo. Somatostatin peptide hormone plays an inhibitory rol on a various physiologic functions in the organism. Five different human somatostatin receptor subtypes have been identified and cloned. Moreover, a great variety of primary tumors and their metastases possess higher somatostatin receptor concentration than normal tissues. Nevertheless, the use of the native hormone isn’t possible since its multiple simultaneous actions and the brief duration of its antisecretory effects. Many efforts have been made to synthesize somatostatin analogues more resistant and with high specificity to somatostatin receptor subtypes. In this sense, the successful clinical introduction of an important diagnostic technique, peptide receptor scintigraphy, has been reported. It is based on bioactive peptides as carrier of gamma or positron-emitting nuclides for visualisation of human somatostatin receptor positive tumours, showing higher sensitivity than other conventional techniques.
Key words: Cancer, Peptides, Somatostatin, Receptor, Peptide Receptor Scintigraphy, Radionuclide, Labeled Somatostatin Analogues.
Introducción
Reportes de la Organización Mundial de la Salud indican, que el cáncer es una de las principales causas de muerte a nivel mundial. De las 58 millones de defunciones que se registraron en el mundo en el 2005, se debieron a tumores malignos 7,6 millones (13%). Más del 70% de las muertes por cáncer registradas en el 2005 se produjeron en países de bajos y medianos ingresos. Se prevé que el número mundial de muertes siga aumentando en todo el mundo y alcance los 9 millones en el 2015 y los 11,4 millones en el 2030.1 Por tal motivo, el desarrollo de nuevas técnicas más sensibles y efectivas ocupan un lugar esencial en el diagnóstico precoz, estadiamiento, tratamiento eficaz y seguimiento de las neoplasias y sus metástasis.
En las últimas décadas, las llamadas técnicas radiológicas convencionales: Ultrasonido (US), Tomografía Axial Computarizada (TAC) e Imágenes por Resonancia Magnética (IRM), permitieron reducir el empleo de técnicas invasivas de diagnóstico que resultaban traumáticas para el paciente. Sin embargo, la detección temprana y estadiamiento de la enfermedad continuaban siendo importantes problemas clínicos por resolver, que contribuyen directa e indirectamente en la selección idónea y el éxito del tratamiento.
Antecedentes
En 1975, emerge el fenómeno de los AcMo2, considerados por muchos como la “bala mágica”, debido a su diversidad y elevada afinidad por el antígeno especifico. Éstos prometían ser vehículos transportadores ideales de radionúclidos, drogas y toxinas; con potenciales aplicaciones diagnósticas y/o terapéuticas.3 La radioinmunodetección es un método diagnóstico por imágenes, basado en el uso de AcMo y sus fragmentos acoplados a radionúclidos emisores gama (ej: 99mTc, 123I, 111In). Esta técnica permite detectar lesiones malignas y distinguir los contornos de la masa tumoral del resto del tejido con mayor facilidad que con otras técnicas.4 Trabajos iniciales con AcMo murinos, ofrecieron una amplia variedad de posibles agentes farmacéuticos, pero resultaban inmunogénicos en ocasiones y poseían pobre reconocimiento por las células inmunes efectoras humanas.3
Como alternativa, se desarrollaron AcMo quiméricos, humanizados y humanos,5,6 pero exhiben reacción cruzada con antígenos no asociados al tumor y formación de inmunocomplejos.7 Mantienen los problemas relacionados con el tamaño y elevado peso molecular (peso molecular ~ 150 kDa) causantes de una escasa extravasación celular desde la sangre; pobre vascularización y drenaje linfático tumoral,8 conllevando a una captación lenta en el tumor. Además, éstos al ser acoplados a radioisótopos muestran complejidades adicionales, pues su lenta depuración sanguínea (varios días hasta semanas) conduce a una elevada actividad de fondo, reduciendo el contraste en las imágenes (relación tumor/ no tumor) e incrementando la exposición radiacional de los órganos sanos.
Más tarde, se reporta el empleo de fragmentos de AcMo altamente específicos (scFvs, 25 kDa; dímeros de scFvs, 55 kDa, etc).9 Éstos al poseer pesos moleculares más pequeños exhiben aclaramiento sanguíneo más rápido, distribución tisular más homogénea, mayor captación en tumor, recidivas locales y metástasis, con respecto a la molécula intacta del AcMo,10 posibilitando mejorar la relación tumor/ no tumor. No obstante, aún poseen un peso molecular de varios miles de Da que limitan su penetrabilidad tumoral principalmente en la detección precoz de lesiones pequeñas y micrometástasis.
A fines de la década de los ochenta, el descubrimiento de ciertos tipos de tumores que sobre-expresan receptores por ciertas hormonas peptídicas reguladoras, así como la alta afinidad y especificidad de las mismas por estos receptores; condujeron al desarrollo de unidades de reconocimiento molecular aún más pequeñas: Péptidos (peso molecular <5,5 kDa)11 de rápido aclaramiento sanguíneo. Igualmente, el advenimiento de métodos automatizados para la síntesis, purificación y caracterización de estos compuestos en grandes cantidades, contribuyó a un desarrollo comercial acelerado y consecuentemente a una explosión en el número de péptidos potencialmente útiles.12 Si bien los mismos ofrecen numerosas ventajas, existe una variedad de obstáculos que pueden entorpecer el desarrollo de los mismos. Los péptidos usualmente poseen menos de 50 aminoácidos y peso molecular < 5,5 kDa.11 Un péptido con bajo peso molecular exhibe baja antigenicidad, rápido aclaramiento sanguíneo y rápida penetración tisular y tumoral.13,14 Sin embargo, a medida que el tamaño se aproxima a los 5,5 kDa, las moléculas peptídicas mayores difunden más lentamente al interno del tumor y pueden ser altamente susceptibles a la proteolisis. Por otra parte, para acoplar un radionúclido con propiedades diagnósticas y/o terapéuticas, se emplea un agente quelante bifuncional (BFCA), cuyo peso molecular de ~ 300 Da comparable al del péptido al cual es enlazado, puede distorsionar la conformación peptídica, y por ende afectar el enlazamiento al órgano blanco15 o alterar su distribución in vivo.16 Por tanto, el BFCA debe ser acoplado de modo tal, que no interfiera con el reconocimiento del péptido por su receptor, Ej.: introducción de la marca a distancia del sitio de enlazamiento o de aminoácidos espaciadores entre el péptido y el BFCA.17,18
La mayoría de los péptidos endógenos tienen un tiempo de vida media biológico demasiado corto para su empleo con fines oncológicos, debido generalmente a su rápida degradación in vivo y sus múltiples acciones. Las enzimas usualmente poseen funciones muy bien definidas tales como: degradación del C- o N-terminal (exopeptidasas) o ruptura del enlace entre los L-amino ácidos (endopeptidasas). Por tanto, transformaciones estructurales tales como: uso de D-aminoácidos, modificación de aminoácidos terminales, ciclización, substitución de enlaces peptídicos, reemplazo de grupos aminos por grupos iminos; empleo de péptidos miméticos, aminoácidos o cadenas laterales inusuales, moléculas no-peptídicas con configuración similar, así como del fragmento (sitio de reconocimiento) que enlaza al receptor, si se conoce previamente el sitio susceptible a la ruptura; pueden reducir la degradación enzimática in vivo de la molécula peptídica, aunque pueda verse afectada su habilidad para enlazar al receptor específico sobreexpresado en tumor.19
Este documento ofrece una detallada revisión sobre la evolución de novedosos agentes diagnósticos basados en moléculas peptídicas marcadas, las cuales se encuentran comercialmente disponibles o en ensayo clínico.
Somatostatina y sus Análogos
La Somatostatina (SST) es una hormona peptídica cíclica de 14 aminoácidos (Fig.1) y peso molecular 1,6 kDa, aislada del hipotálamo ovino.20 Esta se encuentran distribuida ampliamente en el organismo, especialmente en el sistema nervioso central y periférico, sistema digestivo y glándulas endocrinas. Interviene en un amplio espectro de acciones biológicas supresoras sobre la fisiología normal de diferentes órganos a nivel celular Ej.: neurotransmisión, neuromodulación, liberación hormonal de la hipófisis anterior y glándulas periféricas; secreción de factores de crecimiento; proliferación celular y procesos de angiogénesis. Su efecto inhibitorio sobre la secreción hormonal de varias glándulas infiere sus posibles efectos beneficiosos en el manejo de patologías relacionadas con la hiperfunción de glándulas o sobreproducción de hormonas por tumores neuro-endocrinos activos.21 Cinco subtipos de receptores de la somatostatina (SSTRs: ssrt1, sstr2, sstr3, sstr4 y ssrt5), han sido identificados; estas glicoproteínas aparecen en células del tracto gastrointestinal, el sistema nervioso central, e incluso en células del sistema inmune.22,23 Estudios revelan sobre-expresión de dichos receptores de la somatostatina (SSTRs) en un gran número de tumores primarios humanos y sus metástasis con respecto a los tejidos sanos: tumores neuroendocrinos, cáncer de mama, pulmón, sarcoma, próstata, etc.24 No obstante, la somatostatina no ha sido efectiva por su corto tiempo biológico en circulación (2-3 min), debido a posibles efectos de rebote hormonal; su rápida degradación enzimática y sus múltiples funciones.21
A fines de los setenta, se reporta la síntesis y evaluación de análogos de la somatostatina 22-24 más resistentes a la acción de las enzimas peptidasas; sintetizados a partir de modificaciones en su estructura. (Fig.1). Estas transformaciones le confieren al péptido mayor estabilidad y tiempo de vida in vivo (2-3 horas) y preservan la actividad biológica de la molécula original; no obstante, pueden afectar el grado de afinidad de los análogos por los cinco receptores de la somatostatina.24 Así, en 1979, se sintetiza el primer análogo de la somatostatina, Octreotide (OC)25 mediante la reducción del tamaño molecular de 14 a 8 aminoácidos, introducción de un aminoácido D-Fenilalanina N-terminal, intervención en el enlace peptídico del grupo amino-alcohol-Treonin(ol) proveniente del aminoácido Treonina C-terminal y substitución en el sitio de reconocimiento ligando receptor del L-Triptófano por su D-isómero. El Octreotide se enlaza con alta afinidad a sstr2, con relativa baja afinidad a ssrt3 y ssrt5 y no reconoce a ssrt1 y sstr4.25
Más recientemente, se obtiene el Octreotate (Oc-ATE), mediante el reemplazo del grupo alcohol en el carboxilo terminal del Octreotide por un grupo ácido carboxílico para incrementar la afinidad por el sstr2, ya que este receptor se encuentra altamente expresado en ciertos tumores malignos. El Oc-ATE enlaza con mayor afinidad a sstr2 que el Octreotide, pero muestra una reducción en su reconocimiento por el resto de los receptores de la somatostatina. 26
Estudios in vitro con el análogo Vapreotide (RC-160), reportan mayor afinidad por los ssrts en cáncer de mama, ovario, páncreas, colón y próstata que el Octreotide. El RC-160 no marcado atraviesa la barrera hematoencefálica, en contraste con el Octreotide; lo cual permite emplear el RC-160 marcado en la visualización de tumores y metástasis cerebrales que contengan receptores de la somatostatina.27 Asimismo, otro derivado que ha suscitado creciente interés, es el Lanreotide. Este posee afinidad moderada por ssrt2, ssrt3, ssrt4, sstr5 y no enlaza a ssrt1.28
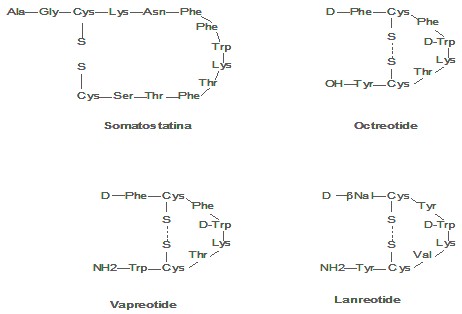
Fig.1. Somatostatina y varios de sus análogos.
El uso clínico de estas moléculas sintéticas ha mostrado exitosos resultados en el tratamiento de tumores gastroenteropancreáticos.24
Centelleografía de Receptores Peptídicos
La Centelleografía de Receptores Peptídicos (CRP) es un método diagnóstico, que conjuga la sensibilidad y especificidad de las pequeñas moléculas peptídicas previamente acopladas a un radioisótopo emisor gama o positrónico, para reconocer receptores presentes en las membranas celulares con la gran sensibilidad de la Gammagrafía;29 mediante el uso de cámaras gama y más recientemente Tomografía por Emisión de Fotón Único (SPECT) o Tomografía por Emisión de Fotones (PET).
El éxito de la Centelleografía de Receptores Peptídicos depende del bajo peso molecular del péptido de interés; selección adecuada del radionúclido; estabilidad de la marca in vivo; unión radiopéptido receptor instantánea con alta afinidad en presencia de elevada densidad del receptor específico y baja expresión del mismo en tejidos sanos. Principalmente, son preferidos aquellos péptidos que exhiban internalización celular, pues al ser atrapados en el interior de la célula posibilitan obtener imágenes más contrastadas (mayor relación tumor/ no tumor). La combinación de estas propiedades permite una eficiente visualización tumoral minutos después de la administración del radiofármaco.
Esta técnica es considerada como una efectiva modalidad por imágenes basada en la presencia de receptores funcionales más que en las características anatómicas del tumor.30 Brinda información sobre el origen de las células tumorales, permite la valoración del pronóstico del paciente y del posible tratamiento; al posibilitar la detección de tumores en estadios primarios, micro-metástasis distantes y lesiones ocultas que por métodos diagnósticos convencionales resulta muy difícil su detección; y al ser identificados precozmente podrán ser tratados por cirugía o radioterapia externa local.31
Es útil realizar una comparación directa del desempeño entre PET y SPECT. El PET puede ser considerado como una tomografía por emisión de fotón doble en contraste con la tomografía por emisión monofotónica. Las principales ventajas del PET surgen de las propiedades físicas de la emisión de positrones. Cuando un positrón, electrón cargado positivamente, es emitido desde el núcleo, viaja una corta distancia perdiendo energía hasta que alcanza el estado de reposo. Entonces interactúa con otro electrón del medio de modo que ambos se aniquilan dando lugar a dos fotones gama que viajan en direcciones opuestas. Por tanto, al contrario del SPECT donde normalmente un fotón único es emitido y detectado en cada desintegración, en PET es emitido un par de fotones y en consecuencia su detección involucra un par de detectores en situación opuesta que debe registrar eventos en un mismo instante de tiempo. Al contrario de las cámaras gama o SPECT la detección no se limita a aquellos fotones que viajan en ángulos rectos respecto al detector y en consecuencia la sensibilidad es varias veces mayor en PET que para SPECT. 32
Por tanto, la principal ventaja del PET comparado con SPECT, es la mejor capacidad de cuantificación. La principal desventaja del PET es el costo tanto de la cámara como del ciclotrón, la complejidad del procedimiento, la disponibilidad de radionucleidos emisores de positrones y la tasa de dosis relativamente alta que recibe el paciente.32
No obstante, ambos sistemas carecen de la resolución anatómica del US, TAC o IRM. En años recientes, ha cobrado creciente interés la combinación del SPECT y el PET con la TAC e IRM para hacer scanners híbridos PET / TAC33,34, SPECT/ TAC35,36 y PET / IRM37,38. Esta novedosa tecnología provee información tanto anatómica como funcional mediante la fusión de imágenes co-registradas, con vistas a definir un parámetro biológico específico en una localización anatómica claramente definida.39 Un número creciente de investigaciones reportan resultados exitosos mediante imágenes de fusión para la localización preoperatoria de tumores, detección de enfermedades recurrentes, estadiamiento tumoral y predicción de la respuesta tumoral. En todos los estudios, la fusión de los datos de imágenes cross-seccionales (TAC o IRM) con imágenes de radionúclidos contribuyeron con el mejoramiento en la detección tumoral, permitió cambios de estadíos en el paciente, diagnóstico y manejo terapéutico.40-42
Radionúclidos más usados en el marcaje de péptidos
El empleo de radiopéptidos para el diagnóstico de tumores malignos, presupone el marcaje del péptido con un radionúclido emisor de rayos gama o partículas positrones. Generalmente, los radionúclidos usados en medicina nuclear son producidos en complejas instalaciones nucleares, ciclotrón o reactor nuclear. La construcción, explotación, mantenimiento de las mismas, así como las tecnologías empleadas, son sumamente caras, y por ende prohibitivas para países con limitados recursos. Una alternativa ideal, es el generador, fácilmente transportable, considerablemente más barato y sirve como fuente de radioisótopos a instituciones o países distantes o que no cuentan con el presupuesto económico necesario para poseer un ciclotrón o un reactor nuclear.
Para la selección del radionúclido es necesario tener en cuenta algunos aspectos importantes:
Período de semidesintegración (t1/2) adecuado para el estudio. La energía de emisión deberá proveer imágenes gammagráficas de buena calidad, especialmente en estudios CRP-SPECT deberá estar entre 100-300 keV, en cuyo intervalo la eficiencia de la cámara gama es máxima. Debe provocar la mínima dosis de radiación al paciente, particularmente en tejidos sanos y órganos críticos. Su costo debe ser aceptable y su disponibilidad elevada.
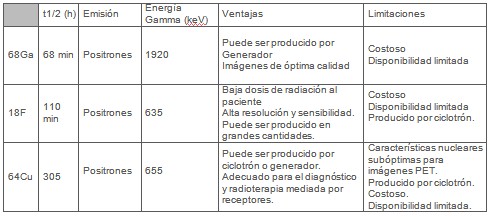
El acoplamiento del radionúclido al péptido deberá efectuarse mediante un procedimiento rápido y sencillo; que exhiba altos rendimientos de marcaje con elevada actividad específica y conservación de la actividad biológica del péptido. En las Tabla 1 y Tabla 2 se muestran los radionúclidos más usados en SPECT y PET, respectivamente.
Tabla 1: Radionúclidos más usados en SPECT.
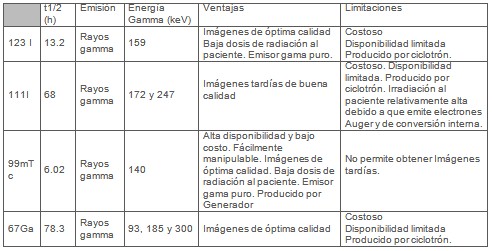
Tabla. 2: Radionúclidos más usados en PET.
Los métodos destinados al radiomarcaje de péptidos se divide en dos grandes grupos: (i) método directo (ii) método indirecto.
La técnica directa se basa en el acoplamiento del radionúclido directamente a los aminoácidos que conforman la secuencia peptídica. Sin embargo, posee diversas limitaciones tales como: rápida deshalogenación in vivo en el caso de la radioiodinación o verse afectada su actividad biológica debido a posibles transformaciones estructurales del sitio de enlazamiento, si éste se encuentra involucrado en la formación del complejo péptido-radionúclido como en el caso de los 99mTc-péptidos, mientras que en la técnica indirecta se emplean grupos prostéticos o BFCAs. La misma fue desarrollada como una alternativa para el marcaje de péptidos, cuyas modificaciones moleculares no son posibles y/o las condiciones de reacción empleadas durante el método directo puedan afectar el reconocimiento del péptido por el receptor.
En general el uso de BFCAs se fundamenta en la conjugación mediante la formación de un enlace amida, entre un grupo carboxilo del BFCA en forma de éster activado y el grupo amino N-terminal del aminoácido Lisina o D-Fenilalanina de la secuencia peptídica en cuestión. Ulteriormente, el BFCA será capaz de aportar los grupos reactivos para el acoplamiento del radionúclido con elevada estabilidad.
Más recientemente, se reporta una nueva variante consistente en el acoplamiento de un brazo de naturaleza aminoacídica durante la síntesis en fase sólida del péptido, para su enlazamiento al 99mTc. Esta técnica permite acoplar el ligando espaciador y el BFCA durante el proceso de síntesis de la secuencia peptídica. Por tanto, posee ventajas distintivas con respecto a la conjugación convencional del BFCA en solución Ej.: ahorro de reactivos, optimización mínima de las condiciones de reacción y menos pasos de purificación durante el proceso, etc. El empleo del grupo prostético, se basa en la conversión del mismo a un éster activo correspondiente y su acoplamiento a grupos aminos por medio de un residuo de lisina pertenecientes al péptido en cuestión. En la Tabla 3 y Tabla 4 se muestran brevemente los métodos de radiomarcaje empleados para cada radionúclido SPECT o PET, respectivamente.
Tabla 3. Radionúclidos SPECT. Métodos más empleados para el marcaje de péptidos.
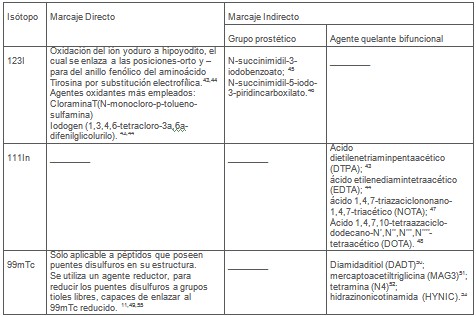
Tabla 4. Radionúclidos PET. Métodos más empleados para el marcaje de péptidos.

Centelleografía de Receptores Peptídicos. Su evolución.
El desarrollo de la Centelleografía de Receptores Peptídicos se inicia con el empleo del agente 123I-[Tyr]-octreotide en la visualización de tumores endocrinos in vivo, pero mostraba aclaramiento sanguíneo por vía hepatobiliar, impidiendo la detección de tumores pequeños en abdomen.64
En la década de los ochenta, se obtiene el 111In-DTPA-octreotide (Octreoscan),65 radiofármaco peptídico más ampliamente usado en el diagnóstico de patologías malignas, donde el Octreotide es acoplado al anhídrido bicíclico DTPA. Este nuevo agente resultó ser más ventajoso debido a su rápido aclaramiento sanguíneo por vía hepatobiliar y renal, requisito esencial en la localización de tumores ocultos en el hígado y tracto gastrointestinal, aún minutos después de su administración.66 El t1/2 relativamente largo del 111In permitió obtener imágenes tardías con alta relación tumor/ no tumor a las 24 y 48 horas después de la inyección del radiofármaco.
No obstante, los tumores que expresan los subtipos de receptores de somatostatina reconocidos por el Octreoscan generalmente sólo sobre-expresan el sstr2.67 Además, el DTPA no es un BFCA adecuado para acomplejar radiometales, observándose disociación del metal in vivo. Como alternativa, la introducción del BFCA poliamino carboxilato macrocíclico DOTA68 que forma complejos muy estables con diversos iones metálicos bajo condiciones fisiológicas, permitió la obtención de nuevos agentes diagnósticos más efectivos en la visualización de tumores que el Octreoscan, ej.: 111In-DOTA-lanreotide69,70, 111In-[DOTA-D-Phe1] octreotide (DOTAOC)71,72, 111In-[DOTA-D-Phe1]vapreotide73, etc.
Generalmente, la distribución de los radiofármacos diagnósticos y terapéuticos sobre un tumor sólido no es homogénea. Debido a la incapacidad de las moléculas radiomarcadas para penetrar diversas regiones en el interior de una masa tumoral sólida o diferencias en las densidades de sitios de enlazamiento específico de células tumorales individuales. Numerosos estudios confirman la considerable heterogeneidad en la expresión individual de cada receptor en tumores del mismo y diferente tipo, siendo el sstr2, el más predominantemente expresado en una variedad de tumor o ausente o expresado en menor densidad en otro número significativo de neoplasias. Así, en tumores de pulmón se reportaron los sstr2, sstr3 y sstr574, Los adenomas productores de hormona de crecimiento expresan sstr2 y sstr5, pero existe una expresión predominante de sstr3 en adenomas de la hipófisis inactivos75 y en timomas76; una alta incidencia de sstr1-sstr3 han sido revelados en cáncer cervical y endometrial.77 La expresión de sstr1-sstr3 y sstr5 es frecuente en tumores gastroenteropancreáticos, cáncer medular del tiroides y cáncer de ovario, etc.78
Con vistas a extender no sólo el rango actual de cánceres diana sino también incrementar la captación tumoral, dada la presencia de diferentes subtipos de receptores sobre la misma célula tumoral o en el mismo tumor, recientes investigaciones han sido reportadas. Éstas exhiben el desarrollo de derivados de la somatostatina radiomarcados con perfiles de enlazamiento superiores a los radiopéptidos ya existentes basados en la hormona nativa somatostatina Ej.: el 111In-DOTA0-Nal3-octreotide exhibe alta afinidad por sstr2, sstr3 y sstr5, aunque baja por sstr1 y sstr4; mientras que 111In-DOTA-Nal3-Thr8-octreotide y 111In-DOTA-BzThi3-Thr8-octreotide, muestran ambos elevada afinidad por sstr2, sstr3 y sstr5 e intermedia por sstr4. Estos exitosos resultados sugieren promisorias aplicaciones en el manejo del cáncer.79
Paralelamente, autores reportan el empleo de numerosos radiopéptidos basados en el atractivo radionúclido 99mTc, con excelentes resultados en la clínica. Ej (99mTc)-depreotide80, 99mTc-[N40-Tyr3]-octreotate (99mTc-demotate)81, 99mTc-HYNIC-DPhe1-Tyr3-octreotide82, 99mTc-EDDA-HYNIC-Tyr3-octreotide83, 99mTc-MAG3-vapreotide84, etc.
En particular el depreotide (NeoSpect/NeoTect [99mTc-P829] (Amersham Health/GE Healthcare), kit comercial, ha cobrado una gran atención en el campo de la oncología debido a sus excelentes resultados como agente imagenológico en la evaluación de nódulos pulmonares solitarios indeterminados.80 El mismo posee elevada afinidad por sstr2, sstr3 y sstr5, mostrando una visualización tumoral más rápida con relación al Octreoscan (1d vs 2d). A diferencia del Octreotide, el Depreotide, posee una configuración cíclica sin la presencia de un puente disulfuro entre los residuos de Cisteína (Cys) que delimitan los aminoácidos pertenecientes al sitio de enlazamiento a receptor. Esta configuración hace al péptido invulnerable a la ruptura por reducción del ciclo Cys-Cys, confiriéndole estabilidad durante el radiomarcaje directo con 99mTc.80
Por otra parte, estudios comparativos, de diversos análogos de la somatostatina-DOTA radiomarcados con 68/67Ga e 111In, para evaluar la influencia de diferentes radiometales sobre el comportamiento biológico. Muestran las superiores características farmacocinéticas de los análogos marcados con 67/68Ga, convirtiendo a estos agentes en candidatos potenciales para la detección in vivo de tumores que expresan receptores de la somatostatina. Al compararlos se observó que aquellos marcados con los radioisótopos Galio exhiben mayores afinidad e internalización mediada por receptor en células de tumor pancreático de ratas AR42J (positivas a sstr2) in vitro.
Además, estudios de biodistribución de todos los análogos DOTA-somatostatina (radiomarcados con 68/67Ga o 111In) en ratones desnudos con tumores implantados, mostraron parámetros farmacocinéticos más favorables (mayores captación tumoral específica, aclaramiento sanguíneo, menor retención renal) que el 111In-DTPA-octreotide (usado como estándar interno). Igualmente, en esta ocasión, los análogos marcados con 68/67Ga muestran mayor captación en tejidos positivos a receptores de la somatostatina (suprarrenales, páncreas, y tumor) que sus contrapartes acoplados a 111In. Estos resultados indican que la selección del radiometal influye considerablemente con el comportamiento biológico del análogo de la somatostatina asociado, debido a diferencias existentes entre el número de coordinación y la geometría adoptada por los diversos complejos metálicos formados (68/67Ga – DOTA-péptido o 111In-– DOTA-péptido).
Recientemente, ha sido sintetizado y caracterizado un agente quelante bifuncional monorreactivo NOTA acoplado al N-terminal del [Tyr]-octreotide (TOC).85 El péptido resultante, NODAGA-Tyr3-octreotide (NODAGATOC), fue radiomarcado con 67Ga y 111In y testado para la visualización de tumores positivos-sstr2 (i.e., tumores neuroendocrinos). Ambos radiopéptidos mostraron alta internalización específica en células AR42J. Sin embargo, 111In-NODAGATOC mostró mejor afinidad por SSTR-2 in vitro. Mientras que en ratones con tumores implantados AR42J (sstr2 positivos), el 67Ga-NODAGATOC presentó excreción más rápida desde todos los órganos no blancos excepto los riñones y mayor captación en órganos dianas (suprarrenales, páncreas y estómago) y tumor. No obstante, se observó una eliminación relativamente rápida desde el tumor y órganos positivos a receptores de la somatostatina. Nuevos análisis son requeridos para determinar el potencial de este nuevo compuesto como agente diagnóstico por imágenes.86
Particularmente, entre los radioisótopos Galio, el emisor positrónico 68Ga ha obtenido un gran interés debido a sus adecuadas propiedades radiofísicas. Sin embargo, su ventaja más importante es su disponibilidad a partir de un generador 68Ge/68Ga, lo cual obvia la necesidad de un ciclotrón. Especialmente atractiva es la larga vida media el radionúclido padre, 68Ge, de 270.8 días, permitiendo el uso del generador durante más de un año.87 Actualmente, un modelo de este generador está disponible comercialmente motivando a numerosos investigadores a desarrollar nuevos agentes radiomarcados, incentivados aún más, por las ventajas adicionales ofrecidas por los radionúclidos emisores positrónicos ej: 68Ga, 18F, 64Cu, etc; con relación a la sensibilidad superior de la PET en comparación con la SPECT.
En cuanto al 18F, autores reportan sus numerosas aplicaciones en el marcaje de péptidos con fines oncológicos88-91 ej: 4-[18F]-Fluorobenzoil-octreotide92 y (2-[18F] Fluoropropionil-(D)-Phe1)-octreotide.91 El 18F, parece ser un radionúclido atractivo para estudios de imágenes por receptor debido a la combinación de su t1/2 significativamente corto con los péptidos de bajo peso molecular, cuyo rápido aclaramiento sanguíneo permite obtener imágenes más contrastadas, o sea, mayor relación tumor/ no tumor, reduciendo la irradiación innecesaria de los tejidos sanos. 88-91
Estudios con otro radiopéptido, 64Cu-TETA-octreotide, revela elevada afinidad en comparación con 111In-DTPA-octreotide en membranas de células de carcinoma hipofisiario de ratón AtT20 in vitro. En pacientes con tumores neuroendocrinos, 64Cu-TETA-octreotide mostró similar biodistribución pero mejor detección tumoral que el 111In-DTPA-octreotide.
Los resultados sugieren que el 64Cu-TETA-octreotide es un agente promisorio para la visualización de imágenes PET de tumores neuroendocrinos. Un nuevo análogo de la somatostatina asociado a DOTA a través del residuo D-Tyr1 del péptido fue preparado y radiomarcado con 64Cu.93 El complejo resultante 64Cu-DOTA-D-Tyr1-octreotate (DOTA-DY1-TATE), retuvo alta afinidad por membranas de tumor pancreático en AR42J rata in vitro. Igualmente, estudios de biodistribución in vivo en ratas con tumor implantado AR42J mostraron alta captación de 64Cu-DOTA-DY1-TATE mediada por receptores de la somatostatina en páncreas y tumor. En cuanto a la retención prolongada en sangre e hígado fue probablemente debido a la poca estabilidad del complejo péptido-metal.93
Proyecciones futuras
Nuevos análogos de la somatostatina capaces de enlazar los cinco receptores de la somatostatina se encuentran en estudio, incluyendo aquellos receptores poco reconocidos (sstr1 y sstr4) por los análogos ya existentes Ej.: SOM230 enlaza con alta afinidad a sstr1-sstr13 y a sstr5, pero no a sstr4. 94
Recientemente los investigadores han incursionado en la evaluación pre-clínica de un nuevo radioligando pansomatostatina, KE 108, el cual exhibe mayor afinidad por los cinco receptores de la somatostatina que la propia hormona nativa somatostatina, aún después de ser radioiodinado o modificado por su acoplamiento con DOTA.95
Conclusiones
El desarrollo de radiofármacos basados en pequeñas moléculas peptídicas ha constituido un hito en el manejo de enfermedades cancerígenas, debido a sus excelentes propiedades farmacocinéticas y la elevada afinidad por el receptor específico sobreexpresado en la lesión tumoral. Nuevos agentes más efectivos y sensible continúan bajo evaluación pre-clínica o en ensayo clínico con resultados promisorios. La introducción de los mismos permitirá la detección cada vez más temprana de lesiones malignas y sus metástasis, y por ende, contribuirá con el mejoramiento de la calidad de vida y prolongación de la sobrevida de nuestros pacientes oncológicos.
Referencias bibliográficas
- Organización Mundial de la Salud. 2006, Nota descriptiva N°297.
- Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975;256 (5517): 495-7.
- Anna M Wu, Peter D Senter. Arming antibodies: prospects and challenges for inmunoconjugates. Nature Biotechnology 2005; 23 (9); 1137-46.
- Larson SM. Clinical Radioimmunodetection, 1978-1988: overview and sugestion for standarization of clical trials. Cancer Res 1990; 50 (suppl) 892s-898s.
- Feldhaus, M.J. & Siegel R. W. Yeast display of antibody fragments a discovey and characterization platform. J.Immuno. Methods 2004; 290 : 69-80.
- Lonberg N et al. Antigen-specific human antibodies from mice compromising four distinct genetic modifications. Nature 1994; 368: 856 - 9.
- Ruiz-Cabello F, Cabrera T, López-Nevot MA & Garrido F. Impaired surface antigen presentation in tumors: implications for T cell-based immunotherapy. Semin Cancer Bio 2002; 12:15 -24.
- Jain RK. Tumor physiology and antobody delivery. Front. Radiat. Ther. Oncol 2, 1990. 32-46; 64 - 68.
- Hulahov, A & Chester KA. Engineered single chain antibody fragments for radioimmunotherapy. Q J Nucl Med Mol Imaging 2004; 48: 279 -88.
- Adams GP et al. High affinity restricts the localization and tumor penetration of single-chain Fv antibody molecules. Cancer Res 2001; 61: 4750 -55 .
- Okarvi SM. Recent developments in 99mTc-labelled peptide-based radiopharmaceuticals: an overview. Nucl Med Commun 1999; 20: 1093 -112.
- Weiner RE & Thakur ML Radiolabeled Peptides in Oncology Role in Diagnosis and Treatment. Biodrugs 2005; 19 (3): 145 - 63.
- Fujimori K, Covell DG, Fletcher JE, et al. A modeling analysis of monoclonal antibody percolation through tumors: a binding-site barrier. J Nucl Med 1990; 31: 1191-8.
- Jain RK. Transport of molecules in the tumor interstitium: a review. Cancer Res 1987; 47: 3039-51.
- Baidoo KE, Lin K-S, Zhan Y, et al. Design, synthesis, and initial evaluation of high-affinity technetium bombesin analogues. Bioconjug Chem 1998; 10: 218-25
- Qu T, Wang Y, Zhu Z, et al. Different chelators and different peptides together influence the in vivo properties of 99mTc. Nucl Med Commun 2001; 22: 203-15.
- Pallela VR, Consigny M, Patti R, et al. Thrombospondin analog 99mTc-TP-1201 for imaging thrombosis. J Lab Comp Radiopharm 1997; 40: 452-5.
- Pallela VR, Thakur ML, Chakder S, et al. 99mTc-labeled vasoactive intestinal peptide receptor agonist: functional studies. J Nucl Med 1999; 40: 352-60.
- Ronald E. Weiner and Mathew L. Thakur. Radiolabeled Peptides in Oncology Role in Diagnosis and Treatment. Biodrugs 2005; 19 (3): 145 - 63.
- Gustavsson S, Lundquist G. Biochem Biophys Res Commun 1978;82(4):1229-35.
- Guillemin R. Peptide in the brain: The new endocrinology of the neurons. Science 1978; 202 : 39 -402.
- Arnold R, Simon B, Wied M. Treatment of neuroendocrine GEP tumours with somatostatin analogues: a review. Digestion 2000; 62 Suppl 1:84-91.
- Fehmann HC, Wulbrand U, Arnold R. Treatment of endocrinegastroenteropancreatic tumors with somatostatin analogues. Recent Results Cancer Res 2000; 153:15-22.
- Reubi JC, Waser B, Schaer JC et al. Somatostatin receptor sstr1-sstr5 expression in normal and neoplastic human tissues using receptor autoradiography with subtype-selective ligands. Eur J Nucl Med 2001; 28:836- 46.
- Bauer W, Briner U, Doepfner W et al. SMS201-995: a very potent and selective octapeptide analogue of somatostatin with prolonged action. Life Sci 1982; 31(11) :1133 - 40.
- Kwekkeboom DJ, Bakker WH, Kooij PP et al. [177Lu-DOTA0-Tyr3]octreotate: comparison with [111In-DTPA0]octreotide in patients. Eur J Nucl Med 2001; 28:1319– 25.
27. Pinski J, Milovanovic TY, Hamaoui A et al. Biological activity and receptor binding characteristics to various human tumors of acetylated somatostatin receptors. Proc Soc Exp Biol Med 1992; 200: 49–56.
28. Smith-Jones PM, Bischof C, Leimer M, et al. DOTA-lanreotide: a novel somatostatin analog for tumor diagnosis and therapy. Endocrinology 1999; 140: 5136 - 48.
29. Kaltsas GA, Mukherjee JJ & Grossman AB. The value of radiolabelled MIBG and octreotide in the diagnosis and management of neuroendocrine tumours. Annals of Oncology 2001; 12 (Suppl 2) S47–S50.
30. de Herder WW, Hofland LJ, van der Lely AJ et al. Peptide receptors in gut endocrine tumours. Bailliere’s Clinical Gastroenterology 1996; 10: 571–87.
31. Van EijK CHJ, Krenning EP, Bootsma A, Oei HY, Van Pel R, Lindemans J et al. Somatostatin -receptor scintigraphy in primary breast cancer. Lancet 1994; 12:640-3.
32. Brian F. Hutton. Tomografía por Emisión. Temas Avanzados. In: Heather E. Patterson y Brian F. Hutton, editors. Versión en Español: Margarita Núñez. Organización Internacional de Energía Atómica. Programa Asistido de Capacitación a Distancia para Tecnólogos en Medicina Nuclear. Módulo 9. Unidad 12 b.
33. Jarrit PH, Carson KJ, Hounsel AR et al. The rol of PET/CT scanning in radioteherapy planning. Br J Radiol 2006 Spec No 1: S27-35.
34. Tsukamoto E, Ochi S. PET/CT today: system and its impact on cancer diagnosis. Ann Nucl Med 2006; 20 : 255-67.
35. Schillaci O, Filippi L, Danieli R et al. Single-photon emision computed tomography/ computed tomography in abdominal diseases. Semin Nucl Med 2007; 37: 48-61
36. Schillaci O, Filippi L, Manni C et al. Single-photon emision computed tomography/ computed tomography in brain tumors. Semin Nucl Med 2007; 37: 34-47.
37. Pichler BJ, Judenhofer MS, Catana C et al. Performance test of an LSO-APD detector in a 7-T MRI scanner for simultaneaus PET/MRI. J Nucl Med 2006; 47: 639-47.
38. Seemann MD. Whole-body PET/MRI: The future in oncological imaging. Technol Cancer Res Treat 2005; 4: 577-82.
39. Yamamoto Y, Nishiyama Y, Monden T et al. Clinical usefulness of fusion of 131I SPECT and CT images in patients with differentiated thyroid carcinoma. J Nucl Med 2003; 44: 1905-10.
40. Schillaci O, Spanu A, Madeddu G. [99mTc]sestamibi and [99mTc]tetrofosmin in oncology: SPET and fusion imaging in lung cancer, malignant lymphomas and tumors. Q J Nucl Med Mol Imaging 2005; 49: 133-44.
41. Von Schulthess GK. Integrated modality imaging with PET-CT and SPECT-CT: CT issues. Eur Radiol 2005; 15 Suppl 4: D121-6.
42. Schillaci O. Single-photon emision computed tomography/ computed tomography in in lung cancer, malignant lymphoma. Semin Nucl Med 2006; 36: 275-85.
43. Thakur ML. Radiolabelled peptides: Now and the future. Nucl Med Commun 1995;16:724–32.
44. Fischman AJ, Babich JW, Strauss HW. A ticket to ride: Peptide radiopharmaceuticals. J Nucl Med 1993;34:2253–63.
45. Khawli LA, Kassis AI. Synthesis of 125I labeled N-succinimidyl p-iodobenzoate for use in radiolabelling antibodies. Nucl Med Biol 1989;16:727–33.
46. Zalutsky MR, Narula AS.A method for radiohalogenation of proteins resulting in decreased thyroid uptake of radioiodine. Appl Radiat Isot 1987;38:1051–5.
47. Hnatowich DJ. Recent developments in the radiolabeling of antibodies with iodine, indium, and technetium. Semin Nucl Med 1990;20:80–91.
48. Baker RJ, Diamanti CI, Goodwin DA et al. Technetium-99m complexes of EDTA analogs: Studies of the radiochemistry and biodistribution. Int J Nucl Med Biol 1981;8:159–69.
49. Liu S, Edwards DS. 99mTc-labeled small peptides as diagnostic radiopharmaceuticals. Chem Rev 1999; 99:2235–68.
50. Lin KS, Luu AN, Baidoo KE, Pili R, Carducci MA, Wagner HN, Jr. In vivo evaluation of a promising 99mTc-labeled bombesin analog for breast cancer imaging. In: Nicolini M, Mazzi U, editors. Technetium, rhenium, and other metals in chemistry and nuclear medicine 6. Padova: SGEditoriali; 2002. pp 363-7.
51. Guhlke S, Schaffland A, Zamora PO et al. 188Re- and 99mTc-MAG3 as prosthetic groups for labeling amines and peptides: Approaches with pre- and postconjugate labeling. Nucl Med Biol 1998;25:621–31.
52. Maina T, Nock B, Nikolopoulou A et al. [99mTc]Demotate, a new 99mTc-based [Tyr3]octreotate analogue for the detection of somatostatin receptorpositive tumours: Synthesis and preclinical results. Eur J Nucl Med 2002;29:742–53.
53. Decristoforo C, Mather SJ, Cholewinski W et al 99mTc-EDDA/HYNIC-TOC: A new 99mTc-labelled radiopharmaceutical for imaging somatostatin receptor-positive tumours: First clinical results and intra-patient comparison with 111In-labelled octreotide derivatives. Eur J Nucl Med 2000;27:1318–25.
54. Rhodes BA. Direct labeling of proteins with 99mTc. Nucl Med Biol 1991;18: 667–76.
55. Zamora PO, Rhodes BA. Imidazoles as well as thiolates in proteins bind technetium-99m. Bioconjug Chem 1992;3: 493–8.
56. Maecke HR, Hofmann M, Haberkorn U. 68Ga-labeled peptides in tumor imaging. J Nucl Med 2005;46:172S–8S.
57. Green MA, Welch MJ. Gallium radiopharmaceutical chemistry. Nucl Med Biol 1989;16:435–48.
58. Eisenwiener KP, Prata MIM, Buschmann I et al. NODAGATOC, a new chelator-coupled somatostatin analogue labeled with [67/68Ga] and [111In] for SPECT, PET, and targeted therapeutic applications of somatostatin receptor (hsst2) expressing tumors. Bioconjug Chem 2002; 13: 530–41.
59. Guhlke S, Wester HJ, Bruns C, Sto¨cklin G. (2-[18F]fluoropropionyl-(D)phe1)-octreotide, a potential radiopharmaceutical for quantitative somatostatin receptor imaging with PET: Synthesis, radiolabelling, in vitro validation, and biodistribution in mice. Nucl Med Biol 1994;21:819–25.
60. Wester H-J, Hamacher K, Sto¨cklin G. A comparative study of N.C.A. fluorine-18 labeling of proteins via acylation and photochemical conjugation. Nucl Med Biol 1996; 23: 365–72.
61. Vaidyanathan G, Binger DD, Zalutsky MR. Fluorine-18-labeled monoclonal antibody fragments: A potential approach for combining radioimmunoscintigraphy and positron emission tomography. J Nucl Med 1992;33:1535–41.
62. Hostetler ED, Edwards WB, Anderson CJ, Welch MJ. Synthesis of 4-[18F]fluorobenzoyl octreotide and biodistribution in tumor-bearing Lewis rats. J Label Compounds Radiopharm 1999;42:S720–S721.
63. Lewis JS, Welch MJ. Copper chemistry related to radiopharmaceutical production. In: Nicolini M, Mazzi U, editors. Technetium, rhenium, and other metals in chemistry and nuclear medicine 6. Padova:SGEditoriali; 2002. pp 23–33.
64. Krenning EP, Kwekkeboom DJ, Bakker Wh et al. Somatostatin receptor scintigraphy with [111In-DTPA-D-Phe1]- and 123I-Tyr3]-octreotide: The Rotterdam experience with more than 1000 patients. Eur J Nucl Med 1993; 20: 716–31.
65. Krenning EP, Bakker WH, Breeman WA. Localisation of endocrine-related tumours with radioiodinated analogue of somatostatin. Lancet 1989; 4: 242-4.
66. Reubi JC, Schar JC, Waser B, et al. Affinity profiles for human somatostatin receptor subtypes SST1-SST5 of somatostatin radiotracers selected for scintigraphic and radiotherapeutic use. Eur J Nucl Med 2000; 27:273 - 82.
67. Lugtenburg PJ, Lo¨wenberg B,Valkema R et al. Somatostatin receptor scintigraphy in the initial staging of low-grade non-Hodgkin’s lymphomas. J Nucl Med 2001; 42: 222–9.
68. McMurry TJ, Brechbiel M, Kumar K & Gansow OA. Convenient Synthesis of Bifunctional Tetraaza Macrocycles. Bioconjugate Chem. 1992; 3:108 -17.
69. Traub T, Petkov V, Ofluoglu S et al. 111In-DOTA-lanreotide scintigraphy in patients with tumors of the lung. J Nucl Med 2001;42:1309–15.
70. Virgolini I, Szilvasi I, Kurtaran A et al. Indium-111In-DOTA-lanreotide: Biodistribution, safety, and radiation absorbed dose in tumor patients. J Nucl Med 1998; 39:1928–36.
71. De Jong M, Breeman WAP, Bakker WH et al. Comparison of 111In-labeled somatostatin analogues for tumor scintigraphy and radionuclide therapy. Cancer Res 1998;58:437–41.
72. De Jong M, Bakker WH, Krenning EP et al. Yttrium-90 and indium-111 labelling, receptor binding, and biodistribution of [DOTA0,D-Phe1,Tyr3]octreotide, a promising somatostatin analogue for radionuclide therapy. Eur J Nucl Med 1997;24:368–71.
73. Froidevaux S, Heppeler A, Eberle AN et al. Preclinical comparison in AR4-2J tumor-bearing mice of four radiolabeled 1,4,7,10-tetraazacyclododecane- 1,4,7,10-tetraacetic acid-somatostatin analogs for tumor diagnosis and internal radiotherapy. Endocrinology 2000;141:3304–12.
74. Papotti M, Croce S, Bello M, et al. Expression of somatostatin receptor types 2, 3 and 5 in biopsies and surgical specimens of human lung tumours. Correlation with preoperative octreotide scintigraphy. Virchows Arch 2001; 439:787–97.
75. Kwekkeboom DJ, Krenning EP, de Jong M. Peptide receptor imaging and therapy. J Nucl Med 2000; 41: 1704-13
76. Ferone D, van Hagen MP, Kwekkeboom DJ, et al. Somatostatin receptor subtypes in human thymoma and inhibition of cell proliferation by octreotide in vitro. J Clin Endocrinol Metab 2000; 85:1719 - 26.
77. Schulz S, Schmitt J, Weise W. Frequent expression of immunoreactive somatostatin receptors in cervical and endometrial cancer. Gynecol Oncol 2003; 89:385- 90.
78. Reubi JC, Waser B. Concomitant expression of several peptide receptors in neuroendocrine tumours: molecular basis for in vivo multireceptor tumour targeting. Eur J Nucl Med Mol Imaging 2003; 30:781- 93.
79. Ginj M, Chen J, Walter MA, Eltschinger V, Reubi JC and Maecke H R. Preclinical Evaluation of New and Highly Potent Analogues of Octreotide for Predictive Imaging and Targeted Radiotherapy Clinical Cancer Research 2005;11:1136 - 45.
80. Menda Y, Kahn D. Somatostatin receptor imaging of non-small cell lung cancer with 99mTc depreotide.Semin Nucl Med 2002;32:92–6.
81. Maina T, Nock B, Nikolopoulou A et al. [99mTc]Demotate, a new 99mTc-based [Tyr3]octreotate analogue for the detection of somatostatin receptorpositive tumours: Synthesis and preclinical results. Eur J Nucl Med 2002;29:742–53.
82. Bangard M, Behe M, Guhlke S et al. Detection of somatostatin receptor-positive tumours using the new 99mTc-tricine-HYNIC-D-Phe1-Tyr3-octreotide: First results in patients and comparison with 111In-DTPA-D-phe1-octreotide. Eur J Nucl Med 2000;27:628–37.
83. Decristoforo C, Mather SJ, Cholewinski W, et al. 99mTc-EDDA/ HYNIC-TOC: A new 99mTc-labelled radiopharmaceutical for imaging somatostatin receptor-positive tumours: First clinical results and intra-patient comparison with 111In-labelled octreotide derivatives. Eur J Nucl Med 2000;27:1318–25.
84. Guhlke S, Schaffland A, Zamora PO et al. 188Re- and 99mTc-MAG3 as prosthetic groups for labeling amines and peptides: Approaches with pre- and postconjugate labeling. Nucl Med Biol 1998;25:621–31.
85. Eisenwiener KP, Prata MIM, Buschmann I et al. NODAGATOC, a new chelator-coupled somatostatin analogue labeled with [67/68Ga] and [111In] for SPECT, PET, and targeted therapeutic applications of somatostatin receptor (hsst2) expressing tumors. Bioconjug Chem 2002;13:530–41.
86. Okarvi S.M. Peptide-Based Radiopharmaceuticals: FutureTools for Diagnostic Imaging of Cancers and Other Diseases. Medicinal Research Reviews 2004; 24 ( 3): 357-97.
87. Maecke HR, Hofmann M, Haberkorn U. 68Ga-labeled peptides in tumor imaging. J Nucl Med 2005;46:172S–8S.
88. Varagnolo L, Stokkel MPM, Mazzi U, Pauwels EKJ. 18F-labeled radiopharmaceuticals for PET in oncology, excluding FDG. Nucl Med Biol 2000; 27:103–12.
89. Kilbourn MR, Welch MJ. Fluorine-18 labeled receptor based radiopharmaceuticals. Appl Radiat Isot 1986; 37:677–83.
90. Walsh JC, Akhoon KM, Satyamurthy N et al Application of silicon-fluoride chemistry to fluorine-18 labeling agents for biomolecules: a preliminary note [abstract]. J Label Compds Radiopharm 1999; 42:S1–S3.
91. Guhlke S, Wester HJ, Bruns C, Stöcklin G. (2-[18F]Fluoropropionyl-( D)Phe1)-octreotide, a potential radiopharmaceutical for quantitative somatostatin receptor imaging with PET: synthesis, radiolabeling, in vitro validation and biodistribution in mice. Nucl Med Biol 1994; 21:819–25.
92. Hostetler ED, Edwards WB, Anderson CJ, Welch MJ. Synthesis of 4-[18F]fluorobenzoyl octreotide and biodistribution in tumour-bearing Lewis rats [abstract]. J Label Compds Radiopharm 1999; 42:S720–S722.
93. Li WP, Lewis JS, Kim J et al. DOTA-D-Tyr1-octreotate: A somatostatin analogue for labeling with metal and halogen radionuclides for cancer imaging and therapy. Bioconjug Chem 2002;13:721–8.
94. Kvols L K. & Woltering E A. Role of somatostatin analogs in the clinical management of non-neuroendocrine solid tumors. Anti-Cancer Drugs 2006, 17:601–8.
95. Reubi JC, Eisenwiener KP, Rink H et al. A new peptidic somatostatin agonist with high affinity to all five somatostatin receptors. Eur J Pharmacol. 2002; 456:45– 9.