Los Tumores Neuroendocrinos son generalmente enfermedades poco frecuentes y de lento crecimiento, caracterizados en ocasiones, por una elevada producción hormonal causante de disímiles síntomas significativos que atentan contra la calidad de vida del paciente por un extenso período de tiempo.
Rol de la Hormona Somatostatina y sus Análogos Radiomarcados en el Tratamiento de Tumores Neuroendocrinos. Artículo Revisión
Marlein Miranda Cona1, Gilmara Pimentel González2, Rolando Ravelo Silva3 e Iraida Sánchez Monzón4.
1 Licenciatura en Química. Master en Ciencias Radioquímicas.
2 Licenciatura en Química. Doctora en Ciencias Químicas.
3 Licenciatura en Radioquímica
4 Técnica en Radiofísica Médica
Centro: Laboratorio de Radiofarmacia, Departamento de Medicina Nuclear, Instituto Nacional de Oncología y Radiobiología.
Summary
Neuroendocrine tumors constitute a heterogeneous group that occur either sporadically or as part of familial syndromes. Although some of them may show aggressive behavior and become highly malignant, the great majority are either benign or relatively slow growing. In addition, they can be characterized by a high hormonal production that caused several traumatic symptoms attempting against quality of life of the oncologic patients for a long time.
Somatostatin hormone plays an inhibitory effect on a various physiologic functions in the organism. Five different human somatostatin receptor subtypes have been identified. Nevertheless, the use of the native hormone isn’t possible since its multiple simultaneous actions and the brief duration of its antisecretory effects. Many efforts have been made to synthesize somatostatin analogues, more resistant to enzyme digestion and with high receptor specificity to cell membrane-specific somatostatin receptors. Targeted Therapy technique has recently gained a remarkable attention in Oncology field. It is based on the coupling of a beta or alfa emitting radioisotope to a molecule which would specifically bind to tumor cells, to deliver an effective radiation dose to the tumor without damaging healthy tissues. The encouraging clinical application of labeled somatostatin analogues as therapeutic modality in somatostatin receptor-positive lesions have been reported. It allows to reduce tumor growth/metastasis, control symptoms, improve the quality of life and prolong the survival of patients.
Key words: Neuroendocrine tumors, Peptides, Somatostatin, Receptors, Targeted Radiotherapy, Radionuclide, Labeled Somatostatin Analogues.
Resumen
Los Tumores Neuroendocrinos son generalmente enfermedades poco frecuentes y de lento crecimiento, caracterizados en ocasiones, por una elevada producción hormonal causante de disímiles síntomas significativos que atentan contra la calidad de vida del paciente por un extenso período de tiempo.
La Somatostatina es una hormona peptídica que ejerce acciones biológicas supresoras sobre la fisiología normal del organismo. Cinco subtipos de receptores de la misma son sobre-expresados en tumores y sus metástasis, con respecto a los tejidos sanos, principalmente en tumores neuroendocrinos. Sin embargo, dicha hormona no ha sido efectiva por su corto tiempo en circulación. Mediante modificaciones estructurales, diversos análogos más resistentes a la degradación plasmática han sido sintetizados y evaluados, con amplia aplicación en la clínica.
La Radioterapia Metabólica, es una técnica que ha cobrado creciente interés en el tratamiento de tumores primarios y metastásicos que continúan en crecimiento y que han sido pretratados con quimioterapia y radioterapia externa con poco éxito. Esta técnica se basa en el enlazamiento específico de radiopéptidos a receptores sobre-expresados en el tumor, para depositar una dosis radiacional citotóxica, que ocasione la muerte celular, sin causar daño a los tejidos sanos. Análogos de la somatostatina en combinación con radioisótopos con propiedades terapéuticas, han sido exitosamente empleados en el tratamiento de tumores neuroendocrinos y sus metástasis.
Palabras Claves: Radioterapia Metabólica, Somatostatina, Receptores, Tumores Neuroendocrinos, Radioisótopos, Análogos de la Somatostatina Radiomarcados.
Introducción
El cáncer es la segunda causa de muerte por enfermedades crónicas no transmisibles a nivel mundial.
La búsqueda de técnicas más efectivas y menos invasivas en el manejo de tumores malignos y sus metástasis, ha cobrado un creciente interés en el campo de la oncología. En años recientes, el descubrimiento de ciertos tipos de tumores que sobre-expresan receptores por ciertas hormonas peptídicas reguladoras, así como la alta afinidad y especificidad de las mismas por estos receptores; condujeron al desarrollo de radiofármacos basados en péptidos. Paralelamente, el arribo de procedimientos automatizados para obtención y evaluación de estos compuestos en grandes cantidades, contribuyó a un desarrollo comercial acelerado y consecuentemente a una explosión en el número de péptidos potencialmente útiles. 1
Este documento ofrece una revisión sobre los radiopéptidos más difundidos en la terapia de ciertos tipos de tumores malignos.
Tumores Neuroendocrinos (TNEs)
Los Tumores neuroendocrinos son enfermedades poco frecuentes difundidas a través del sistema endocrino, siendo el tumor carcinoide y el de pulmón de células pequeñas, el de mayor incidencia en adultos. Aunque la mayoría son relativamente benignos (bien diferenciados) con lento crecimiento preservando muchas de sus características de diferenciación multipotentes; algunos pueden mostrar comportamiento agresivo y transformarse en altamente malignos (poco diferenciados) 2 (Tabla nš 1). Sus características clínicas y biológicas pueden variar mucho; de acuerdo con el origen. Aunque se pueden originar en cualquier parte del cuerpo, la mayoría se encuentra en bronquios, estómago, intestino delgado y apéndice. Pueden causar síntomas significativos debido a su producción hormonal Ej.: hipoglicemia, que puede presentarse con convulsiones, sudoración, confusión, debilidad muscular y náuseas; caquexia; diabetes; diarrea crónica; alteraciones electrolíticas secundarias; hipersecreción ácida; úlcera; etc. Se supone que la liberación al torrente sanguíneo de la hormona serotonina, junto con otras sustancias, es la causante del síndrome carcinoide, constituido por flushing, broncoespasmo, diarrea y taquicardia. El síndrome carcinoide se asocia a Tumores neuroendocrinos provenientes del intestino medio, por lo general, en el contexto de la enfermedad metastásica. 3,4
Generalmente los Tumores neuroendocrinos metastatizan en hígado. Las metástasis hepáticas neuroendocrinas (MHN) representan aproximadamente el 10% de todas las lesiones metastásicas hepáticas. 5 A menudo progresan lentamente, pero pueden igualmente ocasionar síntomas significativos asociados a su extensión y segregación hormonal. Cuando el tejido hepático es reemplazado por el tumor, causa presión mecánica sobre los tejidos circundantes, disfunción hepática, fallos cardíacos y finalmente la muerte. 3
Tabla nš 1. Clasificación actual de los Tumores neuroendocrinos. 6
- Tumores gastroenteropancreáticos
- Tumores derivados del páncreas endocrino (gastrinoma, insulinoma, VIPoma, glucagonoma y somatostatinoma).
- Tumor neuroendocrino de estómago, duodeno, yeyuno, apéndice y ciego.
- Tumor neuroendocrino de colon y recto (la mayoría son carcinoides).
- Tumores de la línea simpatoadrenal
- Feocromocitomas.
- Paragangliomas.
- Neuroblastomas.
- Cáncer medular de tiroides
- Neoplasias endocrinas múltiples (NEM)
- NEM1: hiperplasia o neoplasia de hipófisis anterior, paratiroides y sistema endocrino duodenopancreático. Algunos adenomas o nódulos hiperplásicos suprarrenales, tiroides y lipomas múltiples.
- NEM 2A: cáncer medular de tiroides, feocromocitoma e hiperplasia paratiroidea.
- NEM 2B: neurinomas, anormalidades musculoesqueléticas y de la motilidad intestinal.
- Tumor neuroendocrino de pulmón
- Tumor de células pequeñas.
- Tumores hipofisiarios
En la actualidad se dispone de diversas modalidades terapéuticas en el manejo de los Tumores neuroendocrinos y sus metástasis. El tratamiento más eficaz es la resección quirúrgica del tumor primario, que es útil en la enfermedad localizada; 7 sucedida por la administración de análogos de la somatostatina (SST) no marcados, interferón-alfa y/o radiofármacos como el metoxi-isobutil-isonitrilo radioiodinado (131I-MIBG); para prevenir el crecimiento tumoral y controlar síntomas asociados con síndromes humorales específicos. 8,9 La quimioterapia es reservada principalmente a pacientes con enfermedad progresiva, recurrente y/o agresiva. Aunque, puede ser efectiva temporalmente en la minoría de los pacientes con Tumores neuroendocrinos poco diferenciados, pues la mayoría de los bien diferenciados son relativamente quimiorresistentes y pueden presentarse efectos colaterales considerables. 7
En cuanto a las metástasis hepáticas neuroendocrinas, desafortunadamente son usualmente múltiples y difusas, siendo la resección quirúrgica a menudo imposible. 10 Por ende, el tratamiento se centra en el mejoramiento de los síntomas y la reducción de la hipersecreción hormonal por la eliminación de la lesión. Como opción paliativa se emplea la ablación local por radiofrecuencia o termoterapia inducida por láser, 11 embolización arterial hepática con o sin quimioterapia 12 o trasplante hepático, en pacientes jóvenes con tumores inoperables, hepatomegalia y síntomas incontrolables; en quienes todas las otras terapias han sido infructuosas. 13 Sin embargo, todos estos procedimientos invasivos podrían inducir la liberación hormonal y aún provocar una crisis carcinoide con peligro de muerte. 14
En los últimos años se ha incursionado en el empleo de nuevos tratamientos, entre ellos los anticuerpos monoclonales. Éstos prometían ser vehículos transportadores ideales de radionúclidos, drogas y toxinas; con potenciales aplicaciones diagnósticas y/o terapéuticas. 15 No obstante, poseen varios inconvenientes en cuanto a producción, inmunogenicidad, parámetros farmacocinéticos y costos. 16,17 En contraste, la radioterapia metabólica basada en radiopéptidos constituye una excelente opción; por ser fáciles de sintetizar, altamente sensibles y específicos por su receptor y poseer adecuados parámetros farmacocinéticos, que permiten minimizar la dosis de radiación en los tejidos sanos.
Radioterapia Metabólica
La Radioterapia Metabólica (RM), se basa en el enlazamiento específico de péptidos, previamente acoplados a radionúclidos adecuados, a receptores sobreexpresados en células tumorales. Con vistas a depositar una dosis radiacional letal que ocasione la muerte celular sin dañar los tejidos sanos, minimizando así la aparición de efectos adversos. 18 Esta técnica se emplea en la terapia de tumores primarios y metastáticos que continúan en crecimiento o tumores cerebrales simples inoperables, pre-tratados con quimioterapia y radioterapia externa local con poco o sin éxito. 19,20
Esta modalidad terapéutica depende entre otros factores, de la cantidad de radioligando que pueda ser concentrada en la célula tumoral, selección adecuada del radionúclido, su velocidad de internalización, degradación y reciclaje tanto del ligando como del receptor. 21
Varios factores pueden determinar los valores de captación de los péptidos radiomarcados sobre el tumor: masa de péptido inyectada, estabilidad del péptido marcado in vivo; localización tumoral, tipo y densidad de la expresión del receptor específico en el tumor, afinidad del péptido marcado por el receptor, eficiencia de la internalización del complejo radiopéptido-receptor, atrapamiento final del radionúclido en el interior de la célula tumoral y radiosensibilidad de la célula neoplásica. 22
Somatostatina y sus análogos
La Somatostatina (SST) es una hormona peptídica que ejerce acciones biológicas supresoras sobre la fisiología normal de diferentes órganos. Esta se encuentra distribuida ampliamente en el organismo, especialmente en el sistema nervioso central y periférico, sistema digestivo y glándulas endocrinas. Interviene en un amplio espectro de acciones biológicas supresoras sobre la fisiología normal de diferentes órganos a nivel celular. Han sido descritos cinco subtipos de receptores (sstrs: ssrt1, ssrt2, ssrt3, ssrt4 y ssrt5) de la misma. 23 Su efecto inhibitorio sobre la secreción hormonal de varias glándulas infiere sus posibles efectos beneficiosos en el tratamiento de patologías relacionadas con la hiperfunción de glándulas o sobreproducción de hormonas por tumores neuro-endocrinos activos (TNEs). Ciertos tipos de carcinomas caracterizados por elevada densidad de receptores de la somatostatina con relación a los tejidos sanos han sido descritos, siendo los Tumores neuroendocrinos, 23 los que exhiben las concentraciones más elevadas de sstr2, constituyendo éstos un blanco ideal en la terapia con somatostatina. 23 Sin embargo, en la práctica clínica, la somatostatina resulta ser inefectiva por su corta vida media en circulación (2-3 min) debido a sus múltiples funciones y a la degradación enzimática. Disímiles análogos han sido desarrollados mediante modificaciones estructurales de la somatostatina Ej.: Octreotide, Octreotate, Lanreotide, Vapreotide. Éstos ejercen la mayoría de las acciones biológicas de la hormona nativa, poseen afinidad por receptores de la somatostatina y una vida media mayor (2-3 horas).23
Selección del radionúclido
El empleo de radiopéptidos para el tratamiento de tumores malignos, presupone el marcaje del péptido con un radionúclido emisor de partículas altamente energéticas (beta, alfa, electrones de conversión interna (CI) o electrones Auger (Au)).
El acoplamiento del radionúclido al péptido deberá efectuarse mediante un método rápido y sencillo; que exhiba elevados rendimientos de marcaje con alta actividad específica, conservación de la actividad biológica y unión péptido-receptor suficientemente fuerte in vivo. En general, la distribución de los radiofármacos diagnósticos y terapéuticos sobre un tumor sólido no es homogénea. Debido a la incapacidad de las moléculas radiomarcadas para penetrar diversas regiones en el interior de una masa tumoral sólida o diferencias en las densidades de sitios de enlazamiento específico de células tumorales individuales. La eficacia terapéutica de las partículas energéticas (radiación ionizante) dependerá de la distancia del átomo en decaimiento a la membrana de la célula diana y su relación con la probabilidad de alcanzar el núcleo celular. 24
El blanco principal de los efectos biológicos de la radiación ionizante es el ácido desoxirribonucleico (ADN), donde se producen diferentes lesiones (Ej.: roturas de cadena simple y/o de cadena doble, daños de base, entrecruzamiento proteína-ADN y múltiples sitios dañados), debido a la ionización directa del mismo (efecto directo) o por su interacción con radicales libres presentes en el medio (principalmente radicales hidroxilos producidos en las moléculas de agua que difunden al interior de la célula). La distribución y tipo de lesiones causadas en el ADN dependerá de la naturaleza de la partícula incidente y su energía. 24
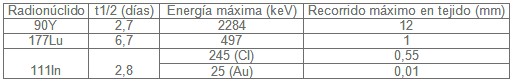
Por tanto, la selección del radionúclido se basa en el tiempo de vida media, tipo y energía de radiación emitida y distancia sobre la cual es depositada (recorrido máximo en tejido) (Tabla nš 2). Así, los radionúclidos emisores de partículas energéticas asociados a análogos de la somatostatina, pueden depositar dosis de radiación citotóxica con una alta transferencia de energía lineal (LET; parámetro relacionado con la probabilidad de eliminar células) selectivamente sobre tumores que expresen receptores de la somatostatina. 25
En cuanto al tiempo de vida media (t1/2; tiempo requerido para reducir el número inicial de átomos radioactivos a la mitad), éste se relaciona inversamente con la velocidad a la cual la dosis de radiación absorbida es depositada sobre la célula. Así, una mayor velocidad de deposición de la dosis (t1/2 corto) es mejor frente a tumores que se dividen rápidamente (rápido crecimiento). Mientras que un t1/2 largo puede ser más efectivo en tumores de crecimiento relativamente lento como la mayoría de los Tumores neuroendocrinos. 26
Si bien las propiedades físicas del radioisótopo son importantes, pues la heterogeneidad tumoral puede causar respuesta incompleta; el fuego cruzado, dosis radiacional proveniente del radionúclido localizado sobre las células tumorales positivas (expresan receptores de la somatostatina), puede eliminar las células tumorales negativas (no expresan receptores de la somatostatina) más cercanas. 26
La radiosensibilidad tumoral es de suma importancia en el éxito de la radioterapia dirigida. De ahí que, cuando dos tumores poseen similares niveles de receptores peptídicos, aquel que sea más radiosensible será un mejor candidato para la radioterapia metabólica. Sin embargo, aún no está claro, si un tumor radiosensible que usualmente tiene baja densidad de receptores de somatostatina sea un buen candidato para la radioterapia metabólica. 26
Otro aspecto importante a considerar es el denominado, efecto bystander, relacionado con las respuestas biológicas observadas en células, cuyas células vecinas son irradiadas sin recibir radiación las primeras. Estudios reportan tasa de mutación incrementada y tasa de sobrevida disminuida en estos casos. Estas observaciones han negado un criterio general en la radiobiología basado en que el daño celular es causado sólo por ionización directa o por radicales libres generados, como una consecuencia de la deposición de la energía en el interior del núcleo. No obstante, el rol del efecto bystander como promotor de la eficacia radioterapéutica está aún por ser determinada. 24
Otra ventaja de la radioterapia metabólica, es que la radiación puede ser depositada selectivamente no sólo en tumores primarios y metástasis grandes sino también en aquellos que son muy pequeños para ser visualizados e identificados por técnicas imagenológicas, para ser eliminados por cirugía o radioterapia externa. 26
Tabla.2 Propiedades físicas de los radioisótopos usados comúnmente en la radioterapia dirigida de los Tumores neuroendocrinos.
Dosimetría paciente específica
Debido a la alta variación individual entre pacientes, se requiere hacer cálculos dosimétricos paciente-específico antes de usar el agente radioterapéutico. Los métodos dosimétricos previos a la radioterapia metabólica, se emplean para confirmar el sitio del tumor primario y sus metástasis; evaluar la densidad de receptores en el tumor y estimar la dosis radiacional sobre órganos críticos (médula ósea y riñones) y tejidos tumorales. Tales datos permiten individualizar regímenes terapéuticos, identificar los pacientes que podrían beneficiarse con el tratamiento y excluir aquellos que no. 26,27
La Centelleografía de Receptores Peptídicos (CRP) con 111In-DTPA-octreotide (Octreoscan) o 177Lu-DOTA-octreotate, es una modalidad diagnóstica por imágenes muy sensible en la localización de Tumores neuroendocrinos primarios y metastáticos. Esta técnica puede ser empleada fácilmente en las estimaciones dosimétricas, corregidas por la medición del volumen preciso del órgano por Tomografía Axial Computarizada o Resonancia Magnética Nuclear, siempre y cuando sea necesario. 26
Criterios de inclusión
Los pacientes elegibles para la radioterapia metabólica, son aquellos con tumor inoperable, tumor metastático y con sobre-expresión de receptores para somatostatina en todos los sitios comprometidos; reserva medular; hemoglobina > 10 g/l, glóbulos blancos > 3.0*109 /l y plaquetas > 100*109 /l; urea <10 mmol/l; creatinina <160 mmol/l; velocidad de filtración glomerular > 40 ml/min; reserva hepática medida por perfil hematológico convencional; buen estado general y tiempo de recuperación de dos meses, si se ha utilizado quimioterapia previamente. 28
Las contraindicaciones son: embarazo, lactancia, mielosupresión, compromiso metastático extenso de la médula ósea, compromiso de la función renal e insuficiencia renal crónica, compromiso hepático extenso, haber alcanzado la dosis límite por dosimetría paciente específica y estado general deteriorado. 28
Agentes terapéuticos
A fines de los ochenta, se obtiene el 111In-DTPA-octreotide (Octreoscan),29 basado en el acoplamiento del análogo octreotide al agente quelante bifuncional ácido dietilendiaminotetraacético (DTPA), encargado de aportar los grupos reactivos necesarios para el acoplamiento del radiometal. El Octreoscan, es el radiofármaco peptídico más ampliamente usado en el diagnóstico de patologías malignas. Su utilidad para la radioterapia metabólica ha sido sugerida, pues el 111In emite electrones Au y electrones de CI con LET elevada, que puede ocasionar efectos radiotóxicos letales sobre la proliferación tumoral, siempre y cuando, este localizado a unos pocos nanómetros del ADN del núcleo. Sin embargo, tales partículas exhiben poca penetrabilidad tisular y en consecuencia, eficacia limitada en tumores grandes y pacientes en estadío terminal. 30
Además, el DTPA no es un agente quelante (BFCA) adecuado para acomplejar emisores beta, ya que exhibe disociación del metal in vivo. Como alternativa, se desarrolló un nuevo BFCA, el poliamino carboxilato macrocíclico ácido 1,4,7,10 tetraazaciclododecano-N,N’,N’’,N’’’-tetraacético (DOTA)31, capaz de formar complejos muy estables con diversos iones metálicos bajo condiciones fisiológicas. En la Fig.1 se representan los derivados de la somatostatina acoplados a DOTA más empleados: 90Y-DOTA0-Tyr3-octreotide (90Y-DOTATOC, 90Y-SMT-487), 90Y-DOTA-lanreotide (MAURITIUS) y 177Lu-DOTA-Tyr3-The8-octreotate (177Lu-DOTA-TATE).26
Fig.1 Radiofármacos basados en análogos de la somatostatina acoplados a DOTA, más empleados en la radioterapia metabólica de los Tumores neuroendocrinos.
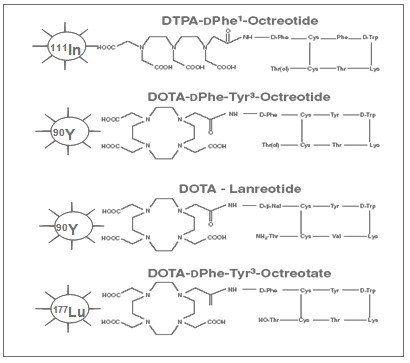
Estos difieren con respecto al perfil de afinidad por los receptores de la somatostatina. Si bien, el DTPA-OC enlaza con alta afinidad a sstr2, moderada a sstr3 y sstr5, y no reconoce a sstr1 y a sstr4. 32 El derivado DOTA-TATE posee un incremento de la afinidad por sstr2 en nueve veces con respecto al DOTA-TOC, incluso una vez que el mismo es marcado con 90Y mantiene una afinidad mayor en seis o siete veces. 33 Sin embargo, exhibe una reducción notable de su reconocimiento por el resto de los receptores de la somatostatina. Mientras que el DOTA-lanreotide tiene la menor afinidad por sstr2 pero muestra moderada afinidad por sstr3-sstr5.34 No obstante, tanto el DOTA-TOC como el DOTA-TATE exhiben mayor captación tumoral que el DOTA-lanreotide, siendo más difundidos los primeros en el tratamiento de los Tumores neuroendocrinos, ya que el sstr2 se encuentra altamente expresado en estas lesiones malignas. 35
El 90Y-DOTATOC y el 177Lu-DOTA-TATE poseen un potencial terapéutico mayor que el Octreoscan, debido a los valores superiores de la energía media y recorrido máximo en tejido de las partículas beta emitidas por el 90Y y el 177Lu en comparación con los electrones Auger provenientes del 111In. 21 El largo recorrido (mm a cm) de dichas partículas puede conducir a la irradiación de todas las células localizadas dentro del máximo rango y trayectoria de la partícula en cuestión, sin necesidad de que el agente radioterapéutico esté presente en el interior o enlazado a cada célula diana. 24 Al mismo tiempo, la elevada estabilidad del complejo radiometal-DOTA, posibilita la deposición de mayores dosis de radiación citotóxica en tumores positivos a receptores de la somatostatina. 21
Un análisis de las características de los isótopos emisores beta 90Y y 177Lu, revela sus ventajas específicas para la terapia tumoral. El 90Y emite partículas de mayores Emax y Rp, un mejor fuego cruzado a través del tumor y su t1/2 relativamente corto deposita más radioactividad sobre la célula tumoral por molécula peptídica. Estas propiedades favorecen su empleo en el tratamiento de tumores grandes o con distribución heterogénea de receptores. 36 No obstante, no es útil en pequeños tumores, pues éstos al no absorber toda la energía emitida por el 90Y, la célula sana vecina recibirá altas dosis y será expuesta a la toxicidad. 37 En contraste, las partículas de 177Lu al tener menores Emax y Rp son asociadas con mejor absorción en tumores pequeños, y su emisión gama posibilita efectuar estudios diagnósticos (CRP) 36. Por tanto, para tratar pacientes con tumores de disímiles tamaños y distribución de receptores no homogéneas, la combinación de las altas energías del 90Y para lesiones grandes y las bajas energías del 177Lu para lesiones pequeñas y metástasis podría ser una excelente opción, lo cual garantiza una velocidad de cura mayor. 36 Modelos matemáticos empleados en el estudio de la respuesta tumoral con diferentes partículas beta en relación al tamaño del tumor, sugieren que el diámetro de tumor óptimo para el 90Y es de 34 mm mientras que para el 177Lu es 2 mm. 38
Seguridad y efectos colaterales
Como otros tratamientos, los órganos críticos son los riñones y la médula ósea. Los radiopéptidos son retenidos en las células del túbulo proximal, conduciendo a un acúmulo de la radioactividad en riñones. 26 Han sido descritos diferentes regímenes de co-infusión de aminoácidos básicos (lisina y arginina), antes, durante y después del radioligando; con un 27% de reducción promedio en la dosis absorbida renal sin efectos sobre la captación tumoral y sin observarse casos de insuficiencia renal en pacientes tratados. 26,27,39
Igualmente, estudios muestran captación en la médula ósea, sin reportar casos de mielotoxicidad. No obstante, el tratamiento no deberá realizarse en pacientes con metástasis que envuelvan la médula ósea extensivamente. 27
Respuesta a la Terapia
Recientes estudios han mostrado que los péptidos acoplados a 111In no son ideales para la radioterapia debido a que la pobre vascularización y necrosis central propia de los tumores sólidos grandes, conducen a una captación heterogénea del radiofármaco y dificultan la proximidad y deposición energética de los electrones Au, sobre el ADN del núcleo. 40 Por consiguiente, las respuestas observadas a corto plazo se debe a pequeñas lesiones existentes. Se sugiere suministrar 111In-péptidos conjuntamente a emisores de partículas beta de alta energía con vistas a erradicar las micrometástasis. 30
Resultados de diversos protocolos en el tratamiento de Tumores neuroendocrinos con 90Y-DOTA-TOC revelan una respuesta objetiva con relación a la reducción del tamaño tumoral en un 25% y un tiempo medio para la progresión post-tratamiento de 30 meses. Igualmente, reportan las considerables diferencias existentes entre diferentes tipos de Tumores neuroendocrinos en cuanto a la densidad de receptores de la somatostatina e histología. Así, los tumores gastroenteropancreáticos exhiben una respuesta más favorable (37%) que otros Tumores neuroendocrinos, tratados con los mismos radiofármacos. 39,41,42
El 177Lu-DOTA-TATE resulta ser la mejor opción, pues se observa una reducción del tamaño tumoral de un 30%, en un tiempo menor de 25 meses. 26,43,44
Esta baja respuesta con uno y otro, puede estar relacionada con la radiorresistencia relativa de los Tumores neuroendocrinos, pero también refleja la ausencia de un criterio uniforme en la selección del paciente. Por tanto, se hace necesario establecer parámetros predictivos para seleccionar pacientes que se beneficien con dicho tratamiento e identificar aquellos que no responden. 26
A pesar de tales resultados, en ambos casos, se observa mejoramiento distintivo en la calidad de vida y regresión tumoral positivamente correlacionada con niveles de captación elevados en las imágenes dosimétricas. 45
Por otra parte, estudios experimentales en pacientes tratados con dosis intermedias repetidas de 90Y o 177Lu DOTA-Tyr3-octreotide or 131I-MIBG, después de la reducción quirúrgica del tumor primario, muestran completa remisión de las metástasis hepáticas, proporcionando al paciente una paliación de la enfermedad de larga duración y una supervivencia prolongada. 30,46
Prospectos futuros
La base de la terapia con radiofármacos ha sido la sobreexpresión de antígenos o receptores en células tumorales en comparación con las células normales. Con vistas a optimizar sus efectos, combinaciones terapéuticas con 131I-MIBG y 90Y-DOTA-TATE o de 111In/90Y/177Lu-octreotide permanecen como una opción terapéutica atractiva después de una resección completa del tumor para asegurar la buena captación del radiofármaco por los tumores remanentes o metástasis. 43,47 Si estos tratamientos son repetidos regularmente, es posible que la enfermedad pueda ser estabilizada por un período de varios años o curada. 48
Por otra parte, el empleo de radionúclidos emisores de partículas alfa Ej.:211At, 212Bi, 213Bi, 225Ac ha cobrado un gran interés; dado a sus deposiciones energéticas altamente localizadas en las células tumorales e irradiación mínima del tejido sano circundante. 24
Las integrinas son glicoproteínas transmembranales, compuestas por una subunidad alfa y otra beta, juegan un rol importante en las interacciones en la matriz celular relacionadas con la invasión tumoral, formación de metástasis así como inducción de la angiogénesis tumoral. El sitio de reconocimiento principal de las integrinas es la secuencia tripeptídica, Ar-Gly-Asp (RGD), identificada en proteínas intracelulares como la fibronectina y el fibrinógeno. 49,50 El receptor de tales proteínas, avb3, ha sido estudiado extensivamente debido a su rol en varios procesos biológicos tales como la angiogénesis. El mismo es expresado sobre varios tumores humanos malignos y en células endoteliales proliferativas. Estudios previos han mostrado que pueden regular la viabilidad celular por inhibición del enlazamiento a la integrina. 51 Numerosos compuestos han sido diseñados sobre la base de la secuencia RGD, como antagonistas del receptor avb3, que pudieran incrementar la eficacia terapéutica de los análogos de la somatostatina. 52-54 Unido a esto, se ha demostrado el rol de dicha secuencia en la activación directa de la enzima caspase-3, proteasa clave en la inducción selectiva de la muerte celular (apoptosis). Para combinar estas características en un compuesto, nuevos análogos han sido sintetizados y evaluados. Ejemplo: RDG-DTPA-octreotate. Este radiofármaco consiste en un péptido que enlaza específicamente receptores de la somatostatina, Tyr-octreotate; el quelato DTPA para enlazar radiometales tales como 111In y un péptido RGD. En tal caso, el octreotate retiene su alta afinidad por sstr2 y el péptido RGD enlaza a los receptores de la integrina avb3 como factor inductor de la apoptosis. Desafortunadamente, exhibe elevada captación renal, limitando su empleo en la radioterapia metabólica. 55
Paralelamente, diversos ensayos sobre la quimioterapia dirigida a los receptores de la somatostatina han sido efectuados. Investigadores incursionan en el desarrollo y acción antitumoral de diferentes análogos de la somatostatina enlazados a agentes quimioterapéuticos. Esta modalidad parece ser efectiva en modelos de tumores pre-clínicos y puede ser una aplicación promisoria para tratar tumores positivos a receptores de la somatostatina. La misma inhibe el crecimiento tumoral mediante la inducción de apoptosis y/o necrosis y también permite el empleo de menores dosis de citotóxicos, resultando ser menos tóxica para los órganos sanos. Hasta el momento, no se reportan ensayos clínicos en humanos. 56
Conclusiones
La introducción de nuevos agentes radiofarmacéuticos basados en pequeños péptidos marcados constituyen una importante alternativa en el tratamiento de tumores neuroendocrinos. Debido a sus atractivas propiedades farmacocinéticas y elevada afinidad por el receptor específico sobre-expresado en tumor. No obstante, aún quedan por resolver problemas relacionados con la distribución heterogénea del radiopéptido sobre la lesión, principalmente en tumores sólidos de gran tamaño inoperables. Nuevos agentes radioterapéuticos más efectivos continúan en estudio. El futuro uso clínico de los mismos posibilitará reducir aún más el tamaño tumoral, controlar los síntomas, y por ende, contribuirá con el mejoramiento de la calidad de vida y prolongación de la sobrevida de los pacientes oncológicos.
Referencias bibliográficas
1. Ronald E. Weiner and Mathew L. Thakur. Radiolabeled Peptides in Oncology Role in Diagnosis and Treatment. Biodrugs 2005; 19 (3): 145 - 63.
2. Kaltsas G, Mukherjee JJ, Plowman PN et al. The role of chemotherapy in the nonsurgical management of malignant neuroendocrine tumours. Clinical Endocrinology 2001; 55: 575–87.
3. Oates JA: The carcinoid syndrome. N Engl J Med 1986; 315:702-4.
4. Quintana J C. Terapia de Tumores Neuroendocrinos: Generalidades. Medwave. Edición Mayo 2005. Año 5, No. 4.
5. Benevento A, Boni L, Frediani L et al. Result of liver resection as treatment for metastases from noncolorectal cancer. J Surg Oncol 2000, 74:24-9.
6. Bombardieri et al. Position of nuclear medicine techniques in the diagnostic work-up of neuroendocrine tumors. Q J Nucl Med Mol Imaging 2004; 48:150-63.
7. Oberg K, Astrup L, Eriksson B et al. Guidelines for the management of gastroenteropancreatic neuroendocrine tumours (including bronchopulmonary and thymic neoplasms).I. General overview. Acta Oncology 2004 ;43: 617–25.
8. Kaltsas GA, Besser GM & Grossman AB The diagnosis and medical management of advanced neuroendocrine tumors. Endocrine Reviews 2004; 25 : 458–511.
9. Oberg K: Endocrine tumors of the gastrointestinal tract: systemic treatment. Anticancer Drugs 1994, 5:503-19.
10. Veenendaal LM, Borel Rinkes IHM, Cornelis JM Lips et al. Review Liver metastases of neuroendocrine tumours; early reduction of tumour load to improve life expectancy. World Journal of Surgical Oncology 2006, 4:35.
11. Liu LX, Zhang WH, Jiang HC: Current treatment for liver metastases from colorectal cancer. World J Gastroenterol 2003, 9:193-200.
12. Roche A: [Hepatic chemo-embolization]. Bull Cancer 1989, 76:1029-37.
13. Florman S, Toure B, Kim L et al: Liver transplantation for neuroendocrine tumors. J Gastrointest Surg 2004, 8:208-12.
14. Wettstein M, Vogt C, Cohnen M et al: Serotonin release during percutaneous radiofrequency ablation in a patient with symptomatic liver metastases of a neuroendocrine tumor. Hepatogastroenterology 2004, 51:830-2.
15. Anna M Wu, Peter D Senter. Arming antibodies: prospects and challenges for inmunoconjugates. Nature Biotechnology 2005; 23 (9); 1137-46.
16. Jain RK. Tumor physiology and antobody delivery. Front. Radiat. Ther. Oncol2, 1990. 32-46; 64-8.
17. Ruiz-Cabello F, Cabrera T, López-Nevot MA & Garrido F. Impaired surface antigen presentation in tumors: implications for T cell-based immunotherapy. Semin Cancer Bio 2002. 12:15-24.
18. Krenning EP, de Jong M, Kooij PP et al. Radiolabelled somatostatin analogue (s) for peptide receptor scintigraphy and radionuclide therapy. Annals of Oncology 1999; 10 (Suppl 2) S23–S29.
19. Kwekkeboom DJ, Krenning EP, de Jong M. Peptide receptor imaging and therapy. J Nucl Med. 2000;41:1704 –13.
20. Merlo A, Hausmann O, Wasner M, et al. Locoregional regulatory peptide receptor targeting with the diffusible somatostatin analogue 90Y-labeled DOTA0- D-Phe1-Tyr3-octreotide (DOTATOC): a pilot study in human gliomas. Clin Cancer Res. 1999; 5:1025–33.
21. Wiseman GA & Kvols LK. Therapy of neuroendocrine tumors with radiolabeled MIBG and somatostatin analogues. Seminars in Nuclear Medicine 1995; 25 272–8.
22. de Herder WW, Hofland LJ, van der Lely AJ et al. Somatostatin receptors in gastroentero-pancreatic neuroendocrine tumours. Endocrine-Related Cancer 2003; 10: 451–8.
23. Guillemin R. Peptide in the brain: The new endocrinology of the neurons. Science 1978; 202 : 390- 402.
24. Amin I. Kassis & S. James Adelstein. Radiobiologic Principles in Radionuclide Therapy. Journal Of Nuclear Medicine 2005; 46 :1 (Suppl) .
25. Stepanek J, Larsson B, Weinreich R. Auger-electron spectra of radionuclides for therapy and diagnostics. Acta Oncology 1996; 35 : 863 - 8.
26. Pauwels S, Barone R, Walrand S et al. Practical dosimetry of peptide receptor radionuclide therapy with 90Y-labeled somatostatin analogs. J Nucl Med 2005; 46 (Suppl 1) 92S - 98S.
27. Bodei L, Cremonesi M, Grana C et al. Receptor radionuclide therapy with 90Y-[DOTA]0-Tyr3-octreotide (90Y-DOTATOC) in neuroendocrine tumours. European Journal of Nuclear Medicine and Molecular Imaging 2004; 31: 1038–46.
28. Kaltsas GA, Papadogias D, Makras P et al. Treatment of advanced neuroendocrine tumours with radiolabelled somatostatin analogues Endocrine-Related Cancer 2005; 12: 683 - 99.
29. Krenning EP, Bakker WH, Breeman WA. Localisation of endocrine-related tumours with radioiodinated analogue of somatostatin. Lancet 1989; 4: 242-4.
30. de Jong M, Valkema R, Jamar F et al. Somatostatin receptor-targeted radionuclide therapy of tumors: preclinical and clinical findings. Sem Nucl Med 2002; 32:133 - 40.
31. McMurry TJ, Brechbiel M, Kumar K et al. Convenient Synthesis of Bifunctional Tetraaza Macrocycles. Bioconjugate Chem 1992; 3:108 -17.
32. Reubi JC, Korner M, Waser B et al. High expression of peptide receptors as a novel target in gastrointestinal stromal tumours. European Journal of Nuclear Medicine and Molecular Imaging 2004; 31: 803–10.
33. Reubi JC, Macke HR & Krenning EP Candidates for peptide receptor radiotherapy today and in the future. Journal of Nuclear Medicine 2005; 46 (Suppl 1): 67S–75S.
34. Virgolini I, Britton K, Buscombe J et al. a In- and Y-DOTA-lanreotide: results and implications of the MAURITIUS trial. Seminars in Nuclear Medicine 2002; 32: 148–55.
35. Virgolini I, Traub T, Novotny C et al. Experience with indium-111 and yttrium-90-labeled somatostatin analogs. Current Pharmacy Design 2002; 8: 1781–807.
36. de Jong M, Breeman WA, Valkema R, Bernard BF & Krenning EP Combination radionuclide therapy using 177Lu- and 90Y-labeled somatostatin analogs. Journal of Nuclear Medicine 2005; 46 (Suppl 1): 13S–17S.
37. Krenning EP, Kwekkeboom DJ, Valkema R et al. Peptide receptor radionuclide therapy. Annals of the New York Academy of Sciences 2004; 1014: 234–45.
38. O’Donoghue JA, Bardies M, Wheldon TE. Relationships between tumor size and curability for uniformly targeted therapy with beta-emitting radionuclides. J Nucl Med 1995; 36:1902–9.
39. Valkema R, Pauwels SA, Kvols LK et al. Long-term follow-up of renal function after peptide receptor radiation therapy with (90)Y-DOTA(0),Tyr(3)-octreotide and (177)Lu-DOTA(0), Tyr(3)-octreotate. Journal of Nuclear Medicine 2005; 46 (Suppl 1): 83S–91S.
40. Lewington VJ. Targeted radionuclide therapy for neuroendocrine tumours. Endocrine-Related Cancer 2003;10 : 497–501.
41. Chinol M, Bodei L, Cremonesi M & Paganelli G Receptor-mediated radiotherapy with Y-DOTA-DPhe-Tyr-octreotide: the experience of the European Institute of Oncology Group. Seminars in Nuclear Medicine 2002; 32: 141–7.
42. Waldherr C, Pless M, Maecke HR et al. Tumor response and clinical benefit in neuroendocrine tumors after 7.4GBq (90)Y-DOTATOC. Journal of Nuclear Medicine 2002; 43: 610–6.
43. Krenning EP, Valkema R, Kwekkeboom DJ et al. Molecular imaging as in vivo molecular pathology for gastroenteropancreatic neuroendocrine tumors: implications for follow-up after therapy. Journal of Nuclear Medicine 2005; 46 (Suppl 1): 76S - 82S.
44. Kwekkeboom DJ, Mueller-Brand J, Paganelli G et al. Overview of results of peptide receptor radionuclide therapy with 3 radiolabeled somatostatin analogs. Journal of Nuclear Medicine 2005; 46 (Suppl 1) 62S–66S.
45. Kwekkeboom DJ, Bakker WH, Teunissen JJM et al. Treatment with Lu-177-DOTA-Tyr3-octreotate in patients with neuroendocrine tumors: interim results [abstract]. Eur J Nucl Med Mol Imaging 2003; 30(suppl 2) : S231.
46. Lam MG, Lips CJ, Jager PL et al: Repeated [131I]metaiodobenzylguanidine therapy in two patients with malignant pheochromocytoma. J Clin Endocrinol Metab 2005, 90:5888-95.
47. Larson SM & Krenning EP A pragmatic perspective on molecular targeted radionuclide therapy. Journal of Nuclear Medicine 2005; 46 (Suppl 1): 1S–3S.
48. Kaltsas GA, Besser M & Grossman AB. The diagnosis and medical management of advanced neuroendocrine tumors. Endocrine Reviews 2004; 25: 458–511.
49. Varner JA. The role of vascular cell integrins alpha v beta 3 and alpha v beta 5 in angiogenesis. EXS. 1997;79: 361–90.
50. Ruoslahti E, Pierschbacher MD. New perspectives in cell adhesion: RGD andintegrins. Science. 1987;238:491–7.
51. Astrid Capello, Eric P. Krenning, Bert F. Bernard et al. Anticancer Activity of Targeted Proapoptotic Peptides J Nucl Med 2006; 47:122–9.
52. Chen Y, Xu X, Hong S, et al.RGD-Tachyplesin inhibits tumor growth.Cancer Res 2001;61:2434–38.
53. Anuradha CD, Kanno S, Hirano S. RGD peptide-induced apoptosis in human leukemia HL-60 cells requires caspase-3 activation. Cell Biol Toxicol. 2000;16:275–83.
54. Chatterjee S, Brite KH, Matsumura A. Induction of apoptosis of integrinexpressing human prostate cancer cells by cyclic Arg-Gly-Asp peptides. Clin Cancer Res. 2001;7:3006–11.
55. Bernard B, Capello A, van Hagen M, et al. Radiolabeled RGD-DTPA-Tyr3- octreotate for receptor-targeted radionuclide therapy. Cancer Biother Radiopharm. 2004;19:173–80.
56. Nagy A, Schally AV, Halmos G, et al. Synthesis and biological evaluation of cytotoxic analogs of somatostatin containing doxorubicin or its intensely potent derivative, 2-pyrrolinodoxorubicin, Proc Natl Acad Sci USA. 1998;95:1794–99.