La carcinomatosis peritoneal es una forma habitual de recidiva tras la cirugía en los tumores de localización abdominal y pélvica. Considerada como un signo de enfermedad generalizada, es tratada de forma paliativa y en general suele tener un desenlace fatal. Su aparición indica en general enfermedad neoplásica avanzada, y viene a representar una vía de diseminación metastásica, junto con la hematógena y linfática que utilizan los tumores malignos de localización intraabdominal.
Circuito de perfusión de quimioterapia intraperitoneal con hipertermia, en carcinomatosis peritoneal.
Cuenca Zamorano, R., Serrano Donaire, L., Montaner Perise, D.; Dr. J. Lara
Unidad de Perfusión de Cirugía Cardiovascular
Hospital Universitario Virgen de las Nieves. Granada.
La carcinomatosis peritoneal es una forma habitual de recidiva tras la cirugía en los tumores de localización abdominal y pélvica. Considerada como un signo de enfermedad generalizada, es tratada de forma paliativa y en general suele tener un desenlace fatal. Su aparición indica en general enfermedad neoplásica avanzada, y viene a representar una vía de diseminación metastásica, junto con la hematógena y linfática que utilizan los tumores malignos de localización intraabdominal.
En un reciente estudio multicéntrico de Sadeghi, Lyon, France del 2000 (1) donde se incluían 370 pacientes con carcinomatosis de origen digestivo y no ginecológico, la supervivencia media osciló entre 3,1 y 6 meses; la carcinomatosis peritoneal (CP) tuvo un origen gástrico en 125 casos, colorrectal en 118, pancreático en 58 desconocido en 43 y de origen misceláneo en 26 casos. La supervivencia fue influida por el estadío inicial de la carcinomatosis peritoneal, desde 9.8 meses en estadio I con granulaciones peritoneales menores de 5 milímetros a algo más de 3 meses en estadío IV. La presencia de ascitis se asoció con peor supervivencia en pacientes con carcinoma gástrico o pancreático.
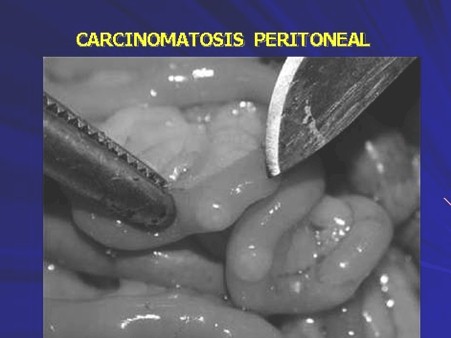
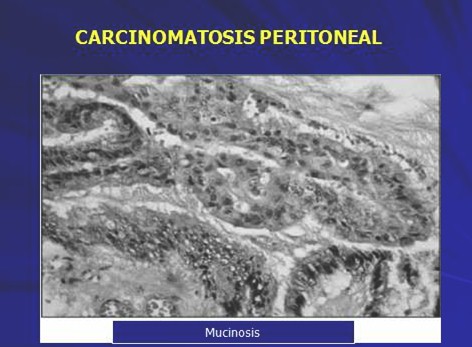
La diseminación de las células tumorales en el peritoneo, puede ser espontánea, producirse durante la cirugía por mecanismos como la formación de émbolos tumorales por presión, por fuga de células malignas al cortar los vasos linfáticos o por la siembra de las mismas en la cavidad peritoneal durante la disección quirúrgica. (Foto 1,2)
En estudios en los que se ha tratado la carcinomatosis peritoneal con quimioterapia sistémica se obtuvo buena respuesta tumoral, sin mejoría de la supervivencia. Desde 1980 han aparecido nuevas propuestas para el tratamiento de los pacientes afectados de diseminación tumoral peritoneal (CP), debidas al escaso éxito terapéutico de la terapia con quimioterapia sistémica con pérdida rápida y progresiva de calidad de vida.
En un trabajo de Koppe (2) de la Universidad de Nijmegen, Holanda se revisa la literatura médica con objeto de estudiar la incidencia y pronostico de la siembra peritoneal durante la cirugía de cáncer colorrectal (CCR), la incidencia de recurrencia intraperitoneal y las estrategias terapéuticas en la actualidad frente a la carcinomatosis peritoneal especialmente enfocado a la cirugía de citorreducción y quimioterapia intraperitoneal hipertérmica. Aunque la diseminación hematógena constituye la mayor amenaza en pacientes con carcinoma colorrectal, la carcinomatosis peritoneal presumiblemente por siembra celular es un evento frecuente en pacientes con recurrencia del carcinoma; en 12 series de pacientes con cáncer colorrectal la carcinomatosis peritoneal varió entre un 3% y un 28%. La carcinomatosis peritoneal es encontrada en 7% de pacientes con cirugía primaria, de un 4%-9% en el seguimiento después de cirugía curativa, en más del 44% de recurrencia de cáncer colorrectal y entre 40%-80% de éxitus por cáncer colorrectal. La supervivencia media publicada después de quimioterapia sistémica con 5-fluoruracilo por carcinomatosis peritoneal varía entre 5.2 y 12.6 meses, La supervivencia media después de citorreducción quirúrgica agresiva seguida de perfusión intraperitoneal de citostáticos con hipertermia varia de 12 a 32 meses
Sugarbaker (4, 12, 14) describió, en 1995, las técnicas quirúrgicas que permiten, cuando esto es posible, una resección completa de la enfermedad neoplásica peritoneal, si la enfermedad neoplásica es resecable, siendo deseable consolidar el resultado de la cirugía mediante un tratamiento complementario que erradique la enfermedad microscópica residual.
Aunque parece evidente que los factores pronósticos más importantes continúan siendo el estadio de la enfermedad, el momento del diagnostico y la radicalidad de la cirugía, el empleo de nuevas drogas citostáticas, la aplicación de las mismas y la aplicación de una cirugía basada en la historia natural y la biología tumoral, están permitiendo la aplicación de terapias mucho mas individualizadas y efectivas.
Fotos 1 y 2.
La administración de drogas tumorales por vía intraperitoneal, la inmunoterapia intracavitaria, o la quimioterapia mas hipertermia intraperitoneal constituyen, la línea terapéutica más interesante en el tratamiento de esta enfermedad. La perfusión intraperitoneal con quimioterapia e hipertermia, ha ofrecido hasta el momento resultados esperanzadores.
La administración intraperitoneal de determinados fármacos citostáticos consigue una exposición de las superficies peritoneales a estos, muchas veces mayor que tras su administración por la vía sistémica habitual. Consiste en realizar tras la cirugía de exegesis máxima o debulking, una perfusión a dosis altas de quimioterapia regional hipertérmica durante el acto operatorio.
La cirugía posibilita (fotografía 3) la reducción de la enfermedad peritoneal a un tamaño mínimo y libera todas las adherencias, creando las condiciones para obtener la mayor eficacia de los citostáticos. Estos son potenciados por el calor, que también tiene un efecto citostático por sí mismo, se elimina en atrapamiento celular, y se consiguen niveles altos de fármacos en la zona a tratar, imposible de lograr por vía sistémica debido a su toxicidad.

Fotografía 3.
Debido a la barrera peritoneal-plasmática, las sustancias de alto peso molecular como mitocinac, 5-fluorouracilo, cisplatino o doxorrubicina, permanecen largo tiempo dentro del abdomen, antes de su eliminación a través de la sangre, lo que las hace especialmente indicadas en este tratamiento.
En el manejo terapéutico de la carcinomatosis peritoneal, como destaco, Sugarbaker, existen varios principios fundamentales:
• El clínico debe seleccionar a los pacientes con enfermedad aislada en abdomen y pelvis. Los pacientes que tienen la enfermedad persistente en otros sitios se aprovecharan poco o nada del tratamiento quirúrgico radical.
• En esta enfermedad debe conseguirse reducción de masa tumoral al máximo, de forma que solo la enfermedad microscópica residual permanezca.
• La quimioterapia intraperitoneal y sistémica son utilizadas para erradicar la enfermedad de la superficie peritoneal, así como para controlar el tumor primario recurrente.
• La citorreducción obtenida tras la cirugía se considera completada cuando no hay implantes residuales macroscópicos.
Aunque fue Weisberger, en 1955, el primero en utilizar la quimioterapia intraperitoneal (mostaza nitrogenada), no fue hasta 1980, cuando Spratt notifico el uso clínico de la quimioterapia intraperitoneal hipertérmica (QIPH) en un paciente con pseudomixoma peritoneal, y en 1982 cuando Sugarbaker planteó la diseminación de determinados canceres abdominales como estadio locorregional de la enfermedad, estableciendo la necesidad de utilizar localmente y a altas dosis, la quimioterapia con hipertermia , para eliminar la enfermedad microscópica residual; administrando la quimioterapia inmediatamente tras la cirugía de citorreducción radical y en el mismo acto operatorio, con el fin de interrumpir, la implantación de células tumorales, que se produce durante la disección quirúrgica en las superficies intraabdominal y pélvica.
Técnica de Perfusión hipertérmica de Citostáticos por vía Intraperitoneal
Una vez concluida la citorreducción quirúrgica es montado el separador de Thompson, según la técnica del Coliseo, y se suspende el abdomen del separador con dos suturas a la piel de la incisión abdominal, e infunden la solución que tiene el citostático en la cavidad abdominal. Mediante la cobertura con un plástico se aísla la cavidad, con un cierre en forma de campana, en cuyo interior se coloca un aspirador de humos que cogerá los vapores generados durante la perfusión con el quimioterápico.
La perfusión se hace durante 90 minutos, el flujo de perfusión oscila entre 500 y 1000 ml/min., con una solución de Dextrosa al 1,5% (entre 3 y 5 litros), a los que se añade el citostático. Diseñamos un circuito cerrado, utilizando dos tubos de ¼ montados en sendos rodillos, uno de entrada, y otro de salida peritoneal, que estaban conectados a su vez a un circuito de perfusión de cardioplegia modificado, creando un circuito cerrado. (Fotografía, 4,5).
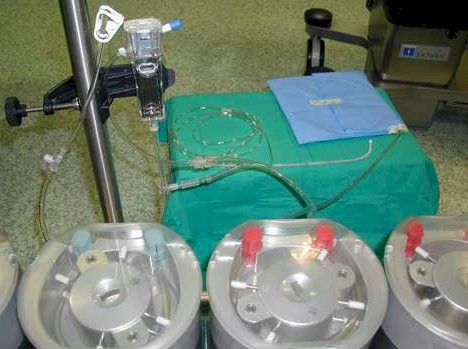
Fotografía 4.
El circuito pasa por un intercambiador de calor para conseguir una temperatura intraperitoneal de 42-43ºC, registrado mediante control de temperatura intraperitoneal con un termómetro dentro de la cavidad peritoneal. Temperaturas superiores aumentan el riesgo de necrosis de intestino delgado, y temperaturas inferiores hacen que cada grado de temperatura perdido disminuyan a la mitad las ventajas obtenidas con la hipertermia.
Este sistema nos permitió utilizar el intercambiador de calor del sistema del circuito de cardioplegia modificado, y así mantener la temperatura del fluido que se infunde a 44-46ºC de manera que el líquido peritoneal se mantenga a la temperatura deseada. A través de un evacuador de humo se extrae el aire bajo la cubierta de plástico que aísla la cavidad en forma de campana, evitando así cualquier posible contaminación del aire del quirófano por aerosoles citostáticos. Cuando se termina la perfusión intraoperatoria se aspira todo el líquido del abdomen y se pasa a la fase reconstructiva de la cirugía.
Durante todo el procedimiento debe haber un especial control y monitorización de las constantes del paciente, manteniendo especial atención a la temperatura general del paciente.
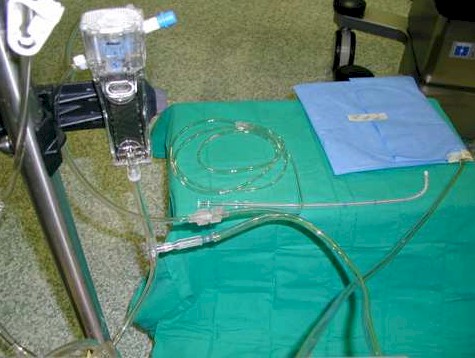
Este sistema de circuito de perfusión de cardioplegia modificado, nos da varias ventajas:
• Evitar pérdidas externas de líquido citostático.
• Mantener el nivel de fluido y su distribución constante dentro de la cavidad peritoneal.
• Mantener la temperatura de forma constante a 43-44ºC durante todo el procedimiento en la cavidad peritoneal.
• Evitar al cirujano la distribución manual del líquido citostático.
Los beneficios de la quimioterapia intraperitoneal con hipertermia tras cirugía citorreductora son importantes porque:
• El calor tiene efectos antitumorales por sí mismo: Incrementa la citotoxicidad.
• Incrementa la penetración de los medicamentos en los tejidos.
• Se consigue una distribución uniforme de la quimioterapia intraperitoneal en todas las superficies del abdomen y la pelvis.
• Se eliminan las nauseas y los vómitos.
• Durante el tiempo quirúrgico es posible monitorizar, todos los parámetros del paciente.
• De esta forma se consiguen curaciones y disminuye la necesidad de laparotomías sucesivas. Aun con todo, hay que tener en cuenta que las complicaciones más frecuentes del procedimiento son Pancreatitis 7% y fistulizaciones 4%.
Conclusiones
El diagnóstico de Carcinomatosis peritoneal es un diagnostico fatal asociado con mal pronóstico y mala calidad de vida. La supervivencia es valorada en meses y tradicionalmente la cirugía era indicada como un esfuerzo paliativo Los avances en biología celular, citorreducción quirúrgica y en farmacología han mejorado las perspectivas de esta condición Un agresivo tratamiento combinado sobre la superficie peritoneal con cirugía de citorreducción para reducir la carcinomatosis peritoneal a nivel microscópico y perfusión intraperitoneal de quimioterapia hipertérmica es capaz de erradicar el cáncer la quimioterapia hipertérmica refuerza la citotoxicidad de las drogas e incrementa su penetración en el tejido canceroso.
La quimioterapia intraperitoneal hipertérmica durante los últimos años se ha convertido en protagonista asociada al procedimiento de cirugía citorreductora y peritonectomía, y mejorar las cifras de supervivencia de los pacientes con carcinomatosis peritoneal. La complejidad de la perfusión de quimioterapia intraperitoneal hipertérmica y la toxicidad hacen difícil la generalización de este procedimiento siendo necesario hacer una adecuada selección de pacientes
Los mejores resultados se obtienen en aquellos casos en los que existe menor volumen de carcinomatosis, y en los que la cirugía ha conseguido una buena citorreducción.
Los efectos antineoplásicos de la quimioterapia son potenciados por el calor, en virtud del aumento de la permeabilidad celular por alteración del transporte activo de las drogas y la alteración del metabolismo celular.
La administración de altas dosis de quimioterapia intraperitoneal es posible sin toxicidad renal ni sistémica y minimiza los efectos secundarios al estar el paciente anestesiado y monitorizado.
La combinación de la quimioterapia hipertérmica con otras modalidades terapéuticas locorregionales o sistémicas, abre líneas de trabajo esperanzadoras para un conjunto de pacientes que en este momento carecen de perspectivas, más allá de la paliación.
Bibliografía.
1. Sadeghi B, Arvieux C, Glehen O, et al. Peritoneal carcinomatosis from non gynecologic malignancies: results from the EVOCAPE 1 multicentric prospective study. Cáncer 2000; 88:358-363.
2. Koppe MJ, Boerman OC, Oyen WJ, Bleichrodt RP. Peritoneal carcinomatosis of colorectal origin: incidence and current treatment strategies. Ann Surg. 2006 Feb; 243 (2):212-22.
3. Farre Alegre, P.Bretcha Boix, M. L.Martin, M. Sureda, A. Brugarolas. Plataforma Oncologica. Hospital San Jaime. Torrevieja. Alicante.
4. Sugarbaker PH, Chang D. Results of treatment of 385 patients with peritoneal surface spread of appendiceal malignancy. Ann Surg Oncol 1999; 6:727-731.
5. Glehen O, Mithieux F, Osinsky D, Beaujard AC, Freyer G, Guertsch Ph, Francois Y, Peyrat P, Panteix G, Vignal J, Gilly F. Surgery combined with peritonectomy procedures and intraperitoneal chemohyperthermia in abdominal cancers with peritoneal carcinomatosis: a phase II study. J Clin Oncol 2003; 21(5):799-806.
6. Verwall V, van Ruth S, de Bree E, van Slooten W, van Tinteren H, Boot H, Zoetmulder F. Randomized trial of cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer. J Clin Oncol 2003; 21: 3737-43.
7. Begossi G, Gonzalez Moreno S, Ortega Perez G, Fon L, Sugarbaker PH. Cytoreduction and intraperitoneal chemotherapy for the management of peritoneal carcinomatosis, sarcomatosis and mesothelioma. EJSO 2002; 28:80 87.
8. Witkamp A, de Bree E, Van Goethem, Zoetmulder F. Rationale and techniques of intraoperative hyperthermic intraperitoneal chemotherapy. Cancer Treat Rev 2001; 27:365-374.
9. Takahashi I, Emi Y, Hasuda S, Kakeji Y, Maehara Y, Sugimachi K. Clinical application of hyperthermia combined with anticancer drugs for the treatment of solid tumors. Surgery 2002; 131: S78-84.
10. Witkamp A, de Bree E, Kaag M, Boo H, Beijnen J, Van Slooten G, Van Coevorden F, Zoetmulder F. Extensive cytoreductive surgery followed by intraoperative hyperthermic intraperitoneal chemotherpy with mitomycin-C in patients with peritoneal carcinomatosis of colorectal origin. Eur J Cancer 2001; 37:979-984.
11. Carmingnani C, Esquivel J, Sugarbaker PH. Cytoreductive surgery and intraperitoneal chemotherapy for the treatment of peritoneal surface malignancy. Rev Oncol 2003; 5(4):192-8.
12. Sugarbaker PH. Cytoreduction including total gastrectomy for pseudomyxoma peritonei. Br J Surg 2002; 89:208-12.
13. Elias D, Bonnay M, Puizillou J, Antoun S, Demirdjian S, El Otmany A, Pignon J, Drouard-Troalen L, Ouellet J, Ducreux M. Heated intraoperative intraperitoneal oxaliplatin after complete resection of peritoneal carcinomatosis: pharmacokinetics and tissue distribution. Ann Oncol 2002; 13(2):267-272.
14. Sugarbaker P, Jablonski KA. Prognostic features of 51 colorectal and 130 appendiceal cancer patients with peritoneal carcinomatosis treated by cytoreductive surgery and intraperitoneal chemotherapy. Ann Surg 1995; 221:124-132.
15. Glehen O, Schreiber V, Cotte E, Sayag-Beaujard A, Osinsky D, Freyer G, Francois Y, Vignal J, Gilly F. Cytoreductive surgery and intraperitoneal chemohyperthermia for peritoneal carcinomatosis arising from gastric cancer. Arch Surg 2004; 139(1): 20-26.
16. Shen P, Levine E, Hall J, Case D, Russel G, fleming R, Mc Quellon R, Geisinger K,Loggie B. Factors predicting survival after intraperitoneal hyperthermic chemotherapy with mitomicin C after cytoreductive surgery for patients with peritoneal carcinomatosis. Arch of Surg 2003; 138(1):26-33.
17. Jayne D, Fook S, Loi C, Seow-Choen F. Peritoneal carcinomatosis from colorectal cancer. Br J Surg 2002; 89(12):1545-1550.