La demanda mundial de huevos para el 2015 será 12 millones de toneladas métricas más que en el 2005. Dos tercios de la demanda adicional provendrán de Asia. El huevo ha sido descrito por su bajo aporte de energía, excelente proteína, buena fuente de reconocidas vitaminas con la excepción de vitamina C; buena fuente de todas las vitaminas B y de las liposolubles A, D y E. El huevo provee zinc, selenio, calcio y es una excelente fuente de fósforo, necesario para la salud ósea y excelente fuente de yodo, requerido para la síntesis de hormonas tiroideas. La deficiencia de yodo es la principal causa mundial prevenible de daño cerebral y retardo mental. La suplementación de gallinas ponedoras con cantidades variables de yodo orgánico o inorgánico, incrementó el contenido de yodo en huevos. Investigaciones actuales en medicina y nutrición, señala a los ácidos grasos omega-3 como notables y esenciales componentes en la dieta humana. Los efectos fisiológicos de los ácidos grasos omega-3 incluyen la disminución de los triglicéridos plasmáticos y reducción de la ateroesclerosis. Enriquecimiento de la dieta para ponedoras, con ácido graso linolénico o con un vegetal que lo contenga (semilla de colza, semilla de lino) o la adición de alimentos con ácidos grasos eicosapentanoico o docosahexanoico, incrementan el contenido de omega-3 en huevos. Los huevos son un rico aporte de colesterol en la dieta, aunque con base en la evidencia epidemiológica, no hay razones para excluir los huevos en los saludables hábitos de alimentación.
Contenido de yodo en huevos: una importante fuente de minerales, vitaminas y ácidos grasos omega-3
Iodine content in eggs: an important source of minerals, vitamins and omega-3 fatty acids
Autor: Dr. Luis A. Caballero
Instituto Nacional de Nutrición. División de Salud Pública. Programa Nacional de Micronutrientes
Resumen
La demanda mundial de huevos para el 2015 será 12 millones de toneladas métricas más que en el 2005. Dos tercios de la demanda adicional provendrán de Asia. El huevo ha sido descrito por su bajo aporte de energía, excelente proteína, buena fuente de reconocidas vitaminas con la excepción de vitamina C; buena fuente de todas las vitaminas B y de las liposolubles A, D y E. El huevo provee zinc, selenio, calcio y es una excelente fuente de fósforo, necesario para la salud ósea y excelente fuente de yodo, requerido para la síntesis de hormonas tiroideas. La deficiencia de yodo es la principal causa mundial prevenible de daño cerebral y retardo mental. La suplementación de gallinas ponedoras con cantidades variables de yodo orgánico o inorgánico, incrementó el contenido de yodo en huevos. Investigaciones actuales en medicina y nutrición, señala a los ácidos grasos omega-3 como notables y esenciales componentes en la dieta humana. Los efectos fisiológicos de los ácidos grasos omega-3 incluyen la disminución de los triglicéridos plasmáticos y reducción de la ateroesclerosis. Enriquecimiento de la dieta para ponedoras, con ácido graso linolénico o con un vegetal que lo contenga (semilla de colza, semilla de lino) o la adición de alimentos con ácidos grasos eicosapentanoico o docosahexanoico, incrementan el contenido de omega-3 en huevos. Los huevos son un rico aporte de colesterol en la dieta, aunque con base en la evidencia epidemiológica, no hay razones para excluir los huevos en los saludables hábitos de alimentación.
Palabras clave: Yodo, Huevo de gallina, suplementación con yodo, colesterol, omega-3, producción de huevos, consumo de huevos
Abstract
World demand for hen eggs by 2015 will be 12 million metric tons more than in 2005. About two-thirds of additional demand will come from Asia. The egg has been described as a low energy source, an excellent source of protein, a good source of the recognized vitamins with the exception of vitamin C, a good source of all the B vitamins, plus the fat soluble vitamin A. It also provides useful amounts of vitamins D and E. Egg provides zinc, selenium, calcium and is an excellent source of phosphorus, required for bone health, and is an excellent source of iodine, required to make the thyroid hormone. Iodine deficiency is the world’s leading preventable cause of brain damage and mental retardation. Supplementing layer diets with varying amounts of organic or inorganic iodine increased the iodine content of eggs. Current research in nutritional medicine indicates that the omega-3 fatty acids are becoming more prominent as essential components of the human diet. The physiological effects of ω-3 fatty acids are lowering of plasma triglycerides, reduction in atherosclerosis. Enrichment of the layer diet with linolenic fatty acid or a vegetable source of it (rapeseed, linseed) or the addition of any source of eicosapentaenoic and/or docosahexaenoic fatty acids, increase the ω-3 content of the eggs. Eggs are a rich source of dietary cholesterol although based on the epidemiologic evidence; there is no reason to think such a healthy eating pattern could not include eggs.
Key words: Iodine, hens' egg, iodine supplementation, cholesterol, omega-3, egg production, egg consumption
Producción y consumo mundial de huevos:
Entre 1970 y 2005, la producción de carne de aves y huevos se incrementó más rápidamente que la producción de carne de vaca, ternera y cerdo. Mientras Norte y Centro América así como Europa perdieron parte del mercado, China y Brasil se convirtieron en los nuevos centros de producción en Asia y Sur América. Entre 1990 y 2000 los países en desarrollo sobrepasaron en volúmenes de producción a los países desarrollados y actualmente contribuyen con la producción del 55% de carne de aves y 68% de la producción de huevos. En contraste con la producción, la contribución de los países en desarrollo a los volúmenes de exportación de productos avícolas, es todavía mucho más bajo que el de los países desarrollados. Especialmente los huevos son principalmente comercializados por países europeos y asiáticos. (Windhorst 2006)
El rendimiento de huevos por gallina, tuvo un promedio mundial de 9,90 Kg/gallina en el año 2000. Ese mismo año, África mostró el rendimiento más bajo con 3,94 Kg/gallina, seguido por América Latina y el Caribe, Asia, Oceanía, Europa y Norte América con un rendimiento de 8,11; 9,54; 13,38; 15,04 y 15,21 Kg/gallina respectivamente. Sin embargo América Latina y el Caribe, mostró en el periodo 1992-2000 el mayor incremento en el rendimiento: 19%. Si agrupamos la población de gallinas en América Latina y el Caribe, para el año 2000, Brasil, con 330 millones de cabezas representa el 56% de la población, seguido de México con 18%, países andinos con 12%, del cono sur con 7%, América Central 5%, el Caribe 2%.
La producción de huevos para el año 2000, es capitalizada por México con 1,6 millones de TM, lo que representa un 34% de la producción total de la región considerada. Le sigue Brasil con 29%, países andinos 17%, cono sur 10%, América Central 8%, el Caribe 2%. (Ormel 2001)
La demanda mundial de huevos será de 12 millones de toneladas métricas más que en el 2005, y se equiparará con una producción de 70,9 millones de toneladas métricas el año 2015. Se predice que dos tercios de la demanda adicional serían aportados por Asia, 12% por África y 11% de América Latina. La producción de huevos en Norte América se espera incremente menos de 2%, Europa un poco más de 3%, mientras Asia aumentaría su producción 22%. Estas proyecciones pueden verse afectadas por algunos factores como la irrupción de la influenza aviar, aumento del costo de los alimentos y el boom de la producción de bioenergía, así como por decisiones políticas. (Evans 2008)
La producción de etanol se inició en Brasil a finales de la década de los 70 y algunos años después en los Estados Unidos. Los miembros de la Unión Europea se enfocaron en el biodiesel debido al más bajo precio del diesel y el incremento en el número de automóviles movidos por diesel. Después de varios años de moderado crecimiento, la producción de biocombustibles comenzó un vertiginoso crecimiento. Ello ha aumentado la demanda por tierras arables, cuyas cosechas alimentarían refinerías de etanol y plantas de biodiesel. Como consecuencia aumentaría el costo de los alimentos para el ganado, la avicultura y la población humana. Sin embargo, actualmente la producción de bioenergía no constituye una amenaza para la industria de los huevos. (Windhorst 2007)
En 2007, más del 60% de la población mundial vivía en Asia, donde la mayoría de sus países aumentarán el consumo total y per cápita de huevos motivado por un mayor poder de compra. África mantendrá un bajo consumo, dado el menor ingreso, lento crecimiento económico e inestabilidad política en muchos países al sur del Sahara. Europa con 733 millones de personas, es el tercer continente más poblado, pero a su vez el primero con crecimiento poblacional negativo. Se espera un estable consumo en la próxima década, aunque puede haber un mayor consumo en algunos nuevos miembros de la Unión Europea por aumento del poder adquisitivo. En Brasil y México vivían 52% de los 569 millones de habitantes de Latino América y el Caribe durante el 2007. Para el 2015, alrededor de 70 millones más de personas vivirán en este subcontinente, esperándose un considerable incremento en la demanda, aunado al aumento del poder de compra. Oceanía con 35 millones de habitantes en 2007, representa el 0,5% de la población mundial, y ostenta un bajo consumo comparado con Europa y Norte América, esperándose pequeños cambios en el futuro. Estados Unidos y Canadá, con 5% de la población mundial, presentan un alto consumo de huevos y no se esperan importantes aumentos en el consumo existente. (Evans 2008)
Iowa, Ohio, Indiana, Pensilvania y California son los 5 mayores estados productores de huevos, representando aproximadamente el 50% de todas las ponedoras en los Estados Unidos. Se reportó para este mismo país, una producción de 6,43 billones de huevos durante el mes de Mayo de 2008, superior a los 6,34 billones producidos durante Mayo del pasado año. (United Egg Producers 2008)
En el Gráfico 1 se presentan los vaticinios del consumo per cápita de huevos para el año 2015 en el Mundo, los diversos continentes, Norte América, Latinoamérica y el Caribe.
GRÁFICO 1
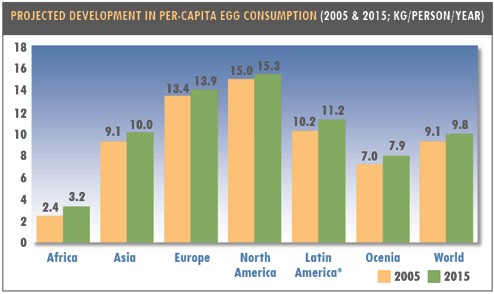
Fuente: Evans Terry. Asia to lead in both production and consumption to 2015
Importancia del consumo de huevos en la nutrición humana:
Los huevos son una importante fuente de proteínas, vitaminas y minerales. Un huevo de tamaño promedio -58 gramos- aporta unas 78 Kilocalorías y 3% de los requerimientos diarios de energía de un hombre adulto. Son una excelente fuente proteica, con todos los aminoácidos esenciales necesarios para el cuerpo humano. En la albúmina se halla la mayor parte de la proteína de un huevo, que representa 12,5% de su peso. Contiene la mayoría de las vitaminas con excepción de la vitamina C, buena fuente de todas las vitaminas B y vitamina A; en menor cuantía vitaminas D y E. Excelente fuente de yodo, necesario para sintetizar las hormonas tiroideas y de fósforo, requerido para la salud ósea. Provee significantes cantidades de zinc, importante en el crecimiento y combate de infecciones; selenio, un importante antioxidante y calcio, constituyente óseo y participante en la función nerviosa. La grasa del huevo representada por 11,2% se encuentra casi en su totalidad en la yema. (Eggs and Nutrition 2008)
Elevar el contenido de yodo en huevos es una ingeniosa vía, aunque poco usada para prevenir la deficiencia de yodo; adicionalmente se afirma que el consumo de estos huevos permite prevenir y tratar la hipercolesterolemia. Se ha patentado un método para producir huevos que contienen cantidades entre 7 y 60 ppm de aminoácidos yodados, mediante el empleo de una dieta con más de 250 mg de yodato de calcio por kilogramo de alimento. (Ishikawa 1980)
El yodo es un elemento esencial para la síntesis de hormonas tiroideas triiodotironina (T3) y tiroxina (T4). Las evidencias señalan alteraciones en las neuronas, células gliales, mielina, sinapsis y en la morfología del cerebro y cerebelo en el déficit severo de yodo. Actualmente se considera la deficiencia de yodo, como la más importante causa prevenible de daño cerebral y retardo mental. (Vani 2004)
Los programas de salud en muchos países tratan de enfrentarse a la carencia de yodo con el uso de sal yodada, así como con la producción de alimentos enriquecidos con yodo. (EFSA 2005)
Desde finales de los ochenta, se ha propuesto en nutrición humana el concepto de “alimento funcional” que no solo tiene valor nutricional, sino también otros efectos fisiológicos, reducir el riesgo de enfermedades y actuar en el sistema inmune. La suplementación de las aves de corral con vitaminas, minerales y otros microelementos puede incrementar su contenido en huevos y carne. Se ha establecido que el yodo contenido en huevos es rápidamente asimilado por el organismo humano. (Stambury 1996, Gruzauskas 2002, Jeroch 2002)
Un estudio fue realizado para evaluar la importancia del consumo de huevos en la dieta americana y la asociación del consumo de huevos y los valores de colesterol. Para ello se tomaron en cuenta los datos del National Health and Nutritional Examination Survey correspondientes al periodo 1988-1994: NAHNES 1988-94, para comparar dietas que contenían huevos con las que no la contenían. El aporte diario de nutrientes en los consumidores de huevos fue significativamente mayor para todos los nutrientes estudiados -excepto fibra y vitamina B6- que en los no consumidores de huevos. Los huevos contribuyeron diariamente con un aporte menor del 10% de energía y vitamina B6; 10%-20% folato y grasa total, saturada y poliinsaturada; 20%-30% de vitaminas A, E y B12. Después de ajustar variables demográficas como edad, género y raza y variables del estilo de vida como fumar y actividad física, el colesterol de la dieta no se relacionó con las concentraciones séricas de colesterol. Este estudio transversal y poblacional, concluyó que en la dieta americana, el consumo de huevos no se asoció con altas concentraciones de colesterol sérico y contribuyó de manera importante en la nutrición. (Song 2000)
Altos niveles de colesterol sérico predicen el inicio de enfermedad coronaria. Sin embargo, a pesar de representar los huevos una importante fuente de colesterol en la dieta, las guías de la American Heart Association no incluyen una recomendación para limitar el consumo de huevos, pero recomienda la adopción de prácticas de alimentación cónsonas con la buena salud. La evidencia epidemiológica señala que no hay razón para creer, que los patrones saludables de alimentación no deben incluir los huevos. Llama la atención el caso de Japón, quien presenta dentro de los países desarrollados, un relativo bajo porcentaje de enfermedad coronaria, a pesar de tener uno de los consumos per cápita de huevos más altos del Mundo, aunque dentro del contexto de una dieta relativamente baja en grasa total y saturada. (Kritchevsky 2004)
Investigaciones para lograr la reducción del colesterol en el huevo, se han centrado en la dieta e intervención farmacológica de las aves, mediante drogas que inhiben la síntesis del colesterol en la gallina o inhiben la transferencia de colesterol desde la sangre. La suplementación con cromo en concentraciones menores de 1 ppm, se ha señalado que disminuye el colesterol del huevo.
El perfil de ácidos grasos de la yema puede ser fácilmente modificado, cambiando el tipo de grasa empleado en la dieta de aves. Diferentes alimentos como linaza, aceite de cártamo, aceite de perilla (Perilla frutescens), algas marinas, pescado, aceite de pescado y aceites vegetales, se han agregado a la dieta de las gallinas con el objeto de incrementar el contenido de ácidos grasos omega-3. El consumo de ácidos grasos poliinsaturados se recomienda en la población general, para reducir el riesgo de arterioesclerosis y apoplejía.
Se han diseñado huevos con una baja relación de ácidos grasos saturados-insaturados. El aceite de canola (acrónimo en inglés de Canadian oil low acid) producto de Brassica napus, es comúnmente usado para alterar la relación de grasas saturadas e insaturadas en el huevo. La cáscara contiene la mayor cantidad de minerales, con aproximadamente 2200 mg de calcio y 20 mg de fósforo. Manipulaciones dietéticas han permitido aumentar la concentración de selenio, yodo y cromo en huevos. Existe una variada predilección del consumidor, por el color de la yema. El color de la yema proviene en gran medida, de pigmentos naturales aportados por diversas plantas como caléndula, ají, maíz amarillo o de origen animal como algas verde-azules spirulina, que también son ricas en proteínas.
El consumo de carotenoides como luteína y zeaxantina, dos de los más comunes xantophilas encontradas en la yema, previenen la degeneración macular, una importante causa de ceguera en personas de avanzada edad. Existe un mercado minoritario para los productos orgánicos y los países trabajan en reglamentar su funcionamiento, en aras de proteger la salud humana. Para ser certificados los huevos como orgánicos, deben ser producidos con una alimentación libre de pesticidas, herbicidas, antibióticos o de manipulación genética; tampoco se emplearían pesticidas para el control de endo y ectoparásitos, y por lo regular las gallinas no están enjauladas.
Un dato importante a tomar en cuenta, es que al existir un exceso de huevos fértiles, éstos pueden ser colocados en el mercado. No existen diferencias nutricionales entre huevos fertilizados y los no fertilizados, ya que el embrión no se desarrolla en huevos fértiles que son prontamente refrigerados después de la puesta. (Jacob 2000)
La administración de ajo (Allium sativum) a ponedoras Hisex Brown, Isa Brown, Lohmann, Starcross, Babcock y Starcross-579, redujo el colesterol sérico y en huevos, sin la aparición de efectos adversos. (Chowdhury 2002)
HMG-CoA (3 hidroxi-3-metilglutaril-CoA) reductasa (HMGR), cataliza los diferentes pasos en la biosíntesis de colesterol. Las estatinas son HMG-CoA (3 hidroxi-3-metilglutaril-CoA) reductasa (HMGR) inhibidoras, por lo que reducen el colesterol del suero. (Istvan 2001)
Inhibidores de la HMG-CoA (3 hidroxi-3-metilglutaril-CoA) reductasa (HMGR) como las estatinas, pasta de ajo y la administración vía oral de cobre, lograron reducir los niveles de colesterol en la yema, en porcentajes de 46%, 32% y 34% respectivamente. En 1976, se produce el primer reporte de un inhibidor de HMG-CoA (3 hidroxi-3-metilglutaril-CoA) reductasa (HMGR), la mevastatina o compactina, aislada de cultivos de Pennicillium citrinum; luego han surgido un gran número de estatinas como lovastatina, simvastatina, pravastatina, fluvastatina, atorvastatina, cerivastatina, rosuvastatina, pitavastatina. La cerivastatina salió del mercado dada la aparición en personas, de un importante número de casos de rabdomiolisis y muerte. La atorvastatina parece ser el más potente compuesto investigado en ponedoras, en reducir el colesterol. En marzo de 2004 se dio a conocer en la Web la primera versión del genoma del pollo (Gallus gallus), siendo publicado en Nature ese mismo año. Probablemente los más grandes avances en la reducción del colesterol, se logren mediante la transgénesis; ello dependerá del marco regulatorio para los alimentos producto de la bioingeniería, de la aceptación del consumidor y factores económicos. (Elkin 2007)
En Australia, los huevos aportan a los adultos 28% de yodo, 58% de selenio, 48% de folato, 12-20% de omega-3, 11-18% de omega- 6, 21% de fósforo, 25% de proteína, 43% de B12, 32% de vitamina A, con base en las RDI y Nutrient Reference Value for Australia and New Zealand. (AECL 2008)
Se ha reportado que el consumo de huevos enriquecidos con yodo, producidos por gallinas alimentadas con kelp, reducen el colesterol plasmático en humanos y en animales de experimentación. Garber y colaboradores hallaron que el efecto fue más pronunciado en personas con elevados valores iniciales de colesterol y en casos con hiperlipidemia mixta: elevado colesterol y triglicéridos. (Garber 1992)
La inclusión de huevos en el desayuno, en un programa de manejo de peso con dieta deficiente en energía, puede ofrecer un suplemento nutricional e incrementar la pérdida de peso, según se desprende de un estudio realizado durante 8 semanas, en 152 hombres y mujeres entre 25 y 60 años de edad, con Índice de Masa Corporal elevado. (Vander Wal 2008)
En México, se alimentaron ponedoras White Leghorn con “langostilla” (Pleuroncodes planipes), un crustáceo marino, en concentraciones de 3% y 6%, que aumentaron los niveles de todos los ácidos grasos n-3 y n-6 analizadas por cromatografía de gases: linoleico, α-linolénico, araquidónico, eicosapentanoico y docosahexanoico. Los crustáceos y peces marinos son ricos en n-3 porque en su dieta incluyen zooplancton y fitoplancton, una importante fuente de ácidos grasos poliinsaturados. (Carrillo-Domínguez 2005)
El ácido linoleico es precursor de los ácidos araquidónico y docosapentanoico, y el ácido linolénico es precursor de los ácidos eicosapentanoico y docosahexanoico.
Una revisión de Sparks sobre el rol de los huevos en el cambio de la nutrición humana, trata sobre los beneficios de la modificación en huevos del perfil de grasas y antioxidantes. El contenido de colesterol puede ser reducido, disminuyendo la masa de la yema en relación al huevo o mediante el uso de aditivos como beta-ciclodextrina que tiene un efecto específico en el contenido de colesterol en la yema. La relación de ácidos grasos poliinsaturados n-3:n-6 en la dieta, es importante por su papel en el metabolismo energético y en las membranas biológicas, y también por metabolismo de los eicosanoides, la expresión genética y comunicación intercelular. Los huevos producidos por gallinas que reciben alimentación convencional tienden a ser relativamente altos en su contenido de ácidos grasos poliinsaturados n-6, pero la manipulación dietética puede emplearse para incrementar los ácidos grasos poliinsaturados n-3, directamente usando aceites de pescado o indirectamente incrementando los niveles del precursor de n-3 con ácido alfa-linolénico en forma de linaza o similares. El ácido graso poliinsaturado n-3 docosahexanoico, por su alto grado de insaturación es muy susceptible a la oxidación durante el almacenamiento o la cocina, pero esto puede ser resuelto en parte enriqueciendo la yema de huevo con antioxidantes como la vitamina E, con lo que además se aumentaría el aporte de antioxidantes en el consumidor. (Sparks 2006)
Se ha encontrado que el aceite de linaza produce un gran incremento en los ácidos linoleico y linolénico en la grasa del huevo, mientras la soya y el aceite de cártamo solo incrementan el ácido linoleico a pesar de que el aceite de soya contiene 7 a 8% de ácido linolénico. (Fisher 1957)
La incorporación de ácido linoleico y linolénico en los lípidos del huevo, se incrementa en relación a las cantidades presentes en la dieta y alcanza una meseta a niveles de 5% en la dieta. El ácido linoleico alcanza mayores niveles que el linolénico, aunque la incorporación de ambos se reduce cuando se incluye sebo. (Reiser 1961)
Un estudio se dedicó a conocer la composición de huevos enriquecidos, obtenidos mediante la alimentación de las ponedoras con linaza, minerales, vitaminas y luteína. Se halló que 100 gramos de estos huevos contenían 6 veces más ácidos grasos omega-3 ALA , 3 veces más DHA, 3 veces más vitamina D, 4 veces más ácido fólico, 6 veces más vitamina E, 6 veces más luteína y zeaxantina, 2,5 veces más yodo y 4 veces más selenio. Como el contenido de ácidos grasos omega-6 no cambió, la relación omega-6/omega-3 disminuyó, lo que resulta beneficioso. Estos huevos contenían un poco menos de colesterol y como en los huevos estándar, son ricos en vitamina B12, vitamina B5 (ácido pantoténico), vitamina B2 (riboflavina) y fósforo. Estos huevos son particularmente apropiados para personas ancianas. (Bourre 2006)
La suplementación en la dieta de gallinas Hisex Brown, de 30 semanas de edad, con semillas de lino, aditivos de hierbas, vitamina E, Se, I y ácido fólico, produjo mayor contenido de ácidos grasos omega-3, vitamina E, menos colesterol (170 mg vs 200 mg en huevos regulares), más ácido fólico, yodo y selenio en comparación con los huevos de gallinas que no recibieron esta dieta enriquecida. Los huevos presentaron altos niveles de DHA, a pesar de que la linaza en la dieta no lo contiene, lo que confirma el proceso de síntesis de DHA a partir de ácido linolénico, bajo la influencia de las enzimas desaturasa y elongasa. El total de ácidos grasos poliinsaturados omega-3 en estos huevos enriquecidos, supera los 400 mg, lo cual constituye entre 44-50% de los requerimientos diarios de estos ácidos grasos, y que se estiman en 800-1000 mg. (Yannakopoulos 2005)
Un estudio conducido en Irán, en gallinas Hy-Lyne White de 24 semanas de edad, midió el efecto de la administración de aceite de canola en el contenido de colesterol y ácidos grasos omega-3. La dieta con 3 y 5% de aceite de canola, incrementó el porcentaje total de los ácidos grasos omega-3 en 4,72 y 6,8%, comparado con el 1,43% de la dieta control. La concentración de colesterol en el huevo, fue más alta en aves alimentadas con 5% de aceite de canola y también aumentó con 3% del mismo aceite, comparada con la dieta control. Los investigadores concluyen, que 5% de aceite de canola en una dieta de ponedoras basada en maíz amarillo y soya, puede incrementar el contenido de ácidos grasos omega-3 en la yema de huevo y ser beneficioso para la salud humana. (Rowghani 2007)
Los huevos de muchas pequeñas granjas, son buscados por su sabor y condiciones de bioproducción, sin embargo suelen presentar menor contenido de minerales y otros nutrientes, por lo que se requeriría fomentar la suplementación en dichas granjas. (Travnicek 2006)
Mundialmente se ha implicado a Salmonella enteritidis como agente causal en brotes de intoxicación alimentaria, particularmente en productos avícolas. En un estudio realizado en Chile, se analizaron 1081 muestras de huevos en venta en la región Metropolitana. El porcentaje de aislamiento de S. enteritidis en las muestras de huevos analizadas alcanzó 0,09%, equivalente a una de cada 1000 muestras, no detectándose en la cáscara pero si en la yema; esto respalda el concepto de contaminación transovárica del huevo en el sitio de producción. Por ello se requiere un estricto control y vigilancia sanitaria, de los productos avícolas en su producción, procesamiento, transporte y expendio. (Alexandre 2000)
Algunos aspectos de la fisiología aviar:
Gran parte del huevo es formado a nivel del oviducto, específicamente la clara, las membranas de la cáscara y la cáscara propiamente dicha. En las aves de interés comercial, como la gallina, codorniz y pava, solo se desarrolla el oviducto izquierdo. La progesterona presenta un alza 7 horas antes de la ovulación y alcanza su pico unas 3 horas antes de la misma, lo que sería responsable del alza de la LH, que a su vez desencadenaría finalmente la ovulación. La progesterona, es la hormona que estimula la síntesis de secreciones del oviducto tales como albúmina y membranas de la cáscara.
El útero, una de las partes del oviducto, es el segmento donde se desarrolla la cáscara y donde mayor tiempo permanece el huevo en formación, unas 20 horas. La cáscara está constituida por acumulación de cristales de carbonato de calcio. El ión carbonato se forma a partir de CO2 y agua, con acción de la enzima anhidrasa carbónica. La calcificación del huevo para formar la cáscara, se realiza mayormente durante la noche, y el calcio proviene del hueso medular y no de la dieta; durante el día el proceso es inverso, depositándose calcio de la dieta en la médula de los huesos largos, dado que el huevo en formación no se encuentra en el útero y aún no se ha iniciado la calcificación de la cáscara. Durante el proceso de máxima calcificación, el calcio es retirado de la sangre en una cantidad cercana a los 150 mg/hora, lo que significaría retirar el total del calcio sanguíneo en 10 a 15 minutos. Para evitar esta situación, el calcio acumulado en los huesos largos, por acción de la parathormona es movilizado hacia la sangre, para ser depositado en la cáscara, presumiblemente por acción de esteroides ováricos y otros mecanismos no bien conocidos. La oviposición, que significa la expulsión del huevo desde el útero, ocurre regularmente cada 24-36 horas; por lo general la primera oviposición ocurre temprano en horas de la mañana y luego va sufriendo retrasos de 1 a 2 horas. Aunque muchas investigaciones indican una independencia entre la ovulación y la oviposición, en general la oviposición se produce 15-30 minutos antes de la ovulación del siguiente huevo. (Crossley 1982)
Bajo ordinarias condiciones del día, la ocurrencia de la ovulación y oviposición en la gallina doméstica está restringida a un periodo de 8-10 horas. Existen plenas evidencias que avalan el rol de las gonadotrofinas y progesterona en el crecimiento y maduración del folículo y el normal funcionamiento ovárico en la gallina. Una creciente lista de factores, interaccionan para lograr el crecimiento folicular y la ovulación, entre los que se citan: factores de crecimiento, macrófagos, activador del plasminógeno, ornitina decarboxilasa, inhibina, activina, folistatina, relaxina, oxitocina, prostaglandinas y péptidos intestinales vasoactivos. La glándula adrenal se ha involucrado en la sincronización de la ovulación. La producción de huevos en gallinas ponedoras, declina con el progreso de la edad, lo que es un indicador del declinamiento de la ovulación. Al aumentar la edad aumenta el intervalo entre las ovulaciones y disminuye la producción de huevos. Se sugieren diferencias en el crecimiento y maduración folicular entre los diversos genotipos de las aves. Se ha sugerido una mayor actividad en el eje pituitario-ovárico en gallinas ponedoras blancas en comparación con las de color marrón. (Zakaria 2002)
Los ácidos linoleico y linolénico son esenciales para las aves de corral; como los animales no los pueden sintetizar, se deben suplir en la dieta. El ácido araquidónico puede ser sintetizado in vivo a partir de ácido linoleico, mientras los ácidos EPA y DHA pueden ser sintetizados in vivo a partir de ácido linolénico. (Yannakopoulos 2005)
La biosíntesis de colesterol es un complejo proceso que envuelve más de 30 enzimas. En las ponedoras, el colesterol se biosintetiza principalmente en el hígado y se incorpora dentro de las partículas de vitelogenina (VTG) y de lipoproteínas de muy baja densidad ricas en triglicéridos (VLDL), que son segregadas dentro del flujo sanguíneo y seguidamente captadas por oocitos en desarrollo mediante endocitosis. Las VLDL y VTG se transforman después intracelularmente dentro de la yema, constituyendo alrededor del 60% y el 24% de la materia seca de la yema y más o menos un 95% y un 5% del colesterol de la misma respectivamente.(Elkin 2006)
El yodo es transferido durante la incubación a través de las paredes endomesodérmicas extraembrionarias que rodean la yema, y de allí a la circulación embrionaria. Algunos investigadores sugieren que la glándula pituitaria, que actúa directamente en el desarrollo de la glándula tiroides, puede también influir en el intercambio de yodo a través de las paredes del saco de la yema, afectando la tiroides por el incremento del suplemento de yodo. (Daugeras-Bernard 1980)
Las hormonas tiroideas T4 y T3 se encuentran en la yema y en muy bajas concentraciones en la clara. A los seis días de incubación, la cabeza y principalmente el cerebro contiene 4,1 picogramos de T4 y 4,6 picogramos de T3. A los 10 días se inicia la función tiroidea y la concentración de T4 se incrementa progresivamente entre los 10 y 20 días en cerebro, ojos, hígado y corazón, alcanzando a los 20 días, valores de 4,8 nanogramos en ojos y 8,2 nanogramos en hígado. La concentración de T3 se incrementa marcadamente en el cerebro, alcanzando valores de 5,1 nanogramos a los 20 días; el incremento de T3 es menos marcado en ojos y corazón. Así que las yodotironinas están disponibles para el embrión del pollo a través de su desarrollo, antes y después del inicio de la función tiroidea. (Prati 1992)
Requerimientos de yodo en aves:
Una dieta típica para la alimentación de gallinas contiene 1-2 mgI/kg, los cuales provienen mayormente de la suplementación con una premezcla que puede contener KI o Ca(IO3 )2; de sal yodada con 3 g KI/Kg Na Cl. La materia prima comúnmente empleada para formular la dieta en aves de corral contribuye con menos de 0,15 mgI/Kg al menos que contemple alguna materia rica en yodo como el kelp. El yodo en la dieta de las aves puede estar en forma libre, en forma de yoduro o yodato. El yodo libre y yodato son reducidos a yoduro en el intestino antes de su absorción. (Leeson 2001)
Los minerales traza típicamente suplementados en las aves, incluyen zinc, manganeso, cobre, hierro, selenio y yodo. La premezcla de los minerales citados, regularmente es formulada y suplementada a las aves separada de la premezcla de vitaminas, debido a la potencial oxidación de estas últimas. Se incluyen en cantidades muy pequeñas, en un rango frecuente de 0,05-0,5%. El exceso de un mineral, puede interferir la disponibilidad de otro. El más común antagonismo ocurre entre el zinc y cobre. Altos niveles de zinc, pueden inhibir la absorción de cobre, su acumulación hepática y deposición en el huevo. Una relación mayor de 4:1 de zinc: cobre puede ser considerada antagonista. Altos niveles de hierro y cobre pueden interferir la disponibilidad del zinc y potencialmente inducir anemia. El exceso de fósforo en la dieta interfiere la disponibilidad del manganeso, en las aves de corral. Condiciones ambientales como el agua y los suelos, pueden contribuir a excesiva exposición a los minerales traza. Por ejemplo, en el medio oeste de Estados Unidos, existe una abundancia de manganeso y zinc, que pueden transferirse a las cosechas de maíz producidas en estos suelos y al agua de bebida, por lo que estas potenciales fuentes, deben tomarse en cuenta al calcular la rata de consumo de minerales traza en las aves. (Scheideler 2006)
Alimentos preparados con colza, produjeron un aumento de la glándula tiroides el cual no fue contrarrestado con el suministro de yoduro de potasio. Se requirió aportar lisina adicionalmente para lograr un óptimo crecimiento de los pollos y pigmentación de la pluma. (Kratzer 1954)
Un experimento evaluó el efecto del glucosinolato presente en una dieta con semillas de colza -planta bociógena del género Brassica- en la transferencia del yodo de la dieta al huevo. El porcentaje de 125I transferido a la yema fue significativamente reducido por la inclusión de alta concentración de glucosinolato en el alimento. (No authors listed 1977)
El contenido de glucosinolatos se ha reducido actualmente en las dietas a base de colza, sin embargo contienen sinapina -un precursor de trimetilamina- y goitrina, que al existir una reducción de la enzima trimetilamino oxidasa, producen aspecto en la yema que afectan la aceptación del huevo por parte del consumidor. La suplementación con yodo mejoró el peso del huevo y la yema pero no lo hizo en la cualidad sensorial de huevos producidos con una alimentación a base de colza. Cabe destacar que se reportan bajos porcentajes en la producción de huevos con desagradable olor a pescado, en gallinas ponedoras alimentadas con colza: 3,4% en Hy-Line y 7,4% en ISA Brown, lo que apunta a la selección en el cruzamiento de las ponedoras como parte de la solución. (Lichovnikova 2008)
Aparentemente todas las especies animales, tienen un amplio margen de seguridad ante el exceso del consumo de yodo. Tenores de yodo en la dieta de 500-1000 veces los niveles mínimos requeridos, son bien tolerados en ratas, cerdos, pollos y rumiantes. Los caballos resultan ser más susceptibles a la toxicidad por yodo; en ellos se produce bocio y se reduce la organificación del yodo en la tiroides. Perdomo reportó reducción de la producción de huevos en ponedoras con niveles de 312 mgI/Kg en la dieta y cese de la puesta con niveles de 5000 mgI/Kg, situación que se revirtió a los 7 días de reiniciar la alimentación normal. La administración en pollos de 300 gr de peso, de dosis masivas y únicas por intubación de 300 mg de yodo (900 mgI/Kg de peso) no produjo síntomas y fue rápidamente aclarado en la orina; sin embargo el consumo de 300 mg de yodo, en frecuentes y pequeñas raciones durante un período de 10 días, produjo malestar general y anorexia. Se ha establecido que el I en posición 5 de la molécula de tironina, es requerido para la bioactividad de las hormonas tiroideas, T3 y T4; se conoce además que el Br puede reemplazar el I en la posición 5 de las T3 y T4 sin pérdida de la actividad hormonal. Baker y colaboradores, lograron aminorar los síntomas neurológicos, restablecer el consumo voluntario y crecimiento en pollos alimentados con dosis tóxicas de yodo al suministrarles sales de bromo. (Baker 2004)
Los efectos del exceso de yodo en la yema de huevos fueron evaluados después de inyectar 0,5 o 1 mg de yoduro en el segundo día de incubación. Los niveles de yodo en el plasma embrionario se incrementaron significativamente sobre los niveles de controles de la misma edad. Estos incrementos fueron proporcionales a la cantidad de yodo en exceso en la yema. Una relación constante se mantuvo entre los niveles de yodo en el líquido alantoideo y el plasma durante todo el periodo de incubación. Hasta el día 10, el contenido de yodo en el tiroides embrionario se correlacionó estrechamente con el incremento de la concentración del yodo en plasma. Después del día 10, ya se ha establecido el eje hipotálamo-adenohipófisis-tiroides y el incremento del yodo en la tiroides no guardó esa misma correlación con el yodo del plasma, aunque duplicó el de los controles. Como el tamaño de la tiroides se duplicó en los embriones tratados, las concentraciones de yodo fueron similares en los controles y embriones tratados. El exceso de yoduro no bloqueó la organificación del yodo en la tiroides. Los niveles circulantes de hormonas tiroideas no fueron diferentes en los embriones tratados y controles, a pesar de duplicarse el contenido de hormonas tiroideas en bocios de los embriones tratados. (Daugeras-Bernard 1993)
Los efectos de la suplementación a un grupo de ponedoras ISA Brown, con altas cantidades de yodo y por largo periodo de tiempo, impactó negativamente en la producción de huevos, el peso del huevo e índice de la yema. (Lichovnikova 2003)
La suplementación en la dieta de ponedoras, mediante kelp o KI, incrementó el contenido de yodo en huevos dependiendo de la fuente y el periodo de puesta. El pasaje de yodo proveniente de KI a los huevos, fue mayor a finales del ciclo de postura. La deposición de yodo disminuyó a valores iniciales, dos semanas después de suspendida la suplementación en la dieta. El contenido de colesterol en la yema disminuyó significativamente, alrededor de 20%, entre las semanas 41 y 45 de edad, y se mantuvo hasta el final del ciclo de postura, por debajo del grupo control. Se presentó en las gallinas, una tendencia al decrecimiento en la concentración plasmática de tiroxina y triiodotironina. (Rys 1995)
La dieta típica para ponedoras contiene 1-2 mgI/kg, pero más altas concentraciones son a veces empleadas para aumentar el contenido de yodo en huevos, lo que puede traer efectos adversos. Exceso de yodo en dietas de crecimiento puede prevenir la maduración sexual en machos y hembras, en dietas de ponedoras se reduce progresivamente la producción de huevos y con niveles de 2500 mgI/Kg se inhibe la ovulación y cesa la producción de huevos. Simultáneamente con la declinación de la puesta, baja el consumo de alimentos, disminuye el peso del huevo y el contenido de colesterol en la yema. La fertilidad no es afectada en hembras de cría pero se reduce la viabilidad de los huevos fértiles, se extiende el período de empollar y se incrementa la mortalidad embrionaria y la muerte dentro del cascarón. La fertilidad en los machos se aminora por la mayor incidencia de espermatozoides muertos, aunque la viabilidad de huevos puestos por gallinas normalmente alimentadas no se ve afectada. Todas las variables reproductivas, el consumo de alimentos y peso corporal se normalizan dentro de los 7 días posteriores al retorno de una dieta normal. Existe un incremento transitorio en la concentración de yodo y colesterol plasmático, durante el consumo excesivo de yodo en todos los tipos de aves. (Lewis 2004)
Investigadores de Turquía, llevaron a cabo un experimento con 600 ponedoras SHSY tipo Brown, de 21 semanas de edad para determinar los efectos de la suplementación durante 30 semanas, con niveles de 0, 3, 6, 12 y 24 mgI/Kg en forma de yodato de calcio. La suplementación con 12 mgI/Kg incrementó el consumo de alimentos por docena de huevos, comparado con los grupos suplementados con 0 y 6 mgI/Kg. El peso del huevo fue menor en los grupos suplementados con 12 y 24 mgI/Kg comparado con el grupo que no la recibió.
La suplementación con 12 y 24 mgI/Kg redujo el índice de albúmina y las unidades Haugh. La concentración de yodo en la yema, albúmina y en el huevo completo, se elevó al incrementarse la suplementación con yodo. Concluyen que la suplementación con 3 y 6 mgI/Kg en la dieta de las ponedoras, puede ser empleada para enriquecer los huevos, sin los efectos adversos en el desempeño de las aves y las cualidades del huevo. (Yalcin 2004)
En la República Checa, se alcanzaron concentraciones de yodo en la yema, que excedieron los 2500 ug /Kg de materia fresca, analizados en huevos producidos entre las semanas 32 y 60 del ciclo y con un aporte diario de 0,116-0,132 mg de yodo por ave. (Travnicek 2006)
El máximo nivel de yodo que puede ser tolerado en la dieta de gallinas ponedoras, es de 5 mg/Kg de alimento, según lo adoptó el panel convocado por la Unión Europea. Entre los productos de animales terrestres, la leche y los huevos muestran las más altas concentraciones de yodo. (EFSA 2005)
Determinaciones del contenido de yodo en huevos:
En un experimento realizado en Ohio, Estados Unidos, en gallinas White Leghorn, se halló un incremento en el valor del contenido de yodo en huevos, más o menos proporcional a la cantidad de yodo en la dieta. El valor (en ppm) del contenido de yodo en huevos frescos libres de cáscara, en aves alimentadas con una dieta basal, pescado, kelp y yoduro de potasio, fueron 0,57; 0,77; 7,81 y 8,25 respectivamente. En otro experimento de estos mismos investigadores, se halló un incremento de 75 veces en el contenido de yodo, cuando se alimentó a las aves con 2 mg de yodo diariamente en forma de kelp, linaza yodada o yoduro de potasio. Al elevar a 5 mg de yodo diariamente, en forma de linaza yodada o yoduro de potasio, el incremento fue de 150 veces en el contenido de yodo en huevos. (Wilder 1933)
La región del sureste de Polonia es caracterizada por bajas concentraciones de yodo en el agua potable y alimentos. En ella se determinó en huevos que habían sido previamente secados y congelados, el contenido de yodo en la yema, que osciló entre 4 y 20 ug. Estos huevos provenían de pequeñas granjas de algunas aldeas. (Holynska 1993)
Incrementando el contenido de yodo en la premezcla, se produjo un aumento del 52,2% en la concentración de este elemento en el huevo. (Dobrzánski 2001)
En Polonia, se administró a gallinas Lohmann Brown, preparaciones de “mineral-humic” a la dieta, lo que provocó un significativo incremento del selenio y una disminución del molibdeno. El contenido en el huevo de Co, Cu, I, Zn, Mn no resultó afectado. (Dobrzánski 2007)
En un estudio realizado durante 1997, por grupos de alimentos en 20 localidades del Reino Unido, el promedio del contenido de yodo en huevos fue de 0,48 mg/Kg peso fresco. Las más altas concentraciones de bromo, yodo y flúor se hallaron en el grupo de los pescados, lo que refleja la relativa abundancia de estos elementos en el ambiente marino. (Food Standards Agency U K 2000, MAFF 1997)
En Corea se analizó mediante la activación de neutrones, el contenido de yodo en alimentos de consumo común. El contenido resultó más alto en algas marinas comestibles, pescados y huevos enriquecidos, y muy bajo en cereales, granos, frutas y vegetales. Los niveles de yodo oscilaron entre 13.700 y 1.790.600 ug/Kg en algas marinas; entre 478 y 2.840 ug/Kg en pescados y mariscos; 314 ug/Kg en huevos y 1.869 ug/Kg en huevos enriquecidos con yodo. El contenido de yodo en la mayoría de los vegetales y frutas fue menor a 10 ugI/Kg. (Moon 1998)
Las tablas de composición de alimentos de Alemania establecen para los huevos un contenido entre 1 y 40 ugI/100 g. (Food Composition and Nutrition Tables 1994)
En los Estados Unidos un estudio conducido entre los años 1982-1986, reveló un contenido de yodo en huevos entre 40 y 71 ug/100 g. (Pennington 1989)
En los Estados Unidos se señaló para el periodo 1982-1991, un contenido de 480 ± 390 nanogramos/g. (Pennington 1995)
Una importante fuente de yodo dietario en los Estados Unidos, está representada por los huevos, la carne y el pollo. El huevo contiene alrededor de 29 ug de yodo. (Leung 2007)
En muchos países de Europa donde el alimento para los animales es yodado, los productos como huevos y carne proveen una considerable cantidad de yodo. En el Reino Unido se reportó un contenido de 53 ugI/100 g de huevo. (Lee1994)
En Noruega se estimó el consumo de yodo en la población y sus principales fuentes. Aunque en este país no existió la obligatoria yodación de la sal, la deficiencia de yodo ha desaparecido. El incremento del contenido de yodo en la leche y sus derivados, a través de la fortificación de los piensos y el extendido consumo de pescado de mar, explican la erradicación del bocio endémico. Los huevos presentaron una concentración promedio de 45 ugI/100g. (Dahl 2004)
El contenido de yodo en varios alimentos del mercado suizo, se analizó durante los años 1999-2001 mediante ICP-MS empleando isótopos de 129I. El promedio del contenido de yodo en huevos (nanogramos/g) ± SD fue de 324 (247-428). Para la mayoría de los alimentos, la concentración promedio de yodo excede la correspondiente mediana, indicando que la distribución está sesgada hacia valores altos. (Haldimann 2005)
En Finlandia se reportó un contenido de yodo en huevos de 170 nanogramos/g. (Varo 1982)
En Reino Unido se reportó en el periodo 1977-1979, una concentración de 525 nanogramos/g. (Wenlock 1982)
En Grecia, el contenido de yodo en huevos enriquecidos fue de 34 ug por huevo, comparado con 9 ug por huevo no enriquecido. (Yannakopoulos 2005)
Diversos alimentos adquiridos en la población egipcia de Kafr El-Sheikh, fueron analizados mediante HPLC. De ellos el pescado presentó la mayor cantidad de yodo con 32 ug/100 g. Le siguen los huevos con 26,23 ug/100 g; queso con 20,86 ug/100 g; yogur con 18,61 ug/100 g; leche con 18,30 ug/100g. (El-Sayed 1997)
Travnicek y colaboradores determinaron mediante el método de Sandell-Kolthoff, el contenido de yodo en la yema y la albúmina de huevos procedentes de grandes y pequeñas explotaciones en la República Checa, los años 2004 y 2005. El promedio en la yema de grandes granjas en el 2004 fue de 1014,1 ± 356,6 y en el 2005 aumentó a 1663,8 ± 1179,7 ug/kg materia fresca. El promedio de las yemas de pequeñas granjas en 2004 y 2005 fueron 307,1 ± 255,7 y 519,5 ± 508,2 ug/Kg materia fresca. Los investigadores compararon los resultados del año 2005 con otros del año 1996, y demostraron un incremento de 123,7% en el contenido de yodo en la yema de grandes granjas y de 19,2% en pequeñas granjas. El contenido de yodo en la albúmina tuvo un promedio de 16,2 ± 9,7 ug/Kg de materia fresca y suma 2,6-5% del contenido total de yodo en un huevo. El coeficiente de correlación entre el contenido de yodo en la yema y la albúmina hallado fue r = 0,67. En este país, un huevo producido en una gran explotación contiene en promedio 31,2 ug de yodo, mientras el obtenido en pequeñas granjas contiene 10 ug. Los huevos con mayor contenido del mineral, cubren del 7-14% de los requerimientos diarios de yodo en adultos. (Travnicek 2006)
En Lituania -parte de una región con deficiencia endémica de yodo- se alimentaron 120 ponedoras Hisex Brown de 47 semanas de edad, con niveles de 1 y 4 mg de yodo estable por Kilogramo de alimento, lográndose 24 % y 196% más yodo en los huevos al compararlos con un grupo control. También se estableció que la adición de yodo estable al alimento incrementó los niveles de yodo en el hígado de las gallinas en 12,5%-25%. Estos mismos investigadores agregaron yodo estable en el agua de bebida en concentraciones de 0,5 y 5 mg de yodo por litro de agua, incrementando el contenido de yodo en la carne de pollos Ross parrilleros en un promedio de 16 y 76% al compararlo con un grupo control que recibió yoduro de potasio en el alimento. (Cepuliene 2008)
Estudios realizados en Nueva Zelanda, revelaron durante 2003-2004 un contenido promedio en huevos de 0,69 mgI/Kg, superior al obtenido en 1997-1998 que fue de 0,54 mgI/Kg. El muestreo realizado durante Julio- Agosto de 2003 en las localidades de Auckland, Napier, Christchurch y Dunedin reportó un contenido de yodo en huevos de 0,51; 0,69; 0,452 y 0,458 ug/Kg respectivamente en las localidades citadas. (Vannort 2000, Vannort 2003)
Dos huevos con un peso total de 104 g contienen 43 ug de yodo, según los resultados de un estudio realizado durante 2007 en Australia, con lo que se provee el 28% de las recomendaciones diarias. (AECL 2008)
En la Tabla 1 se resumen algunos resultados de las determinaciones del contenido de yodo en huevos.
Tabla 1. Contenido de yodo en huevos
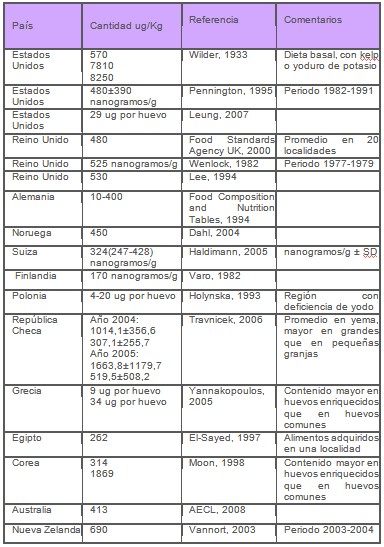
FUENTE: Datos compilados por Luis Caballero 2008
Bibliografía:
1. AECL. Australian Egg Corporation Limited. Nutritional Value Table. (Citado el 25/08/2008 en: http://www.aecl.org )
2. Alexandre M, Pozo C, González V, Martínez M C, Prat S, Fernández A, Fica A, Fernández J. 2000. Detección de Salmonella enteritidis en muestras de productos avícolas de consumo humano en la Región Metropolitana. Revista Médica de Chile. 128(10)
3. Baker D H. 2004. Iodine Toxicity and Its Amelioration. Experimental Biology and Medicine. 229:473-478
4. Bourre J M, Galea F. 2006. An important source of omega-3 fatty acids, vitamins D and E, carotenoids, iodine and selenium: a new natural multi-enriched egg. J Nutr Health Aging. 10(5): 371-6
5. Carrillo-Domínguez S, Carranco-Jauregui M E, Castillo R M, Castro M I, Avila E, Perez F. 2005. Cholesterol and n-3 and n-6 Fatty Acid Content in Eggs from Laying Hens Fed with Red Crab Meal (Pleuroncodes planipes). Poultry Science. 84:167-172
6. Cepuliene Ramune, Bobiniene R, Siruydis V, Gudaviciute D, Miskiniene M, Kepaliene I. 2008. Effect of stable iodine Preparation on the Quality of Poultry Products. Veterinarija ir Zootechnika. 42(64)
7. Chowdhury S R, Chowdhury S D, Smith T K. 2002. Effects of dietary garlic on cholesterol metabolism in laying hens. Poultry Science. 81(12):1856-1862
8. Crossley J. 1982. Fisiología del oviducto aviar. Monografías de Medicina Veterinaria. 4(2)
9. Dahl L, Johansson L, Julshamn K, Meltzer H M. 2004. The iodine content of Norwegian foods and diets. Public Health Nutrition. 7(4): 569-576
10. Daugeras-Bernard N, Demeneix B A, Lachiver F. 1993. Excess iodide and thyroid function in the developing chick embryo. Gen Comp Endocrinol. 89(1):91-100
11. Daugeras-Bernard N, Lachiver F. 1980. Thyroid function and iodine metabolism in the chicken embryo. Reprod Nutr Dev. 20(1B):203-7
12. Dobrzanski Z, Gorecki H, Chojnacka K, Gorecka H, Sinowiec M. 2007. Effect of Dietary Humic Preparations on the Content of Trace Elements in Hens' Eggs. American Journal of Agricultural and Biological Sciences. 2(2):234-240
13. Dobrzanski Z, Strzelbicka G, Szczpel J, Trziszka T. 2001. Study on enrichment of hen eggs with selenium and iodine. Electronic Journal of Polish Agricultural Universities. 4(2)
14. Egg and Nutrition: Nutritional values of the egg. (Citado el 14/08/2008 en: http://www.nutritionandeggs.co.uk/eggs_nutrition/nutrition 1.html )
15. Elkin R G. 2006. Reducing shell egg cholesterol content. I. Overview, genetic approaches, and nutritional strategies. World's Poultry Science Journal. 62:665-687
16. Elkin R G. 2007. Reducing shell egg cholesterol content. II. Review of approaches utilizing non-nutritive dietary factors or pharmacological agents and an examination of emerging strategies. World's Poultry Science Journal. 62:5-32
17. El-Sayed N, Gad Z, Nofal L, Ismail H, El Sahn F, Gad A. 1997. Iodine deficiency disorders among primary-school children in Kafr ElSheikh, Egypt. Eastern Mediterranean Health Journal. 3(1):29-37
18. European Food Safety Authority (EFSA). 2005. Opinion of the Scientific Panel on Additives and Products or Substances used in Animal Feed on the request from the Commission on the use of iodine in feeding stuffs
19. Evans Terry. 2008. Asia to lead in both production and consumption to 2015. Egg Industry
20. Fisher H, Leveille G. 1957. Observations on the Cholesterol, Linoleic and Linolenic Acid Content of Eggs as Influenced by Dietary Fats. The Journal of Nutrition. 63(1):119-129
21. Food Composition and Nutrition Tables (5th). 1994. CRC press, Germany
22. Food Standards Agency UK-1997. 2000. Total Diet Study -Fluorine, Bromine and Iodine. No. 5
23. Garber D W, Henkin Y, Osterlund L C, Darnell B E, Segrest J P. 1992. Plasma lipoproteins in hyperlipidemic subjects eating iodine-enriched eggs. Journal of the American College of Nutrition. 11(3):294-303
24. Gruzauskas R, Lukosevicius L, Danius S. 2002. Eggs as a functional food. 10 Baltic Poultry Conference. Vilnius, p. 18-21
25. Haldimann M, Alt A, Blanc A, Blondeau K. 2005. Iodine content of food groups. Journal of Food Composition and Analysis. 18(6):461-471
26. Holynska B, Ostachowicz B, Ostachowicz J, Szybinski Z. 1993. Evaluation of iodine concentration in potable water and selected food specimens from moderate endemic goiter area in Poland. Endokrynol Pol. 44(3):359-65
27. Ishikawa T, Kamimae B. 1980. Method for producing eggs containing a high amount of iodinated amino acids. United States Patent Application. No. 922.581
28. Istvan E S, Deisenhofer J. 2001. Structural Mechanism for Statin Inhibition of HMG-CoA Reductase. Science. 292(5519):1160-1164
29. Jacob J, Miles R. 2000. Designer and Specialty Eggs. Institute of Food and Agricultural Sciences. University of Florida
30. Jeroch H, Eder K, Schone F, Hirche F, Bottcher W, Seskeviciene J, Kluge H. 2002. Amounts of essential fatty acids, α tocoferol, folic acid, selenium and iodine in designer eggs. Lithuanian Veterinary Academy International Symposium on Physiology of Livestock. p. 31-32
31. Kratzer F H, Davis P N, Williams D E, Marshall B J. 1954. Factors Influencing the Growth of Chicks and Poults Fed Rations Containing Rapeseed Oil Meal. The Journal of Nutrition. 53(3):407-418
32. Kritchevsky S. 2004. A Review of Scientific Research and Recommendations Regarding Eggs. Journal of the American College of Nutrition. 23(90006):596S-600S)
33. Lee S, Lewis J, Buss D, Holcombe G, Lawrence P. 1994. Iodine in British foods and diets. Br J Nutr 72:435-446
34. Leeson S, Summers JD. 2001. Minerals-Iodine. In Scott's Nutrition of the Chicken, 4th ed., pp 408-412. Guelph, Ont.:University Books
35. Leung A, Pearce E. 2007. Iodine Nutrition in North America. Hot Thyroidology. No. 5
36. Lewis P D. 2004. Responses of domestic fowl to excess iodine: a review. British Journal of Nutrition. 91(1):29-39
37. Lichovnikova M, Zeman L, Cermakova M. 2003. The long-term effects of using a higher amount of iodine supplement on the efficiency of laying hens. Br Poult Sci. 44(5):732-4
38. Lichovnikova M, Zeman L, Jandasek J. 2008. The effect of feeding untreated rapeseed and iodine supplement on egg quality. Czech J. Anim. Sci. 53(2):77-82
39. MAFF (Ministry of Agriculture, Fisheries and Food- United Kingdom). 1997. Dietary intake of iodine and fatty acids. Food Surveillance Information Sheet No. 127
40. Moon S, Kim J, Chung Y, Chung Y S. 1998. The Iodine content in Common Korean Foods. Korean J Nutrition. 31(2):206-212
41. No authors listed. 1977. Transfer of 125I to eggs in hens fed on diets containing high and low glucosinolate rapeseed meals. Br Poult Sci 18:705-10
42. Nutritional elements in U.S. diets: Results from the total diet study, 1982 to 1986. 1989. J Am Diet Assoc 89:659-664
43. Ormel P. 2001. América Latina y el Caribe en el contexto mundial de los productos de origen animal: Producción de huevos. FAO. 28 p.
44. Pennington J A, Young B. 1995. Iron, zinc, copper, manganese, selenium and iodine in food from the United States Total Diet Study. Journal of Food Composition and Analysis. 3:166-184
45. Pennington J A, Young B, Wilson D B. 1989. Nutritional elements in U S diets: Results from the total diet study, 1982 to 1986. J Am Diet Assoc 89(5):659-664
46. Prati M, Calvo R, Morreale G, Morreale de Escobar G. 1992. L-thyroxine and 3,5,3' –triiodothyronine concentrations in the chicken egg and in the embryo before and after the onset of thyroid function. Endocrinology. 130:2651-2659
47. Reiser R, Murty N L. 1961. Influence of Graded Levels of Dietary Linoleic and Linolenic Acids on the Fatty Acid Composition of Hens' Eggs. The Journal of Nutrition. 75:287-294
48. Rowghani E, Arab M, Nazifi S, Bakhtiari Z. 2007. Effect of Canola Oil on Cholesterol and Fatty Acid Composition of Egg-yolk of Laying Hens. International Journal of Poultry Science. 6(2):111-114
49. Rys R, Wir-Konas E, Pyska H, Kuchta M, Pietras M. 1995. Effect of varying amounts of Kelp and K J in the diets on the laying performance, iodine and cholesterol content of eggs, and thyroid hormones in the blood of layers. Roczniki Naukowe Zootechniki. 23(2):199-214
50. Scheideler S. 2006. Trace mineral balance in poultry. Egg Industry
51. Song W, Kerver J. 2000. Nutritional Contribution of Eggs to American Diets. Journal of the American College of Nutrition. 19(90005)
52. Sparks N H C. 2006. The hen's egg –is its role in human nutrition changing? World's Poultry Science Journal. 62:308-315
53. Stambury J B. Iodine deficiency and iodine deficiency disorders, present knowledge in nutrition. 1996. Seventh Edition. ILSI press, Washington D. C. p. 152-160
54. Travnicek J, Kroupova V, Herzig I, Kursa J. 2006. Iodine content in consumer hen eggs. Veterinarni Medicina, 51(3):93-100
55. United Egg Producers. General US Stats. (Citado el 15/08/2008 en: http://www.unitedegg.org )
56. Vander Wal J S, Gupta A, Khosla P, Dhurandhar N V. 2008. Egg breakfast enhances weight loss. International Journal of Obesity
57. Vani S, Umesh K. 2004. Iodine Deficiency and Development of Brain. The Indian Journal of Pediatrics. 71(4):325-329
58. Vannoort R W, Cressey P J, Silvers K. 2000. New Zealand Total Diet Survey Part 2: Elements. E S R. Client Report F W 99/47. Wellington: Mo H
59. Vannoort R W, Thomson B. 2003/04 New Zealand Total Diet Survey. New Zealand Food Safety Authority. ISBN 0-478-29801-3
60. Vannort R W, Shaw I, Thomson B. 2003. 2003-2004 New Zealand Total Diet Survey. Analytical Results Q1. Client Report F W 03/77
61. Varo P, Saari E, Paaso A, Koivistoinen P. 1982. Iodine in Finnish foods. International Journal of Vit. Nutr. Res 52:80-89
62. Wenlock R W, Buss D H, Moxon R E, Bunton N G. 1982. Trace nutrients, iodine in British food. British Journal of Nutrition 47:381-390
63. Wilder O H M, Bethke R M, Record P R. 1933. The iodine content of Hens'eggs as affected by the Ration. The Journal of Nutrition. 6(4)
64. Windhorst H W. 2006. Changes in poultry production and trade worldwide. World's Poultry Science Journal. 62:585-602
65. Windhorst H W. 2007. Bio-energy production –a threat to the global egg industry? World's Poultry Science Journal. 63:365-379
66. Yalcin S, Kahraman Z, Yalcin SS, Dedeoglu H E. 2004. Effects of supplementary iodine on the performance and egg traits of laying hens. Br Poult Sci. 45(4):499-503
67. Yannakopoulos A, Tserveni-Gousi A, Christaki E. 2005. Enhanced Egg Production in Practice: the case of Bio-Omega-3 Egg. International Journal of Poultry Science. 4(8):531-535
68. Zakaria A H. 2002. Egg production is a reflection of ovarian physiology: A review. Arab Gulf Journal of Scientific Research. 20(4):190-208