Introducción: El Síndrome X o Síndrome Polimetabólico constituye un estadio previo en el desarrollo de la Diabetes Mellitus Tipo 2 (DM2). Se caracteriza por la presencia de diversos grados de intolerancia a la glucosa (IG), hipertensión arterial (HTA), dislipemia (DL), resistencia a la insulina (RI) e hiperinsulinemia (HI) compensatoria. Es elevada la prevalencia de factores de riesgo cardiovascular (FRC) en pacientes con Síndrome X y sujetos con hiperinsulinemia y resistencia a la insulina.
Objetivo: Estudiar la resistencia a la insulina mediante la prueba de tolerancia oral a la glucosa (PTOG) en pacientes con hiperinsulinemia recién diagnosticada y factores de riesgo cardiovascular. Establecer la prevalencia de hiperinsulinemia y resistencia a la insulina en este grupo de riesgo.
Material y métodos: Se estudiaron 46 pacientes de 16 a 68 años (9 mujeres y 37varones) con factores de riesgo cardiovascular (HTA, dislipemia, obesidad, hiperuricemia, insuficiencia coronaria o vascular, antecedentes familiares de diabetes, tolerancia alterada a la glucosa o glucosa alterada en ayunas) y un grupo control de 10 sujetos sanos sin factores de riesgo cardiovascular. Se efectuó prueba de tolerancia oral a la glucosa (PTOG) (75 g) con dosajes de glucosa e insulina (I) basales y 30,60 y 120 minutos post-estímulo. Se determinaron los niveles de colesterol total, colesterol HDL, colesterol LDL, triglicéridos y ácido úrico en muestras de sangre con ayuno de 12 hs. mediante Metrolab 2300 automatizado. La I fue determinada por IRMA (Inmunotech). Se calculó en cada caso el índice HOMA como medida de la resistencia a la insulina y el índice de masa corporal (IMC). Análisis estadístico: estudio de prevalencia, prueba de Wilcoxon para muestras independientes, prueba no paramétrica de Kruskal-Wallis y análisis discriminante lineal.
Hiperinsulinemia (HI) e Insulinorresistencia (IR), diagnosticados con la prueba de tolerancia oral a la glucosa (PTOG), en pacientes con elevada prevalencia de factores de riesgo cardiovascular.
Argüello, Elizabeth María Cecilia. Título de Grado y Post- grado: Bioquímica. Especialista en Endocrinología. Lugar de Trabajo: HUMANA Instituto Médico Privado de Prevención y Control de Enfermedades.
Trabajo Científico. Certificado de Especialista en Endocrinología: 237. Colegio de Bioquímicos de la Provincia de Córdoba.
Vergara, Miguel Ángel. Titulo de Grado y Post-grado: Médico Cirujano. Especialista en Cardiología. Docente adscripto a la Cátedra de Semiología. UNC. Lugar de Trabajo: HUMANA Instituto Médico Privado de Prevención y Control de Enfermedades.
Hiperinsulinemia (HI) e Insulinorresistencia (IR), diagnosticados con la prueba de tolerancia oral a la glucosa (PTOG), en pacientes con elevada prevalencia de factores de riesgo cardiovascular
Resumen
Introducción: El Síndrome X o Síndrome Polimetabólico constituye un estadio previo en el desarrollo de la Diabetes Mellitus Tipo 2 (DM2). Se caracteriza por la presencia de diversos grados de intolerancia a la glucosa (IG), hipertensión arterial (HTA), dislipemia (DL), resistencia a la insulina (RI) e hiperinsulinemia (HI) compensatoria. Es elevada la prevalencia de factores de riesgo cardiovascular (FRC) en pacientes con Síndrome X y sujetos con hiperinsulinemia y resistencia a la insulina.
Objetivo: Estudiar la resistencia a la insulina mediante la prueba de tolerancia oral a la glucosa (PTOG) en pacientes con hiperinsulinemia recién diagnosticada y factores de riesgo cardiovascular. Establecer la prevalencia de hiperinsulinemia y resistencia a la insulina en este grupo de riesgo.
Material y métodos: Se estudiaron 46 pacientes de 16 a 68 años (9 mujeres y 37varones) con factores de riesgo cardiovascular (HTA, dislipemia, obesidad, hiperuricemia, insuficiencia coronaria o vascular, antecedentes familiares de diabetes, tolerancia alterada a la glucosa o glucosa alterada en ayunas) y un grupo control de 10 sujetos sanos sin factores de riesgo cardiovascular. Se efectuó prueba de tolerancia oral a la glucosa (PTOG) (75 g) con dosajes de glucosa e insulina (I) basales y 30,60 y 120 minutos post-estímulo. Se determinaron los niveles de colesterol total, colesterol HDL, colesterol LDL, triglicéridos y ácido úrico en muestras de sangre con ayuno de 12 hs. mediante Metrolab 2300 automatizado. La I fue determinada por IRMA (Inmunotech). Se calculó en cada caso el índice HOMA como medida de la resistencia a la insulina y el índice de masa corporal (IMC). Análisis estadístico: estudio de prevalencia, prueba de Wilcoxon para muestras independientes, prueba no paramétrica de Kruskal-Wallis y análisis discriminante lineal.
Resultados: La prueba de tolerancia oral a la glucosa (PTOG) en los pacientes del grupo de riesgo mostró aumento de los valores de glucosa y de la variabilidad de la respuesta respecto a los controles. La insulinemia basal fue normal en la mayoría de los pacientes con factores de riesgo cardiovascular, pero se halló una prevalencia de 98% (IC: 88,5 –99,9) de hiperinsulinemia en pacientes con factores de riesgo cardiovascular cuando se efectuó la prueba de tolerancia oral a la glucosa (PTOG). El 73% de los pacientes con hiperinsulinemia tuvieron prueba de tolerancia oral a la glucosa (PTOG) normal. La prueba de Kruskal-Wallis demostró diferencias significativas entre controles y pacientes con hiperinsulinemia cuando se analizaron los parámetros clínicos y de laboratorio. En cambio, en los sujetos con hiperinsulinemia con prueba de tolerancia oral a la glucosa (PTOG) normal o prueba de tolerancia oral a la glucosa (PTOG) alterada, la única variable que mostró diferencias significativas entre ambos grupos fue la insulinemia a los 30 minutos post-estímulo. El HOMA fue menor para el grupo control y considerando el valor del percentilo 90, (1,35) de su distribución, se observó que la proporción de casos por debajo de este valor fue 8% para el grupo con resistencia a la insulina y prueba de tolerancia oral a la glucosa (PTOG) alterada y de 14% para los pacientes con resistencia a la insulina y prueba de tolerancia oral a la glucosa (PTOG) normal. Según el análisis discriminante lineal, la edad y el colesterol LDL fueron las únicas variables que permitieron separar los pacientes con resistencia a la insulina y prueba de tolerancia oral a la glucosa (PTOG) normal de aquellos con resistencia a la insulina y prueba de tolerancia oral a la glucosa (PTOG) alterada.
Conclusión: El HOMA puede ser útil en el estudio de resistencia a la insulina dado su bajo costo. La prevalencia de hiperinsulinemia fue elevada en el grupo de riesgo, pero la prueba de tolerancia oral a la glucosa (PTOG) demostró baja sensibilidad para identificar estos pacientes cuando se valoró solamente la glucosa. De acuerdo a nuestros resultados, sería importante realizar el dosaje de I durante la prueba de tolerancia oral a la glucosa (PTOG) en pacientes con elevada prevalencia de factores de riesgo cardiovascular a fin de detectar anormalidades en la secreción de I y evitar la evolución a la diabetes.
Introducción
El síndrome X o polimetabólico, constituye un estadio previo en el desarrollo de la Diabetes Mellitus Tipo 2 (DM 2).
Se caracteriza por diversos grados de intolerancia a la glucosa (IG), hipertensión arterial (HTA) y dislipemia (DL). El estado de insulinorresistencia (IR) e hiperinsulinemia (HI) compensatoria resultante, son considerados principales responsables de su patogenia. Cuando el páncreas es incapaz de sostener crónicamente la situación de hiperinsulinemia compensatoria, comienzan a manifestarse diferentes grados de intolerancia a los hidratos de carbono, cuya expresión máxima es la Diabetes Mellitus Tipo 2. (1, 2, 31, 32, 37, 45).
La Diabetes Mellitus Tipo 2 constituye la forma más frecuente de diabetes, ya que representa más del 90% de la diabetes en los países occidentales o industrializados. La importancia fundamental de la Diabetes Mellitus Tipo 2 para la salud pública reside en que es un trastorno crónico asociado con el desarrollo de complicaciones microvasculares específicas, tales como retinopatía, nefropatía y neuropatía, así como una incidencia más alta de las enfermedades macrovasculares, incluyendo cardiopatía coronaria, enfermedad vascular periférica y afecciones cerebrovasculares.
Estas complicaciones dan lugar a un grado de morbilidad mayor que el hallado entre los no diabéticos de la misma edad y sexo. También se hallan tasas de mortalidad excesivas. Las tasas de mortalidad específicas de la edad entre sujetos con Diabetes Mellitus Tipo 2 aproximadamente duplican los de los no diabéticos.
Al producirse complicaciones vasculares, aumenta la pérdida de empleo y la incapacidad, así como los costos de atención sanitaria. (1 – 12, 17, 19, 22, 23, 26, 28, 29, 36, 51).
La epidemiología de la Diabetes Mellitus Tipo 2 comprende varios aspectos. Existe una prevalencia étnica subrayando la importancia de la influencia genética. También se ve muy afectada su prevalencia por el estilo de vida. La vida occidental, caracterizada por una dieta hipercalórica, con alimentos refinados, pobres en fibras, y con gran cantidad de azúcares, junto con una actividad física reducida o nula, es particularmente diabetógena.
La frecuencia de Diabetes Mellitus Tipo 2, aumenta con la edad; siendo mayor a partir de los 50 años. En niños y adolescentes es baja, incluyendo la variante de inicio precoz conocida como MODY, que tiene una herencia autosómica dominante y que habitualmente se presenta en individuos menores de 25 años. Estudios recientes revelan la aparición de Diabetes Mellitus Tipo 2 en niños, como un fenómeno que está surgiendo en todo el mundo occidental, desencadenando una epidemia, producto de la vida moderna. El factor genético es importante, pero el disparador es el aumento de la obesidad. (1, 2, 9, 12, 20, 23, 24, 29, 34, 39, 40).
Esta enfermedad presenta algunas características particulares. En primer término la mitad de los enfermos que la padecen desconocen el diagnóstico por un período prolongado de tiempo. Por otro lado, la existencia de un progresivo deterioro de la secreción de insulina lleva a estos pacientes a la intolerancia a la glucosa en primera instancia y diabetes franca posteriormente.
La insulinorresistencia, es un hallazgo temprano en los pacientes obesos como en los diabéticos tipo 2 con normopeso. Así, la resistencia a la insulina por sí sola no es suficiente en la mayoría de los casos para causar resistencia a la glucosa, sino que es clave el desarrollo de la alteración en la secreción de insulina para progresar a la intolerancia a la glucosa y a la Diabetes Mellitus Tipo 2 posteriormente. (1-4, 32, 37, 38, 47, 48, 50).
La Diabetes Mellitus Tipo 2 está caracterizada por una interacción compleja entre una secreción de insulina afectada y una sensibilidad decreciente a la insulina.
En el estado post-prandial normal, un abrupto incremento de la glucosa produce un rápido y transitorio pico de secreción de insulina, conocido como pico precoz, que disminuye a los 10 minutos, seguido de un segundo pico que dura tanto como el estímulo de glucosa. (2,5)
En la Diabetes Mellitus Tipo 2, aparece en primer término un defecto en esta fase temprana de secreción, que se observa incluso antes de que se produzca la hiperglucemia. Esta anormalidad en la secreción de insulina es importante, ya que la dinámica de la secreción de insulina tiene un efecto tan grande en el metabolismo de glucosa como la cantidad real total de insulina emitida. Una de las primeras consecuencias de la pérdida del pico precoz es la inhibición incompleta de la secreción de glucagón y de la lipólisis. Se ha demostrado que la pérdida del pico temprano de secreción de insulina da por resultado un incremento notable en la producción hepática de glucosa y contribuye de manera considerable a la hiperglucemia en la Diabetes Mellitus Tipo 2. (2,5)
El hígado y el músculo son los principales tejidos sensibles a la insulina que aseguran el mantenimiento de la homeostasis normal de glucosa. Los defectos en la acción de la insulina afectan la supresión de la producción hepática de glucosa y estimulan su absorción periférica en respuesta a un incremento fisiológico de la insulina. La capacidad de los tejidos periféricos para aumentar la absorción de glucosa en respuesta a un incremento fisiológico en el nivel de insulina, varía por lo menos cinco veces, aún en sujetos no diabéticos. Una disminución en la sensibilidad de los tejidos periféricos a la insulina, es otro factor fundamental que contribuye al estado de intolerancia a la glucosa que se observa en la Diabetes Mellitus Tipo 2 (3,5).
Objetivos
1) Estudiar la insulinorresistencia mediante la prueba de tolerancia oral a la glucosa (PTOG) y evaluar la relación entre concentraciones de insulina basal y post-estímulo, en pacientes con hiperinsulinemia recién diagnosticada y los factores de riesgo cardiovascular.
2) Demostrar la necesidad de realizar la prueba de tolerancia oral a la glucosa (PTOG), con dosaje de insulina en pacientes de riesgo, ya que las anormalidades en la secreción de la insulina son previas a las de glucosa. (7, 8, 10, 12, 26, 32, 37, 38, 41, 44, 46, 50).
3) Estimar la prevalencia de hiperinsulinemia y/o insulinorresistencia en el grupo de riesgo y evaluar, en aquellos pacientes que resultaran hiperinsulinémicos, su respuesta a la prueba de tolerancia a la glucosa.
4) Señalar la importancia del HOMA desde el punto de vista epidemiológico como también su utilidad para establecer la eficacia de un tratamiento y la ventaja por su bajo costo.(55,62).
Materiales y Métodos
En este informe se analizaron los datos correspondientes al resultado de pruebas de tolerancia a la glucosa e insulinemia en individuos con factores de riesgo cardiovascular. Asimismo este grupo de individuos se caracterizó por su perfil metabólico y medidas antropométricas.
Se estudiaron 46 pacientes con algunas de las situaciones clínicas que se asocian a la insulinorresistencia: hipertensión arterial (HTA), dislipemia (DL), obesidad, antecedentes familiares, etc, con edades comprendidas entre los 16 y 68 años, 9 mujeres y 37 varones.
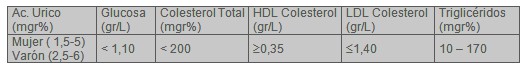
A todos los individuos se les realizó un examen clínico completo y análisis de laboratorio: glucosa, colesterol total, HDL colesterol, LDL colesterol, triglicéridos y ácido úrico, obteniéndose muestras de sangre en ayunas y después de 12 horas de la última comida, procesando las mismas en forma automatizada, METROLAB 2300.
Se efectuó una prueba de tolerancia oral a la glucosa (PTOG), utilizando una dosis única de 75 gramos de glucosa independientemente de la edad y el peso, diluida con 150 a 200 ml de agua en un tiempo de ingesta no mayor a los 5 minutos. Se midieron los niveles de glucemia e insulinemia en ayunas (muestra Basal) y post-estímulo a los 30,60 y 120 minutos.
Las insulinas fueron determinadas por método inmunorradiométrico (IRMA) INMUNOTECH, que utiliza anticuerpos monoclonales de ratón contra dos epitopes diferentes de Insulina humana.
Además de los dosajes, se determinó a cada individuo el HOMA, índice que relaciona la insulina y glucosa basal de la siguiente forma. (53, 62).
Insulina= uUI/ml
Glucosa = mmol/l
Se utilizó la prueba de Wilcoxon de comparación de distribuciones de glucemias en un grupo control y otro con factores de riesgo cardiovascular. Se compararon mediante la prueba no paramétrica de Kruskal-Wallis tres grupos: los hiperinsulinémicos PTOG (-), los hiperinsulinémicos PTOG (+) y los controles. Las variables analizadas fueron edad, índice de masa corporal (IMC), tensión arterial sistólica (TAS), tensión arterial diastólica (TAD), glucosa basal 30, 60, 120 minutos, colesterol total, HDL, LDL colesterol, triglicéridos, ácido úrico, insulina basal, 30, 60, 120 minutos, y HOMA. Se realizó análisis discriminante lineal que incluyendo las variables edad, BMI, col, HDL col, LDL col y triglicéridos.
Criterios de Inclusión (13, 14, 16, 21, 42, 43, 47-50)
· Antecedentes familiares de Diabetes.
· Edad mayor a 45 años con la salvedad de no descartar Diabetes Mellitus Tipo 2 en jóvenes e infancia, lo que llevó al rango de edades descripto en materiales y métodos.
· Identificación previa de tolerancia alterada a la glucosa o glucosa en ayunas alterada de acuerdo a la siguiente tabla: criterio según la Organización Mundial de la Salud (OMS).
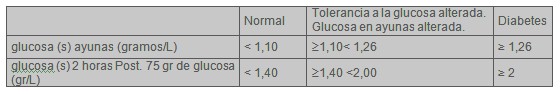
Tabla 1: Criterio según OMS
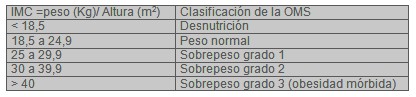
· Sobrepeso u obesidad según clasificación de la OMS. Tabla 2. El factor de riesgo más alto es para un índice de masa corporal (IMC) mayor o igual a 27.
Tabla 2.
· Anomalías metabólicas: hipertrigliceridemia, hiperlipoproteinemia mixta, dislipemia, hiperuricemia. Mayor riesgo para HDL colesterol ≤ 0,35 mg/dl y Triglicéridos ≥ 250 mg/dl.
· Infecciones repetidas en particular infección de piel o de la mucosa.
· Mujeres que dieron a luz a niños a término con peso mayor de 4 Kgr.
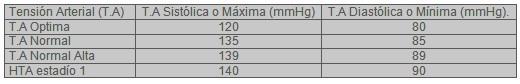
· Hipertensión Arterial. Según el siguiente criterio de la OMS y recomendaciones de la American Diabetes Association (ADA) Tabla 3.
· Insuficiencia coronaria.
· Insuficiencia vascular.
Criterio Diagnóstico: (13,14,16,21,42,43,45-50)
Se emplearon para todas las evaluaciones los valores de referencia de la técnica utilizada.
El diagnóstico de Diabetes Mellitus Tipo 2 se realizó en base a una glucosa elevada en ayunas en dos oportunidades separadas, según criterio de la OMS.
Glucosa ayunas ≥ a 1,26 gramos/L
En presencia de una glucemia en ayunas normal, el diagnóstico se efectuó en base a una prueba de tolerancia oral a la glucosa (PTOG) alterada. Tabla 1.
Los valores de referencia para los dosajes de insulina basal a los 30, 60 y 120 minutos post ingesta de 75 gramos de glucosa que se aplicaron fueron los de la técnica utilizada.
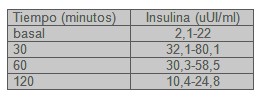
Grupo Control
El grupo control incluyó a 10 sujetos sanos sin factores de riesgo cardiovascular, independientemente de edad y sexo y con valores normales de índice de masa corporal (IMC), tensión arterial, colesterol total, HDL colesterol, LDL colesterol, triglicéridos, ácido úrico y prueba de tolerancia oral a la glucosa (PTOG) con dosaje de glucosa e Insulina basal, 30, 60, 120 min., según los valores de referencia de las técnicas utilizadas y usando el criterio de la ADA, para descartar mayor probabilidad de desarrollo de Diabetes Mellitus Tipo 2.(13).
Resultados
Prevalencia de Insulinorresistencia en el grupo de riesgo
El análisis del perfil de insulinemia hasta los 120 min, permitió establecer que sólo 1 de los 46 casos examinados, presentaba un perfil de insulinemia compatible con la normalidad. Esto representa una prevalencia del 98% de hiperinsulinemia en este grupo con un intervalo de confianza al 95 que va del 88,5 al 99,9%. Con idénticos criterios clínicos, ninguno de los casos control presentó un perfil de insulinemia fuera de los patrones normales.
Prueba de tolerancia a la glucosa en los 45 individuos Insulinorresistentes
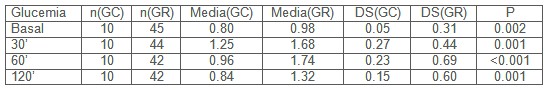
El objetivo de este análisis, es evaluar si la prueba de tolerancia a la glucosa es un criterio suficiente para identificar al grupo hiperinsulinémico en el grupo de riesgo, evaluando este criterio conjuntamente con el grupo control. La Tabla 1 presenta los valores medios, desviaciones típicas y el resultado de la prueba Wilcoxon para muestras independientes, mediante la cual, se comparan las distribuciones de glucemia basal, a los 30, 60 y 120 minutos entre el grupo de riesgo (GR) el grupo control (GC). En todos los casos se muestra que las distribuciones de glucemia están alteradas, con cambios no solo en sus valores medios, que se encuentran elevados, sino también con un aumento de variabilidad de la respuesta en el grupo de riesgo.
Tabla 1: Valores medios, desviaciones estándar y valor p para la prueba de Wilcoxon de comparación de distribuciones de glucemias en un grupo control y otro con factores de riesgo cardiovascular.
La Figura 1, presenta los perfiles medios en el grupo de riesgo y en el grupo control para la glucemia. Claramente, el perfil medio del grupo de riesgo se muestra aumentado con respecto al control. Esto implica que hay una buena chance de detectar anormalidades en este perfil. La pregunta es ¿cuántos individuos serían declarados normales, aun cuando en promedio el perfil está elevado?
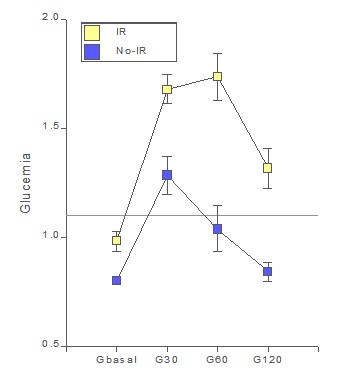
Figura 1: Perfiles promedio ± error estándar de glucemia en individuos insulinorresistentes y no insulinorresistentes.
Teniendo en cuenta los valores de corte para la glucemia Basal y 120’ post 75gr de glucosa, se reclasificaron los pacientes del grupo de riesgo insulinorresistente como normales, con tolerancia alterada a la glucosa y como diabéticos. El resultado de esta clasificación se muestra en las Tabla 2 y 3.
Tabla 2: Frecuencias absolutas según respuesta a la prueba de tolerancia oral a la glucosa (PTOG).
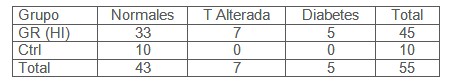
Tabla 3: Frecuencias relativas por grupo (expresadas en porcentajes) según respuesta a la prueba de tolerancia oral a la glucosa (PTOG).
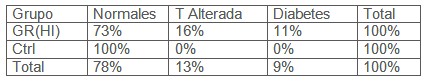
Como puede observarse en la Tabla 3, un 73% individuos del grupo de riesgo con perfil de insulinemia alterado presenta valores normales a la prueba de tolerancia la glucosa. Con un intervalo de confianza al 95%, este porcentaje es como mínimo del 58% y como máximo del 85%. Luego, al menos casi un 60% de los individuos con factores de riesgo cardiovascular e hiperinsulinemia, presentarán una prueba de tolerancia a la glucosa normal. Por otra parte, ninguno de los casos control fue clasificado con tolerancia alterada o diabético. Estos resultados implican que la prueba de tolerancia a la glucosa, aunque específica, tiene baja sensibilidad para detectar alteraciones de la insulinemia.
¿Qué características diferencian a los individuos que resultaron normales a la prueba de tolerancia a la glucosa respecto de los que no lo hicieron?
Comparación de hiperinsulinémicos TPOG (-), TPOG (+) y Controles
Se compararon mediante la prueba no paramétrica de Kruskal-Wallis tres grupos: los hiperinsulinémicos PTOG (-), los hiperinsulinémicos PTOG (+) y los Controles que, en todo los casos, resultaron PTOG (-). Las variables analizadas fueron Edad, BMI, tensión arterial sistólica, tensión arterial diastólica, Glucosa basal, G30, G60, G120, COL, HDL, LDL, triglicéridos, AU, IB, I30, I60, I120, HOMA. En todos los casos hubo diferencias entre los controles sanos e hiperinsulinémicos, pero no entre hiperinsulinémicos PTOG (+) y PTOG (-), excepto para la variable Insulinemia 30’. En este caso los hiperinsulinémicos PTOG (+) tu-vieron valores medios menores que los PTOG (-) (Figura 2). Estos resultados estarían indicando que, al menos con la evaluación de los metabolitos convencionales toma-dos uno a uno, no es posible predecir la hiperinsulinemia en una gran fracción de los pacientes con factores de riesgo cardiovascular.
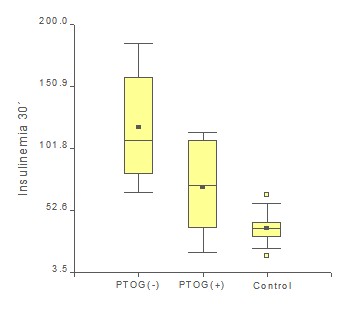
Figura 2: Box plot mostrando la distribución de insulinemia a los 30 minutos en hiperinsulinémicos PTOG (+), PTOG (-) y un control sano.
Lo que sigue es un intento de buscar, dentro del conjunto de variables metabólicas y antropométricas disponibles excepto la glucemia y la insulinemia, combinaciones de aquellas que tengan valor diferenciador de estos grupos clínicos.
Se analizó el índice HOMA, que relaciona la glucemia basal con la insulinemia basal como potencial indicador útil para el seguimiento de tratamientos. La Figura 3, presenta los diagramas de caja (box-plot) para HOMA, en los grupos con insulinorresistencia PTOG (+), PTOG (-) y Controles sanos. Tomando como criterio de corte para HOMA, el percentil 90% de su distribución en el grupo control (1,35 - marcado en la figura), la proporción de casos por debajo de él, es del 8% en el grupo con insulinorresistencia PTOG (+) y del 14% de los insulinorresistentes PTOG (-).
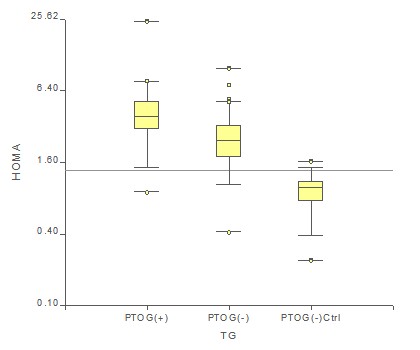
Figura 3: Box plot mostrando la distribución de HOMA en hiperinsulinémicos PTOG (+), PTOG (-) y un control sano.
Análisis discriminante
Un análisis discriminante lineal que incluyó las variables Edad, BMI, COL, HDL, LDL y TRIG, mostró que las variables más importantes en la separación de PTOG (+) y PTOG (-) dentro de los Insulinorresistentes son la edad y LDL. Así, individuos jóvenes (<48a) y/o con LDL alto (>1.62), tienden a mostrar pruebas de tolerancia a la glucosa negativas más frecuentemente que aquellos individuos mayores con bajos niveles de LDL (Figura 4).
En consecuencia, individuos jóvenes con factores de riesgo cardiovascular que muestren pruebas de tolerancia a la glucosa normales acompañadas de valores altos de LDL, podrían estar enmascarando una insulinorresistencia. Es interesante indicar que los dos casos PTOG (+) menores de 48 años, son los que presentan mayor BMI dentro de ese grupo.
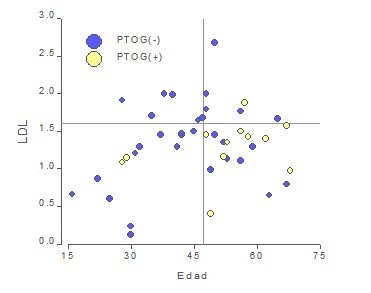
Figura 4: Diagrama de dispersión de LDL vs Edad mostrando los casos hiperinsulinémicos PTOG (+) y PTOG (-).
Discusión
De acuerdo a los datos analizados se desprende la importancia de realizar la prueba de tolerancia oral a la glucosa (PTOG), con dosaje de glucosa e insulina en cada uno de los puntos de la misma a todos aquellos individuos con elevada prevalencia de factores de riesgo cardiovascular, dado que las anormalidades en la secreción de insulina son previas a la de glucosa y es en este momento donde el cuadro es totalmente reversible, con tratamiento apropiado, normalizando precozmente los parámetros alterados evitando su evolución hacia la diabetes de curso irreversible.
El valor de la insulinemia basal, fue normal en la mayoría de los casos, por lo que carece de valor diagnóstico, a menos que se lo relacione con la glucosa basal por medio del HOMA, siendo este importante desde el punto de vista epidemiológico, ya que permite clasificar poblaciones con determinadas características. Dicha clasificación se hace sacando un porcentaje de insulinorresistencia respeto a una población testigo normal. El HOMA mejora o empeora después de una terapéutica determinada. También tiene la ventaja de su bajo costo (53).
Dado que un 73% de individuos del grupo de riesgo con perfil de insulinemia alterada, presenta valores normales a la Prueba de Tolerancia Oral a la Glucosa, podríamos decir que la prueba de tolerancia oral a la glucosa (PTOG), aunque específica, tiene baja sensibilidad para detectar alteraciones de la insulinemia si dosamos exclusivamente glucosa en cada uno de los puntos. Según el análisis discriminante lineal, las variables más importantes en la separación de PTOG (+) y PTOG (-) dentro de los pacientes con hiperinsulinemia y/o insulinorresistencia, son la edad y LDL colesterol. En consecuencia individuos jóvenes con factores de riesgo cardiovascular que muestren prueba de tolerancia oral a la glucosa (PTOG) normales acompañadas de valores altos de LDL colesterol, podrían estar enmascarando una hiperinsulinemia y/o insulinorresistencia.
De acuerdo a la comparación entre hiperinsulinemia y/o insulinorresistencia, PTOG (+), PTOG (-) y controles y analizando las variables edad, índice de masa corporal (IMC), tensión arterial sistólica, tensión arterial diastólica, Glucosa basal, 30, 60, y 120 min., colesterol total, HDL Y LDL colesterol, triglicéridos, Ac. Úrico, Insulina basal, 30, 60, y 120 min., y HOMA. Hubo diferencias significativas entre controles sanos y los resistentes a la insulina, pero no entre hiperinsulinemia y/o insulinorresistencia, PTOG (+) y PTOG (-), excepto para la variable 30 min., en los pacientes con hiperinsulinemia y/o insulinorresistencia, PTOG (+) diferenciándose de los PTOG (-), con valores medios mayores. Esto podría indicar que los individuos con hiperinsulinemia y/o insulinorresistencia con PTOG (+) tendrían peor pronóstico, por estar en una fase de descenso de la insulina.
La prevalencia de factores de riesgo cardiovascular en los pacientes con hiperinsulinemia y/o insulinorresistencia, se correlaciona con los hallados por otros autores para el síndrome polimetabólico y diabetes mellitus tipo 2.
Conclusiones
Según los datos estadísticos y la elevada prevalencia de Insulinorresistencia y/o Hiperinsulinemia en el grupo de riesgo, se hace indispensable la caracterización de estos individuos realizando una prevención primaria de la diabetes en ciertas situaciones:
· Antecedentes familiares de diabetes mellitus tipo 2
· Sobrepeso: índice de masa corporal (IMC) ³ 27
· Anomalías metabólicas
· Hipertrigliceridemia: ³ 250 miligramos %
· Hipercolesterolemia: ³ 200 miligramos %
· Hiperlipoproteinemia mixta: colesterol HDL £ 0,35 gramos/l, colesterol LDL ³ 1,40 gramos/l
· Infecciones repetidas (en particular, infección de la piel o de la mucosa)
· Mujeres que dieron a luz niños a término con peso mayor de 4 Kg.
· Hipertensión: tensión arterial sistólica=140 mmHg, tensión arterial diastólica= 90 mmHg
· Edad > 45 años
El inicio silente de la Diabetes Mellitus Tipo 2, hace que las complicaciones específicas, por ejemplo, la retinopatía y nefropatía, ya estén presentes en el 10 a 15% de los pacientes en el momento del diagnóstico. Es muy importante tomar el fenómeno de Insulinorresistencia como blanco para la acción clínica en la atención primaria.
Esto podría lograrse con:
· Caracterización de individuos con alto riesgo.
· Realizando en primera instancia una glucemia e insulinemia basal y relacionando las mismas con el HOMA, para ubicar al paciente epidemiológicamente.
· En caso de epidemiología positiva, efectuar la prueba de tolerancia oral a la glucosa (PTOG) con dosaje de glucosa e insulina, ya que la glucemia, aunque específica, tiene baja sensibilidad para detectar alteraciones de la insulinemia, y estas son previas a la de glucosa.
· Si el paciente es resistente a la insulina y/o hiperinsulinémico, escoger el tratamiento apropiado, a fin de darle las mejores posibilidades de normalizar precozmente los parámetros alterados y evitar la evolución hacia la diabetes, donde el cuadro es irreversible.
· Una vez seleccionado el tratamiento, utilizar el HOMA para el seguimiento, el cual puede empeorar o mejorar, mostrándonos la efectividad o no de la terapéutica.
· Evaluar correctamente desde el punto de vista bioquímico, a pacientes con factores de riesgo cardiovascular y susceptibles de desarrollar Diabetes Mellitus Tipo 2, debe preocupar a médicos y bioquímicos para tratar de encontrar, el marcador que indique precozmente, con mayor exactitud, los inicios de esta enfermedad, ya que los enfermos desconocen el diagnóstico por un período prolongado de tiempo (9 a 12 años)
Glosario
DM 2= Diabetes Mellitus Tipo 2
IR= Insulinorresistencia
HI= Hiperinsulinemia
IG= Intolerancia a la glucosa
HTA= Hipertensión arterial
DL= Dislipemia
RER= Retículo endoplásmico rugoso
GLUT= Transportador específico de glucosa
EGF= Factor de crecimiento epidérmico
PDGF= Factor de crecimiento derivado de las plaquetas
IRS 1= Sustrato del receptor de insulina
IGF 1= Factor de crecimiento insulinosímil
PI 3= Fosfoinositol 3 quinasa
NGF= Factor de crecimiento neural
MSA= Factor de crecimiento estimulante de la multiplicación
PAI 1= Inhibidor del activador del plasminógeno
OB-AV= Obesidad abdominovisceral
HHA= Hipotálamo hipófiso-adrenal
AGL= Ácidos grasos libres
TNF alfa= Factor de necrosis tumoral alfa
IMC= Índice de masa corporal
NPY= Neuropéptido Y
MSH= Hormona melanocito estimulante
GH= Somatotrofina
IGF BP 1= Proteína transportadora de IGF 1
SHBG= Proteína transportadora de esteroides sexuales
LH= Hormona luteinizante
AGNE= Ácidos grasos no esterificados
Bibliografía
1. Litwak, L. y col. Síndrome Polimetabólico. Una Situación frecuente en la práctica diaria. RAEM. 1996, Vol. 33, N0 1: 4-18.
2. Pierre – Jean Guillausseau. Diabetes Tipo II: Una Actualización. Groupe de Recherche.Servier.1999.
3. Frechtel, G.D. Bases Fisiopatológicas y Moleculares de la diabetes tipo II. Seporata 1998. Química Montpellier S.A.
4. Ellenberg, M. et al. Diabetes Mellitus. Theory and Practice, Third Edition 1996. Pag. 1 – 96.
5. Lastreto, B. Mereshian, P. Páncreas. Endocrino. Fisiología Humana, tomo 1. Primera Edición 1998. Pag. 263 – 287.
6. Kannel, W.B. La tensión arterial como factor de riesgo cardiovascular. Prevención y tratamiento. JAMA (ed. Arg.), vol. 6 No 2. 1997.
7. Reaven, G.M et al. Hipertensión y Anomalías Metabólicas Asociadas. El Rol de la Resistencia a la Insulina y el Sistema Simpático – Suprarrenal. The New England Journal of Medicine. Vol. 334 No 6, 1996.
8. Kannel, W.B et al. Diabetes and Cardiovascular. Risk Factors: The Framingham Study. Circulation, Vol 59, N0 1, 1997.
9. Fuller, J.H. Hipertension and Diabetes. Epidemiologie Aspects as a Guide to Management. Journal of Cardiovascular Pharmacology. Vol 21 (Suppl. 2) 1993.
10. Kannel, W>B. et al. The Epidemiology of Imparied glucose Tolerance and hipertension. American Heart Journal, Vol 121, N0 4, Part. 2, 1991.
11. Stamler, J. et al. Diabetes, Other Risk Factors, and 12 –Yr. Cardiovascular Mortality for Men Screened in the Multiple Risk Factor Intervention Trial. Diabetes Care. Vol 16, No 2, 1993.
12. Ferrannini, E. et al. Insulin Resístanse In Essential Hipertension. The New England journal of Medicine Vol 317, No 6, 1997.
13. Screening for Type 2 Diabetes. Diabetes Care, vol 23, suppl. 1, 2000.
14. Report of the Expert Committee on the Diagnosis and Classification of D.M. Diabetes Care, Vol. 23, Suppl. 1, 2000.
15. Smoking and Diabetes. Diabetes Care, Vol. 23, No 1, 2000.
16. Shaw, J.E. et al. Impared Fasting Glucose: How Low Should It go?. Diabetes Care, Vol. 23, No 1. 2000.
17. Vegt, F. Et al. Similar 9 year. Mortality Risks and Reproducibility for the World Health Organization and American Diabetes Association Glucose Tolerance. Categories. Diabetes Care, Vol 23, No 1, 2000.
18. Muggeo, M. et al Fasting Plasma Glucose Variability Predicts 10 Year Survival of Type 2. Diabetic Patients. Diabetes Care, Vol 23, No 1, 2000.
19. Mac Gregor, A. S. et al. Role of Systolic Blood Pressure and Plasma Triglycerides in Diabetic Peripheral Arterial Discase. Diebates Care, Vol 22, No 3, 1999.
20. Harris, M. I. Et al. Racial and Ethic Differences in Glicemic Control of Adults with Type 2 Diabetes. Diabetes Care, Vol 22, No 3, 1999.
21. Lindahl, B. et al. Screening for impaired Glucose Tolerance. Diabetes Care, Vol 22, No 12, 1999.
22. Yamamoto, M. et al. Impaired Diurnal Cardiac Autonomie Finction in Subjects with Type 2 Diabetes. Diabetes Care, Vol 22, No 12, 1999.
23. Rosenbloom, A.L. et al.Emerging Epidemie of Type 2. Diabetes Youth. Diabetes Care. Vol 22 No 2, 1999.
24. Doria, A. Et al. Phenotypie Characterictics of Early onset. Autosomal Dominant. Type 2 Diabetes Unlinked to Knows Maturity – Onset Diabetes of the young (MODY). Genes. Diabetes Care, Vol 22, No 2, 1999.
25. Wareham, N.J. et al. Fasting Proinsulin Concentrations Predict the development of Type 2. Diabetes. Diabetes Care, Vol 22, No 2, 1999.
26. Campagna, A.F. et al. HDl Colesterol Subfractions and Risk of Developing Type 2 Diabetes Among Pima Indians. Diabetes Care, Vol 22, No 2, 1999.
27. Suematsu, Ch. et al. Impaired Fasting Glucose and the risk of Hipertension japanese men between the 1980 s and the 1990 s. Diabetes Care, Vol 22, No 2, 1999.
28. Coutinho, M. et al. The Relationship between Glucose and Incident Cardiovascular Events. Diabetes Care, Vol 22, No 2, 1999.
29. Chee Eng Tan. Et al. Prevalence of Diabetes and Ethnic Differences Cardiovascular Risk Factors. Diabetes Care, Vol 22, No 2. 1999.
30. Naoyawatanabe. Et al. Elevated Remnant – Like Lipoprotein Particles In Impaired Glucose Tolerance and Type 2 Diabetic Patients. Diebetes Care, Vol 22, 1999.
31. Meneilly, G.S et al. Metabolic Alterations in Midde – Aged and Elderly Obese Patients with Type 2 Diabetes. Diabetes Care, Vol 22, No 1, 1999.
32. Kekalainen, P. et al. Hiperinsulinemia Cluster Predicts the Development of Type 2 Diabetes Independently of Family History of Diabetes. Diabetes Care, Vol 22, No 1, 1999.
33. Wollensen, F. Et al. Peripheral Atherosclerosis and Serum Lipoprotein ( ) in Diabetes. Diabetes Care, Vol 22, No 1, 1999.
34. Bruno, G. et al. Clinical, Inmunological, and Genetic Heterogenecity of Diabetes in Italian Population. Based Cohort of Lean. Newly Diagnosed Patients Aged 30 – 54 years. Diabetes Care, Vol 22, No 1, 1999.
35. Bjornholt, J. V. et al. Fasting Blood Glucose: Underestimated Risk Factor for Cardiovascular Death. Diabetes Care, Vol 22, No 1, 1999.
36. Vanzetto, G. at al. Predictions of Cardiovascular Events in Clinically Seleted High – Risk NIDDM Patients. Diabetes Care, Vol 22, No 1, 1999.
37. Haffner, S.M. et al. Insulin Sensivity in Subjects with Type 2 Diabetes. Diabetes Care, Vol 22, No 4, 1999.
38. Elbein, S.C. et al. Reduced B – Cell. Compensation to the Insulin Resistance Associated with Obesity in Members of Caucasion Familial Type 2 Diabetic Kindreds. Diabetes Care, Vol 23, No 2, 2000.
39. Hawa, M.I. et al. Antibodies to IA. 2 and GAD 65 in Type 1 and Type 2 Diabetes. Diabetes Care, Vol 23, No 2, 2000.
40. MOOY, J. M. et al. Major Stressful Life Events in Relation to Prevalence of Undetected Type 2 Diabetes. Diabetes Care, Vol 23, No 2, 2000.
41. Yeni – Komshian, H. et al. Relationship Between Several Surrogate Estimates of Insulin – Mediated Glucose Disposal in 490 Healthy Nondiabetic Volunteers. Diabetes Care, Vol 23, No 2, 2000.
42. American Diabetes Association. Standards of Medical Care for Patients with Diabetes Mellitus. Diabetes Care, Vol 23, Suppl. 1, 2000.
43. American Diabetes Association. Management of Dyslipidemia in adults with Diabetes. Diabetes Care, Vol 23, Suppl. 1, 2000.
44. Su – Chi – Li et al. Cardiovascular Risk Profile in Individual with Borderline Glicemia. Diabetes Care, Vol 23, No 3, 2000.
45. Foss, C. H. et al. Normal Blood Presure and Preserved Diurnal Variation in offspring of Type 2 Diabetic Characterized by Features of the Metabolic Sindrome. Diabetes Care, Vol 23, No 3, 2000.
46. Stumvoll, M. et al. Use of the Oral Glucose Tolerance Test to Assess Insulin Release and Insulin Sensitivity. Diabetes Care, Vol 23, No 3, 2000.
47. Revision Internacional Roche. Obesidad: Una Enfermedad no reconocida. Complicaciones y Manejo Actual. 1999.
48. Temple, R. Et al. Medición de la Secreción de Insulina en la diabetes de Tipo II, problemas y dificultades. Diabet. Med. 9:503 – 512. 1992.
49. Francesconi, M. et al. El paciente diabético con sobrepeso. Diabetoghaphia. Pub. Med. Internacional. Ed. 14. 1999.
50. Davies, M.J. et al. Diabetes y Secreción de Insulina. Diabet. Med. 1993. 10:305-312.
51. Giugliano, D. Et al. Diabetes y Complicaciones vasculares. Metabolism. 1993. 44:363-368.
52. Ferrannini, E. Insulin Resistance versus Insulin deficiency in Noninsulin – Dependent. Diabetes Mellitus: Problems and prospects. Endocrine Reviews 19 (4): 477 – 490. 1998
53. Scaglia, H. Resistencia a la Insulina Aspectos Bioquímicos y Moleculares. RAEM, 2000. Vol. 37. No 4
54. Sinay, I. Resistencia a la Insulina. Aspectos Clínicos. RAEM. 2000. Vol 37. No 4
55. Sinay, I. Resistencia a la Insulina. Diagnóstico. RAEM. 2000. Vol 37. No 4
56. Costa Gil, J.E. Resistencia a la Insulina. Tratamiento. RAEM. 2000. Vol 37. No 4
57. Kennedy, A. Et. Al. The Metabolic Significance of Leptin in Humans: Gender – Based Differences in Relationship to Adiposity, Insulin Sensitivity, and Energy Expenditure. Journal of Clinical Endocrinology and Metabolism. 1997
58. MC Neely, M.J. et. Al. Asociation Between Baseline Plasma Leptin Levels and Subsequent Development of Diabetes in Japanese Americans Diabetes Care 22:65 – 70, 1999.
59. Rossetti, L. Simposio. Obesidad. Forum, No 35. 1997.
60. Fox, C. Plasma leptin Concentrations in Pima Indians Living in Drastically Different Environments. Diabetes Care 22:413 – 417. 1999
61. Contreras. P Manual de Aspectos no reproductivos en Endocrinología Ginecológica – Insulinorresistencia en Endocrinología Ginecológica. Cap. 2 pág. 91.
62. Bonora, E Homeostasis Model Assessment. Closely Mirrors the glucose Clamp Technique in the Assessment of Insulin Sensitivyty.