Las estatinas son un grupo de fármacos usados para disminuir el colesterol en sus distintas formas, en pacientes que lo tienen elevado (hipercolesterolemia) y que presentan, por tanto, un mayor riesgo de sufrir episodios de patología cardiovascular.
Teniendo en cuenta que la patología cardiovascular es la principal causa de muerte en el mundo desarrollado, el conocimiento de este grupo farmacológico es fundamental para introducirse en la principal área de prevención de morbimortalidad, junto con la dedicada al cáncer.
Revisión farmacoclínica de las estatinas
Autor: Miguel Angel Ortiz Arjona
Médico de atención primaria.
Experto universitario en farmacovigilancia.
Concepto
Las estatinas son un grupo de fármacos usados para disminuir el colesterol en sus distintas formas, en pacientes que lo tienen elevado (hipercolesterolemia) y que presentan, por tanto, un mayor riesgo de sufrir episodios de patología cardiovascular.
Teniendo en cuenta que la patología cardiovascular es la principal causa de muerte en el mundo desarrollado, el conocimiento de este grupo farmacológico es fundamental para introducirse en la principal área de prevención de morbimortalidad, junto con la dedicada al cáncer.
Historia
El hallazgo de las estatinas es una de las manifestaciones que mejor define la moderna farmacología. Inicialmente se definió exactamente la diana terapéutica donde se deseaba actuar: la 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa, enzima involucrada en la síntesis del colesterol. Conocida la misma se inició la búsqueda de sustancias que cumplieran los requisitos exigidos para el bloqueo del receptor hasta que se lograron encontrar las primeras moléculas que se fueron perfeccionando hasta conseguir las actuales estatinas.
La mevastatina fue la primera estatina aislada de hongos, pero su eficacia para inhibir la HMGCoA reductasa estaba limitada por su toxicidad y fue pronto retirada del mercado.
Posteriormente, en 1979, Hoffman y col. aislaron la lovastatina. Se obtuvieron de los hongos Penicillium citrinus y Aspergillus terreus respectivamente. La pravastatina es un metabolito fúngico, aislado de cultivos de Nocardia autotrophica, mientras que la fluvastatina fue la primera estatina totalmente sintética. A partir de este momento se sintetizaron la simvastatina, a partir de un producto de la fermentación del Aspergillus terreus y todas las demás, manteniéndose la investigación en esta línea en el momento actual.
Componentes
Hasta el momento actual, las estatinas reconocidas por la FDA y la EUDRA son:
. Atorvastatina.
. Cerivastatina, retirada del mercado en el 2001 por el laboratorio fabricante (Bayer) debido a su asociación con efectos adversos serios.
. Fluvastatina.
. Lovastatina.
. Pitavastatina.
. Pravastatina.
. Simvastatina.
. Rosuvastatina.
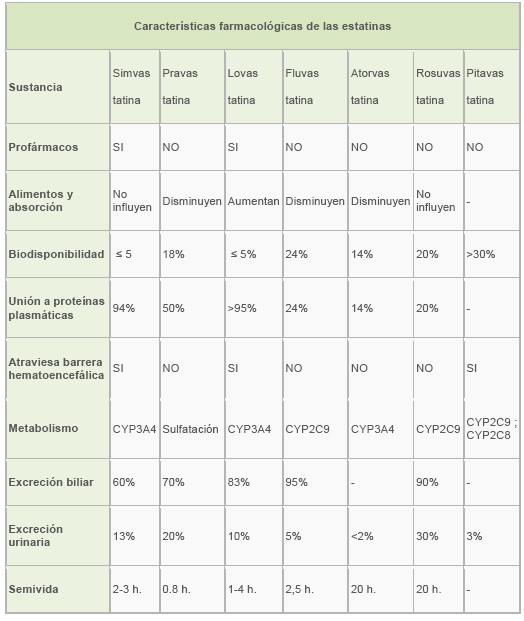
Farmacocinética
Vías de administración.
Hasta ahora todas las estatinas desarrolladas se utilizan por vía oral.
Absorción.
Se absorben por vía oral, en un margen variable desde el 30% de la lovastatina hasta el 35% de la pravastatina. Como norma general las estatinas disminuyen su absorción ante la presencia de alimentos en el estómago. No obstante, las modificaciones en las concentraciones máximas o en las respectivas curvas de asimilación, no tienen repercusión sobre los resultados finales en la modificación de los niveles de colesterol, por lo que en general se aconseja tomarlas a cualquier hora del día y en la mayoría de los casos con o sin alimentos. Igualmente, no parece haber acúmulo debido a dosis múltiples, por lo que es consenso general la toma en dosis única.
Las recomendaciones que se hacen de no tomar zumo de pomelo mientras se está en tratamiento con las estatinas es debido a interferencia en el metabolismo, no a alteraciones de la absorción. 1
En general, la biodisponibilidad de las estatinas es escasa, oscilando entre un 5% de la lovastatina y un 17% de la pravastatina. 2
Distribución.
La unión a proteínas plasmáticas es variable, pero en líneas generales muy elevada. Salvo el 50% de la pravastatina todas están por encima del 95%. La distribución tisular es amplia, atravesando barrera hematoencefálica y placentaria, pasando incluso a leche en mujeres lactantes. 2
La especificidad hepática de estos fármacos está determinada por su grado de lipofilicidad y por la presencia de unas proteínas transportadoras de aniones orgánicos que permiten que las estatinas más hidrofílicas, como pravastatina y rosuvastatina, entren en el hepatocito. 3 Por otra parte, algunas estatinas pueden inhibir la glucoproteína-p (multidrug resistanse protein), una proteína transportadora de muchos fármacos en la célula, por lo que podrían predisponer a interacciones farmacológicas. 4
Metabolismo y metabolitos.
El metabolismo es hepático, sufriendo efecto primer paso. En la mayoría, existen diferencias en la metabolización respecto al sexo y la edad, pero no las suficientes como para modificar las dosis en ausencia de otras patologías. Parece claro que son sustratos del CYP450: la lovastatina, la simvastatina y la atorvastatina se metabolizan exclusivamente por el CYP3A4, y la fluvastatina lo hace de manera exclusiva por el 2C9. En el caso de la rosuvastatina, sólo un 10% utiliza el CYP2C9 y 2C19. La pitavastatina tiene una baja afinidad por el CYP2C9, por lo que no representa una importante vía de metabolización. La pravastatina no se metaboliza por la vía del citocromo, sino que lo hace a través de unas enzimas presentes en el citoplasma del hepatocito. 4
Los metabolitos pueden ser derivados hidroxilados, omega o beta-oxidados, metilados o glucuronizados. La actividad farmacológica de los mismos es muy variable. Así, desde la lovastatina o simvastatina que son realmente unas lactonas inactivas farmacológicamente y que realizan su actividad farmacológica a través de sus metabolitos, hasta la fluvastatina, que tiene metabolitos prácticamente inactivos, el rango es amplio.2
Excreción.
En su mayor parte la excreción es por heces, debido a su poca absorción. Según la estatinas tiene desde un 2% a un 20% de excreción renal.
A modo de resumen podemos apreciar en la siguiente tabla las diferencias y similitudes entre las estatinas:
Farmacodinámica
Mecanismo de acción.
Las estatinas son inhibidoras de la 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa. Esta enzima cataliza la conversión de la HMG-CoA a mevalonato, que es un metabolito clave en la biosíntesis de colesterol. Su bloqueo se produce debido al gran parecido estructural que exhiben estos fármacos con el HMG-CoA. La afinidad de las estatinas por la enzima de 1.000 a 10.000 veces la del sustrato natural. La reacción concreta sería:
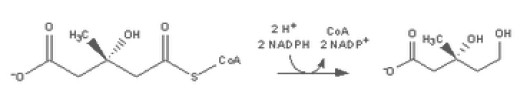
En la que una molécula de HMG-CoA se reduce mediante la actuación de la HMG-CoA reductasa y la coenzima NADPH dando como resultado Mevalonato y CoA. La inhibición de las estatinas se realiza de forma competitiva, parcial y reversible.
El bloqueo de la síntesis hepática del colesterol produce una activación de las proteínas reguladoras SREBP (sterol regulatory elements-binding proteins), que activan la transcripción de proteínas y, por tanto, producen una mayor expresión del gen del receptor de LDL y un aumento en la cantidad de receptores funcionales en el hepatocito. 5
Por otra parte, se ha demostrado que las estatinas también producen la inhibición del antígeno 1 asociado con la función de los linfocitos (LFA-1: lymphocyte function-associated antigen-1). 6 La LFA-1 es una glucoproteína de la familia de las integrinas expresada por la superficie de los leucocitos. Cuando la LFA-1 es activada por determinados receptores, se une a la molécula de adhesión intracelular-1 (ICAM-1 o CD 54) y estimula la extravasación de los leucocitos y la activación de los linfocitos T.
Esto significa que la LFA-1 es un agente proinflamatorio y que su inhibición es beneficiosa en procesos como la artritis reumatoidea y el rechazo de homoinjertos. Se demostró que las estatinas y, en especial, la lovastatina, se unen a un sitio del dominio de LFA-1, actualmente designado sitio de lovastatina. Este es el mecanismo molecular mediante el cual la lovastatina, la simvastatina y, en menor grado otras estatinas, inhiben la LFA-1. 7 Se trataría de uno de los mecanismos antiinflamatorios y, por ende, antiaterogénicos que poseen las estatinas.
Efectos
Como consecuencia de la inhibición de la HMG-CoA disminuyen los niveles de colesterol total y LDL, sustancias íntimamente relacionadas con la aterosclerosis y el aumento del riesgo cardiovascular. La apolipoproteína B también disminuye sustancialmente durante el tratamiento con estatinas. Además, algunas estatinas aumentan moderadamente el C-HDL y reducen los triglicéridos plasmáticos. Como resultado de estos cambios, el cociente entre Colesterol total y Colesterol HDL, así como el cociente entre Colesterol LDL y Colesterol HDL se reducen. 1
Aparte de sus efectos sobre el perfil lipídico, las estatinas tienen otros efectos cardiovasculares beneficiosos, especialmente sobre la pared arterial, conocidos como efectos pleiotrópicos y que explicarían el beneficio adicional no atribuible a la reducción del cLDL observado en muchos estudios de intervención. 8 Al inhibir la HMG-CoA reductasa, las estatinas interfieren en la formación de isoprenoides a partir del mevalonato. 9
Los isoprenoides son moléculas, como el farnesilpirofosfato (FPP) y el geranilgeranilpirofosfato (GGPP), derivadas del metabolismo del mevalonato, que sirven como etiquetas lipídicas para la modificación postraduccional de una gran variedad de proteínas, incluyendo la subunidad gamma de las proteínas G y las proteínas pequeñas unidoras de GTP. Como consecuencia de esto, la prenilación de las proteínas G (Rho, Rac, Rac1, Rab y Ras) se reduce. La prenilación de estas moléculas es necesaria para su anclaje a la membrana celular y, así, poder ejercer su mecanismo de acción relacionado con la migración, la diferenciación y la proliferación celular. En líneas generales, estimulan vías proinflamatorias e inhiben mecanismos útiles para la homeostasis del endotelio. A través de estos potenciales efectos sobre las proteínas celulares, las estatinas pueden tener una serie de propiedades antiateroscleróticas y antitrombóticas, como la inhibición del crecimiento de la célula muscular lisa, la adhesión celular, la activación plaquetaria y la secreción de proteína C reactiva, entre otras. 4
El ácido mevalónico, puede actuar, además, en forma directa inhibiendo la síntesis de óxido nítrico (NO), en un proceso dependiente de la inhibición de la genilgeranil transferasa. El óxido nítrico es una molécula esencial para la adecuada función y vasodilatación del endotelio. A esto hay que añadir los efectos resultantes de la inhibición de la LFA-1, lo cual termina incidiendo de forma importante sobre la función endotelial de los vasos sanguíneos.
Estatinas y función endotelial
Las estatinas mantienen y mejoran la función endotelial al aumentar la biodisponibilidad del óxido nítrico, que es sintetizado por la enzima óxido nítrico sintetasa (eNOS). El óxido nítrico es el principal regulador de la homeostasis de las arterias y de la vasodilatación endotelio dependiente. Las funciones del óxido nítrico son, entre otras, la inhibición de mecanismos proinflamatorios y actúar como antioxidante sobre las lipoproteínas. 10 Las estatinas preservan y aumentan la biodisponibilidad del óxido nítrico de varias formas:
· La inhibición de la proteína Rho aumenta la expresión de la enzima sintetasa de óxido nítrico.
· Aumentando la semivida del RNAm de la enzima sintetasa de óxido nítrico.
· Reduciendo el exceso de caveolina, molécula que actúa como inhibidor de la enzima sintetasa de óxido nítrico.
· Inhibiendo la producción de superóxido.
Al proteger al óxido nítrico las estatinas disminuyen la agregación plaquetaria y la reducción del tromboxano A2 por parte de las plaquetas y así limitan la formación de la placa inestable. 11
Las estatinas aumentan, además, la expresión del activador tisular del plasminógeno e inhiben la expresión de endotelina-1, un potente vasoconstrictor con acción mitogénica. 12,13
Propiedades antioxidantes de las estatinas
La propia acción hipolipemiante reduce de por sí el estrés oxidativo. No obstante, las estatinas tienen mecanismos antioxidantes propios que inhiben la producción del radical anión superóxido: El superóxido es sintetizado por la NADPH oxidasa, enzima que se puede activar por la acción del receptor de membrana de la angiotensina II, tipo I (R-AT1). Las estatinas bloquean el R-AT1 y además inhiben la fosforilación de la NADPH oxidasa, inactivándola. 14,15
Inhibición de la proliferación del músculo liso
La proliferación del músculo liso, es un fenómeno central en la patogénesis de las lesiones vasculares, inclusive la reestenosis postangioplastia, la aterosclerosis postrasplante y la oclusión de los injertos venosos coronarios. Las estatinas bloquean la RhoA, uno de los mediadores de la proliferación del músculo liso. 16
Acción antiinflamatoria
La aterosclerosis tiene un fuerte componente inflamatorio caracterizado por la presencia de monocitos, macrófagos y linfocitos T en la placa. Este proceso es inducido por citoquinas proinflamatorias, radicales libres y déficit de óxido nítrico. 17 Las estatinas, además de aumentar la biodisponibilidad de óxido nítrico inhiben a varias de las citoquinas proinflamatorias. 18
Un marcador de inflamación y también factor pronóstico de riesgo de enfermedad coronaria es la proteína C reactiva (PCR). 19 Se considera que la PCR es también proinflamatoria, ya que al unirse al LDL-C de la placa ateromatosa, activa el complemento e induce la expresión del inhibidor 1 del activador del plasminógeno (PAI-1), reduce la expresión de la eNOS y aumenta la expresión de las moléculas de adhesión. 20, 21 Por lo tanto, es válido suponer que el descenso de los valores plasmáticos de PCR podría ser beneficioso.
Los grandes estudios con estatinas, como el AFCAPS/ TexCAPS, mostraron reducción de PCR en sangre. Por su acción antiinflamatoria, las estatinas aumentan la estabilidad de la placa ateromatosa, y gran parte de la disminución de las complicaciones coronarias es atribuible a este mecanismo. Los estudios preclínicos demostraron que las estatinas reducen la acumulación de macrófagos en la placa ateromatosa e inhiben la producción de metaloproteinasas por los macrófagos activados. Las metaloproteinasas tienen la capacidad de degradar proteínas de sostén y por lo tanto son en parte responsables del accidente de placa con formación de trombo. 22
En resumen, podríamos decir que hay, además de la disminución directa del colesterol, cuatro mecanismos por los cuales las estatinas podrían prevenir las enfermedades cardiovasculares:
1. Mejorando la función endotelial
2. Modulando la respuesta inflamatoria
3. Estabilizando la placa de ateroma
4. Previniendo la formación del trombo
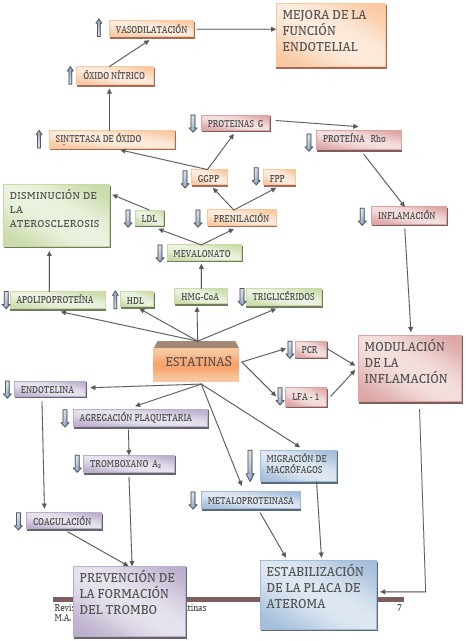
En el gráfico adjunto, se puede apreciar la compleja interacción de moléculas y funcionalismos que llevan a conseguir los efectos de las estatinas.
Gráfico: efectos de las estatinas
Leyenda
GGPP: geranilgeranilpirofosfato
FPP: Farnesilpirofosfato
HDL: Colesterol ligado a las lipoproteinas de aslta densidad
LDL: Colesterol ligado a las proteinas de baja densidad
HMG-CoA: 3-hidroxi-3-metilglutaril-coenzima A reductasa
PCR: Proteína C reactiva
LFA- 1: Lymphocyte function-associated antigen-1
Ensayos clínicos con estatinas
Desde la publicación de estudios como el Framingham Heart, el Seven Countries o el MRFIT (Multiple Risk Factor Intervention Trial), quedó patente el papel de la hipercolesterolemia como factor de riesgo principal en los episodios de morbilidad y mortalidad de origen cardiovascular. 23,24,25 Con estudios como el Lipid Research Clinics Coronary Primary Prevention o el Helsinki Heart se demostró que la reducción de colesterol prevenía la aparición de estos eventos cardiovasculares. 26,27 Esto llevó a la creación del NCEP (National Cholesterol Education Program) en 1987 y a sus recomendaciones sobre el tratamiento de la hipercolesterolemia. Se iniciaron estudios angiográficos para corroborar anatómicamente los hallazgos de estos estudios y comenzaron los estudios con estatinas siguiendo las recomendaciones del NCEP. Desde ese momento han sido numerosos los estudios realizados, destacando los siguientes:
Estudios en prevención primaria:
. Estudio WOSCOPS (West Of Scotland Coronary Prevention Study), en 6695 pacientes varones y realizado con la pravastatina y con reciente publicación de los resultados a largo plazo. 28
. Estudio AFCAPS (Air Force Coronary Atherosclerosis Prevention Study), con 6605 pacientes y realizado con lovastatina. 29
. Estudio CARDS (Collaborative Atorvastatin Diabetes Study), con 2838 pacientes tratados con atorvastatina. 30
. Estudio CHESS (Comparative HDL Efficacy and Safety Study), realizado sobre 917 pacientes, comparando la simvastatina con la atorvastatina a altas dosis. 31
. Estudio PRINCE (The PRavastatin INflamation/CRP Evaluation), con 1702 pacientes y valoración de los efectos antiinflamatorios de la pravastatina. Incluye un subestudio sobre prevención secundaria. 32
. Estudio JUPITER (Justification for the Use of statins in Primary prevention: an Intervention Trial Evaluating Rosuvastatin), estudio en curso que pretende estudiar en 15000 pacientes la efectividad de la rosuvastatina frente a placebo. 33
. Estudio STELLAR (Statin Therapies for Elevated Lipid Levels compared Across doses to Rosuvastatin). Estudio randomizado abierto que compara la eficacia de rosuvastatina frente a atorvastatina, pravastatina y simvastatina a dosis variables en pacientes con hipercolesterolemia primaria. 34
. Estudio ADVOCATE (the ADvicor Versus Other Cholesterol-Modulating Agents Trial Evaluation). 35
. Estudio ORBITAL (Open label primary care study: Rosuvastatin Based compliance Initiatives linked to achievement of LDL goals). Estudio randomizado, abierto, de 24 semanas de duración que valora la eficacia de rosuvastatina sola o en combinación en pacientes con hipercolesterolemia primaria, según objetivos de colesterol LDL europeos. 36
. Estudio FDF (the French-Dutch Fluvastatin study). Estudio randomizado, doble ciego y grupo control, con 431 pacientes con hipercolesterolemia primaria y valoración de los efectos de la fluvastatina sobre los niveles de LDL y HDL. 37
Estudios en prevención secundaria:
. Estudio 4S (Scandinavian Simvastatin Survival Study), con 4.444 pacientes con cardiopatía coronaria e hipercolesterolemia. 38,39
. Estudio CARE (Cholesterol and Recurrents Events Study), con 4159 pacientes y utilización de pravastatina. 40
. Estudio LIPID (Long-term Intervention with Pravastatin in Ischemic Disease), con 9014 pacientes e igualmente con pravastatina. 41
. Estudio de protección cardíaca o HPS (Heart Protection Study), con un total de 20.536 pacientes y estudio de la simvastatina a dosis de 40 mgr/día en 5963 de ellos, en los que redujo el riesgo de enfermedad coronaria y de acontecimientos cardiovasculares totales tanto en los diabéticos con antecedentes de enfermedad coronaria como en los que no tenían el antecedente. 42
. Estudio MIRACL (Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering Study), con 3086 pacientes y altas dosis de atorvastatina. 43
. Estudio ASCOT-LLA (Anglo-Scandinavian Cardiac Outcomes Trial- Lipid Lowering Arm), con 10305 pacientes y estudio de la atorvastatina. 44
. Estudio PROVE IT (Pravastatin or Atorvastatin Evaluation and Infection therapy-Thrombolysis in myocardial Infarction), con 4162 pacientes y comparación de atorvastatina a altas dosis con pravastatina. 45
. Estudio TNT, (Treating to New Targets), con 10001 pacientes y comparación entre altas y bajas dosis de atorvastatina. 46
. Estudio 3T (Treat-To-Target Study), con 1087 pacientes con enfermedad cardiovascular y dislipemia, tratados con atorvastatina o simvastatina. 47
. Estudio ALLHAT-LLT (The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial) con 10355 pacientes hipertensos y dislipémicos, usando pravastatina (40 mg al día). 48
. Estudio COMETS (COmparative study with rosuvastatin in subjects with METabolic Syndrome). Estudio randomizado, doble ciego de 12 semanas de duración que compara el efecto de la rosuvastatina frente a atorvastatina y placebo sobre los niveles de colesterol LDL en pacientes con síndrome metabólico y riesgo cardiovascular a 10 años inferior al 10%. 49
. Estudio ECLIPSE (An Evaluation to Compare Lipid lowering effects of rosuvastatin and atorvastatin In force titrated subjects: a Prospective Study of Efficacy and tolerability). Estudio randomizado de 24 semanas de duración que compara la eficacia de rosuvastatina y atorvastatina en pacientes con hipercolesterolemia primaria y riesgo cardiovascular a los 10 años superior al 20%. 50
. Estudio EXPLORER (EXamination of Potential Lipid-modifying effects Of Rosuvastatin in combination with Ezetimibe versus Rosuvastatin alone). Ensayo randomizado abierto de 6 semanas de duración que compara la eficacia de rosuvastatina en combinación con ezetimiba frente a rosuvastatina sola en pacientes con hipercolesterolemia y riesgo cardiovascular a los 10 años superior al 20%. 51
. Estudio MERCURY I (Measuring Effective Reductions in Cholesterol Using Rosuvastatin therapY I). Estudio randomizado abierto de 16 semanas de duración que compara la eficacia y la seguridad de rosuvastatina frente a atorvastatina, pravastatina y simvastatina en pacientes con hipercolesterolemia primaria, siguiendo los parámetros europeos. 52
. Estudio MERCURY II (Measuring Effective Reductions in Cholesterol Using Rosuvastatin therapY II). Estudio randomizado abierto de 16 semanas de duración que compara la eficacia y la seguridad de rosuvastatina frente a atorvastatina y simvastatina en pacientes con hipercolesterolemia primaria, siguiendo los parámetros de la NCEP ATP III. 53
. Estudio PULSAR (Prospective study to evaluate the Utility of Low doses of the Statins Atorvastatin and Rosuvastatin). Estudio randomizado abierto que compara la seguridad y eficacia de rosuvastatina y atorvastatina a bajas dosis en pacientes con hipercolesterolemia y riesgo cardiovascular a los 10 años superior al 20%. 54
. Estudio POLARIS (Prospective Optimisation of Lipids by Atorvastatin or Rosuvastatin Investigated in high-risk Subjects with hypercholesterolaemia). Estudio randomizado doble ciego de 26 semanas de duración que compara la eficacia y seguridad de la rosuvastatina y la atorvastatina en pacientes con hipercolesterolemia y riesgo cardiovascular a los 10 años superior al 20%. 55
. Estudio CORONA (COntrolled ROsuvastatin multiNAtional trial in heart failure). Estudio randomizado, doble ciego, que evalúa el efecto de la rosuvastatina en 5011 pacientes con fallo cardíaco de origen isquémico.
. Estudio AURORA (A study evaluating the Use of Rosuvastatin in patients requiring Ongoing Renal dialysis: an Assessment of survival and cardiovascular events). Estudio randomizado, doble ciego a largo plazo con 2775 pacientes comparando la rosuvastatina frente a placebo. 56
. (DIrect Statin COmparison of LDL-C Values: an Evaluation of Estudio DISCOVERY Rosuvastatin therapY). Estudio randomizado, abierto, de 12 semanas de duración, diseñado para evaluar la eficacia de la rosuvastatina frente a otras estatinas en pacientes con hpercolesterolemia primaria según los objetivos europeos de niveles de colesterol LDL. 57
. Estudio LUNAR (Limiting UNdertreatment of lipids in ACS with Rosuvastatin). Estudio randomizado, abierto, de 12 semanas de duración que compara rosuvastatina con atorvastatina en pacientes con síndromes coronarios agudos.
. Estudio URANUS (the Use of Rosuvastatin versus Atorvastatin iN type 2 diabetes mellitUS). Estudio randomizado, doble ciego, que compara en pacientes diabéticos tipo II la respuesta del colesterol LDL ante el tratamiento con rosuvastatina o atorvastatina. 58
. Estudio ANDROMEDA (A raNdomized, Double-blind study to compare Rosuvastatin [10 & 20 mg and atOrvastatin [10 & 20 Mg in patiEnts with type II DiAbetes). 59
. Estudio CORALL (COmpare Rosuvastatin [10–40 mg with Atorvastatin [20–80 mg on apo B/apo A-1 ratio in patients with type 2 diabetes meLLitus and dyslipidaemia).
Estudios angiográficos
. Estudio Post-CABG (Post- Coronary Artery Bypass Grafting Trial), con 1351 pacientes y uso de lovastatina. 60
. Estudio AVERT (Atorvastatin versus Revascularizacion Treatment), con 341 pacientes y utilizando la atorvastatina. 61
. Estudio REGRESS (The REgression GRowth Evaluation Statin Study), con 600 pacientes y utilizando pravastatina. 62
. Estudio ACAPS (the Asymptomatic Carotid Artery Progression Study), con 919 pacientes y estudio de la lovastatina. 63
. Estudio CCAIT (Canadian Coronary Atherosclerosis Intervention Trial). 331 pacientes con lovastatina, 64 que dio lugar a un interesante subestudio en mujeres. 65
. Estudio PLAC I (Pravastatin, Limitation of Atherosclerosis in the Coronary arteries I), con 408 pacientes. 66
. Estudio PLAC II (Pravastatin, Lipids, and Atherosclerosis in the Carotid arteries II), con 151 pacientes y valoración de la pravastatina. 67
. Estudio KAPS (Kupio Atherosclerosis Prevention Study), con 447 pacientes tratados con pravastatina. 68
. Estudio MARS, (the Monitored Atherosclerosis Regression Study), con 188 pacientes y valoración de la lovastatina. 69
. Estudio ASAPS (the Atorvastatin vs. Simvastatin on Atherosclerosis Progression Study), con 325 pacientes. 70
. Estudio BCAPS (ß-Blocker Cholesterol-lowering Asymptomatic Plaque Study), con 793 pacientes y fluvastatina, aunque estudia principalmente la efectividad del metoprolol para disminuir la placa de ateroma de la carótida. 71
. Estudio CAIUS, (the Carotid Atherosclerosis Italian Ultrasound Study), con 305 pacientes e investigando la pravastatina. 72
. Estudio FAST (Fukuoka AtherosclerosiS Trial), con 246 pacientes comparando pravastatina y probucol. 73
. Estudio ARBITER (Arterial Biology for the Investigation of the Treatment Effects of Reducing cholesterol), con 141 pacientes en los que se compara atorvastatina y pravastatina. 74
. Estudio ARBITER 2, estudio indirecto en el que se valora la efectividad del tratamiento con niacina asociada a estatinas. 75
. Estudio REVERSAL (the REVERSing atherosclerosis with Aggressive Lipid lowering study), comparando pravastatina y atorvastatina en 654 pacientes. 76
. Estudio IDEAL (the Incremental Decrease in Endpoints through Aggressive Lipid lowering trial), comparando atorvastatina y simvastatina en 8888 pacientes mayores de 80 años. 77
. Estudio SEARCH (the Study of the Effectiveness of Additional Reductions in Cholesterol and Homocysteine tests), comparando dosis bajas y altas de simvastatina.
. Estudio ASTEROID (A Study To Evaluate the effect of Rosuvastatin On Intravascular ultrasound-Derived coronary atheroma burden), Estudio abierto de 24 meses de duración diseñado para evaluar los efectos de rosuvastatina sobre el grosor de la placa de ateroma coronaria en 349 pacientes. 78,79
. Estudio METEOR (Measuring Effects on intima media Thickness: an Evaluation Of Rosuvastatin). Estudio randomizado, doble ciego, de 24 meses de duración que evalúa el efecto de la rosuvastatina sobre la placa de ateroma carotídea en pacientes asíntomáticos con hipercolesterolemia de bajo riesgo. 80
. Estudio ORION (Outcome of Rosuvastatin treatment on carotid artery atheroma: a magnetic resonance Imaging ObservatioN). Estudio randomizado, doble ciego, de 24 meses de duración evaluando el efecto de la rosuvastatina a diferentes dosis sobre la placa carotídea de ateroma en pacientes hipercolesterolémicos asintomáticos. 81
. Estudio LIPS (Lescol Intervention Prevention Study). Estudio randomizado, doble ciego con grupo de control, realizado sobre 1658 pacientes con angina de pecho, y valorando la efectividad de la fluvastatina para disminuir el riesgo de eventos cardíacos mayores. 82
. Estudio de las 3 provincias. Interesantísimo estudio retrospectivo realizado en 3 provincias de Canadá con 18.637 pacientes con infarto de miocardio previo, en los que se comparó la efectividad de 5 estatinas (atorvastatina, pravastatina, simvastatina, lovastatina y fluvastatina) en la prevención secundaria. 83
. Otros estudios angiográficos con estatinas en monoterapia, como el MAAS, CIS o LCAS.
Otros innumerables ensayos clínicos han sido realizados para intentar demostrar la utilidad de las estatinas en otras patologías, como la osteoporosis, la enfermedad de Parkinson, la enfermedad de Alzheimer, o el shock séptico. 84,85,86,87
Muy recientemente, en el congreso anual del American College of Chest Physicians (CHEST 2008, Octubre del 2008, Philadelphia), Danai Khemasuwan y su equipo del Albert Einstein Medical Center, presentaron los resultados de un estudio según el cual el tratamiento con estatinas está asociado a una reducción de tromboembolismo venoso, trastorno que incluye la trombosis de vena profunda y el embolismo pulmonar, en pacientes con tumores sólidos en órganos tales como la mama, el pulmón y el colon.
Los resultados revelaron que los pacientes que tomaban estatinas tuvieron menos probabilidades de desarrollar tromboembolismo venoso en comparación con el resto (8% frente a 21%). Este efecto fue independiente de otros factores, como tabaquismo, metástasis, quimioterapia utilizada, inmovilidad y uso de ácido acetilsalicílico. 88
Interacciones.
Interacciones farmacodinámicas
Tanto los fibratos como la niacina (ácido nicotínico) aumentan el riesgo de miopatía asociado a las estatinas. Esto es especialmente importante en el caso del gemfibrozilo, el cual además de la interacción a nivel de receptor, interfiere con el metabolismo hepático a nivel del CYP3A4. 2
Interacciones farmacocinéticas
Las interacciones más importantes de las estatinas se producen a nivel del metabolismo hepático, ya que dependen varias de ellas de distintas isoenzimas del CYP450. Así, mientras que lovastatina, simvastatina y atorvastatina dependen del CYP3A4 y rosuvastatina depende del CYP2C9, respecto a fluvastatina y pravastatina no se ha definido la enzima implicada, aunque se conocen algunas de sus interaciones farmacocinéticas. Así, en relación con el metabolismo hepático nos podemos encontrar las siguientes interacciones de interés:
Fármacos que interaccionan con la CYP3A4.
Inhibidores.
Potentes
· Antibióticos macrólidos:
o Eritromicina.
o Telitromicina.
o Claritromicina
· Inhibidores de la proteasa:
o Saquinavir
o Indinavir
o Ritonavir
· Antifúngicos azólicos:
o Ketoconazol
o Itraconazol
o Fluconazol
· Nefazodona
Otros
. Bergamotina (componente del zumo de pomelo)
. Quercetin
. Amiodarona
. Aprepitan
. Cimetidina
. Ciprofloxacino
. Ciclosporina
. Diltiazem
. Imatinib
. Equinácea
. Enoxacina
. Ergotamina
. Metronidazol
. Mifepristona
. Tofisopam
. Gestodene
. Mibefradil
. Inhibidores de la transcriptasa inversa no nucleósidos.
. Fluoxetina y otros IRSS
. Verapamilo
Inductores.
. Fenobarbital
. Carbamazepina
. Fenitoína
. Rifampicina
. Modafinilo
. Felbamato
. Glucocorticoides
. Griseofulvina
. Pioglitazona
. Primidona
. Topiramato
. Troglitazona
. Rifabutín
Fármacos que interaccionan con la CYP2C9. 89
Inhibidores.
. Fluvoxamina
. Fluconazol
. Ketoconazol
. Metronidazol
Inductores.
. Rifampicina
. Secobarbital
. Fenitoína
Otros fármacos que interaccionan con las estatinas. 1
Fármaco. Resultados de la interacción.
Antiácidos: disminuyen la absorción de las estatinas.
Anticoagulantes: aumenta la efectividad anticoagulante.
Resinas de intercambio iónico: disminuyen la absorción de las estatinas.
Colchicina: aumento de la toxicidad de la colchicina.
Glibenclamida: aumento de los niveles plasmáticos de la glibenclamida.
Anticonceptivos orales: aumentan hasta un 30% los niveles hormonales en sangre.
Uso clínico
Indicaciones
Dislipemias. 90 : Las estatinas están indicadas como un complemento de la dieta para reducir los niveles elevados de colesterol total, colesterol LDL, Apolipoproteína B, y de triglicéridos; y para aumentar el colesterol HDL en pacientes con:
· Hipercolesterolemia primaria
· Dislipidemia mixta.
· Hipercolesterolemia familiar homozigótica.
Prevención cardiovascular. 90
Prevención primaria de eventos coronarios. En los pacientes hipercolesterolémicos sin evidencia clínica de enfermedad coronaria:
· Reducir el riesgo de infarto de miocardio.
· Reducir el riesgo de sufrir procedimientos de revascularización miocárdica.
· Reducir el riesgo de mortalidad cardiovascular sin aumento en la muerte de causas no cardiovasculares.
Prevención secundaria de eventos cardiovasculares. En los pacientes con evidencia clínica de enfermedades cardiovasculares: 91
· Reducir el riesgo de mortalidad total mediante la reducción de muerte coronaria.
· Reducir el riesgo de infarto de miocardio.
· Reducir el riesgo de sufrir procedimientos de revascularización miocárdica.
· Reducir el riesgo de accidente cerebrovascular y los ataques isquémicos transitorios (TIA).
· Ralentizar la progresión de la aterosclerosis coronaria.
Tratamiento complementario a la corrección de otros factores de riesgo y otros tratamientos cardioprotectores.
Efectos adversos
En general, las estatinas son bien toleradas y la tasa de abandono en los ensayos clínicos como consecuencia de cualquier efecto adverso es < 10%, similar a la de los pacientes que toman placebo, y menos del 1% son efectos adversos graves. 92 El efecto adverso más grave está relacionado con la afección muscular, que puede ir desde las mialgias (dolor muscular proximal y/o debilidad muscular con un valor de creatinquinasa [CK] normal o ligeramente aumentado) hasta formas más graves, como la miopatía (dolor y/o debilidad más la presencia de creatinquinasa [CK] muy elevada, generalmente > 10 veces el valor normal) o la rabdomiólisis (afección muscular grave, con debilidad y dolor muscular, presencia de creatinquinasa [CK] muy elevada, mioglobinuria y fallo renal). En general, la afección más frecuente es la mialgia sin elevación de la creatinquinasa [CK]. Una mención aparte merece la cerivastatina, actualmente retirada del mercado, ya que es la estatina que presentó mayor cantidad de casos graves de miopatía. 93 La tasa de rabdomiólisis fatal asociada al uso de cerivastatina fue al menos 15 veces superior que la producida por otras estatinas, y estuvo relacionada con el uso de dosis altas del fármaco (0,8 mg/día) o bien cuando se administró conjuntamente con gemfibrozilo.
Conforme se han ido sintetizando nuevas moléculas de estatinas se ha ido buscando por una parte mejorar la eficacia terapéutica, pero por otra también el disminuir la aparición de reacciones adversas. Por tanto, la frecuencia de aparición de las mismas ha de tomarse de una forma orientativa, consultando en cada caso las frecuencias a nivel individual. Para la valoración de las reacciones adversas (RAM) tendremos en cuenta los criterios de la CIOSM, tal y como se aprecia en la tabla adjunta.
Tabla: reacciones adversas a las estatinas
Leyenda
La clasificación de la CIOMS, hace un gradiente de la reacciones según su frecuencia.
MUY FRECUENTES: = 10%
FRECUENTES: <10% y =1%
POCO FRECUENTES: <1% y =0.1%
RARAS: <0.1% y =0.01%
MUY RARAS: <0.01%
Reacciones adversas a las estatinas. 1
Sistema implicado. Grupo CIOSM. Tipo de reacción.
Trastornos gastrointestinales.
Frecuentes: Estreñimiento, flatulencia, dispesia, náuseas, diarrea.
Poco frecuentes: Anorexia, vómitos.
Raras: Hepatitis, ictericia colestática.
Muy raras: Insuficiencia hepática.
Trastornos del sistema nervioso.
Frecuentes: Dolor de cabeza, mareo, parestesias, hipoestesia.
Poco frecuentes: Neuropatía periférica.
Muy raras: Disgeusia.
Piel y anejos.
Frecuentes: Erupción cutánea, prurito.
Poco frecuente: Urticaria.
Muy raras: Edema angioneurótico, erupción ampollosa (incluyendo eritema multiforme, síndrome de Stevens-Johnson y necrolisis epidérmica tóxica).
Trastornos musculoesqueléticos.
Frecuentes: Mialgias, artralgias.
Poco frecuentes: Miopatía.
Raras: Miositis, rabdomiolisis, calambres musculares.
Muy raros: Rotura tendinosa.
Trastornos endocrinos.
Poco frecuentes: Alopecia, hiperglucemia, hipoglucemia, pancreatitis.
Psiquíatricos.
Frecuentes: Insomnio.
Poco frecuentes: Amnesia.
Trastornos generales.
Frecuentes: Astenia, dolor torácico, dolor de espalda, edema periférico, fatiga.
Poco frecuentes: Malestar, aumento de peso.
Varios.
Frecuentes: Reacciones alérgicas.
Poco frecuentes: Trombocitopenia, acúfenos, impotencia.
Muy raras: Alteraciones visuales o auditivas, ginecomastia, anafilaxia.
Un estudio, publicado en el número del 31 de julio de 2007 en el Journal of the American College of Cardiology, ha sacado a la luz otra sorprendente asociación epidemiológica: los bajos niveles de colesterol LDL se asocian con un mayor riesgo de cáncer. Es tan sorprendente que deberá ser contrastada, sobre todo teniendo en cuenta grandes metaanálisis realizados y que obtuvieron resultados totalmente distintos. 94
Contraindicaciones
Serán contraindicaciones absolutas: 90
. Hipersensibilidad a cualquier estatina o a algunos de los excipientes de las presentaciones comerciales.
. Hepatopatía activa o elevaciones persistentes e inexplicables de las transaminasas séricas
. Embarazo y lactancia.
. Administración concomitante de inhibidores potentes de la CYP3A4 (itraconazol, ketoconazol, inhibidores de la proteasa del HIV, eritromicina, claritromicina, telitromicina y nefazodona) o del CYP2C9. (Contraindicación relativa en estatinas no dependientes del CYP450).
Serán contraindicaciones relativas
(Se pueden tomar pero será necesario un especial control médico):
. Ancianos (edad > 70 años).
. Insuficiencia renal.
. Hipotiroidismo sin controlar.
. Antecedentes personales o familiares de trastornos musculares hereditarios.
. Antecedentes previos de toxicidad muscular con una estatina o un fibrato.
. Alcoholismo.
. Administración concomitante de inhibidores débiles de la CYP3A4.
Presentaciones.
La mayoría de las presentaciones son en forma de comprimidos. En algunos casos éstos son recubiertos. La fluvastatina tiene una presentación de liberación retardada. La dosificación dependerá de cada estatina, pero suele haber cuatro dosificaciones de cada una de ellas. Así, por ejemplo nos encontramos que la atorvastatina tiene presentaciones de 10, 20, 40 y 80 miligramos. La tendencia es a que vayan comercializándose dosis cada vez más altas, debido al mejor conocimiento de los efectos secundarios a dosis elevadas y a la mayor exigencia de control de los niveles de colesterol que presentan las guías clínicas y consensos de especialistas.
Dadas las características fisicoquímicas de las estatinas, entre los excipientes habituales nos podemos encontrar: 2
. Gelatina,
. Estearato de magnesio, (E 470)
. Celulosa microcristalina, (E-460 I)
. Almidón pregelatinizado (maíz),
. Lauril sulfato de sodio,
. Talco, (E 553 b)
. Dióxido de titanio, (E171)
. Óxido de hierro rojo, (E172)
. Óxido de hierro amarillo, (E172)
. Óxido de hierro negro, (E 172)
. Alcohol bencílico,
. Butilparabén, metilparabén y propilparabén.
. Carboximetilcelulosa de sodio, (E468)
. Fosfato de calcio edetate, (E540)
. Dióxido de silicio, (E 551)
. Propionato de sodio. (E281)
. Bicarbonato de potasio, (E501)
. Povidona, (E1201)
. Polietileno glicol 8000.
Referencias.
1. Agencia española de medicamentos y productos sanitarios. Información de fichas técnicas autorizadas. Enlace consultado el 30 de octubre de 2008. 31
2. Daily Med. Current Medication Information. 1 3. De Angelis G. The influence of statin characteristics on their safety and tolerability. Int J Clin Pract. 2004;58:945-55
4. Alonso Karlezi,R, Mata Pariente,N, Mata López,P; Control de las hiperlipemias en la práctica clínica. Rev Esp Cardiol 2007; 6: 24 - 35 ISSN : 1579-2242 2
5. Nissen S, Tuzcu M, Schoenhagen P, Brown BG, Ganz P, Vogel RA, et al. Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis. JAMA. 2004;291:1071-80.
6. Frohlich ED. Promise of prevention and reversal of target organ involvement in hypertension. J Renin Angiotensin Aldosterone Syst. 2001;2(Suppl 1):2–7.
7. Kallen, J. et al. Structural basis for LFA-1 inhibition upon lovastatin binding to the CD11a I-domain. J Mol Biol 1999; 292, 1–9.
8. Davignon J, The cardioprotective effects of statins. Curr Atheroscler Rep. 2004;6:27-35
9. Liao JK. Isoprenoids as mediators of the biological effects of statins. J Clin Invest. 2002;110:285-8
10. Denicola A, Batthyany C, Lissi E, et al. Diffusion of nitric oxide into low density lipoprotein. J Biol Chem 2002;277:932-6.
11. Lacoste L, Lam JY, Hung J, et al. Hyperlipidemia and coronary disease. Correction of the increased thrombogenic potential with cholesterol reduction. Circulation 1995; 92:3172–77.
12. Essig M, Nguyen G, Prie D, et al. 3-Hydroxy-3-methylglutaryl coenzyme A reductase inhibitors increase fibrinolytic activity in rat aortic endothelial cells. Role of geranylation and Rho proteins. Circ Res 1998; 83:683–90.
13. Hernandez-Perera O, Perez-Sala D, Navarro-Antolin J, et al. Effects of 3-hydroxy-3-methylglutaryl-CoA reductase inhibitors, atorvastatin and simvastatin, on the expression of endothelin-1 and endothelial nitric oxide synthase in vascular endothelial cells. J Clin Invest 1998;101:2711–19.
14. Cai H, Harrison DG. Endotelial dysfunction in cardiovascular diseases: the role of oxidant stress. Circ Res 2000;87:840–44.
15. Wassmann S, Laufs U, Baumer AT, Muller K, et al. HMG-CoA reductase inhibitors improve endothelial dysfunction in normocholesterolemic hypertension via reduced production of reactive oxygen species. Hypertension 2001;37:1450–57.
16. Laufs U, Marra D, Node K, Liao JK. 3-Hydroxy-3-methylglutaryl-CoA reductase inhibitors attenuate vascular smooth muscle proliferation by preventing rho GTPase-induced down-regulation of p27(Kip1). J Biol Chem 1999; 274:21926– 31.
17. Ross R. Atherosclerosis is an inflammatory disease. Am Heart J 1999; 138:S419–20.
18. Vaughan CJ, Gotto AM Jr., Basson CT. The evolving role of statins in the management of atherosclerosis. J Am Col. Cardiol.2000 35:1–10.
19. Ridker PM, Cushman M, Stampfer MJ, et al. Inflammation, aspirin, and the risk of cardiovascular disease in apparently healthy men. New Engl J Med 1997; 336:973–79.
20. Torzewski J, Bowyer DE, Waltenberger J, et al. Processes in atherogenesis: complement activation. Atherosclerosis 1997; 132:131–38.
21. Danenberg HD, Szalai AJ, Swaminathan RV, et al. Increased thrombosis after arterial injury in human C-reactive protein-transgenic mice. Circulation 2003;108: 512–15.
22. Aikawa M, Rabkin E, Sugiyama S, et al. An HMGCoA reductase inhibitor, cerivastatin, suppresses growth of macrophages expressing matrix metalloproteinases and tissue factor in vivo and in vitro. Circulation 2001;103:276–83.
23. Kannel WB, Feinleib M, McNamara PM, Garrison RJ, Castelli WP. An investigation of coronary heart disease in families: the Framingham Offspring Study. Am J Epidemiol. 1979;110:281–290 3
24. Keys A. Seven Countries: A Multivariate Analysis of Death and Coronary Heart Disease. Cambridge, Mass: Harvard University Press; 1980
25. Iso H, Jacobs DR Jr,Wentworth D, et al. Serum cholesterol levels and six-year mortality from stroke in 350,977 men screened for the multiple risk factor intervention trial. New Engl J Med 1989;320:904–10.
26. Respecto al Lipid Research Clinics Coronary Primary Prevention, pueden consultarse los siguientes artículos:
· Lipid Research Clinics Program: The Coronary Primary Prevention Trial: design and implementation. J Chron Dis 32: 609, 1979
· Lipid Research Clinics Program: The Lipid Research Clinics Coronary Primary Prevention Trial. I. Reduction in incidence of coronary heart disease. JAMA 251: 351, 1984
· Lipid Research Clinics Program: The Lipid Research Clinics Coronary Primary Prevention Trial. II. The relationship of reduction in incidence of coronary heart disease to cholesterol lowering. JAMA 251: 365, 1984
27. Respecto al Helsinki Heart, pueden consultarse los siguientes artículos:
· Mänttäri M, Elo O, et al. The Helsinki Heart Study: basic design and randomization procedure. Eur Heart J. 1987 Oct;8 Suppl I:1-29.
· Manninen V, Elo MO, et al.Lipid alterations and decline in the incidence of coronary heart disease in the Helsinki Heart Study.: JAMA. 1988 Aug 5;260(5):641-51.
· Manninen V, Huttunen JK et al. Relation between baseline lipid and lipoprotein values and the incidence of coronary heart disease in the Helsinki Heart Study. Am J Cardiol. 1989 May 2;63(16):42H-47H.
28. Ian Ford, Ph.D., Heather Murray, M.Sc,et al, for the West of Scotland Coronary Prevention Study Group. Long-Term Follow-up of the West of Scotland Coronary Prevention StudyN Engl J Med 2008; 358:193-195, Jan 10, 2008.Disponible en la web en [4
29. Downs, JR.Clearfield, M. Weiss, S. et al. Primary Prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of de AFCAPS/TexCAPS. JAMA, 1998;279:1615-1622
30. Colhoun HM, Betteridge DJ, et al, on behalf of the CARDS investigators. Primary prevetion of cardiovacular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo-controllede trial. N Engl J Med 2004;364:685-96.
31. Ballantyne CM, Blazing MA, et al. Effect on high-density lipoprotein cholesterol of maximum dose simvastatin and atorvastatin in patients with hypercholesterolemia: results of the Comparative HDL Efficacy and Safety Study (CHESS). Am Heart J 2003; 146:862-9.
32. Albert MA, Danielson E, Rifai N, Ridker PM,. Effect of statin therapy on C-reactive protein levels: the pravastatin inflammation/CRP evaluation (PRINCE): a randomized trial and cohort study. JAMA. 2001;286:64-70. (PMID: 11434828)
33. Ridker PM. Rosuvastatin in the primary prevention of cardiovascular disease among patients with low levels of low-density lipoprotein cholesterol and elevated high-sensitivity C-reactive protein: rationale and design of the JUPITER trial. Circulation 2003; 108: 2292–2297.
34. Jones P, Davidson M, Stein E, et al. Comparison of the Efficacy and Safety of Rosuvastatin Versus Atorvastatin, Simvastatin, and Pravastatin Across Doses (STELLAR Trial). Am J Cardiol 2003;92:152-160.
35. Bays HE, Dujovne CA,et al. ADVOCATE Group. Comparison of once-daily, niacin extended-release/lovastatin with standard doses of atorvastatin and simvastatin (the ADvicor Versus Other Cholesterol-Modulating Agents Trial Evaluation [ADVOCATE). Am J Cardiol 2003;91:667–72.
36. Willich SN, Müller-Nordhorn J, Sonntag F, et al. Economic evaluation of a compiance-enhancing intervention in patients with hypercholesterolaemia: Design and baseline results of the open label primairy care study: rosuvastatin bases compliance initiatives to achievements of LDL goals (ORBITAL) study. Am Heart J 2004; 148:1060-1067
37. B Jacotot, J D Banga, P Pfister, and M Mehra Efficacy of a low dose-range of fluvastatin (XU 62-320) in the treatment of primary hypercholesterolaemia. A dose-response study in 431 patients. The French-Dutch Fluvastatin Study Group. Br J Clin harmacol. 1994 September; 38(3): 257–263. 5
38. The Scandinavian Simvastatin Survival Study Group. Randomized trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994;344:1383-1389
39. Pedersen, T.R., L.Wilhelmsen, O.Faergeman, et al. Follow-up study of patients randomized in the Scandinavian Simvastatin Survival Study (4S) of cholesterol lowering. Am J Cardiol 2000;86:257-262
40. Sacks FM, Pfeffers MA, Moye LA, et al. The effect of pravastatin of coronary events after miocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrents Events Trial investigator. N.Eng.J.Med. 1996;335:1001-1009
41. LIPID Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. N Engl J Med 1998;339:1349–57.Disponioble en la web en [6
42. Collins R, Armitage J, Parish S, Sleigh P, Peto R, Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomised placebo-controlled trial. Lancet 2003;361: 2.005-16.
43. Schwartz GG, Olsson AG, Ezekowitz MD, Ganz P, Oliver MF, Waters, et al.. Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering (MIRACL) study Investigators. The effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled study. JAMA 2001;285:1711-8. 7
44. Sever PS, Dahlöf B, Poulter NR, et al, for the ASCOT investigators. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial- Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet 2003;361:1.149-58.
45. Cannon CP, Braunwald E, et al, for the Pravastatin or Atorvastatin Evaluation and Infection therapy-Thrombolysis in myocardial Infarction 22 Investigators. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med 2004;350:1.495-504 8
46. 11. LaRosa JC, Grundy SM, Waters DD, Shear C, Barter P, Fruchart JC, et al, for the Treating to New Targets (TNT) investigators. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005;352:1425-35 9
47. Olsson AG, Eriksson M, et al. A 52-week, multicenter, randomized, parallel-group, double-blind, double-dummy study to assess the efficacy of atorvastatin and simvastatin in reaching low-density lipoprotein cholesterol and triglyceride targets: the treat-to-target (3T)study. Clin Ther 2003;25:119-38
48. ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group. The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial. Major outcomes in moderately hypercholesterolemic, hypertensive patients randomized to pravastatin vs usual care: The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT-LLT). JAMA 2002;288:2.998-3.007. 10
49. Stalenhoef AFH, Ballantyne CM, Sarti, C et al. A Comparative study with rosuvastatin in subjects with METabolic Syndrome: rationale and design of the COMETS study. Diabetes Metab 2003;29(Suppl): 4S318 Abstract 2559. 11
50. Faergeman O, Sosef F, Duffield E, On behalf of the ECLIPSE Study Investigators. Efficacy and tolerability of rosuvastatin and atorvastatin when force-titrated in high-risk patients: results from the ECLIPSE Study. Atheroscler Suppl 2006;7:580.
51. Ballantyne CM, Weiss R, Moccetti T, et al. EXPLORER Study Investigators. Efficacy and safety of rosuvastatin 40 mg alone or in combination with ezetimibe in patients at high risk of cardiovascular disease (results from the EXPLORER study). Am J Cardiol 2007;99:673–80
52. Stender S, Schuster H, Barter P, et al. Comparison of rosuvastatin with atorvastatin, simvastatin and pravastatin in achieving cholesterol goals and improving plasma lipids in hypercholesterolaemic patients with or without the metabolic syndrome in the MERCURY I trial. Diabetes, Obesity and Metabolism 2005; 7(4):430-438.
53. Ballantyne CM, Raichlen JS, Cain VA, et al. Effect of switching high- and very high-risk patients to rosuvastatin from atorvastatin or simvastatin on achievement of new ATP III goals: MERCURY II. Atherosclerosis Supplement 2005;6(1): 101
54. Clearfield M, Kallend D, Palmer M, et al. Efficacy and safety of rosuvastatin 10mg versus atorvastatin 20mg: Results of the PULSAR study. Atherosclerosis Supplements 2005;6(1): 104
55. Leiter LA, Palmer M, Sosef F et al. Rosuvastatin 40 mg versus atorvastatin 80 mg in high-risk patients with hypercholesterolaemia: results of the POLARIS study at 8 and 26 weeks. Eur Heart J 2005; 26: (Abstract Supplement):581, (Abs P3503)
56. Fellström B, Zannad F, Schmieder R et al. Effect of rosuvastatin on outcomes in chronic haemodialysis patients — baseline data from the AURORA study. Atheroscler Suppl 2006;7(3):578, Abs Th-P16:387.
57. Strandberg TE, Feely J, Sigurdsson EL. DISCOVERY: A comparison of the efficacy and safety of rosuvastatin and atorvastatin in high-risk subjects with hypercholesterolaemia. International Journal Clinical Practice 2005;59(Suppl 148):3.
58. Berne, C and Siewert,A for the URANUS study investigators. Comparison of rosuvastatin and atorvastatin for lipid lowering in patients with type 2 diabetes mellitus: results from the URANUS study. Cardiovascular Diabetology 2005, 4:7 12
59. Betteridge, DJ and Gibson, JM. Effects of rosuvastatin on lipids, lipoproteins and apolipoproteins in the dyslipidaemia of diabetes. Diabetic Medicine Volume 24 Issue 5, Pages 541 - 549
60. Campeau, L Knatterud, GL et al. The Post Coronary Artery Bypass Graft Trial Investigators. The Effect of Aggressive Lowering of Low-Density Lipoprotein Cholesterol Levels and Low-Dose Anticoagulation on Obstructive Changes in Saphenous-Vein Coronary-Artery Bypass Grafts. N Engl J Med 1997; 336:1839-1840, Jun 19, 1997 13
61. Pitt B, Waters D, et al. Aggressive Lipid-Lowering Therapy Compared with Angioplasty in Stable Coronary Artery Disease. N Engl J Med 1999;341:70 14
62. Barth JD, Zonjee MM.et al. The REGRESS Research Group. Regression growth evaluation statin study (REGRESS): study design and baseline characteristics in 600 patients. Can J Cardiol. 1992 Nov;8(9):925-32.
63. Furberg, CD Adams Jr, HP et al. Effect of lovastatin on early carotid atherosclerosis and cardiovascular events. Asymptomatic Carotid Artery Progression Study (ACAPS) Research Group. Circulation. 1994;90:1679-1687 15
64. Waters, D. Higginson, L. et al. Effects of monotherapy with an HMG-CoA reductase inhibitor on the progression of coronary atherosclerosis as assessed by serial quantitative arteriography. The Canadian Coronary Atherosclerosis Intervention Trial. Circulation 1994;89:959-68 16
65. Waters D, Higginson L, et al. Effects of cholesterol lowering on the progression of coronary atherosclerosis in women: a Canadian Coronary Atherosclerosis Intervention Trial (CCAIT) substudy.Circulation 1995;92:2404-10 17
66. Pitt B.; Mancini GBJ. et al. Pravastatin limitation of atherosclerosis in the coronary arteries (PLAC I) : reduction in atherosclerosis progression and clinical events. Journal of the American College of Cardiology. 1995, vol. 26, no5, pp. 1133-1139 ISSN 0735-1097
67. Crouse J R; Byington R. P. Pravastatin, lipids, and atherosclerosis in the carotid arteries (PLAC-II) Am j card. 1995, vol. 75, no7, pp. 455-459
68. Salonen, R, Nyssonen, K et al. The Kuopio Atherosclerosis Prevention Study (KAPS): effect of pravastatin treatment on lipids, oxidation resistance of lipoproteins, and atherosclerotic progression. Am-J-Cardiol. 1995 Sep 28; 76(9): 34C-39C
69. David H. Blankenhorn; Stanley P et al. The MARS Research Group. Coronary Angiographic Changes with Lovastatin Therapy: The Monitored Atherosclerosis Regression Study (MARS). Annals of Internal Medicine. 1993. Volume 119 Issue 10. Pages 969-976 18
70. Smilde TJ, Wissen S, Wollersheim H, et al. Effect of aggressive versus conventional lipid lowering on atherosclerosis progression in familial hypercholesterolaemia (ASAP): a prospective, randomised, double-blind trial. Lancet 2001;357:577–81
71. Hedblad B, Wikstrand J, et al. Low-dose metoprolol CR/XL and fluvastatin slow progression of carotid intima-media thickness: Main results from the Beta-Blocker Cholesterol-Lowering Asymptomatic Plaque Study (BCAPS). Circulation. 2001 Apr 3;103(13):1721-6.
72. Sirtori, C.R, Bianchi, G.Pravastatin intervention trial on carotid artery atherosclerosis in patients with mild hypercholesterolemia: the CAIUS study. The International Journal of Cardiac Imaging Volume 11, Supplement - 2 / junio de 1995. pp 119-124
73. Yasunori Sawayama, Chie Shimizu, et al. Fukuoka atherosclerosis trial (FAST) Effects of probucol and pravastatin on common carotid atherosclerosis in patients with asymptomatic hypercholesterolemia J Am Coll Cardiol, 2002; 39:610-616 19
74. Taylor, AJ; Kent, SM; et al. ARBITER: Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol. A Randomized Trial Comparing the Effects of Atorvastatin and Pravastatin on Carotid Intima Medial Thickness Circulation. 2002;106:2055. 20
75. Taylor, AJ; Kent, SM; et al.Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol (ARBITER) 2 A Double-Blind, Placebo-Controlled Study of Extended-Release Niacin on Atherosclerosis Progression in Secondary Prevention Patients Treated With Statins. Circulation. 2004;110:3512-3517 21
76. Steven E. Nissen; E. Murat Tuzcu, et al. for the REVERSAL Investigators Effect of Intensive Compared With Moderate Lipid-Lowering Therapy on Progression of Coronary Atherosclerosis. A Randomized Controlled Trial JAMA. 2004; 291:1071-1080. 22
77. Pedersen, TR; Faergeman, O. et al. for the IDEAL study group. High-Dose Atorvastatin vs Usual-Dose Simvastatin for Secondary Prevention After Myocardial Infarction. JAMA. 2005;294:2437-2445. 23
78. Nissen S. Design and methodology of a study to evaluate the effect of rosuvastatin on intravascular ultrasound-derived coronary atheroma burden: The ASTEROID study. Atherosclerosis Supplements 2003;4(2);27
79. Steven E. Nissen, MD et al. The ASTEROID Trial. Effect of Very High-Intensity Statin Therapy on Regression of Coronary Atherosclerosis.JAMA. 2006;295:
80. Crouse JR 3rd, Raichlen JS, Riley WA, et al. METEOR Study Group. Effect of rosuvastatin on progression of carotid intima-media thickness in low-risk individuals with subclinical atherosclerosis: the METEOR Trial. JAMA 2007;297:1344–53. 24
81. Hatsukami TS, Zhao XQ, Yuan C, et al. Study design for a randomized, double-blind trial to assess the effect of 24 months of dosing with rosuvastatin on progression of carotid artery atheroma in moderately hypercholesterolemic patients with asymptomatic carotid stenosis. Atherosclerosis Supplements 2001;2(2):47-8
82. Lee, CH; de Feyter,P et al. Beneficial effects of fluvastatin following percutaneous coronary intervention in patients with unstable and stable angina: results from the Lescol intervention prevention study (LIPS) Heart. 2004 October; 90(10): 1156–1161. doi: 10.1136/hrt.2003.027284. 25
83. Zheng Zhou, Elham Rahme et al. Effectiveness of statins for secondary prevention in elderly patients after acute myocardial infarction: an evaluation of class effect.CMAJ. 2005 April 26; 172(9): 1187–1194. 26
84. Respecto a estudios del papel de las estatinas en la osteogénesis pueden consultarse:
· Mohammed H. Moghadasian, Jiri J. Frohlich, Statins and bonesCan.Med.As.Jour. • MAR. 20, 2001; 164 (6)
· Meier CR, Schlienger RG, Kraenzlin ME, Schlegel B, Jick H.HMG-CoA reductase inhibitors and the risk of fractures. JAMA 2000; 283:3205-10.
· Wang PS, Solomon DH, Mogun H, Avorn J. HMG-CoA reductase inhibitors and the risk of hip fractures in elderly patients. JAMA 2000; 283:3211-6.
· Chan KA, Andrade SE, Boles M, Buist DS, Chase GA, Donahue JG, Goodman MJ, Gurwitz JH, LaCroix AZ, Platt R. Inhibitors of hydroxymethylglutaryl-coenzyme A reductase and risk of fracture among older women. Lancet 2000; 355:2185-8.
· Van Staa TP, Wegman S, de Vries F, Leufkens B, Cooper C.Use of statins and risk of fractures. JAMA 2001; 285:1850-5.
· LaCroix AZ, Cauley JA, Jackson R y col. Does statin use reduce risk of fracture in postmenopausal women? J Bone Miner Res 2000; 15 (suppl1): S 155.
85. Simons M, Schwarzler F, Lutjohann D, von Bergmann K, Beyreuther K, Dichgans J, Wormstall H, Hartmann T, Schulz JB. Treatment with simvastatin in normocholesterolemic patients with Alzheimer's disease: A 26-week randomized, placebo-controlled, double-blind trial. Ann Neurol. 2002 Sep;52(3):346-50.
86. Jick H, Zornberg GL, Jick SS, Seshadri S, Drachman DA. Statins and the risk of dementia. Lancet. 2000 Nov 11; 356(9242):1627-31.
87. Michael Donnino and Michael Cocchi, Beth Israel Deaconess Medical Center. Boston, Massachusetts Study of Statin Therapy in the Treatment of Sepsis Estudio randomizado doble ciego iniciado en febrero del 2008. Información 28
88. Danai Khemasuwan, M.D et al. CHEST 2008: Statins Lower Risk of Deep Vein Thrombosis. Study of patients with solid organ tumors associates statins with a nearly threefold lower risk
89. E Galli y L Feijoo. CITOCROMO P-450 Y SU IMPORTANCIA CLÍNICA. Revista de Neuro-Psiquiatría 2002; 65: 187-201. Último acceso 4 de marzo, 2008. 29
90. Véase Guía de Prescripción Terapéutica. Información de medicamentos autorizados en España. (Revisado el 29, septiembre, 2.008). 30
91. Miller M, Dobs A, Yuan Z, Battisti WP, Borisute H, Palmisano J. Effectiveness of simvastatin therapy in raising HDL-C in patients with type 2 diabetes and low HDL-C. Curr Med Res Opin. 2004 Jul; 20(7):1087-94.
92. Davidson MH.. Safety profiles for HMG-CoA reductase inhibitors. Drugs. 2001;61:1917-26.
93. Thompson P, Clarkson P, Karas R. Statin-associated myopathy. JAMA. 2003; 289:1681-90.
94. Baigent C, Keech A et al. Cholesterol Treatment Trialists' (CTT) Collaborators. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of ata from 90,056 participants in 14 randomised trials of statins. Lancet. 2005 Oct 8;366(9493):1267-78