La Diabetes Mellitus (DM) se describe actualmente como un síndrome heterogéneo, caracterizado por un estado de hiperglucemia crónico, como consecuencia de una secreción anormal de insulina, por un defecto absoluto o relativo de la misma o por un exceso de factores que se oponen a su acción, de esto resulta una alteración en el metabolismo de los carbohidratos, proteínas y lípidos, siendo el resultado final una alteración progresiva de los vasos capilares en diferentes órganos, constituyendo un complejo patológico que en términos genéricos suele ser multifactorial y heterogéneo. En el mundo se calcula que alrededor de 135 millones de personas padecen la enfermedad y se espera que para el año 2.025 existan 300 millones de los cuales 45% vivirán en países en vías de desarrollo y 55% en países desarrollados.
Aspectos clínicos, humorales y electrofisiológicos indicativos de neuropatía autónoma diabética.
Dra. Jacqueline Bizet Almeida. Especialista de Primer Grado de Medicina Interna del Hospital Clínico - quirúrgico Universitario “Saturnino Lora”, Santiago de Cuba, Cuba.
Dra. Genellys Fernández Camps. Especialista de II Grado de Medicina Interna del Hospital Clínico – quirúrgico Universitario “Saturnino Lora”; Santiago de Cuba, Cuba. Profesor Auxiliar de Propedéutica y Medicina Interna del Instituto Superior de Ciencias Médicas de Santiago de Cuba, Cuba. MSc en Enfermedades Infecciosas y Medios Diagnósticos.
Introducción
La Diabetes Mellitus (DM) se describe actualmente como un síndrome heterogéneo, caracterizado por un estado de hiperglucemia crónico, como consecuencia de una secreción anormal de insulina, por un defecto absoluto o relativo de la misma o por un exceso de factores que se oponen a su acción, de esto resulta una alteración en el metabolismo de los carbohidratos, proteínas y lípidos, siendo el resultado final una alteración progresiva de los vasos capilares en diferentes órganos, constituyendo un complejo patológico que en términos genéricos suele ser multifactorial y heterogéneo (1).
En el mundo se calcula que alrededor de 135 millones de personas padecen la enfermedad y se espera que para el año 2.025 existan 300 millones de los cuales 45% vivirán en países en vías de desarrollo y 55% en países desarrollados.
En estos momentos la Diabetes Mellitus se encuentra situada dentro de las 10 primeras causas de muerte en nuestro país. Esta enfermedad ocupa un lugar sobresaliente entre las causas de morbilidad con una tasa de prevalencia nacional de 21.5 X 1.000 habitantes en 1999 y de 18.5 X 1.000 habitantes en nuestra provincia en el año 2.000. Estas cifras muestran tendencia a incrementarse cada año debido a múltiples causas, entre las que podemos citar el aumento de individuos con predisposición hereditaria a esta afección, disminución de la mortalidad en recién nacidos de padres diabéticos, así como de los propios diabéticos, la terapéutica sustitutiva que prolonga la vida poblacional, el incremento de los individuos obesos, la tendencia al sedentarismo, malos hábitos dietéticos, además de efectuarse el diagnóstico precoz a través de una activa dispensarización de los pacientes (2).
Existen evidencias que la importancia de la Diabetes Mellitas como problema de salud, viene determinada por el desarrollo y progresión de sus complicaciones crónicas microvasculares y macrovasculares, que afectan la calidad de vida del diabético y provocan una elevada tasa de invalidez prematura y muerte, por lo que en las etapas finales del proceso diabético puede producirse una afectación extensa de prácticamente todos los sistemas orgánicos, que se caracteriza por una microangiopatía con aterosclerosis acelerada, una neuropatía que afecta los sistemas nerviosos periféricos y vegetativos, una alteración neuromuscular con atrofia muscular, una embriopatía y una disminución de la resistencia a la infección.
La relación entre la aparición y severidad de las complicaciones microvasculares con el grado de control glucémico, detectadas en estudios retrospectivos hace algunas décadas, ha quedado confirmada por los resultados de estudios actuales que demuestran que los diabéticos tipo 1, controlados estrictamente, presentan una clara disminución de la incidencia de todas las complicaciones microvasculares. Sin embargo, es la patología macrovascular la que confiere a la Diabetes Mellitus tipo 2 sus altas tasas de morbilidad y mortalidad (3).
Las enfermedades del Sistema Nervioso Periférico (neuropatías periféricas) se encuentran entre las alteraciones neurológicas más frecuentes del paciente diabético. Su gravedad varía desde las anormalidades sensoriales ligeras que se encuentran en el 70% de los pacientes con Diabetes Mellitus antigua, hasta trastornos paralíticos fulminantes que ponen en riesgo la vida. El diagnóstico diferencial de la enfermedad nerviosa periférica representa un riesgo, porque el catálogo de las enfermedades que producen neuropatías es extenso, considerándose que el término neuropatía periférica se refiere a cualquier enfermedad del Sistema Nervioso Periférico, que varía desde el compromiso de un solo nervio (mononeuropatía), hasta el compromiso focal de más de un nervio periférico en particular (mononeuropatía múltiple), así como el trastorno diseminado y casi siempre simétrico del Sistema Nervioso Periférico (polineuropatía). Aunque puede manifestarse una gran variedad de síntomas y signos por afecciones del Sistema Nervioso Periférico, el repertorio de patologías celulares subyacentes es limitado, por lo que sólo hay pocas características clínicas o patológicas específicas de algunas neuropatías individuales. No obstante, en los últimos cinco años se han visto rápidos avances en el diagnóstico y tratamiento (4).
Gracias al uso de nuevos procederes diagnósticos, como son los estudios electrofisiológicos y de la conducción de los impulsos motores y sensitivos, ha surgido el criterio de las llamadas alteraciones o lesiones neuropáticas asintomáticas o subclínicas, las cuales se pueden poner de manifiesto aún antes de la aparición de las manifestaciones clínicas de la diabetes mellitus.
La neuropatía diabética ha sido una de las complicaciones de la diabetes mellitus que mayor interés ha despertado entre los investigadores en los últimos años tal vez por los escasos conocimientos que sobre su patogenia y tratamiento se tienen.
Está establecido que el engrosamiento de la membrana basal de los capilares constituye un rasgo histopatológico constante en el síndrome diabético, depende en parte del control metabólico, por estar la membrana basal constituida fundamentalmente por una glicoproteína que guarda dependencia con los niveles de glucosa y hormona del crecimiento en sangre; resultaría lógico pensar que las manifestaciones microvasculares y neurológicas de la Diabetes Mellitas se encuentran íntimamente unidas al control metabólico. Las razones antes señaladas han determinado que algunos investigadores postulen que es incorrecto hablar en estos casos de complicaciones de la diabetes y que sería más exacto hablar de síndrome vasculoneural específico de la diabetes (5).
Se define pues la neuropatía diabética como las manifestaciones clínicas o subclínicas que ponen en evidencia una lesión o trastorno de la función, localizadas o generalizadas, de las estructuras del Sistema Nervioso Periférico, tanto somático como visceral, que incluyen a las raíces espinales, craneales, ganglios sensitivos, motores viscerales y sus ramos comunicantes respectivos, mientras ocurran en aparente relación con la diabetes (6).
Se piensa que la lesión nerviosa de estos pacientes consiste en una disminución de la fibra nerviosa, donde histológicamente pueden observarse zonas de desmielinización del cilindroeje, así como proliferación del tejido conectivo endural y perineural.
No obstante su verdadera patogenia aún se desconoce y se han propuesto varias hipótesis, entre ellas la hipoxia, y otros factores ambientales y vasculares. Por otro lado el defecto de la insulina produce un trastorno en el metabolismo lipídico, y cuya resultante es un incremento en los ácidos grasos libres circulantes, trastornos en el contenido de la mielina neural, acumulación de sorbitol a partir de la glucosa, situación esta que afecta la capacidad de la célula nerviosa para utilizar la energía, trastornos de la osmolaridad intracelular y alteraciones de la capacidad de la membrana para el transporte de iones que finalmente se expresan como disfunción del nervio periférico, manifestándose en forma de dolor, ardor, parestesias, debilidad muscular, etc.
Entre otros mecanismos patogénicos se invocan que la hiperglucemia induce a modificaciones muy intensas en las proteínas celulares (tubulina) y las estructurales. Los productos finales de la glucosilación acelerada aumentan, y a su vez, estos son originados por la glucosilación no enzimática de las proteínas de vida perdurable por lo que se encuentran depósitos de estos en los vasos sanguíneos (7).
Se informa que la introducción de nuevos métodos diagnósticos para el estudio de la función neurovegetativa del diabético ha abierto un nuevo campo de investigación en la clínica diabetológica. Se expresa que la función autónoma en el diabético es mucho más común que lo que se diagnostica y la falta de su búsqueda sistemática podría ser la razón. Siendo la Neuropatía Diabética Autónoma responsable de cambios estructurales y funcionales que pueden afectar elementos aferentes y eferentes de los Sistemas Simpáticos y Parasimpáticos acompañados con frecuencia a una forma polineuropática, planteándose la misma cuando predominen en el cuadro clínico los síntomas o signos de disfunción autonómica.
Cualquier órgano inervado por el Sistema Simpático puede ser afectado por disfunción autonómica la cual se defina como una disminución de la función del sistema nervioso autónomo periférico expresado a través de su órgano efector, la disfunción autonómica comprende dos categorías principalmente (8):
- Aquellas en la cual se demuestran lesiones estructurales al nivel de las neuronas periféricas denominadas Neuropatías Autonómicas.
- El fallo autonómico funcional, en el cual no se demuestran alteraciones estructurales.
La disfunción autonómica pudiera ser expresión de una disminución del tono neurotrópico como consecuencia de trastornos en la síntesis, secreción o respuesta de algunos factores neurotrópicos como el factor de crecimiento neurotrópico, factor de crecimiento insulínico tipo 1 imprescindible para el desarrollo normal de las neuronas y axones.
Todos los inconvenientes anteriormente planteados, así como las características particulares de estos pacientes, nos inducen a pensar que esta variedad de neuropatía contribuye directamente a la mortalidad de dichos pacientes, además de la disminución de la calidad de vida.
Esta complicación que aparece en el curso de la diabetes mellitus es el problema principal de nuestra investigación en el contexto del programa de control de enfermedades crónicas no transmisibles permitiendo profundizar en el conocimiento de esta entidad, con el propósito de elevar la calidad de la atención al paciente diabético.
Objetivo
Determinar los elementos clínicos, humorales y electrofisiológicos identificativos de Neuropatía Autónoma en pacientes diabéticos.
Revisión bibliográfica actualizada.
La diabetes mellitus (DM) es un importante problema de salud en todo el mundo, con elevada morbimortalidad (9), es una de las patologías no transmisibles más frecuentes por la severidad y diversidad de sus complicaciones crónicas (10).
Durante los últimos 25 años se han incrementados de manera dramática el número de personas con diabetes en el mundo la prevalencia de la diabetes en varias poblaciones, y el número de estudios que describen la frecuencia de la diabetes en distintos entonos sociales y geográficos (10).
Un estudio de 1994 calculaba que había en el mundo 110 millones de diabéticos; sin embargo la prevalencia en la población general varía notablemente de unos estudios a otros, dependiendo de la etnia y la localización geográfica (11).
Otros estudios (12–16) de acuerdo a estimaciones realizadas entre los años 1994 y 2000 afirman que el número de pacientes con diabetes en todo el mundo en el año 200 se encontraba alrededor de 150 millones de personas. Se espera que de continuar las tendencias actuales, en el año 2010 ese número ascienda a 225 – 230 millones, y para el año 2025 se alcance la alarmante cifra de 300 millones de pacientes con diabetes.
Se han descrito cifras tan dispares como el 1% de China y Japón y el 40% de la Polinesia mientras que la OMS sitúa la prevalencia en los países europeos en un 2- 5% (17).
En Estados Unidos se calcula que sumando la tolerancia alterada a glucosa (TAG), la diabetes mellitus no insulinodependiente (DM tipo 2) diagnosticada y la no diagnosticada en mayores de 65 años, la prevalencia superaría el 30 – 40%, siendo estos datos aplicables a Europa (17).
Muchos países calculan que la DM se encuentra entre las siete primeras causas de muerte; en España sin embargo supone la cuarta causa de defunción (9) y se calcula que la padece alrededor del 4% de la población, y su frecuencia va aumentando con la edad, así en mayores de 65 años la padece un 10 – 15%, y en mayores de 80 años el 20%, es considerada la cuarta causa de muerte en la mayoría de los países desarrollados, la tercera en mujeres y la séptima en hombres (18,19).
Conceptualmente es una enfermedad producida por una alteración del metabolismo de los carbohidratos en la que aparece una cantidad excesiva de azúcar en la sangre y a veces en la orina (18,19).
Por el contrario existe un concepto más amplio de DM que la define como un síndrome metabólico caracterizado por un defecto en la secreción y/o acción de la insulina, que produce hiperglucemia y alteración del metabolismo de grasas y proteínas (20).
Berenguer y cols (1) la definen como un síndrome heterogéneo, caracterizado por un estado de hiperglucemia crónico, como consecuencia de una secreción anormal de insulina, por un defecto absoluto o relativo de la misma o por un exceso de factores que se oponen a su acción, de esto resulta una alteración en el metabolismo de los carbohidratos, proteínas y lípidos, siendo el resultado final una alteración progresiva de los vasos capilares en diferentes órganos, constituyendo un complejo patológico que en términos genéricos suele ser multifactorial y heterogéneo, el cual es un concepto más específico, donde se tienen en cuenta los elementos clínicos y fisiopatológicos más importantes.
Es considerada una enfermedad multiorgánica ya que puede lesionar casi todos los órganos y en especial los ojos, los riñones, el corazón y las extremidades (18–20).
Figuerola (21) plantea que no es en una afección única, sino un síndrome dentro del cual deben individualizarse diferentes entidades nosológicas. El nexo común de todas ellas es la hiperglucemia y sus consecuencias, es decir, las complicaciones específicas, las cuales son comunes a todas las formas de diabetes.
Esta es un trastorno crónico de base genética caracterizado por tres tipos de manifestaciones: a) un síndrome metabólico consistente en hiperglucemia, glucosuria, polifagia, polidipsia, poliuria y alteraciones en el metabolismo de los lípidos y de las proteínas como consecuencia de un déficit absoluto o relativo en la acción de la insulina; b) un síndrome vascular que puede ser macroangiopático y microangiopático y que afecta todos los órganos, pero especialmente el corazón, la circulación cerebral y periférica, los riñones y la retina, y c) un síndrome neuropático que puede ser a su vez autónomo y periférico (21).
Se distinguen dos formas de diabetes mellitus. La tipo 1, o diabetes mellitus insulino-dependiente (DMID), denominada también diabetes juvenil, afecta a niños y adolescentes, y se cree producida por un mecanismo autoinmune y es de evolución rápida. La tipo 2, o diabetes mellitus no insulino-dependiente (DMNID), o diabetes del adulto, suele aparecer en personas mayores de 40 años y es de evolución lenta. Muchas veces no produce síntomas y el diagnóstico se realiza por la elevación de los niveles de glucosa en un análisis de sangre u orina (22,23).
Más que una entidad única, la diabetes es un grupo de procesos con causas múltiples. El páncreas humano segrega una hormona denominada insulina que facilita la entrada de la glucosa a las células de todos los tejidos del organismo, como fuente de energía (24).
En el diabético, hay un déficit en la cantidad de insulina que produce el páncreas, o una alteración de los receptores de insulina de las células, dificultando el paso de glucosa. De este modo aumenta la concentración de glucosa en la sangre y ésta se excreta en la orina. En los diabéticos tipo 1, hay disminución o una ausencia de la producción de insulina por el páncreas. En los diabéticos tipo 2, la producción de insulina es normal o incluso alta, pero las células del organismo son resistentes a la acción de la insulina; hacen falta concentraciones superiores para conseguir el mismo efecto (25).
La obesidad puede ser uno de los factores de la resistencia a la insulina: en los obesos, disminuye la sensibilidad de las células a la acción de la insulina. La diabetes tipo 1 tiene muy mal pronóstico si no se prescribe el tratamiento adecuado. El paciente padece sed acusada, pérdida de peso, y fatiga. Debido al fallo de la fuente principal de energía que es la glucosa, el organismo empieza a utilizar las reservas de grasa. Esto produce un aumento de los llamados cuerpos cetónicos en la sangre, cuyo pH se torna ácido interfiriendo con la respiración. La muerte por coma diabético era la evolución habitual de la enfermedad antes del descubrimiento del tratamiento sustitutivo con insulina en la década de 1920 (25,26).
En las dos formas de diabetes, la presencia de niveles de azúcar elevados en la sangre durante muchos años es responsable de lesiones en el riñón, alteraciones de la vista producidas por la ruptura de pequeños vasos en el interior de los ojos, alteraciones circulatorias en las extremidades que pueden producir pérdida de sensibilidad y, en ocasiones, necrosis (que puede precisar amputación de la extremidad), y alteraciones sensitivas por lesiones del sistema nervioso. Los diabéticos tienen mayor riesgo de sufrir enfermedades cardiacas y accidentes vasculares cerebrales (22–25,27).
Tradicionalmente, las complicaciones crónicas de la diabetes se clasifican en microangiopáticas o complicaciones específicas de la enfermedad (retinopatía, neuropatía), macroangiopáticas (equivalente a la ateromatosis) y neuropáticas (21).
Es muy importante la detección precoz y un buen control del nivel de azúcar en la sangre para prevenir y/o retrasar la aparición de complicaciones (18).
La primera causa de muerte en personas diabéticas es el infarto de miocardio y sus complicaciones más frecuentes son el fallo renal, la afectación del sistema nervioso, la enfermedad ocular y alteraciones vasculares que pueden llevar a la amputación de un miembro (18,19).
Las alteraciones anatomopatológicas descritas en todas las estructuras (corteza, médula espinal, troncos periféricos, etc.) del sistema nervioso de los pacientes con diabetes son múltiples. El mecanismo patogénico no está totalmente aclarado, pero muchas experiencias apoyan la idea de que la hiperglucemia per se es la principal responsable, aunque existan otros factores implicados (21,28).
La afección del sistema nervioso por la diabetes ocasiona cambios histopatológicos, bioquímicos, funcionales y clínicos muy diferentes, de modo que en realidad debería hablarse de neuropatías diabéticas.
Histopatológicamente, las lesiones más comunes son degeneración y pérdida axonales, desmielinización segmentaria, cambios en las células de Schwann, en las células perineurales y en los vasos endoneurales, alteraciones en los nódulos de Ranvier, atrofia axonal distal y, en las formas crónicas, regeneración en forma de brotes (21,24).
El mecanismo bioquímico exacto mediante el cual la hiperglucemia induce las lesiones no está claro y se han postulado tres hipótesis (21–25, 27):
- Teoría del sorbitol: En los nervios periféricos de pacientes diabéticos existen concentraciones de sorbitol 2-10 veces superiores a las normales, postulándose que, al igual que ocurre en otros tejidos como el cristalino, en los nervios el exceso de glucosa que no puede metabolizarse por la vía de la glucosa-6-fosfato escoge la vía del sorbitol, que no requiere insulina. Este aumento del sorbitol intracelular se acompaña de una disminución del mioinositol intracelular, debido a la inhibición de su captación causada por la hiperglucemia y, probablemente, por el mismo aumento de la concentración de sorbitol. La disminución del mioinositol altera la actividad de la Na+K+ATPasa, que es probablemente la responsable de los fallos estructurales y funcionales del nervio.
- Teoría de la glicación no enzimática: Este mecanismo puede contribuir mediante la formación de AGE, los cuales son atacados por los macrófagos, ocasionando desmielinización segmentaria.
- Teoría del metabolismo de la carnitina: La administración de acetil-l-carnitina a ratas diabéticas normaliza la Na+K+ATPasa, la actividad proteincinasa y la velocidad de conducción motora del nervio, lo que sugiere que una alteración en el metabolismo de la carnitina podría desempeñar un papel importante en la neuropatía diabética.
A pesar de lo planteado anteriormente, los investigadores todavía no saben qué es lo que causa la neuropatía. El control de la glucosa parece desempeñar una función en la neuropatía. Es más probable que la neuropatía afecte a personas que han tenido diabetes durante un largo tiempo o cuyo control de la glucosa resulta insuficiente (29).
Pero nadie sabe con seguridad qué tan altos deben ser los niveles de glucosa para que se produzca daño nervioso. Probablemente, la glucosa no daña las células nerviosas en forma directa. En cambio, puede afectar otros sistemas del organismo que, a su vez, afectan al sistema nervioso (29).
Ahora, investigadores europeos informan que los llamados autoanticuerpos que atacan a las propias células nerviosas del organismo están asociados al desarrollo subsiguiente de neuropatía autonómica en los pacientes diabéticos (24,30).
En un grupo de pacientes diabéticos tipo 1 o insulinodependientes, más de la mitad tenían autoanticuerpos contra los nervios autónomos y estos pacientes tenían un aumento de más de siete veces del riesgo de desarrollar neuropatía autonómica (30,31). Estas observaciones parecen indicar que la neuropatía autonómica en la diabetes tipo 1 puede tener un fondo autoinmune.
Los haces de los nervios autónomos y ganglios obtenidos de diabéticos tipo 1 con neuropatía del sistema autónomo presentan infiltración con monolitos y el suero de tales personas puede contener anticuerpos fijadores del complemento a ganglios linfáticos lo cual sugiere que los mecanismos autoinmunitarios contribuyen a dichas complicación (28).
Sin embargo; pese a todos estos descubrimientos los mecanismos que producen dicho cuadro clínico heterogéneo no se conoce con detalle, y por ello la neuropatía se clasifica en base a la zona afecta.
La neuropatía diabética es posible prevenirla al menos en algunos casos. El DCCT (Diabetes Control and Complications Trial - Ensayo sobre el Control y las Complicaciones de la Diabetes) estudió las complicaciones que se presentan tanto en personas que realizaban un control riguroso de la glucosa como en aquellas que realizaban un tratamiento normal para la diabetes. En comparación con la cantidad de personas del grupo de tratamiento estándar que desarrolló neuropatía, sólo un tercio de esa cantidad de personas desarrolló neuropatía en el grupo de control riguroso de la glucosa (29).
La neuropatía del sistema nervioso autónomo es una alteración frecuente y su detección puede ser relativamente temprana en el curso de la diabetes cuando se buscan de manera intencionada sus alteraciones. Al igual que ocurre con la afección sensitiva, las anomalías objetivas (denervación autónoma del corazón, hipotensión postural asintomática, etc.) preceden largo tiempo a las manifestaciones clínicas. Por otra parte, la afección aislada del sistema vegetativo es rara y suele acompañarse de manifestaciones de neuropatía sensitiva. Los signos más comunes son las alteraciones de la sudación, la disfunción eréctil, la hipotensión ortostática, la enteropatía diabética, la gastroparesia diabética y la vejiga neurógena (21,29,32,33).
Se ha demostrado que individuos con diabetes mellitus tipo 1 y 2 de larga fecha pueden desarrollar signos de disfunción autonómica incluyendo los sistemas colinérgicos, noradrenérgicos y peptidérgicos (péptido como el polipéptido pancreáticos, sustancia P, etc) (24).
Las alteraciones de la sudoración se caracterizan por crisis de diaforesis profusa, en particular después de comer, que se localiza exclusivamente en la cara y la zona supraumbilical del tronco (21,29,32,33). También puede aparecer anhidrosis distal, sudación compensatoria de tronco y cara, intolerancia al calor y a veces “sudor” gustativo (28).
La soriasis (“golpe de calor”) y la hipertermia, constituyen los riesgos más graves, en particular cuando existe ya un trastorno vascular; también facilita las infecciones de los pies por grietas de la piel (28).
La disfunción eréctil ocurre con relativa frecuencia en diabéticos de larga evolución y parece estar relacionada con factores vasculares y neuropáticos (afección simpática del plexo sacro). La eyaculación retrógrada, también frecuente en estos pacientes, se produce como consecuencia de una disfunción vegetativa del esfínter vesical (21,29,32,33). La prevalencia de esta complicación puede llegar a un 50% en varones diabéticos (28).
La vejiga neurógena consiste en la incapacidad de ésta, cuando se distiende, de emitir estímulos sensoriales a la corteza. En consecuencia, se producen grandes dilataciones de la vejiga con emisión de más de 1.000 mililitros de orina en una sola micción, lo que representa un riesgo adicional de infección urinaria (21,28-33).
Esta disfunción vesical causada por la neuropatía ocasiona micción infrecuente vaciamiento incompleto de la vejiga, goteo e incontinencia por rebosamiento (28).
La gastroparesia diabética es una dilatación átona del estómago que puede ser responsable de náuseas, vómitos, digestiones "pesadas" o simplemente mal sabor de boca al levantarse por la mañana, aunque a menudo es asintomática.
La enteropatía diabética se produce por afección predominante del plexo de Auerbach y consiste en diarreas líquidas, predominantemente nocturnas, que pueden acompañarse de incontinencia fecal e intensificación de las diarreas durante el sueño (21,28,32-34).
También se plantean otras causas de diarrea como hipermotilidad por perturbación de la inhibición simpática hipomotilidad que ocasiona proliferación bacteriana insuficiencia pancreática o un síndrome similar al sprue (28).
La colelitiasis es más frecuente en los diabéticos que en el resto de la población, suponiéndose que este aumento de la incidencia depende de la asociación con obesidad y la atonía de la vesícula biliar, que ha sido comprobada en estos enfermos (21,29,32-34).
La hipotensión ortostática ocurre por fracaso de los barorreceptores controlados por el sistema vegetativo; en ocasiones puede ser muy grave siendo el efecto cardiovascular más incapacitante (21-25,27,28,34).
Los medicamentos que ocasionan depleción volumétrica o vasodilatación pueden empeorar la hipotensión. Con mayor frecuencia la denervación cardíaca ocasiona aceleración de la frecuencia del corazón y alteraciones en la respuesta al estrés (24).
Los individuos con neuropatía de tipo autónomo en el árbol cardiovascular muy probablemente isquemia o infarto silente del miocardio, prolongación anormal del intervalo QT, y respuesta deficiente en la frecuencia cardíaca y la presión arterial al ejercicio, todos estos factores pueden desencadenar un problema cardiaco agudo (24,35).
La afección del sistema nervioso vegetativo es evidentemente multisistémica. Así, se han demostrado alteraciones funcionales de este tipo en la capacidad pulmonar total y en los centros que controlan la respiración automática durante el sueño, habiéndose comprobado, en diabéticos afectos de otras manifestaciones del sistema nervioso vegetativo, períodos de apnea de hasta 90 segundos. Se ha sugerido que esta anomalía es la responsable de determinadas muertes súbitas nocturnas que sobrevienen en diabéticos (21,34).
Existen pruebas simples de detección de la neuropatía vegetativa como el estudio de la pupila (la dilatación es simpática), de los reflejos respiratorios (falla la respuesta a la hipoxia y la hipercapnia) y de la función cardiovascular (que consisten en analizar las variaciones de la frecuencia cardíaca al efectuar cambios posturales, en la maniobra de Valsalva o en las variaciones del ritmo respiratorio) (21,34,35).
Estas pruebas pueden ser de utilidad para advertir a los pacientes y médicos de algunas situaciones de riesgo (por ej. por la posibilidad de paradas respiratorias en el período de postextubación en la anestesia) (21,28,34).
Algunos pacientes con afección sensitiva y vegetativa presentan pérdidas de peso acentuadas que sugieren la existencia de un tumor maligno, cuya búsqueda es infructuosa. Este síndrome, denominado caquexia diabética neuropática, suele remitir en el curso de varios meses y es sumamente raro (21-25,27).
Otro enfoque es realizar un electromiograma, en dicho estudio se adhiere un disco a la piel que cubre el músculo, el médico aplica una pequeña descarga eléctrica sobre los nervios y una máquina lee y registra el voltaje de los discos. En caso de estar en presencia de una neuropatía, la velocidad con que el impulso recorre el músculo disminuye y de esa manera, muestra alguna anormalidad. A la mayoría de las personas estas descargas eléctricas no les producen molestias (29).
En los pacientes portadores de una neuropatía severa también puede realizar un segundo tipo electromiograma, donde una aguja insertada en los músculos mide las descargas eléctricas. Este estudio es más exhaustivo permitiendo saber si una fibra nerviosa se está rompiendo o se está curando el mismo es incómodo para la mayoría de las personas, pero vale la pena realizarlo ya que permite obtener un diagnóstico acertado (29,32).
Para los diferentes tipos de neuropatía autónoma existen otros estudios tales como estudios endoscópicos (cistoscopia, colonoscopía, gastroduodenoscopia con manometría), estudios hemodinámicas (cistometría, estudios urodinámicos), estudios metabólicos (determinación de los niveles de glucemia, triglicéridos, colesterol total y sus fracciones HDLc, LDLc y VLDL), estudios inmunológicos (determinación de autoanticuerpos contra nervios autónomos, anticuerpos fijadores del complemento a ganglios linfáticos), estudios imagenológicos (monografía renal, vesical y medición de orina residual, cistografía, fluoroscopia del sistema digestivo, tránsito intestinal y radiografía (RX) de colon por enema), estudios neurofisiológicos ( estudios de conducción nerviosa, respuesta simpática de la piel), electrocardiograma (ECG) de doce derivaciones entre otros.
Todos ellos con el objetivo de descartar cualquier otra causa de neuropatía.
Desde el punto de vista terapéutico son pocas las posibilidades recayendo fundamentalmente en el control metabólico adecuado, control de los factores de riesgo tales como la dislipidemia, el consumo de alcohol, obesidad, hipertensión arterial hábito de fumar, sedentarismo y estrés.
Así mismo es necesario la administración de suplementos vitamínicos del complejo B (vitamina B1, B6 y B12), analgésicos, antidepresivos tricíclicos (amitriptilina, desipramina), AINEs, gabapeptina como medicamento de última línea y otros agentes como mexilitine, fenitoína, cabamazepina, clonidina, fludocortisona y octreotide (24,34.
Método
Características de la investigación.
Se realizó un estudio descriptivo y transversal, con el propósito de evaluar la presencia de aspectos clínicos, humorales y electrofisiológicos sugestivos de Neuropatía Autónoma, en pacientes egresados del Servicio de Medicina Interna del Hospital Provincial Clínico-Quirúrgico Docente Universitario “Saturnino Lora”. En el período comprendido desde Abril del año 2006 a Abril del año 2007.
En la fase organizativa se sostuvo una reunión de trabajo con la dirección de la institución, así como con el servicio de Medicina Interna, el departamento de Laboratorio clínico, Imagenología y Neurofisiología donde se explicaron los objetivos de la investigación con el fin de establecer las coordinaciones de trabajo para la obtención de la información.
Además a los pacientes que integraron el universo se les explicó el objetivo del estudio y se tomó el consentimiento informado (Anexo 1); así como se les explicó que el mismo no constituye daño ni riesgo para su salud.
Diseño metodológico:
El universo de interés lo constituyeron pacientes diabéticos atendidos en el Servicio de Medicina Interna por descompensación de su patología de base (Diabetes Mellitus) en el período de interés. Fue seleccionada una muestra aleatoria de 80 pacientes, estratificada por sexo, los cuales reunían las características, que a juicio de los investigadores, lograron satisfacer los intereses para lo cual fue diseñado el estudio. Los requerimientos estadísticos de lo tamaños maestrales se supeditaron al recurso tiempo y a las posibilidades materiales disponibles, que sin afectar el diseño metodológico de la investigación, brindaron la robustez suficiente de las diferentes técnicas estadísticas aplicadas, y por consiguiente, poca sensibilidad a las variaciones de los modelos matemáticos de base, en correspondencia con la satisfacción razonable de las suposiciones básicas que exige cada técnica de análisis empleada (36).
Para la determinación del tamaño muestral se utilizó la fórmula para poblaciones finitas:
P (1 – P)
n = E2
S2 + P (1 – P)
N
Donde:
n: tamaño de la muestra.
E: diferencia admisible de la proporción poblacional.
P: proporción poblacional.
S2: varianza poblacional.
N: tamaño poblacional.
La muestra escogida de pacientes diabéticos reunió las siguientes características (37) (criterios de inclusión):
Ausencia de enfermedades tales como:
- Neumopatías.
- Insuficiencia cardíaca.
- Insuficiencia renal crónica.
- Hipotiroidismo.
- Lesiones intracraneales.
- Amiloidosis.
- Hipotensión ortostática idiopática.
Ausencia de ingestión prolongada de fármacos tales como:
- Antidepresivos tricíclicos.
- Parasimpaticomiméticos.
- Parasimpaticolíticos.
- Simpaticomiméticos.
- Simpaticolíticos.
- Vasodilatadores.
- Antihistamínicos.
- Antiarritmicos.
- Cardiotónicos.
- Antihipertensivos.
- Diuréticos.
- Antiserotonínicos.
Criterios de exclusión: cuando los pacientes no cumplan los criterios de inclusión anteriormente expuestos.
Criterios de salida:
- Fallecimiento.
- Salida espontánea del estudio.
Metódica:
Para la consecución del objetivo propuesto se estudiaron las siguientes variables:
Variables generales:
Grupo de edades: (según la 10Ş Revisión de la Clasificación internacional de enfermedades y problemas relacionados con la salud) (38):
- 15 – 24 años.
- 25 – 34 años.
- 35 – 44 años.
- 45 – 54 años.
- 55 – 64 años.
Fueron exceptuados los grupos de edades iguales o mayores a los 65 años, teniendo en cuenta que en los mismos aparecen con mayor frecuencia los estadíos más avanzados de la enfermedad y otras enfermedades asociadas que fueron excluidas.
Sexo: Masculino, Femenino.
Tiempo de evolución de la enfermedad (39): Se tuvo en cuenta el mismo según las siguientes categorías, calculado a partir de la fecha de diagnóstico de la enfermedad, dado por el carácter crónico de estas entidades, que determina una aparición lenta y progresiva de los daños que ocasionan a nivel de los diferentes órganos y sistemas de la economía:
- Menor de 5 años.
- De 5 a 10 años.
- De 11 a 15 años.
- Mayor de 15 años.
Variables para determinación de aspectos clínicos (40):
Esfera neurológica:
Se exploró con el objetivo de determinar la presencia de:
Vejiga neurogénica: Para los intereses de la investigación se seleccionaron criterios evaluativos para determinar la presencia de esta, teniendo en cuenta que algunos establecidos en la actualidad tales como: Cistometría vesical, Cistografía y Cistoscopia; no se encuentran disponibles en nuestro alcance.
Criterio mayor: Ultrasonografía con orina de retención o volumen diurético residual ≥ 15 ml.
Criterios menores:
- Diabético de difícil control.
- Infecciones urinarias a repetición o crónicas.
- Disociación entre glucemia y glucosuria.
- Diuresis matutina superior a 400 ml.
- Disminución de la frecuencia miccional en las 24 horas del día.
- Sensación de vaciamiento vesical incompleto.
- Disminución de la fuerza del chorro.
- Dificultad para iniciar la micción.
- Goteo de orina postmiccional.
- Desaparición de la nicturia.
- Retención urinaria aguda.
- Micción prolongada.
Se estableció la presencia de una vejiga neurogénica ante la presencia del criterio mayor y 2 menores ó en sustitutivo, la presencia de 5 criterios menores de los cuales al menos 3 esté relacionados con alteraciones del patrón miccional.
Disfunción sexual:
En el hombre: Se determinó por la presencia al interrogatorio de:
- Eyaculación retrograda.
- Pérdida de la sensibilidad testicular.
- Impotencia.
En la mujer: Se determinó mediante la presencia al interrogatorio de:
- Pérdida del deseo sexual.
- Pérdida del orgasmo.
Esfera digestiva:
Se exploró con el objetivo de determinar la presencia de:
Neuropatía autónoma intestinal: Para los intereses de la investigación se seleccionaron criterios clínicos evaluativos para determinar su presencia, tomados al interrogatorio y examen físico del paciente; teniendo en cuenta que los de mayor peso establecidos en la actualidad, tales como: Fluoroscopia, Gastroduodenoscopia con manometría, Colonoscopia, No resultan disponibles en nuestro medio.
Elementos clínicos tomados:
A nivel esofágico:
- Molestia retroesternal.
- Disfagia.
- Odinofagia.
A nivel de estómago y duodeno: Anorexia, náuseas, halitosis.
- Vómitos.
- Sensación de repletura.
- Bazuqueo.
- Epigastralgia.
- Síndrome pseudooclusivo.
A nivel de asas intestinales:
- Constipación.
- Diarreas.
- Incontinencia fecal.
Estudios endoscópicos e imagenológicos a realizar:
Se realizarán Esofagogastroduodenoscopia y radiografía de colon por enema para descartar la posibilidad de una causa orgánica concomitando con dicha enfermedad.
Esfera cardiovascular:
Se determinó mediante la presencia de:
Taquicardia: Se evaluó mediante la toma de la frecuencia cardiaca central en las siguientes condiciones:
- En el reposo (acostado): con valores mínimos entre 90 y 100 latidos por minuto.
- En el cambio a la bipedestación: hasta el 5to minuto con valores mínimos entre 120 y 130 latidos por minuto.
- En la maniobra de Valsalva: luego de 5 respiraciones profundas con frecuencia cardiaca central inferior a 60 latidos por minuto.
Hipotensión ortostática: Se evaluó mediante la toma de la tensión arterial en las siguientes condiciones:
- En el reposo (acostado): con valores no precisos para cada individuo.
- En el cambio a la bipedestación: se utilizó como criterio la caída de la presión arterial por lo menos 30∕20 mmHg al adoptar la posición de pie.
- En la maniobra de Valsalva: luego de 5 respiraciones forzadas, con cifras de presión arterial sistólica y diastólica superior a la tomada en el reposo.
Realización de estudios electrocardiográficos:
Mediante la monitorización cardiaca a través de un equipo Cardiofix convencional de 12 derivaciones sin las posteriores, para la determinación de las variaciones del intervalo R-R (LATIDO- LATIDO). Se consideró alterado:
- En el reposo: con disminución del intervalo R-R.
- En la maniobra de Valsalva: luego de 5 espiraciones forzadas con amplitud del intervalo R-R inferior a 15 latidos por minuto.
Variables asociadas a estudios electrofisiológicos (8,41):
Para corroborar el diagnóstico clínico se realizó estudios electrofisiológicos, con equipo NEUROFAX FOUR MINI, en el departamento de Neurofisiología del Hospital Clínico- Quirúrgico “Juan Bruno Zayas”, mediante la determinación de velocidad de conducción nerviosa para miembros y la respuesta simpática de la piel:
Estudio de velocidad de conducción nerviosa: Para corroborar el diagnóstico clínico de neuropatía periférica se realizó estudio electrofisiológico:
- Sensitivo
- Motor
Se consideró resultado alterado la presencia de al menos uno de los siguientes tipos de daño de cada una de las categorías anteriores:
- Daño axonal: Se expresa por una disminución de la amplitud del potencial de acción muscular obtenido por estimulación nerviosa en fibras motoras, en las sensitivas se observa igualmente una reducción de la amplitud del potencial de acción nerviosa. Mientras permanezcan fibras intactas, la conducción nerviosa se mantiene, pero las amplitudes de los potenciales y su área bajo la curva disminuyen su función del número de fibras que han dejado de conducir el impulso nervioso. En los casos en que la degeneración axonal se produzca en las fibras de mayor diámetro se observa una reducción de la velocidad de conducción o una prolongación de la latencia.
- Daño mielínico: Se expresa electrofisiológicamente por un enlentecimiento o bloqueo de la conducción nerviosa, con el consiguiente incremento de la dispersión temporal de los potenciales de acción musculares y nerviosos. Estas alteraciones se traducen en latencias y duraciones prolongadas, potenciales polifásicos, amplitudes disminuidas y velocidad de conducción enlentecida. En caso de desmielinización severa, el bloqueo de conducción puede ser total y no se obtiene ningún potencial en respuesta a la estimulación nerviosa.
- Daño mixto: Los parámetros de estimulación y registro fueron los siguientes:
- Estímulo eléctrico con frecuencia de 1 HZ y duración de 0,2 mseg.
- Sensibilidad de 2-5 MV∕división.
- Velocidad de barrido: de 1-3 mseg∕división.
- Delay: 0
- Premedición: 50.
- Amplificadores: Low cot: 0,5 Hz.
- High cot: 3000 Hz.
- Ganancia: por 100 000.
Respuesta simpática de la piel:
- Normal
- Alterado
Parámetros establecidos:
- Latencia: Miembros superiores: 1.3 – 1.5 segundos. Miembros inferiores: 1.9 – 2.09 segundos.
- Amplitud: Normal. Disminuida. Nula.
Se expresa a través de la integridad de los mecanismos de integración simpática en la conducción del sistema nervioso.
La prolongación de la latencia se considera como criterio de anormalidad, las pequeñas fibras no mielinizadas simpáticas pueden desarrollar bloqueo de conducción con disminución de la amplitud. La respuesta simpática de la piel está ausente en 2∕3 de pacientes con neuropatía diabética. En la mayoría de los pacientes afectados es más frecuente encontrar síntomas autonómicos.
Los parámetros de estimulación y registro serán los siguientes:
- Temperatura del laboratorio ≥ 220 c.
- Temperatura de la piel ≥ 340 c.
- Electrodo estándar Ag y AgCl.
- Duración del estímulo: 0,1 – 0,2 mseg.
- Intervalo del estímulo: 10 – 30 MA.
- Filtros: 0,1 y 1 Hz ( High pass). 100 – 400 (Low pass).
Variables para la determinación del estado humoral: Las mismas fueron determinadas para evaluar el control metabólico de cada paciente, durante la investigación.
Determinación de parámetros del Lipidograma (42,43):
- Determinación del colesterol sanguíneo: Mediante el método de Pearson modificado. Fue considerado como valor promedio de normalidad para ambos sexos el rango de 3,8 – 6,7 mmol∕ l.
- Determinación de HDL- colesterol: Mediante métodos enzimáticos obtenidos a través de un precipitado de colesterol a criterio de expertos, en el rango de favorable> 1.50 mmol∕ l y el desfavorable de ≤ 1.49 mmol∕ l 44.
- Determinación de triglicéridos: Mediante determinación en sueros por métodos enzimáticos, a criterio de expertos, con un rango de valor normal de 0.50 – 1.74 mmol∕ l44.
- Determinación de LDL- colesterol: Tomando en cuenta el método enzimático de que TG∕2 – COLESTEROL – HDL = LDL – COLESTEROL, a criterio de expertos, con un rango de valor normal de< 3.88 mmol∕ l44.
Determinación del nivel de glucosa en sangre: Mediante el método de la glucosaoxidasa, considerándose como valor normal:
- Glucemia en ayunas: 4,4 – 6,1 mmol∕ l.
- Glucemia postprandrial: 5,5 – 8,0 mmol∕ l.
Para los intereses de la investigación fueron creados criterios evaluativos del control metabólico, teniendo en cuenta que los establecidos en la actualidad, incluyen la determinación de la Hemoglobina glicosilada, no disponible esta última en nuestro medio (40):
Buen control metabólico: Glucemia en ayunas de 4,4 – 6,1 mmol∕ l, la postprandrial de 5,5 – 8,0 mmol∕ l y el colesterol sanguíneo inferior a 6,7 mmol∕ l. Sin aumento de fracciones del lipidograma, con ausencia de sintomatología clínica.
Mal control metabólico: Glucemia e ayunas > 7,8 mmol∕ l, postprandrial >10 mmol∕ l y colesterol sanguíneo superior a 6,7 mmol∕ l y∕o incremento de fracciones del lipidograma a expensas fundamentalmente de LDL, colesterol y triglicéridos.
Técnicas y procedimientos:
Recolección de la información:
Para la documentación y el aval científico del presente trabajo se llevó a cabo una profunda y exhaustiva revisión del material bibliográfico disponible acerca del tema que nos ocupa, en dependencia del objetivo propuesto, en el centro provincial de información de ciencias médicas, a través de los sistemas MEDLINE y LILACS, así como en la biblioteca de dicho centro y el centro MEGACEN, además de entrevistas a expertos sobre la temática de interés. Se creó una base de datos en soporte magnético para un mejor procedimiento de los mismos. Se revisó de forma concurrente las historias clínicas de los pacientes, con el fin de obtener los datos necesarios para cumplimentar el objetivo propuesto. Los datos se recogieron en una planilla de vaciamiento de datos para una mejor manipulación de los mismos (Anexo 2).
Procesamiento y análisis de la información:
El resumen y presentación de los datos se llevó a cabo mediante cuadros estadísticos y gráficos. Se calcularon porcentajes como medida de resumen para variables cualitativas, así como promedios, en el caso de las variables cuantitativas.
Se determinó la asociación estadísticamente significativa entre los diferentes criterios de clasificación de las variables involucradas a través de la prueba de hipótesis no paramétrica Chi cuadrado (X2) de independencia, para lo cual fue seleccionado un nivel de significación = 0,05.
- H0: No difiere la distribución de las variables de interés en las diferentes poblaciones subyacentes de las cuales se extrajeron.
- H1: Difiere la distribución de las variables estudiadas en las diferentes poblaciones subyacentes de las cuales se extrajeron.
En caso de identificarse asociación estadísticamente significativa en la población subyacente, fue aplicado el test de comparación de proporciones (X2 a posteriori), para las variables tiempo de evolución y control metabólico. Para lo cual fue dividida la muestra en dos grupos según intereses del estudio: Grupo 1: Presencia de Neuropatía Autónoma y Grupo 2: Ausencia de Neuropatía Autónoma.
La hipótesis estadística a docimar en este caso fueron:
H0: Pg1 = Pg2
H1: Pg1 ≠ Pg2
Donde:
Pg1= Proporción poblacional con las características de interés en el Grupo 1.
Pg2= Proporción poblacional con la característica de interés en el Grupo 2.
Para ambas técnicas estadísticas de análisis cualitativo utilizadas fue seleccionado un nivel de significación = 0,1.
ANÁLISIS Y DISCUSION DE LOS RESULTADOS
La Diabetes Mellitus es una de las enfermedades más frecuentes en clínica humana, siendo un problema de salud universal que afecta a todas las sociedades, pero más frecuente a aquellas de los países desarrollados. Se considera que alrededor de 135 millones de personas sufren de este mal, y este número se está incrementando rápidamente con el envejecimiento de la población, sobre todo a expensas de la Diabetes Mellitus no insulinodependiente, que comprende del 85% al 90% de la población total de diabéticos, y asume formas heterogéneas relacionado ello con el aumento de la expectativa de vida, que a su vez facilita y predispone al desarrollo y aceleración de las enfermedades, por lo que si tomamos en cuenta el proceso de envejecimiento de la población cubana, se pudiera esperar también un incremento de la prevalencia de la enfermedad en los años venideros, a menos que puedan ser cumplimentadas las estrategias preventivas y de control de dicha entidad (45).
La neuropatía del sistema nervioso autónomo, es una alteración frecuente y su detección puede ser relativamente temprana en el curso de la diabetes cuando se buscan de manera intencionada. Sus alteraciones, al igual que ocurre con la afección sensitiva, las anomalías objetivas (denervación autónoma del corazón, hipotensión postural asintomática, etc.) preceden largo tiempo a las manifestaciones clínicas. Por otra parte, la aparición aislada del sistema vegetativo es rara y suele acompañarse de manifestaciones de neuropatía sensitiva. Los signos más comunes son las alteraciones de la sudación, la disfunción eréctil, la hipotensión ortostática, la enteropatía diabética, la gastroparesia diabética y la vejiga neurógena (46).
Al analizar el conjunto de pacientes estudiados donde se caracterizan los mismos según grupo de edades y sexo, se apreció un incremento de individuos con edades superiores a los 35 años, sin diferencias extremas para cada sexo en cada grupo etáreo portador de esta entidad. Lo cual pudiera traducir una relación directamente proporcional entre la edad y la prevalencia de estas entidades en la población, así como de aquellos factores biológicos y ambientales que descansan en la génesis de esta enfermedad, presente per sé en el organismo humano en proceso de envejecimiento. A pesar de los resultados no esperados para el sexo, es de dominio la magnitud variable proporcional entre ambos sexos en lo referente e esta enfermedad (Cuadro Nş 1).
Cuadro Nş 1. Distribución porcentual de pacientes según grupo de edades y sexo.
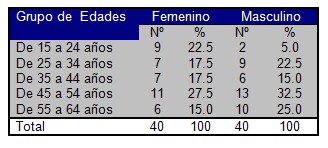
p > 0,05
Estudios actuales plantean la tendencia hacia una frecuencia de aparición de la enfermedad aproximadamente igual en hombres que en mujeres (47,48), lo cual puede estar influenciado por múltiples factores como el aumento de individuos con predisposición hereditaria, mayor predisposición a la obesidad, sedentarismo, stress, hábitos tóxicos, costumbres dietéticas incorrectas, entre otros; involucrados estos al proceso de envejecimiento de la población, lo que causa una transición epidemiológica, que incrementa la repercusión que produce como enfermedad crónica no transmisible sobre la población sin dejar de tomar en cuenta un incremento en la natalidad en el sexo masculino, así como una disminución de la mortalidad en hombres diabéticos, lo cual se hizo evidente en el análisis de la diabetes mellitus como causa básica de muerte en Cuba, en el período de 1988 – 1998 (49).
Estudios realizados acerca de diferentes tópicos de la enfermedad, y su relación con la neuropatía diabética (modificación de conocimiento de la población, morbilidad y mortalidad, etc.), identifican la presencia de una mayor frecuencia de enfermos en las edades mayores de 40 años y el sexo femenino. Al respecto, Caballero Garzón (50), plantea que la presencia de pacientes comprendidos en estas edades, pudiera justificarse debido al envejecimiento que sufre nuestra población, y a que la diabetes es una de las enfermedades crónicas no transmisibles más frecuentes en las poblaciones de edad avanzadas.
Así mismo, Lavaurt de la Uz y Castañeda Fernández, plantean que en esto influye la mayor presencia de factores de riesgos, siendo más evidentes en pacientes de 50 años de edad y coincidiendo además la prevalencia del sexo femenino, hecho que se justifica en relación a la presencia de factores de riesgo en la mujer como la obesidad, la diabetes gestacional y la paridad (8,51,52).
Se conoce que un diabético antes de los 14 años de edad, tiene una esperanza de vida de 12 años menor que la población general, si debuta entre los 15 y los 44 años de edad, tendrá de 7 a 10 años menos, y si lo hace de 45 a 64 años de 0 a 7 años menos (53).
La diabetes mellitus es una enfermedad metabólica crónica y compleja que se caracteriza por deficiencia absoluta o relativa de insulina, hiperglucemia crónica y otras alteraciones del metabolismo de los carbohidratos y de los lípidos; ello a su vez puede originar múltiples complicaciones microvasculares en los ojos, el riñón y las extremidades inferiores, así como neuropatías periféricas y frecuentemente lesiones macrovasculares, todas ellas aparejadas al tiempo de evolución de la enfermedad.
Siguiendo la continuidad del estudio, se observó un predominio del tiempo de evolución de la enfermedad en períodos superiores a los 5 años (Gráfico Nş 1), que tal y como se plantea en la literatura de consulta, a mayor tiempo de evolución, más incidencia de factores de riesgos, así como se hacen más evidentes los disturbios bioquímicos, sobre todo los relacionados con el sorbitol, el desbalance de la bomba sodio-potasio, en relación con la hiperglucemia, factores estos que se acentúan más en el diabético tipo 2, ya que generalmente debutan a una mayor edad, donde hay mayores alteraciones vasculares y cambios degenerativos biológicos, todo lo cual está aparejado al control metabólico y en ocasiones al descuido al que son sometidos dichos pacientes, sumándosele además que el grado de disfunción vascular y daño endotelial , los hacen más propensos a dichas alteraciones (54).
Las personas con diabetes pueden desarrollar daño temporal o permanente en el tejido nervioso. La lesión en los nervios es causada por una disminución del flujo sanguíneo y por los altos niveles de azúcar en la sangre y tiene mayores posibilidades de desarrollo si los niveles de azúcar en la sangre son mal supervisados. Algunos diabéticos no desarrollan neuropatía, mientras que otros pueden desarrollar esta condición en una etapa relativamente temprana. En promedio, el inicio de los síntomas se presenta de los 10 a 20 años después de diagnosticada la enfermedad y aproximadamente el 50% de las personas con dicha condición finalmente desarrollan neuropatía (55).
Las enfermedades del Sistema Nervioso Periférico (Neuropatías Periféricas), se encuentran entre las alteraciones neurológicas más frecuentes. Su gravedad varía desde las anormalidades sensoriales ligeras que se encuentran en el 70% de los pacientes con diabetes antigua, hasta trastornos paralíticos fulminantes que ponen en riesgo la vida. El diagnóstico diferencial de la enfermedad nerviosa periférica representa un riesgo, porque el catálogo de las enfermedades que producen neuropatías es extenso, considerándose que el término neuropatía periférica se refiere a cualquier enfermedad del Sistema Nervioso Periférico en particular (mononeuropatía múltiple), así como el trastorno diseminado y casi siempre simétrico del Sistema Nervioso Periférico (polineuropatía). Aunque puede manifestarse una gran variedad de síntomas y signos por afecciones del Sistema Nervioso Periférico, el repertorio de patologías celulares subyacentes es limitado, por lo que sólo hay pocas características clínicas o patológicas específicas de algunas neuropatías individuales. No obstante, en los últimos años se ha visto rápidos avances en el diagnóstico y tratamiento (56).
La aplicación de estudios de conducción nerviosa llevados a cabo por interés de la presente investigación, propiciaron evaluar su distribución en la muestra de pacientes estudiados. Según el patrón sensitivo obtenido en dicho estudio, se comprobó que solo un 6,2% de los pacientes (5 individuos) no presentaron ningún tipo de daño neuronal, siendo el daño mixto (axonomielínico) el que identificó mayor peso porcentual (65%). Tal realidad permitirá corroborar la tesis actual de la existencia en los enfermos estudiados de un predominio de polineuropatía diabética distal, simétrica, mixta y predominantemente sensitiva, mucho más al tener en cuenta los resultados contrarios obtenidos en dicho grupo de enfermos al evaluar la respuesta motora, donde el daño mixto representó sólo un 6,2% de prevalencia, contra un 48,7% de normalidad (Cuadro Nş 2)
Cuadro Nş 2 Distribución porcentual de pacientes según respuesta sensitiva y motora, de estudios de conducción nerviosa.
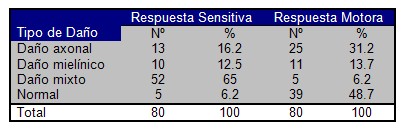
p < 0,01
La neuropatía periférica es una polineuropatía simétrica que afecta a la extremidad distal de los miembros inferiores, la proximal de los superiores, cara anterior del tronco y que presenta una progresión centrípeta, puede ser subclínica, cuando se diagnóstica sólo por técnicas electrofisiológicas, o clínicas, la cual se caracteriza por la presentación del dolor, parestesias y disestesias que afectan a las extremidades inferiores.
La neuropatía hiperglicémica diabética incluye síntomas sensoriales menores, reducción de la velocidad de conducción nerviosa y resistencia a la falla de conducción isquémica, y la hipoxia nerviosa parece tener un papel significante en su origen. Entre los fenómenos más persistentes, se encuentra la polineuropatía simétrica distal, la cual afecta predominantemente la función sensorial y autónoma. La axonopatía distal podría ser la patogenia básica. Otros fenómenos persistentes son las lesiones focales y multifocales que ocasionan neuropatías craneales, tóraco-abdominales y de la pierna, inclusive neuropatías motoras de la pierna baja (Amiotrofia diabética), alguna de estas pueden tener base isquémica. En particular, las lesiones multifocales proximales pueden sumarse y producir una neuropatía difusa distal simétrica. LAS lesiones focales, por su parte, en sitios de compresión, interna o externa, pueden reflejar una susceptibilidad anormal del nervio diabético al daño por compresión. Las lesiones inflamatorias vasculares focales pueden involucrar neuropatías proximales de la pierna baja, por último puede ocurrir polineuropatía inflamatoria desmielinizante (57).
La polineuropatía simétrica distal, es la forma más frecuente de neuropatía diabética. Se produce como consecuencia de las lesiones en las fibras principalmente sensitivas y autonómicas de los nervios periféricos de las extremidades inferiores. Las fibras motoras no suelen estar involucradas, al menos inicialmente. Los síntomas comienzan de forma insidiosa en los dedos gordos de los pies y posteriormente progresan hacia regiones más proximales de las extremidades inferiores y pueden incluso llegar hasta el abdomen y el tórax. La manifestación más típica es la perdida normal de la sensibilidad térmica y dolorosa. La anestesia favorece el desarrollo de las heridas, ulceraciones e infecciones crónicas. Por otra parte, también es posible el dolor de tipo neuropático que se manifiesta como sensación de quemazón o de dolor lancinante profundo y que es muy molesto para el enfermo. La pérdida de la sensibilidad vibratoria y propioceptiva no suele producir alteraciones clínicas relevantes a no ser que la neuropatía diabética sea muy extensa. Los hormigueos y la sensación de adormecimiento y de presión en las piernas son también muy frecuentes. Los síntomas motores son generalmente muy leves y se limitan a los pies y las piernas (58).
La neuropatía diabética ha sido pues una de las complicaciones de la diabetes mellitas que mayor interés ha despertado entre los investigadores en los últimos años, por los escasos conocimientos que sobre su patogenia y tratamiento se tiene, estableciéndose además que el engrosamiento de la membrana basal (MB) de los capilares constituye un rasgo histopatológico constante en el síndrome diabético (59,60).
El Sistema Nervioso Autónomo es predominantemente un sistema eferente que trasmite impulsos desde el Sistema Nervioso Central hacia órganos periféricos. Estos efectos incluyen: Control de la frecuencia cardiaca y fuerza de contracción del corazón, contracción y dilatación de vasos sanguíneos, contracción y relajación del músculo liso de varios órganos, acomodación visual, tamaño pupilar y secreción de glándulas exocrinas y endocrinas.
A menudo el Sistema Nervioso Autónomo funciona por medio de reflejos viscerales, es decir, las señales sensoriales que entran en los ganglios autónomos, la médula espinal, el tallo cerebral o el hipotálamo pueden dar lugar a respuestas reflejas adecuadas que son devueltas a los órganos para controlar su actividad. Reflejos simples terminan en el órgano interesado mientras que reflejos más complejos son controlados por centros autonómicos superiores en el Sistema Nervioso Central, principalmente el hipotálamo (61).
Existe una serie de síntomas que son característicos de las alteraciones del Sistema Nervioso Autónomo y cuya presencia debe hacerse sospechar una disautonomía. Entre ellos merece destacarse los siguientes: diarreas, principalmente nocturnas, sudación o trastornos vasomotores localizados en ciertas áreas del cuerpo, episodios de palpitaciones rítmicas en reposo y sin causa evidente, cuadros de sensación lipotímica o sincopes coincidentes con la bipedestación e impotencia masculina (62).
La afectación del sistema nervioso por la diabetes ocasiona cambios histopatológicos, bioquímicos, funcionales y clínicos muy diferentes, de modo que en realidad deberá hablarse de disautonomía diabética predominantemente neurológica lo cual concuerda con el elevado porcentaje (51,4%) de alteraciones clínicas de la esfera neurológica sobre los restantes: esfera cardiovascular (25,0%), esfera digestiva (23,6%), en la muestra escogida para el estudio (Gráfico Nş 2).
Lesiones cervicales o torácicas determinan la aparición de una vejiga espástica con micciones involuntarias, imperiosas, frecuentes y de poca cantidad ya que la capacidad de la vejiga es reducida. Lesiones de áreas medulares lumbares bajas causan incontinencia urinaria. Lesiones del cono medular o nervios periféricos producen aumento de volumen residual y micción por rebosamiento. Los trastornos de la función sexual consisten en pérdida de la libido, imposibilidad de obtener una erección adecuada para realizar el coito y alteraciones en la eyaculación (63).
La disfunción eréctil ocurre con relativa frecuencia en diabéticos de larga evolución y parece estar relacionada con factores vasculares y neuropáticos (afección simpática del plexo sacro). La eyaculación retrograda también frecuente en estos pacientes se produce como consecuencia de una disfunción vegetativa del esfínter vesical. La vejiga neurógena consiste en la incapacidad de esta, cuando se distiende de emitir estímulos sensoriales a la corteza. En consecuencia, se producen grandes dilataciones con emisión de más de 1.000 mililitros de orina en una sola micción, lo que representa un riesgo adicional de infección urinaria.
La gastroparesia diabética es una dilatación átona del estómago que puede ser responsable de náuseas, vómitos, digestiones “pesadas” o de simplemente mal sabor en la boca al levantarse por la mañana, aunque a menudo es asintomático. La enteropatía diabética se produce por afección predominante del plexo de Auerbach y consiste en diarreas líquidas predominantemente nocturnas, que pueden acompañarse de incontinencia fecal.
La colelitiasis es más frecuente en los diabéticos que en el resto de la población, suponiéndose que este aumento de la incidencia depende de la asociación con obesidad y la atonía de la vesícula biliar, que ha sido comprobada en estos pacientes. La hipotensión ortostática ocurre por fracaso de los barorreceptores controlados por el sistema vegetativo; en ocasiones puede ser muy grave y provocar caídas al suelo (64).
Todo lo anteriormente planteado coincide con los datos obtenidos en el presente estudio, con un mayor grado de afectación de la esfera neurológica para el sexo masculino (73,7%) dominado por la disfunción eréctil, y la esfera digestiva para el sexo femenino (44,1%), dominado por la enteropatía diabética. Del total de 72 pacientes que arrojaron presencia clínica de Neuropatía Autónoma. (Cuadro Nş 3)
Cuadro Nş 3 Distribución porcentual de pacientes con presencia clínica de Neuropatía Autónoma según sexo.
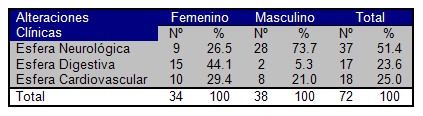
p > 0,05
El principal controlador de la erección es el sistema autónomo con sus dos vertientes: Simpático y Parasimpático. Además el tejido eréctil y las arterias cavernosas y helicianas reciben terminaciones no adrenérgicas, no colinérgicas cuyos mediadores neurohormonales juegan un rol preponderante en el mecanismo íntimo de la erección.
La erección será el resultado de mecanismos reflejos integrados a nivel medular, los cuales pueden desencadenarse por estimulación psicógena y/o reflexógena. La psicógena es el resultado de la excitación de centros corticales ya sea por estimulación de los sentidos o por fantasías sexuales y parece estar mediada por el sistema simpático. La reflexógena surge por estimulación exteroceptiva de los órganos genitales siendo mediada por el sistema parasimpático, la cual es la mayormente afectada en el paciente diabético (65).
La disfunción de la vejiga urinaria es especialmente molesta y a menudo obliga al sondaje crónico indefinido con todas las complicaciones que ello implica. La impotencia y la eyaculación retrograda son manifestaciones adicionales en el varón. La disfunción eréctil se asocia a una disminución de la producción de oxido nítrico en la vasculatura del pene (65).
La vejiga neurogénica diabética se produce por denervación de las fibras simpáticas aferentes, así como de las fibras parasimpáticas eferentes, que inervan el músculo detrusor. El síntoma más precoz es la pérdida de la sensación vesical con aumento del intervalo entre las micciones y el volumen de orina matutina, después se afectan las fibras motoras, lo que da lugar a atonía y pérdida de la fuerza del músculo detrusor. El chorro de orina es lento y débil, finalmente se establece una incontinencia urinaria por pérdida del esfínter y el paciente orina por rebosamiento.
La neuropatía autónoma gastrointestinal por estudios multicéntricos actuales, posee una inclinación por el sexo femenino en sus dos formas (66):
- Gastropatía diabética: Relacionada con los mecanismos auto inmunes de la enfermedad, la neuropatía gástrica cursa con atonía, dilatación, retraso de la evacuación y disminución de la secreción gástrica. Clínicamente se manifiesta por dolor abdominal, retención gástrica, pesadez postprandial, náuseas, vómitos, anorexia y control metabólico irregular con frecuente hipoglucemia.
- Enteropatía diabética: Cursa con crisis intermitentes de diarreas postprandial, con movimientos anormales por lo común acompañados de incontinencia fecal nocturna. A menudo existe sobre infección y mejora de forma espectacular tras la administración de antibióticos de amplio espectro. Entre los episodios diarreicos a veces hay un cuadro de estreñimiento cada vez más severo y el grado de atonía puede ser tan intenso que es capaz de ocasionar un megacolon.
Los resultados anteriores pudieran estar en relación con un tiempo de evolución prolongado de la enfermedad, hecho que predispone a la aparición de esta complicación, trastorno que se profundiza por una disminución del efecto protector de la insulina sobre los vasos sanguíneos, al estar esta última mermada en los enfermos diabéticos. Se conoce que la realización del diagnóstico temprano de la neuropatía diabética, por lo general, es poco frecuente, si se tiene presente que a mayor tiempo de evolución es la incidencia de los factores de riesgo asociados al daño metabólico, y en consecuencia, aumenta la probabilidad de detección de los trastornos neurológicos (67). Lo cual coincide con mayor predominio de neuropatía autónoma clínica en los diabéticos escogidos con tiempo de evolución de la enfermedad superior a 15 años (47,2%), rectificado por la ausencia de neuropatía clínica para dicho tiempo de evolución en la muestra escogida. (Cuadro Nş 4)
Cuadro Nş 4: Distribución porcentual de pacientes según tiempo de evolución y presencia clínica de Neuropatía Autónoma.
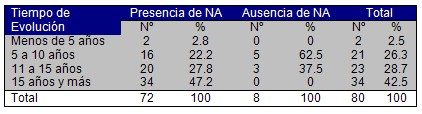
p > 0,05. NA: neuropatía autónoma.
En estudio realizado por Fajardo Vega, donde evalúa las complicaciones no infecciosas de la diabetes según tiempo de evolución, encuentra un total de 10 pacientes con polineuropatía diabética, de los cuales siete tenían más de 15 años de evolución, dos de 10 a 14 años de evolución, uno de cada cinco pacientes a 9 años de evolución, y ningún paciente con menos de 5 años de evolución de la enfermedad (68).
Los nervios envían mensajes desde y hacia el cerebro, relacionados con el dolor, la temperatura y el tacto. Y ordenan a los músculos cuando y como moverse. También controlan los sistemas del cuerpo encargados de digerir los alimentos y de excretar la orina. Alrededor de la mitad de todas las personas con diabetes manifiestan alguna clase de daño nervioso. Es más común en quienes han tenido la enfermedad durante un largo tiempo (69).
El paciente afectado del síndrome diabético desarrolla a lo largo de su padecimiento severas complicaciones vasculares, propias de la hiperglucemia sostenida. El control adecuado de la diabetes disminuye la incidencia y progresión de estas, tal como lo demostró el ensayo sobre el control y las complicaciones de la diabetes (DCCT) que pretendía conocer sí un tratamiento insulínico intensivo en los diabéticos tipo 1 podía influir en la prevención y desarrollo de las complicaciones tardías, en comparación con un grupo de diabéticos tratados con el método insulínico convencional. Participaron en este estudio 29 hospitales de Estados Unidos y Canadá y más de 600 profesionales de la salud. Se seleccionaron 1441 pacientes con diabetes tipo 1; 726 sin neuropatía ni otras complicaciones dependientes de la diabetes y una dirección media de tres años (prevención primaria) y 715 con neuropatía mínima o moderada y una duración media de la diabetes de 9 años (prevención secundaria) (70).
La glucosa alta en sangre causa cambios químicos en los nervios y perjudica la habilidad de los nervios para trasmitir señales. También tiene el potencial para dañar los vasos sanguíneos que llevan el oxigeno y los nutrientes a los nervios.
La Declaración de las Américas sobre la diabetes plantea que cuando la diabetes está suficientemente controlada, puede representar una importante carga social y económica para el individuo. Pero es posible prevenirla y evitar las complicaciones en las personas con la enfermedad mediante un buen control de la glucemia (70).
El control metabólico ha sido actualmente un factor planteado mundialmente como determinante en el desarrollo de complicaciones de la Diabetes Mellitus y en este caso de la Neuropatía Autónoma. Al evaluar este rubro (Cuadro Nş 5), se pone de manifiesto que la totalidad de pacientes con Neuropatía Autónoma tuvieron un mal control metabólico (72 pacientes) para un 100%, siendo significativo señalar que en ninguno se encontró un buen control metabólico, esto se explica por las diferentes alteraciones metabólicas que trae aparejadas la hiperglucemia en estos pacientes, a lo cual se le suman progresivamente los no menos generalizados valores promedios de las LDL, triglicéridos y colesterol sanguíneo en la población objeto de estudio.
Cuadro Nş 5 Distribución porcentual de pacientes según control metabólico y presencia de Neuropatía Autónoma.
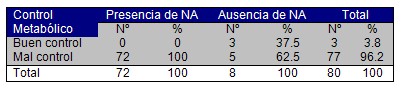
p < 0,01. NA: neuropatía autónoma.
Conseguir el adecuado control metabólico de la diabetes es muy importante en la prevención y el tratamiento de la neuropatía. La diabetes, se caracteriza por una notable hiperglucemia postprandrial después de la ingestión de carbohidratos. En la diabetes no insulinodependiente los efectos combinados del retraso en la secreción de la insulina y la resistencia a la insulina por parte del hígado, perturban la supresión de la producción de la glucosa por dicha glándula; por lo que surge hiperglucemia a pesar de que las concentraciones de insulina pueden rebasar las cifras que se detectan en personas no diabéticas, aparejado esto a la existencia de una hipertrigliceridemia por la menor actividad de la lipoproteinlipasa, con una consecuente tendencia a la obesidad, asociada a un mayor o menor grado de hipertensión arterial, se presenta lo que se ha postulado en llamar el “Síndrome X o Metabólico”, en el que la insulinorresistencia es la vía final o nexo común para los cuatro elementos anteriormente descritos (intolerancia a los hidratos de carbono o diabetes no insulinodependiente, insulinorresistencia , hipertensión arterial, hipertrigliceridemia) (71).
La aterosclerosis tiene un desarrollo más precoz, frecuente e intenso en la población diabética, que en la no diabética (riesgo 2 - 2,5 veces superior), y se iguala en ambos sexos la propensión a padecerla. Las complicaciones ateroscleróticas son más frecuentes en la Diabetes Mellitus no insulino dependiente (DMNID), que en la insulinodependiente (DMID); y constituyen en la actualidad la causa principal de muerte de los pacientes diabéticos en general.
El paciente diabético muestra una serie de factores patogénicos más importantes o específicos, que condicionan, a través de diferentes vías, las complicaciones ateroscleróticas (72):
- Hiperglucemia: Glicación no enzimática de proteínas, glucosilación enzimática parietal vascular, activación de la vía del sorbitol, liberación de radicales superóxido, influencia de GH y factores de crecimiento, alteraciones hemorreológicas (deformabilidad eritrocitaria, viscosidad sanguínea), hiperactividad plaquetaria, incremento de la coagulación, disminución de la fibrinolisis y disfunción endotelial (endotelina-prostaciclina).
- Hiperinsulinismo: Síntesis parietal lipídica, crecimiento de las células parietales, aumento de la actividad del inhibidor del activador del plasminógeno (PAI) con disminución de la fibrinolisis
- Dislipemia: Aumento de las concentraciones de triglicéridos y menos frecuentemente de pequeñas partículas de baja densidad (LDL), ligadas a colesterol, disminución de HDL- colesterol ( en especial en la DMNID), oxidación y glicación de partículas LDL- colesterol con formación de anticuerpos frente a estas e inmunocomplejos. Desde el punto de vista patogénico, son múltiples las presuntas vías que conducen a esta dislipemia en el individuo diabético.
4. Para asociar los valores de azúcar con el riesgo de complicaciones micro y macrovasculares, es tan útil usar directamente los datos prospectivos de glucosa en la población, como utilizar indirectamente la confianza en el nivel de glucosa en ayunas como signo de diabetes, lo cual compite con la confianza en el nivel de glucosa postprandrial. Este último es más sensible a la presencia de diabetes, ya que una pequeña disminución de la reserva secretoria malogra la habilidad de manejar la carga de glucosa, mientras que la capacidad secretoria de la insulina en ayunas es la última en desaparecer cerca del 85% de los casos de diabetes en países desarrollados son tipo 2 y muchos exhiben hiperinsulinemia asociada a dislipoproteinemia, obesidad, hiperuricemia y presión arterial alta (73).
5. Al identificar la relación existente entre el resultado electrofisiológico de la Respuesta Simpática de la piel y el estado de control metabólico, se evidenció que el 93,5% ( 72 pacientes), del total de la muestra de pacientes con mal control metabólico (77 pacientes), presentaron alteraciones electrofisiológicas, siendo significativo la presencia de Neuropatía Autónoma en el total de 72 pacientes para un 90% (Cuadro Nş 6); lo cual coincide al confrontar dicho resultado con el total de pacientes que presentaron evidencia clínica de Neuropatía Autónoma (Cuadro Nş 3). Confiriéndole un alto grado de confianza y seguridad a la Respuesta Simpática de la piel en el diagnóstico de la Neuropatía Autónoma del diabético.
Cuadro Nş 6. Resultados electrofisiológicos de la Respuesta Simpática de la piel según estado de control metabólico.
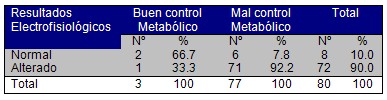
p > 0,05
Para el estudio de la Diabetes Mellitus y en especial de la Neuropatía Autónoma, se llevan a cabo múltiples investigaciones actuales, así como para el estadiamiento de la misma cobrando importancia el estudio electrofisiológico de la respuesta simpática de la piel, pues este es específico para su diagnóstico, ya que la misma es una complicación degenerativa que se presenta en el paciente diabético, relacionado con un trastorno o alteración de la actividad nerviosa, los hechos enumerados nos dan base para pensar, que los mecanismos patogenéticos de los mecanismos de acción negativa de alteraciones del metabolismo de los hidrocarbonos, en el período de una marcada descompensación de la diabetes (y en menor grado en el período de subcompensación), incluyen una acción combinada sobre el nervio, aumentando el contenido de mioinositol en las capsulas mielínicas, lo que favorece la destrucción de la mielina, acarrea serias alteraciones metabólicas en los nervios periféricos, e insuficiencia energética (74).
En la valoración del estado funcional de un nervio pueden utilizarse diferentes criterios: La presencia de signos y síntomas, el estudio de técnicas electrofisiológicas con percepción vibratoria y la disminución térmica. Tratando de determinar el papel que desempeña el Sistema Nervioso Autónomo en la regulación nerviosa, podemos establecer tres elementos: Los barorreceptores, los centros nerviosos bulbares, y las vías eferentes simpáticas y parasimpáticas encargadas del mantenimiento del tono basal o capacidad de autorregulación propia del músculo liso vascular (75).
Las terminaciones nerviosas periféricas del simpático forman un retículo o plexo de donde salen las fibras terminales que se ponen en contacto con las células efectoras. Toda la noradrenalina de los tejidos periféricos se encuentra en las terminaciones simpáticas en las cuales se acumula, partículas subcelulares análogas a las granulaciones cromafines de la medula suprarrenal. La liberación de noradrenalina en las terminaciones nerviosas se produce en respuesta a los potenciales de acción que se propagan por dichas terminaciones (76).
Las exploraciones complementarias para el diagnóstico de la Neuropatía Autónoma son muy variadas, van a depender del sistema u órgano que queramos investigar (velocidad de conducción nerviosa, biopsia nerviosa, electromiografía, transito esófago-gastrointestinal, manometría, urografía, tomografía, etc.). La mayoría de las exploraciones comentadas solo se realizarán cuando existan dudas diagnósticas con implicaciones terapéuticas y en los trabajos de investigación. Dado que en la Diabetes Mellitus la afectación del Sistema Nervioso Autónomo es “universal”, si demostramos su alteración a nivel de un determinado órgano o sistema, supondremos su afectación también en el resto del organismo. De los numerosos test propuestos para su determinación, la Respuesta Simpática de la piel posee un alto valor diagnóstico e índice de seguridad, con una disminución de la relación costo-beneficio (77,78).
CONCLUSIONES
- El daño autónomo de la esfera neurológica dominado por la disfunción sexual masculina presenta un patrón diferencial mayor en individuos diabéticos portadores de neuropatía autónoma.
- La existencia de una polineuropatía simétrica distal con daño sensitivo mixto induce de igual forma un trastorno de la función sensorial como autónoma.
- La hiperglucemia crónica unido al elevado proceso de aterogénesis que justifican el mal control metabólico es directamente proporcional a la presencia de neuropatía autónoma refirmado por las alteraciones electrofisiológicas encontradas.
- El mayor tiempo de evolución de de la enfermedad se asocia significativamente en lo particular a la progresión del defecto neuromuscular autónomo.
- La respuesta simpática de la piel posee un alto valor diagnóstico e índice de seguridad con una disminución de la relación costo – beneficio.
Referencias bibliográficas
1. Berenguer Iglesias MD, Biroles Dens M, Burdó Vidialle M, Franch Nodol L, Gimbert Rafels RM, Hernández Hicet E, et al. Guía para el tratamiento de la Diabetes tipo II en la atención primaria de salud. Cataluña. Sociedad Española de Medicina de familia y comunitaria; 1995.p.9-10.
2. Famet Cerero O, Cabrera Rode F, González Fernández P. Diabetes Mellitus un problema de salud. Rev. Avances Médicos de Cuba 2000; VII (23). 19-30.
3. Vine Colin D, Clinical Neurophisiology. The moud shy hospital. London, United Kingdom ∕ ed Edition, 2005: 139-155.
4. Gries FA. Alternative therapeutic principles in the prevention, of microvascular and neuropathic complications. Diabetes Forschungs Institute an der Heinrich- Heine University. Disseldorf. Germany.
5. Stevens MJ; Feldman EL; Greene DA. The ethiology of diabetic neuropathy: The combine role of metabolic and vascular defect Department on Internal Medicine, University of Michigan. USA. 2000.
6. Pfeifer MA: Schumer MP. Clinical trials of diabetic neuropathy. Past, present and future. Department of Internal Medicine, Southern Illinois University Scholl of Medicine. USA. Febrary 2000.
7. Fabianne F, De Vincentis N, Staffilano A. Tolreast in the first prevention of diabetic neuropathy. Divisione de Medicine Generale. Instituti clinic di perfezionamento, Milan. Italy.
8. Nordase, A Y Diaz B. El laboratorio de electromiografía, técnicas para la exploración funcional del aparato neuromuscular. 2da parte Vol 1, No 1, Sep- Dic 1998, p.132.
9. Rodríguez Paño B, Sanchos S, García Gosálves F, Divisón JA, Atigao LM, López Abril J, Nahao F, Puras A: Prevalencia de la diabetes mellitus y su asociación con otros factores de riesgo cardiovascular en la provincia de Albacete. Atención Primaria. Vol. 25. Nş 3. 28 de febeo de 2004.
10. Sierra Aiza ID, Mendivil Anaya CO et al: Hacia un manejo práctico de la Diabetes Mellitus tipo 2. Edición especial. Segunda edición. Novo nordisk®. Agosto 2005.
11. McCarty D, Zimmet P: Diabetes 1994 – 2010: Global stimates and projections. Melbourne: International Diabetes Center 2004.
12. King H, Aubet E, Heman WH: Global Buden of diabetes, 1995 – 2025: Prevalence, numerical stimates and projections. Diabetes Care 1998; 21: 14141431.
13. Asociación Latinoamericana de Diabetes (ALAD). Guías ALAD para el diagnóstico y tratamiento de la Diabetes Mellitus. Disponible en: http://www. alad .com.
14. American Diabetes Association: Position Statement: Diabetes Mellitus and Exercise. Diabetes Care 2003; 26: S64 – S70.
15. American Diabetes Association: Follow-up report on the diagnosis of Diabetes Mellitus. Diabetes Care 2003; 26: 3160 – 3167.
16. Diabetes Prevention Program research Group: The Diabetes Prevention Program: Description of lifestyle intervention: Diabetes Care 2002; 25: 2165 – 2171.
17. Diabetes mellitus. Report of WHO Study Group. Technical Report Series. 727. Ginebra: OMS, 2005.
18. Diabetes Mellitus. Biblioteca Encarta. 2005. CD – R.
19. Diabetes Mellitus. Biblioteca Encarta. 2007. CD – R.
20. ¿Qué es la Diabetes? Diabéticos.com. Disponible en: http://www. diabeticos .com/ frontend/ diabeticos / noticia .php?id noticia =179&id seccion =2& treep qos=sub101.
21. Figuerola Pino D, Reynals de Blasis E, Ruíz M y Vidal Puig A: Diabetes Mellitus. En: Farreras – Rozman. Medicina Interna. Sección 15. Metabolismo y Nutrición. Cap. 248. 2006. CD – R.
22. Harrison Tinsley R: Principios de Medicina Interna. Vol. 2. Madrid. McGraw – Hill Interamericana. España. SA, 1994.
23. Matín Zuro, A y Cano Pérez JF: Atención Primaria. 2 vol. Barcelona: Harcourt Brace de España, SA. 4ta ed. 2005.
24. Powers AC: Diabetes Mellitus. En: Harrison's. Principles of Internal Medicine. 16th Edition. McGraw – Hill. 2005, 2152 – 80.
25. Manual Merck. Diabetes Mellitus. Sec. 2: Enfermedades endocrinas y metabólicas. Cap. 13. Trastornos del metabolismo de los hidratos de carbono. 2004. CD – R.
26. Yanousky SZ, Yanousky JA: Obesity. New Engl J Med. 2002; 346: 591 – 602.
27. Neuropatía autónoma diabética. Care New England Willness Center. Disponible en: http://www. wellness ctr.og/ body. cfm?i d=99 &chunk iid=126596.
28. Shewing S: Diabetes Mellitus. En: Cecil – Loeb. Tratado de Medicina Interna. Vol II. 20a edic. McGraw – Hill Interamericana. 1996. 1449 – 74.
29. American Diabetes association. 2005. Disponible en: http://www. diabetes .org/ espanol / todo- sobre - la - diabetes/ complicaciones - neuropatia.jsp.
30. Investigación europea señala relación entre autoanticuerpos y complicaciones de la diabetes. Federación Mexicana de Diabetes. 19 de agosto de 2005. Disponible en: http://fm diabetes .com/www/ noticias .asp?Id =200508 23145 621.
31. Diabetes Care. Agosto de 2005. Reutes Health.
32. University of Chicago Hospitals. Medical Center. La neuropatía diabética (problemas de los nervios). Disponible en: http://www. uc hospitals .edu/ online -library/ content =S03466.
33. Biblioteca Virtual de Salud. Merck Source. Neuropatía diabética. Disponible en: http://www. merck source .com/ pplus/ cns/ cnsh ladam. jspzQzp qzEzzS zppdoc szSzus zSzcns zSz content zSzada mzSzes pzSzes pencyz Szati clezSz 000693 zPzhtm.
34. Vinic Al. Diabetic neuropathies. Med Clin Noth Am. 2004; 88(4): 947 – 99.
35. Roca Goderich R. Temas de Medicina Interna. 4a Edic. Edit. Ciencias Médicas. La Habana. 2002. T. 3: 211 – 52.
36. Wayna WD. Bioestadística: Bases para el análisis de las ciencias de la salud. 2 reimp. 3ed, Limusa Sa de CV, México, Grupo Noriega Editores; D,F. 1996.P.365.
37. Mateo de Acosta F, Padrón Durán M, Más Díaz . Manual de diagnóstico y tratamiento de la endocrinología y metabolismo. La Habana: Científico- Técnica, 1985-254.
38. Clasificación Internacional de Enfermedades y problemas relacionados con la salud. 10 Rev. Washington DC: Organización panamericana de la salud; 1995 t2-p. 129.
39. Revista Avances MEDICOS DE cuba año VII Nş 23-2000. Atención a la Diabetes Mellitus. Publicación trimestral de prensa latína, agencia informativa latinoamericana SA. P. 19-22,28-30.
40. Figuerola Pino D, Reynals de Blasis E, Ruiz M, Vidal Puig A. Diabetes Mellitus. En Farreras Rozman. MEDICINA Interna. 14 ed, sección 15. Capitulo 248- 2000 ediciones Harcourt, SA. www. Harcourt. Es.
41. Kimura J, Electrodiagnosis in disease of nerve and muscle principles and practice F.A. Davis, Philadelphia; 2002.
42. Franes Fischbach laboratory diagnostic. Philadelphia. USA. Ed. J.B. Lippincort company, 1992-p-296-307.
43. Hernández Solana G, ZALDIVAR Núñez C. Manual de práctica de laboratorio clínico. Ciudad de la Habana. Ed. Pueblo y educación; 1987.p. 39-49.
44. Comunicación personal Dra. Josefina Otero. Especialista de Segundo Grado en Laboratorio Clínico. Santiago de CUBA. Hospital Provincial Clínico-quirúrgico Docente Universitario “Saturnino Lora”.
45. Dotres Martínez, C, Pérez González, R Córdova Vargas, L y col. Programa nacional de prevención, evaluación y control de las enfermedades crónicas no trasmisibles- La Habana- MINSAP, 1998.
46. Urbano - Márquez A, Estruch Riba R, Alfaro Giner A y col. Neurología en Farreras Rozman C, ed Medicina Interna, 13Ş ed. Madris: Morhyl Doyma libros, 2000 : Vol 2: 1404-1408.
47. Barrer DJP, et al: Incidente of diabetes Amongst aged 18-50 years in nine british towns: A collaborative study. Diabetología 22: 421, 1998.
48. Chacón Viltres O. Caracterización clínico-epidemiológica de la Diabetes Mellitus (Trabajo para optar por el título de especialista de 1er grado en Medicina Interna); 1997. Hospital Provincial Docente Clínico – quirúrgico Universitario “Saturnino Lora”. Santiago de Cuba.
49. Collado Mesa F, Vidal Rivalta MG, Durruty Esparraguera V, Sancho Rivero ML, Montero Silva RM. Diabetes mellitus como causa básica de muerte. Rev. Cubana Endocrinol 1998, 9(3): 184-93.
50. Caballero Garzón LM. Modificación de conocimientos en pacientes diabéticos en un área de salud (Trabajo para optar por el Título de Especialista de Primer Grado en Medicina General Integral). 2000. Policlínico “Frank País”. Santiago de Cuba.
51. Lavaurt De la Uz I. Mortalidad por diabetes mellitus. provincia Santiago de Cuba 1989-1998 (Trabajo para optar por el Título de especialista de Primer Grado en Higiene y Epidemiología) 1999, Santiago de Cuba.
52. Castañeda Fernández JA: Causas de muerte y hallazgos necrópsicos en pacientes diabéticos tipo II (Trabajo para optar por el Título de especialista de Primer Grado en Medicina Interna). 1999. Hospital Militar Docente “Joaquín Castillo Duany”. Santiago de Cuba.
53. MINSAP. Indices Seleccionados de mortalidad. Ciudad de la habana 1998.
54. Silveira E, Silveira PR, Neuropatía diabética. J Bras Med 1998, 66(6). 80-106.
55. Muller Va, Ross IS, Klinger H, GEISENHEINER S. Quality of centralized diabetes care: a population based study in the Germany Democratic Republic 1999-2000. Acta diabetol 2003; 30: 166-172.
56. Resnick WR, Wintrobe MN, Doenças do Sistema nervosa periferico. En: Harrizon Tr. Medicina Interna. Editora McGraw - HiIl interamericana Brasil: 2001, Rio de Janeiro 14Ş edicto. Secao 3 2606 - 18.
57. Thomas PK. Classification, diferencial diagnosis, and staging of diabetic peripheral neuropathy. 2003, 46 suppl 2: 554-557.
58. Greene DA, Simes A, Pfeifer MA et al. Diabetic neurophatic. Ann Rev Med 2000, 41: 303 - 17.
59. Cabezas Cerrato, J. et al: Neuropatía Somática en la Diabetes Mellitus: Revisión y experiencias personales VII Jornada diabetológica. Madrid, España 1998.
60. Torres González A. Alteraciones vasculares y humorales diferenciales en pacientes diabéticos, hipertenos y diabéticos – hipertensos. (Trabajo para optar por el Título de especialista en Primer Grado de Medicina Interna); 2002. Hospital Provincial Clínicoquirúrgico Docente Universitario “Saturnino Lora”. Santiago de Cuba.
61. Bake Well S. The authonomic nervous system issue. 2005, Vol 5. Article 6:1 – 2.
62. Camilo J, Borrego A. Trastornos del Sistema Nervioso Autónomo. En: Uribe ES, Chacón AA, Pombo PL, Ed. Fundamentos de Medicina. 5ta ed. Medellín: Corporación para investigaciones biológicas, 2003: 455 – 58.
63. Boulton AJM, Malik RA. Diabetic neuropathy. Med Clin North Am; 82: 909 – 29.
64. Escobedo De la Peña J, Santos Borgoa C. La Diabetes mellitas y la transición de la atención a la salud. Salud PúblicaMex. 2005; 37(1): 37 – 45.
65. Sampson MJ, Wilson S, Karagiannis P et al. Progression of Diabetic autonomic neuropathy over a decada in insulin – dependent diabetics. Q J Med. 2000, 73; 635 – 46.
66. Chacra AR M. Sadeinsky, C. Orrelana Sáenez, M. Tagle Luzarraga. “Complicaciones tardías”, [Sección 11], en Orellana Sáenz C, Robalino Velazco J: Diabetología para el próximo milenio. Ediciones Orellana- Robalino, Quito, 1999; 184 – 213.
67. Ward JD. Biochemical and vascular factor in the patogénesis of diabetic neuropathy. Royal Hellemshire Hospital. Sheffield. United Kingdom. 2004. 190 – 235.
68. Fajardo Vega Y. Caracterización clínico – epidemiológica de la Diabetes Mellitus en un área de salud de Chivirico. (Trabajo para optar por el Título de especialista de Primer Grado en Medicina General Integral), 1999. Santiago de Cuba.
69. Organización Panamericana de la Salud/ Organización Mundial de la Salud. 39a Reunión del Consejo Diachvo. OPS/OMS. Washington, DC: OPS/OMS, 2004.
70. Neuropatía Diabética (daño nervioso) y diabetes. http://www. diabetes .org/ todo – sobre – la - diabetes / neuropatia - diabetica .jps
71. Declaración de las Américas sobre la Diabetes Mellitus. Panam Health of Bull. 1996; 30(3): 261 – 5.
72. Kanh BB. Type 2 Dibetes: when insulin secretion fail to compensate for insulin resistance cell. 2002; 92: 593 – 96.
73. Partanem J et al. Natural history of peripheral neuropathy in patients non – insulin – dependent. Diabetes Mellitus. N Engl J Med, 2005; 333: 89 – 94.
74. Organización Mundial de la Salud. Factores de riesgo de enfermedades cardiovasculares: nuevas esferas de investigación. Ginebra. Informe de un Grupo Científico de la OMS. Ser Inf Tecn, Nş 841, 2004.
75. Prijozhan OM. Lesión del Sistema Nervioso en la Diabetes Mellitus (neurodiabetología). 2a Moscu, Mir, 2003: 241.
76. Waxman SG: Patophysiology of nerve conduction (part 2): 297 – 301, 1998.
77. Landaborg L, Young J. Fisiología y farmacología del sistema nervioso autónomo. En: Isselbacher K, Braunwald E, Wilson JD, Martin J, Fauer A, Kasper D. Principios de Medicina Interna. 13a ed. España: Interamericana Mc. Grau – Hill, 2004: vol 1: 481 – 97.
78. American Diabetes Association. Standarized measures in Diabetic Neuropathy. Consensus statements. Diabetes Care. 2001, 19 (suppl 1) S72 – S79. Online: http://www. diabetes .org/ diabetes care / supplements /s72.htm.