Las quemaduras son lesiones hísticas de variable extensión y profundidad, que representan un sitio susceptible de colonización oportunista por microorganismos de origen exógeno y endógeno. La destrucción de la piel permite la invasión bacteriana y constituye un medio de cultivo ideal para estos microorganismos. Se realizó un estudio retrospectivo de 67 pacientes ingresados en la Unidad de Quemados del Hospital “Hermanos Ameijeiras”, en el período de enero de 2007 hasta diciembre de 2008, con el diagnóstico de quemaduras, a los cuales se les realizaron cultivos locales en el tejido dañado mediante el método de hisopado en la lesión por quemadura durante la segunda y tercera semana de evolución intrahospitalaria. Los gérmenes más frecuentes aislados en este período fueron los gram negativos: Pseudomona aeruginosa y el Staphylococcus aureus. La mayoría de los casos con cultivos positivos desarrollaron infección clínica local.
Infección local en la unidad de quemados del Hospital “Hermanos Ameijeiras”
Dra. Mayra Cecilia Hernández Collado. Especialista 1er Grado en Cirugía Plástica y Caumatología. Master en Ciencias
Dra. Luz Marina Miquet Romero. Especialista de 2º Grado en Cirugía Plástica y Caumatología. Master en Ciencias
Dr. Herman González Reyes. Especialista 1er Grado en Cirugía Plástica y Caumatología
Dr. Rafael Rodríguez Garcell. Especialista de 2º Grado en Cirugía Plástica y Caumatología. Master en Ciencias
Resumen
Las quemaduras son lesiones hísticas de variable extensión y profundidad, que representan un sitio susceptible de colonización oportunista por microorganismos de origen exógeno y endógeno. La destrucción de la piel permite la invasión bacteriana y constituye un medio de cultivo ideal para estos microorganismos. Se realizó un estudio retrospectivo de 67 pacientes ingresados en la Unidad de Quemados del Hospital “Hermanos Ameijeiras”, en el período de enero de 2007 hasta diciembre de 2008, con el diagnóstico de quemaduras, a los cuales se les realizaron cultivos locales en el tejido dañado mediante el método de hisopado en la lesión por quemadura durante la segunda y tercera semana de evolución intrahospitalaria. Los gérmenes más frecuentes aislados en este período fueron los gram negativos: Pseudomona aeruginosa y el Staphylococcus aureus. La mayoría de los casos con cultivos positivos desarrollaron infección clínica local.
Palabras clave: quemaduras, infección local.
Introducción
La atención al problema de la sepsis es de vital importancia para cualquier especialidad que tenga el reto de enfrentarse a ella. En las diferentes especialidades médico-quirúrgicas y en particular en el paciente portador de una lesión por quemaduras, la sepsis continúa siendo una complicación, a veces esperada, en la evolución de los pacientes críticos, cualquiera que sea la causa de esta condición.
Las quemaduras son lesiones hístico necróticas agudas, traumáticas, debido al efecto de una variación térmica local, que pueden provocar deterioro hemodinámico y afectación en diferentes órganos y sistemas de órganos si la extensión y profundidad del daño tisular es considerable (1,2).
Desde el punto de vista fisiopatogénico la enfermedad por quemaduras debe considerarse en dos aspectos íntimamente relacionados y mutuamente influyentes: el local, sitio de afectación primario y que por el compromiso del daño en extensión, expresa una Insuficiencia Cutánea Aguda, aumento de la permeabilidad vascular y edema, el otro aspecto a considerar es el impacto de la lesión a nivel sistémico induciendo además de los trastornos hemodinámicos iniciales, alteraciones metabólicas, nutricionales e inmunológicas en proporción a la gravedad de la lesión.
El cuadro clínico resultante de esta agresión en los pacientes con quemaduras extensas lo podemos describir en dos etapas: la primera caracterizada por el shock hipovolémico y por una marcada hipoproteinemia, (fase hipodinámica), que culmina una vez lograda la estabilidad hemodinámica; la segunda, caracterizada por inmunodepresión, hipermetabolia, catabolia y desnutrición (fase hiperdinámica); con un alto riesgo de sepsis, frecuentemente acompañado del Síndrome de Respuesta Inflamatoria Sistémica.
En 1833, Ballingall describía “…La muerte ocurre entre las 3era y 6ta semanas de la quemadura con el individuo "... hundiéndose en un estado turbulento, agotado por el profuso exudado del material de una extensa superficie supurada".
Sin embargo, independientemente de la introducción de avances médicos-quirúrgicos-farmacológicos, en el siglo XXI la “Sepsis para el Quemado constituye una Amenaza vital después de sobrevivir a la fase inicial de Shock / Resucitación”.
Se ha responsabilizado a la herida cutánea como el primer foco de sepsis, pero su importancia ha disminuido notablemente debido a significativos avances en el tratamiento de la herida: necrectomía e injertos precoces, antimicrobianos tópicos, vigilancia microbiológica agresiva y mejor uso de antibioticoterapia (3) Sin embargo, existen muchos elementos para prestar atención a factores endógenos como el fenómeno de la translocación bacteriana y de toxinas y el estado nutricional e inmunológico entre otros bien conocidos, y retomar con fuerza los criterios probados, demostrados y avalados por la historia de la medicina que en ocasiones por viejos no se valoran y que tiene que ver con los procesos higiénico - epidemiológico elementales cuya violación favorece la instalación de sepsis por vía exógena.
El tejido necrótico resultante de la quemadura constituye un sitio susceptible de colonización por bacterias tanto de origen endógeno como exógeno (4).
Este tejido es rico en proteínas coaguladas, se encuentra húmedo y, al ser avascular, la perfusión en la escara y tejidos próximos es claramente insuficiente dificultando la entrega de oxígeno, nutrientes y células fagocitarias al tejido localizado por debajo de la escara. Los antibióticos sistémicos tendrían igual grado de dificultad; en este sentido, la infección de la escara se comporta como un absceso.
Las condiciones locales son apropiadas para que aumente el número de bacterias y penetren a través de glándulas y folículos alcanzando el tejido viable; pudiendo ocurrir de forma secuencial o no lo descrito por Mc Millan: la colonización – infección no invasiva de la quemadura - infección invasiva de la quemadura sin bacteriemia - infección invasiva con bacteriemia y bacteriemias de otra etiología, y/o otras infecciones (5) en un paciente que evoluciona con un Síndrome de Inmunodeficiencia Adquirido por trauma.
El manejo de los pacientes con quemaduras ha evolucionado de tal manera que niños y adultos jóvenes pueden tener una sobre vida superior al 80% en quemaduras superiores o iguales al 70% de la superficie corporal (2), siendo la infección actualmente la principal amenaza vital en los pacientes que superan la fase vital de shock-resucitación; aunque clásicamente la herida cutánea ha sido el primer foco de sepsis, su importancia ha disminuido debido a significativos avances en el tratamiento de la herida (escarectomías e injertos precoces, antimicrobianos tópicos, vigilancia microbiológica agresiva, mejor uso de antibioticoterapia, etc) emergiendo la infección como foco séptico relevante y origen más frecuente de muerte por causa infecciosa.
Son varios los factores que favorecen el desarrollo de infecciones de los pacientes con quemaduras. La agresión térmica destruye la primera y más importante barrera defensiva del organismo, la piel y las mucosas, perdiéndose su protección mecánica, bioquímica (ácidos grasos) e inmunológica (secreción de IgA). Se pierde la flora normal de piel y mucosas abriendo paso a la colonización por gérmenes más virulentos. La perfusión en la escara y tejidos próximos es claramente insuficiente, dificultando la llegada de defensas humorales y celulares y de los antibióticos sistémicos, en este sentido, la infección de la escara de comporta como un absceso.
La incidencia de infección en los pacientes quemados varía mucho de unas unidades de quemados a otras y se haya claramente asociada al porcentaje de superficie corporal quemada (SCQ), así en pacientes con un porcentaje mayor de un 30% o 40% (6,7), la infección es la norma aumentando también con las edades extremas de la vida. Enfermedades concomitantes, etc.
Se deprime la respuesta inmune sistémica, de forma proporcional a la severidad de la agresión. Ésta afecta prácticamente a todos los componentes del sistema inmunológicos y se correlacionan con las complicaciones infecciosas y supervivencias de los quemados.
La infección de la herida por quemadura es de difícil interpretación, por ello debe ser monitorizado cualquier cambio que pueda reflejar infección. Son indicativos los cambios de color, la parición de eritema u edema violáceo en tejido normal circundante, la repentina separación de la escara, o la formación de nuevas escaras. La aparición de coloración verdosa sobre la herida o grasa subcutánea, o el desarrollo de ectima gangrenoso sugieren infección por pseudomona aeruginosa. Cambios en la temperatura corporal, hipotensión, taquicardia, confusión mental, neutropenia o neutrofilia, trombocitopenia y fallo renal, indican desarrollo de sepsis. Sin embargo, y debido a la profunda alteración que ocurre en la homeostasis por la quemadura en sí misma y la propia inflamación subyacente, la apreciación de estos cambios es compleja. (8)
Dada la dificultad de evaluar la herida por quemadura sobre la base de la observación clínica y los datos de laboratorio, la biopsia es necesaria para el diagnóstico de la infección. El momento de la toma de biopsias puede ser guiado por los cambios clínicos, pero muchos centros recomiendan tomarlas de forma rutinaria cada 48 horas. La muestra biopsiada debe ser examinada buscando evidencia histológica de invasión bacteriana además de cuantificarla microbiológicamente por cultivo (8).
No debemos olvidar que los cultivos obtenidos a partir de frotis de superficie únicamente son reflejo de la presencia de microorganismos del ambiente hospitalario, nos indican colonización nosocomial, pero no son indicativos de etiología infecciosa.
Aun así los cultivos rutinarios de la herida y vía respiratoria son esenciales, ya que permiten conocer la flora que coloniza al enfermo y orientan la antibióticoterapia precoz y efectiva cuando aparece la infección clínica. El aislamiento del paciente con quemadura se muestra como una medida eficaz en la prevención de las infecciones que sufre el paciente.
La presencia de gérmenes de origen endógeno en la colonización bacteriana de la quemadura, sobre todo enterobacterias gramnegativas, apoyan la idea de que la descontaminación digestiva selectiva puede ser útil en la disminución de las infecciones severas en pacientes críticos. Recientes estudios han demostrado la utilidad de ésta técnica en pacientes quemados.
No obstante, a pesar de adoptarse estrictas medidas de aislamiento, o descontaminación, no debe olvidarse que el paciente quemado está constantemente expuesto a multitud de gérmenes que llegan por diferentes vías. El uso correcto de la antibióticoterapia en estos pacientes, gravemente inmunodeprimidos, es esencial. Ningún antibiótico puede eliminar a todos los potenciales patógenos, y su uso injustificado solo consigue seleccionar gérmenes multirresistentes y hongos. No existe una pauta antibiótica universalmente eficaz; la elección dependerá de la situación clínica, flora y patrones de sensibilidad prevalentes en la unidad en cada momento, así como de los gérmenes aislados previamente en el paciente (8).
La antibióticoterapia profiláctica sistémica post-quemaduras está contraindicada, pues aumenta el riesgo de infecciones graves más precoces y por microorganismos resistentes. En principio solo está indicada la profilaxis antibiótica perioperatoria en dos situaciones: tras escarectomías y tras la realización de cierto tipo de injertos (8).
Utilizando como punto de partida la información presentada y sirviéndonos de referencia estudios previamente realizados y publicados sobre la infección y sepsis en esta Unidad de Quemados, pretendemos dar a conocer con éste trabajo el nivel de colonización y posible riesgo de infección del paciente quemado en nuestra unidad.
Marco teórico
La piel es uno de los mayores órganos del organismo y sólo el músculo la sobrepasa en peso y extensión. Su extensión es de 0.25 m² en el recién nacido y de 1.8 m² en el adulto. La piel normal cumple funciones de sensibilidad, protección del medio ambiente y termorregulación. La pérdida de una parte sustancial de la piel es incompatible con la vida.
La piel tolera la exposición corta a temperaturas hasta de 40°C, pero de allí en adelante el incremento de la temperatura resulta en aumento logarítmico de la lesión tisular, y a 70°C una exposición fugaz ya produce necrosis de la epidermis. (9)
Las quemaduras son lesiones producidas en los tejidos vivos, debido a la acción de diversos agentes que pueden ser esquemáticamente clasificados en agentes físicos (noxas térmicas, eléctricas y radiantes), agentes químicos y biológicos. (9-11) Todos ellos pueden provocar, desde alteraciones funcionales reversibles, hasta la destrucción tisular total e irreversible. Por ser la piel nuestra superficie de contacto con el medio externo, representa el principal órgano afectado.
La gravedad de la quemadura está determinada por la intensidad de la temperatura y por la duración de la exposición al agente causante. Tanto el espesor como la extensión de la quemadura definen el pronóstico del paciente.
Los mediadores inflamatorios son responsables tanto de la perpetuación y progresión de las alteraciones locales en la herida de la quemadura como de los aspectos deletéreos sistémicos, entre ellos el hipermetabolismo y el catabolismo exagerado.
El aumento generalizado de la permeabilidad capilar que se observa en las quemaduras, por la acción de agentes vasoactivos, resulta en grandes pérdidas del volumen circulatorio. El secuestro masivo de líquido en los tejidos produce una gran reducción del volumen circulatorio, con vasoconstricción e isquemia en ciertas regiones, especialmente en la circulación esplácnica.
La pérdida diaria de proteína por la herida llega a ser muy considerable y la migración transcapilar de proteínas induce enormes pérdidas proteicas en el líquido de edema, en las flictenas y en la secreción de la herida. (13)
Aunque el sangrado externo por quemaduras generalmente es modesto, hay pérdida considerable de glóbulos rojos por destrucción térmica directa, por trombosis y coagulación y por diapedesis a través de capilares de permeabilidad aumentada. Pero como la pérdida de plasma es proporcionalmente mayor, lo usual es que el paciente exhiba un hematocrito elevado.
Cuando el hematocrito desciende en forma significativa, es muy probable que se deba a hemorragia por lesiones asociadas. Tal situación se presenta en politraumatismos con ruptura del bazo, fracturas y lesiones graves de los tejidos blandos. Se debe establecer con precisión la causa de la hemorragia y administrar transfusiones para restaurar la volemia y prevenir el colapso circulatorio en preparación para operación de emergencia, lo cual tiene prioridad sobre el tratamiento de la quemadura, que bien puede esperar.
Otra causa frecuente de reducción del valor del hematocrito puede ser la hemorragia gastrointestinal por ulceración aguda o gastritis erosiva.
La quemadura real del árbol traqueobronquial es extremadamente rara, pero la irritación por inhalación de humo y gases calientes resulta en aumento de las secreciones y en espasmo bronquial. Muchas de las muertes consecuentes a incendios se deben a la inhalación de humo y de productos tóxicos de la combustión.
A las pérdidas de líquidos en el edema se añade la pérdida de agua por evaporación. Mientras un individuo normal evapora diariamente alrededor de 10 ml por kilogramo de peso, el quemado evapora entre 40 y 150 ml por kilogramo en cada 24 horas.
La quemadura produce profundas alteraciones en los mecanismos sistémicos de defensa del huésped, con disminución tanto de la inmunidad celular como del sistema inmunitario humoral, anergia a antígenos cutáneos de hipersensibilidad retardada y disminución de las inmunoglobulinas, especialmente de la gammaglobulina. La sepsis constituye la complicación más seria y la primera causa de morbilidad y mortalidad.
La presencia local de microorganismos puede ser simplemente colonización superficial de los tejidos quemados, o verdadera sepsis de la herida o sepsis de la quemadura. Esta se define como la presencia de más de 100.000 bacterias, o sea 105, por gramo de tejido. (14)
Los microorganismos invasores, que constituyen una verdadera infección mixta, son poco afectados por antibióticos administrados por vía sistémica, debido al carácter avascular e isquémico de la herida. La infección por virus resulta en las flictenas y lesiones dolorosas típicas del herpes simplex.
La incidencia de complicaciones sépticas es proporcional al área cutánea quemada.
El examen histológico por biopsia de la herida es el método más seguro y confiable tanto para diferenciar la simple colonización microbiana de tejidos no viables de la infección invasora de tejido viable, como para establecer el diagnóstico de infección invasora de la quemadura.
El tétanos puede acompañar a las quemaduras. Por ello se debe proceder a inmunizar al paciente en la misma forma que se hace con otros tipos de heridas mayores o de alto riesgo.
Una de las mayores causas de mortalidad por sepsis en los pacientes quemados es la tromboflebitis supurativa, entidad que constituye un estado séptico generalizado y causa embolias sépticas secundarias, con muy elevada mortalidad. La aparición de pus al exprimir el sector distal de la vena cateterizada es signo patognomónico y requiere resección inmediata y amplia de todo el trayecto venoso afectado, dejando abierta la herida.
La úlcera de Curling, o "úlcera de estrés", produce hemorragia, manifestada por hematemesis y/o melena, en un 10 a 20% de los pacientes con quemaduras graves. Con el creciente uso del fibroendoscopio se detectan lesiones en más del 80% de los pacientes con quemaduras severas. La administración rutinaria de agentes antiácidos y antisecretores ha logrado disminuir esta ominosa complicación.
El paciente con quemaduras extensas representa una víctima potencial de las alteraciones en la estructura pulmonar que llevan a la hipoxemia y a la falla ventilatoria, y que terminan con sepsis pulmonar y un cuadro generalizado de consolidación bronconeumónica, el grave síndrome de insuficiencia respiratoria aguda del adulto.
Aunque parezca evidente, frente a todo paciente quemado es esencial hacer un diagnóstico correcto de la lesión, el que incluye, profundidad, extensión, localización y agente etiológico.
La profundidad determina la evolución clínica que seguirá el proceso. Existen varias clasificaciones que intentan ordenar y simplifica una realidad compleja y dinámica. Los elementos que se utilizan para su clasificación, incluyen la indemnidad de la membrana basal, la permeabilidad de los plexos dérmicos, la conservación de las terminaciones sensitivas. Una de las clasificaciones más utilizada en nuestro medio es la de Benaim, que las divide en 3 tipos (12)
Quemaduras tipo A. Afectan la epidermis y en ocasiones la dermis papilar, pudiendo dividirse en 2 tipos. Las quemaduras A eritematosas, en que hay vasodilatación del plexo dérmico superficial, observándose la piel enrojecida, seca y turgente. Hay irritación de las terminaciones nerviosas que producen escozor, prurito y dolor. La conservación de la capa germinativa permite la epitelización en 7 a 10 días. Es la típica quemadura solar de playa. Las quemaduras A flictenulares en que, además de la vasodilatación, se produce un aumento de la permeabilidad del plexo dérmico superficial, con formación de flictenas y edema. Existe eritema cutáneo y la irritación de las terminaciones nerviosas hace que sean muy dolorosas. Reepitelizan en 10 a 14 días.
Quemaduras tipo AB. Existe destrucción de la epidermis y de la dermis papilar, conservándose la dermis reticular y las porciones profundas de los anexos cutáneos. El plexo dérmico superficial se trombosa y el profundo se encuentra vasodilatado y con aumento de la permeabilidad. Presenta un aspecto blanquecino, que al cabo de 10 días forma una escara intermedia. Las terminaciones nerviosas superficiales también reencuentran comprometidas, por lo que son poco dolorosas. Su evolución es dinámica y de acuerdo al potencial de regeneración de los anexos remanentes, pueden evolucionar a la epidermización (ABA) o a la profundización (ABB). Las que epidermizan lo hacen en plazos de 14 a 21 días, sin embargo, el epitelio es frágil y el resultado estético es regular.
Quemaduras tipo B. Existe destrucción total de la piel incluyendo anexos, trombosis de los plexos dérmicos superficial y profundo y de las terminaciones nerviosas, por lo que son indoloras. La piel está acartonada, dura, sin turgor y tiene un color blanco grisáceo, originando una escara.
Otra clasificación ampliamente empleada es la de Converse, que divide a las quemaduras en grados (13). Las de primer grado equivalen a las quemaduras tipo A eritematosas de Benaim. Las de segundo grado superficial equivalen a las tipo A flictenulares. Las de segundo grado profundo equivalen a las tipo AB y las de tercer grado equivalen a las tipo B. Ocasionalmente se habla de quemaduras de cuarto grado, correspondiendo al compromiso hasta el plano óseo.
La extensión debe determinarse con la mayor exactitud posible, ya que de ella depende en gran parte la posibilidad de shock y compromiso sistémico del paciente, siendo además un criterio básico para establecer el pronóstico vital. La extensión se expresa como porcentaje de superficie corporal quemada y para su cálculo puede emplearse la fórmula de Pulasky-Tennison (regla de los 9), la regla de la palma y dedos de la mano (1% de la superficie corporal) y diagramas de superficie corporal (Ejemplo: Lund y Browder) (13,14).
La localización tiene gran importancia en el pronóstico estético y funcional, pudiéndose diferenciar zonas especiales, que son todas aquellas potencialmente productoras de secuelas y que no podrían ser áreas dadoras de injertos.
Estas corresponden a los pliegues de flexión, cara y cuello, manos y pies, mamas, genitales y regiones periorificiales. Las zonas neutras o generales, son aquellas que tienen poco movimiento, con menos posibilidades de retracción y, por lo tanto, de secuelas funcionales y que no comprometen áreas estéticamente importantes. (12)
Finalmente debe establecerse el agente etiológico y las circunstancias en que se produjo la quemadura, ya que de ellos dependerá en gran medida el enfoque terapéutico. Estos factores pueden además tener importantes repercusiones médico legales.
La respuesta fisiopatológica del paciente quemado es compleja y dinámica. El daño causado depende de la cantidad de energía involucrada, del tiempo de acción y de las características de la piel afectada, siendo mayor el daño, mientras más delgada sea la piel.
Las alteraciones locales causadas por la quemadura afectan primariamente a los plexos dérmicos y que, de acuerdo a su magnitud, pueden corresponder a vasodilatación que se traduce en eritema; aumento de la permeabilidad vascular que lleva a la formación de flictenas y exudación y coagulación intravascular causando necrosis. En las quemaduras pueden diferenciarse tres áreas concéntricas. Centralmente existe la zona de coagulación o de necrosis. Alrededor de ella, está la zona de éstasis, que presenta alteraciones de la microcirculación.
Finalmente el área más periférica es la zona de hiperemia, en que existe vasodilatación. La evolución de zona de estasis depende en gran medida de la reposición hidroelectrolítica inicial.
En quemaduras de mayor gravedad se produce una respuesta sistémica, debido a la liberación de numerosas sustancias vasoactivas que entran a la circulación (catecolaminas, glucocorticoides, vasopresina, angiotensina, interleuquinas, etc). Estas alteraciones tienen su máxima expresión en el denominado gran quemado, término que se aplica cuando existe una extensa superficie quemada, en general sobre 20%, produciéndose una desestabilización grave del medio interno que requiere medidas de tratamiento intensivo.
Según Benaim, los períodos evolutivos que caracterizan a las quemaduras de mayor gravedad pueden dividirse en período de reacción inmediata, caracterizando por una gran descarga de adrenalina. Período de alteraciones texturales y humorales que se refiere a los cambios que se producen en el espacio extracelular denominados alteraciones humorales y en los diferentes órganos llamados a su vez alteraciones texturales y que duran alrededor de 1 semana. Período intermediario se inicia a partir de la segunda semana, caracterizándose por un estado hipercatabólico y que termina cuando se ha cubierto toda la superficie cruenta. Finalmente el período de recuperación que comienza cuando no quedan superficies cruentas, siendo importante la rehabilitación funcional, estética y sicológica, completándose con la reincorporación del individuo a la sociedad (12).
La investigación sobre la infección del lugar de la quemadura ha demostrado que aún contando con los mejores recursos disponibles, la colonización de la misma ocurre siempre entre el 7 y el 10 día del evento (14,15). La flora del lugar de la quemadura puede cambiar, pero no eliminarse. Los agentes colonizantes particulares varían, de acuerdo a la situación del medio donde se atiende la quemadura, pero es imposible esterilizarla completamente. En cualquier caso, se ha demostrado que en la producción de infección, es más importante la disminución de la resistencia del huésped que la virulencia del agente involucrado. Prácticamente todos los mecanismos inmunológicos han demostrado estar alterados en los pacientes con quemaduras severas. Sin embargo, de todos ellos, el deterioro en la migración, quimiotaxis y fagocitosis de los polimorfonucleares neutrófilos parece ser el mecanismo más importante. (15)
Usualmente, con terapéutica adecuada, la mayoría de estas alteraciones son de corta duración, pero a veces, pueden persistir por más tiempo. La inmunosupresión es de mayor magnitud en pacientes ancianos, en quemaduras extensas y cuando existe infección asociada.
El "paso de bacterias endógenas viables a partir del tracto gastrointestinal, a través de la barrera mucosa, a los ganglios linfáticos mesentéricos, sangre y otros órganos extraintestinales" se conoce como translocación bacteriana (16). Se ha demostrado que este fenómeno ocurre en las quemaduras y que puede ser responsable de sepsis persistente, disfunción orgánica múltiple e infección de la quemadura. Esto se debe a que la injuria térmica ocasiona también alteraciones del tracto digestivo gastrointestinal. Por los tanto los tres requisitos para que ocurra translocación bacteriana se presentan en las quemaduras: alteración de la barrera mucosa digestiva, deterioro de las defensas del huésped y sobrepoblación bacteriana.
Todos estos factores se agravan cuando se asocian los trastornos metabólicos y nutricionales con los que evoluciona una lesión por quemadura y el grado de influencia de los mismos se encuentra en relación directa con la edad y el porcentaje de superficie corporal involucrada en la quemadura (16).
La fuente principal de la infección de la quemadura está constituida por el tejido necróticoy los gérmenes invaden en profundidad a la misma para producir infección clínica. (16)
Las manifestaciones clínicas de la infección de la quemadura pueden dividirse en sistémicas y locales. Dentro del cuadro sistémico deben alertar la fiebre ó hipotermia, la taquicardia no explicada, el aumento de la frecuencia respiratoria, el dolor tardío en la zona de la quemadura, el íleo, la desorientación, la oliguria y la leucocitosis ó leucopenia. La expresión clínica de la sepsis local puede ser muy florida y alarmante por los cambios bruscos en las características del tejido lesionado; pueden ir desde cambios de coloración con secreción purulenta hasta profundización de la lesión. Aunque muchas veces indistinguibles, pueden existir datos que permiten diferenciar la infección de la zona de la quemadura dependiente de gérmenes gram positivos en contraparte con los gram negativos (principalmente pseudomona).
Existen claros signos histológicos que indican infección de la quemadura: la presencia de bacterias en tejido viable ó densos acúmulos en la subescara ó rodeando folículos pilosos y glándulas sudoríparas, una gran reacción inflamatoria, el hallazgo de tejido hemorrágico cerca de zonas viables, la trombosis isquémica de pequeños vasos y la necrosis isquémica de tejido no injuriado. Las inclusiones intracelulares deben alertar sobre la posible existencia de una infección viral. Los hallazgos patológicos de biopsias de quemaduras permiten clasificar el estadio infeccioso de la misma y ayudan en diagnóstico de infección invasora. (17)
No existe un único método totalmente confiable por sí mismo en diagnosticar infección de la quemadura. Deben sumarse el cuadro clínico, los hemocultivos, el cultivo cuantificado de la biopsia de la quemadura y la histología particular. Como siempre en medicina, no existe sustituto alguno para el interés y diligencia del personal de salud comprometido en evaluar los sitios injuriados diaria y exhaustivamente.
Si bien es cierto que los cultivos superficiales de la zona de la quemadura pueden indicar un índice global de la prevalencia y de los agentes bacterianos comunes en la Unidad de Quemaduras, no predicen con certeza en qué caso se trata de colonización ó de infección microbiana invasiva. (17,18) Reportaron la utilidad de los cultivos bacterianos cuantificados de biopsias de quemaduras en lograr esta diferenciación. Así, un cultivo bacteriano < 105 por gramo de tejido excluye la infección invasiva de la quemadura, y es consistente principalmente con colonización de la misma. Cultivos 105 / gm de tejido se asocian en 50 - 70% de casos con verdadera infección de la quemadura. Por lo tanto, más importante que un sólo cultivo cuantificado aislado, lo es el seguimiento de los mismos junto con el de los otros medios diagnósticos ya presentados. Se recomienda, por tanto, que un seguimiento con de este tipo se efectúe de manera interdiaria, sobre todo en quemaduras severas. Además, procedimientos laboratoriales rápidos pueden dar claves diagnósticas en menos de 24 horas, con el consiguiente beneficio del tratamiento específico oportuno.
La infección es la principal causa de muerte en quemados, siendo las superficies cruentas su origen más frecuente, por sobrecrecimiento de flora endógena o por contaminación externa. Otras infecciones en estos pacientes tienen como puertas de entradas las vías centrales u otros catéteres endovenosos, la soda vesical, el tubo endotraqueal, etc. En cualquier caso, una de las acciones más eficaces para evitar las infecciones en los pacientes quemados es el tratamiento correcto de las quemaduras: utilizando de forma adecuada los antisépticos tópicos, planteando correctamente la eliminación de las lesiones térmicas quirúrgicas y cubriendo precozmente las superficies cruentas. (17)
- Clínica: La inspección de la quemadura y otros lechos cruentos es una práctica básica para detectar una infección local. Los signos inflamatorios y los exudados malolientes son datos que han de hacer sospechar la presencia de microorganismos. El dolor y los cambios de color del tejido sano circundante también sugieren infección local.
- Cultivo microbiológico y biopsia de piel: La sospecha clínica de infección de una zona cruenta (quemaduras, superficies desbridadas, zonas donantes, etc.) debe acompañarse de la toma de muestras para cultivo (exudados y biopsias) seguido de un tratamiento antiséptico empírico tópico más agresivo: utilización de antisépticos de amplio espectro, aumento de la frecuencia de las curas, etc.
Si la infección local se acompaña de signos de sepsis, se iniciará antibioticoterapia sistémica intravenosa empírica de amplio espectro hasta tener disponibles los resultados de las pruebas microbiológicas en la que se especificarán, además del antibiograma, la sensibilidad de los diferentes a antisépticos tópicos. Estos resultados permiten pautar tratamientos intravenosos y locales más específicos para el control de las infecciones en estos pacientes.
- Microorganismos: El detritus tisular que forma la quemadura, junto al exudado producido por la misma, favorece la formación de un microclima idóneo para el sobrecrecimiento de saprofitos de la piel, así como para la proliferación de patógenos exógenos.
Factores dependientes del paciente quemado que influyen en el desarrollo de la infección
En los pacientes quemados, se producen una serie de fenómenos que favorecen la infección (18).
- Destrucción de las barreras mecánicas (piel y mucosas) a los microorganismos. Barreras que no sólo actúan mecánicamente, sino que también impiden o, dificultan la adherencia y multiplicación de los gérmenes, mediante descamación, emisión de ácidos grasos (que inhiben el crecimiento de los microorganismos, sobre todo si son Gram positivos), IgA secretoria, etc.
- Destrucción de la flora residente (flora de nuestra piel y mucosas) que inhibe por competencia nutritiva, bacteriocinas, etc. la implantación de otra flora distinta.
- Pérdidas proteicas. Estas barreras destruidas permiten pérdida de proteínas, anticuerpos, factores de coagulación, etc., y además, sus restos constituyen un buen caldo de cultivo de los microorganismos.
- Disminución de inmunoglobulinas, aunque la más afectada es la IgG, bien por acumulación de ésta en el epitelio quemado tras su extravasación, bien por pérdida, etc. Además también están alteradas en su funcionalidad, con buena respuesta a unos antígenos, pero no a otros (19).
- Disminución de fibronectina, glicoproteína que se encuentra en el plasma y en la matriz extracelular de muchos tejidos. Se comporta como opsonina frente a S. aureus y es necesaria para un adecuado funcionamiento reticuloendotelial. Es característico su descenso en estadios presépticos de estos pacientes.
- Consumo de complemento, pues los productos de la quemadura activan la vía alternativa del complemento, produciendo una depleción de factores. Además, el sistema también funciona anormalmente. Por último, todo ello produce una disminución en la activación de los macrófagos (20).
- Alteración de la inmunidad celular, como lo demuestran varios hechos:
· Retraso en el rechazo de injertos, lo que puede aprovecharse para cubrir temporalmente la superficie quemada, con aloinjertos, a pesar de ser preferibles los homo o autoinjertos.
· Reducción de la respuesta a diversos antígenos y a mitógenos.
· Si bien el número de linfocitos T y B es normal, la relación T4/T8 está disminuida (inmunodepresión).
Se cree que toda la alteración funcional de los linfocitos se debe a productos derivados de la quemadura que circulan por el plasma (de aquí que se intente su elimiríación por plasmaféresis).
- Reducción y déficit funcional de las células fagocíticas: los neutrófilos están parcialmente desactivados, como demuestra la pérdida de granulaciones, déficit del quimiotactismo y motilidad, reducción de lisozima en los gránulos así como de la producción de peróxido de oxígeno y superóxido, disminución de la capacidad de agregación de los leucocitos, etc.
Todo esto aparece con mayor frecuencia en pacientes con superficie corporal quemada mayor del 40% (7), aunque no se conoce bien el factor o factores presentes en el suero de los quemados que originan estos déficits (21,22).
Clasificación clínica y microbiológica de las infecciones en el paciente quemado
Es difícil al haber grandes diferencias en la superficie y profundidad de las quemaduras de distintos pacientes, así como en diversas zonas de un mismo paciente; además, a veces evolucionan peor zonas aparentemente sanas que otras con descarga de material purulento. Por último, las infecciones en quemados pueden proceder no de la quemadura, sino de las diversas instrumentaciones y manipulaciones necesarias para el tratamiento del paciente.
Aunque no hay un acuerdo unánime en las definiciones de las infecciones de estos pacientes, creemos que la clasificación de Mc Millan (22) es útil y pedagógica.
- Infección no invasiva de la quemadura: Suele ocurrir en gran parte de los quemados, en alguna zona de la superficie traumatizada. En general se trata de una sola bacteria, que a veces permite el crecimiento de otras bacterias u hongos en muy pequeño número. Esto puede diferenciar de la colonización de la quemadura, realizada generalmente por varias bacterias sin un claro predominio de ninguna. En nuestra experiencia (23) produce el 50-55% de las infecciones en «quemados críticos» y casi el 100% de las infecciones en «quemados no críticos».
La escara desvitalizada puede contener desde unas pocas potencias de 10, hasta 101° microorganismos por gramo de tejido, sin evidencia de invasión. Sin embargo, cuando esta infección local sobrepasa las defensas del sujeto, la infección se hace invasiva. Este gran número de bacterias sobre la escara origina (por los enzimas de degradación que producen) la hidrólisis de aquella. También puede dar síntomas sistémicos, si emiten toxinas que atraviesan el tejido de granulación y pasan a circulación general.
Los criterios de esta infección no invasiva, varían con la edad, tamaño y profundidad de la quemadura, pero, en general, se caracteriza por una rápida separación de la escara muerta o gran exudación de la zona quemada. Los recuentos bacterianos en biopsias de la escara son superiores a 105 gérmenes/gramo, mientras que las del tejido sano adyacente ofrecerán recuentos inferiores a dicha cifra. Los síntomas son moderados: picos bajos de fiebre y leucocitosis ligera sin desviación izquierda. El control de esta infección hace que no progrese a la fase siguiente.
- Infección invasiva de la quemadura sin bacteriemia: Se considera que existe invasión, cuando en biopsias del tejido sano contiguo a la quemadura, existen más de 105 bacterias/gramo (pudiendo llegar a 10'° ó 10' l). El estado clínico del paciente varía según el género y especie invasora. En general, el tejido de granulación está edematoso, pálido y evoluciona a seco, costroso y necrótico, en un enfermo que previamente había presentado un drenaje abundante por la quemadura (en esta evolución participan las trombosis de los vasos que irrigan la zona). Los picos febriles son abundantes y hay leucocitosis con desviación izquierda. En casos muy graves, la temperatura y los leucocitos pueden estar por debajo de la normalidad, el paciente responde cada vez menos y puede llegar al shock séptico.
Todo este cuadro clínico ocurre sin confirmación de microorganismos en sangre, y puede deberse (24) a la difusión de toxinas desde las bacterias. Esta infección requiere un vigoroso tratamiento, pues muchas veces conduce a septicemia, siendo difícil separar ambos tipos de infección, pues no siempre que existe bacteriemia puede confirmarse esta bacteriológicamente, como referiremos en el punto siguiente.
3. Infección invasiva con bacteriemia y bacteriemias de otra etiología: Puede originarse desde una escara colonizada (vía linfática) o tras una infección invasiva. También las bacterias pueden alcanzar directamente los vasos por instrumentación, etc., realizada en la zona quemada o en una adyacente. En nuestra experiencia (23) estas infecciones suponen el 30-35% de todas las detectadas en nuestros pacientes críticos, y son prácticamente inexistentes en quemados no críticos.
La clínica es similar a la de la infección invasiva sin bacteriemia pero con hemocultivos positivos. Para su diagnóstico deben realizarse hemocultivos seriados en los picos febriles, y a pesar de todo, no siempre se pueden recuperar los patógenos, pero suele haber una correlación entre hemocultivo positivo y clínica de sepsis.
4. Otras infecciones: Son menos frecuentes. En nuestra unidad constituyen el 1520% del total de las infecciones (23).
4.1. Infección respiratoria: Al mejorar la terapia y por ende la supervivencia de los quemados, da tiempo a que se manifiesten los problemas respiratorios, sobre todo los derivados de inhalación (24), de ahí que se observen dichos problemas con creciente frecuencia.
En estos pacientes (aún sin síndrome de inhalación) hay en primer lugar una hiperventilación que posteriormente evoluciona a hipoventilación, originando atelectasias y, a veces, bronconeumonías (24), a lo que contribuye la menor movilidad de la caja torácica, descenso de la función mucociliar y destrucción de las vías aéreas. En la inhalación, además de lo anterior, contribuyen a la obstrucción, los productos de ésta.
No hay que olvidar que otro origen de la infección pulmonar puede ser una tromboflebitis infectada (25) que produce una diseminación hematógena de microorganismos.
4.2. Tromboflebitis infectada: Puede constituir hasta el 5% de las infecciones (11), con gran mortalidad. Puede producirse en los vasos traumatizados por el calor. electricidad, etc., o bien, a partir del lugar de perfusión de líquidos intravenosos, si no se toman las medidas adecuadas (26-27).
4.3. Endocarditis: En hemocultivos positivos reiterados sin otra fuente (venosa o en zona quemada), o bien modificación de los ruidos cardíacos. Una ecocardiografía puede confirmar el diagnóstico.
4.4. Polimiositis: En quemados de origen eléctrico (estos pacientes también pueden tener infecciones secundarias en vísceras dañadas por el trauma eléctrico).
4.5. Condritis supurativa: Sobre todo el cartílago auricular. El reblandecimiento y asimetría del cartílago de la oreja quemada sugieren el diagnóstico. Si no se detiene la infección puede progresar a mastoides y producir absceso intracraneal.
4.6 Infección ocular: Si hay ulceración o perforación de la córnea, pueden infectarse con mucha facilidad.
Patógenos: evolución y tipos
Evolución:
En la época preantibiótica, el mayor agente patógeno en estos pacientes era el Streptococcus B-hemolítico grupo A (o S. pyogenes). A partir de 1945, con el uso de la penicilina, desaparece como patógeno principal. Después (años 50), S. aureus y bacilos Gram negativos son los que producen la mayor parte de las infecciones en quemados, y más, tras el tratamiento con sulfamidas. El S. aureus podía recuperarse hasta del 75% de los pacientes que morían de septicemia. (28,29)
En la década de los 60, Pseudomonas aeruginosa se convierte en el patógeno principal de las quemaduras, desplazando a los gérmenes más prevalentes en la década anterior, fruto de la selección originada por los antibióticos de amplio espectro.
A las Pseudomonas se unen en la siguiente década, S. aureus meticilinresistentes, Cándida y hongos ambientales (mucor, Aspergillus). También se observan infecciones por virus como herpesvirus. Todo ello se debe a una mayor presión antibiótica. (30)
En la actualidad, por último, tenemos como principales agentes patógenos Pseudomona aeruginosa (muchas veces polirresistente), Staphylococcus aureus meticilinresistentes, enterococos, enterobacterias con gran resistencia a antibióticos y hongos, sobre todo del género Cándida; todos estos microorganismos suelen aislarse más, tras terapias prolongadas o con antibióticos de amplio espectro. (31)
Principales tipos de agentes patógenos
Streptococcus pyogenes: Su incidencia es muy reducida en la actualidad. Sin embargo es un microorganismo muy transmisible y puede originar infecciones letales.
El principal factor predisponente es que el propio enfermo sea portador orofaríngeo de S. pyogenes. De aquí que lo más frecuente es que se tenga endemias y no epidemias (asociadas estas a portadores entre el personal sanitario).
La clínica consiste en un rápido deterioro de la quemadura, con dolor, enrojecimiento, induración e inflamación. Aparece un borde rojo, que se extiende desde el margen de la quemadura e invade tejido normal. A las pocas horas comienza con síntomas sistémicos: fiebre alta, taquicardia, leucocitosis con desviación izquierda (aunque todo esto ocurre en situación preterminal).
Staphylococcus aureus: Staphylococcus aureus es un microorganismo de virulencia moderada pero fácil transmisión, por lo que puede infectar o colonizar gran número de enfermos, e incluso sobrevive mucho tiempo en los fómites (por lo que estos pueden ser vehículo de infección). Sin embargo, la principal vía de transmisión cruzada es a través de las manos del personal sanitario. Por otra parte, también el personal sanitario puede ser fuente de Staphylococcus aureus-que infecte á enfermos. Pero,-en general, las infecciones endógenas, en las que el paciente se autoinfecta con su propia flora, son mucho más importantes, por su frecuencia, que las cruzadas.
La clínica de infección de la quemadura por Staphylococcus aureus es insidiosa, excepto si se trata de infección invasiva, produciendo rápida disolución del tejido de granulación, fiebre, leucocitosis, desorientación severa y a veces, íleo paralítico. Puede sobrevenir shock, pero no siempre es de etiología infecciosa en este tipo de enfermos.
Un factor importante que predispone a la infección por estas bacterias es la deficiente función antiestafilocócica de los neutrófilos del paciente quemado, y más en pacientes con superficie corporal quemada mayor del 30% (6).
Pseudomona aeruginosa: No es un germen con gran patogenicidad, pero por la posibilidad de crecer en cualquier zona húmeda, con sólo trazas de materia orgánica, y su gran resistencia a antibióticos, se convierte en un patógeno oportunista típico, que infecta a quemados, sobre todo en la fase de inmunosupresión. Los factores predisponentes a estas infecciones desde el punto de vista inmunológico son: anormalidad en la función de los neutrófilos, déficit de opsoninas y consumo del complemento (que suele ocurrir en las quemaduras y más si están muy colonizadas por Pseudomonas). Además de la gran capacidad de supervivencia, ya comentada, este microorganismo produce un gran número de factores patógenos (exotoxinas, endotoxinas, estearasas, factores de difusión, leucocidinas, proteasas, etc.) por lo cual, si producen infección invasiva, ésta puede ser devastadora.
La fuente de Pseudomonas aeruginosa suele ser el tracto gastrointestinal de los propios enfermos. También pueden aislarse Pseudomonas del entorno del quemado, pero, en general, estas cepas son distintas de las que han originado infecciones en la unidad. Pero hay dos fómites que pueden participar como vehículos de infecciones cruzadas (e incluso como reservorio de Pseudomonas): el equipo de hidroterapia y el respirador. Se evita añadiendo lejía tras el baño de cada enfermo, en el primer caso, y con desinfección y reposición diaria de tubuladuras y limpieza y llenado diario del frasco humidificador (27). Si exceptuamos los dos fómites comentados, la vía general de transmisión cruzada de estos gérmenes son las manos del personal sanitario.
La clínica típica de infección de quemadura por Pseudomonas consiste en el desarrollo en aquella de un pigmento verde, con descarga de material purulento durante 2-3 días. Después, la escara se seca y la infección avanza al tejido de granulación previamente sano, donde también origina exudación verdosa. Tras esto, se decolora y aparecen áreas de necrosis. En zonas alejadas de la quemadura infectada pueden desarrollarse áreas necróticas (ectima gangrenosum), que indican septicemia. En todo este proceso, la temperatura es normal o incluso subnormal, y el paciente está bien orientado hasta el estadio terminal.
Otros gramnegativos: Según McManus (6), producen el 16% de las infecciones invasivas, aunque, en general, no son muy patógenos, por lo que para originar infección, el sujeto debe estar en inmunosupresión, difundiendo desde su hábitat normal (tubo digestivo) tras una selección por terapia antibiótica.
La difusión entre enfermos se hace preponderantemente por las manos del personal sanitario, aunque pueden colaborar algunos fómites como el equipo de hidroterapia mal desinfectado.
Los factores favorecedores de infección son similares a los de las Pseudomonas: un déficit funcional en los neutrófilos, anticuerpos y complemento. La clínica consiste en un deterioro del tejido de granulación que sé hace edematoso y pálido; si la infección se difunde a sangre, aparece gran aumento de temperatura y leucocitosis. En estadios terminales puede observarse lo contrario: leucopenia e hipotermia.
Anaerobios: Poco frecuentes, se observan más frecuentemente en quemados de origen eléctrico.
Hongos: Producen el 10-15% de las infecciones (23) y éstas se han distribuido de forma similar entre quemaduras y septicemias: Como refiere Me Millan originan con bastante frecuencia infecciones invasivas (20%). (23)
Los factores predisponentes principales de la infección fúngica son la inmunosupresión (sobre todo en linfocitos T4) y la terapia prolongada con antibióticos, y más, si son de amplio espectro, pues en el intestino suprimen la flora normal y permiten un sobrecrecimiento de levaduras. Otros hongos como Mucor, Aspergillus, etc. tienen origen ambiental, y si bien son muy poco frecuentes, cuando originan infección ésta es muy grave.
Las septicemias pueden originarse bien en la quemadura, desde la que invade el tejido sano y por ende los vasos sanguíneos, bien desde el tubo digestivo sobrecolonizado por estos microorganismos. La invasión de hongos desde la quemadura se diagnostica por visualización de las hifas en biopsias del tejido sano adyacente.
La clínica es poco llamativa, sin modificación de la temperatura ni leucocitosis. Sólo se sospecha, al ver un tejido de granulación seco, plano y de color amarillento o naranja.
Virus: Se han descrito herpesvirus y citomegalovirus, como en otros inmunodeprimidos, pero su significado patogénico real no se conoce (1). La mayoría de estas infecciones son autolimitadas y desaparecen en 7-10 días (32).
Básicamente, existen dos modalidades de manejo de la herida:
El método cerrado u oclusivo, cuyo objeto es la protección y aislamiento de la herida, la absorción de secreciones, la inmovilización y el control del dolor. Numerosos materiales se encuentran hoy disponibles para el vendaje de las quemaduras, entre ellos los hidrocoloides, poliuretanos, hidrogeles y el alginato de calcio. Las vendas oclusivas de gasa se aplican sobre un antibiótico tópico, el cual es muy efectivo en cuanto a la prevención de la infección. El más usado en nuestro medio es la sulfadiazina de plata, cuyo bajo costo y alta potencia bactericida la hacen un material preferido.
El método abierto o de exposición se basa en el principio de permitir la formación de una costra o coágulo que se convierta en la barrera protectora de la herida. Es particularmente útil en las quemaduras de la cara y del periné, y en general ahorra tiempo de enfermería. El agente tópico (sulfadiazina de plata o similar) es aplicado tres veces al día sobre la quemadura. El paciente es acostado sobre sábanas estériles y cubierto con una tienda o techo de sábanas extendidas entre las barandas de la cama. Hay gran tendencia a la hipotermia, por lo cual este método requiere control de la temperatura ambiente mediante calefacción artificial. (14)
Cualquiera que sea el método, la quemadura debe ser cubierta con un antibiótico o un agente antibacteriano de aplicación tópica, destinado a prevenir o controlar la infección de la herida. Debe tenerse en cuenta que todos los antibióticos de uso tópico retardan el proceso de cicatrización. Por ello algunos de los nuevos agentes, algunos impregnados de colágeno y de factores de crecimiento tisular, han merecido justificado interés. (14)
La persistencia de una herida no cicatrizada determina la evolución final del paciente. En efecto, es la herida abierta la que perpetúa alteraciones metabólicas, compromete los mecanismos inmunitarios, induce depleción proteica y desnutrición y abre las puertas para la sepsis que desemboca en la falla orgánica múltiple, común denominador de las muertes en los pacientes con quemaduras severas. Por ello, los pacientes con quemaduras deben ser tratados por medio de una pronta resección de los tejidos necróticos, seguida del cierre inmediato de la herida.
Problema científico
¿Cómo se comporta la flora bacteriana local en los tejidos quemados?
Objetivos
Objetivo general: Determinar el tipo de flora bacteriana presente en el tejido lesionado por quemaduras y su asociación con la infección clínica.
Objetivos específicos:
- Identificar los gérmenes aislados con más frecuencia en el tejido quemado.
- Determinar si existe asociación entre la presencia de gérmenes y la infección clínica de la lesión por quemadura.
Material y método
Se realizó un estudio transversal, descriptivo, en la Unidad de Quemados del HHA en el periodo comprendido entre Enero del 2007 y Diciembre de 2008.
- Criterio de Inclusión: Pacientes con el diagnóstico de quemaduras dermo-hipodérmicas.
- Criterio de exclusión: aquellos pacientes que ingresaron con zonas cruentas producidas por otras causas.
La fuente de información consistió en la revisión del libro de ingreso de la unidad. Luego de obtener el dato primario, se revisaron los informes del Comité de Infecciones, las planillas de los protocolos de atención al quemado, y el mapa microbiológico de la sala confeccionado por el departamento de microbiología mediante el programa GALEN de SOFTEL. Se seleccionaron 67 historias clínicas pertenecientes a pacientes ingresados.
En cada paciente se controlaron las siguientes variables
Demográficas:
- Edad: en años
- Sexo: Biológico: masculino ó femenino
Clínicas:
- Superficie Corporal Quemada (SCQ): en por ciento
- Infección local: Según las características clínicas se diagnosticó la infección local.
Microbiológicas:
- Cultivos positivos: cuando por cultivo cualitativo se identificó la presencia de germen.
- Cultivos negativos: cuando por cultivo cualitativo no se identificó la presencia de germen.
Operacionalización de variables
La superficie corporal quemada (SCQ) fue estratificada en:
- < 10
- 10-19.9
- 20-29.9
- 30-39.9
- 40-49.9
- 50-59.9
- 60
Para identificar los gérmenes existentes en el tejido quemado se obtuvo el resultado de los cultivos cualitativos realizados mediante el método de hisopado en la lesión por quemadura durante la segunda y tercera semana de evolución intrahospitalaria. Se tuvo en cuenta además el resultado frente a la tinción de Gram (Grampositivo (+) o Gramnegativo (-)).
Según el resultado del cultivo; los pacientes fueron clasificados en dos grupos: con cultivo positivo y con cultivo negativo.
Mediante la revisión de las historias clínicas se determinó la presencia de infección local atendiendo a la descripción de las características locales del tejido quemado en el momento de las curas realizadas coincidiendo con el período de las tomas de muestras.
Fueron considerados como infección local la existencia en la lesión de uno de los siguientes signos patognomónicos:
- Eritema perilesional
- Coloración violácea o eritematosa en los márgenes de la quemadura
- Secreciones purulentas
- Punteado hemorrágico
- Cambios de coloración en el tejido, pigmentación verdosa en la grasa subcutánea y/o presencia de estigma gangrenoso en piel sana.
- Roído de ratón.
O la presencia de uno de los siguientes signos unido a uno de los anteriores:
- Profundización de la lesión en ausencia de compromiso en la perfusión.
- Deterioro del tejido de granulación si existía previamente
Atendiendo a la aparición de uno de estos signos en la lesión, los pacientes fueron clasificados en uno de dos grupos: con infección clínica, sin infección clínica.
Los datos se recogieron en una base de datos confeccionada para el estudio en formato Excel del paquete de office 2003. Para resumir la información utilizamos el método de estadística descriptiva, para las variables cualitativas se utilizó el porcentaje y para las cuantitativas la media y la desviación estándar (medida de dispersión). Los resultados se muestran en tablas y gráficos.
Se emplearon los paquetes estadísticos SPSS-PC (Versión 10.0, Jaendel Scientific, EEUU) y EPI-Info (Centro de Control de las Enfermedades, Atlanta, Georgia, EEUU) en sus versiones para Windows 9X/2000/ME/NT/XP (Microsoft, EEUU) en el procesamiento estadístico de los resultados.
Análisis y discusion de los resultados
Se estudiaron 67 pacientes portadores de lesiones por quemaduras. El 46,26% perteneció al sexo femenino y el 53,73% al sexo masculino (tabla # 1, Gráfico 1). La media de la edad fue de 45,05 años, la desviación estándar de 16,95, la mayor edad fue de 87, y la menor 18. El 41,79% de la muestra estuvo representado por pacientes menores de 40 años.
Tabla #1. Distribución de la muestra según sexo.
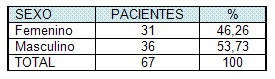
Fuente: Base de datos
En un estudio sobre sepsis realizado en esta unidad de quemados en el periodo entre 1996 y 2004, la mayor frecuencia de lesionados fue de los pacientes con edades entre 30 y 40 años, resultado similar al nuestro, sin embargo, en el presente estudio se observa un mayor por ciento de lesionados en el grupo de mayores de 40 años y 16/67, es decir, el 23,88% tenían 60 o más años (38), tendencia que debe ser observada por la participación cada vez más creciente de personas con este rango de edad en las tareas domesticas y sociales de forma independiente.
En el estudio de referencia se encontró un discreto predominio porcentual en el sexo femenino (50,2%), lo cual difiere de lo encontrado en este trabajo. Internacionalmente se reporta que ambos sexos pueden ser afectados por igual, siendo referido en diversos estudios frecuencias diferentes. (39)
Tabla # 2. Distribución de pacientes según superficie corporal quemada.
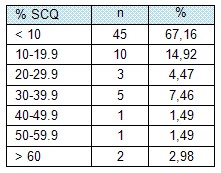
Leyenda:
SCQ: superficie corporal quemada.
El 67,16% de los pacientes incluidos en la muestra tenían una afectación menor del 10% de la superficie corporal, seguida por el grupo de pacientes con una superficie corporal quemada entre 10 y 19,9%, lo que constituyó el 14,92%. (Tabla # 2, Gráfico 2)
Tabla # 3. Clasificación de los pacientes según resultados de los cultivos cualitativos
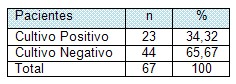
Los cultivos superficiales de la quemadura (cultivos cualitativos), al ser fáciles de obtener, se realizan de forma habitual en la mayoría de las unidades de quemados. El objetivo es evaluar la microbiota presente en las heridas realizando una estrecha vigilancia de la quemadura para detectar los microorganismos antes de que se produzca la invasión de la misma.
Según el resultado de los cultivos cualitativos realizados en este estudio, en el 65,67 por ciento de los pacientes no se aislaron bacterias en las lesiones durante la segunda y tercera semana de evolución. En 23 / 67 pacientes fueron encontrados gérmenes, lo que representa un 34,3% (Tabla # 3).
Estudios realizados sobre infecciones locales en pacientes quemados muestran una frecuencia de 86% de cultivos positivos en la lesión (40) cifra superior a la encontrada en este trabajo.
Se debe destacar que la frecuencia con que se diagnostican los gérmenes depende de la etapa de evolución en que se realice, del método empleado y de la terapéutica local que se imponga. Como factor influyente se señala las características microbiológicas de la unidad en cuestión.
Hay evidencia definitiva de que la infección se debe, en su mayoría, a bacterias endógenas es decir, que están en el paciente y ocurre por dos mecanismos: las bacterias en el borde de la herida o infección presente en otras partes del cuerpo. (50)
Tabla # 4. Principales gérmenes aislados en las lesiones por quemadura durante el periodo de estudio.
Germen - # Pacientes - %
- Pseudomona aeruginosa – 9 - 13,42
- Acinetobacter spp – 8 - 11,94
- Staphylococcus aureus - 7 - 10,44
- Escherichia Coli - 4 - 5,97
- Staphylococcus coagulasa negativo - 4 - 5,97
- Citrobacter spp - 2 - 2,98
- Klebsiella pneumoniae - 2 - 2,98
- Enterobacter Cloacae - 2 - 2,98
- Citrobacter spp - 2 - 2,98
- Klebsiella - 1 - 1,49
- Citrobacter Freundi - 1 - 1,49
- Proteus Mirabilis - 1 - 1,49
- Hafnia Alvei - 1 - 1,49
Fuente datos del Galen de Softel
En la tabla # 4 se muestran los gérmenes que con más frecuencia fueron encontrados en el estudio. Observamos un predominio de gérmenes gram negativo, siendo los más frecuentes Pseudomona aeruginosa y Acinetobacter, seguidos por Staphylococcus aureus (grampositivo).
La flora bacteriana en general, cambia según la etapa de evolución de la quemadura, pues en los primeros días se aíslan bacterias Gram positivas y a partir de la segunda semana predominan bacterias Gram negativas, (50) como se puede observar, en los casos estudiados durante la segunda y tercera semana de evolución donde fueron los gérmenes gramnegativos los más frecuentes en las lesiones.
Se ha visto que la presencia de microbiota polimicrobiana en una herida tiene más importancia en sí que la presencia de un determinado patógeno. La aparición de microbiota mixta puede determinar el desarrollo de sinergia entre los distintos microorganismos, lo que facilita el desarrollo de la infección. (51) En la serie de nuestro estudio se pudo comprobar este fenómeno.
Tabla # 5. Clasificación de los pacientes según los hallazgos clínicos de signos de infección.
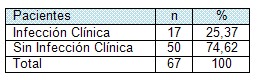
El diagnóstico de sepsis se realiza por cultivos cualitativos, cuantitativos sumados al estudio histológico y la valoración clínica, sin despreciar que un solo indicador no asegura el diagnóstico (5,8).
En este estudio se quiso determinar la presencia de signos clínicos de infección local y resultó que el 25,37% de la muestra se incluyeron en esta categoría, (Tabla # 5 Gráfico 5). Este resultado difiere del reportado por otra Unidad de Quemados del país la cual reporta un 38,4% de pacientes con infección clínica. (53)
La sepsis proveniente del área quemada ocurre cuando se rompe el equilibrio de la ecuación: Aumento del número de bacterias / Resistencia inmunológica del paciente. Cuando el tratamiento de la herida por quemadura no es efectivo en el control de la proliferación bacteriana, la sepsis proveniente del área lesionada invade tejidos sanos y/o la circulación sistémica (8,5), colocando al paciente en riesgo de complicaciones severas como la Sepsis asociada a no al Síndrome de Respuesta Inflamatorio Sistémico. (54)
Las condiciones locales han justificado el uso de antimicrobianos tópicos tales como la sulfadiazina de plata y el acetato de mafenida, el cuidado local de la herida y la práctica de medidas estrictas de control de infecciones para reducir la incidencia de la sepsis local, previniendo o limitando la extensión de la colonización de la herida por patógenos potenciales. Estas medidas no resultan suficientes para reducir la incidencia de infección local. Esto hace necesario mantener un alto grado de alerta para la detección precoz de la infección lo que justifica el uso de la técnica de cultivo cualitativo. Si analizamos el comportamiento clínico de los casos con cultivos cualitativos positivos, observamos que, el 73,91% de ellos mostraron infección clínica en el momento del estudio.
Al no tener instrumentado en este servicio la realización de cultivos cuantitativos y estudios histológicos del área lesionada a fin de confirmar el diagnóstico e identificar a los agentes productores, nos valemos de lo anterior y de la semiología de la lesión por quemadura.
Tabla # 6. Clasificación de los pacientes según resultado del cultivo e infección clínica.
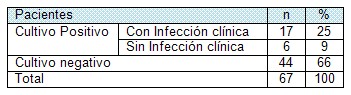
Aunque se comprobó la presencia de gérmenes en 23 pacientes, (Tabla # 6, Gráfico 6) el 9% de la muestra total (6 pacientes) no tuvieron manifestaciones clínicas (locales) de infección, lo que hace pensar que en el momento del estudio solo existía colonización.
Conclusiones
- La flora bacteriana presente en el tejido lesionado de los pacientes estudiados en este período fue a predominio de gérmenes Gram negativos. La mayoría de los casos con cultivos positivos desarrolló infección clínica localmente.
- Los gérmenes que con más frecuencia se aislaron fueron Pseudomona aeruginosa, Acinetobacter spp y Staphylococcus aureus.
- El 23% de la muestra tuvo cultivos positivos y en el 17% existió infección clínica en la lesión. El 73,91% de los casos con cultivos cualitativos positivos tuvieron infección clínica en el período estudiado.
Recomendaciones
Instrumentar en la Unidad de Quemados el uso de las técnicas de cultivos cuantitativos e histológicos para el diagnóstico de Infección local en las lesiones por quemaduras.
ANEXOS
Gráfico 1. Distribución de la muestra según sexo. Fuente: Tabla 1.
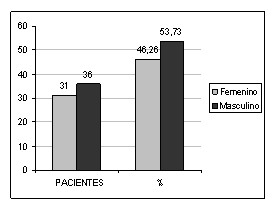
Gráfico 2. Distribución de pacientes según superficie corporal quemada. Fuente: Tabla 2.
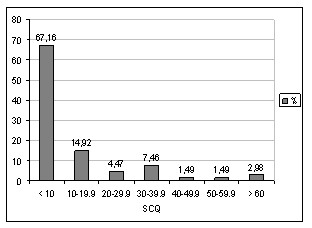
Gráfico 3. Clasificación de los pacientes según resultados de los cultivos cualitativos. Fuente: Tabla 3.
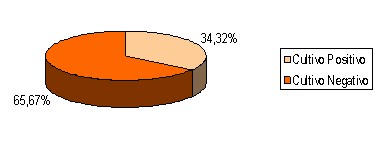
Gráfico # 4 Principales gérmenes aislados en las lesiones por quemadura durante el periodo de estudio. Fuente: Tabla 4.
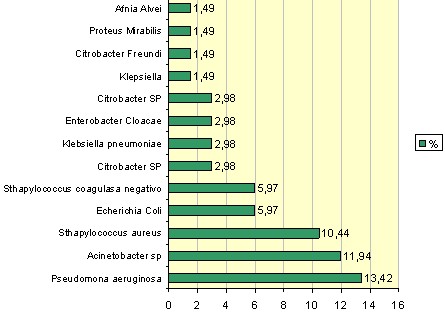
Gráfico 5. Clasificación de los pacientes según los hallazgos clínicos de signos de infección. Fuente: Tabla 5.
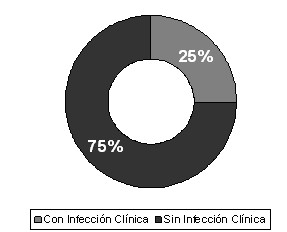
Gráfico 6. Clasificación de los pacientes según resultado del cultivo e infección clínica. Fuente: Tabla 6.
Bibliografía
- Borges H; García R: Atención al paciente quemado en unidades especializadas. En: Borges H; García R; González G et al: Manual de Procedimientos de Diagnóstico y Tratamiento en Caumatología y Cirugía Plástica. Tomo I. Ed. Pueblo y Educación. Ciudad de la Habana. 1984. Pág. 25- 48.
- Shaffle JR, Davis B, William P. Recent outcomes in the treatment of burn injury in the United Status: a report from the American Burn Association patient registry. J Burn Care Rehabil. 1995; 16:216-32.
- Lin E, Calvanos S, Lowry S. Inflammatory cytokines and cell response in surgery. 2000; 127: 117-26.
- Song W, Lee KM, Kang HJ, Shin DH, Kim DK.: Microbiologic aspects of predominant bacteria isolated from the burn patientes in Korea. Burns; 2001: 27(2):136-39.
- Abraham E, Matthay M, Dinarello C, Vincent J, Cohen J, Opal S, Glauser M, Parsons P, Fisher C, Repine J. Consensus conference definitions for sepsis, septic shock, acute lung injury, and acute respiratory distress syndrome: time for a reevaluation. Crit Care Med 2000; 28 (1): 232-35.
- McManus, W. F.; Goodwin, C. W.; Manson, A. D.; Pruitt, B. A.: «Burn wound infection». J. Trauma. 21: 753. 1981.
- Yurt, R. W.; Shires, G. T.: aBurls In: Principies and practice of infectious diseases». Second Ed. Manden. G. L. Douglas, R. G. and Bennett. J. E. Ed. New York. 1985.
- ARYA SC., AGARWAL N., «Nosocomial infections in adult intensive-care units».Lancet.2003 Aug 9;362(9382):493-97
- Del Sol A. Las quemaduras y sus diferentes aspectos. C. de La Habana: Ed. Científico técnica. 1990; 18: 31-46.
- Marko P, Layon J. Caruso L. et al Burn Injuries. Current O-pinion in Anaesthesiology 2003, 16:183–91
- Freddi O, Kestens G, Quemaduras Graves. En Lovesio Carlos: Medicina Intensiva. 5ª Edición. Editorial El Ate-neo. Buenos Aires. 2001. 805-16
- Benaim F: Enfoque global del tratamiento de las quemaduras. En: Coiffman F (ed), Cirugía Plástica Reconstructiva y Estética. Barcelona, Masson–Salvat, 1994: 443-96
- Converse JM, Robb Smith AH: The healing of surface cutaneous wounds; its analogy with healing of superficial burns. Ann Surg 1994; 120: 873-8.
- Zapata R, Villanueva M: Diagnóstico y tratamiento inicial del paciente quemado en la emergencia. En Zapata R, Del Reguero A, Kube Leon R (eds). Actualización en quemaduras. Rumbo al 2000. Caracas, Ateproca, 1999: 12-21
- Cornejo Giraldo, Mario P. Quemaduras e Infección. Enfermedades Infecciosas. Hospital Nacional del Sur de Arequipa (HNSA) – IPSS. Universidad Católica de Santa María. Mayo, 1995
- GARRIDO G., MADERO R., HERRUZO R., GARCÍA-CABALLERO J., «Infección nosocomial en una UCI: análisis multivariante de los factores de riesgo». Med Clín. (Barc.) 1997; 108: 405-9
- Gelfand, J. A.: «Infections in boro patients: A paradignm for cutaneous infection in the paticnt at riskrr. Arn. J. Med. 76: 158, 1984.
- Alexander, C. L.; Ogle, C. K.; Stinnett, J. D.; Me Millan,B.G.: «A sequential prospective analysis of inmunologic abnormalities and infection following severe thermal injury». Aun. Surg. 188: 809, 1978.
- Bjornson, A. B.; Altemier, W. A.; Bjornson, H. S.: «ComplemenL opsoninsand che immune response to bacterial infcction in burned patients». Ann. Surg.191:323, 1980.
- Mc Cabe, W. P.; Rebuck, J. W.; Kelly, A. P.; Ditmars,D. M.: «Leukocyte response as a monitor of immunodepre si, in burn patients». Arch. Surg. 106: 155, 1973.
- Grogan, J. B.: «Suppressed in vitro chemotaxis of burn neutrophil»,. J. Trauma. 16: 985, 1976.
- Mc Millan, J. D.: «Evaluation of leukocyte chcmotaxis in vitro in thermally injury patients. J.C.». lnrese. 54: 1001, 1974.
- Moncrief, J. A.; Teplitz, C.: « Changing concepts in burn sepsis». J Trauma., 4: 233, 1964.
- Divincenti, F. C.; Pruitt, B. A.; Reckler, J. M.: « Inhalation injuries». J. Trauma. 11: 109, 1971.
- Pruitt, B. A.; Flemma, R. J.; Divincenti, F. C.; Foley, F. D.: « Mason Pulmonary complications in burn patient: A comparative study of 697 patients». J. Thorac. Cardiovasc. Suig. 59: 7, 1970.
- Pruitt, B. A.; Me Manus, W. F.; Kim, S. H.; Treat R. C.: «Diagnosis and treatment of cannularelated intravenous sepsis in burn patients». Ann. Surg. 191: 546. 1980.
- Santos C.E de los: Historia del tratamiento de las quemaduras. 1ª ed. En: Guía básica para el tratamiento del paciente quemado. Santo Domingo: Alfa & Omega; 1999. p. 17-20
- Ogura H. Hasshiguchi N. Tanaka H et al. Long term enhanced expresión of heat shock proteins and decelerated apoptosis in polymorfonuclear leukocytesfrom major burn patients. J Burn Care Rehab 2002; 23:103-9
- Kang HJ, Kim JH, Lee EH. Change of Complement System Predicts the outcome of patients with severe thermal injury. J. Burn Care Rehabil. 2003; 24: 148-53
- Efron P. Moldawer L, Cytokines and Wound Healing: The rol of cytokine and anticytokine therapy in the repair response. J Burn Care Rehabil. 2004; 25: 149-60
- NASSER S., MABROUK A., MAHER A., «Colonization of burn wounds in Ain Shams University Burn Unit».Burns. 2003 May;29(3):229-33.
- MAYHALL CG., «The epidemiology of burn wound infections: then and now».Clin Infect Dis. 2003 Aug 15;37(4):543-50.
- Miquet R LM. Estudio inmunológico en pacientes quemados. (Tesis para optar por el título de Especialista de 1er. Grado en Cirugía Plástica y Quemados. Ciudad de La Habana: Hospital Clínico Quirúrgico Hermanos Ameijeiras ,1990.
- Kang HJ, Kim JH, Lee EH. Change of Complement System Predicts the outcome of patients with severe thermal injury. J. Burn Care Rehabil. 2003; 24: 148-53.
- Mohammad-Reza A, Abdolaziz RL, Ali-Reza T, Javad S, Reza D. Epidemiology and mortality of burns in the South West of Iran. Burn 2001; 27(3): 219-26.
- Lemos A. T.O. Costa. Infecções no paciente queimado. In.. Comissão de Controle de Infecção Hospitalar CCIH Hospital das Clinicas da UFMG. Manual de infecção hospitalar, epidemiologia, prevenção e controle. Rio de janeiro Medisi.. 2001, 1116-26.
- Alderson P, Bunn F, Lefebvre C, Li Wan Po A, Li L, Roberts I, et al. The Albumin Reviewers. Solución de albúmina humana para la reanimación y expansión de volumen en pacientes críticos. En: La Cochrane Library plus en español. Oxford, número 4, 2004. Update Software Ltd.
- Rodríguez Garcell R, Miquet Romero LM: Estudio de la sepsis en pacientes quemados. Revista electrónica de Portales Medicos.com. Vol III. No 21. 2008. Disponible en: http://www.portalesmedicos.com
- Mzezewa S, Jonsson K, Aberg M, Salemark L.: A Prospective study on the epidemiology of burns in patients admitted to the Harare burns units. Burns 1999; 25:499-04.
- García D E. infecciones nosocomiales en la unidad de quemados Rev. Med. Post UNAH Vol. 7 No 2 171-77, 2002
- Garnacho J: Conceptos y definiciones. En:"Guías para el tratamiento de las infecciones relacionadas con catéteres intravasculares de corta permanencia en adultos" de la Conferencia. Reconsenso: Infecciones por Catéter SEIMC-SEMICYUC Madrid: Drug Farma 2002: 13-18.
- Pascual A. Etiopatogenia y factores de riesgo. Conferencia de Consenso Infección por Catéter SEIMC-SEMICYUC. Madrid: Drug Farma 2002:43-55.
- Fernández, E.M. García, F. Sandoval G, Quemaduras en la infancia. Valoración y tratamiento BOL PEDIATR 2001; 41: 99-105,
- Martindale, R: Use of immune enhancing diets in burns. Journal of parenteral and enteral nutrition; 2001(25):24-26
- Mc Clave Stephen MD. The effects of inmune enhancing diets on mortality, hospital lingth of stay, duration of mecharucal ventilation and other parameters. J.P.E.N; 2001(25); 44-50.
- Lin E, Calvanos S, Lowry S. Inflammatory cytokines and cell response in surgery. 2000; 127: 117-26.
- Crisol F, Gómez P, Palao R. Gran Quemado. En: Carrasco-Jiménez MS. Emergencias Médicas II. Madrid: Arán Ediciones 2000; 1195-1208.
- Freddi O, Kestens G, Quemaduras Graves. En Lovesio Carlos: Medicina Intensiva. 5ª Edición. Editorial El Ate-neo. Buenos Aires. 2001. 805- 816
49. Anlat R, Ozerdem OR, Dalay C, Kesiktas E, Acarturk S, Seydauoglu G. A restrospective analysis of 1083 Turkish patients with serious burns. Burn 2002; 28(3):239-43.
50. Rangel G.H; Infección en quemaduras: Cir Plast. Vol 15 (2) 2005 pág. 111 -17.
51. Laloë V. Epidemiology and mortality of burns in General Hospital of Eastern Sri Lanka. Burn 2002; 28 (8):778-81.
52. Burillo A. Diagnóstico microbiológico de las infecciones de piel y tejidos blandos. En Procedimientos en microbiología clínica. Ed. Editores: Emilia Cercenado y Rafael Cantón. Madrid. 2007: 309 - 25.
53. Hallazgos necropsicos en pacientes quemados. Informe de 315 casos: Rodríguez S.O; MEDISAN 2001;5(4):49-53)
54. Efron P. Moldawer L, citokines and anticitokine terapy in the repair response. J. Burn Cara Rehabil. 2004; 25: 149-60.
55. Cuenca-Pardo J, Álvarez-Díaz C: Fase inflamatoria en el paciente quemado. Cir Plas, 11: 2001, 90 – 97. Disponible en http://medigraphic.com
56. Sánchez R, Monserrat J. Balance entre citocinas pro y antiinflamatorias en estados sépticos. Disponible en. http://www.doyma.es el 16/06/2007.
57. Rangel Gaspar H.Infección en quemaduras: Cir Plas 2005;15:111-17. Disponible en: http://medigraphi.com
58. Wang GQ.The clinical significance of the SRIS scoring sistemin severly burned patients.Ann Burns Fire Disasters 1999; 12:2004.
59. Bracho F. La respuesta inmunológica a las quemaduras. En: MEDICRIT 2005;2:17-20 Disponible en : www.medicrit.com
60. Gutiérrez Salgado J, Carrera Gomez J. Síndrome de respuesta inflamatoria sistémica definición, comentarios fisiopatológicos e importancia en cirugía plástica. Cir Plast 1998; 18: 53-Disponible en: http://www.imbiomed.com.mx
61. 35-Hettiarafchy SH,Dziewolsky P. Pathophisiology and types of burns.BMJ 2004;328:1427-9.
62. Kang HJ,Kim JH,Lee EH.Change of complement system predicts the outcome of patients with severe thermal injury.J Burns Care 2003;24: 148-53
63. Martindale R. Use of immune enchancing diets in burns. J Parenter Enter Nutr 2001;25:24-6
64. Wang GQ. The clinical significance of the SRIS scoring sistemin severly burned patients.Ann Burns Fire Disasters 1999; 12:2004.
65. Ogura H, Hasshiguchi N, Tanaka H. Long tem enchanced expression of hest shock proteins and decelerated apoptosis in polymorfonuclesr linkocytes fron mayor burn patients. J Burns Care Rehabil 2003;23:103-9.
66. Rangel Gaspar H. Infección en quemaduras: Cir Plas 2005;15:111-17. Disponible en: http://medigraphi.com
67. Losada H, Manterola C.SRI, sepsis y SDOM. Una visión quirúrgica. Rev Chil Cir 2004; 56:31- Álvarez F, Martínez M: Decálogo de normas para la utilización de antibióticos en pacientes Críticos. Disponible en: http://www.doyma.es 16/06/2007.
68. Sánchez R, Monserrat J. Balance entre citocinas pro y antiinflamatorias en estados sépticos. Disponible en. http://www.doyma.es el 16/06/2007.
69. Álvarez F, Martínez M: Decálogo de normas para la utilización de antibióticos en pacientes Críticos. Disponible en: http://www.doyma.es el 16/06/2007.
70. 48-Betancourt M: Mortalidad infantil por quemaduras y síndrome de respuesta inflamatoria sistémica. Rev Med IMSS 2004; 42 (2): 103-8
71. Istre GR, Mc Coy MA, Osbron L, Barnard JJ, Bolton A: Deaths and injuries from house fires. N Engl J Med 2001; 344(25):1911-16.
72. Müller MJ, Pegg SP, Rule MR. Determinants of death following burn injury. Br J Surg 2001; 88 (4):583-87.
73. Calder F. Four year of burn injuries in Red Cross Hospital in Afghanistan. Burn 2002; 28:563-68.
74. Laloë V. Epidemiology and mortality of burns in General Hospital of Eastern Sri Lanka. Burn 2002; 28 (8):778-81.
75. Mukerji G, Chamania Sh, Gupta P, Gupta S. Epidemiology of paediatric burns in Indore, India.Burn 2001;27(1):33-38.
76. Anlat R, Ozerdem OR, Dalay C, Kesiktas E, Acarturk S, Seydauoglu G. A restrospective analysis of 1083 Turkish patients with serious burns. Burn 2002; 28(3):239-43.
77. Mohammad-Reza A, Abdolaziz RL, Ali-Reza T, Javad S, Reza D. Epidemiology and mortality of burns in the South West of Iran. Burn 2001; 27(3): 219-26.
78. Lemos A. T.O. Costa. Infecções no paciente queimado. In.. Comissão de Controle de Infecção Hospitalar CCIH Hospital das Clinicas da UFMG. Manual de infecção hospitalar, epidemiologia, prevenção e controle. Rio de janeiro Medisi.. 2001, 1116-26.
79. Alderson P, Bunn F, Lefebvre C, Li Wan Po A, Li L, Roberts I, et al. The Albumin Reviewers. Solución de albúmina humana para la reanimación y expansión de volumen en pacientes críticos. En: La Cochrane Library plus en español. Oxford, número 4, 2004. Update Software Ltd.
80. Cuenca J, Álvarez C: Efectividad de la Unidad de Quemados del Hospital de traumatología Dr. Víctor de la Fuente Narváez .Estudio Comparativo. Cir Plas, 12, 3, 2002: 104 -8
81. Annane D, Sebille V, Troche G, Raphael JC, Gajdos P, Bellissant E: A 3-level prognostic classification in septic shock based on cortisol levels and cortisol response to corticotropin. JAMA 2000; 283:1038-45.
82. Ariasa F. Frutos M: Utilización y rendimiento de los hemocultivos en una unidad de cuidados intensivos medicoquirúrgica. Med Intensiva 2003; 27(10):647-52
83. Garnacho J: Conceptos y definiciones. En:"Guías para el tratamiento de las infecciones relacionadas con catéteres intravasculares de corta permanencia en adultos" de la Conferencia. Reconsenso: Infecciones por Catéter SEIMC-SEMICYUC Madrid: Drug Farma 2002: 13-18.
84. Pascual A. Etiopatogenia y factores de riesgo. Conferencia de Consenso Infección por Catéter SEIMC-SEMICYUC. Madrid: Drug Farma 2002:43-55.
85. Fernández, E.M. García, F. Sandoval G, Quemaduras en la infancia. Valoración y tratamiento BOL PEDIATR 2001; 41: 99-105.
86. Martindale, R: Use of immune enhancing diets in burns. Journal of parenteral and enteral nutrition; 2001(25):24-26
87. Mc Clave Stephen MD. The effects of inmune enhancing diets on mortality, hospital lingth of stay, duration of mecharucal ventilation and other parameters. J.P.E.N; 2001(25); 44-50.
88. Alsbjörn BF. Biologic wound coverings in burn treatment. World J Surg 16:43, 1992.
89. Clark WR Jr. Smoke inhalation: Diagnosis and treatment. World J Surg 16:24, 1992.
90. Ferrada R, Aragón N, Becerra C. Cultivo biopsia en quemaduras. Rev Colomb Cirugía 7:151, 1992.
91. Heimbach D, Eingrav L, Grube B, Marvin J. Burn depth: A review. World J Surg 16:10, 1992.
92. Monafo WW, Bessey PQ. Benefits and limitations of burn wound excision. World J Surg 16:37, 1992.
93. Morehouse JD, Finkelstein J, Marano MA, et al. Resuscitation of the thermally injured patient. Crit Care Clin 8:355, 1992.
94. Pruitt BA, McManus AT. The changing epidemiology of infection in burn patients. World J Surg 16:57, 1992.
95. Robson MC, Barnett RA, Leitch IOW, Hayward PG. Prevention and treatment of postburn scars and contracture. World J Surg 16:87, 1992.
96. Tredget EE, Yu YM. The metabolic effects of thermal injury. World J Surg 16:68, 1992.
97. Waymack JP, Herndon DN. Nutritional support of the burned patient. World J Surg 16:80, 1992.
98. Wong L, Munster M. New techniques in burn wound management. Surg Clin North Am 73:363, 1993.
99. Richard P, Le Floch R, Chamoux C, Pannier M, Espaze E, Richet H.Pseudomonas aeruginosa outbreak in a burn unit: role of antimicrobials in the emergence of multiply resistant strains. J Infect Dis 1994 Aug;170(2):377-83.