Los Síndromes Neurológicos Infecciosos se hallan entre las enfermedades más rápidamente devastadoras y son una importante causa de muerte. A pesar de haber transcurrido casi doscientos años del primer reporte de un brote de meningitis epidémica, esta patología provoca por su comportamiento paradójico, gran interés entre los profesionales de la salud y en la población en general. Neisseria meningitidis, su agente etiológico, ocupa un lugar destacado entre las bacterias patógenas. Sin embargo a pesar del amplio uso de los antibióticos y el desarrollo de vacunas, la enfermedad causada por esta bacteria continúa siendo un serio problema, tanto en países desarrollados, como en países subdesarrollados, y es la principal causa de meningitis bacteriana epidémica y endémica en el mundo. El análisis de la resistencia a los antimicrobianos en Neisseria meningitidis debe hacerse sobre dos aspectos claramente diferenciados en el control de la infección meningocócica: la quimioprofilaxis y el tratamiento. Estos hechos han llevado al incremento de la vigilancia por parte de los laboratorios de referencia de la concentración inhibitoria mínima (CIM) para la penicilina, de la actividad beta-lactamasa y presencia de plásmidos en los aislamientos de Neisseria meningitidis. En este trabajo se realizó una revisión bibliográfica sobre las cepas más frecuentemente aislada de Neisseria meningitidis, la susceptibilidad a la penicilina y la situación actual de la enfermedad meningocócica.
Artículo de revisión. Neisseria meningitidis: caracterización y susceptibilidad a la penicilina. Situación actual de la Enfermedad Meningocócica.
Dra. Mayra Flores López*, Dra. Sahily Ortega Medina**, Dra. Idalmis D. Reyes Rodríguez***, Dra. Tania Farias Delgado****, Dra. Hussimy Marchena Morera*****, Lic. Greyci Cuervo Arango Bernia******.
*Especialista de primer grado de MGI, Master en Bacteriología- Micología,
** Especialista de primer grado en M.G.I, Master en parasitología,
*** Especialista de primer grado en M.G.I, Especialista de 1er grado en Microbiología, Master en Enfermedad Infecciosas,
**** Especialista de primer grado de Microbiología y Master en Enfermedades Infecciosas,
***** Especialista de primer grado en pediatría, Especialista de segundo grado en Endocrinología, Master en Atención Integral al Niño.
****** Lic. en Enfermería.
Resumen
Artículo de revisión. Neisseria meningitidis: caracterización y susceptibilidad a la penicilina. Situación actual de la enfermedad meningocócica.
Los Síndromes Neurológicos Infecciosos se hallan entre las enfermedades más rápidamente devastadoras y son una importante causa de muerte. A pesar de haber transcurrido casi doscientos años del primer reporte de un brote de meningitis epidémica, esta patología provoca por su comportamiento paradójico, gran interés entre los profesionales de la salud y en la población en general. Neisseria meningitidis, su agente etiológico, ocupa un lugar destacado entre las bacterias patógenas.
Sin embargo, a pesar del amplio uso de los antibióticos y el desarrollo de vacunas, la enfermedad causada por esta bacteria continúa siendo un serio problema, tanto en países desarrollados, como en países subdesarrollados, y es la principal causa de meningitis bacteriana epidémica y endémica en el mundo. El análisis de la resistencia a los antimicrobianos en Neisseria meningitidis debe hacerse sobre dos aspectos claramente diferenciados en el control de la infección meningocócica: la quimioprofilaxis y el tratamiento. Estos hechos han llevado al incremento de la vigilancia por parte de los laboratorios de referencia de la concentración inhibitoria mínima (CIM) para la penicilina, de la actividad beta-lactamasa y presencia de plásmidos en los aislamientos de Neisseria meningitidis. En este trabajo se realizó una revisión bibliográfica sobre las cepas más frecuentemente aislada de Neisseria meningitidis, la susceptibilidad a la penicilina y la situación actual de la enfermedad meningocócica.
Palabras clave: Neisseria meningitidis, caracterización, enfermedad meningocócica, susceptibilidad a la penicilina, concentración inhibitoria mínima, actividad beta- lactamasa, presencia de plásmidos.
Introducción.
La meningitis bacteriana es una enfermedad inflamatoria grave del sistema nervioso central debida al crecimiento de bacterias en las leptomeninges y zonas adyacentes, por lo que siempre existe cierto grado de encefalitis concomitante. Aunque la causa de la meningitis bacteriana aguda varía según la edad y otras condiciones bajo las cuales ocurre la infección, uno de los agentes etiológicos más frecuentes es Neisseria meningitidis, una bacteria gramnegativa encapsulada, aeróbica, no esporulada y no móvil, la cual tiene la forma de cocos arriñonados y se agrupa generalmente en pares. La meningitis bacteriana y la septicemia causada por este patógeno humano son formas clínicas de la enfermedad meningocócica (EM) y están caracterizadas por un comienzo rápido y una alta tasa de mortalidad. (1)
La enfermedad meningocócica continúa siendo de global importancia para las autoridades de salud; mientras pandemias de dicha enfermedad ocurren en China y África por el serogrupo A capsular, casos esporádicos, brotes y estados hiperendémicos son causados por el serogrupo B y C en Europa Central, América del Norte, América Central y América del Sur. El manejo de esta enfermedad, la cual afecta solamente una pequeña proporción de portadores de meningococo, requiere de un rápido diagnóstico y una exhaustiva vigilancia. (2,3)
En 1946, la Neisseria meningitidis fue aislada por primera vez en Cuba. Durante muchos años la enfermedad meningocócica se convirtió en un agobiante problema de salud para nuestro país, afectado por una epidemia que comenzó a finales de la década del 70. El mes de mayo de 1976 fue el comienzo de una epidemia causada por el serogrupo C, con seis casos y tres fallecidos. La tasa de la enfermedad meningocócica alcanzó el 5.6 x 100.000 habitantes en 1979, pero después de una vacunación masiva con la vacuna francesa A-C, la incidencia de la enfermedad continuó en ascenso pero a expensas del serogrupo B como agente predominante.
El pico de la incidencia ocurrió en 1983 cuando fueron reportados 14.4 casos por 100.000 habitantes. Las investigaciones encaminadas a lograr una vacuna antimeningocócica del serogrupo B, a partir de las diferentes proteínas de membrana externa (PME), comenzó en 1982. A finales de 1988, la vacuna antimeningocócica cubana BC (VA-MENGOC-BC) fue administrada primero a grupos en edad de riesgo y subsecuentemente a toda la población entre 3 meses y 24 años. Desde entonces el número de casos ha disminuido a menos de 1 por 100.000 habitantes desde 1993 hasta nuestros días. (4,5)
Aún cuando solamente una pequeña proporción de portadores es la que enferma y existe una baja incidencia de la enfermedad meningocócica en nuestro medio, es comprensible mantener la vigilancia de los serotipos y subtipos y del comportamiento de la susceptibilidad a la penicilina de las cepas de Neisseria meningitidis que circulan en nuestro medio. (6)
Tanto el serotipo como el subtipo pueden ser determinados mediante un ensayo inmunoenzimático (ELISA) usando anticuerpos monoclonales (AcM), lo cual es útil en la caracterización de aislamientos de Neisseria meningitidis para la identificación de variantes antigénicas de las proteínas PorA y PorB. Desde principios de la década del 80 hasta 1992 la mayoría de las cepas que circulaban en Cuba presentan el fenotipo B:4:P1.15, así la vacuna cubana fue preparada con cepas de meningococo con dicho fenotipo. (7)
Por otra parte, el análisis de la situación de la resistencia a los antimicrobianos en Neisseria meningitidis debe hacerse sobre dos aspectos claramente diferenciados en el control de la infección meningocócica: la quimioprofilaxis y el tratamiento. En los laboratorios de microbiología clínica, las pruebas de sensibilidad antimicrobiana para el meningococo no se realizan como un procedimiento de rutina, ya que este microorganismo ha sido siempre altamente susceptible a la penicilina con concentraciones inhibitorias mínimas (CIM) alrededor de 0.05 µg/mL (12). Sin embargo en las últimas décadas han aparecido cepas moderadamente resistentes (CIM 0.1-0.8 µg/mL) y francamente resistentes a la penicilina (CIM > 0.8 µg/mL) en países como España, Reino Unido, Sudáfrica y Cuba (13,14,15,16); tal concentración (CIM> 0.8 µg/mL) es la que se alcanza en el líquido cefalorraquídeo a las dosis establecidas en el tratamiento de la enfermedad meningocócica con dicho antimicrobiano. Estos hechos han llevado al incremento de la vigilancia por parte de los laboratorios de referencia de la concentración inhibitoria mínima (CIM) para la penicilina, de la actividad beta-lactamasa y presencia de plásmidos en los aislamientos de Neisseria meningitidis. (8,9)
Con esta revisión nos proponemos dar a conocer la caracterización tanto genotípica como fenotípica de la Neisseria meningitidis, la susceptibilidad a la penicilina así como la situación actual de la enfermedad meningocócica tanto en Cuba como en el mundo.
Desarrollo.
El género Neisseria comprende 12 especies y biovariedades aisladas en humanos. En la novena edición del Manual Bergey solo se reconocen 11 especies, sin tener en cuenta la Neisseria polisaschareae descrita por Riou en 1983. (10,11)
Especies patógenas
Neisseria meningitidis
Neisseria gonorrhoeae
Especies no patógenas
Neisseria sicca
Neisseria mucosa
Neisseria subflava: biovariedades Neisseria flava, Neisseria subflava, Neisseria perflava
Neisseria canis
Neisseria lactamica
Neisseria flavescens
Neisseria cinerea
Neisseria elongata
Neisseria dentrificans
Características morfológicas y fisiológicas.
El género Neisseria es el más importante en la familia Neisseriaceae, son cocos de 0,6-1,0 mm de diámetro que se presentan aislados o más frecuentemente en pares con los lados adyacentes aplanados. La especie Neisseria elongata es una excepción y se presenta como bacilos cortos de 0,5 mm a menudo agrupados como diplobacilos o en cadenas cortas. La división de las especies cócicas es en dos planos en ángulo recto uno del otro dando como resultado a veces tétradas. Pueden presentar cápsulas y fimbrias (pili), no poseen endosporas y aunque son gramnegativas tienen tendencia a resistir la decoloración de Gram. Los flagelos están ausentes y no hay motilidad. (12)
Las especies patógenas (Neisseria meningitidis, Neisseria gonorrhoeae) son muy exigentes en sus requerimientos nutricionales y para iniciar su desarrollo precisan medio enriquecido, una humedad relativa elevada y atmósfera con un 5-10% de CO2. Para evitar la acción inhibidora de los ácidos grasos libres contenidos en el medio (peptona y agar) se deben añadir sustancias protectoras como sueros, albúmina y almidón, en estas condiciones se desarrollan dentro de estrechos límites de temperatura entre 35 y 37°C y un pH entre 7,2 y 7,6. Son muy sensibles a la acción de los agentes externos (desecación, temperaturas extremas, antisépticos y desinfectantes). Las colonias con el tiempo sufren un proceso de autolisis que se puede evitar por la adición de cationes divalentes (Ca++, Mg++). (13,14)
En medio sólido el meningococo crece como una colonia transparente, no pigmentada, no hemolítica, de un diámetro aproximado de 1-5 mm. Las colonias son convexas y si se presentan grandes cantidades de polisacáridos tendrán una apariencia mucoide. El meningococo crecerá bien en bases de agar sangre, GC y medios como tripticasa-soja, agar chocolate y agar de Müeller Hinton con suplemento enriquecedor. (15)
Caracterización de cepas de Neisseria meningitidis.
La caracterización de cepas de Neisseria meningitidis nos ayuda a establecer diferencias entre cepas que están estrechamente relacionadas dentro de una misma especie. Esta condición nos propicia el establecimiento de asociaciones de determinada cepa tipo con fenómenos clínicos epidemiológicos por lo que constituye una útil herramienta en la vigilancia epidemiológica, para la comprensión de la patogenia de la enfermedad meningocócica, y en los estudios preliminares y de evaluación de vacunas. (16)
Métodos fenotípicos.
Desde principios del siglo XX ha sido un tema de estudio la diferenciación de cepas de Neisseria meningitidis basándose en la composición inmunoquímica del polisacárido capsular.
En la actualidad son reconocidos 13 serogrupos, aunque realmente se plantea la existencia de 12 pues como el D perdió su cápsula pasó a ser no seroagrupable. Hasta la década del 60 los estudios epidemiológicos se basaron solo en la caracterización de serogrupos aislados de enfermos y portadores. (17,18)
Los estudios relacionados con la caracterización de cepas por medio de pruebas de susceptibilidad antimicrobiana (PSA), se inician bajo el nombre de “Pruebas in vitro de la actividad antimicrobiana en bacterias” y con el documento referido al descubrimiento de la Penicilina en 1920 por Alexander Fleming (60). Jackson y Finland fueron los primeros en mostrar la importancia de la estructuración fundamental de una prueba con relación al tamaño del inoculo, duración de la incubación y el punto final para la determinación cualitativa de la susceptibilidad. No fue hasta 1960 que Bauer y colaboradores realizan un trabajo significativo donde se acordaban las condiciones de estandarización que recibe el nombre de disco de difusión de Bauer–Kirby en su honor. Este método solo fue útil para bacterias que crecían rápido en atmósfera aerobia. (19,20)
Con la continuación de éste y otros estudios se deja ya establecida la PSA con difusión en disco y la PSA con dilución en agar, siendo el método de dilución en placa de agar la técnica de preferencia para Neisseria, sobre la base de la determinación de la concentración inhibitoria mínima (CIM) la cual definimos como la menor concentración del antimicrobiano que es capaz de inhibir el crecimiento del microorganismo. (21,22)
Mediante técnicas como la Electroforesis en Gel de Poliacrilamida (SDS-PAGE) se observó que la membrana externa del meningococo contenía varias proteínas principales, las cuales fueron agrupadas por su peso molecular mediante la técnica de mapeo peptídico tridimensional en 5 clases estructurales designadas con números arábigos del 1 al 5. (23)
En 1985 Frasch propuso una nomenclatura que fuera uniforme teniendo en cuenta los siguientes elementos; utilizó un esquema semejante al O: K: H empleado para Escherichia coli por lo que quedó de la siguiente forma. (24)
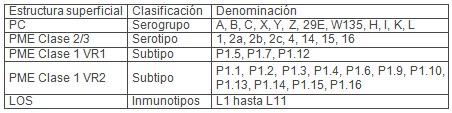
Serogrupo PC
Serotipo Proteína 2/3
Subtipo Proteína 1
Inmunotipo LPS
Ejemplo Cepa B: 4:P1.15.19:L3,7.9.
En la actualidad se conocen 22 tipos bien definidos de meningococo y aún permanecen alrededor de un 30% de cepas que no son tipables por el método de SDS-PAGE. (25)
Abdillahi y Poolman emplearon el ensayo inmunoenzimático de células completas (ELISA) con AcM para tipar y subtipar cepas de meningococo. Sin embargo algunos meningococos no reaccionaron con los diferentes grupos de AcM y fueron denominados no subtipables. (26)
La especificidad del serotipaje con AcM específicos está entre el 72 y el 100% y el sero-subtipaje muestra valores entre el 64 y el 98%. Su uso nos brinda la posibilidad de eliminar posibles reacciones cruzadas y con ello ha aumentado la precisión del serotipaje del meningococo. Sin embargo se presentan falsos negativos ya que algunos AcM no son muy sensibles. (27)
En cuanto a los inmunotipos, la heterogeneidad que presentan los LPS del meningococo también ha servido para establecer un sistema de clasificación utilizando los LPS purificados, mediante la técnica de la inhibición de la hemaglutinación (IHA) y el uso de un ELISA con AcM. (28)
Aunque el empleo de AcM ha facilitado el inmunotipaje sigue resultando difícil su interpretación ya que los meningococos a veces expresan varios inmunotipos, lo cual puede estar bajo la influencia de las condiciones de crecimiento. Muchas veces éstos se omiten cuando se describe el fenotipo debido a que no siempre se realiza su determinación. (29)
Los inmunotipos son identificados con la letra L y se reconocen del 1 al 11 (L1-L11). Los L12 y L13 no están bien definidos aún. (30)
Estructura de superficie de Neisseria meningitidis usadas para caracterización fenotípica
Métodos genotípicos.
Los avances en la genética molecular han dado un nuevo enfoque a la epidemiología de la enfermedad meningocócica con el surgimiento de técnicas alternativas que brindan una potencial ventaja en la caracterización de las cepas. (31)
Dentro de los más empleados tenemos el análisis de restricción (AER), la restricción de fragmentos de diversas longitudes (RFLP), electroforesis en campo pulsante (ECP) y electroforesis de enzimas multilocus (EEM) entre otras. (32)
La electroforesis de enzima multilocus (EEM) ha sido usada en Neisseria meningitidis de grupo B para identificar clones específicos que producen enfermedad meningocócica y para estudiar la diversidad genética de estos organismos. (33) La técnica de enzima multilocus (EEM) permite estudiar el polimorfismo genético de los microorganismos a través de un análisis de la migración electroforética de las enzimas citoplasmáticas de las bacterias. Este método fue aplicado por primera vez en poblaciones bacterianas de meningococo de los serogrupos B y C en 1986.
Recientemente métodos de subtipaje basados en el manejo de ácidos nucleicos han emergido como otras alternativas. Por ejemplo el Ribotipaje, la Electroforesis en Gel de Campo Pulsado (EGCP) de macrofragmentos de ADN genómico, la técnica de Reacción en Cadena de la Polimerasa con análisis de restricción del gen Por A y la Amplificación de Fragmentos Polimórficos al Azar han sido usados en múltiples investigaciones epidemiológicas (34). La electroforesis en campo pulsante (ECP) y la enzima multilocus (EEM) han demostrado las habilidades discriminatorias más altas, para un índice de discriminación del 99.7% y 99.4% respectivamente.
A pesar de las limitaciones del sero/subtipamiento basado en AcM, éste sigue siendo un método atractivo debido a que éste es fácil de realizar, es relativamente poco costoso y no requiere de un equipamiento sofisticado, por lo que su uso es ideal en instituciones y países con limitados recursos. (35)
Susceptibilidad antimicrobiana
Se sabe que la nasofaringe humana constituye el único reservorio de Neisseria meningitidis. Conocida la importancia de los portadores sanos en la transmisión de la enfermedad, la eliminación de los meningococos de la nasofaringe rompe la cadena de transmisión y constituye una de las medidas primarias de acción sanitaria contra la enfermedad meningocócica. (36)
Existen 2 grupos bien diferenciados de drogas antimicrobianas en el manejo de la infección del estado de portador por Neisseria meningitidis (quimioprofilácticos y terapéuticos). Entre los quimioprofilácticos de eficacia probada se encuentran sulfamida, rifampicina, minociclina, espiramicida y ciprofloxacina. La penicilina, ampicillín, tetraciclina, eritromicina, cloranfenicol y cefalosporinas no son eficaces como agente quimioprofiláctico, pero son útiles en el tratamiento de casos clínicos. (36,37)
Penicilina
Descubierta por Fleming en 1929, quien la aisló del hongo Penicillium notatum se introduce en 1944 con gran eficacia.
La producción de beta-lactamasa por cepas de Neisseria meningitidis es extremadamente rara. La resistencia a los beta-lactámicos se debe a tres mecanismos: (38)
- Producción de beta-lactamasa.
Esta enzima fue descrita en 1940 por Abraham y Chain en E. coli y ha sido encontrada en una amplia variedad de bacterias. Constituye una familia diversa de enzimas capaces de desdoblar el anillo betalactámico de las penicilinas y cefalosporinas, perdiéndose su actividad biológica y considerándose una de las causas principales de su fracaso. Su clasificación ha variado desde 1968 hasta la fecha, en que se dividen en 4 grupos A, B, C y D, atendiendo a la especificidad del substrato, parámetros cinéticos y secuencias genéticas. (39)
- Alteraciones en la permeabilidad de la membrana citoplasmática.
Se ha reconocido que la disminución de la permeabilidad citoplasmática es de especial importancia, sobre todo para las bacterias gramnegativas, que tienen una pared externa más compleja en comparación con las bacterias grampositivas. Aún no se conoce bien el mecanismo por el cual se produce este fenómeno debido a que se han encontrado altos niveles de sensibilidad para otras moléculas de estructura similar a los beta-lactámicos, que utilizan las mismas porinas para atravesar la membrana externa. (40)
- Modificación de una o más proteínas receptoras de penicilina (PBP)
Mendelman en 1988 expresa que la disminución de la susceptibilidad a la penicilina en Neisseria meningitidis se debe a la producción de una forma alterada de las PBP2, que tienden a una menor afinidad por la droga. Esto es debido a una mutación del gen pen A, el cual codifica para las PBP2, en presencia de una presión selectiva constante. Una vez establecida una población bacteriana mutante inicial, es muy probable la producción de mutaciones adicionales, dando como resultado niveles más altos de resistencia. Los mecanismos de transmisión genética (transducción, conjugación y transformación) se consideran importantes en el origen de la resistencia moderada a la penicilina. Se han secuenciados genes Pen A de otras Neisserias tales como Neisseria lactámica, Neisseria polysachareae y Neisseria flavesscens, demostrándose que algunos fragmentos de los genes Pen A de distintas cepas de meningococo moderadamente resistentes a la penicilina son idénticos a los correspondientes fragmentos de estas cepas no patógenas, que de modo natural se comportan como moderadamente resistentes. (41)
Cloranfenicol
Fue descrito en 1947, posteriormente Kirby en 1952 estudió su eficacia en el tratamiento de MM. Alcanza altos niveles en el LCR con una concentración del 50% de la que alcanza en sangre, pudiéndose usar de manera efectiva, sobre todo en pacientes alérgicos a la penicilina. El cloranfenicol se usa en regiones endémicas de África, donde la detección de la infección y cepas resistentes a esta droga no es un hecho frecuente. (42)
Cefalosporina
En 1965 Eickhoff y Finland estudiaron la sensibilidad de Neisseria meningitidis a la cefalotina encontrándose una concentración inhibitoria mínima (CIM) entre 0.2 y 1.6 mg/ml. Sin embargo su uso y el de otras cefalosporinas de primera generación, tanto en tratamiento como en la profilaxis, no han tenido éxitos. Se han estudiado cefalosporinas de segunda generación (cefuroxima) en el tratamiento, pero las de tercera generación son más activas, como cefotaxima, ceftriaxona y ceftazidima. La concentración inhibitoria mínima (CIM) a las nuevas cefalosporinas de tercera generación es muy baja, generalmente inferior a 0.008 mg/ml. Existen diversos trabajos de comparación de estas cefalosporinas con la terapia convencional de ampicillina y cloranfenicol en meningitis bacteriana, cualquiera de los tres mencionados parece tener una eficacia similar. La ceftriaxona por su larga vida media en sangre y fácil administración (una sola dosis al día) resulta eficaz en el tratamiento, especialmente en epidemias en países en vía de desarrollo, también resulta efectiva en la quimioprofilaxis dando mejores resultados que la rifampicina en la erradicación de los portadores meníngeos. (43)
Sulfamida
Desde 1940 muestran su eficacia para Neisseria meningitidis y constituyen la principal arma para eliminar el estado de portador. Millan y colaboradores en los años 60 descubren las primeras cepas resistentes, éstas se aíslan en todo el mundo provocando grandes epidemias en Brasil, África y Europa, además de proliferar de forma endémica en España. Las sulfamidas son los mejores quimioprofilácticos en cuanto a efectividad, bajo costo y ausencia de efectos secundarios, siempre que la cepa a erradicar sea sensible. En los últimos 10 años se reportan ondas epidémicas donde la resistencia no ha bajado del 80%. (44)
Rifampicina
Sustituye a la sulfadiacina debido a la diseminación de cepas resistentes a ella. En 1969, la rifampicina demuestra su efectividad en la erradicación de portadores de meningococo, y se observa una reducción del 93% después de 4 semanas de su administración. Dentro del resto de los quimioprofilácticos la rifampicina es la droga que actualmente se recomienda en muchos países como sustituto de las sulfamidas, en numerosos trabajos se reporta el alto por ciento de erradicación del meningococo de la nasofaringe. Con el surgimiento de cepas resistentes a esta droga, se evalúan otras como la minociclina y la combinación de rifampicina y minociclina. (45)
Quinolonas
Son antibióticos con gran capacidad de penetración en tejidos faríngeos, secreciones nasales y saliva, mantienen niveles de concentración inhibitoria mínima (CIM) adecuados por más de 12 horas, reduciendo el estado de portador en un 93-97%. La ciprofloxacina muestra gran efectividad, la concentración inhibitoria mínima (CIM) frente a cepas de meningococo es muy baja (0.004 a 0.008 mg/ml) no detectándose cepas resistentes por lo que se recomienda su uso en la quimioprofilaxis de adultos. Pugsley y Renkonen evaluaron la ciprofloxacina en el tratamiento de portadores nasofaríngeos de Neisseria meningitidis demostrando su eficacia para este propósito. Por producir lesiones en el cartílago de crecimiento no se recomienda en niños ni en embarazadas. Por la posibilidad de administración en una sola dosis y su eficacia elevada ofrece nuevas posibilidades en campos militares. (46)
Situación mundial de la enfermedad
África
Los países más afectados por epidemias de enfermedad meningocócica son los que están en el “Cinturón Africano”. En 5 de estos países (Ghana, Chad, Níger, Nigeria y Burkina Fasso).
En la región del cinturón, las tasas de ataque son aproximadamente de 1000 por 100.000 habitantes. Las epidemias en esta zona provocadas por el meningococo serogrupo A no han disminuido a pesar de la utilización de vacunas, posiblemente la causa fundamental de este fenómeno sean los inadecuados e insuficientes programas de vacunación que alcanzan muy bajas coberturas en las edades de riesgo. En el año 1996 se reportó una gran epidemia en Nigeria, con un aproximado de más de 13 000 enfermos y 4 000 muertes, en Zambia se ha reportado también una gran cantidad de casos, aunque estos datos no son exactos ya que ninguno de estos dos países tienen una estadística de salud confiable. (47)
Las Américas
Se reportaron 73 147 casos, de ellos 2 857 en América Central y 48 457 en América del Sur, las tasas de mortalidad fueron más altas entre los jóvenes y ancianos que en edades intermedias. En los Estados Unidos el serogrupo A fue desplazado por el B y después por el C, sin embargo, el B fue aislado en la mayoría de los casos (56%), demostrado en estudios recientes. En Canadá el serogrupo C se ha convertido en endemia durante los últimos 30 años; el promedio anual de casos ha sido de 224 con tasa inferior a 2 por 100.000 habitantes.
Durante un período de 6 semanas, un brote de meningoencefalitis causado por meningococos del serogrupo C afectó en las provincias canadienses de Québec y Ontario a 10 adolescentes con un 50% de mortalidad. Esta cepa y otras 4 que comparten características antigénicas se han visto implicadas en un marcado incremento de brotes por el serogrupo C en Estados Unidos desde 1991 y forman parte de un gran complejo de cepas genéticamente relacionadas entre sí (ET-37) responsables tanto de pequeños brotes como de enfermedades esporádicas en el continente. En los Estados Unidos la incidencia anual de enfermedad meningocócica demuestra que un 46% de los casos infectados han sido niños menores de 2 años. No se observaron diferencias significativas con respecto al sexo y los serogrupos aislados fueron el B y C. (48)
Europa
Desde los años 70 la incidencia de esta enfermedad del serogrupo B se ha incrementado en varios países europeos incluyendo a Gran Bretaña (49).
Asia
Específicamente en China, la situación es más grave, la mortalidad ha sido alta y hay años de reportes de 55 a 400 casos por 100.000 habitantes aunque actualmente se observa un descenso ligero. La enfermedad ha sido causada principalmente por el serogrupo A. (49,50)
Las áreas del mundo que han experimentado recientemente enfermedad meningocócica epidémica son: Australia, Noruega, Holanda, China, Egipto, Arabia Saudita, Kenia y Este de Canadá.
Cuba: se continúa la vigilancia de la cepa patógena; en un estudio realizado en una escuela militar de Ciudad de La Habana, durante un período de baja endemicidad se obtuvo como resultado:
Los fenotipos NA:NT:P1.NST:L3.7.9 (25%), NA: NT:13:L3, 7.9 (19%) fueron los más frecuentes y sólo el 7.6% resultó B4:P1.15:L3.7.9, fenotipo causal de la epidemia ocurrida en Cuba. La reducción del índice de portadores de la cepa epidémica, así como la ausencia del serogrupo C, está relacionada con la inmunización masiva realizada en Cuba con VA-MENGOC-BC, entre 1987-90 y con su incorporación al Programa Nacional de Inmunizaciones, desde 1991. (51)
Bibliografía.
1. Martínez Mota I. Neisserias y Moraxella catarralis. Llop Hernández A, Valdés-Dapena Vivanco M, Zuazo Silva JL. Microbiología y Parasitología Médicas. 1ª Edición. Ciudad de La Habana: Editorial Ciencias Médicas; 2001. p.217-238.
2. Pan American Health Organization. Development of improved meningococcal vaccines with emphasis on group B. Washington, D.C; Pan Américan Health Organization; Mar. 1993. 18 p. (DRC/RDV, MASTRPLN.MEN).
3. Nicaragua. Ministerio de Salud. Dirección de Vigilancia Epidemiológica. Situación epidemiológica de la enfermedad meningocócica en Nicaragua. Managua; MINSA; 2004. 14 p. tab, graf. (Boletín epidemiológico, 49).
4. Hoeprich PD. Tratado de Enfermedades Infecciosas. 2 ed. Ciudad de la Habana: Editorial Científico técnico; 1982; T2. p. 897-909
5. Valcárcel NM; Rodríguez C; Terry H. La Enfermedad meningocócica en Cuba. Cronología de una epidemia.Ciudad de la Habana: Editorial Ciencias Médicas;1991.
6. Tomezzoli S, Juárez M del V, Rossi S I, Lema D A, Barbaro CR, Fiorini S. Abdomen agudo como manifestación inicial de meningococemia. Arch. Argent. Pediatr. 2008; 106(3):260-263, jun.
7. Scholten RJPM. Lipo-oligosaccharide immunotying of Neisseria Meningitidis by whole- cell ELISA with monoclonal antibodies. J. Med. Microbiol 1994; 41(4):236-43.
8. Abdillahi H & Poolman JT. Whole-cell ELISA for typing Neisseria meningitidis with monoclonal antibodies. {Letter} FEMS Microbiol 1987;48: 367-71.
9. Abdillahi H & Poolman JT. Definition of meningococcal class 1 OMP subtyping antigens by monoclonal antibodies. FEMS Microbiol Immunol 1988; 1:139-144.
10. Martínez I, Patton AS, Sotolongo F, Llop A, Sosa J. Caracterización de cepas de Neisseria meningitidis Grupo B. ACTA CIENTIFICA SVBE 1994; 3(1):31-4.
11. Sáez-Nieto JA. Resistencia a antimicrobianos en Neisseria meningitidis. Enf Infec Microbiol Clin 1988; 6(10): 450-3.
12. Campos J. Detection of relatively penicillin resistant Neisseria meningitidis by disk susceptibility testing. Antimicrob Agents Chemother 1987; 1478-82.
13. Sutcliffe EM, Jones DM. El-SheikhS. Penicillin-insensitive meningococci inthe UK {letter}. Lancet 1988; 1:657-8.
14. Sáez-Nieto JA, Campos J. Penicillin-resistant strains of Neisseria meningitidis in Spain {letter}. Lancet 1988; 1:1452-3.
15. Botha P. Penicillin-resistant Neisseria meningitidis in southern Africa {letter}. Lancet 1988; 1:54.
16. Valdés MJ, Martínez I, Sierra G, Camaraza MA, Cuevas I, Mirabal M, Rodríguez P, Fuentes Y, Bolaños G, Villasusa I. Portadores de Neisseria meningitidis, caracterización de las cepas aisladas y respuesta inmune basal a VA-MENGOC-BC. Vaccimonitor. 2008; 17(2): mayo-ago.
17. Núñez N, Martínez I, Izquierdo L, Álvarez N, López O. Portadores de Neisseria meningitidis y Neisseria lactámica en tres grupos de edades diferentes. Vaccimonitor. 2007; 16 (2): Mayo-ago.
18. Benson CA. Acute neurologic infectins. Med. Clin. North. Am 1986; 70(5):987-1011.
19. Martínez Motas I, Sierra González G, Núñez Gutiérrez N, Izquierdo Pérez L, Climent Ruíz Y, Mirabal Sosa M. Caracterización de cepas de Neisseria meningitidis aisladas de portadores en Cuba durante 20 años. Rev. cuba. med. Trop. 2006; 58(2): Mayo-ago.
20. Martínez Isabel, Sierra G, Núñez N, Izquierdo L, Climen Y, Mirabal M. Caracterización fenotípica de cepas invasivas de Neisseria meningitidis aisladas en Cuba durante 20 años. Vaccimonitor.2006; 15(1): enero-abr.
21. Camaraza MA, Ochoa R, Arnet AG, Sotolongo F, Martínez I, Cuevas I, Hernández D. Inmunogenicidad inducida por la vacuna antimeningocócica VA-MENGOC-BC® contra la cepa de Neisseria meningitidis ATCC C11 en adolescentes después de 12 años de vacunados. Rev. cuba. med. trop.2004; 56 (1): enero-abr.
22. Ferreira RJ, Porco GA. Vacunas derivadas del análisis de los genomas: vacunología inversa. Interciencia. 2008; 33(5):353-358, may.
23. Gabastou Jean-Marc, Agudelo C I, Brandileone M C de C, Castañeda E, Lemos A Silva de, Di Fabio, J L. Caracterización de aislamientos invasivos de S. pneumoniae, H. influenzae y Neisseria meningitidis en América Latina y el Caribe: SIREVA II, 2000-2005.Rev. panam. salud pública= Panam. J. public health .2008; 24(1):1-15, jul.
24. Tuyama M, Boente RF, Rebelo MC, Igreja RP, Barroso DE. The utility of the polymerase chain reaction assay for a etiologic definition of unspecified bacterial meningitis cases. Mem. Inst. Oswaldo Cruz. 2008; 103(2):138-142, mar.
25. Parra E, Castañeda E, Moreno J. Identificación de Haemophilus influenzae, Streptococcus pneumoniae y Neisseria meningitidis por reacción en cadena de la polimerasa. Biomédica (Bogotá). 2007; 27(3):454-460, sept.
26. Toro E, Fernández S, Rodas A, Franco E, Flores A. Tipificación por electroforesis en campo eléctrico pulsado (PFGE) de cepas de Neisseria meningitidis, aisladas de un brote de infección meningocóccica en un fuerte militar en Caracas. Rev. Inst. Nac. Hig. 2005; 36(1):28-34.
27. Barroso D E, Rebelo MC. Recognition of the epidemiological significance of Neisseria meningitidis capsular serogroup W135 in the Rio de Janeiro region, Brazil. Mem. Inst. Oswaldo Cruz. 2007; 102(6):773-775, sept.
28. Oliveira Anderson MF, Santos Jose EF, dos Oliverira LL. Ouza Luciana BS, de Santana WJ, Coutinho Henrique DM. Fatores de virulência de Neisseria spp. Arq. ciencias saúde UNIPAR. 2004; 8(1):39-44, jan.-abr.
29. Failace L, Wagner M, Chesky M, Scalco R, Jobim LF. Simultaneous detection of Neisseria meningitidis, Haemophilus influenzae and Streptococcus sp. by polymerase chain reaction for the diagnosis of bacterial meningitis. Arq. Neuropsiquiatr. 2005; 63(4):920-924, dez.
30. MacFaddin. Pruebas Bioquímicas para la Identificación de Bacterias de Importancia Clínica. 3ª edición. Ciudad de La Habana: Editorial Ciencias Médicas; 2006. P.236-253.
31. Apiacella MA. Neisseria meningitidis: En Mandell GL, Bennett JE, Dollin R, editores. Enfermedades infecciosas. Principios y practica. 4a ed. Buenos Aires: Editorial Médica Panamericana; p.2125-2135, 1997.
32. Sotolongo F, et al. Neisseria meningitidis. Aspectos teóricos prácticos sobre el diagnóstico, clasificación y valoración de la respuesta inmune. Serie monográfica, Ciudad de la Habana. Ediciones Finlay; p.2-14, 1995.
33. Koneman EW, Allen SD, Janda WM. Neisseria. Diagnóstico Microbiológico. 14 ed. México. Editorial Médica Panamericana. P.321-324, 1992.
34. Pohlner J, Halter R, Beyreuther K, Meyer TR. Gene structure and extracellular secretion of Neisseria gonorrhoeae IgA protease. Nature 1987;325:458-462.
35. Brooks GF, Lammel CJ, Blake MS, Kusecek B, Achtman M. Antibodies against IgA1protease are stimulated both by clinical disease and asyntomatic carreage of serogroup A. Neisseria Meningitidis. J Infect. Dis 1992;166:1316-1321.
36. Silva Marcos V, Marotto Paulo CF, Stocco Joyce M, Richtmann R, Ramalho M de O. Curso Temas de Antibioticoterapia - Aula 5: Antibióticos em infecções graves. J. bras. med.2004; 86(6):39-62, jun
37. Frasch CE, Mocca LF,. Determinación del serogrupo y el serotipo en los grupos epidemiológicos de la Enfermedad meningocócica. Revista de laborat 1981;71:437-54.
38. Teló Enio P, Machado Alice BM, Schmitt VM, Chesky M. Determinação do limite mínimo de detecção da técnica de pcr "semi-nested" para Neisseria meningitidis, Haemophilus influenzae e Streptococcus pneumoniae. Rev. Bras.anal.clin. 2007; 39(3):197-200.
39. Wilfert CM, Gutman LT. Neisseria. En Joklik WK, Willet HP, Amos DB, Wilfert CH. Zinsser Microbiology. 20 ed. Appleton and lange, 1992; p.445-50.
40. Barroso D E, Silva LA. Neisseria meningitidis: a neglected cause of infectious haemorrhagic fever in the amazon rainforest. Braz. J. infects. dis. 2007; 11(6):598-602, dec.
41. Falcão Mário C, Andrade Samantha B, Ceccon ME. Neonatal sepsis and meningitis caused by Neisseria meningitidis: a case report. Rev. Inst. Med. Trop. Sao Paulo. 2007; 49(3):191-194, May-June.
42. Restrepo Jaramillo B N, Aguirre C, Upegui G, Carrizosa M J. Características del manejo hospitalario y oportunidad de la consulta en pacientes con meningitis por Neisseria meningitidis y Haemophilus influenzae tipo b. Medellín, Colombia. CES med. 2005; 19(2):47-55, julio-dic.
43. Bakir J, Gentile A. Enfermedad meningocóccia: su prevención. Rev. Hosp. Niños B. Aires. 2005; 47(214):233-245, oct.
44. Stella-Silva N, Oliveira Solange A, Marzochi Keyla BF. Doença meningocócica: comparação entre formas clínicas. Rev. Soc. Med. Trop. 2007; 40(3):304-310, maio-jun.
45. Lemos Ana Paulo Silva de. Descrição de um novo clone de Neisseria meningitidis Sorogrupo C, Grande São Paulo, 1990 a 2003. São Paulo; s.n; 2005. 119.
46. Castilhos Kelli F; Santos Luciane O; Silva Alexandre R; Ohlweiler L; Rotta Newra T. Achados neurológicos em crianças internadas no Hospital de Clínicas de Porto Alegre por meningococcemia: estudo de 34 casos. Rev. AMRIGS; 2003. 47(1):54-56, jan.-mar.
47. Bricks Lucia F. Doenças meningococicas: morbidade e epidemilogia nos ultimos 20 anos: revisão. Pediatria (SAo Paulo). 2002; 24(3/4):122-131.
48. Paniagua Matías M, Frisone Horacio M, Romero J P, Merino D E. Meningitis en población pediátrica de la provincia de Corrientes (Argentina). Prensa méd. argent. 2007; 94(6):367-373, ago.
49. Bricks Lucia F. Doenças meningococicas: morbidade e epidemilogia nos ultimos 20 anos: revisão. Pediatria (SAo Paulo). 2002; 24(3/4):122-131.
50. Pérez García MaC, Picón Manduca Teresa, Galazka Cukieri TB, Quian Rivero JW, Gutiérrez Rodríguez SI, Ferrari Castilla Ama, Montano Benthencourt NM; Rubio Santoro IM. Enfermedad invasiva meningocócica en Uruguay. Informe epidemiológico y recomendaciones, mayo 2002. Rev. Méd. Urug. 2002; 18(1):83-88, mayo.
51. Núñez Gutiérrez N, Martínez Motas I, Izquierdo Pérez L, Mirabel Sosa M, Sierra González G. Prevalencia y dinámica de portadores asintomáticos de Neisseria meningitidis en estudiantes universitarios de una escuela militar de Ciudad de la Habana. Rev. panam. Infectol. 2006; 8(1):9-17, enero-mar.