Las consecuencias de la anemia en el paciente crítico incluyen una inadecuada oxigenación tisular y eventualmente isquemia de los órganos terminales como pulmón, corazón, hígado y cerebro. La decisión de transfundir depende de un juicio clínico, que requiere sopesar los posibles beneficios y los riesgos conocidos. Una alternativa, largamente anhelada, ha sido la búsqueda de sustancias transportadoras de oxígeno, sustitutos artificiales de los eritrocitos. Estas soluciones capaces de transportar oxígeno, que en los últimos años han motivado un creciente interés y desarrollo basado en sus potenciales ventajas, como la biocompatibilidad, ausencia de transmisión de enfermedades infecciosas y fácil conservación, se encuentran muchas en estadios experimentales, pero significan un gran paso de avance en la solución de un problema que se torna difícil desde varios puntos de vista. Estos compuestos junto a las nuevas generaciones de coloides están marcando un punto de viraje en el uso de los fluidos en el paciente crítico. Conocer en que momento nos encontramos de este camino nos motivó a realizar una breve revisión sobre algunos de los sustitutos de componentes sanguíneos en tentativa o de uso en la práctica médica.
Articulo de revisión. Sustancias transportadoras de oxígeno.
MSc. Dr. Francisco José Pérez Santos. Especialista en Medicina Familiar. Especialista en Medicina Interna. Diplomado en Cuidados Intensivos. Máster en Ciencias en Urgencias Médicas.
Dra. Johanna Díaz Landeira. Especialista en Medicina Familiar. Especialista en Cardiología.
MSc. Dra. Jacqueline Domínguez García. Especialista en Medicina Interna. Diplomado en Cuidados Intensivos. Máster en Ciencias en Urgencias Médicas.
MSc. Dr. Julián Morejón Chávez. Especialista en Medicina Interna. Especialista en Medicina Intensiva y Emergencia. Máster en Ciencias en Urgencias Médicas. Profesor Asistente en Medicina Intensiva.
Dra. Maricela Cruz Pérez. Especialista en Medicina Familiar. Especialista en Cardiología.
MSc. Dra. Ivonne Elizalde Guzmán. Especialista en Medicina Familiar y Medicina Intensiva y Emergencias. Máster en Ciencias en Urgencias Médicas.
Correspondencia: MSc. Dr. Francisco José Pérez Santos. Calle 2ª edifico E apartamento A entre B y C, reparto Poey, Arroyo Naranjo, Ciudad de la Habana, Cuba. Hospital Clínico-Quirúrgico ¨Hermanos Ameijeiras¨ Unidad de Cuidados Intensivos de Cirugía Cardiovascular
Resumen
Las consecuencias de la anemia en el paciente crítico incluyen una inadecuada oxigenación tisular y eventualmente isquemia de los órganos terminales como pulmón, corazón, hígado y cerebro. La decisión de transfundir depende de un juicio clínico, que requiere sopesar los posibles beneficios y los riesgos conocidos. Una alternativa, largamente anhelada, ha sido la búsqueda de sustancias transportadoras de oxígeno, sustitutos artificiales de los eritrocitos.
Estas soluciones capaces de transportar oxígeno, que en los últimos años han motivado un creciente interés y desarrollo basado en sus potenciales ventajas, como la biocompatibilidad, ausencia de transmisión de enfermedades infecciosas y fácil conservación, se encuentran muchas en estadios experimentales, pero significan un gran paso de avance en la solución de un problema que se torna difícil desde varios puntos de vista. Estos compuestos junto a las nuevas generaciones de coloides están marcando un punto de viraje en el uso de los fluidos en el paciente crítico. Conocer en que momento nos encontramos de este camino nos motivó a realizar una breve revisión sobre algunos de los sustitutos de componentes sanguíneos en tentativa o de uso en la práctica médica.
Palabras clave: Perfluorocarbonos, Sustitutos sanguíneos, Hemoglobina libre de estroma, Transportadores de oxígeno.
Abstract
The anemia itself can cause organ dysfunction in the lung, heart, gut, and brain. Anemia in the ICU is primarily a result of blood loss and dilution from excess fluid administration. The magnitude of blood transfusion in the critically ill patient population is quite large and responsible for a large proportion of the blood transfused in hospitals. Criteria for these procedures have become more stringent because of the increased awareness of infectious diseases. In addition, use of blood components has largely replaced use of whole blood; only the components necessary to fulfill specific patient needs are transfused. New hematologic agents are being researched in hopes of filling the demanding needs in many conditions in critical care and other fields. In an effort to develop agents that enhance the oxygen-delivery capability of blood in the case of acute severe anemia without the risks associated with allogeneic blood transfusions, several products are undergoing development and clinical trials. So we were motivate to review current knowledge about cell-free hemoglobin solutions and others blood substitutes and oxygen carriers.
Key words: Fluorocarbons, Blood substitutes, Oxygen carriers, Hemoglobins, Stroma-free hemoglobin.
Introducción.
Las consecuencias fisiopatológicas de la anemia en el paciente crítico incluyen una inadecuada oxigenación tisular y eventualmente isquemia de los órganos terminales. Esto puede depender tanto de una disminución en la disponibilidad como de un aumento del consumo de oxígeno. (1) Las transfusiones sanguíneas pueden incrementar la disponibilidad de oxígeno en los pacientes críticos, aunque el uso excesivo con este fin puede no ser útil en todos los pacientes. (2)
La transfusión sanguínea se considera un trasplante de órganos. Con ella se pasa de un individuo a otro, una gran cantidad de células y sustancias químicas, la mayoría extrañas para el paciente que las recibe. Se considera en los centros de excelencia, que no transfundir es medicina de un nivel muy superior a aquella basada en transfusiones realizadas deliberadamente. (3) En posesión de esta información y conociendo los resultados imprevisibles de las transfusiones, se torna vital el manejo adecuado de estas, por un lado evitamos la pérdida de un producto precioso, que pudiera emplearse en la industria médico-farmacéutica y, por otro lado, evitamos un daño potencial a un ser humano que confía en nuestro juicio y conocimiento. (4,5)
Cada año se administran 15 millones de transfusiones en Estados Unidos. La decisión de transfundir depende de un juicio clínico, que requiere sopesar los posibles beneficios y los riesgos conocidos frente a los tratamientos alternativos. (1) En la actualidad, las transfusiones son, probablemente, más seguras que nunca, pero el riesgo, así como la percepción del mismo y el temor a la transmisión de enfermedades del público, obligan a obtener el consentimiento informado del paciente. (6)
Una parte del problema es la oposición de ciertos sectores al uso de cualquier hemoderivado, incluso las transfusiones autólogas. La ética fundamental de religiones prominentes tiene como centro un dador de vida quien expresó sus pensamientos sobre la vida y la sangre. La Biblia hace más de 400 referencias a la sangre, y a veces la conecta con la salvación de la vida. (7-9) Las interpretaciones teológicas de estas han sido diversas y fuente de contradicciones entre grupos religiosos, algunos de los cuales como los Testigos de Jehová las han hecho centro de su predica lo que ha motivado contradicciones éticas, filosóficas y jurídicas. (10,11)
Otra arista es que el precio de las unidades de sangre se ha disparado en los últimos tiempos y esta tendencia continuará en el futuro inmediato. El precio del concentrado de hematíes en Estados Unidos se sitúa actualmente en 470 dólares. En España el costo oscila entre los 90 y 100 dólares. (12,13)
Cada vez más se aboga por un uso racional de la sangre. Se hace referencia a las consecuencias derivadas de enfermedades emergentes que pueden transmitirse por la sangre, algunas de ellas desconocidas y para cuya detección la investigación resulta muy cara. La necesidad de extremar el control de la sangre ha llevado a algunos países a decidir que los pacientes que han sido transfundidos no pueden donar sangre. (14,15)
Se han propuesto una serie de elecciones posibles, como el uso de eritropoyetina, que ha demostrado ser efectiva y reducir la estadía hospitalaria. (16) El uso de las nuevas generaciones de almidones es una opción válida para reducir las necesidades sanguíneas. De la misma forma se avanza en nuevas generaciones más eficientes de recuperadores de sangre. (17)
Una alternativa, largamente anhelada, ha sido la búsqueda de sustitutos artificiales de los eritrocitos, de sustancias transportadoras de oxígeno, a la que la comunidad científica ha encaminado sus pasos, aún temerosos, como en un viaje iniciático, desconocido, pero que se anuncia promisorio.
Estas soluciones capaces de transportar oxígeno, que en los últimos años han motivado un creciente interés y desarrollo basado en sus potenciales ventajas, como la biocompatibilidad, ausencia de transmisión de enfermedades infecciosas y fácil conservación, se encuentran muchas en estadios experimentales, pero significan un gran paso de avance en la solución de un problema que se torna difícil desde varios puntos de vista. Estos compuestos junto a las nuevas generaciones de coloides están marcando un punto de viraje en el uso de los fluidos en el paciente crítico. Conocer en que momento nos encontramos de este camino nos motivó a realizar una breve revisión sobre algunos de los sustitutos de componentes sanguíneos de uso en la práctica médica o en tentativa.
Desarrollo. Transportadores artificiales de oxígeno.
Recuento sobre transporte de oxígeno en el organismo y respiración celular.
La evolución de los organismos unicelulares requirió del desarrollo de métodos eficientes para utilizar la energía contenida en los compuestos carbonados. Las células desarrollaron estructuras especializadas, las mitocondrias, para utilizar el oxígeno (O2) molecular como aceptor de electrones provenientes de los compuestos orgánicos. A partir de ello fueron capaces de generar y almacenar grandes cantidades de energía en forma de trifosfato de adenosina (ATP). (18)
En los vertebrados superiores el aporte de oxígeno a los tejidos se lleva a cabo por la acción combinada de los pulmones, el sistema cardiovascular y la sangre. El proceso se realiza a través de un gradiente decreciente de la presión parcial de oxígeno desde la atmósfera hasta la mitocondria celular. El oxígeno no se almacena en ningún tejido, excepto en el músculo donde puede encontrarse como parte de la oximioglobina, por ello el metabolismo aerobio depende del aporte constante de oxígeno. La cantidad de oxígeno transportado a los tejidos está en función de la concentración de hemoglobina sanguínea, del oxígeno unido a ésta (saturación de hemoglobina) y del flujo sanguíneo (gasto cardíaco). (18) Según la fórmula:
DO2 = CaO2 x IC
Donde:
CaO2, contenido arterial de oxígeno: (1,34 x Hb x SatO2) + (0,0031 x PaO2)
IC, índice cardíaco: litros por minutos de sangre que bombea el corazón con relación a la superficie corporal.
El oxígeno es transportado en la sangre principalmente por la hemoglobina. El objeto de este sistema de transporte es asegurar que aún las células más remotamente situadas se expongan a una adecuada concentración de oxígeno. En condiciones normales una mínima cantidad de oxígeno se encuentra disuelta en el plasma. (18)
La curva de disociación de la hemoglobina describe la relación entre la saturación de la hemoglobina y la tensión de oxígeno en la sangre (PO2). La P50 se define como la tensión de oxígeno en la sangre (PO2) necesaria para producir una saturación del 50% de la hemoglobina y es una manera conveniente de expresar la afinidad de esta por el oxígeno. La P50 normal es de alrededor de 27 milímetros de mercurio (mmHg) una reducción de esta significa una aumento de la afinidad por el oxígeno y una desviación de la curva hacia la izquierda. Un aumento de la P50 indica una disminución de la afinidad por el oxígeno y una desviación de la curva a la derecha. (18)
La integridad y el desarrollo normal de las diferentes funciones celulares, órganos, sistemas y en último término del cuerpo humano, dependen de su capacidad de generar energía, fundamentalmente con la glucólisis. Habitualmente se realiza en presencia de oxígeno (metabolismo aerobio) y se genera acetyl-CoA, que entra en el ciclo de Krebs produciéndose dióxido de carbono (CO2) y agua con liberación de energía (36 moles de ATP por cada mol de glucosa). En ausencia de oxígeno (metabolismo anaerobio) se genera ácido láctico con liberación de sólo 2 moles de ATP por cada mol de glucosa. La utilización de éste es por tanto decisiva para el correcto funcionamiento celular. (19)
Para una misma demanda metabólica, si el transporte de oxígeno (DO2) disminuye, la proporción de oxígeno que es extraída por los tejidos aumenta y el consumo de oxígeno (VO2) permanece constante. Es decir, un descenso del transporte de oxígeno se compensa con un incremento de la extracción tisular de oxígeno (EO2) sin que varíe el transporte de oxígeno, que en estas condiciones está en función de los requerimientos metabólicos y es independiente de los cambios en el transporte de oxígeno. Sin embargo, el aumento de la extracción tisular de oxígeno es limitado y cuando el transporte de oxígeno alcanza un nivel crítico (300-330 ml/min/m2) la extracción es máxima y descensos mayores del transporte de oxígeno no pueden ser compensados. (20,21)
En estas condiciones el consumo de oxígeno es dependiente de la disponibilidad de oxígeno y no de la demanda metabólica. El desequilibrio entre la demanda metabólica de oxígeno y el transporte de oxígeno se traduce en un déficit de oxígeno que conlleva un metabolismo celular anaerobio con aumento de la producción de lactato y acidosis metabólica. Cuando esta situación se prolonga lo suficiente, se agotan los depósitos intracelulares de fosfatos de alta energía y se altera la función celular, con pérdida de la integridad y lisis celular, lo que en definitiva se manifiesta como una disfunción de diferentes órganos y sistemas que compromete la vida del enfermo. (18)
De los factores que influyen sobre el transporte de oxígeno el más importante y, junto con la reposición volémica, el más urgente de reponer en situaciones de shock hemorrágico, es el valor de hemoglobina (Hb) en la sangre circulante. El objetivo final de la transfusión de glóbulos rojos es mejorar la inadecuada entrega de oxígeno o revertir la isquemia cuando el volumen intravascular y la función cardiaca son adecuados para la perfusión de los tejidos y debe ser usada cuando el tiempo y la condición fisiopatológica del paciente descartan otro manejo. (22)
La transfusión de hemoderivados no está exenta de riesgos; de forma inmediata, e independientemente del riesgo de reacción hemolítica aguda por error ABO, se produce hipotermia de causa multifactorial: porque el paciente crítico padece hipotermia, porque en la situación de emergencia suele aumentarse la hipotermia (exploraciones, manipulaciones sistémicas, etc) y porque la sangre se almacena a 1-6 º C y su transfusión en ocasiones masiva (> 100 ml/min) provoca hipotermia en muchas ocasiones refractaria al uso de calentadores sistémicos y de fluidos. (23)
También pueden presentarse problemas metabólicos relacionados con la transfusión de concentrados de hematíes: hiperkaliemia por acumulación de potasio (K) a lo largo del período de almacenamiento de la sangre que, en general, tiene poca trascendencia clínica ya que la cantidad absoluta de potasio es, en términos generales modesta y el paciente suele estar hipopotasémico e hipocalcemia por toxicidad cítrica, en casos de transfusión rápida de plaquetas y plasma (por encima de 20 ml/kg); no obstante, la hipocalcemia observada en casos de transfusión masiva también tiene origen multifactorial y escasa trascendencia clínica por lo que no se recomienda el uso generalizado de tamponadores específicos; por otra parte, el citrato infundido es una molécula con pH ácido que puede contribuir a la producción acidosis metabólica. (14)
Existen también otros problemas relacionados con la transfusión de hemoderivados que, si bien deben ser despreciables en el momento de la reanimación aguda de los pacientes en shock, sí deben ser tenidos en cuenta para las fases clínicas posteriores, tales como contaminación bacteriana (especialmente con plaquetas), transmisión de enfermedades virales y bacterianas, priones y zoonosis, distress respiratorio post-transfusional e inmunomodulación. (22)
El agente infeccioso más comúnmente trasmitido es el citomegalovirus, si bien no representa un problema significativo para el paciente inmunocompetente. Las hepatitis post-transfusionales representan la infección, clínicamente significativa más frecuente. El desarrollo de test diagnóstico para hepatitis C en donantes ha reducido el riesgo de contaminación, sin embargo los test para hepatitis B y HIV no han hecho desaparecer totalmente este riesgo. (24) Los riesgos infecciosos e inmunológicos de la transfusión de sangre homóloga pueden resumirse de la manera siguiente:
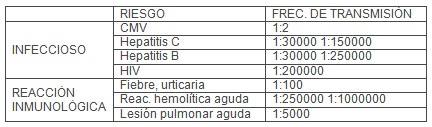
Existen abundantes datos reconociendo que las transfusiones de sangre homóloga ejercen acciones inmunosupresoras inespecíficas, existe un deterioro de los natural killer, de la función de los macrófagos y una disminución de la relación Linfocitos T Helper/Supresor. Además, hay una correlación entre el deterioro funcional y la cantidad de sangre transfundida. (24)
En paralelo, se discute también la capacidad oxiférica de la sangre almacenada por tiempo prolongado. Durante este período de tiempo (42 días en la actualidad), los hematíes sufren modificaciones evolutivas en su membrana que les hacen perder flexibilidad en la microcirculación, padecen oxidación lipídica y hemólisis y, al final del período de almacenamiento, la concentración de 2,3 DPG es casi indetectable con pérdida de capacidad de transporte durante las primeras horas tras su infusión. El impacto clínico de estas modificaciones es, por el momento, desconocido pero en estudios observacionales se ha demostrado correlación estadística entre la ancianidad de los hematíes transfundidos y aumento de morbilidad posterior (infecciones). Por todo lo anteriormente descrito y por la constatación de la utilidad de la anemia permisiva en pacientes críticos se están modificando los criterios transfusionales, en la actualidad se aconseja buscar valores de hemoglobina óptima adaptados a la situación y respuesta clínica individualizada de cada paciente. (25-27)
La política actual para la reposición de la capacidad de la sangre para transportar oxígeno debe estar basada en la necesidad de aumentar el aporte de oxígeno en aquellos pacientes que son incapaces de alcanzar o cubrir las demandas mediante los mecanismos cardiopulmonares normales y, por tanto, evitar la hipoxia tisular. La corrección de la hipovolemia se considera prioritaria ya que permite la puesta en marcha de estos mecanismos. (28)
Desdichadamente no existe una cifra de hemoglobina como umbral de transfusión, ya que no valora la repercusión fisiológica de la anemia; la decisión debe ser siempre individualizada en función de las necesidades y situación del paciente. El uso de umbrales transfusionales restrictivos y liberales no ha arrojado diferencias en la mortalidad de los pacientes lo que inclina la balanza hacia los primeros. Ensayos clínicos dirigidos a maximizar el aporte de oxígeno a valores supranormales no han conseguido demostrar una reducción en la mortalidad. Los intentos de definir el umbral de transfusión con relación a parámetros metabólicos han tenido un éxito limitado. Se han propuesto como marcadores parámetros oximétricos como la PvO2, la SvO2 o la tasa de extracción de oxígeno. (29)
En este contexto surgen los transportadores sintéticos de oxígeno los que se encuentran en fase experimental algunos de ellos todavía. El sustituto ideal es aquel capaz de brindar los mismos beneficios que el componente natural, no trasmitir agentes infecciosos, no producir efectos adversos de envergadura, no provocar aloinmunización, no requerir pruebas de compatibilidad, ser estable a temperatura ambiente y permitir un almacenamiento fácil y prolongado. (30) En la actualidad no existe un sustituto que reúna todas estas condiciones. A continuación se describen las características, estadio de desarrollo y aplicación clínica de los sustitutos de la sangre en desarrollo, los que se dividen en 2 categorías:
- Productos que utilizan hemoglobina libre en forma de moléculas en solución.
- Las emulsiones y compuestos altamente fluorinados conocidos como perfluorocarbonos.
Soluciones de hemoglobina.
La hemoglobina es una elección obvia como sustituta de la transfusión de eritrocitos al ser el pigmento respiratorio de los mismos. La primera infusión intravascular de hemoglobina se realizó en 1916 por Stellards y Minot; desde entonces se han hecho múltiples intentos para su empleo terapéutico. (30)
Un aspecto importante en la preparación de las soluciones de hemoglobina es su fuente de obtención. De forma ideal debe emplearse hemoglobina humana y una fuente de esta pueden ser los eritrocitos caducos de los bancos de sangre; sin embargo, en los últimos años, con la optimización del almacenamiento, los medios de manipulación y conservación, se ha reducido el número de unidades caducas en los bancos de sangre y existe consecuentemente una disminución de esta fuente de obtención. Una fuente alternativa de obtención lo constituye el empleo de hemoglobina de origen animal. (5)
Hemoglobina libre de estroma.
Cuando se transfunde un extracto de hemoglobina, el estroma eritrocitario infundido actúa como un antígeno que puede combinarse con los anticuerpos de receptor y causar coagulación intravascular diseminada (CID) y fallo renal. Cuando se remueve el estroma, la solución de hemoglobina se convierte en un producto relativamente no tóxico al eliminarse la toxicidad renal y al no poseer sistema antigénico ABO, permite la transfusión sin necesidad de conocer previamente el grupo sanguíneo del paciente. (31)
La vida media de la hemoglobina libre de estroma es corta. La hemoglobina libre permanece en la circulación solo de 2 a 4 horas. Fuera del eritrocito, la molécula tetramérica de hemoglobina se disocia en dímeros y monómeros que se aclaran rápidamente en el riñón. La hemoglobina también se une con proteínas del plasma como la haptoglobina y se aclara por células del sistema retículo endotelial. (30)
La hemoglobina liberada de los eritrocitos pierde su habilidad para unir 2,3 DPG, el cual es esencial para una baja afinidad por el oxígeno, expresada por la P50. Esto resulta en una inaceptable alta unión al oxígeno (P50 = 15 mm de Hg), con una desviación a la izquierda de la curva de disociación del oxígeno. Una solución a este problema es la piridoxilación de la hemoglobina con piridoxal-5 fosfato (análogo del 2,3-DPG), el cual reduce la afinidad por el oxígeno a los valores de la sangre normal (P50 = 27 mm de Hg). Desdichadamente, la hemoglobina piridoxilada tiende a disociarse en fragmentos pequeños y se excreta por los riñones en pocas horas. (32)
Existen diferentes métodos para estabilizar la molécula de hemoglobina en solución y alargar su vida media en la circulación, entre ellos: el uso de enlaces cruzados intramoleculares que estabilizan el tetrámero para prevenir la disociación; acoplarla covalentemente a polímeros como el polietilenglicol que produce un tetrámero conjugado y el empleo de enlaces cruzados intermoleculares (con glutaraldehído o rafinosa) los que producen un polímero de hemoglobina de alto peso molecular. Con el empleo de estos métodos se logra alargar la vida media intravascular de la solución de 15 a 30 horas. Por otra parte parecen tener un menor potencial de efectos adversos. (33)
Las soluciones de hemoglobina producen varios efectos tóxicos indeseados, tales como:
Nefrotoxicidad: debida a la contaminación con detritus celulares, hierro y grupo hem libre fundamentalmente. Puede haber necrosis tubular, marcadamente en los túbulos proximales, estos efectos son dosis dependiente, y están relacionados con toxicidad directa y son reversibles por lo que pueden determinarse las dosis de tolerancia. (34)
Efectos cardiovasculares.
La molécula de hemoglobina no modificada puede producir vasoconstricción, con el consiguiente aumento de la tensión arterial sistémica y pulmonar, así como de las resistencias vasculares y disminución de la frecuencia cardiaca y del gasto cardíaco. Existen diferencias en los efectos sobre la viscosidad sanguínea en los estudios en vivo y en vitro. (35,36)
La vasoconstricción ha sido relacionada con el hecho de que los tetrámeros de hemoglobina extravasados se unen al óxido nítrico derivado del endotelio vascular e impiden su efecto vasodilatador, aunque no solo parece depender de este mecanismo, ya que algunas modificaciones químicas son capaces de disminuir estos efectos, como el aumento del radio molecular conservando intacta la tasa de unión al óxido nítrico. (37,38) A pesar de la vasoconstricción el incremento de la extracción de oxígeno en combinación con el transporte plasmático provee un incremento de la oxigenación aún en los tejidos postestenóticos. También han demostrado que pueden incrementar la disponibilidad de oxígeno en aquellas zonas de la microcirculación de tejidos dañados donde decrece, como puede ser en la pancreatitis aguda y en zonas de isquemia miocárdica o cerebral o de injuria por reperfusión, (39-41)
Otros efectos tóxicos potenciales son la generación de radicales tóxicos y el aumento del riesgo de infección, debido a la liberación de radicales de oxígeno y al hierro libre, respectivamente. Otro riesgo importante es que ninguna fuente de hemoglobina está exenta de infección, en particular la hemoglobina bovina puede trasmitir la encefalopatía espongiforme bovina. (42)
Dentro de las ventajas de estos productos se encuentra que pueden tener una capacidad de almacenaje superior, la hemoglobina polimerizada bovina puede guardarse a temperatura ambiente durante un periodo de 3 años. (43) Varios estudios clínicos han mostrado una disminución en el uso de unidades de glóbulos rojos en pacientes con sangramiento y sometidos a cirugía vascular, cardiaca y no cardiaca. En contraste con los perfluorocarbonos estos compuestos pueden administrarse a concentraciones de oxígeno atmosféricas. (31)
Pueden compensar el déficit de volumen intravascular en el shock hemorrágico, incluso la presión coloidosmótica y la perfusión de órganos y tejidos, manteniendo el transporte de oxígeno incluso en situaciones de pérdida total del volumen sanguíneo. (44)
En los últimos años se han desarrollado ensayos clínicos con algunas hemoglobinas modificadas y hemoglobinas humanas polimerizadas. Estas preparaciones se han empleado en ensayos clínicos fase III en pacientes con pérdidas de sangre profusas por trauma o de origen quirúrgico. (31)
Hemoglobina encapsulada.
Se produce rodeando la molécula de hemoglobina con liposomas que comprenden tanto fosfolípidos no inmunogénicos como fosfolípidos y grasas neutras. Estos liposomas son vesículas esféricas cerradas con un medio interno acuoso y una capa externa lipídica. (31)
Cuando además de la hemoglobina se incluye 2,3 DPG (2,3 difosfoglicerol) en el medio interno, la afinidad por el oxígeno disminuye a niveles similares a los observados en la hemoglobina en el interior de los eritrocitos. A las pocas horas de su administración endovenosa, el 50% de los liposomas se aclaran de la circulación por el sistema retículo endotelial del hígado y el bazo. La activación del complemento permanece como un problema en el uso de este tipo de hemoglobina b. El producto Neo red cells que incluye liposomas con hemoglobina humana y catalasa, se encuentra actualmente en estudio preclínico. (45,46)
Hemoglobina humana recombinante.
En los últimos años se han logrado significativos avances en la producción de hemoglobina humana recombinante empleando bacterias, levaduras o plantas modificadas genéticamente. La capacidad de unión al oxígeno de este tipo de hemoglobina es similar al de la hemoglobina humana normal y tiene las ventajas de no necesitar sangre humana o animal como fuente para su obtención, la ausencia de transmisión de agentes infecciosos y el suministro ilimitado. La principal limitante a sus potenciales usos es su corta vida media plasmática de alrededor de 12 horas después de la administración de una dosis de 50 gramos, equivalentes a 1 unidad de glóbulos. Otra limitante consecuencia de su corta vida media es el no uso de dosis repetidas por la acumulación de niveles tóxicos de hierro que requeriría un cuidadoso monitoreo para determinar la posibilidad administrar nuevas dosis. (47)
Se necesitan aún estudios clínicos que definan los posibles usos. El más probable tomando en cuenta su corta vida media sería como fluido de reemplazo para la hemodilución normovolémica en el periodo perioperatorio. Se ha estimado que un incremento del 3 al 5% en la capacidad de transporte de oxígeno puede evitar durante la hemodilución agresiva el uso de hasta 4 unidades de glóbulos. Otra posible indicación podría ser para disminuir las transfusiones en el postoperatorio y como transportador de oxígeno profiláctico en situaciones en las que el flujo sanguíneo puede disminuir y que pudieran beneficiarse de la reducción de la viscosidad de la sangre mediante hemodilución a la vez que se conserva la capacidad transportadora de oxígeno, al tratarse de una molécula pequeña teóricamente pasa con mucho menos resistencia que los glóbulos rojos por lugares estenosados, por lo que encontraría aplicación en situaciones tales como la endarterectomía y las crisis sicklémicas. (47)
Más recientemente se está trabajando en la tecnología recombinante para la obtención de una hemoglobina mutante con una afinidad alterada para el óxido nítrico, que evite los efectos transitorios pero indeseados de vasoconstricción e hipertensión. A la vez que los efectos deletéreos sobre los túbulos renales no existen. (48)
Hemoglobina obtenida de animales transgénicos.
Recientemente se está empleando la tecnología de ingeniería genética para la producción de animales transgénicos (ratas, cerdos) que puedan sintetizar hemoglobina humana, lo que se logra a través de la introducción de genes de hemoglobina humana en los huevos inmediatamente después de la fertilización. En estudios en cerdos transgénicos se ha observado que la hemoglobina producida es estable y su producción se transmite a la próxima generación. A partir de la sangre del cerdo puede separarse la hemoglobina humana de la animal de forma fácil por técnicas de cromatografía. (45)
Perfluorocarbonos.
Los perfluorocarbonos son compuestos orgánicos en los que los átomos de hidrógeno se remplazan con átomos de flúor. Estos compuestos pueden disolver grandes volúmenes de gases respiratorios (por ejemplo entre el 40 y 70% de oxígeno por unidad de volumen a 37°C, cifras mayores que la sangre) con una relación lineal entre la tensión de oxígeno y la presión parcial de acuerdo con la ley de Henry, lo que contrasta con la curva sigmoide de la sangre total y la hemoglobina. Además incrementan el paso de oxígeno de los eritrocitos a los tejidos. (49,50)
Las primeras emulsiones de perfluorocarbonos para uso clínico se desarrollaron a finales de la década de los 70. En la década de los 80 se realizaron numerosos ensayos clínicos con este compuesto. Inicialmente estaba propuesto para el tratamiento de la anemia pero no fue aprobado para estos fines debido a su pobre eficacia y su relativamente corta persistencia intravascular. (51) Otra desventaja de la emulsión fue su inestabilidad a temperatura ambiente, por lo que se requería su conservación en congelación. En 1990 se aprobó su uso por la FDA en dosis restringidas en pacientes con alto riesgo para la oxigenación del lecho vascular coronario distal durante la angioplastia de balón. (49)
Debido a su pequeña medida pueden emplearse para el transporte de oxígeno a regiones vasculares distales con oclusiones parciales, como en el infarto agudo del miocardio, la trombosis o las crisis de la anemia drepanocítica; también pueden emplearse para el transporte de oxígeno al interior de un tumor para aumentar el tratamiento subsecuente con radiaciones ionizantes. Pueden ser usados en eventos de isquemia del tejido cerebral y en la prevención del la injuria de reperfusión. (52,53) Muestran utilidad en la cirugía cardiaca en la prevención del daño neurológico severo secundario a la formación de émbolos aéreos durante la misma. (54)
Como otros transportadores de oxígeno reducen la necesidad de usar transfusiones de sangre y son de utilidad en la hemodilución normovolémica perioperatoria en situaciones en que se espere niveles bajos de hemoglobina. Otros usos de los fluorocarbonos fuera del campo de la medicina transfusional incluyen: el de agente de contraste en diagnósticos no invasivos debido a su radioopacidad, pueden ser usados en estudios de resonancia magnética para valorar la ventilación. (55)
Existe un uso creciente de estos compuestos en la ventilación líquida, para la apertura de alvéolos colapsados por infiltrados en el tracto respiratorio de niños prematuros. Se ha demostrado un incremento en la producción de surfactante a pesar de una relativa reducción en la producción de fosfolípidos. (56)
El uso de los perfluorocarbonos de alta densidad ha representado un gran paso en la cirugía de vítreo y retina. Estos compuestos facilitan el paso de los líquidos intraoculares y otras maniobras quirúrgicas en el segmento posterior y pueden ser usados como instrumentos para la manipulación retinal hidrocinética durante la cirugía oftalmológica postraumática. (57)
Estas emulsiones han mostrado además capacidad para la perfusión de órganos para trasplante, revolucionando los métodos de conservación de órganos a la luz de los nuevos conceptos de perfusión normotérmica. (58)
Propiedades de los líquidos perfluorocarbonados.
- Líquidos claros.
- Inodoros.
- Química y biológicamente inertes.
- Alta solubilidad en gas.
- Alta densidad.
- Baja viscosidad.
- Baja tensión superficial.
- Radiopacos.
- Fácilmente esterilizables.
Debido a que son inmiscibles en sangre y agua, deben emulsificarse para su uso intravascular. Después de la infusión intravascular las gotas de la emulsión se remueven de la circulación y se retienen temporalmente por las células fagocíticas del sistema retículo endotelial y finalmente se excretan en la exhalación corporal. Los fluorocarbonos con peso molecular en el rango de 460 a 520 tienen tiempos de retención tisular aceptables. (49,52)
Las desventajas de los fluorocarbonos son:
- La necesidad de someter al paciente a un medio con alta concentración de oxígeno lo que puede provocar toxicidad.
- El bloqueo potencial del sistema retículo endotelial (este sistema es el que realiza su aclaramiento) y producir una subsecuente disminución del aclaramiento de agentes patógenos.
Los avances más recientes en la producción de estos compuestos son: la producción de emulsiones más concentradas, las que en principio pueden transportar más oxígeno y el logro de la estabilidad de estos compuestos a temperatura ambiente. En algunos casos se ha indicado el uso de surfactantes fluorofílicos como estabilizadores de la emulsión. Entre las emulsiones de concentrados de fluorocarbonos de segunda generación se encuentra el OxigentTM. (49) (52)
El OxigentTM es una emulsión al 60% de perflubrón (molécula altamente lipofílica con una alta solubilidad de oxígeno). Es estable por un año a temperatura ambiente y esterilizable por vapor, rápidamente eliminada por el organismo y con una vida media de 4 días. Puede ser útil clínicamente como sustituto temporal de los eritrocitos. (49,52) Los perfluorocarbonos no modifican sus características transportadoras ni su compatibilidad con el suero sanguíneo tras periodos prolongados de conservación. (59)
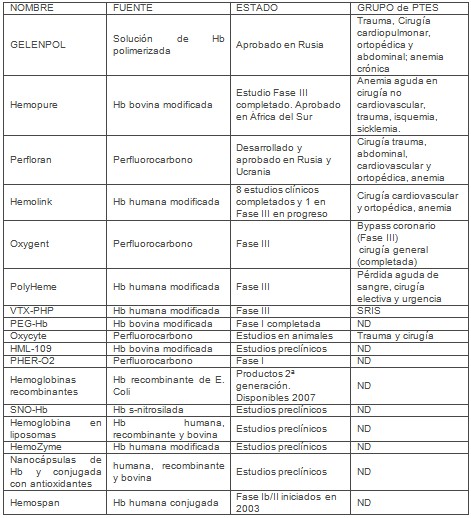
La siguiente tabla muestra un resumen de algunos de los transportadores de oxígeno que se encuentran en desarrollo o en ensayos clínicos.
Tabla 1. Transportadores de oxígeno. (31)
Conclusiones.
El metabolismo aerobio es fundamental para el mantenimiento de las funciones del organismo y depende en primera instancia de la disponibilidad de oxígeno.
Las soluciones de hemoglobina y los perfluorocarbonos son los transportadores artificiales de oxígeno en investigación o en uso en la práctica médica. Los sustitutos de eritrocitos y plaquetas por su parte se someten a ensayos clínicos que probarán su real eficacia. El tiempo de sobrevida en la circulación de los sustitutos de eritrocitos actualmente en uso es muy corto para poder sustituirlos en el tratamiento de las anemias crónicas. Estos preparados tienen un papel más promisorio en la solución de problemas a corto plazo, como la resucitación de urgencia, con la consiguiente transfusión de eritrocitos en las siguientes 24 horas.
Por otro lado, el transporte de oxígeno no es la única función de los eritrocitos, ya que ellos desempeñan un papel también importante en el transporte de dióxido de carbono y como medio tampón. Sin embargo, el valor de estos preparados es inobjetable, por lo que no existen dudas de que el desarrollo de estos constituye una prioridad del desarrollo de la medicina transfusional en los próximos años.
Bibliografía
- Maizes JS, Murtuza M, Kvetan V. Oxygen transport and utilization. Respir Care Clin N Am 2000; 6:473-500.
- Vincent JL, Baron J-F, Reinhart K, et al. Anemia and blood transfusion in critically ill patients. JAMA 2002; 288: 1499-507.
- Mole JR, Nuñez C. Resultados de dos años de auditoría transfusional en el Hospital Clínico Quirúrgico “Celia Sánchez Manduley”.Rev Arg Transf 1998; 2:73-78.
- Mollison PL, Engelfriet CP, Contreras M, Editores. Blood transfusion in clinical medicine10th ed. London: Blackwell Science LTD; 1997.
- Contreras M. Editora. ABC of transfusion. 3rd ed. BMJ Books. Bristol K; 1998.
- Quill TE, Brody H. Physician recommendations and patient autonomy: finding a balance between physician power and patient choice. Ann Intern Med. 1996; 125:763-769.
- Santa Biblia. Versión Reina-Valera Revisada. México, D.F: Sociedades Bíblicas Unidas; 1960. Levítico 7:26,27.
- Santa Biblia. Versión Reina-Valera Revisada. México, D.F: Sociedades Bíblicas Unidas; 1960. Deuteronomio 12:23-25.
- Santa Biblia. Versión Reina-Valera Revisada. México, D.F: Sociedades Bíblicas Unidas; 1960. Génesis 9:3-6.
- Crispen D. Clinical Controversies in End-of-Life Care in the ICU. 31st International Educational and Scientific Symposium of the Society of Critical Care Medicine; enero 26- 30, 2002, San Diego, California. URL disponible en: http://www.medscape.com/viewprogram/1460?src=search
- Vincent JL. Transfusion in the exsanguinating Jehovah's Witness patient--the attitude of intensive-care doctors. Eur J Anaesthesiol 1991; 8:297-300.
- Blumberg N, Joanna M. Mortality Risk, Cost and Decision Making in Transfusion Medicine. Am J Clin Pathol 2000; 114 (6): 933-937.
- Bond CA, Raehl C. Clinical Pharmacy Services, Pharmacist Staffing and Drug Costs in United States Hospitals. Pharmacotherapy 1999; 19 (12): 1354-62.
- Williamson LM, Lowe S, Love EM, et al. Serious hazards of transfusion (SHOT) initiative: analysis of the first two annual reports. BMJ 1999; 319:16-19.
- Pealer LN, Marfin AA, Petersen LR. Transmission of West Nile virus through blood transfusion in the United States in 2002. N Engl J Med 2003; 349:1236-45.
- Elliot JM, Virankabutra T, Tanudsintum S. Erythropoietin Mimics the Acute Phase Response In Critical Illness. Crit Care 2003; 7 (3):35-40.
- Laupacis A, Feeny D, Detsky AS, Tugwell PX. How attractive does a new technology have to be to warrant adoption and utilization? Tentative guidelines for using clinical and economic evaluations. Can Med Assoc J 1992; 146:473-81.
- Lovesio C. El oxígeno en el organismo. En: Carlos Lovesio. Medicina Intensiva. 5 Edición. Buenos Aires: El Ateneo; 2000. p. 36-51.
- Darovic GO, Rokowsky JS. Shock. En: Patrick ML, Woods SL, Craven RF, et al., eds. Medical-Surgical Nursing. Pathophysiological Concepts. Philadelphia: JB Lippincott; 1991. p. 123-142.
20. Jacobson D, Singer M. The cell, the mitochondrion, oxygen and sepsis. En: Vincent JL (eds). Yearbook of Intensive Care and Emergency Medicine. Heidelberg: Springer-Verlag; 1996. p. 263-274.
21. Komatsu T, Shibutani K, Okamoto K, Kumar V, Kubal K, Sanchala V et al. Critical level of oxygen delivery after cardiopulmonary bypass. Crit Care Med 1987; 15:194-197.
22. Moral V. Sangre y Derivados. En: Cuidados críticos, Medicina de Urgencias, sangre y transfusión. Cataluña: FEEA; 2004. p. 199-210.
23. Corwin HL, Parsonnet KC, Gettinger A. RBC transfusion in the ICU: is there a reason? Chest 1995; 108:767-71.
24. Fuentes C, Rubio JM. Transfusión de sangre y hemoderivados. En: Manual de Medicina Intensiva. 2ª Edición. Madrid: Ediciones Harcourt, SA; 2001. p. 391-7.
25. Goodnough LT, Brecher ME, Kanter MH. Transfusion Medicine. N Engl J Med 1999; 340 (6): 525-33.
26. Shapiro MJ, Gettinger A, Corwin HL, et al. Anemia and blood transfusion in trauma patients admitted to the intensive care unit. J Trauma 2003; 55:269-74.
27. Marik PE, Sibbald WJ. Effect of stored-blood transfusion on oxygen delivery in patients with sepsis. JAMA 1993; 269:3024-3029.
28. McFarland JG. Perioperative blood Transfusión: indications and options. Chest 1999; 115 (5): 113-121.
29. Hébert PC. Reassessing Transfusion Strategies in Critically Ill Patients: Is a Restrictive Approach Better Than a Liberal One?. N Engl J Med 1999; 340 (6): 409-17.
30. Alfonso ME. Sustitutos de la sangre. Rev Cubana Hematol Inmunol Hemoter 2001; 17 (2): 90-7.
31. Standl T. Autologous transfusion - from euphoria to reason: clinical practice based on scientific knowledge. Artificial oxygen carriers: cell-free hemoglobin solutions—current status. Anasthesiol Intensivmed Notfallmed Schmerzther 2005; 40 (1):38-45.
32. Talarico TL, Guise KJ, Stacey CJ. Chemical characterization of pyridoxalated hemoglobin polyoxyethylene conjugate. Biochim Biophys Acta 2000; 1476 (1): 53-65.
33. Bi Z, He X, Zhang X, Jiang Y, Zhao Km, Liu Q. Pharmacodynamic study of polyethylene glycol conjugated bovine hemoglobin (PEG-bHb) in rats. Artif Cells Blood Substit Immobil Biotechnol 2004; 32 (2):173-87.
34. Chan WL, Tang NL, Yim CC, Lai FM, Tam MS. New features of renal lesion induced by stroma free hemoglobin. Toxicol Pathol 2000; 28 (5):635-42.
35. Menu P, Bleeker W, Longrois D, Caron A, Faivre-Fiorina B. In vivo effects of Hb solutions on blood viscosity and rheologic behavior of RBCs: comparison with clinically used volume expanders. Transfusion 2000; 40 (9):1095-103.
36. Drobin D, Kjellstrom BT, Malm E. Hemodynamic response and oxygen transport in pigs resuscitated with maleimide-polyethylene glycol-modified hemoglobin (MP4). J Appl Physiol 2004; 96 (5):1843-53.
37. Fitzpatrick CM, Savage SA, Kerby JD, Clouse WD,Kashyap VS. Resuscitation with a blood substitute causes vasoconstriction without nitric oxide scavenging in a model of arterial hemorrhage. J Am Coll Surg 2004; 199 (5):693-701.
38. Vandegriff KD, Bellelli A, Samaja M, Malavalli A, Brunori M, Winslow RM. Kinetics of NO and O2 binding to a maleimide poly (ethylene glycol)-conjugated human haemoglobin. Biochem J 2004; 382 (1):183-9.
39. Rebel A, Ulatowski JA, Kwansa H. Cerebrovascular response to decreased hematocrit: effect of cell-free hemoglobin, plasma viscosity, and CO2. Am J Physiol Heart Circ Physiol 2003 Oct; 285 (4):1600-8.
40. Caswell JE, Strange MB, Rimmer DM. A novel hemoglobin-based blood substitute protects against myocardial reperfusion injury. Am J Physiol Heart Circ Physiol 2005; 288 (4):1796-801.
41. Matsumoto T, Asano T, Mano K, Tachibana H. Regional myocardial perfusion under exchange transfusion with liposomal hemoglobin: in vivo and in vitro studies using rat hearts. Am J Physiol Heart Circ Physiol 2005; 288 (4):1909-14.
42. Alayash AI. Hemoglobin-based blood substitutes and the hazards of blood radicals. Free Radic Res 2000; 33 (4):341-8.
43. Zhao DX, Wei XG, Gu ZY, Zhang GF. Preparation of bovine lipid-free hemoglobin. Sheng Wu Gong Cheng Xue Bao 2002 Sep;18 (5):609-13.
44. Anton N; Hitzler JK; Kavanagh BP. Treatment of life-threatening post-haemorrhagic anaemia with cell-free haemoglobin solution in an adolescent Jehovah's Witness. Br J Haematol 2002; 118 (4):1183-6.
45. Creteur J, Vincent JL. Hemoglobin solutions. Crit Care Med 2003; 31 (12): 698-707.
46. Creteur J, Sibbald W, Vincent JL. Hemoglobin solutions--not just red blood cell substitutes. Crit Care Med 2000; 28 (8):3025-34.
47. Leone BJ. Potential Clinical applications of recombinant human haemoglobin in blood conservation. BioDrugs 1999 Mar; 11 (3): 211-21.
48. Viele MK, Weiskopf RB, Fisher D. Recombinant human hemoglobin does not affect renal function in humans: analysis of safety and pharmacokinetics. Anesthesiology 1997; 86: 848-58.
49. Spahn DR. Blood substitutes. Artificial oxygen carriers: perfluorocarbon emulsions. Crit Care 1999; 3 (5):93-7.
50. Perevedentseva EV, Zaritskiy AR. Perfluorocarbon emulsions increase transfer of oxygen in plasma from erythrocyte to tissues. Artif Cells Blood Substit Immobil Biotechnol 1998; 26 (2):223-9.
51. Mitsuno T, Ohyanagi H. Clinical studies of a perfluorochemical whole blood substitute. Ann Surg 1982; 195:60-9.
52. Clark MC, Weiman DS, Pate JW, Gir S. Perfluorocarbons: future clinical possibilities. J Invest Surg 1997; 10 (6):357-65.
53. Rebel A, Frietsch T, Quintel M, Lenz C. Cerebral effects of perfluorocarbons. Nervenarzt 1999; 70 (8):679-87.
54. Cochran RP, Kunzelman KS, Vocelka CR, Akimoto H. Perfluorocarbon emulsion in the cardiopulmonary bypass prime reduces neurologic injury. Ann Thorac Surg 1997; 63 (5):1326-32.
55. Kauczor HU, Hanke A, Van Beek EJ. Assessment of lung ventilation by MR imaging: current status and future perspectives. Eur Radiol 2002; 12 (8):1962-70.
56. Rudiger M, Wissel H, Ochs M. Perfluorocarbons are taken up by isolated type II pneumocytes and influence its lipid synthesis and secretion. Crit Care Med 2003; 31 (4):1190-6.
57. Bourke RD, Cooling RJ. Perfluorocarbon heavy liquids. Aust N Z J Ophthalmol 1995; 23 (3):165-71.
58. McLaren AJ, Friend PJ. Trends in organ preservation. Transpl Int 2003 Oct; 16 (10):701-8.
59. Kuznetsova IN. Stability of perfluorocarbon emulsions and their compatibility with blood serum. Artif Cells Blood Substit Immobil Biotechnol 1998; 26 (2):181-9.