Patogenia de la preeclampsia. Avances recientes. Una revision.
ALTERACIONES DE LA PLACENTACIÓN E ISQUEMIA PLACENTARIA.
La preeclampsia aparece solamente en presencia de placenta, aún en ausencia de feto (mola hidatiforme), en el caso de embarazo extrauterino y se detiene dramáticamente luego de la expulsión de la placenta en el postparto (4). Los trabajos previos sobre esta enfermedad del embarazo sugieren que las alteraciones patológicas más precoces aparecen en la circulación útero placentaria, lo cual origina una isquemia placentaria y es considerado como el estadío I de la enfermedad (5). En el estadío II, la placenta isquemica secreta varios factores circulantes los cuales provocan la lesión de las células endoteliales en la madre y aparece el cuadro clínico de la preeclampsia (5,6). Existen muchos argumentos que sugieren que la isquemia placentaria desempeña un papel central en la preeclampsia (7): 1) El examen histológico de las placentas de pacientes con preeclampsia muestran numerosos infartos placentarios y un estrechamiento esclerosante de las arteriolas (8); 2) las biopsias de las placentas de estos pacientes revelan una invasión trofoblastica inadecuada de las arteriolas deciduales maternas que origina vasos endurecidos (9); 3) los factores de riesgo maternales para la preeclampsia incluyen condiciones medicas que predisponena las pacientes a una insuficiencia vascular tales como la hipertensión arterial crónica, la diabetes, el lupus y las enfermedades trombosantes adquiridas o hereditarias (3); 4) los embarazos múltiples o la mola hidatiforme que aumentan la masa placentaria pero con una disminución relativa del flujo sanguíneo, aumentan el riesgo de preeclampsia (3); los modelos animales de preeclampsia se basan en la creación de una isquemia placentaria y así alterar el flujo sanguíneo (10).
Durante el desarrollo placentario normal, el citotrofoblasto invade las arteriolas espirales maternas y las remodelan completamente para formas vasos de gran capacidad y de débil resistencia (9).Esta invasión endovascular del citotrofoblasto implica el reemplazo no solamente del endotelio, sino también de la túnica muscular media. En la preeclampsia existe solo una invasión superficial por el citotrofoblasto de las arteriolas uterinas espirales lo cual conduce a una perfusión placentaria reducida y a una insuficiencia placentaria(11). Paradójicamente aún en la placenta normal existe muy poca o ausencia de invasiónde las venulas uterinas. El mecanismo primario que conduce a una débil invasión/diferenciación trofoblastica en la preeclampsia es desconocido, sin embargo factores genéticos, inmunológicos y ambientales (como la hipoxia y la malnutrición) desempeñan un papel importante. Los trabajos extensos del grupo de Fisher sugieren que las diferencias de tensión en O2 serían el primun novens regulador de la capacidad invasiva del citotrofoblasto (12). Se considera que el remodelaje de las arteriolas espirales comienza al final del primer trimestre y se complete entre la 18 y 20 semanas. A pesar de que la edad gestacionalen la cual cesa la invasión trofoblastica de las arteriolas es desconocida, los estudios histológicos han mostrado que la invasión trofoblastica disminuye en la columna decidual cuando la edad gestacional aumenta.
La diferenciación de los trofoblastos durante la invasión implica la modificación de la expresión de varios tipos de moléculas, incluyendo citoquinas, las moléculas de adhesión y la matriz extracelular, las metaloproteinasas y las moléculas de la clase Ib del complejo mayor de histocompatibilidad, HLA-G (13). En el curso de su diferenciación, los trofoblastos modifican su perfil de expresión de las moléculas de adhesión, pasando de un fenotipo epitelial (integrinas 6ab4,aVb5 y E-caderina) a un fenotipo endotelial (integrinas a1b1, a5b3, PECAM y V-caderina) un fenómeno denominado seudo-vasculogenesis (14). Los estudios en vitro y en vivo muestran que los trofoblastos de las pacientes sufriendo de preeclampsia no sufren estas modificaciones fenotípicas y la seudo-vasculogenesis (15). Las vías de señalamiento que regulan esta seudo-vasculogenesis podrían implicar una gran variedad de factores de transcripción, de factores de crecimiento y citoquinas (16).Una atención considerable se ha focalizado recientemente sobre los factores implicados en la angiogenesis como el VEGF, las angiopoietinas y la familia de las efrinas. De manera interesante ha sido mostrado que los trofoblastos exprimían VEGF, PIGF, VEGF-C y sus receptores. Además, el bloqueo de sus vías de transducción disminuye la expresión de la integrina a1 ( un marcador de seudo-vasculogenesis) in vitro (17). Pero ninguna experimentación in vivo no ha podido hasta ahora directamente implicar la vía del VEGF en el defecto de la seudo-vasculogenesis. Más recientemente, ha sido mostrado que los trofoblastos invasivos exprimían también la L-selectina, una molécula de adhesión necesaria para la extravasación de los leucocitos (18).Se ha sugerido que las anomalías del sistema de las selectinas en la interface madre-feto podrían ser los responsables de las anomalías de la implantación en la preeclampsia. Finalmente, la expresión del HLA-G por el trofoblasto, una molécula cuya expresión esta disminuida en la preeclampsia, podría proteger los trofoblastos del ataque por las células NK en el sitio de implantación (19).
Las modificaciones secundarias de la placenta incluyen el ateroma, la necrosis fibrinoide, la trombosis y el infarto (20). Aún cuando todas estas lesiones no están presentes en todas las pacientes, se ha encontrado una correlación entre la severidad de la enfermedad y lo extenso de esas lesiones. El remodelaje anormal de las arteriolas espirales origina una isquemia placentaria, que a su vez origina la secreción de factores solubles en la circulación materna; sin embargo la prueba de una relación causal entre la placentación anormal y el síndrome materno todavía falta (7).
DISFUNCION ENDOTELIAL SISTÉMICA
Una disfunción endotelial generalizada podría explicar una gran parte de los aspectos clínicos de la preeclampsia: la hipertensión arterial por alteración del control endotelial del tono vascular, la proteinuria por un aumento de la permeabilidad glomerular, la coagulopatía como resultado de la expresión anormal de los factores procoagulantes y la disfunción hepática secundaria a la isquemia (21). Los resultados de muchos estudios soportan la teoría de una disfunción endotelial como el origen de las lesiones maternas en la preeclampsia. Ha sido reportado un aumento de los niveles circulantes de fibronectina, del factor VIII y de la trombomodulina, todos marcadores de lesión endotelial (22). La vasodilatación inducida por el flujo ha sido encontrada alterada en los vasos de las pacientes con preeclampsia lo cual sugiere una disfunción endotelial (23). Una disminución de la producción de las moléculas vasodilatadoras derivadas del endotelio como las prostaciclina, un aumento de los niveles de las endotelinas y una reactivación acentuada a la angiotensina II sugieren igualmente una disfunción endotelial(24). Las biopsias renales de estas pacientes han revelado una hinchazón endotelial glomerular, llamada endoteliosis glomerular (25). Por último, el suero de mujeres con preeclampsia induce la activación de las células endoteliales de la vena umbilical in vitro (26).
Numerosos laboratorios han ensayado desde hace varios años tratar de identificar los factores circulantes responsables de esta disfunción endotelial. Muchos grupos han reportado las alteraciones de las citoquinas/factores de crecimiento/moléculas de adhesión tales como el factor de necrosis tumoral (TNF-a) la interleuquina-6 (IL-6), interleuquina-1b (IL-1b), el Fas ligando, lípidos oxidados y la ADMA (dimetilarginina asimétrica) los cuales son liberados por la placenta y/o de otras fuentes maternas en la preeclampsia (1, 27). Sin embargo no existe ninguna prueba de que alguno de estos factores sea responsable de la enfermedad. Recientemente, la neuroquinina-B (cercana a la sustancia P) ha sido encontrada producida por las placentas en la preeclampsia, y puede inducir una hipertensión transitoria en la rata, pero sin causar proteinuria ni endoteliosis glomerular (28). La sensibilidad aumentada a la angiotensina II, una anomalía constante en la preeclampsia, podría ser secundaria a una superexpresión del receptor de la bradiquinina (B2) (29). Esta superexpresión conduciría a una heterodimerisación de los receptores B2 con el receptor del tipo 1 de la angiotensina II (AT1), y este receptor aumentaría la respuesta a la angiotensina II in vitro. Queda por demostrar que estas anomalías son patogeneticas y no epifenomenos. Algunos resultados muy recientes muestran una expresión y una secreción aumentada de los sFLT-1 (soluble fins-like tyrosine kinase 1), el cual es un antagonista natural del VEGF, en los pacientes con preeclampsia (17, 30). De una manera muy interesante, la administración exógena sola del sFlt-1 es capaz de producir un síndrome parecido a la preeclampsia (30).
sFlt-1 Y ESTADO ANTI-ANGIOGÉNICO
El VEGF es un mitogeno especifico de las células endoteliales que desempeña un papel clave en la promoción de la angiogenesis. Las actividades del VEGF son mediadas por su interacción con dos receptores tirosina quinasa de alta afinidad: KDR (Kinase-insert region) y el FlT-1 los cuales son selectivamente expresados sobre las células endoteliales (31). La unión alternativa del Flt-1 origina la expresión de una proteína endogena secretada llamada sFlt-1, la cual no tiene dominio citoplasmatico y transmembranario, pero conserva el dominio de unión al ligando, VEGF (32,33) Fig. 1.
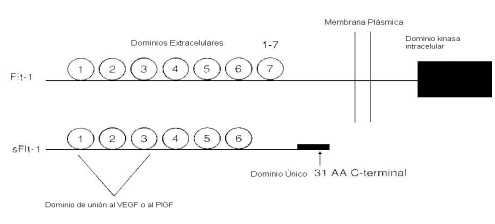
Figura 1.Estructura de las proteínas Flt-1y sFlt-1 en los siete dominios de la inmunoglobulina-like (IgG) que están implicadas en la unión al VEGF o al PIGF. La proteína sFlt-1 tiene un dominio único 31 AA C-terminal derivado de un pasaje alternativo y no tiene dominio transmembranario y citoplasmático. Tomado de 7.
De esta manera, el sFlt-1 puede antagonizar el VEGF circulante y unirse a él y así impedir la interacción del VEGF con sus receptores naturales. sFtl-1 se une y antagoniza también el PIGF, otro miembro de la familia del VEGF producido principalmente por la placenta (7).
Los estudios in vitro confirman que un exceso de sFlt-1 produce un estado anti-angiogénico en el suero de mujeres enfermas de preeclampsia, que puede corregirse con el aporte exógeno de VEGF y del PIGF (34). Un exceso de sFlt-1 aislado, administrado a ratas preñadas, induce albuminuria, hipertensión y lesiones histologicas renales de endoteliosis glomerular. Para que esto suceda, es necesaria la neutralización del VEGF y del PIGF circulante y por la inducción de una disfunción endotelial. Además, niveles disminuidos de VEGF y de PIGF libres se han encontrado al mismo tiempo que niveles aumentados de sFlt-1 en la circulación de las pacientes en los momentos de los primeros síntomas (34,35). Más recientemente aún, los niveles circulantes del VEGF y del PIGF libres han sido encontrados disminuidos, mucho antes de la aparición de los primeros signos clínicos (36,37). El VEGF estimula la angiogenesis y la vasodilatación produciendo ON y prostaciclina, moléculas cuyos niveles están disminuidos en la preeclampsiay se ha sugerido que estas dos sustancias funcionan en paralelo mediando los efectos del VEGF (38). Además un numeroso grupo de pacientes cancerosos que reciben antagonistas del VEGF desarrollan hipertensión y proteinuria (39). Estos resultados sugieren que un exceso de sFlt-1 al neutralizar al VEGF y al PIGF, podría jugar un papel central en la patogenia de la preeclampsia. Sin embargo quedan algunas preguntas por responder. Los mecanismo precisos que conducen a una producción excesiva de sTlt-1 por la placenta no son conocidos, el papel del sFlt-1 en el desarrollo normal de la placenta y en la seudo-vasculogenesis no esta claro. No ha sido reportado anomalías de la coagulación, anomalías cerebrales (eclampsia) o anomalías hepáticas en los animales tratados con sFlt-1. La relación del sFlt-1 con los factores de riesgo de la preeclampsia no es clara. Una hipótesis sugiere que existe un nivel de sFlt-1, debajo del cual un embarazo normal puede desarrollarse y si esta por encima de este nivel puede aparecer la preeclampsia; las pacientes con riesgo de preeclampsia pueden representar un grupo en donde los niveles están bajos, siendo así mas susceptibles al sFlT, lo que conduciría al síndrome materno de la preeclampsia para los niveles cercanos de los de un embarazo normal. Además otros factores producidos por la placenta actúan sinérgicamente con el sFlt-1 y son razonablemente implicados en el desarrollo de esta disfunción endotelial generalizada (7).
ANTICUERPOS AGONISTAS DE LOS RECEPTORES AT1
La presencia de anticuerpos circulantes contra el receptor AT1 de la angiotensina II (AT1-AA) ha sido reportada en mujeres embarazadas (40). Estos anticuerpos estimularían el receptor AT1 y participarían de esta manera en las lesiones vasculares inducidas por la angiotensina II en las pacientes con preeclampsia (41). Recientes resultados muestran que estos anticuerpos podían estimular la NADPH oxidasa de los trofoblastos y de las células vasculares musculares lisas y sugieren que la NADPH oxidasa pudiera ser una fuente importante de la elevación de las ROS (reactive oxigen species) encontradas en la preeclampsia (42). Sin embargo la implicación directa de los AT1-AA en la preeclampsia no ha sido establecida. Además, la relación temporal entre estos anticuerpos y el síndrome clínico hasta ahora no ha sido reportada. Por otra parte todavía hace falta determinar si esos anticuerpos actúan sinérgicamente con otras proteínas como el sFlt-1, para inducir una disfunción endotelial generalizada o si son consecuencia de lesiones endoteliales difusas (7). Finalmente la fuente del antígeno responsable de estos anticuerpos no ha sido identificada.
PAPEL DEL ÁCIDO ÚRICO
Trabajos recientes sugieren que la hiperuricemia participa en el desarrollo de la hipertensión y del síndrome materno (43). La hiperuricemia se debe principalmente a la disminución de la excreción renal por disminución de la filtración glomerular (44). Así mismo puede haber una producción excesiva de ácido urico por la placenta isquemica (45). A menudo la elevación del ácido urico es previa al desarrollo de la hipertensión y de la proteinuria (46) y los niveles de ácido urico se relacionan con un mal pronóstico, sugiriendo que el ácido úrico pudiera tener un papel causal (47). Trabajos experimentales en ratas transformadas hiperuricemicas mediante la administración del ácido oxonico (un inhibidor de la uricasa) muestran la aparición de una hipertensión, una hipertrofia glomerular y un albuminuria (48). Sin embargo estos animales de experimentación no presentan endoteliosis, sugiriendo así que el ácido urico juega probablemente un papel contributivo pero no inicial en el desarrollo de la preeclampsia.