Influenza es una infección viral respiratoria causante de fiebre, coriza, tos, cefalea y malestar general. La mortalidad ocurre durante las epidemias, particularmente entre los pacientes de alto riesgo. El virus puede infectar 5-15% de la población año tras año, dada la gran capacidad que tiene de evolucionar y así evadir la respuesta inmune. Como todos los subtipos conocidos de influenza A tienen como reservorios aves acuáticas, la influenza no es una enfermedad erradicable; la prevención y el control son las únicas metas reales. El método más importante para prevenir la influenza y sus severas complicaciones es la vacunación. Aunque la inmunización es la medida más importante, es poco probable disponer de una vacuna eficaz por muchos meses desde la emergencia de una pandemia.
Los inhibidores de la neuraminidasa son activos y efectivos en contra del virus de la influenza A y B. Acorde con los Centros para el Control y Prevención de Enfermedades, el nuevo virus de la influenza H1N1 es susceptible a oseltamivir y zanamivir, medicamentos antivirales inhibidores de la neuraminidasa, los cuales son dirigidos en la fase temprana de la infección. Los patrones estacionales de la influenza humana en regiones templadas han sido bien documentados; aunque menos atención ha sido puesta para conocer los patrones de infección en áreas tropicales.
Inhibidores de la neuraminidasa para la profilaxis y tratamiento de la nueva influenza A H1N1
Neuraminidase inhibitors for the prophylaxis and treatment of novel influenza a h1n1
Dr. Luis A. Caballero
Instituto Nacional de Nutrición. División de Salud Pública.
Resumen
Influenza es una infección viral respiratoria causante de fiebre, coriza, tos, cefalea y malestar general. La mortalidad ocurre durante las epidemias, particularmente entre los pacientes de alto riesgo. El virus puede infectar 5-15% de la población año tras año, dada la gran capacidad que tiene de evolucionar y así evadir la respuesta inmune. Como todos los subtipos conocidos de influenza A tienen como reservorios aves acuáticas, la influenza no es una enfermedad erradicable; la prevención y el control son las únicas metas reales. El método más importante para prevenir la influenza y sus severas complicaciones es la vacunación. Aunque la inmunización es la medida más importante, es poco probable disponer de una vacuna eficaz por muchos meses desde la emergencia de una pandemia.
Los inhibidores de la neuraminidasa son activos y efectivos en contra del virus de la influenza A y B. Acorde con los Centros para el Control y Prevención de Enfermedades, el nuevo virus de la influenza H1N1 es susceptible a oseltamivir y zanamivir, medicamentos antivirales inhibidores de la neuraminidasa, los cuales son dirigidos en la fase temprana de la infección. Los patrones estacionales de la influenza humana en regiones templadas han sido bien documentados; aunque menos atención ha sido puesta para conocer los patrones de infección en áreas tropicales.
Palabras clave: Gripe pandémica, influenza humana A H1N1, antiviral, inhibidor neuraminidasa, oseltamivir, zanamivir
Abstract
Influenza is a viral respiratory infection causing fever, coryza, cough, headache and malaise. Mortality is possible during epidemics, particularly among high-risk patients. The virus can infect 5-15% of the population year after year because the virus has an extensive capacity to evolve and thus evade the immune response. Because all known influenza A subtypes exist in the aquatic bird reservoir, influenza is not an eradicable disease; prevention and control are the only realistic goals. The main method for preventing influenza and its severe complications is influenza vaccination. Although immunization is the principal means of influenza prophylaxis, a well-matched efficacious vaccine is unlikely to be widely available for several months following the emergence of the pandemic strain.
Neuraminidase inhibitors are active and effective against A and B influenza virus. According to the US Centers for Disease Control and Prevention, the novel H1N1 influenza virus is susceptible to oseltamivir and zanamivir, neuraminidase-inhibitor antiviral medications, which target the early phase of the infection. The seasonal patterns of human influenza in temperate regions have been well documented; however, much less attention has been paid to patterns of infection in the tropical areas.
Key words: Pandemic influenza, human influenza A H1N1, antiviral, neuraminidase inhibitor, oseltamivir, zanamivir
Introducción
Se reconocen tres tipos de virus de la influenza: A, B y C, virus RNA pertenecientes a la familia Orthomyxoviridae. El tipo A comprende 16 subtipos con base en la hemaglutinina y 9 con base en la neuraminidasa; todos estos subtipos han sido detectados en aves silvestres o de granja en todo el mundo y son codificados genéticamente. El subtipo H16, fue caracterizado hace pocos años en un virus aislado en Suecia, de gaviotas cabeza negra, Larus ridibundus. (Fouchier 2005).
De los diferentes subtipos, solo H1 y H3 han ocasionado extensas epidemias; el tipo B se relaciona rara vez con epidemias regionales o diseminadas; el tipo C se relaciona con casos esporádicos y pequeños brotes localizados. Los subtipos del virus de la influenza A se clasifican por las propiedades antigénicas de las glucoproteínas de superficie: la hemaglutinina y la neuraminidasa. La aparición de subtipos completamente nuevos, se presentan a intervalos irregulares y solo en los virus tipo A, como consecuencia de variaciones antigénicas mayores –cambio antigénico- en el antígeno hemaglutinina o de la recombinación impredecible de antígenos humanos y porcinos o aviarios, y ocasiona pandemias. Las variaciones antigénicas menores –desviación antigénica- en los virus A y B que causan las epidemias frecuentes y los brotes regionales, ocurren constantemente, lo que obliga a la reformulación anual de la vacuna antigripal. (Heymann 2005)
El virus de la influenza A es capaz de reinfectar persistentemente a las poblaciones humanas, evadiendo constantemente la inmunidad del huésped a través de la rápida evolución de los antígenos de superficie. Afecta cada invierno, durante los meses de Noviembre a Marzo en el hemisferio norte y durante los meses de Mayo a Septiembre en el hemisferio sur. (Hope-Simpson 1981)
Estudios filogenéticos de genomas del virus A H3N2 procedentes de Nueva Zelanda, Australia y de Nueva York en los Estados Unidos, revelaron que la migración estacional ocurre del hemisferio norte al sur y del hemisferio sur al norte. (Nelson 2007)
La pandemia de influenza despierta gran interés no solo por la morbilidad y mortalidad humana sino también por sus consecuencias en la agricultura y la economía. A la pregunta de si ocurrirá una nueva pandemia de influenza, la respuesta de los investigadores, basados en la biología y la historia, es sí; aunque no pueden saber cuándo, ni con qué virus, cuán severa será y cuán preparados estemos cuando ocurra. (Poland 2007)
Una encuesta realizada por el Centro Europeo para la Prevención y Control de Enfermedades, durante 2007 en 30 países de Europa, mostró una preparación incompleta, donde muchos planes solo contemplaron la mitad de las recomendaciones de la OMS para enfrentar una pandemia. Muchos de los planes de los países de la región Asia-Pacífico, han focalizado su estrategia en el aislamiento social, una estrategia que puede ser muy importante en los países en desarrollo, ante la escasez de antivirales y vacunas. (Shetty 2009)
Antecedentes de pandemia o amenazas durante el último siglo
Durante los últimos 91 años, se han suscitado cuatro pandemias de influenza, incluyendo la producida por el subtipo H1N1 en 2009.
En 1918 la influenza pandémica llamada influenza española, causó unos 40 millones de muertes. Previamente se habían suscitado brotes de enfermedades respiratorias en Francia y el Reino Unido durante el invierno de 1915-1917, considerados como bronquitis epidémica, algunos de ellos con signos clínicos de cianosis heliotrópica, característica que se repite en la pandemia de 1918. Es por ello que algunos investigadores deducen un origen no español de esta pandemia. (Oxford 2002)
Una investigación determinó el impacto en la mortalidad, atribuible a la pandemia de influenza de 1918 en 14 países de Europa, donde deducen 1,1% de exceso de mortalidad en la población total europea. Otros investigadores estimaron 0,65% de exceso de muertes, durante el mismo periodo en la población americana. (Ansart 2009)
Subtipos del virus H2N2 y H3N2 causaron las pandemias de 1957 y 1968 respectivamente. No siempre la introducción de un nuevo subtipo de influenza A, conlleva a una pandemia, debido a que frecuentemente la transmisión es limitada porque el virus no se propaga fácilmente de una persona a otra. (Wit 2008)
A finales de Marzo y hasta inicios de Mayo de 1997, el virus de la influenza H5N1 causó alta mortalidad (70% aproximadamente) en tres granjas de aves en Hong Kong, China. El 21 de Mayo de 1997, un niño de tres años de edad, de esta misma región, contrajo la infección con un descendiente del virus H5N1, desarrollando una fatal neumonía viral, y convirtiéndose en el primer caso reportado de influenza aviar causante de enfermedad respiratoria en humanos. Una de las situaciones que complicó el caso índice en humano de gripe aviar H5N1 en Hong Kong, fue la administración de aspirina. (Subbarao 1998)
Mientras el virus humano de la influenza A emplea las uniones ácido siálico alfa-2-6, el virus aviar emplea las uniones α-2-3. Estas diferencias en la unión al receptor, están en parte relacionadas con la diferente patogenicidad de estos virus en humanos. Estudios realizados con virus aviarios H5N1 de alta patogenicidad, mostraron que este virus raramente ataca la tráquea, en comparación con el virus humano H3N2 que tiene gran afinidad por la tráquea. En el tracto respiratorio inferior el virus H5N1 ataca predominantemente los neumocitos tipo II, macrófagos alveolares y células cúbicas epiteliales no ciliadas de los bronquiolos terminales. Esto se corresponde con la presencia de uniones α-2-3 en las células cúbicas no ciliadas de los bronquiolos terminales y en los neumocitos tipo II, y la virtual ausencia de estos receptores en el tracto respiratorio superior. (van Riel 2006)
En 1997, se detectaron en Hong Kong 18 casos de humanos infectados por el virus de la influenza A H5N1. En 1999 y desde 2003 se han reportado en Asia personas infectadas con los subtipos H9N2, H7N7 y H5N1. El virus influenza A puede infectar diversas especies como aves, caballos, cerdos, ballenas y focas. Las nuevas cepas de virus aviarios que han infectado humanos, no han sido eficientes en su propagación de persona a persona, controlándose la transmisión interespecie con medidas como el exterminio de pollos en granjas y mercados. Cualquier otro subtipo nuevo puede ser el responsable de generar la pandemia de influenza del siglo XXI. (Girón 2004)
A comienzos de Abril de 2009, un agudo incremento de pacientes requiriendo hospitalización por neumonía y un aumento inusual de muertes, fue reportado por el Ministerio de Salud de México. Se observó un aumento de los casos de influenza en pacientes entre 20 y 40 años de edad. Típicamente en este país, la influenza estacional es observada entre los meses de Octubre a Marzo, con un apreciable incremento en la tasa de mortalidad en personas de mayor edad, similar a lo que ocurre en otros lugares templados. Concurrentemente el hallazgo de un niño diagnosticado en los Estados Unidos con un virus de influenza A H1N1 de origen porcino, movilizó una rápida respuesta del sistema público de salud de México. La revisión del record de 2155 pacientes con severa neumonía, en el periodo 24 de Marzo-29 de Abril 2009, reveló 821 hospitalizaciones y 100 muertes. En este mismo periodo se analizaron 8817 muestras nasofaríngeas, de las cuales 2582 resultaron positivas para el virus de la influenza A H1N1 de origen porcino; el porcentaje de mortalidad se incrementó en pacientes entre 5-59 años, con 87% de muertes por neumonía severa, comparados con 17% en promedio, hallado en periodos epidémicos previos. Los datos iniciales de este brote, se asemejaron parcialmente con la fase inicial de las pandemias del siglo pasado. Los autores de esta investigación, sugieren que las personas nacidas antes de 1957 que fueron expuestas en su niñez a la influenza A H1N1 pueden estar mejor protegidas ante este subtipo viral, que aquellos que fueron primeramente expuestos a otros subtipos como H2N2 y H3N2, en fechas más recientes. (Chowell 2009)
El 11 de Junio, la Dra. Margaret Chan, Directora General de la Organización Mundial de la Salud, eleva el nivel de alerta de pandemia de la fase 5 a la fase 6, iniciándose formalmente la pandemia de gripe de 2009.
Se afirma que descendientes del virus de la influenza A H1N1 que causó la catastrófica e histórica pandemia de 1918-1919, han persistido en humanos por más de 90 años y han continuado contribuyendo con sus genes a nuevos virus, causantes de nuevas pandemias, epidemias y epizootias. El virus de la nueva pandemia de influenza A H1N1 en 2009, resultaría la cuarta generación descendiente del virus de 1918. (Morens 2009)
Influenza en animales
En 2004 se aisló en galgos de Estados Unidos el virus de la influenza canina, subtipo H3N8. Ese mismo y en los siguientes años, se ha detectado serológicamente y mediante aislamiento, el virus de la influenza A subtipo H3 N8 en otras razas de perros. Los signos clínicos más comunes fueron fiebre, descarga nasal purulenta y tos por 10-21 días. (Payungporn 2008)
|
La hemaglutinina viral es un determinante crítico en la especificidad de huésped, del virus de la influenza. (Suzuki 2000) Cinco sustituciones en la secuencia de aminoácidos de la hemaglutinina H3, es una de las diferencias reportadas del virus de la influenza canina del virus de la influenza equina. Es importante continuar con la vigilancia virológica y serológica, para monitorear la evolución de la influenza en perros y su posible transmisión a otras especies, incluyendo humanos. (Payungporn 2008)
El clásico virus de la influenza porcina fue aislado e identificado por primera vez en 1930 por Shope. Estudios serológicos indican que esta infección tiene una prevalencia de 25% en las poblaciones de cerdos en todo el mundo. La enfermedad en los cerdos es generalmente leve, cursa con fiebre aguda, apatía, anorexia, respiración laboriosa; son poco frecuentes los estornudos, descarga nasal y conjuntivitis, la tos suele aparecer en las últimas etapas. La morbilidad puede alcanzar el 100%, aunque generalmente la recuperación ocurre entre cinco a siete días después de la aparición de los signos clínicos, la rata de mortalidad es muy baja. La vacunación de los cerdos, usualmente bivalente H1N1 y H3N2, es la principal medida de control, ya que el empleo de medicamentos antivirales no está autorizado y podrían resultar económicamente inviables. (Heinen 2003)
Antes del aislamiento del virus H3N2 en 1998, la influenza porcina fue una enfermedad enzoótica en los Estados Unidos causada exclusivamente por el clásico virus porcino H1N1. Posterior al año citado, la población de cerdos en Estados Unidos es un dinámico reservorio viral contentivo de múltiples linajes, que la convierte en fuente potencial de pandemia humana. (Webby 2004)
En la actualidad, no hay forma de diferenciar en los cerdos los anticuerpos producidos en reacción a la vacunación, de los anticuerpos generados ante las infecciones por influenza porcina H1N1. Aunque los virus de la influenza porcina H1N1 se han encontrado en poblaciones de cerdos desde por lo menos 1930, los virus de la influenza porcina H3N2 no comenzaron a presentarse entre los cerdos de Estados Unidos hasta 1998. (CDC Datos importantes sobre la influenza porcina 2009)
En un estudio reciente se estudió la patogénesis del virus de la influenza porcina, al infectar cerdos de 22 días de nacidos, con subtipos H1N1 y H3N2 aislados en Tailandia. Las lesiones pulmonares, macro y microscópicas fueron mayores con el subtipo H1N1 en comparación con H3N2. Las lesiones histopatológicas comprendieron daño celular epitelial e infiltración mononuclear peribronquial y perivascular. (Sreta 2009)
Alrededor de doce ejemplos de transmisión de influenza porcina de los cerdos al hombre han sido documentados en la literatura médica. Un gran número de éstos ocurrieron en personas que trabajaban con cerdos, aunque muchos casos no son reportados ya que los patrones estacionales de la influenza humana y porcina muchas veces se traslapan. (Olsen 2004)
El término influenza porcina no debe confundirse con el de fiebre porcina clásica o cólera porcina, una enfermedad exclusiva de los cerdos y que no afecta a los humanos, producida por un virus de la familia Flaviviridae, un virus relacionado con el agente causal de la diarrea viral bovina. Tampoco debe confundirse con la fiebre porcina africana, una enfermedad hemorrágica producida por un virus de la familia Asfarviridae, que es endémica en algunos países del sub-Sahara y en una región de Italia, y reportada también en Georgia y algunos países del Caribe, aunque no representa un riesgo para la salud pública humana. (World Organization for Animal Health 2008)
La influenza porcina no es una enfermedad notificable para las autoridades internacionales de salud animal, de allí que su distribución mundial en animales no es bien conocida. La enfermedad es considerada endémica en los Estados Unidos. Brotes en cerdos han ocurrido en Suramérica, en Europa se reportaron en el Reino Unido, Suecia e Italia, en África se reportaron en Kenya así como en países del este asiático, China y Japón. (WHO Swine influenza frequently asked questions 2009)
En Pensilvania un brote de influenza aviar H5N2, de alta patogenicidad atacó pollos y pavos durante 1983, sin embargo los estudios serológicos y virológicos, no evidenciaron transmisión a humanos. Posteriormente en 1993 se detectó serológicamente el virus H5N2, el cual se aisló en 1994, en pollos domésticos en Mexico; el estudio de la hemaglutinina orientó a señalar su origen de una cepa norteamericana. (Horimoto 1995)
Las aves acuáticas son reservorio de todos los subtipos del virus influenza A. En patos silvestres, el virus de la influenza se replica principalmente en las células del tracto intestinal, sin causar signos de enfermedad, pero excretando altas concentraciones del virus en las heces. La naturaleza no virulenta de la infección por influenza en patos y aves zancudas, pudo ser una adaptación al huésped a través de varios siglos, lo que crea un reservorio que asegura la perpetuación del virus. Influenza de origen aviar ha sido implicado en brotes de influenza en mamíferos como focas, ballenas, cerdos y en aves domésticas. (Webster 1998, Horimoto 1995)
Los virus aviarios permanecen estables y adaptados al tracto intestinal de cientos de especies de aves, algunas de las cuales son frecuentemente infectadas por múltiples virus que se engranan en un prolífico reordenamiento genético. Los mecanismos por los cuales, virus aviares cruzan la barrera de las especies, para infectar humanos u otros mamíferos, permitiendo a veces la subsiguiente transmisión de persona a persona, son desconocidos. (Morens 2009)
El análisis de la nucleoproteína de los genes, muestran que el virus de la influenza aviar ha evolucionado dentro de cinco huéspedes específicos en varios linajes: del viejo equino, del reciente equino, de gaviotas, del cerdo y humano. El ancestro del virus humano y del clásico porcino aparentemente ha sido el intacto virus aviar, que parecido al virus de la influenza que corrientemente ha circulado en los cerdos de Europa, derivó todos sus genes de la fuente aviar. Estudios de la nucleoproteína y de linajes de las especies aviares, muestran separados sublinajes de la influenza en Eurasia y en América, indicando que las aves migratorias que se desplazan en migración latitudinal entre estos continentes, tienen poco o ningún rol en la transmisión de la influenza, mientras que las aves que migran longitudinalmente parecen jugar un papel clave en el proceso continuo de evolución del virus. El análisis filogenético de los cambios en los aminoácidos, muestra que los virus de la influenza aviar, a diferencia de los linajes mamíferos, tienen una baja tasa evolutiva (Gorman 1990)
La más importante implicación de los estudios filogenéticos, es que los ancestrales virus que causaron gripe pandémica, como la española en 1918, así como los virus que aportaron segmentos de genes para la gripe asiática en 1957 y la de Hong Kong en 1968, todavía circulan en aves silvestres con pocos o inexistentes cambios mutacionales. (Webster 1998)
Influenza aviar A H5N1 en humanos
La mayoría de los casos humanos por H5N1 se han reportado durante el invierno, en el periodo Diciembre-Marzo, acompañado del incremento de brotes durante ese mismo tiempo en aves de corral. Aunque las aves silvestres acuáticas tienen un importante rol, en la persistencia del virus aviar, la mayoría de los casos confirmados en humanos por el virus aviar H5N1, reportaron contactos recientes con aves domésticas. (Park 2007)
La infección H5N1 en humanos, afecta principalmente el tracto respiratorio bajo, causando daño alveolar difuso y falla respiratoria, en contraste con la influenza humana estacional que afecta principalmente el tracto respiratorio superior. La diarrea es también, común presentándose en más del 70% de los pacientes infectados con el virus H5N1. Se ha detectado RNA viral en el intestino de un niño de 6 años en Tailandia, lo que sugiere la ocurrencia de replicación viral en el intestino humano; este hallazgo puede tener importantes implicaciones en el control de la enfermedad. (Wai 2007)
Desde el año 2003, más de 15 países han reportado más de 413 casos confirmados de gripe aviar H5N1 en humanos, de los cuales 256 han sido fatales. En cinco países: Indonesia, Vietnam, Egipto, China y Tailandia, se han reportado el 90% de los casos. La mediana de edad de los afectados es aproximadamente 20 años, con 77% de los pacientes con 30 años o menos. Aún no está claro el rol que pueda tener, la inmunidad preexistente por previos subtipos de influenza. Aunque la infección por H5N1 es una zoonosis, la vía más importante de transmisión humana es todavía la transmisión del ave al hombre, siendo la transmisión humano a humano rara. Los más conocidos factores de riesgo para la infección humana, son el manejo de aves enfermas o muertas durante una semana desde el inicio de la enfermedad. (Xu 2009)
Antivirales
Numerosos virus afectan el sistema respiratorio humano, entre los que destacan los virus de la influenza A, B y C; parainfluenza 1-4; adenovirus; virus de Epstein-Barr; rhinovirus y virus sincitial respiratorio. Se emplea la terapia antiviral para los virus de la influenza y sincitial respiratorio. (The Merck Manual 2005)
En la práctica clínica el uso de antivirales rara vez es guiado por el antecedente de un diagnóstico de laboratorio. Por tal razón la definición de predictores clínicos de infección por influenza, pueden ayudar a guiar oportunamente la terapia y evitar el uso innecesario de antibióticos. Se estudiaron 3744 personas con síntomas semejantes a la influenza, en 66% de ellos se confirmó influenza. Individuos con influenza mostraron mayor probabilidad de tener tos (93% vs. 81%), fiebre (68% vs. 40%), y/o congestión nasal (91% vs. 81%) que los individuos sin influenza. El mejor predictor de infección por influenza fue tos y fiebre con un valor predictivo positivo de 79%. Este valor predictivo positivo se eleva con el incremento en la temperatura al momento del reclutamiento. Por ello concluyen los investigadores, que cuando la influenza circula en la comunidad, los pacientes con síntomas de influenza y que presenten tos y fiebre dentro de las 48 horas del inicio de los síntomas, es probable que tengan influenza, por lo que la administración de terapia antiviral debe ser apropiadamente considerada. (Monto 2000)
A pesar de haber transcurrido más de setenta años del descubrimiento del virus de la influenza, aún persiste el debate sobre el modo de transmisión. Una reciente revisión de este tema concluye que naturalmente la influenza es transmitida a cortas distancias en personas más que a largas distancias, y ocurre principalmente a través de gotas y por el contacto. Previamente se conoce que la transmisión ocurre por gotas mayores o iguales de 5 um de diámetro, provenientes del tracto respiratorio de individuos infectados y generados al toser, estornudar, hablar o procedimientos de succión o broncoscopia. Estas gotas son propulsadas a través del aire, a una distancia menor de un metro y depositadas en la mucosa oral o nasal de un nuevo huésped o en el ambiente inmediato. Otro modo de transmisión es la aérea, que ocurre con la diseminación de microorganismos contenidos en el núcleo de gotas menores de 5 um de diámetro, producto de la evaporación de gotas más grandes y también por partículas de polvo que pueden contener células escamosas de la piel. (Brankston 2007)
Otros investigadores destacan la importancia de la transmisión de la influenza mediante aerosoles. Los aerosoles se definen como suspensiones en el aire o en un gas, de partículas sólidas o líquidas, suficientemente pequeñas y que pueden transportarse por el aire durante prolongados periodos de tiempo. Pacientes agudamente infectados con el virus A de la influenza, tienen altos títulos de virus en sus secreciones respiratorias, las cuales pueden ser aerosolizadas cuando el paciente tose o estornuda. (Tellier 2006)
La aplicación de medidas físicas para reducir la diseminación de virus respiratorios, sugieren que el uso de máscaras, puede reducir la transmisión de la influenza. (Jefferson 2008)
Resulta muy importante informar a la comunidad, que el virus de la nueva influenza A H1N1, llamado inicialmente como virus de la gripe porcina, no se transmite por el consumo de carne de cerdo o sus productos derivados, que han sido manipulados y cocinados de manera adecuada. Si se cocina la carne hasta que ésta alcance una temperatura interna de aproximadamente 71˚ C, se eliminan los virus de la influenza porcina, así como también otras bacterias y virus. (CDC Datos importantes sobre la influenza porcina 2009)
La influenza porcina no ha mostrado ser transmisible al hombre a través de la ingestión de carne de cerdo y otros productos derivados, manejados y cocinados apropiadamente. (WHO Swine influenza frequently asked questions 2009)
.
La influenza A alcanza su pico de incidencia durante el invierno en regiones templadas. Se reportó recientemente que la humedad absoluta influye en la transmisión y en la supervivencia del virus más que la humedad relativa. (Shaman 2009)
Por razones no del todo conocidas, las epidemias de influenza típicamente ocurren durante los meses de invierno en las regiones templadas de los hemisferios norte y sur, mientras que en los trópicos la epidemia frecuentemente coincide con la época de lluvias.
El periodo de incubación de una enfermedad infecciosa es el tiempo entre la infección y la aparición de los síntomas. El periodo de incubación es clínicamente relevante en la administración de antivirales, muchos de los cuales son más efectivos cuando son dados antes o inmediatamente después del inicio de los síntomas. Una revisión halló en la literatura consultada, un rango de 1-4 días en el periodo de incubación de la influenza. Además estimaron una mediana del periodo de incubación de 1-4 días en la influenza A y de 0,6 días en la influenza B. (Lessler 2009)
Para la nueva influenza A H1N1, se considera un caso confirmado cuando una persona con enfermedad respiratoria aguda es confirmada de tener la infección por el virus A H1N1 en un laboratorio mediante una o más de las pruebas siguientes: método RT-PCR en tiempo real; cultivo viral. Se define enfermedad respiratoria aguda como la aparición reciente de al menos dos de los siguientes síntomas: rinorrea o congestión nasal, dolor de garganta, tos con o sin fiebre o febrícula. (CDC Directrices provisionales 2009)
Los diferentes tipos y subtipos de la influenza, tienen variados efectos en la morbilidad y mortalidad. Un estudio realizado para conocer en Estados Unidos, durante el periodo de los años 1979-2002, los casos de influenza estacional asociados a hospitalización, reveló una tasa mayor de hospitalización en las estaciones en que predominó el virus A H3N2, seguido por el tipo B y A H1N1. Un significativo número de hospitalizaciones ocurrieron en personas de avanzada edad, lo que obedece en parte al envejecimiento de la población durante las últimas dos décadas. La segunda más alta tasa de influenza asociada a hospitalización, se encontró en niños y jóvenes. En niños menores de 5 años la tasa de influenza asociada a hospitalización 113,9/100.000 personas, fue similar a la del grupo de individuos entre 50 y 64 años de edad: 111,3/100.000 personas. (Thompson 2004)
Un estudio realizado en Argentina, para conocer el efecto de la influenza en la mortalidad en el periodo 1992-2002, encontró que el exceso de mortalidad solo se detectó durante las estaciones en que predominó el subtipo A H3N2; aproximadamente 80-95% de los excesos de muerte por neumonía e influenza ocurrieron en personas mayores de 64 años. (Imaz 2006)
La implementación de escalas pronósticas PSI y CURB-65, desarrolladas para mejorar la práctica clínica en el manejo de pacientes con neumonía adquirida en la comunidad, no solo predicen mortalidad, también se correlacionan significativamente con la duración del tiempo de hospitalización, la decisión de ingreso, readmisión a los 30 días y la utilización de cuidados intensivos y/o la necesidad de ventilación mecánica. (Capelastegui 2007)
Existen dos tipos de productos médicos que deben ser usados para responder a una influenza pandémica: drogas antivirales que pueden ser empleadas para tratar los más serios casos y para prevenir la infección, y las vacunas para prevenir la enfermedad, tomando en cuenta que la disponibilidad de antivirales es limitada y que la producción de una nueva vacuna puede llegar a tardar hasta seis meses. (Institute of Medicine 2009)
El virus de la nueva influenza A H1N1 es susceptible a los inhibidores de la neuraminidasa: zanamivir y oseltamivir, pero es resistente a los antivirales del grupo adamantane: amantadina y rimantadina. (CDC Directrices provisionales 2009)
En la profilaxis de la influenza se han empleado diferentes medicamentos antivirales. Entre ellos se cuenta la amantadina y la rimantadina, que actúan sobre las proteínas M2 del virus influenza A, interfiriendo con la infección viral en etapas posteriores a la adsorción y penetración viral. (Balfour 1999) El espectro antiviral de estos compuestos está restringido solo a la influenza A, a diferencia de los inhibidores de la enzima neuraminidasa, oseltamivir y zanamivir, que actúan contra la influenza A y B.
Amantadina fue aprobada en 1966 para la profilaxis de la influenza A H2N2 en Estados Unidos y para la profilaxis y tratamiento de la influenza A en 1976; la rimantadina fue aprobada para el tratamiento y profilaxis de influenza A en 1993.
Zanamivir y oseltamivir fueron aprobados en 1999, para el tratamiento en pacientes sintomáticos por no más de dos días, no contemplándose inicialmente su uso para la prevención de la influenza, ni el tratamiento con zanamivir en niños menores de 12 años, ni el tratamiento con oseltamivir en menores de 18 años de edad. (Winquist 1999)
Zanamivir, un análogo del ácido siálico, anteriormente conocido como GG167, es comercializado como Relenza® y desarrollado por Glaxo Wellcome PLC (UK); oseltamivir anteriormente conocido como RO 64-0796 o como GS 4104, es comercializado como Tamiflu® y desarrollado por Gilead Sciences Inc (Foster City, CA, USA) y Hoffman La Roche Ltd (Basel, Switzerland).
Los inhibidores de la neuraminidasa representan la más avanzada terapia antiviral disponible, actuando en todos los subtipos de influenza. (Oxford 2007)
La investigación se conduce a la futura producción de nuevos agentes inhibidores de la neuraminidasa, como por ejemplo CS-8958 que tiene un largo periodo de acción posterior a una simple aplicación intranasal. (Yamashita 2009)
Los inhibidores de la proteína M2 son aminas tricíclicas que inhiben la replicación del virus influenza a bajas dosis. La amantadina es efectiva en la prevención y tratamiento del virus influenza A. En niños, cuando es usada profilácticamente, disminuye en 50% la infección y entre 70-90% la enfermedad; empleada como tratamiento reduce los síntomas, acorta la enfermedad en un día y reduce las complicaciones, cuando el tratamiento se inicia dentro de dos días de la aparición de los síntomas.(Monto 2003)
Sin embargo la amantadina produce una rápida resistencia, que suele aparecer a los 2-4 días de iniciado el tratamiento, no estando avalado su uso por la Academia Americana de Pediatría. La rimantadina tiene una acción similar a la amantadina, aunque con menos efectos adversos. No está recomendada para su empleo en Pediatría. (Committee on Infectious Diseases 2007)
Oseltamivir y zanamivir, inhiben la enzima neuraminidasa del virus, una proteína implicada en la separación de la partícula viral desde la superficie celular luego del proceso replicativo. Al imposibilitarse la acción de esta enzima, se impide la separación de la nueva progenie viral desde las células -a las cuales están adheridas por unión de hemaglutinina viral al ácido siálico de la mucosa- y su diseminación.
Se ha evaluado in vitro la resistencia a estos fármacos, hallándose el desarrollo de mutaciones tanto en la hemaglutinina como en la neuraminidasa del virus. (Hayden 2006)
Durante el tratamiento la resistencia es baja y de aparición tardía y no hay evidencia de una mayor virulencia de estas cepas en humanos. (McKimm-Breschkin 2000)
La selección de resistencia en el virus de la influenza a los inhibidores de neuraminidasa, ha sido logrado con dificultad in vitro y con baja frecuencia y transitoriedad en la clínica. (Roberts 2001)
Se ha reportado la resistencia con el uso de zanamivir en pacientes inmunocomprometidos. (Reece 2007)
Oseltamivir es rápidamente absorbido desde el tracto intestinal y metabolizado por esterasas hepáticas a oseltamivir carboxilato, que es su metabolito activo. Se distribuye en la superficie del epitelio respiratorio, oído medio y senos paranasales. (Massarella 1999)
Oseltamivir absorbido y metabolizado a GS4071 que es el oseltamivir carboxilato, tiene una vida media de 6-10 horas y es excretado en la orina por filtración glomerular y secreción tubular. Oseltamivir no metabolizado también es excretado en la orina por filtración glomerular y secreción tubular. (He 1999)
Oseltamivir en una dosis de 75 mg vía oral, una o dos veces al día durante seis semanas, demostró ser efectivo para prevenir casos de influenza por virus A o B en pacientes entre 18 y 65 años de edad. La eficacia del oseltamivir en los grupos que recibieron la dosificación una o dos veces al día fue 74%.(Hayden 1999)
La eficacia de la administración profiláctica en la influenza sintomática, de 75 mg vía oral diariamente de oseltamivir es 61% y 73% cuando la dosis se eleva a 150 mg según resultados de meta análisis. Además se reporta la prevención de complicaciones del tracto respiratorio inferior con el empleo de 150 mg diarios de oseltamivir. (Jefferson 2006)
Oseltamivir se emplea tanto profilácticamente como en el tratamiento de influenza A y B en niños. (Matheson 2003)
El uso de oseltamivir en niños menores de un año no es extendido. Sin embargo un estudio retrospectivo en Japón, realizado en niños menores de un año no reportó encefalopatía ni mortalidad asociada. (Okamoto 2005)
Zanamivir se usa de forma inhalatoria, ya que presenta muy baja absorción oral y aún menor en el tracto respiratorio. Alcanza concentraciones de 13% en bronquios y pulmón y 77% en orofaringe. (CDC 2007)
Aproximadamente 4%-17% de la cantidad total de zanamivir oralmente inhalado, es absorbido sistémicamente. El zanamivir absorbido de esta manera tiene una vida media de 2,5-5,1 horas y es excretado inalterado en la orina. (Cass 1999)
La eficacia de la administración profiláctica en la influenza sintomática, de 10 mg vía inhalatoria diariamente de zanamivir es 62%, según resultados de meta análisis. (Jefferson 2006)
Antivirales en la influenza aviar A H5N1
Indonesia ha tenido la mayor cantidad de casos en personas por el virus A H5N1, acompañada de una de las tasas más altas de mortalidad por esta causa en el mundo. Entre Junio 2005 y Febrero 2008, se confirmaron 127 casos, obteniéndose información clínica y epidemiológica a partir de la cual Kandun y colaboradores, reportaron importantes hallazgos. De 127 pacientes, 103 murieron (81%); el promedio de tiempo de hospitalización fue de 6 días, con rango de 1-16 días; de 122 pacientes hospitalizados 121 presentaron fiebre (99%), 107 tos (88%) y 103 presentaron disnea (84%).
El promedio de edad en los afectados fue de 20 años, con un rango entre 2-67 años; casi el 50% de los pacientes habitaban en áreas rurales y el resto en áreas urbanas y semiurbanas. El promedio de tiempo para el inicio de tratamiento con oseltamivir fue 7 días, con un rango entre 0-21 días; el tratamiento se inició en los primeros 2 días de un paciente que sobrevivió; cuatro (36,4%) de 11 pacientes que recibieron tratamiento los primeros 2-4 días sobrevivieron; seis (37,5%) de 16 pacientes que recibieron tratamiento los primeros 5-6 días sobrevivieron; y ocho (18,5%) de 44 pacientes que recibieron tratamiento a los 7 o más días sobrevivieron.
Concluyen que el inicio del tratamiento con oseltamivir en los primeros dos días del cuadro viral se asoció significativamente con menor mortalidad, al compararlo con el inicio del tratamiento a los 5-6 días o después de los 7 días. (Kandun 2008)
Existe evidencia que soporta la actividad de ambos inhibidores de la neuraminidasa en contra de la influenza aviar H5N1, aunque la Organización Mundial de la Salud comúnmente recomienda el uso de oseltamivir para el manejo de casos sospechosos. (Oxford 2007)
Reacciones y efectos adversos de los antivirales
El uso de amantadina y rimantadina, se ha asociado con efectos en el sistema nervioso central, como nerviosismo, ansiedad, dificultad para concentrarse, los cuales son infrecuentes con el uso de inhibidores de la neuraminidasa. (Abad-Santos 2001, Fica 2001)
Con el uso de oseltamivir se ha reportado la presencia de vómitos (9%) y náuseas (10%), los cuales se reducen si el medicamento es tomado con alimentos. (Hayden, JAMA1999) Este mismo autor reportó al tratar profilácticamente con 75 mg una vez al día, náuseas12,1%, vómitos 2,5% y con 75 mg dos veces al día náuseas 14,6% y vómitos 2,7%. La mayoría de los eventos gastrointestinales ocurrieron durante los primeros dos días de tratamiento. (Hayden 1999)
Los más comunes efectos adversos del zanamivir, son diarrea, náusea, sinusitis, bronquitis, tos, cefalea, mareo. Se debe tomar precaución en pacientes con asma, enfermedad pulmonar obstructiva crónica, ya que puede presentarse broncoespasmo y declinación del volumen espiratorio forzado. (Democratis 2006, Winquist 1999)
Prevención y tratamiento con antivirales
Zanamivir ha resultado eficaz para prevenir influenza por virus A o B, con dosis diaria inhalatoria oral de 10 mg durante cuatro semanas, en un grupo de personas entre 18 y 69 años. El estudio se llevó a cabo durante la temporada de influenza de 1997-1998, en dos sitios de estados Unidos. (Monto 1999)
Aunque la vacunación de poblaciones seleccionadas sigue siendo la medida de primera elección para la profilaxis de la gripe, las características del zanamivir como eficacia, seguridad y falta de resistencia, lo convierten en una opción adecuada para sujetos no protegidos por la vacuna y para los que tienen alto riesgo de complicaciones. (Abad-Santos 2001)
El tratamiento con zanamivir en niños de 4 a 12 años, disminuyó en 1,25 días los síntomas de influenza comparado a placebo; en otros estudios en niños mayores de 12 años con influenza, el tratamiento con zanamivir disminuyó los síntomas en 2,5 días. (Committee of Infectious Diseases 2007)
La evidencia disponible respalda el uso de estos fármacos para acortar la enfermedad y disminuir la severidad y complicaciones de la influenza; sin embargo, el costo es elevado y limita su aplicación hacia el escenario terapéutico, especialmente en pacientes de alto riesgo. (Fica 2001)
En un estudio se infectaron tejidos de epitelio respiratorio con virus de la influenza aviar y humana en presencia carboxilato de oseltamivir, lográndose la primera evidencia experimental del rol de la neuraminidasa en la etapa de invasión viral al epitelio ciliado humano. La habilidad de los inhibidores de neuraminidasa para suprimir la infección antes que el virus penetre a las células, destaca su alto potencial como medida preventiva. Según los autores, se tiene la base científica para apoyar el uso profiláctico de estos fármacos en personas de alto riesgo o infectadas con el virus de la influenza aviar. (Matrosovich 2004)
Longini y colaboradores, diseñaron un modelo para simular un ataque de bioterrorismo o una pandemia en Estados Unidos, con un agente similar al virus de la influenza A H2N2 que causó la pandemia de influenza asiática en 1957-1958. En ausencia de intervención, predijeron una rata de ataque de 33% de la población y una rata de mortalidad de 0,58 muertes por mil personas; con el uso profiláctico de antivirales en 80% de los expuestos hasta por ocho semanas, la epidemia puede ser contenida, y el modelo predice una rata de ataque de 2%, con una rata de mortalidad de 0,04 muertes por mil personas. Es así como la profilaxis antiviral es casi tan efectiva como la vacunación del 80% de la población. Además señalan que la vacunación en 80% de menores de 19 años, es casi tan efectiva como la vacunación de 80% de la población. De allí que la profilaxis antiviral tiene el potencial de contener la influenza, hasta que se pueda disponer de adecuadas cantidades de vacunas. (Longini 2004)
El significativo número de hospitalizaciones asociadas a la influenza estacional, en niños menores de 5 años y jóvenes, así como en personas de avanzada edad, deben conllevar a mejorar los esfuerzos de la prevención en estos individuos. (Thompson 2004)
Un reciente meta-análisis sugiere que oseltamivir y zanamivir son capaces de aliviar los síntomas de la influenza estacional en adultos, sin embargo el uso rutinario de estos fármacos no está indicado en pacientes con bajo riesgo de complicaciones para la influenza estacional, aunque estos antivirales sean capaces de disminuir la diseminación de la enfermedad en las casas, la carga viral nasal y las complicaciones del tracto respiratorio inferior. (Jefferson 2006)
En niños, el empleo profiláctico en la influenza de inhibidores de neuraminidasa está indicado en pacientes con factores de riesgo con menos de dos semanas de ser vacunados, con factores de riesgo no vacunados, contactos de niños inmunosuprimidos no vacunados y en el control de brotes. (Committee of Infectious Diseases 2007)
Para la quimioprofilaxis antiviral de la nueva influenza A H1N1, se recomienda el empleo de oseltamivir o zanamivir en niños de un año o más. Oseltamivir puede ser usado en Estados Unidos para la quimioprofilaxis en niños menores de un año. La duración de la quimioprofilaxis post-exposición a un caso confirmado, es de 10 días.
El empleo de oseltamivir para el tratamiento en niños menores de un año, también fue recientemente aprobado por la FDA; la duración del tratamiento es de cinco días. (CDC Interim Guidance for Clinicians on the Prevention and Treatment of Swine-Origin Influenza Virus Infection in Young Children 2009)
En niños, el tratamiento de la influenza con inhibidores de la neuraminidasa se indica en influenza moderada o severa, pacientes con factores de riesgo y en la influenza complicada. (Committee of Infectious Diseases 2007)
El empleo de oseltamivir y zanamivir es efectivo e indicado para su uso en influenza en niños, ambos acortan los días de enfermedad, evitan la diseminación de la enfermedad y disminuyen complicaciones como neumonía, aunque en la influenza B la eficacia es menor. (Jofré 2009)
Para la quimioprofilaxis antiviral de la infección por el nuevo virus de influenza A H1N1 se recomienda el uso de oseltamivir o zanamivir, durante siete días después de la última exposición conocida a un caso confirmado de infección por el nuevo virus de la influenza A H1N1. La dosificación y la programación de las dosis recomendadas son las mismas que se recomiendan para la influenza estacional. (CDC Directrices provisionales 2009)
Además de disponer de vacunas y drogas durante una pandemia, se requieren estrategias no farmacéuticas que ayudan a reducir la dispersión de la enfermedad, tales como evitar las concentraciones en lugares públicos, cuarentena y medidas de higiene personal como el lavado frecuente de manos. (Institute of Medicine 2009)
Para el tratamiento de casos confirmados de la nueva influenza A H1N1, se pueden administrar oseltamivir o zanamivir y la duración recomendada del tratamiento es cinco días. (CDC Directrices provisionales 2009)
La Organización Mundial de la Salud recientemente anunció, la identificación de tres personas con la infección por el nuevo virus de la influenza A H1N1 y resistentes al oseltamivir. El primero de ellos reportado en Dinamarca el 29 de Junio, en un paciente que recibió quimioprofilaxis con oseltamivir después de tener contacto con un enfermo; el 2 de Julio en Japón se reportó el caso de un paciente que también recibió tratamiento preventivo con el antiviral y el 3 de Julio el Departamento de Salud de Hong Kong, reportó el virus resistente, aislado de una niña de 16 años quien presentó fiebre a su arribo de un viaje desde San Francisco, California. Esta niña no había tomado medicamentos antivirales. (CDC Three Reports of Oseltamivir Resistant Novel Influenza 2009)
Vacunas
La hemaglutinina, una glicoproteína superficial del virus de la influenza, es el blanco principal de la protectora respuesta inmune. Por ello la hemaglutinina es el foco en la vigilancia del virus de la influenza y el componente principal de las vacunas comúnmente disponibles. Conocido es el sustancial cambio que presentan las propiedades antigénicas de la hemaglutinina a través del tiempo. Motivado a los continuos cambios evolutivos del virus de la influenza A, las vacunas deben ser actualizadas frecuentemente. Por ejemplo, desde que la influenza A subtipo H3N2 entró a la población humana en 1968, el componente A H3N2 de la vacuna ha tenido que ser actualizado por lo menos treinta veces, para seguir la huella del virus y mantenerse efectivo. (Russell 2008)
El virus de la influenza es causante de la mayor causa de muertes prevenibles por vacunas en el mundo, a pesar de la disponibilidad de seguras y efectivas vacunas. (Poland 2007)
Dos veces al año la OMS, recomienda cuales de las cepas circulantes en esa ocasión -previos análisis antigénicos y genéticos- formarán parte de la nueva vacuna que prevendrá la venidera influenza estacional. Esas recomendaciones se dan durante el mes de Febrero para la vacuna del hemisferio norte, lo que da suficiente tiempo para manufacturar unas 300 millones de dosis para vacunar a la población entre Octubre y Noviembre y prepararla para la influenza que típicamente alcanza su pico entre los meses de Diciembre y Marzo. El proceso es similar en el hemisferio sur y se dan las recomendaciones durante el mes de Septiembre. De allí que las cepas para las vacunas comúnmente son seleccionadas casi un año antes de la estación de influenza en que serán usadas. (Russell 2009)
La producción mundial de vacunas es limitada y es llevada a cabo en países industrializados. La misma no llegaría a ser suficiente para cubrir globalmente la población de alto riesgo. Además es discutible si la infraestructura global existente es capaz de manejar a tiempo la distribución y entrega de vacunas ante una pandemia. (WHO/IVR 2003)
La distribución de los limitados inventarios de vacunas, en situaciones de influenza pandémica es objeto de debate. Convencionalmente se focaliza la vacunación en personas mayores de 65 años, sin considerar el patrón de la pandemia que puede variar el riesgo de mortalidad hacia los jóvenes. En tres escenarios diferentes, el mayor riesgo de mortalidad correspondió a los menores de 45 años en la pandemia de 1918 y a mayores de 65 años en las pandemias de 1957 y 1968. El mayor número de años de vida perdidos, pudieron ser evitados seleccionando diferentes grupos etéreos: menores de 45 años en el escenario de 1918; personas de 45-64 años en el escenario de 1968 y personas mayores de 45 años en el escenario de la pandemia de 1957. (Miller 2008)
Los hallazgos del brote inicial en México, de la pandemia por la nueva influenza A H1N1, sugieren una racionalización de las vacunas, focalizando los esfuerzos de prevención en la población joven. (Chowell 2009)
La Directora General de la OMS, asume las recomendaciones del grupo de expertos en inmunizaciones, recientemente reunido. Aunque se considere como moderada la severidad de la actual pandemia, algunos grupos como los de las embarazadas, personas con asma y otras condiciones crónicas, así como la obesidad mórbida, parecen incrementar el riesgo de enfermedad severa y muerte. Los países necesitan determinar el orden de prioridad de los grupos a inmunizar, tomando en cuenta las condiciones particulares de cada país, aunque siempre colocando a los trabajadores de la salud con la mayor prioridad para ser vacunados. (OMS Recomendaciones de la OMS con respecto a las vacunas 2009)
Embarazo y lactancia
Ács y colaboradores sugieren un efecto teratogénico indirecto de la influenza durante el embarazo, posiblemente por la alta fiebre y basado en los conocidos efectos de la hipertermia asociados con un incremento en la incidencia de los defectos del tubo neural. (Ács 2005, Moretti 2005)
Se reportó en Japón 1,1% de incidencia por malformaciones congénitas en 90 embarazadas que recibieron en su primer trimestre, 75 mg de oseltamivir, dos veces al día durante cinco días. Dicha incidencia se halla dentro de la incidencia de malformaciones en la población general: 1-3%. (Hayashi 2009)
De tres mujeres embarazadas que fueron accidentalmente expuestas a zanamivir, una abortó espontáneamente, en la otra se detuvo el embarazo y la tercera llegó al parto de un niño sano. (Freund 1999)
El riesgo de morbilidad por influenza estacional es alto en embarazadas, especialmente durante el tercer trimestre, en comparación con las no embarazadas o en posparto. (Neuzil 1998)
Aunque la nueva influenza H1N1 no haya sido hasta ahora, tan virulenta como se predijo, el incremento del riesgo de complicaciones durante el embarazo deberá tomarse en cuenta en el manejo de estos pacientes afectados. (Tanaka 2009)
Se ha indicado en Chile desde el mes de Mayo de 2009, cuando aún se estaba en la fase 5 de preparación de pandemia, la quimioprofilaxis con oseltamivir para los contactos de la nueva influenza A H1N1, incluyéndose las embarazadas que habitan bajo el mismo techo de un caso confirmado. (Guía Clínica para el manejo de casos 2009)
En el presente, los grupos de alto riesgo para complicaciones por la nueva influenza A H1N1, son los mismos de la influenza estacional, que incluye a embarazadas y niños menores de cinco años. (CDC Interim guidance on antiviral recommendations 2009)
Se desconoce si el virus pasa a través de la leche materna, aunque el principal modo de transmisión debe ser a través de gotas con secreciones respiratorias. Debido al beneficio de la leche materna en los niños, por su poder antiinfeccioso, se recomienda a las mujeres que están recibiendo tratamiento para la nueva influenza, continuar con el amamantamiento. (CDC Novel H1N1 flu and feeding your baby 2009)
Oseltamivir y su metabolito activo se encuentra en la leche materna de madres tratadas, aunque no alcanzan valores significativos en lactantes. (Wentges-van 2008)
Algunos retos para el siglo XXI
- El muestreo de aves acuáticas en Eurasia, América y otros lugares es necesario. La vigilancia de los mercados de aves, vigilancia de cerdos, caballos y del brote de influenza en visones y mamíferos marinos debe continuar. Existe la urgencia de recolectar los datos epidemiológicos necesarios, para desarrollar un sistema de vigilancia en aves y otros animales, de interés no solo para la salud animal, sino para el hombre y la agricultura. (Webster 2002)
- Rápida identificación de los diferentes subtipos virales, mediante técnicas como el análisis secuencial de los genes de la hemaglutinina y neuraminidasa. (Fouchier 2005)
- Si los cerdos constituyen los mayores vasos comunicantes del virus de la influenza, los cambios en las prácticas agrícolas que separen debidamente los cerdos de las personas y patos, pueden prevenir futuras pandemias, ya que deseablemente se dificulta la transmisión entre las especies del virus de la influenza. (Webster 1998)
- Se necesitan más investigaciones, en modelos con infecciones por otros patógenos respiratorios y en la prevención y control de la influenza viral en cerdos. (Sreta 2009)
- Identificación de los cambios genéticos responsables de la transmisión entre mamíferos constituye una importante tarea para el futuro. (Wit 2008)
- Mayores esfuerzos para la investigación de la persistencia del virus de influenza en comunidades tropicales, donde la actividad del virus parece presentarse a lo largo de todo el año, a diferencia de la marcada estacionalidad de las zonas templadas. (Hope-Simpson 1981)
- Las características epidemiológicas de la influenza en los países industrializados se conocen bien, pero en los países en desarrollo la información es mínima. (Heymann 2005)
- El neurotropismo en humanos, mostrado en el sudeste asiático por el virus H5N1, merece una mayor atención. (Wai 2007)
- Se requiere mejorar las actuales tecnologías para la producción masiva de vacunas -como lo es la clásica inoculación de huevos de gallina- y que protejan contra un más amplio espectro del virus de la influenza. (WHO/IVR 2003)
- Aunque la hemaglutinina sea la proteína más importante como ingrediente para las vacunas de influenza, otras proteínas como las nucleoproteínas, M2 y neuraminidasa deberán jugar en el futuro cercano, un papel más interesante en las vacunas de influenza.
- Mayores estímulos para la investigación y desarrollo de nuevos antivirales.
- Frenar el abuso de los antivirales, mediante la difusión masiva de mensajes claros tanto a los potenciales beneficiarios de los mismos, como a los administradores de salud, tomando en cuenta el bagaje técnico existente y las connotaciones regionales y locales relacionadas al costo y accesibilidad de los mismos.
Anexo 1: Esquema del virus A de la influenza
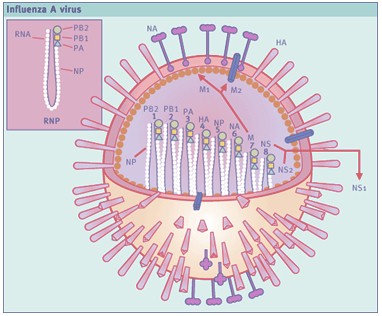
HA: Hemaglutinina NA: Neuraminidasa
Fuente: Fields Virology. 1966. Third edition, Philadelphia
Anexo 2: Imagen del virus de la nueva influenza A H1N1
Fuente: CDC Influenza Laboratory. 2009
Referencias:
- Abad-Santos F, Gallego S, Novalbos J, Martínez E, Gálvez M. Eficacia del zanamivir inhalado para el tratamiento y la prevención de la gripe. An Med Interna (Madrid) 2001; 18(2):93-99
- Ács N, Banhidy F, Puho E, et al. Maternal influenza during pregnancy and risk of congenital abnormalities in offspring. Birth Defects Res A Clin Mol Teratol 2005; 73:989-996
- Ansart S, Pelat C, Pierre-Yves Boelle, Carrat F, Flahault A, Valleron A. Mortality burden of the 1918-1919 influenza pandemic in Europe. Influenza and Other Respiratory Viruses 2009; 3:99-106
- Balfour H. Antiviral drugs. N Engl J Med 1999; 340:1255-1268
- Brankston G, Gitterman L, Hirji Z, Lemieux C, Gardam M. Transmission of influenza A in human beings. Lancet Infectious Diseases 2007; 7:257-265
- Capelastegui A. Eficacia de las escalas pronósticas (Fine y CURB-65) para predecir el riesgo de mortalidad en la neumonía comunitaria. Pneuma 2007; 8:37-38
- Cass L, Efthymiopoulos C, Bye A. Pharmacokinetics of zanamivir after intravenous, oral, inhaled or intranasal administration to healthy volunteers. Clin Pharmacokinet 1999; 36 (Suppl):1-11
- Centers for Disease Control and Prevention (CDC). Datos importantes sobre la influenza porcina (gripe porcina). http://www. cdc. gov/ swine flu/ espanol /swine-espanol (accesado Abril, 2009)
- Centers for Disease Control and Prevention (CDC). Directrices provisionales para el control de infecciones y recomendaciones para el uso de medicamentos antivirales en pacientes con infección presunta o confirmada por influenza porcina (gripe porcina) tipo A (H1N1) y en personas que hayan tenido contacto cercano con ellos. http://www .cdc. gov/ swine flu/ espanol /recomendaciones (accesado Abril ,2009)
- Centers for Disease Control and Prevention (CDC). Interim Guidance for Clinicians on the Prevention and Treatment of swine-origin Influenza Virus Infection in Young Children. http://www. cdc. gov/ swine flu/ children treatment (accesado Abril, 2009)
- Centers for Disease Control and Prevention (CDC). Interim guidance on antiviral recommendations for patients with novel influenza A (H1N1) virus infection and their close contacts. Atlanta (GA): The Centers 2009; www. cdc. gov/ h1n1 flu/ recommendations.htm (accesado Mayo, 2009)
- Centers for Disease Control and Prevention (CDC). Novel H1N1 flu (swine flu) and feeding your baby: what parents should know. Atlanta (GA): The Centers 2009; www. cdc. gov/ h1n1 flu/ breast feeding. htm (accesado Mayo, 2009)
- Centers for Disease Control and Prevention (CDC). Prevention and control of influenza. Recommendations of the Advisory Committee on Immunization Practices. MMWR Recomm Rep 2007; 56:1-60
- Centers for Disease Control and Prevention (CDC). Three Reports of Oseltamivir Resistant Novel Influenza A (H1N1) Viruses. http://www. cdc. gov/ h1n1 flu/ HAN/ 070909. htm (accesado Julio, 2009)
- Committee on Infectious Diseases. Antiviral therapy and prophylaxis for influenza in children. Pediatrics 2007; 119:852-860
- Chowell G, Bertozzi S, Colchero M, Lopez-Gatell H, Alpuche-Aranda C, Hernandez M, Miller M. Severe Respiratory Disease Concurrent with the Circulation of H1N1 Influenza. The New England Journal of Medicine 2009; 361:1-6
- Democratis J, Pareek M, Stephenson I. Use of neuraminidase inhibitors to combat pandemic influenza. Journal of Antimicrobial Chemotherapy 2006; 58:911-915
- Fica A. Influenza: Una revision de su quimioprofilaxis y terapéutica antiviral. Rev Chil Infect 2001; 18(2):127-131
- Fouchier R, Munster V, Wallensten A, Bestebroer T, Herfst S, Smith D, Rimmelzwaan G, Olsen B, Osterhaus A. Characterization of a novel influenza A virus hemagglutinin subtype (H16) obtained from black-headed gulls. J Virol 2005; 79:2814-2822
- Freund B, Gravenstein S, Elliott M, et al. Zanamivir: a review of clinical safety. Drug Saf 1999; 21:267-281
- Girón B, Cáceres B. Influenza: La pandemia del siglo XXI. Revista del Instituto Nacional de Higiene Rafael Rangel 2004; 35(2)
- Gorman O, Bean W, Kawaoka Y, Webster R. Evolution of the nucleoprotein gene of influenza A virus. J Virol 1990; 64:1487-1497
- Guía clínica para el manejo de casos Nueva Influenza Humana A (H1N1) Etapa de Mitigación. Gobierno de Chile Ministerio de Salud, 29-05-2009. pp. 1-9
- Hayashi M, Yamane R, Tanaka M, et al. Pregnancy outcome after maternal exposure to oseltamivir phosphate during the first trimester: a case series survey [Japanese]. Nihon Byoin Yakuzaishi Gakkai Zasshi 2009; 45:547-550
- Hayden F, Atmar R, Schilling M, Johnson C, Poretz D et al. Use of the selective oral neuraminidase inhibitor oseltamivir to prevent influenza. N Engl J Med 1999; 341:1336-1343
- Hayden F, Treanor J, Fritz R, et al. Use of the oral neuraminidase inhibitor oseltamivir in experimental human influenza. JAMA 1999; 282:1240-1246
- Hayden F. Antiviral resistance in influenza viruses-implications for management and pandemic response. New Engl J Med 2006; 354:785-788
- He G, Massarella J, Aitken M, et al. The pharmacokinetics and safety of the oral neuraminidase inhibitor Ro 64-0796/GS4104 when administered concurrently with cimetidine or probenecid in healthy subjects. J Antimicrob Chemother 1999; 44(Suppl A):44
- Heinen P. Swine influenza: a zoonosis. Veterinary Sciences 2003. http://www. Vet scite.org/ ublish /articles /000041 /print.html (accesado Abril, 2009)
- Heymann D. –ed. Influenza. En: El Control de las enfermedades transmisibles. 18a ed. Washington, D.C.: OPS, 2005. Publicación Científica y Técnica No. 613
- Hope-Simpson R. The role of season in the epidemiology of influenza. J Hyg 1981; 86:35-47
- Horimoto T, Rivera E, Pearson J, Senne D, Krauss S, Kawaoka Y, et al. Origin an molecular changes associated with emergence of a highly pathogenic H5N2 influenza virus in Mexico. Virology 1995; 213:223-230
- Imaz M, Eimann M, Poyard E, Savy V. Exceso de mortalidad asociada a influenza en Argentina 1992-2002. Revista Chilena de Infectología 2006; 23(4):297-306
- Institute of Medicine (IOM).Pandemic Influenza A Guide to Recent Institute of Medicine Studies and Workshops. May, 2009. pp. 1-5
- Jefferson T, Demicheli V, Di Pietrantonj C, Jones M, Rivetti D. Neuraminidase inhibitors for preventing and treating influenza in healthy adults. Cochrane Database of Systematic Reviews 2006; (3):CD001265
- Jefferson T, Foxlee R, Del Mar C et al. Physical interventions to interrupt or reduce the spread of respiratory viruses: systematic review. BMJ 2008; 336:77-80
- Jofré L. Tratamiento y profilaxis de influenza estacional en niños. Neumología Pediátrica 2009; 4(1):29-34
- Kandun I, Tresnaningsih E, Purba W, Lee V, Samaan G et al. Factors associated with case fatality of human H5N1 virus infections in Indonesia: a case series. The Lancet 2008; 372:744-749
- Lessler J, Reich N, Brookmeyer R, Perl T, Nelson K, Cummings D. Incubation periods of acute respiratory viral infections: a systematic review. The Lancet Infectious Diseases 2009; 9:291-300
- Longini I, Halloran E, Nizam A, Yang Y. Containing Pandemic Influenza with Antiviral Agents. American Journal of Epidemiology 2004; 159(7): 623-633
- Massarella J, Ward P. Clinical pharmacokinetics of the prodrug oseltamivir and its active metabolite RO 64-0802. Clin Pharmacokinet 1999; 37:471-484
- Matheson N, Symmonds-Abrahams M, Sheik A, Shepperd S, Harnden A. Neuraminidase inhibitors and treating influenza in children. Cochrane Databse System Rev 2003; 3.CD002747
- Matrosovich M, Matrosovich T, Gray T, Roberts N, Klenk H. Neuraminidase Is Important for the Initiation of Influenza Virus Infection in Human Airway Epithelium. Journal of Virology 2004; 78(22):12665-12667
- McKimm-Breschkin J. Resistance of influenza virus to neuraminidase inhibitors: a review. Antiviral Res 2000; 47:1-17
- Miller M, Viboud C, Olson D, Grais R, Rabaa M, Simonsen L. Prioritization of Influenza Pandemic Vaccination to Minimize Years of Life Lost. The Journal of Infectious Diseases 2008; 198:305-311
- Monto A, Gravenstein S, Elliott M, Colopy M, Schweinle J. Clinical Signs and Symptoms Predicting Influenza Infection. Arch Intern Med 2000; 160:3243-3247
- Monto A, Robinson D, Herlocher M, Hinson J, Elliot M, Crisp A. Zanamivir in the prevention of influenza among healthy adults: a randomized controlled trial. JAMA 1999; 282:31-35
- Monto A. The role of antivirals in the control of influenza. Vaccine 2003; 21:1796-1800
- Morens D, Taubenberger J, Fauci A. The Persistent Legacy of the 1918 Influenza Virus. The New England Journal of Medicine 2009; 361(3):225-229
- Moretti M, Bar-Oz B, Fried S, et al. Maternal hyperthermia and the risk for neural tube defects in offspring: systematic review and meta-analysis. Epidemiology 2005; 16:216-219
- Nelson M, Simonsen L, Viboud C, Miller M, Holmes E. Phylogenetic Analysis Reveals the Global Migration of Seasonal Influenza A Viruses. PLoS Pathogens 2007; 3(9):1220-1228
- Neuzil K, Reed G, Mitchel E, et al. Impact of influenza on acute cardiopulmonary hospitalizations in pregnant women. Am J Epidemiol 1998; 148:1094-1102
- Okamoto S, Kamiya I, Kishida K, Shimakawa T, Fukuy T, Morimoto T. Experience with oseltamivir for infants younger than 1 year old in Japan. Pediatr Infect Dis J 2005; 24:575-576
- Olsen C. Influenza: Pigs, People and Public Health. Public Health Fact Sheet 2004; 2(6)
- Organización Mundial de la Salud (OMS). Recomendaciones de la OMS con respecto a las vacunas contra la gripe por A (H1N1). Nota informativa núm.2Julio, 2009. http://www. Who .int/csr/ disease /swine flu /notes /h1n1 _ vaccine _2009 0713/es/ index.h (accesado Julio, 2009)
- Oxford J, Sefton A, Jackson R, Innes W, Daniels R, Johnson N. World War I may have allowed the emergence of “Spanish” influenza. The Lancet Infectious Diseases 2002; 2:111-114
- Oxford J. Antivirals for the treatment and prevention of epidemic and pandemic influenza. Influenza Other Respi Viruses 2007; 1(1):27-34
- Park A, Glass K. Dynamic patterns of avian and human influenza in east and southeast Asia. Lancet Infect Dis 2007; 7:543-548
- Payungporn S, Crawford P, Kouo T, Chen L, Pompey J, Castleman W, Dubovi E, Katz J, Donis R. Influenza A virus (H3N8) in Dogs with Respiratory Disease, Florida. EID 2008; 14(6)
- Poland G, Jacobson R, Targonski P. Avian and pandemic influenza: An overview. Vaccine 2007; 25:3057-3061
- Reece P. Neuraminidase inhibitor resistance in influenza viruses. J Med Virol 2007; 79:1577-1586
- Roberts N. Treatment of influenza with neuraminidase inhibitors: virological implications. R Soc Lond 2001; 356:1895-1897
- Russell C, Jones T, Barr I, Cox N, Garten R, et al. Influenza vaccine strain selection and recent studies on the global migration of seasonal influenza viruses. Vaccine 2008; 26S:D31-D34
- Shaman J, Kohn M. Absolute humidity modulates influenza survival, transmission, and seasonality. PNAS 2009; 106(9): 3243-3248
- Shetty P. Preparation for a pandemic: influenza A H1N1. The Lancet 2009; 9:339-340
- Sreta D, Kedkovid R, Twamsang S, Kitikoon P, Thanawongnuwech R. Pathogenesis of swine influenza virus (Thai isolates) in weanling pigs: an experimental trial. Virology Journal 2009; 6:34
- Subbarao K, et al. Characterization of an avian influenza virus isolated from a child with a fatal respiratory illness. Science 1998; 279:393-396
- Suzuki Y, Ito T, Suzuki T, Holland R, Chambers T, Kiso M, et al. Sialic acid species as a determinant of the host range of influenza A viruses. J Virol 2000; 74:11825-11831
- Tanaka T, Nakajima K, Murashima A, García-Bournissen F, Koren G, Ito S. Safety of neuraminidase inhibitors against novel influenza A (H1N1) in pregnant and breastfeeding women. CMAJ 2009; 18(1-2):55-58
- Tellier R. Review of Aerosol Transmission of Influenza A Virus. Emerging Infectious Diseases 2006; 22(11):1657-1662
- The Merck Manual. Section Infectious Diseases: Selected Viruses that infect humans. 2005
- Thompson W, Shay D, Weintraub E, Brammer L, Bridges C, Cox N, Fukuda K. Influenza-Associated Hospitalizations in the United States. JAMA 2004; 292(11):1333-1340
- van Riel D, Munster V, de Wit E, Rimmelzwaan G, Fouchier R, Osterhaus A, et al. H5N1 virus attachment to lower respiratory tract. Science 2006; 312(5772):399
- Wai Fu N, Ka Fai T. Pathology of human H5N1 infection: new findings. Lancet 2007; 370:1106-1108
- Webby R, Rosowk K, Erickson G, Sims Y, Webster R. Multiple lineages of antigenically and genetically diverse influenza A virus co-circulate in the United States swine population. Virus Research 2004; 103(1-2):67-73
- Webster R. Influenza: An Emerging Disease. Emerging Infectious Diseases 1998; 4(3):436-441
- Webster R. The importance of animal influenza for human disease. Vaccine 2002; 20:S16-S20
- Wentges-van H, van Eijkeren M, van der Laan J. Oseltamivir and breastfeeding. Int J Infect Dis 2008; 12:451
- WHO/IVR. State of the art of new vaccines Research & Development. Initiative for Vaccine Research-World Health Organization. Geneva, April 2003
- Winquist A, Fukuda K, Bridges C, Cox N. Neuraminidase Inhibitors for Treatment of Influenza A and B Infections. MMWR 1999; 48(RR14). Centers for Disease Control and Prevention, Atlanta.
- Wit E, Fouchier R. Emerging influenza. Journal of Clinical Virology 2008; 41:1-6
- World Health Organization (WHO). Swine influenza frequently asked questions. http://www. Who .int/csr /disease /swine flu /flaq/e n/print--- (accesado Abril, 2009)
- World Organization for Animal Health (OIE). What is African Swine fever? In: Chapter 15.1, Terrestrial Animal Health Code 2008
- World Organization for Animal Health (OIE). What is Classical Swine Fever? In: Chapter 15.1, Terrestrial Animal Health Code 2008
- Xu C, Dong L, Xin L, Lan Y, Chen Y, Yang L, Shu Y. Human avian influenza A (H5N1) virus infection in China. Sci China Ser C-Life Sci 2009; 52(5):407-411
- Yamashita M, Tomozawa T, Kakuta M, Tokumitsu A, Nasu H, Kubo S. CS-8958, a Prodrug of the New Neuraminidase Inhibitor R-125489, Shows Long-Acting Anti-Influenza Vírus Activity. Antimicrobial Agents and Chemotherapy 2009; 53(1):186-192