Existe un número limitado de componentes que son detectados en el cerebro en forma rutinaria in vivo con el espectro de protones. El pico más alto en el tejido cerebral normal corresponde a las moléculas de N-acetil aspartato, que se utiliza como marcador neuronal, ya que se encuentra presente exclusivamente en las neuronas. Este patrón característico nos permite comparar distintas funciones metabólicas a través de marcadores del metabolismo energético (Creatina), replicación celular (Colina), metabolismo anaerobio (Lactato), neurotransmisores (Mioinositol, Glutamato y Glutamina); además de macromoléculas tales como lípidos.
Espectroscopia cerebral por Resonancia Magnética.
Autores
Dra. Caren González. Residente 3º año postgrado radiología y diagnóstico por imágenes del Hospital Universitario de los Andes. Universidad de los Andes.
Dr. César Villamizar. Médico Radiólogo.
Dr. Gustavo Rojas. Médico Radiólogo.
Dr. Franklin Moreno. Médico Radiólogo.
Dra. Mercedes Ávila. Médico Radiólogo.
Dr. Carlos Parales. Médico Radiólogo.
Palabras clave: Espectroscopia, Resonancia Magnética, Espectro Cerebral Normal, Metabolitos.
Key words: Spectroscopy, Magnetic Resonance, Normal Brain Spectrum, Metabolites.
Resumen
Introducción: la Espectroscopia por Resonancia Magnética (E-RM) realizada a través de la determinación del hidrógeno (H1), es una técnica no invasiva que permite determinar "in vivo" los protones que se encuentran en el cerebro en condiciones normales y patológicas permitiendo obtener un espectro metabólico del cerebro.
Objetivo: utilidad de la neuroespectroscopia para definir metabolitos en el espectro cerebral normal de H1 y determinar su relación con la creatina.
Revisión: Existe un número limitado de componentes que son detectados en el cerebro en forma rutinaria in vivo con el espectro de protones. El pico más alto en el tejido cerebral normal corresponde a las moléculas de N-acetil aspartato, que se utiliza como marcador neuronal, ya que se encuentra presente exclusivamente en las neuronas. Este patrón característico nos permite comparar distintas funciones metabólicas a través de marcadores del metabolismo energético (Creatina), replicación celular (Colina), metabolismo anaerobio (Lactato), neurotransmisores (Mioinositol, Glutamato y Glutamina); además de macromoléculas tales como lípidos.
Conclusión: la capacidad para detectar, y cuantificar, un conjunto de metabolitos de un volumen cerebral determinado por Espectroscopia por Resonancia Magnética (E-RM); permite analizar las variaciones de los mismos en las alteraciones patológicas. La información es independiente de las posibles alteraciones estructurales; de esta manera la Espectroscopia por Resonancia Magnética (E-RM) aporta información complementaria a la imagen por resonancia magnética y constituye en ocasiones el único marcador de la patología, ya que es capaz de detectar alteraciones que cursan con un estudio estructural normal
Summary
Introduction: The Magnetic Resonance Spectroscopy (E-RM) performed by means of the hydrogen (H1) determination, is a noninvasive technique that allows “in vivo” determination of protons in the brain under normal and pathological conditions, allowing to obtain a metabolic brain spectrum.
Objective: To determine the utility of the neurospectroscopy defining metabolites in the normal brain spectrum of H1 and their relationship with creatine.
Review: There are a limited number of components been detected in the brain in routine form “in vivo” with the spectrum of protons. The highest pick in the normal brain tissue corresponds to N-acetyl aspartate molecules, which are used as neuronal marker, is exclusively present in the neurons. This characteristic pattern allows us to compare different metabolic functions using energy metabolism markers (Creatine), cell replication (Coline), anaerobic metabolism (Lactate), neurotransmitters (Myoinositol, Glutamate and Glutamine); besides such macromolecules as lipids.
Conclusion: The ability for detecting, and quantifying, a set of metabolites from a given brain volume by E-RM; allows to analyze changes of the same ones in pathological alterations. The information is independent of possible structural alterations; this way the E-RM offers complementary information to the magnetic resonance image and occasionally constitutes the only marker of the pathology, since it is able to detect alterations coursing with a normal structural study.
Introducción
Mientras que la resonancia magnética convencional (RM) obtiene información anatómica basada en la señal del agua, la espectroscopia por resonancia magnética (E-RM) realizada a través de la determinación del hidrógeno (H1), es una técnica no invasiva que permite determinar "in vivo" los protones que se encuentran en el cerebro en condiciones normales y patológicas permitiendo obtener un espectro metabólico del cerebro basado en que la diferencia en la composición química de sus metabolitos se refleja en una diferente frecuencia de resonancia, esto es lo que se conoce como quimical shift.1-2-3-4
La espectroscopia protónica, tiene ventajas importantes incluyendo el no requerir sustancias radioactivas (debido a la abundancia de los protones en forma 100% natural); puede efectuarse en la mayoría de los equipos de resonancia que se utilizan actualmente para la evaluación de pacientes, requiere un tiempo no mayor de 6 minutos para su realización y es altamente sensible debido al gran rango giromagnético de los protones naturales. 1-2
Desde el punto de vista bioquímico los átomos de hidrógeno del agua, proteínas o lípidos son los mismos. Sin embargo, las distintas moléculas de acuerdo a su configuración tridimensional generan por sí mismas micro campos magnéticos que se sobreponen al campo magnético generado por el resonador (Fig. 1).2
Existe un número limitado de componentes que son detectados en el cerebro en forma rutinaria in vivo con el espectro de protones. Un espectro (bandas separadas en orden según su respectiva longitud de onda) se registra con tiempo de eco prolongado (>50 milisegundos), el cual contiene señales de N-acetil aspartato (NAA), Creatina (Cr), y Colina (Co). El lactato (Lac) no se detecta en condiciones normales. Otro espectro con modo de adquisición de eco estimulado (STEAM), que se obtiene al utilizar tiempo de eco corto (<35 milisegundos), identifica fácilmente la significativa presencia del LAC; contiene señales de otros compuestos como el mioinositol (Mi), glutamato y glutamina (Glu) además de macromoléculas tales como lípidos. 2-5
La espectroscopia por resonancia magnética (E-RM) se efectúa mediante la realización de dos tipos de muestreo:
- Para un voxel único (pequeño volumen cúbico de un área cerebral de 8 cm).6
- Técnicas multi-voxel de imágenes de variación química (espectro de un corte total del cerebro, obteniendo análisis de varias regiones en forma simultánea). 6-7
- Chemical shift imaging: representa metabolitos en escala de colores sobrepuesta a imagen convencional referencial (Fig. 2).6
El tamaño del volumen de interés (VDI) debe ser normalizado para el tamaño descrito en las enfermedades globales. 2-8 El VDI se debe definir en una región determinada y elegida con respecto al diagnóstico sospechado (zona de isquemia, área con posible foco epileptogénico, etc). En la tabla 1 se presentan una lista de las posiciones recomendadas. 2
Tabla 1. Selección de Colocación de vóxel:
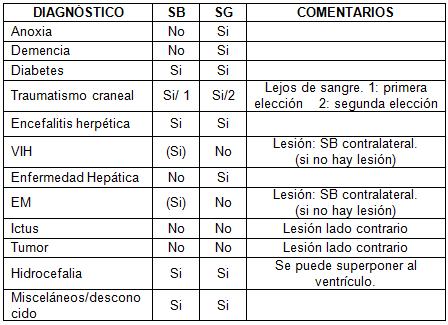
SB: Sustancia Blanca; SG: Sustancia Gris.
Interpretación
Un método apropiado para el diagnóstico en neuroespectroscopia consiste en definir cada metabolito en el espectro cerebral de H1 y determinar si se encuentra elevado o reducido con respecto a la creatina. 7 Para definir los índices normales se debe tener en cuenta la edad del paciente al igual que el análisis comparativo con el hemisferio contralateral debido a la variabilidad de los niveles de los metabolitos a estudiar. La altura de la espectroscopia por resonancia magnética (E-RM) se lee de derecha a izquierda, el pico agudo más alto de resonancia, dos partes por millón (ppm), se asigna al marcador neuronal (NAA); el siguiente grupo de picos pequeños corresponden a la glutamina y glutamato. La segunda resonancia más alta a 3 ppm es la Creatina (Cr) y junto a ésta existe otro pico prominente asignado a la colina (Co) la cual forma parte de la membrana celular. La relación Co/Cr es de 0.5 espectros. Otro pequeño pico es el mioinositol, cuya identificación es difícil debido a que tiene un espectro similar al de la glucosa. Un pico que aparece a 1.33 ppm es el del lactato, el cual no se detecta en condiciones normales en el cerebro humano debido a su baja concentración, no obstante, puede detectarse su señal en condiciones patológicas que causan incremento en su concentración tales como isquemia cerebral, hipoxia cerebral o incluso en lesiones quísticas (Fig. 3). 2-9-10
El espectro en el recién nacido tiene diferencias importantes: existe inversión en la altura de los picos del N-acetil aspartato (NAA), Co, Cr y mioinositol; el pico de Co es mayor que el de Cr (a manera inversa que en el adulto). 7-10
Metabolitos
N-acetil aspartato (NAA, pico 2.0ppm): es un marcador neuronal y sus concentraciones disminuyen en diferentes tipos de injurias cerebrales. La diferencia de concentración de N-acetil aspartato (NAA) entre la sustancia gris y la sustancia blanca no son clínicamente significativas. En 1984 Koler y col. demostraron que el N-acetil aspartato (NAA) existía en concentraciones más altas en la sustancia gris que en la blanca, además que el N-acetil aspartato (NAA) estaba presente solamente en el sistema nervioso central, mayormente en las neuronas, mas no en las células gliales. 2-11-12-13
Debido a su característica de encontrarse sólo en el sistema nervioso central, en espectroscopia el N-acetil aspartato (NAA) se utiliza como marcador de viabilidad neuronal Todo aquello que produzca una destrucción neuronal, sea tumor, esclerosis múltiple, infarto o enfermedad de Alzheimer entre otras causas, originará una disminución en este metabolito, lo cual se verá reflejado en la espectroscopia. 11
Colina (Co, pico 3.2 ppm): En el pico de la Co contribuyen la fosfocolina, glicerofosfocolina y fosfatidilcolina. La Co forma parte de la membrana celular, su incremento refleja el aumento en la síntesis de membranas o del número de células tal como se observa en tumores. 2-11
Creatina (Cr 3.03 ppm y 3.94 ppm): en el pico de Cr contribuyen la fosfocreatina y en menor grado la lisina y el glutatión; es un buen estándar para comparar con otros metabolitos y tiene un rol importante en el mantenimiento de los sistemas dependientes de energía en las neuronas, es utilizado como reserva de los fosfatos de alta energía y además actúa como buffer en los reservorios de ATP-ADP. La creatina es ingerida en la dieta, además es sintetizada en el hígado, riñones y páncreas. 2-11-12
La creatina fosfato sirve como reserva de fosfatos de alta energía en el citosol del músculo y neuronas. La creatinquinasa convierte a la creatina en creatina fosfato utilizando ATP. En el músculo en reposo la creatina fosfato es tres veces más alto que la creatina, aunque esta relación se invierte con el ejercicio intenso. Los tejidos como el músculo y el cerebro donde ocurren los mayores cambios metabólicos de energía poseen las más altas concentraciones de creatinquinasa. 12
Por ser la creatina el pico relativamente más estable en espectroscopia se usa como valor de control para los demás metabolitos como el N-acetil aspartato (NAA) y la colina. 2-11
Lactato (Lac, pico 1.32): los niveles cerebrales de Lac son muy bajos o se encuentran ausentes. Su presencia indica que el mecanismo oxidativo de respiración celular es inadecuado y que está siendo reemplazado por el catabolismo. El Lac lo podemos encontrar como un doble pico a 1.32 ppm en lesiones necróticas o quísticas. 2-11
Mioinositol (MI, pico 3.56 ppm): es un metabolito que actúa en la neurorrecepción hormona-sensitiva (dependiente de hormonas) y es precursor del ácido glucurónico. La disminución de MI se ha asociado con la acción protectora del litio en la manía y en casos de neuropatía diabética. La combinación de MI elevado con disminución de N-acetil aspartato (NAA) se ha observado en la Enfermedad de Alzheimer. 2
Glutamato (Glu, pico 2.1-2.5 ppm): neurotransmisor que actúa en el metabolismo de las mitocondrias. El N acetil aspartil glutamato (NAAG) está localizado junto al N-acetil aspartato (NAA) en las neuronas y puede ser dividido por una dipeptidasa en N-acetil aspartato (NAA) y glutamato. El NAAG y el glutamato son aminoácidos excitadores y en concentraciones fisiológicas el glutamato puede ser neurotóxico. Datos recientes sugieren que el NAAG puede ser la forma en que las neuronas almacenan el glutamato para proteger a la célula de la acción excitatoria y potencialmente neurotóxica de la misma. 2-11
Alanina (pico 1.3-1.4 ppm): función incierta. Se puede incrementar en ciertas lesiones del sistema nervioso central (SNC), observándose esta elevación en tumores intracraneales tales como los meningiomas. 2
Lípidos: Su pico se obtiene por la suma de grupos metilo, metileno y protones de vinilo de ácidos grasos insaturados. Es característico de los tumores de alto grado y puede reflejar necrosis tumoral. Los lípidos en el cerebro tienen tiempos de relajación muy cortos, no se observan con TE cortos. La resonancia de los lípidos puede ser el resultado de contaminación del vóxel por grasa subcutánea. 11
Conclusión
La capacidad para detectar, y cuantificar, un conjunto de metabolitos de un volumen cerebral determinado por espectroscopia por resonancia magnética (E-RM); permite analizar las variaciones de los mismos en las alteraciones patológicas. La información es independiente de las posibles alteraciones estructurales; de esta manera la espectroscopia por resonancia magnética (E-RM) aporta información complementaria a la imagen por resonancia magnética y constituye en ocasiones el único marcador de la patología, ya que es capaz de detectar alteraciones que cursan con un estudio estructural normal
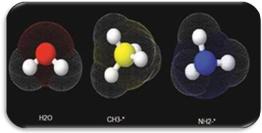
Fig. 1. Protones de Hidrógeno en distintas moléculas.
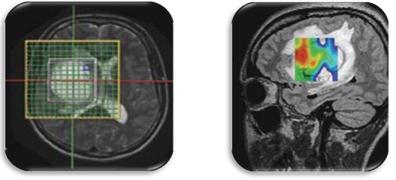
Fig. 2. Chemical Shift
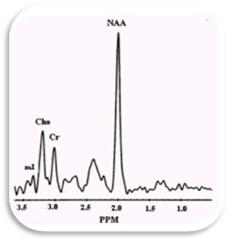
Fig. 3. Espectro normal cerebral
BIBLIOGRAFÍA
1. Onofre J, Martínez H, Arteaga M, Gómez A, Mauregui S. Espectroscopia por resonancia magnética en Enfermedades neurológicas. Rev Mex Neuroci 2002,3(4):213-217.
2. Onofre J, Martínez H, Arteaga M, Gómez A, Mauregui S. Espectroscopia por resonancia magnética en el cerebro humano. Principios básicos. Rev Mex Neuroci 2002,3(4):207-210.
3. Moriarty M, Belinda S, Li Y, Regal B, He J,Markowitz C, Grossman R, Gonen O. Espectroscopia por Resonancia Magnética de N-Acetilaspartato Cerebral Total Un Marcador Potencial para la Toma de Decisiones en la EM Recurrente-Remitente.
4. Matthews PM, Francis G, Antel J, Arnold DL. Proton magnetic resonance spectroscopy for metabolic characterization of plaques in multiple sclerosis. Neurology 1991;41:1251-1256.
5. Arístides A, et al. Temporal lobe epilepsy cualitative reading of HRM spectroscopy images for pre surgical evaluation. Radiology 2001;218:144-151.
6. Yuan Y, Min Chi Ch, et al. Reproducibility of hippocampal single voxel proton MR spectroscopy and Chemical shift imaging. Am J Radiol 2001;176:539-536.
7. Stark D, Bradley W. Neuroespectrocopia en Resonancia Magnética. Vol. III, Cáp. 72, Editorial Modby, pp. 1595-1635. USA, 2000.
8. Ernst T, Kreis R, Ross B. Absolute quantitation of water and metabolites in the human brain. I. Compartments and water. J Magn Reson 1993;102(1):1.
9. Myung K, Chang H, Systemic lupus erithematosus: brain MR imaging and single voxel hydrogen 1 MR spectroscopy. Radiology 2000:217:43-49.
10. Barker P. Magnetic resonance spectroscopy in cerebral ischemia and infarction. Seminars Cerebrovasc Dis Stroke 2001;1:331-342.
11. Martinot CP, Martinot CL. Rev. Per. Neurol. 2001:7(3).
12. Davie C, Hawkins C, Barker G. Serial proton magnetic resonance spectroscopy in acute multiple sclerosis lesions. Brain 1994;117:49-58.
13. Narayama PA, Wolinsky JS, Jackson EF, McCarthy M. Proton MR spectroscopy of gadolinium-enhanced multiple sclerosis plaques. JMRI 1992;2:263-270.