Los Traumatismos Cráneo Encefálicos (TCE) y el Daño Cerebral Traumático (DCT) asociado, constituyen uno de los problemas de salud más complejos a los que se enfrenta el Especialista de Medicina General Integral durante su práctica profesional. Se realizó una investigación descriptiva y prospectiva para caracterizar a los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC), diagnosticados en la Atención Primaria de Salud, en el Centro Médico de Diagnóstico Integral del Área de Salud Integral Comunitaria “La Gran Colombia”, de la Parroquia Santa Rosalía, Municipio Libertador, Caracas, entre los meses de Enero del 2007 y Enero del 2009.
Pacientes con Daño Cerebral Traumático Ligero y Síndrome Postconmocional en la Atención Primaria de Salud. Parroquia Santa Rosalía. Caracas. Enero de 2007 a enero de 2009.
MSc. Dr. Carlos Enrique Hernández Borroto. Especialista de I Grado en Medicina General Integral. Máster en Educación Médica. Máster en Urgencias Médicas. Profesor Instructor.
MSc. Dra. Clarivel Presno Labrador. Especialista de II Grado en Medicina General Integral. Máster en Educación Médica. Profesora Auxiliar.
Correspondencia: MSc. Dr. Carlos Enrique Hernández Borroto.
Entidad: Universidad Bolivariana de Venezuela. Ave. Leonardo da Vinci. Los Chaguaramos. Caracas
RESUMEN
Los Traumatismos Cráneo Encefálicos (TCE) y el Daño Cerebral Traumático (DCT) asociado, constituyen uno de los problemas de salud más complejos a los que se enfrenta el Especialista de Medicina General Integral durante su práctica profesional. Se realizó una investigación descriptiva y prospectiva para caracterizar a los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC), diagnosticados en la Atención Primaria de Salud, en el Centro Médico de Diagnóstico Integral del Área de Salud Integral Comunitaria “La Gran Colombia”, de la Parroquia Santa Rosalía, Municipio Libertador, Caracas, entre los meses de Enero del 2007 y Enero del 2009.
Se consideró como universo a la totalidad de pacientes con diagnóstico de Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (N= 67). Las conclusiones principales fueron: el sexo masculino fue el más frecuente en todos los grupos de edades y el grupo de 21 a 39 años el más afectado. La mayoría de ocupación trabajadores y acudieron entre 25 y 48 horas después del trauma. Los traumas ocurrieron entre viernes y domingo y en los meses de febrero, abril, junio a septiembre y diciembre. El principal mecanismo fue la aceleración/desaceleración durante accidentes de tránsito. La mayoría obtuvo 15 puntos en la Escala de Coma de Glasgow y se le realizó radiografía de cráneo a la totalidad de los pacientes. La cefalea fue el síntoma más frecuente y el latigazo cervical la lesión más asociada; a los 6 meses casi la totalidad tenían buena recuperación y una integración social adecuada según Cuestionario Rivermead ad hoc.
Palabras o frases clave: aceleración/desaceleración; Cuestionario “Rivermead”; daño cerebral traumático ligero; Escala de Coma de Glasgow; latigazo cervical; síndrome postconmocional.
INTRODUCCIÓN
Los Traumatismos Cráneo Encefálicos (TCE) y el Daño Cerebral Traumático (DCT) asociado, constituyen uno de los problemas de salud más complejos a los que se enfrenta el Especialista de Medicina General Integral durante su práctica profesional (1). A pesar de esto, la mayoría de ellos están familiarizados de alguna manera, con el manejo de sus formas más severas o graves, y sin embargo es su variante leve, el Daño Cerebral Traumático Ligero (DCTL), la más frecuente y la que provoca mayores dificultades diagnósticas y terapéuticas (2).
El Daño Cerebral Traumático (DCT) es un problema de salud pública significativo en los Estados Unidos de América. En este país más de 1.4 millones de personas sufren alguna de sus formas cada año, con un costo total estimado para el sistema de salud de más de 60 billones de dólares anuales (3,4).
Los antecedentes históricos sobre los traumas craneales y sus manifestaciones, han llegado hasta la actualidad de manera indirecta a través de restos fosilizados, momias, cráneos trepanados e instrumentos quirúrgicos rudimentarios utilizados para esos fines (5).
La primera referencia escrita está contenida en el Papiro de Edwin Smith. El mismo data de 1700 años antes de Cristo, y describe la conducta médico quirúrgica ante 48 casos, 27 de los cuales corresponden a traumatismos craneanos (6).
Desde fines del siglo XVIII se conoce que cirujanos aborígenes o chamanes indígenas practicaban operaciones craneanas. Esta afirmación se debe a Paul Broca, quien estudió un cráneo procedente del Perú, en el cual claramente se observan los surcos dejados por instrumentos quirúrgicos para levantar un colgajo óseo cuadrangular (7).
Las indicaciones de las operaciones en muchos casos eran traumatismos contundentes ocasionados por macanas que generalmente golpeaban el lado izquierdo de la cabeza. Estos combates casi siempre eran el resultado de batallas entre tribus enemigas. Es posible que en otros casos, las trepanaciones hayan sido indicadas por otras razones: cefalea intensa y prolongada, epilepsia y tal vez algunos trastornos mentales (5).
Los cráneos trepanados más antiguos que se conocen son del período Mesolítico y fueron hallados por Gorman en Ucrania (8). Las excavaciones de Vasilyevica II tienen una antigüedad de 8020 a 7620 años. En el período Neolítico, el cráneo de Ensin, en Alsacia, tiene dos defectos parcialmente cicatrizados y tienen una cronografía de 5100 ± 155 años (5).
En el siglo I de nuestra era, el romano Celso describió las trepanaciones y los instrumentos usados desde la época de Hipócrates, incluyendo las telebrás y las trefinas, muy semejantes a las que conocemos actualmente (9).
En Venezuela la primera cirugía craneal por diversas causas se halla en un cráneo trepanado por aborígenes precolombinos, que presenta una perforación a nivel del hueso frontal, sobre la glabela, y regeneración del tejido óseo. El mismo fue colectado por José María Cruxent en el año 1946, en la localidad de la isla del Burro, Lago de Valencia, Estado Carabobo, que estaba habitada antes de la llegada de los españoles por los Caquetios, una tribu del grupo lingüístico Arawaco (5).
Varias publicaciones sobre traumatismos craneoencefálicos aparecieron a finales del siglo XIX y principios del XX, en la Gaceta Médica de Caracas. Pablo Acosta Ortiz publicó en 1893 un caso de herida cefálica por arma de fuego (10), y Luis Razetti, promotor del renacimiento de la medicina venezolana, profesor de cirugía, fundador de la Academia Nacional de Medicina de Venezuela y su Secretario Perpetuo, fue autor de varias publicaciones sobre Traumatismos Cráneo Encefálicos (TCE) (11,12).
Actualmente, entre las principales causas de los Traumatismos Cráneo Encefálicos (TCE), se encuentran los accidentes de tránsito. Para el año 2002 las primeras causas de muerte en Venezuela fueron: las cardiovasculares, el cáncer y los accidentes viales (13). Según estadísticas revisadas, el 53% de los lesionados fallece en el lugar del accidente, el 40% sufre discapacidad temporal o permanente, y el 80% de los que han sufrido un Traumatismo Cráneo Encefálico (TCE) experimentan convulsiones entre 1 y 5 años después del evento (13). Para este mismo año los estados con mayor índice de lesionados fueron: Táchira, Lara, Zulia, Anzoátegui, Mérida y Carabobo (13).
El Daño Cerebral Traumático Ligero (DCTL) representa entre el 70 y 90% de todos los Traumatismos Cráneo Encefálicos (TCE) tratados. Es diagnosticado más comúnmente en adolescentes y adultos jóvenes, y típicamente causado por caídas y accidentes automovilísticos. La incidencia estimada en estudios poblacionales es de aproximadamente 600 casos por cada 100 000 habitantes (14,15).
El Congreso Americano de Rehabilitación en 1993 propuso una definición del Daño Cerebral Traumático Ligero (DCTL) que pudiera ser utilizada por los médicos, de manera más práctica, particularmente cuando no estuviera disponible la puntuación de la ECG, o cuando esta fuera inválida (16). Esta definición establece que cualquiera de los siguientes síntomas, si aparecen después de la aplicación de las fuerzas antes mencionadas, sobre el encéfalo, reflejan un daño de severidad suficiente como para merecer la clasificación de Daño Cerebral Traumático Ligero (DCTL):
· Cualquier periodo de pérdida de la conciencia.
· Cualquier pérdida de la memoria de los sucesos ocurridos antes (amnesia retrógrada) o después (amnesia anterógrada) del evento traumático (este periodo en su totalidad es a veces designado como amnesia post traumática, APT).
· Cualquier alteración del estado de conciencia al momento del evento (sensación de mareo, desorientación o confusión).
· Defectos neurológicos focales que pueden o no ser transitorios.
Esta definición incluye solamente a los pacientes con pérdida de la conciencia inferior a los 30 minutos, valores de la ECG 30 minutos después del trauma entre 13 y 15, y una APT con una duración menor de 24 horas.
Un estudio realizado en el Hospital Universitario "Dr. Alfredo Van Grieken", en Coro, Estado Falcón, tuvo entre sus conclusiones que el Daño Cerebral Traumático Ligero (DCTL) es el más frecuente, observándose en el 88,1% de los pacientes estudiados con Traumatismos Cráneo Encefálicos (TCE) (17).
Otras publicaciones relacionadas se han realizado en el Estado Mérida (18), presentaciones de casos en el Hospital J.M. de los Ríos en Caracas (19), aplicación del proceso de atención de enfermería a estos pacientes en el Hospital Universitario del Seguro Social “Dr. Ángel Larralde” en los Teques, Estado Miranda (20) y sobre Traumatismos Cráneo Encefálicos (TCE) en niños, en el Hospital “Pérez de León” en Caracas (21).
En ninguna de las publicaciones anteriores se hace una caracterización clínica o epidemiológica de los pacientes estudiados.
El Daño Cerebral Traumático Ligero (DCTL) o conmoción cerebral, es una causa común de ingreso en los centros de atención al trauma (22) y es generalmente causado por fuerzas de aceleración/desaceleración aplicadas sobre la cabeza que producen un periodo de inconsciencia de 20 minutos o menos y/o amnesia retrógrada breve, un valor en la Escala de Coma de Glasgow (ECG) entre 13 y 15, ausencia de déficit neurológico focal y de complicaciones intracraneales, así como hallazgos normales en la Tomografía Axial Computarizada (TAC).
A pesar de que la mayoría de los pacientes con Daño Cerebral Traumático Ligero (DCTL) se recuperan antes de los 3 meses post trauma, algunos experimentan dificultades de más largo plazo que afectan su habilidad para desempeñar sus roles sociales y responsabilidades (23-31).
Los pacientes con Daño Cerebral Traumático Ligero (DCTL) son casi siempre tratados en consultas de emergencia, y más del 80% son enviados a sus casas el mismo día, sin ser ingresados en las unidades de salud (3). Un diagnóstico certero es el primer paso para lograr un abordaje integral en cada paciente, sin embargo esto no se logra en muchos casos debido a variaciones en los criterios usados (23,32-35) y en la terminología diagnóstica (conmoción, daño craneal leve o menor, daño cerebral leve o menor, trauma craneal leve o menor, etc.) (32,36-38).
El Daño Cerebral Traumático Ligero (DCTL) induce la aparición de un grupo de síntomas como: cefalea, visión borrosa, pobre concentración, trastornos del sueño, depresión e irritabilidad, los cuales en su conjunto son conocidos actualmente como Síndrome Postconmocional (SPC), condición transitoria cuya evolución favorable refleja la completa recuperación de la función neurológica alterada (28,29,39).
La existencia de este síndrome ha sido reconocida desde hace varios siglos, aunque uno de los primeros trabajos que hizo referencia específica a este problema fue la obra de Erichsen (1886) titulada On concussion of the spine, nervous shock, and other obscure injuries to the nervous system (40).
Los antecedentes del mismo también se encuentran en la Primera Guerra Mundial, donde los soldados británicos se encontraban expuestos a múltiples traumas cefálicos, particularmente antes de la introducción del casco de acero en 1916 (41), sufriendo el llamado “shell-shock”. En ese mismo año Pierre Marie había denominado como “síndrome subjetivo postconmocional” al conjunto de secuelas tardías de los Traumatismos Cráneo Encefálicos (TCE), cuya sintomatología venía definida fundamentalmente por cefaleas, tristeza, estado vertiginoso y carácter irritable (citado por Amat [42]).
En 1915 se pensaba que éste “shell-shock” consistía en una lesión neurológica (forma de conmoción cerebral), resultado de poderosas fuerzas compresivas (43,44). Sin embargo algunos médicos, como Myers CS (45) y Salmon TW (46) expresaron que los síntomas parecían tener un origen psicológico más que orgánico, proponiendo el término “neurosis traumática”.
Cada vez era mayor el número de soldados que habían estado cerca de una detonación, sin recibir trauma craneal directo, y que sufrían de amnesia, pobre concentración, cefalea, tinnitus, hipersensibilidad al ruido, mareos y temblor (47).
Ante la subjetividad de estos síntomas, muchos de los cuales se prestaban para la simulación, y teniendo en cuenta que el gobierno británico para fines de 1918 había entregado más de 32 mil pensiones a soldados con el diagnóstico de “shell-shock”, se prohibió toda información a los medios y a la comunidad científica sobre esta enfermedad, temiendo consecuencias mayores. Por ejemplo, en noviembre de 1917 se le prohibió a Myers CS enviar un artículo sobre este tema a la revista British Medical Journal (48).
Para evitar otra “epidemia” de “shell-shock” durante la Segunda Guerra Mundial, las autoridades británicas prohibieron el uso de este término (49). A pesar de esta precaución, y como es lógico, los soldados siguieron exponiéndose a eventos traumáticos y desarrollando síntomas comunes a este trastorno (41).
En 1939 Schaller creó el término “estado conmocional post trauma”, describiéndolo como “un trastorno de la conciencia sin cambios patológicos o inmediatos en el cerebro” (50). A pesar de que propuso en su artículo un grupo de síntomas y características conductuales para diferenciar este trastorno del “estado psiconeurótico post traumático”, Schaller no pudo encontrar ninguno patognomónico, de hecho los dos trastornos comparten un grupo importante de síntomas, entre ellos la cefalea y los mareos (41,50).
En 1941 el término “Síndrome Postconmocional” ya había sido aceptado con las características clínicas que se reconocen actualmente (41). Watson y colaboradores consideran que fueron Strauss y Savitsky en 1934 los primeros en llamar a dicho conjunto de síntomas como “síndrome o trastorno postconmocional” (51).
El concepto de Síndrome Postconmocional (SPC) ha ganado significación a la luz de datos recientes que muestran que la incidencia del Daño Cerebral Traumático Ligero (DCTL) es mucho mayor de lo que se pensaba (52). En el año 2003 el Centro para el Control de las Enfermedades (CDC) de Atlanta, reportó que el Daño Cerebral Traumático Ligero (DCTL) aporta aproximadamente 500 mil visitas a los departamentos de emergencia sin hospitalizaciones, y 200 mil hospitalizaciones, cada año, en los Estados Unidos de América (23).
Los criterios diagnósticos del Síndrome Postconmocional (SPC) se propusieron por primera vez en 1992, en la 10ma revisión de la Clasificación Internacional de las Enfermedades (CIE-10) (53,54), que incluye aspectos clínicos y de investigación.
Durante la preparación de la 4ta edición del Manual Diagnóstico y Estadístico de los Desórdenes Mentales (DSM-IV), también se propuso el Diagnóstico del Síndrome Postconmocional (SPC) (55). Estos criterios fueron publicados de forma modificada en un apéndice del DSM-IV (56) como siguen:
1. Historia de un daño cerebral traumático causante de una “conmoción cerebral significativa”.
2. Déficit cognitivo de la atención y/o de la memoria.
3. Presencia de por lo menos 3 de los siguientes 8 síntomas (por más de tres meses):
A. Fatiga.
B. Trastornos del sueño.
C. Cefalea.
D. Mareos.
E. Irritabilidad.
F. Trastornos afectivos.
G. Cambios de personalidad.
H. Apatía.
4. Los síntomas comienzan o empeoran después del trauma.
5. Los síntomas interfieren con la vida social del individuo.
6. Exclusión del diagnóstico de demencia por trauma, u otros desórdenes que puedan explicar los síntomas.
A pesar de las estadísticas mencionadas y de la publicación y generalización de los criterios diagnósticos del Síndrome Postconmocional (SPC), se han constatado pocos estudios prospectivos que profundicen en los aspectos clínicos y epidemiológicos de este trastorno. De hecho el primero de estos fue realizado en el Hospital General “Ben Taub” de Houston, Texas y publicado el año 2005 por Boake C y colaboradores (52).
Se pretende con los resultados de esta investigación descriptiva, contribuir al conocimiento de estas entidades, y promover la producción de nuevas hipótesis que generen estudios analíticos en Venezuela y otras regiones del continente.
PROBLEMA CIENTÍFICO:
Después de algunos meses atendiendo pacientes en la consulta de emergencias del Centro Médico de Diagnóstico Integral del Área de Salud Integral Comunitaria “La Gran Colombia”, de la Parroquia Santa Rosalía en Caracas, con síntomas postconmocionales después de diferentes eventos traumáticos, no se disponen de datos científicamente obtenidos que caractericen clínica y epidemiológicamente a los pacientes con daño cerebral traumático ligero y el síndrome postconmocional resultante del primero, en el área geográfica antes mencionada.
Se propuso investigar este tema teniendo en cuenta como principales elementos su pertinencia al no ser ampliamente investigado en el país, la ciudad, y no existir estudios previos en la parroquia mencionada. Igualmente, teniendo en cuenta la importancia de este problema de salud (por su frecuencia, gravedad, interés social, económico, etc.). Se han tenido en cuenta los beneficios que pueden derivarse del estudio en cuanto a sus aplicaciones prácticas y a su valor teórico.
Se considera que el problema científico y el diseño del estudio se ajustan a los principios éticos de la investigación y que los resultados obtenidos compensan los recursos utilizados.
El otro elemento que se ha tenido en cuenta para valorar la justificación de este trabajo es su viabilidad. Las variables fueron factibles de medir, el tiempo para la obtención de los resultados fue el apropiado, hubo disponibilidad de sujetos (tanto en número como en el tiempo necesario para su inclusión). Fue posible la colaboración con otros profesionales, servicios o centros de salud, así como disponer de sus instalaciones y equipamiento.
No fue necesario el uso de grandes recursos financieros.
La experiencia del equipo investigador y el interés de los mismos fueron decisivos para la culminación de la investigación.
Se tuvieron en cuenta en todo momento las consideraciones éticas.
MARCO TEÓRICO:
Serán abordados los aspectos fisiopatológicos y de diagnóstico actuales del Daño Cerebral Traumático Ligero (DCTL) y del Síndrome Postconmocional (SPC). Los elementos clínicos se profundizarán en el acápite de análisis y discusión de los resultados.
BASES FISIOPATOLÓGICAS ACTUALES:
El daño cerebral traumático (DCT) aún representa la primera causa de morbilidad y mortalidad en los menores de 45 años, en todo el mundo. El Daño Cerebral Traumático (DCT) es de distribución universal, y se puede manifestar con entidades clasificadas como leves (conmoción cerebral) hasta con daños devastadores, como los típicos de los accidentes automovilísticos (57).
Esta entidad es el resultado de la aplicación tanto de fuerzas físicas externas como de fuerzas rápidas de aceleración/desaceleración, que producen un trastorno de las funciones cerebrales que se manifiestan a través de dificultades físicas y/o cognitivas. Es importante destacar que en el Daño Cerebral Traumático Ligero (DCTL) es la aplicación de dichas fuerzas al encéfalo, más que a la cabeza per se, las que producen el daño (2). Dicho por el autor en otras palabras: no todos los traumas en la cabeza producen daños encefálicos, y algunos daños encefálicos (particularmente aquellos que resultan de la aplicación de fuerzas de aceleración/desaceleración), pueden ocurrir sin aparentes traumas en la cabeza.
Algunos aspectos biomecánicos:
En el Daño Cerebral Traumático Ligero (DCTL) se cree que la rápida deformación del tejido cerebral ocasiona una despolarización difusa mecánicamente inducida de las neuronas corticales (58). Los detalles de esta deformación son aún poco conocidos, a pesar de que este es un tema que tiene intenso interés para los investigadores y ha sido objeto de numerosos estudios por décadas (59).
En los impactos occipitales el daño por contragolpe es visto casi siempre en la región frontal (60,61). Se han propuesto varias hipótesis biomecánicas para explicar el contragolpe, entre ellas: las vibraciones del cráneo, ondas de presión, cavitaciones, rotación encefálica y “deformación segmentada” del tejido cerebral (58,60).
Ninguna explicación ha podido ser confirmada por estudios directos debido a dificultades prácticas para medir esta “deformación” en cerebros de sujetos humanos. Helbourn en 1943 observó en un modelo de cráneo humano, que la aceleración angular era suficiente para causar una deformación segmentada del gel en su interior (62). En 1946 Pudenz y Shelden reemplazaron la mitad superior del cráneo de monos con plástico transparente, y filmaron la parte superior del cerebro moviéndose y distorsionándose durante traumas craneales (60). Ellos postularon que la rotación encefálica era el factor dominante de los daños por contragolpe.
Estudios ultra estructurales indican ampliamente que el Daño Cerebral Traumático Ligero (DCTL) puede dañar la estructura de los microfilamentos neuronales y causar daño axonal traumático (63,64). Estos hallazgos apoyan la idea de que el Daño Cerebral Traumático Ligero (DCTL) puede introducir un daño estructural primario en reacción a la no adecuada alineación axonal, así como a su desconexión y edema, producidos por las fuerzas físicas que actuaron sobre el tejido nervioso (64-66).
Los modelos experimentales han demostrado que el Daño Cerebral Traumático Ligero (DCTL) es capaz de producir daño axonal difuso, tanto por la aplicación de las ya mencionadas fuerzas biomecánicas como por procesos citotóxicos que incluyen (67-72):
· Trastornos en la regulación del Calcio y el Magnesio.
· Formación de Radicales Libres.
· Excitotoxicidad por neurotransmisores.
· Respuesta inflamatoria.
· Disrupción de la homeostasia vascular.
Después de una amplia revisión de la literatura relacionada, el autor sistematiza los mecanismos fisiopatológicos implicados en el Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC), dividiéndolos en generales, específicos y otros mecanismos.
Mecanismos generales:
Un primer estadio después del trauma, puede caracterizarse por daño tisular directo y por trastornos en la regulación del flujo sanguíneo cerebral (FSC) y del metabolismo. Estos patrones “parecidos a los isquémicos”, conducen a la acumulación de ácido láctico (debido a la glucolisis anaerobia) y aumento en la permeabilidad de las membranas con la formación consecutiva de edema (57).
Al ser este metabolismo anaerobio insuficiente para mantener los requerimientos energéticos de las células, el ATP almacenado se consume totalmente y ocurre un fallo de las bombas iónicas dependientes de energía, que se encuentran embebidas en las membranas celulares.
El segundo estadio de esta cascada fisiopatológica exhibe una despolarización terminal de las membranas que conlleva a una liberación excesiva de neurotransmisores excitatorios (como glutamato y aspartato), activación de sus receptores N-Metil-D-Aspartato (NMDA), del α-amino-3-hidroxi-5-metil-4-isoxazolpropionato (AMPA), y los canales de Sodio y Calcio, voltaje dependientes (57).
Las alteraciones en la producción y/o liberación de neurotransmisores ocurren de manera tanto aguda como crónica después del evento traumático, y en parte pueden ser los responsables de los trastornos cognitivos agudos y crónicos que se ven en estos pacientes (67, 73,74).
La consecuente entrada de Calcio y Sodio conduce a la autodigestión catabólica de los procesos intracelulares. El calcio activa las peroxidasas, lipasas y fosfolipasas, lipídicas, que aumentan la concentración intracelular de ácidos grasos libres y de radicales libres. Adicionalmente la activación de las caspasas, translocasas y endonucleasas inician cambios estructurales progresivos en las membranas biológicas y en el ADN nucleosomal (fragmentación del ADN e inhibición de su reparación) (57)
Estos procesos, unidos, conducen a la degradación de las membranas de las estructuras vasculares y celulares, y por último a la necrosis y muerte celular programada (apoptosis).
Estudios realizados en animales de experimentación han demostrado que el Daño Cerebral Traumático Ligero (DCTL) puede resultar en una profunda muerte neuronal apoptótica, en el córtex y en el tálamo anterior, así como un daño axonal severo en los tractos subcorticales de la substancia blanca, siendo las zonas más vulnerables la corteza cingulada, el cuerpo calloso y la cápsula externa (75).
Mecanismos específicos:
· Flujo sanguíneo cerebral
o Hipoperfusión e hiperperfusión.
o Autorregulación cerebrovascular y reactividad del CO2.
o Vasoespasmo cerebral.
· Disfunción metabólica cerebral.
· Oxigenación cerebral.
· Excitotoxicidad y estrés oxidativo.
· Edema.
· Inflamación.
· Necrosis vs. Apoptosis.
Flujo sanguíneo cerebral. Hipoperfusión e hiperperfusión. Autorregulación cerebrovascular y reactividad del CO2. Vasoespasmo cerebral: mientras que la isquemia cerebral conduce fundamentalmente al stress metabólico y disturbios iónicos, el trauma craneal adicionalmente expone el tejido cerebral a fuerzas de fragmentación con el consecutivo daño estructural de algunas neuronas, astrocitos, microglia, daño microvascular y de las células del endotelio vascular (76-78).
Los mecanismos por los cuales la isquemia post traumática ocurre incluyen: daño morfológico (por ejemplo, distorsión de los vasos), como resultado de los desplazamientos mecánicos; hipotensión ante la presencia de un fallo de la autorregulación (78,79); inadecuada disponibilidad de óxido nítrico y neurotransmisores colinérgicos (77,80); y potenciación de la vasoconstricción inducida por prostaglandinas (81).
El valor crítico de Flujo Sanguíneo Cerebral (FSC) para el desarrollo de un daño irreversible en un Daño Cerebral Traumático (DCT), es de 15 mililitros por cada 100 gramos de tejido cerebral por minuto (82).
Por el contrario, algunos pacientes con Daño Cerebral Traumático (DCT) pueden desarrollar una hiperperfusión cerebral (definida como un Flujo Sanguíneo Cerebral mayor de 55 mililitros por cada 100 gramos de tejido cerebral por minuto) en los primeros estadios del daño. De esa misma forma, la hiperemia puede seguir inmediatamente a la isquemia post traumática (83-86). Este evento patológico es crítico en términos evolutivos, ya que este aumento del Flujo Sanguíneo Cerebral, no en correspondencia con la demanda metabólica, conlleva a la vasoparálisis, con el consecutivo aumento del volumen vascular cerebral y de la Presión Intracraneal (PIC) (87).
Es importante señalar que el diagnóstico de hipo o hiperperfusión es sólo válido después que se ha medido el Flujo Sanguíneo Cerebral en relación al consumo cerebral de oxígeno.
Los trastornos de la autorregulación cerebrovascular y de la reactividad de la vasculatura a los cambios de las presiones de CO2 y O2, así como el vasoespasmo cerebral post traumático, son de incidencia fisiopatológica mayor en los traumas de intensidad moderada a severa (57).
Disfunción metabólica cerebral: la reducción del metabolismo cerebral post traumática relacionada con el insulto primario produce a su vez disfunción mitocondrial, fundamentalmente de la respiración celular y producción de ATP, una reducción de la disponibilidad del pool de coenzimas nicotínico, y una sobrecarga en la concentración de calcio intramitocondrial (88,89). Ya se han explicado previamente las consecuencias de este fallo de la respiración celular.
Excitotoxicidad y estrés oxidativo: el Daño Cerebral Traumático (DCT) está asociado, primaria y secundariamente, a la liberación masiva de neurotransmisores aminoácidos excitatorios, particularmente glutamato (90,91). Este exceso en la disponibilidad extracelular de glutamato afecta a las neuronas y astrocitos, resultando en una sobreestimulación de los receptores ionotrópicos y metabotrópicos del glutamato, con los consecutivos cambios en los flujos de Calcio, Sodio y Potasio (92,93). A pesar de que, como se ha referido anteriormente, estos eventos desencadenan los procesos catabólicos, incluyendo en algunos casos la rotura de la barrera hematoencefálica, las células tratan de compensar los gradientes iónicos aumentando la actividad de la bomba de Sodio y Potasio ATP-dependiente, y por consiguiente la demanda metabólica, creando un círculo vicioso flujo-metabolismo que autodestruye la célula (77,94).
El estrés oxidativo está relacionado con la generación de especies reactivas del oxígeno (radicales libres del oxígeno y entidades relacionadas que incluyen a los superóxidos, peróxido de hidrógeno, óxido nítrico y peroxinitrito) en respuesta al Daño Cerebral Traumático (DCT). La producción excesiva de estas especies reactivas del oxígeno, debida a la excitotoxicidad y al agotamiento del sistema antioxidante endógeno (superóxido dismutasa, glutatión peroxidasa y catalasa), induce la peroxidación de las estructuras celulares y vasculares, la oxidación de las proteínas, fragmentación del ADN e inhibición de la cadena transportadora de electrones mitocondrial (95-97).
A pesar de que estos mecanismos son adecuados para contribuir a una muerte celular inmediata, los procesos inflamatorios y los programas de apoptosis temprana o tardía, son inducidos por el estrés oxidativo (96).
El edema y la inflamación, a pesar de que comparten en común muchos de los mecanismos fisiopatológicos hasta aquí explicados, son de presentación más común en traumas de intensidad mayor y por tanto escapan a los objetivos de este estudio.
Solo se mencionará que estudios realizados en modelos animales han demostrado cambios estructurales y funcionales que aumentan la reactividad de los neurofilamentos en los primeros 30 minutos después del Daño Cerebral Traumático Ligero (DCTL) (M6), con la subsecuente alteración del transporte axoplásmico anterógrado, edema del cilindro axonal y desconexión entre axón y su efector o membrana diana (69). Povlishock y Becker demostraron que el Daño Cerebral Traumático Ligero (DCTL) puede hacer manifiesto un edema axonal que permanece sin cambios, degenera o provoca una respuesta regenerativa, sugiriendo variabilidad en los diferentes grados pronósticos de la evolución del Daño Cerebral Traumático Ligero (DCTL) (98).
Los primeros indicios del Daño Axonal Difuso (DAD), en el Daño Cerebral Traumático Ligero (DCTL), consisten primariamente en una desalineación de la red citoesquelética (71,99), como se ha observado microscópicamente. Las autopsias realizadas a pacientes con Daño Cerebral Traumático Ligero (DCTL) (fallecidos de causas no relacionadas) han mostrado que el cuerpo calloso es el sitio de más frecuente presentación del DAD (100), seguido del tronco encefálico y la substancia blanca lobar (101).
Necrosis vs. Apoptosis: en contraste con la necrosis (que ocurre en respuesta a daños tisulares por mecanismos mecánicos o hipóxico-isquémicos severos, con aumento excesivo en la liberación de aminoácidos excitatorios y fallo metabólico), las neuronas que desarrollan apoptosis se encuentran morfológicamente intactas en el periodo post traumático inmediato con una producción adecuada de ATP que garantizan un potencial de membrana fisiológico (57). Sin embargo, la apoptosis se hace evidente horas o días después del insulto primario. La translocación de la fosfatidilserina inicia de manera discreta, pero progresiva, la desintegración de la membrana celular, de las membranas nucleares, condensación de la cromatina y fragmentación del ADN.
El desarrollo de la apoptosis requiere generalmente suplemento energético y un desbalance entre las proteínas pro y anti-apoptóticas. La activación y desactivación consecutiva de las caspasas (las cuales representan proteasas específicas de la familia de las enzimas convertidoras de interleucinas) se han identificado como las principales mediadoras de la muerte celular programada (102,103).
Otros mecanismos fisiopatológicos:
· Factores neurogenéticos.
· Papel de las células cerebelares, particularmente las de Purkinje.
· Efectos neuroendocrinos.
Factores neurogenéticos: adicionalmente factores neurogenéticos pueden tener influencia en la extensión del daño neuronal producido por el Daño Cerebral Traumático Ligero (DCTL).
Se ha argumentado que la evolución de los pacientes después de un Daño Cerebral Traumático (DCT) está influenciada por el polimorfismo del gen de la Apolipoproteína E (APOE), localizado en el cromosoma 19 (104). De sus tres alelos comunes (ɛ2, ɛ3, ɛ4), el APOE-ɛ4 ha sido el único asociado con una pobre recuperación cognitiva (105,106) y funcional (107-109).
Estudios recientes sugieren que el status del alelo que codifica para la APOE-ɛ4 puede aumentar el riesgo para una pobre evolución después del trauma, particularmente en los casos severos y en los Daños Cerebrales Traumáticos Ligeros (DCTL) repetidos (105, 106,108,109,110,111). Aunque esta relación aún no está establecida completamente, Arciniega y colaboradores han observado en su laboratorio este hallazgo asociado a personas que mantienen anormalidades cognitivas y electrofisiológicas después de un Daño Cerebral Traumático Ligero (DCTL) (2,112,113).
Papel de las células cerebelares, particularmente las de Purkinje: la mayoría de los trabajos experimentales sobre neurotrauma se centran en la respuesta de las neuronas hipocampales y corticales frente a los eventos traumáticos, obviando las estructuras del cerebelo cuando distribuyen anatómicamente los daños (114).
Bell y colaboradores demostraron que el Daño Cerebral Traumático Ligero (DCTL) induce una reducción de la concentración sináptica de la subunidad GluR2 del receptor AMPA en las células de Purkinje. El receptor AMPA tiene 4 subunidades (GluR1-4) y cuando predomina en él la unidad GluR2 es impermeable al calcio, por tanto su reducción (tan temprana como 15 minutos post trauma), aumenta drásticamente la permeabilidad al calcio (desencadenando los mecanismos antedichos) y hace más susceptibles a estas células al daño excitotóxico secundario (114).
Park y colaboradores han demostrado la marcada vulnerabilidad de las células de Purkinje tanto a los traumas ligeros como graves en modelos in vitro de traumas del cerebro anterior. En su estudio, las regiones posteriores del vermis cerebelar, el giro de la fisura horizontal y los giros de los lóbulos II y IV son las que muestran una muerte neuronal demorada más significativa después de un trauma cortical (115).
El daño cerebelar no debe ser subestimado en el trauma, debido a que esta área del sistema nervioso juega un papel crucial en la coordinación motora (116-118) y, como se ha evidenciado recientemente, en las funciones nerviosas superiores (116,119-122).
Efectos neuroendocrinos: la disfunción neuroendocrina post traumática puede aparecer como resultado del daño mecánico directo, procesos excitotóxicos, o ambos, a los componentes del eje hipotálamo-hipófisis-órganos diana (123,124). Las fuerzas de aceleración/desaceleración pueden interrumpir o dividir las proyecciones de sustancia blanca entre estas estructuras, sobre todo cuando estas fuerzas afectan las estructuras situadas medial y profundamente, incluyendo la parte medial de los lóbulos temporales (complejo entorrinal-hipocámpico, la amígdala, etc.), el diencéfalo y tronco encefálico (125-128).
ELEMENTOS DE DIAGNÓSTICO ACTUAL:
Uso de la determinación de los valores de la proteína S-100B:
La familia de las proteínas S-100 fue descrita por BW Moore en 1965 (129), y abarca por los menos 25 proteínas multifuncionales ubicadas en diversos tejidos. A través de la interacción con diferentes proteínas efectoras participan en la regulación de varios procesos celulares: contracción, motilidad, crecimiento celular y diferenciación, progresión del ciclo celular, transcripción, organización estructural de las membranas, dinámica de los constituyentes del citoesqueleto, protección ante el daño oxidativo, secreción y fosforilación de las proteínas (130).
La proteína S-100B (hemodímero de la subunidad β) tiene un peso molecular de 21 kD y está codificada en el brazo largo del cromosoma 21. Su vida media biológica es de aproximadamente 30 minutos, por tanto su elevación persistente implica que se libera continuamente en el tejido afectado (131). Es eliminada principalmente a través del riñón.
En el sistema nervioso es producida primariamente por los astrocitos y su secreción es un proceso precoz durante la respuesta glial a los insultos metabólicos (132).
El Daño Cerebral Traumático (DCT) produce un aumento en los niveles de S-100B en sangre y líquido cefalorraquídeo (LCR). Después de un Daño Cerebral Traumático Ligero (DCTL) sus concentraciones aumentan entre el 31 y el 48% de los pacientes, sin asociación significativa con los síntomas y signos de los trastornos cognitivos (133). Biberthaler P y colaboradores consideran que su medición debe ser añadida a la evaluación inicial de todo Daño Cerebral Traumático Ligero (DCTL), ayudando a evitar hasta el 30% de Tomografías Axiales Computarizadas (TAC) no necesarias (134). Sin embargo, Muller K y colaboradores opinan que la determinación de S-100B no puede reemplazar al examen físico y a la TAC en el abordaje de los pacientes con Daño Cerebral Traumático Ligero (DCTL) (135). Criterios similares han sido publicados por otros autores (136).
Debe tenerse especial cuidado cuando se interpretan los aumentos de S-100B como marcador clínico del daño cerebral, ya que fuentes extracerebrales (particularmente los adipocitos y condrocitos), contribuyen a sus niveles séricos (137).
Los métodos analíticos como: IRMA (immunoradiometric assay), ELISA (enzime linked immunosorbent assay), espectroscopía de masa, Western Blot, electroquemiluminiscencia y PCR (polimerase chain reaction) cuantitativo, pueden detectar cambios en la expresión inmunohistoquímica o en las concentraciones séricas de S-100B, con alta sensibilidad, brindando una importante herramienta, según algunos investigadores, en el diagnóstico clínico (131,138). Ruan S y colaboradores consideran que su determinación tiene posibilidades limitadas para reducir las indicaciones de TAC y los costos hospitalarios (139).
Técnicas de neuroimagen nuevas y experimentales:
Cuando después de un Daño Cerebral Traumático Ligero (DCTL) son detectados hallazgos en alguno de los medios diagnósticos de neuroimagen, la clasificación cambia a “Daño Cerebral Traumático Ligero (DCTL) complicado”, el cual tiene una evolución más desfavorable, muy similar al Daño Cerebral Traumático (DCT) moderado (140). Por tanto es en los pacientes con Daño Cerebral Traumático Ligero (DCTL) sintomáticos, y con hallazgos negativos en las técnicas de neuroimagen tradicionales, donde la utilización de marcadores biológicos (como la proteína S-100B) y de técnicas de neuroimagen más sensitivas, continua (141).
Técnicas de neuroimagen nuevas y experimentales ofrecen aspectos promisorios, y pueden ser útiles en demostrar los mecanismos fisiológicos alterados en estos pacientes y los efectos del tratamiento rehabilitador (142).
Sólo se mencionarán algunos de estos métodos de diagnóstico, ya que su descripción escapa a los objetivos de esta investigación. Para su mejor comprensión serán divididos en técnicas químicas o estructurales y técnicas funcionales (141)
Técnicas químicas o estructurales:
· Imágenes por Tensor de Difusión.
· Imágenes por Transferencia de Magnetización.
· Espectroscopia por Resonancia Magnética.
· Imágenes de Fuente Magnética.
Técnicas funcionales:
· Imágenes de Resonancia Magnética Funcional.
· Tomografía por Emisión de Positrones.
· Tomografía por Emisión de Fotón Único.
El Daño Cerebral Traumático Ligero (DCTL) y el Síndrome Postconmocional (SPC) son trastornos multifuncionales desde el punto de vista fisiopatológico y sus manifestaciones clínicas pueden explicarse ampliamente por los mecanismos abordados en este acápite. En los próximos años nuevos estudios profundizarán en su etiopatogenia y serán introducidos en la práctica clínica recursos de diagnósticos eficientes y efectivos en términos de equidad, eficiencia macro y microeconómica, resultados de salud para las comunidades y satisfacción de la población.
OBJETIVOS
GENERAL:
Caracterizar a los pacientes con el diagnóstico de Daño Cerebral Traumático Ligero y Síndrome Postconmocional atendidos en el Centro Médico de Diagnóstico Integral “La Gran Colombia”, en el Área de Salud Integral Comunitaria homónima, de la Parroquia Santa Rosalía en Caracas, entre enero del año 2007 y enero del 2009.
ESPECÍFICOS:
· Caracterizar epidemiológica y clínicamente a la población objeto de estudio al inicio y los tres meses de seguimiento.
· Valorar la evolución de los pacientes y su funcionamiento social a los seis meses del evento traumático.
DISEÑO METODOLÓGICO
Se realizó una investigación descriptiva y prospectiva para caracterizar a los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC), diagnosticados en la Atención Primaria de Salud, en el Centro Médico de Diagnóstico Integral (CMDI) del Área de Salud Integral Comunitaria (ASIC) “La Gran Colombia”, de la Parroquia Santa Rosalía, Municipio Libertador, Caracas, entre los meses de Enero del 2007 y Enero del 2009.
UNIVERSO DE ESTUDIO
Se consideró como universo o población estudiada, a la totalidad de pacientes con diagnóstico de Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC), en el área geográfica y periodo de tiempo anteriormente mencionados (N= 67).
Los criterios diagnósticos de Daño Cerebral Traumático Ligero (DCTL) utilizados fueron los formulados por el grupo de trabajo del Centro para el Control de las Enfermedades (CDC de Atlanta) en el año 2003 (23). Estos criterios combinan la presencia del antecedente de un daño a la cabeza resultante de un trauma craneal directo o de fuerzas de aceleración/desaceleración aplicadas a la misma, con una o varias de las siguientes condiciones atribuibles al evento traumático:
· Cualquier periodo transitorio de confusión, desorientación o empeoramiento o disminución del nivel de conciencia (puede ser observado o auto-reportado). Los valores de la Escala de Coma de Glasgow nunca inferiores a 13 puntos.
· Cualquier periodo de disfunción de la memoria (amnesia) alrededor del evento traumático con menos de 24 horas de duración (puede ser observado o auto-reportado).
· Cualquier periodo de pérdida de la conciencia menor de 30 minutos (puede ser observado o auto-reportado).
· Convulsión aguda después del trauma craneal.
El diagnóstico de Síndrome Postconmocional (SPC) se estableció utilizando los criterios propuestos en la 10ª revisión de la Clasificación Internacional de las Enfermedades (CIE-10) (53,54): antecedente de un daño cerebral traumático y la presencia de tres o más de los siguientes 8 síntomas:
· Cefalea.
· Mareos.
· Fatiga.
· Irritabilidad.
· Insomnio.
· Dificultades para la concentración.
· Trastornos de la memoria.
· Intolerancia al stress, las emociones y el alcohol.
Los criterios de inclusión utilizados fueron:
· Pacientes mayores de 18 años.
· Arribo a la unidad de emergencias dentro de las 48 horas post trauma.
· Criterios de Daño Cerebral Traumático Ligero (DCTL) y de Síndrome Postconmocional (SPC).
· Aceptación del paciente para participar en el estudio, a través del consentimiento informado por escrito (Ver Anexo 1), que incluye el seguimiento a los tres y seis meses después de la primera consulta, a través de consulta programada o por llamada telefónica.
Criterios de exclusión:
· Pacientes sin hogar.
· Consumo actual de drogas o alcohol.
· Enfermedad psiquiátrica activa actual.
· Daño severo a otros sistemas orgánicos (Incluye el síndrome del latigazo cervical grados 3 y 4).
Métodos teóricos utilizados:
Se utilizó el método de análisis histórico y lógico para analizar los antecedentes de esta problemática de salud desde los tiempos prehistóricos hasta la actualidad, en varios países del mundo. Haciendo énfasis en aspectos diagnósticos, fisiopatológicos y terapéuticos.
Se realizó la revisión documental de artículos impresos y en formato digital sobre el tema de investigación. Asimismo se hizo una amplia búsqueda en Internet, utilizando como principal motor de búsqueda a “Google”, de artículos en español e inglés. Los Descriptores aplicados para las mismas fueron “trauma cráneo encefálico”; “daño cerebral traumático”; “daño cerebral traumático ligero"; “síndrome postconmocional”; “conmoción cerebral”. También se tuvo acceso a las bases de datos de publicaciones de la Biblioteca Médica Nacional de los Estados Unidos de América (MEDLINE) (disponible en: http://www. ncbi.nlm. nih.gov), utilizando los descriptores: “head injury”; “traumatic brain injury”; “mild traumatic brain injury”; “postconcussional syndrome” y “brain concussion”. Tanto en Google como en MEDLINE, fueron utilizados los operadores booleanos “and” “or” “not” para hacer más precisa y limitada la búsqueda, y como límite de tiempo se colocó 5 años. Se utilizaron algunos artículos con más de 5 años de publicados por su importancia histórica o por la validez actual de sus contenidos.
Durante todo el proceso investigativo, de análisis de los resultados obtenidos y en la elaboración del informe final se utilizaron además otros métodos teóricos como: análisis-síntesis, inducción-deducción, tránsito de lo abstracto a lo concreto, así como el enfoque de sistema.
Métodos empíricos utilizados:
Se utilizó la medición de las variables en estudio a través de la confección de una ficha donde se vaciaron los datos de los pacientes al momento de su valoración en la consulta de emergencias del CMDI (Ver Anexo 2), del Cuestionario “Rivermead” para Síntomas Postconmocionales (Ver Anexo 3), la Escala de Coma de Glasgow (ver Anexo 4), la Escala Evolutiva de Glasgow (Ver Anexo 5) y el Cuestionario “Rivermead” para el seguimiento a los pacientes con Daño Cerebral Traumático (DCT) (Ver Anexo 6).
En la ficha de recolección de datos se incluyeron los siguientes ítems de acuerdo a los objetivos propuestos y a las variables de estudio:
Variables para caracterizar epidemiológicamente a los pacientes estudiados:
Edad. Se utilizó la edad cumplida en años y se dividió utilizando la siguiente escala:
· 18 a 20 años
· 21 a 39 años
· 40 a 49 años
· 50 a 59 años
· 60 a 69 años
· Más de 70 años
Sexo. Se utilizó el sexo biológico según la escala que los divide en Masculino y Femenino.
Ocupación. Teniendo en cuenta la actividad principal que realiza en paciente. Se utilizó la siguiente escala:
· Trabajador.
· Estudiante.
· Ama de casa.
· Jubilado.
· Desempleado.
Tiempo transcurrido entre el evento traumático y la primera asistencia médica. Se dividió en horas utilizando la siguiente escala:
· Menos de 12 horas.
· Entre 13 y 24 horas.
· Entre 25 y 48 horas.
Día de la semana en que ocurrió el evento traumático. Se utilizó la escala correspondiente a los siete días de la semana: lunes, martes, miércoles, jueves, sábado y domingo.
Mes del año en que ocurrió el evento traumático. Se utilizó la escala correspondiente a los 12 meses del año: enero, febrero, marzo, abril, mayo, junio, julio, agosto, septiembre, octubre, noviembre, diciembre.
Mecanismo de producción del trauma. Se propusieron los siguientes mecanismos:
· Trauma directo en la cabeza, con cabeza fija y objeto en movimiento. (Producido mayormente por objetos contundentes que golpean la cabeza).
· Trauma directo en la cabeza, con cabeza en movimiento y objeto fijo. (Cabeza que se desplaza dentro o fuera de un vehículo, con o sin motor de combustión, y choca contra objeto que se encuentra estático, caídas desde alturas, etc.).
· Trauma directo en la cabeza, con cabeza y objeto en movimiento. (Combinación de las variantes anteriores)
· Sin trauma directo en la cabeza (aceleración/desaceleración). (Casi siempre producido por frenazos bruscos, choques por detrás cuando el vehículo se encuentra estático y aplicación de violentas fuerzas al tronco o cuello con repercusión cefálica).
Circunstancias en las que se produjo el evento traumático. Se utilizó la siguiente escala:
· Accidente de tránsito.
· Accidente en el hogar (No relacionados con violencia).
· Accidente en el trabajo.
· Accidente en el colegio/liceo/universidad.
· Eventos traumáticos relacionados con la violencia doméstica.
· Eventos traumáticos relacionados con violencia fuera del hogar.
Variables para caracterizar clínicamente a la población de estudio:
Ponderación del estado de conciencia inicial a través de la Escala de Coma de Glasgow, ECG (143). Se utilizó la siguiente escala:
· ECG en 13 puntos.
· ECG en 14 puntos.
· ECG en 15 puntos.
No se utilizaron otros valores de esta escala teniendo en cuenta que valores inferiores se corresponden al Daño Cerebral Traumático Moderado (entre 9 y 12 puntos) y Daño Cerebral Traumático Severo o Grave (menos de 8 puntos).
Medios diagnósticos utilizados inicialmente y a los tres meses del evento traumático. Se consideraron los siguientes:
· Radiografía Simple de Cráneo. En cualquiera de sus vistas principales (anteroposterior, lateral o Towne) o sus combinaciones.
· Tomografía Axial Computarizada. Simple o contrastada.
· Imágenes de Resonancia Magnética. Simple o contrastada.
· Otros. Se tuvo en consideración el Electroencefalograma, y otros estudios electrofisiológicos.
Síntomas postconmocionales y su evolución a los tres meses del evento traumático: Para la obtención de los mismos se utilizó el Cuestionario “Rivermead” diseñado y publicado por King NS y colaboradores, en la revista Journal of Neurology en 1995 (144) (Ver Anexo 3). El Cuestionario “Rivermead” para Síntomas Postconmocionales (CRSPC), ha sido utilizado para determinar la presencia y severidad del Síndrome Postconmocional (SPC) en más de 40 artículos publicados (145).
El mismo fue realizado por cada paciente donde ponderaron, con valores entre 0 y 4, la severidad de 16 diferentes síntomas de común presentación después de un Daño Cerebral Traumático (DCT).
0 = Nunca los he experimentado.
1 = No lo considero un problema.
2 = Lo considero un problema leve.
3 = Lo considero un problema moderado.
4 = Lo considero un problema grave.
En cada caso se compara la intensidad de los síntomas antes y después del evento traumático, según se explica antes de su aplicación.
Para su interpretación se utilizó el sistema modificado propuesto por Eyres S y colaboradores en el 2005 (146). Los ítems son medidos en dos grupos de síntomas: el primero está conformado por los tres primeros (dolor de cabeza, sensación de mareos, nauseas y/o vómitos) (CRSPC-3). Y el segundo grupo combina los restantes 13 ítems (CRSPC-13).
El grupo CRSPC-3 puede tener valores potenciales que oscilan entre 0 y 12, y refleja los síntomas que de manera más temprana aparecen juntos en el Síndrome Postconmocional (SPC).
Los valores del grupo CRSPC-13 oscilan entre 0 y 52 y puntajes altos se asocian con la severidad del Síndrome Postconmocional (SPC). Este grupo refleja los síntomas tardíos del Síndrome Postconmocional (SPC).
Al final se le pregunta al paciente si padece algún otro síntoma o dificultad, y de haber alguno se procede a su ponderación según el mismo procedimiento anterior.
El CRSPC fue aplicado al inicio del estudio y a los tres meses para valorar la evolución general de los síntomas en la población estudiada.
Otras lesiones asociadas al evento traumático. Se consideraron las siguientes:
· Herida epicraneal. Se consideró como tal a cualquier solución de continuidad de alguna de las 5 capas (o todas) del cuero cabelludo. Igualmente se consideró dentro de ellas a las avulsiones del cuero cabelludo y las quemaduras por fricción.
· Hematoma subgaleal. Se consideró el acúmulo de sangre en el espacio subgaleal, o sea entre la galea y el periostio que puede extenderse a grandes áreas. Doloroso, de consistencia blanda en el centro y al palparse produce la impresión de existir un hundimiento.
· Hematoma subperióstico. Se consideró el acúmulo de sangre entre el periostio y la tabla externa del cráneo. De consistencia dura, doloroso y limitado al sitio del trauma.
· Síndrome del latigazo cervical (Whiplash). Se utilizó la definición de la Quebec Task Force (QTF) de 1995 que incluye como mecanismo lesional la aceleración/desaceleración que transmite su energía al cuello. Puede ser el resultado de colisiones en accidentes de vehículos por impacto posterior o lateral, accidentes de inmersión en agua, etc. (147). La QTF divide esta entidad en 4 grados. No es objetivo de este estudio clasificar a los pacientes según los mismos, sin embargo cabe aclarar que sólo se consideraron los pacientes con esta patología hasta el grado 3 que incluye dolor cervical y signos neurológicos (reflejos osteotendinosos disminuidos, déficits sensitivos y/o motores). Puede haber movilidad cervical normal o restringida. El grado 4 incluye fractura o luxación cervical, lo que explica su exclusión en la investigación.
Variables para valorar la evolución de los pacientes y su funcionamiento social a los seis meses del evento traumático:
Ponderación de la evolución de los pacientes a través de la Escala Evolutiva de Glasgow (148) que considera la siguiente escala:
· Buena Recuperación (BR): El paciente regresa a su nivel de funcionamiento pre-trauma.
· Moderadamente Discapacitado (MD): Hay déficit neurológico pero el paciente es capaz de autocuidarse.
· Severamente Discapacitado (SD): El paciente es incapaz de autocuidarse.
· Vegetativo (V): No hay evidencias de funciones mentales superiores.
· Muerto (M).
Ponderación del funcionamiento social de los pacientes a través del Cuestionario “Rivermead” para el seguimiento a los pacientes con Daño Cerebral Traumático (149) (Ver Anexo 6).
El mismo fue realizado por cada paciente donde ponderaron, con valores entre 0 y 4, según la escala que aparece en el instructivo, cada uno de los 10 aspectos evaluados. En cada caso se compara la intensidad de los síntomas antes y después del evento traumático, de la siguiente forma:
0 = Sin cambios.
1 = Sin cambios, pero con más dificultad.
2 = Con cambios ligeros.
3 = Con cambios moderados.
4 = Con cambios muy marcados.
Métodos estadísticos utilizados:
Se elaboró un libro de Microsoft Office Excel 2007 con las hojas de cálculo necesarias para resumir la información obtenida de la ficha de recolección de datos y de los cuestionarios.
En cada hoja se elaboraron los cuadros estadísticos correspondientes a cada variable estudiada, y se insertaron las funciones y fórmulas necesarias para obtener los valores absolutos y por cientos, que se utilizaron como productos de la investigación realizada.
No fue necesario el uso de paquetes estadísticos informáticos.
El informe final de la investigación se realizó con Microsoft Office Word 2007.
Triangulación metodológica de la información:
El uso por el autor de los métodos teóricos y empíricos explicitados, permitió la obtención de los datos necesarios para abordar el problema de salud en cuestión y dar solución al problema científico propuesto.
Consideraciones Bioéticas:
Se les explicó detalladamente a los pacientes y familiares los objetivos del estudio, y leyeron y firmaron un documento de consentimiento informado. Se tuvieron en cuenta los cuatro principios básicos: beneficencia, no maleficencia, autonomía y justicia.
ANÁLISIS Y DISCUSIÓN DE LOS RESULTADOS
El presente estudio se llevó a cabo a lo largo de dos años, lo que permitió seguir a la totalidad de los pacientes según los plazos fijados en el diseño metodológico.
Se estudiaron 67 pacientes con diagnóstico de Daño Cerebral Traumático Ligero (DCTL) que desarrollaron un Síndrome Postconmocional (SPC) y fueron vistos en consulta en las 48 horas post trauma.
Se distribuyó la población estudiada según la edad y sexo de los pacientes, siendo más frecuente el grupo masculino en más del 80%. Este sexo predominó en todos los grupos de edades. Las edades más afectadas fueron las comprendidas entre los 21 y 39 años, a partir de donde comienza a disminuir la frecuencia hasta la 7ma década de la vida (Ver Tabla 1)
TABLA 1. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según edad y sexo. Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.
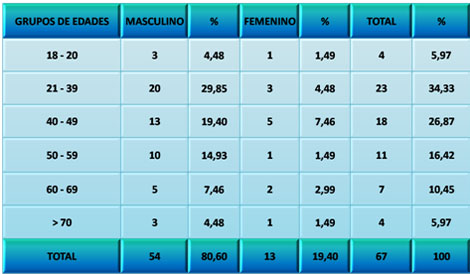
Varios autores norteamericanos coinciden en que los Daños Cerebrales Traumáticos Ligeros (DCTL) son más comunes entre los 15 y 24 años, con un pico en los hombres entre 20 y 24 años, que supera las frecuencias de presentación en todos los demás grupos de edades de ambos sexos. En todos los grupos siempre los hombres duplican las frecuencias sobre el otro sexo (150-153). Estos resultados son lógicos si se tiene en cuenta que los hombres de estas edades son más activos económicamente y ejecutan más actividades que pudieran ser consideradas de riesgo para el desarrollo de un Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC).
Algunos investigadores, como Schanberger M y colaboradores, sugieren que a mayor edad, es peor el impacto de los Traumatismos Cráneo Encefálicos (TCE) sobre el encéfalo, criterio que explica la mayor frecuencia de Daño Cerebral Traumático Ligero (DCTL) en pacientes jóvenes (154).
Preiss-Farzanegan SJ y colaboradores han encontrado que en los Daños Cerebrales Traumáticos Ligeros (DCTL) relacionados con el deporte, el sexo se comporta de manera contraria, donde las mujeres adultas tienen un riesgo elevado para desarrollar síntomas postconmocionales, cuando se comparan con los pacientes masculinos (155).
Un factor que pudiera relacionarse con los Daños Cerebrales Traumáticos Ligeros (DCTL) y su producción es la ocupación de los pacientes. De su distribución se obtuvo que la mayoría de ellos son trabajadores (43,28%), siguiéndole el grupo de los estudiantes (25,37%) y las amas de casa (10,45%) (Ver Gráfico 1)
GRÁFICO 1. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según ocupación. Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.
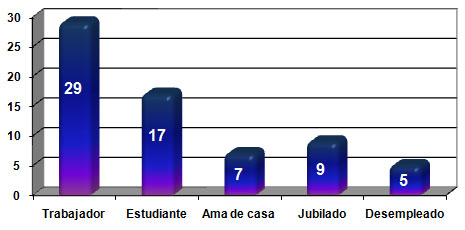
Fuente: Tabla 5 (Ver Anexo 7)
Estos resultados son congruentes con los analizados en las variables edad y sexo. Es importante señalar que en este estudio no se presentó ningún accidente laboral, por lo que los mismos no fueron considerados en las circunstancias del evento traumático.
A pesar de la amplia revisión bibliográfica realizada, se encontraron pocos trabajos que relacionen la ocupación con los Daños Cerebrales Traumáticos Ligeros (DCTL) y el Síndrome Postconmocional (SPC). La mayoría de ellos se centra en los aspectos económicos derivados de la pérdida de años potenciales de trabajo-vida. Sumas ME y Narayan RK escribieron que el Daño Cerebral Traumático (DCT) aporta más casos de pérdida de años potenciales de trabajo-vida (3.5 millones), que el cáncer (1,8 millones) y la enfermedad cerebrovascular (1,6 millones) combinadas (156).
En los casos severos de Daño Cerebral Traumático (DCT) los pacientes casi siempre reciben asistencia médica inmediata, relacionada con la organización de los sistemas de emergencias médicas activados ante estos eventos. Todo lo contrario ocurre con las formas leves, en que depende del paciente y su percepción del daño sufrido, su concurrencia ante los servicios médicos.
La mayoría de los pacientes asistió a recibir atención médica entre 25 y 48 horas después de ocurrido el evento traumático (66%). Sólo un 12% concurrió en las primeras 12 horas (Ver Gráfico 2).
GRÁFICO 2. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según tiempo transcurrido entre el evento traumático y la primera asistencia médica. Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.
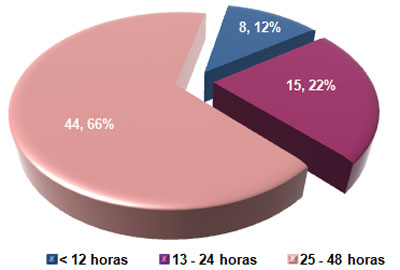
Fuente: Tabla 6 (Ver Anexo 7)
Estos resultados pudieran estar relacionados con las circunstancias, mecanismos y tipo de daño, ya que justamente al ser ligero, inicialmente, no produce en los pacientes la percepción de buscar atención médica inmediata como sucede con los de moderada o intensa magnitud.
En la práctica médica, y según algunos estudios revisados, un número significativo de pacientes con Daño Cerebral Traumático Ligero (DCTL), incluso, no llegan a ir nunca a las instituciones de salud (156).
Los resultados que se muestran en los gráficos 3 y 4 tienen que ver con la presentación del Daño Cerebral Traumático Ligero (DCTL) en diferentes periodos. El Gráfico 3 demuestra como la incidencia de este trastorno aumenta a partir del día viernes, con un pico el sábado, que a partir del domingo comienza a declinar. Se puede explicar este comportamiento teniendo en cuenta que durante el fin de semana aumenta considerablemente la actividad recreativa, turística, el tráfico vehicular y peatonal y la ingestión de bebidas alcohólicas, factores todos que pueden estar implicados en los mecanismos y circunstancias para el desarrollo de un Daño Cerebral Traumático Ligero (DCTL).
Por su parte en el Gráfico 4 se distribuye la incidencia en los meses del año, donde puede verse que los picos coinciden con momentos del año donde todos los factores arriba mencionados están presentes: febrero (carnaval), abril (vacaciones de semana santa), un aumento progresivo desde junio hasta septiembre (vacaciones escolares) y una tendencia al aumento en diciembre (vacaciones de navidad y fin de año).
GRÁFICO 3. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según día de la semana en que ocurrió el evento traumático. Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.

Fuente: Tabla 7 (Ver Anexo 7)
GRÁFICO 4. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según mes del año en que ocurrió el evento traumático. Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.
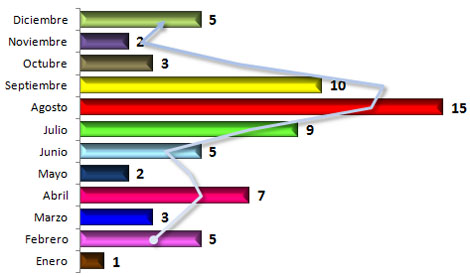
Fuente: Tabla 8 (Ver Anexo 7)
Sumas ME y Narayan RK afirman que hay un pico temprano en la ocurrencia del Daño Cerebral Traumático (DCT) en abril, seguido por un aumento progresivo hacia septiembre. La mayoría de los Traumatismos Cráneo Encefálicos (TCE) y espinales ocurren entre viernes, sábado y domingo, momentos en que la cobertura médica en los hospitales es menos que óptima. Por eso, un problema muy común tiende a ocurrir en momentos inconvenientes, demanda mucho tiempo y atención, y puede tener resultados desastrosos si no es manejado rápida y apropiadamente (156).
En el marco teórico de esta investigación y en algún momento previo de la discusión se han mencionado algunos de los mecanismos de producción que participan en la génesis del Daño Cerebral Traumático Ligero (DCTL) y del Síndrome Postconmocional (SPC). Cuando se distribuyeron los mismos se obtuvo que el mecanismo de aceleración/desaceleración fue el más frecuente (30 pacientes que representan el 44,78%), seguido de los pacientes con cabeza móvil y objeto fijo (Ver Gráfico 5). Es necesario señalar también la relación entre este mecanismo y la producción de las lesiones asociadas al evento traumático, como se explicará más adelante.
Estos mecanismos tienen además estrecha relación con las circunstancias en que se produjo el trauma. La mayoría de los pacientes tuvo un accidente de tránsito (35 para un 52,24%), seguidos de los que padecieron alguna forma de violencia intradomiciliaria (10 pacientes para un 14,93%) (Ver Gráfico 6)
GRÁFICO 5. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según mecanismo de producción del evento traumático. Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.
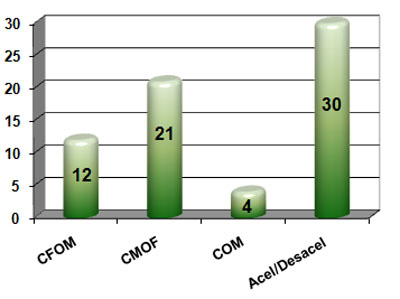
Leyenda:
CFOM: Cabeza Fija Objeto Móvil
CMOF: Cabeza Móvil Objeto Fijo
COM: Cabeza y Objeto Móvil
Acel/Desacel: Aceleración/Desaceleración
Es necesario señalar que se deben tener en cuenta en todo momento los mecanismos fisiopatológicos mencionados y las distintas circunstancias relacionadas, para explicar los síntomas propios del Daño Cerebral Traumático Ligero (DCTL) y el Síndrome Postconmocional (SPC). A partir de este momento se utilizarán elementos de estas variables interrelacionados para analizar el desarrollo de los síntomas postconmocionales y su evolución.
GRÁFICO 6. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según circunstancias en las que se produjo el evento traumático. Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.

Fuente: Tabla 10 (Ver Anexo 7)
Sumas ME y Narayan RK ubican como causa más frecuente a los accidentes de tránsito en más del 49% de los casos (156). Arciniegas DB y colaboradores consideran que los Daños Cerebrales Traumáticos Ligeros (DCTL) resultan en su mayoría de accidentes de tránsito, seguido de los asaltos y caídas, siendo las primeras dos causas más frecuentes en jóvenes de procedencia urbana, y la tercera en los ancianos (2). Otros autores se han centrado, entre el estudio de las circunstancias, en la responsabilidad del accidente, señalando que cuando la responsabilidad del accidente es de uno mismo (descuido o negligencia), otra persona o por causas de fuerza mayor, se ha descrito que se producen menos síntomas postconmocionales y se produce una reincorporación más rápida al trabajo, que cuando la responsabilidad es del empresario o de una institución. Los sentimientos de rabia o de culpa respecto a quien haya sido el responsable del accidente también pueden influir en la evolución del trastorno (38,157).
La Escala de Coma de Glasgow (ECG) se correlaciona adecuadamente con la evolución de los pacientes, siendo de mucha utilidad ya que brinda uniformidad de criterios interobservadores, de ahí su ampliado uso para el abordaje neurológico de los pacientes con Daño Cerebral Traumático (DCT) (158,159)
Casi el 90% de los pacientes estudiados presentó valores de la ECG de 15 puntos (Ver Gráfico 7).
GRÁFICO 7. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según puntuación de la Escala de Coma de Glasgow. Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.
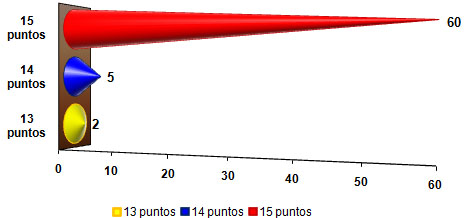
Fuente: Tabla 11 (Ver Anexo 7)
La ECG es el sistema más usado para clasificar la severidad de los Traumatismos Cráneo Encefálicos (TCE) tanto en el periodo agudo como para valorar la evolución de los pacientes (143), y es muy útil cuando es usada adecuadamente.
A pesar de lo elocuente que resulta una puntuación de la ECG entre 13 y 15 puntos, y más si la mayoría tiene el valor máximo, para valorar la intensidad y gravedad de un Daño Cerebral Traumático (DCT), se le realizó radiografía de cráneo al 100% de los pacientes estudiados. A los tres meses a 24 de ellos (35,82%) se les realizó Tomografía Axial Computarizada (TAC) (Ver Gráfico 8).
GRÁFICO 8. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según medios de diagnóstico utilizados al inicio y a los tres meses de seguimiento. Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.
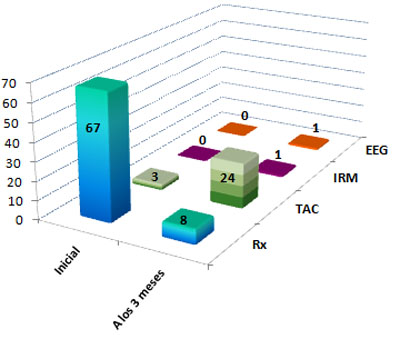
Fuente: Tabla 12 (Ver Anexo 7)
La mayoría de los pacientes con Daño Cerebral Traumático Ligero (DCTL) se recupera satisfactoriamente, lo que está en estrecha relación con la negatividad de los estudios de imágenes indicados. Sin embargo, aproximadamente un 3% puede deteriorarse de manera inesperada y devenir neurológicamente devastado, si el declinar de su estado mental no es verificado precozmente (156). ¿Cuán lejos debe ir un médico en su conducta para asegurarse de que no ocurran resultados devastadores? El resultado de la clásica lucha entre “costo-efectividad” y “mejor conducta posible” es evidente en estas situaciones.
La radiografía de cráneo debe indicarse buscando los siguientes hallazgos: fracturas lineales o deprimidas, posición de la glándula pineal si está calcificada, niveles hidroaéreos en los senos perinasales, pneumoencéfalo, fracturas faciales y cuerpos extraños. La indicación rutinaria de este estudio ha sido criticada, y un estudio multicéntrico soportado por la FDA (Food and Drug Administration) de los Estados Unidos, ha recomendado guías para reducir el número de estudios que resultan negativos. Basado en un análisis de 7035 pacientes con Daño Cerebral Traumático (DCT) de 31 hospitales (156), la FDA propuso para el grupo de bajo riesgo (pacientes con síntomas y signos iniciales mínimos: cefalea, mareos o heridas epicraneales. Que representan el 75% de ellos) recomendar su envío a casa bajo observación, sin necesidad de realizar radiografía de cráneo. Los autores acotan que estas guías no pretenden suplantar el juicio médico.
No obstante los criterios anteriores, el autor considera que es útil parafrasear aquí las palabras de Teasdale y Jennet, autores de la Escala de Coma de Glasgow, y que sirvieron de frase al inicio de este informe final (160):
“… para la mente cuidadosa, pero sobre todo, para la mente legal, las fracturas craneales son marcas obvias de la severidad después de un trauma craneal. Miles de cabezas son radiografiadas en las salas de emergencia, pero solo dos o tres casos de cada cien tienen una fractura; consecuentemente, los radiólogos escriben artículos sobre el mal uso de los recursos y demandan que los clínicos hagan un mejor triage antes de indicar unos rayos X. Los neurocirujanos siempre han abogado que la valoración del estado de conciencia es más importante que una radiografía craneal, y esto ha sido mal interpretado implicando que ellos consideran la detección de una fractura como no importante, especialmente en pacientes ligeramente traumatizados. De hecho, es en ese paciente que no tiene alteraciones de la conciencia, y que puede ser enviado a casa como un trauma trivial, donde el hallazgo de una fractura puede ser más significativo, ya que alerta al médico sobre el riesgo de complicaciones como un hematoma intracraneal o infección…”
Los estudios neuroimagenológicos habituales aportan resultados normales en la mayoría de los pacientes con Daño Cerebral Traumático Ligero (DCTL) (141,161,162). Borg y colaboradores reportan que el 5% de los individuos con ECG de 15 puntos, 20% de los que tienen 14 puntos y 30% de los que tienen puntuaciones de 13 puntos, presentan TAC normales (163). Situación similar sucede con las Imágenes de Resonancia Magnética (IRM), a pesar de que la misma tiene más sensibilidad que la TAC para el manejo de los pacientes con Daño Cerebral Traumático Ligero (DCTL) (164-166). De hecho, entre el 43 y el 68% de los pacientes con Daño Cerebral Traumático Ligero (DCTL) tienen resultados estructurales normales en las IRM (167,168). Esto puede ser debido a que realmente los pacientes no tienen daños evidentes (demostrados por TAC) o a que la tecnología actual no es capaz de diagnosticarlos (169-171). De hecho, y como se ha explicado en el marco teórico, se han demostrado distintos cambios microscópicos, entre ellos daño axonal difuso, en necropsias de pacientes con Daño Cerebral Traumático Ligero (DCTL) (101,172,173) que permanecen indetectables con las técnicas de neuroimagen tradicionales (101,174).
El punto de vista que afirma la transitoriedad de los síntomas del Daño Cerebral Traumático Ligero (DCTL) se sustenta en la ausencia de hallazgos estructurales en las Imágenes de Resonancia Magnética (IRM) de estos pacientes (15). Sin embargo, el uso combinado de la IRM de alta resolución y otros protocolos específicos de escaneo diagnóstico, proveen evidencia de anomalías microestructurales en los casos estudiados (175-177).
Los síntomas postconmocionales presentes en los pacientes fueron identificados y evaluados a través de la aplicación del Cuestionario Rivermead para los mismos como fue explicado en el diseño metodológico.
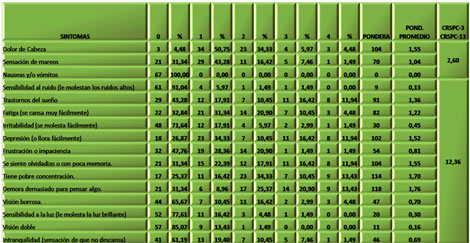
De los tres primeros síntomas (CRSPC-3), fue la cefalea el que obtuvo mayor ponderación, seguido de la sensación de mareos y las nauseas o vómitos. La puntuación total fue de 8,51 (de un rango de 0 a 12) (Ver Tabla 2). La mayoría de los pacientes valoró estos tres síntomas con ponderaciones entre 3 y 4 (“lo considero un problema moderado” o “grave”).
TABLA 2. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según síntomas postconmocionales en la primera consulta. Cuestionario “Rivermead” para Síntomas Postconmocionales (CRSPC). Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.
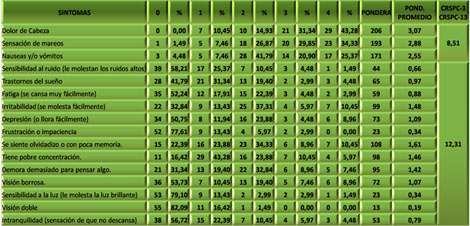
De los 13 síntomas restantes (CRSPC-13) fue “se siente olvidadizo o con poca memoria” el más valorado, seguido de “irritabilidad”, “tiene pobre concentración” y “demora demasiado en pensar algo”. En su conjunto estos síntomas obtuvieron una puntuación de 12,31 (de un rango de 0 a 52) y la mayoría de los pacientes los valoró con ponderaciones entre 0 y 2 (“nunca los he experimentado”, “no lo considero un problema” y “lo considero un problema leve”).
Blinman TA y colaboradores, en un estudio realizado en el Hospital de Niños de Filadelfia, siguieron durante 2 años a pacientes entre 11 y 17 años que padecieron Daño Cerebral Traumático Ligero (DCTL), y concluyeron que los síntomas son de frecuente presentación en el momento de la consulta de emergencia. Asimismo que los síntomas tienden a mejorar y llegar a desaparecer en el seguimiento. El síntoma más común fue la cefalea, pero el más frecuente fue la fatiga (178).
A los tres meses fue aplicado nuevamente el CRSPC a los pacientes, encontrándose que los tres primeros síntomas, que inicialmente habían sido ponderados con 8,51 (Tabla 2), ahora ostentaban el valor de 2,6. Dentro de ellos, la cefalea aún presentaba ponderaciones superiores. Sin embargo, al comparar estos resultados con los obtenidos al inicio del estudio, la mayoría le otorgó valores entre 1 y 2, es decir que no lo consideran un problema o un problema leve, respectivamente (Ver Tabla 3)
En general hubo poca variación del resto de los 13 síntomas explorados, ya que inicialmente se ponderó con 12,31 y a los tres meses se obtuvo 12,36. Se mantiene que “se siente olvidadizo o con poca memoria” entre los síntomas principales de este grupo, junto con “demora demasiado para pensar algo” y “tiene pobre concentración” (Tabla 3).
TABLA 3. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según síntomas postconmocionales a los tres meses. Cuestionario “Rivermead” para Síntomas Postconmocionales (CRSPC). Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.
La mayoría de los estudios longitudinales señalan que los síntomas característicos del síndrome postconmocional son muy comunes en las primeras semanas, pero entre el 50 y 70% de los pacientes restablecen el funcionamiento cognitivo normal en los tres primeros meses y la mayor parte de los afectados lo hacen durante el primer año (179-181).
Sigurdardottir S y colaboradores realizaron una investigación para examinar los síntomas postconmocionales auto-reportados en pacientes con Daño Cerebral Traumático (DCT), utilizando el CRSPC. Concluyeron que en los pacientes con Daño Cerebral Traumático Ligero (DCTL) los síntomas tienden a declinar con el tiempo (182).
Vanderploeg RD y colaboradores opinan que el Daño Cerebral Traumático Ligero (DCTL), incluso en su fase evolutiva más crónica, años después del evento traumático, no es una condición benigna, ya que se asocia a altas frecuencias de cefalea, trastornos del sueño y dificultades en la memoria. Puede además según ellos, complicar o prolongar la recuperación de condiciones pre-existentes o comórbidas como el Desorden de Stress Post Traumático (183).
El Daño Cerebral Traumático Ligero (DCTL) puede incluir otras lesiones asociadas, fundamentalmente relacionadas con los mecanismos y circunstancias en que se produjo el evento traumático.
En los pacientes estudiados predominó el Síndrome del Latigazo Cervical o Whiplash en 11 de ellos (16,42%), seguido en frecuencia por las heridas epicraneales (Gráfico 9).
GRÁFICO 9. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según otras lesiones asociadas. Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.
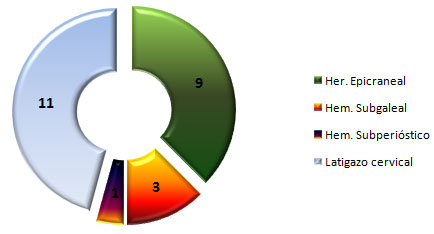
Fuente: Tabla 13 (Ver Anexo 7)
En 1923 Crowe introduce el término “whiplash” para referirse al mecanismo de producción de lesiones cervicales como consecuencia de fuerzas bruscas de aceleración/desaceleración (184) y a los síntomas secundarios al estiramiento cervical que presenta un paciente, tras la hiperextensión e hiperflexión del cuello, producida generalmente cuando su vehículo sufre una colisión frontal o trasera.
La importancia de este síndrome viene determinada por los tres aspectos siguientes: 1. Los estudios experimentales clásicos realizados por Ommaya y colaboradores, quienes demostraron que la aceleración/desaceleración brusca sin impacto directo sobre el cerebro produce contusiones en la superficie cerebral y la médula cervical; 2. La frecuente coexistencia de Daño Cerebral Traumático Ligero (DCTL), Síndrome Postconmocional (SPC) y “latigazo cervical”, y 3. El amplio solapamiento de ambos síndromes (181).
En un estudio comparativo entre este síndrome y el síndrome postconmocional se comprobó el alto grado de solapamiento clínico entre ambos. Los autores documentaron que los pacientes con lesiones cervicales presentan con más frecuencia fobia a la conducción y depresión; por el contrario, los afectados de lesiones cerebrales padecían más frecuentemente mareos (185).
A los seis meses del evento traumático 66 pacientes (98,51%) tenían buena recuperación según la Escala Evolutiva de Glasgow (EEG) (Ver Gráfico 10).
GRÁFICO 10. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según su evolución a los 6 meses del evento traumático a través de la Escala Evolutiva de Glasgow. Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.
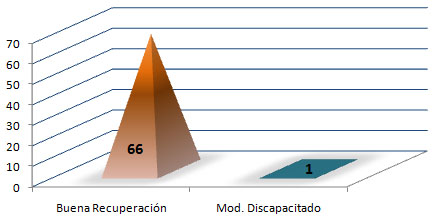
Fuente: Tabla 14 (Ver Anexo 7)
Sólo 1 paciente (1,49%) se clasificó como moderadamente discapacitado al presentar déficits sensitivos de una extremidad como consecuencia de un síndrome de latigazo cervical grado 3 (Ver Gráfico 10).
La mayoría de los pacientes se recupera totalmente después de un Daño Cerebral Traumático Ligero (DCTL), aunque entre el 7 y 33% pueden tener síntomas persistentes (28,36,180).
Después de 6 meses la mayoría de los pacientes valoraron con ponderaciones entre 0 y 2 (“sin cambios”, “sin cambios, pero con más dificultad” y “con cambios ligeros”) todos los ítems relacionados con su integración social a través del Cuestionario Rivermead ad hoc. Un pequeño grupo de pacientes ponderaron con 3 (“con cambios moderados”) algunos ítems: 3 pacientes el ítem “considera que el trabajo es más agotador”, 2 pacientes “habilidad para participar en actividades sociales anteriores” y 1 paciente “habilidad para disfrutar actividades recreativas anteriores” (Ver Tabla 4).
TABLA 4. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC), a los seis meses del evento traumático, según Cuestionario “Rivermead” para el seguimiento a los pacientes con Daño Cerebral Traumático (DCT). Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.
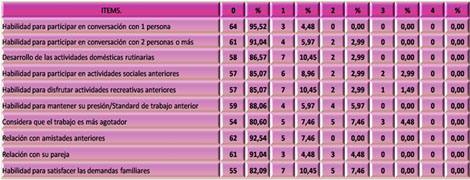
Respecto a la incorporación al trabajo, una revisión llevada a cabo por Binder sobre 17 estudios con 2.600 personas de ocho países occidentales, señala que entre el 66 y el 86% de los pacientes con síndrome postconmocional se reincorporaron al trabajo en el primer año, aunque el autor reconoce las limitaciones de estos datos, pues en algunos de los estudios incluidos no se eliminaron aquellos individuos que presentaban además otras limitaciones como, por ejemplo, secuelas motoras (186).
CONCLUSIONES
· La mayoría de los pacientes correspondieron al sexo masculino en todos los grupos de edades y más de la tercera parte de los pacientes tenían edades comprendidas entre los 21 y 39 años.
· La ocupación de casi la mitad de la población estudiada era trabajadora y las dos terceras partes acudió a los servicios médicos entre 25 y 48 después de ocurrido el evento traumático.
· La mayor parte de los eventos traumáticos ocurrieron entre los días viernes, sábado y domingo, con mayor incidencia el día sábado. Los traumatismos se comportaron con picos de incidencia a lo largo del año que coincidió con los meses donde hay periodos vacacionales: febrero (carnaval), abril (semana santa), desde junio a septiembre (vacaciones escolares), diciembre (navidad y fin de año)
· El principal mecanismo fisiopatológico fue el de aceleración/desaceleración en casi la mitad de los pacientes, y la circunstancia mayormente asociada fue los accidentes de tránsito en más de la mitad de los casos.
· Casi la totalidad de los pacientes obtuvo valores en la Escala de Coma de Glasgow de 15 puntos en la primera consulta, y a la totalidad se le realizó radiografía de cráneo. A los tres meses de seguimiento, más de la tercera parte de había realizado Tomografía Axial Computarizada de cráneo.
· En la evaluación inicial de los pacientes, según el CRSPC-3, los síntomas más frecuentes fueron la cefalea, seguida de los mareos y por último las nauseas y/o vómitos, y la mayoría de los pacientes los valoró como “un problema moderado” o “grave”. Según el CRSPC-13, fue “se siente olvidadizo o con poca memoria” el más valorado, aunque todos los síntomas de este grupo obtuvieron ponderaciones entre 0 y 2.
· En la evaluación a los tres meses, según el CRSPC-3, fue la cefalea el síntoma más valorado, aunque con ponderaciones entre 0 y 2 junto con los otros dos síntomas. No hubo variación entre los síntomas del grupo CRSPC-13.
· Las lesiones asociadas más frecuentes fueron el síndrome del latigazo cervical en casi una quinta parte de los pacientes, seguido de las heridas epicraneales.
· A los seis meses del evento traumático, casi la totalidad de los pacientes tenían una buena recuperación según la Escala Evolutiva de Glasgow, y valoraron con puntuaciones entre 0 y 2 o sea “sin cambios”, “sin cambios, pero con más dificultad” y “con cambios ligeros” todos los ítems del Cuestionario Rivermead para el seguimiento de estos pacientes en su integración social.
RECOMENDACIONES
· Investigar la correspondencia del diagnóstico de los pacientes con Síndrome Postconmocional utilizando los criterios del CIE-10 y los del DSM-IV.
· Realizar estudios de seguimiento de pacientes con Daño Cerebral Traumático Ligero y Síndrome Postconmocional en periodos de tiempo mayores.
ANEXO 1. PLANILLA DE CONSENTIMIENTO INFORMADO
Estimado paciente, estamos realizando una investigación con el objetivo de conocer el comportamiento del Daño Cerebral Traumático Ligero y del Síndrome Postconmocional en el Área de Salud de “La Gran Colombia” de la Parroquia Santa Rosalía.
Para lograr la misma, después que usted ha recibido una atención médica integral en la consulta de emergencias del Centro Médico de Diagnóstico Integral, y se le ha explicado a profundidad su padecimiento y esclarecido sus dudas, si usted está de acuerdo, se procederá a registrar, en una ficha, una serie de datos socio demográficos, epidemiológicos y clínicos sobre usted y su enfermedad.
Asimismo, se le aplicará un cuestionario llamado “Rivermead”, para conocer si ha experimentado una serie de síntomas que pudieran relacionarse con el evento traumático que ha sufrido.
Es necesario que a los tres y seis meses regrese a este centro de salud para realizarle una consulta de seguimiento que tendrá los mismos fines y elementos. Esta consulta será convenida previamente por teléfono, y de no ser posible su asistencia, será necesario que por esta vía responda algunas preguntas relacionadas con la evolución de su enfermedad, que incluye el cuestionario “Rivermead” nuevamente.
En todo momento se guardará confidencialidad de sus datos personales y clínicos siguiendo los principios del secreto profesional. Los datos de esta investigación sólo se usarán con fines científicos.
Si está de acuerdo en participar en esta investigación debe firmar este documento. Muchas gracias.
Nombres y Apellidos del Paciente: ________________________________________
Firma: __________________
Fecha:
ANEXO 2. FICHA DE RECOLECCIÓN DE DATOS
Fecha:
Nombres y Apellidos: ___________________________________________________
Números de Teléfonos Fijo/Móvil: ______________________________________
Edad: _____ Sexo: _____ Ocupación: ____________________________________
Tiempo de Transcurrido el Evento (en horas): _____________________
Día de la semana en que ocurrió el trauma: _______________
Mes del año en que ocurrió el trauma: ____________________
Datos relacionados con mecanismo del trauma:
Trauma directo en la cabeza con cabeza fija y objeto en movimiento: _____
Trauma directo en la cabeza con cabeza en movimiento y objeto fijo: _____
Trauma directo en la cabeza con cabeza y objeto en movimiento: _____
Sin trauma directo en la cabeza (aceleración/desaceleración): _____
Datos relacionados con circunstancias del trauma:
Accidente de tránsito: _____
Accidente en el hogar (no relacionados con violencia): _____
Accidente en el trabajo: _____
Accidente en el colegio/liceo/universidad: _____
Eventos traumáticos relacionados con la violencia doméstica: _____
Eventos traumáticos relacionados con violencia fuera del hogar: _____
Escala de Coma de Glasgow: _____
Datos relacionados con los medios diagnósticos 1ra consulta:
Radiografía Simple de Cráneo (AP, Lateral o Towne): ____________________
Tomografía Axial Computarizada (TAC): ________________________________
Imágenes de Resonancia Magnética (IRM): _______________________________
Otros: _________________________________________________________________
Datos relacionados con los medios diagnósticos seguimiento a los 3 meses:
Radiografía Simple de Cráneo (AP, Lateral o Towne): ______________________
Tomografía Axial Computarizada (TAC): __________________________________
Imágenes de Resonancia Magnética (IRM): ________________________________
Otros: ___________________________________________________________________
Otras lesiones asociadas al trauma:
Herida epicraneal: Si _____ No _____
Hematoma subgaleal: Si _____ No _____
Hematoma subperióstico: Si _____ No _____
Síndrome del latigazo cervical: Si _____ No _____
Otras: ________________________________________
Escala Evolutiva de Glasgow:
Buena Recuperación (BR): ____
Moderadamente Discapacitado (MD): ____
Severamente Discapacitado (SD): ____
Vegetativo (V): ____
Muerto (M): ____
ANEXO 3. CUESTIONARIO “RIVERMEAD” PARA SÍNTOMAS POST-CONMOCIONALES.
Estimado paciente. Después de un trauma craneal o accidente, algunas personas experimentan síntomas que pueden causar preocupaciones o problemas. Nos gustaría conocer si usted sufre de alguno de los síntomas mencionados a continuación. Como muchos de ellos ocurren a veces normalmente y no relacionados con eventos traumáticos, nos gustaría que usted comparara la presencia de los mismos ahora con los que pudo tener antes del evento. En cada caso, por favor circule el número más cercano a su apreciación de respuesta, como se muestra a continuación. Los fines de estos datos ya le han sido explicados en el documento de consentimiento informado. Muchas gracias por su colaboración.
0 = Nunca los he experimentado.
1 = No lo considero un problema.
2 = Lo considero un problema leve.
3 = Lo considero un problema moderado.
4 = Lo considero un problema grave.
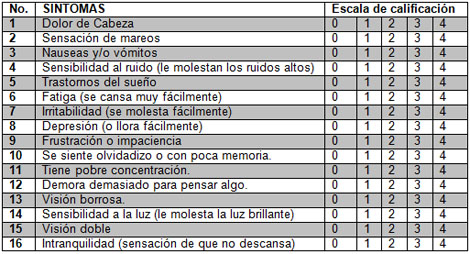
¿Padece usted algún otro síntoma o dificultad? Por favor especifíquelo a continuación y valórelo como hizo anteriormente. Gracias.
Tomado de: King NS, Crawford S, Wenden FJ, Moss NEG, Wade DT. The Rivermead Post Concussion Symptoms Questionnaire: a measure of symptoms commonly experienced after head injury and its reliability. Journal of Neurology 1995; 242: 587-592.
ANEXO 4. ESCALA DE COMA DE GLASGOW
A. Apertura ocular
4 – Espontánea (ojos abiertos, no necesariamente despierto)
3 – Ante orden (respuesta no específica, no necesariamente ante comandos)
2 – Ante dolor (dolor por estímulo en el esternón, miembros superiores, presión supraorbitaria)
1 – Ninguna (incluso por presión supraorbitaria)
B. Respuesta verbal
5 – Orientado (está orientado y conversa)
4 – Confundido (conversa pero confundido y/o desorientado)
3 – Inapropiado (es inteligible pero no logra expresar oraciones completas)
2 – Ininteligible (sonidos que no llegan a ser lenguaje)
1 – Ninguno (no existe verbalización de ningún tipo)
C. Respuesta motora
6 – Obedece órdenes (es capaz de seguir comandos simples)
5 – Localiza el dolor (trata de evitar la presión esternal o supraorbitaria)
4 – Retira el miembro (retira los brazos ante el dolor, abduce los hombros)
3 – Flexión anormal (ante estímulos dolorosos o espontáneamente adopta una postura en decorticación)
2 – Extensión anormal (ante estímulos dolorosos o espontáneamente adopta una postura en descerebración)
1 – Ninguna (ante cualquier estímulo, incluidos los dolorosos; los miembros inferiores permanecen fláccidos)
Tomado de: Teasdale G, Jennett B. Assessment of coma and impaired consciousness. A practical scale. The Lancet 1974; 2(7872): 81-84.
ANEXO 5. ESCALA EVOLUTIVA DE GLASGOW
Definición de términos:
Buena Recuperación (BR): El paciente regresa a su nivel de funcionamiento pre-trauma.
Moderadamente Discapacitado (MD): Hay déficit neurológico pero el paciente es capaz de autocuidarse.
Severamente Discapacitado (SD): El paciente es incapaz de autocuidarse.
Vegetativo (V): No hay evidencias de funciones mentales superiores.
Muerto (M).
Tomado de: Jennett B, Bond M. Assessment of outcome after severe brain damage: A practical scale. The Lancet 1975; l: 480-484.
ANEXO 6. CUESTIONARIO RIVERMEAD PARA EL SEGUIMIENTO A LOS PACIENTES CON DAÑO CEREBRAL TRAUMÁTICO.
Estimado paciente. Después de un trauma craneal o accidente, algunas personas experimentan síntomas que pueden causar preocupaciones o problemas. Nos gustaría conocer si usted presenta algunas de las dificultades que se listan a continuación. Al igual que con los cuestionarios anteriores, nos gustaría que usted comparara la presencia de los mismos ahora con los que pudo tener antes del evento. En cada caso, por favor circule el número más cercano a su apreciación de respuesta, como se muestra a continuación. Los fines de estos datos ya le han sido explicados en el documento de consentimiento informado. Muchas gracias por su colaboración.
0 = Sin cambios.
1 = Sin cambios, pero con más dificultad.
2 = Con cambios ligeros.
3 = Con cambios moderados.
4 = Con cambios muy marcados.
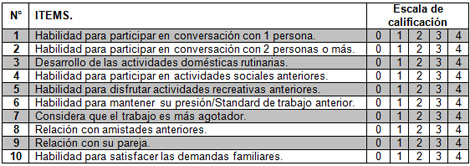
¿Padece usted algún otro síntoma o dificultad? Por favor especifíquelo a continuación y valórelo como hizo anteriormente. Gracias.
Tomado de Crawford C, Wenden FJ, Wade DT. The Rivermead head injury follow up questionnaire: a study of a new rating scale and other measures to evaluate outcome after head injury. Journal of Neurology Neurosurgery and Psychiatry 1996; 60: 510-514.
ANEXO 7. TABLAS UTILIZADAS COMO FUENTES DE LOS GRÁFICOS DE LA INVESTIGACIÓN.
Tabla 5. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según ocupación. Parroquia Santa Rosalía. Caracas. Enero
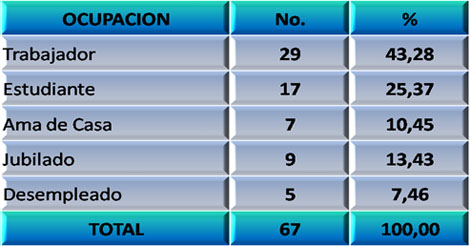
Tabla 6. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según tiempo transcurrido entre el evento traumático y la primera asistencia médica. Parroquia Santa Rosalía. Caracas. Enero

Tabla 7. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según día de la semana en que ocurrió el evento traumático. Parroquia Santa Rosalía. Caracas. Enero
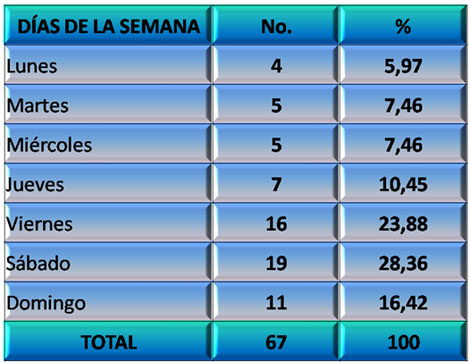
Tabla 8. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según mes del año en que ocurrió el evento traumático. Parroquia Santa Rosalía. Caracas. Enero
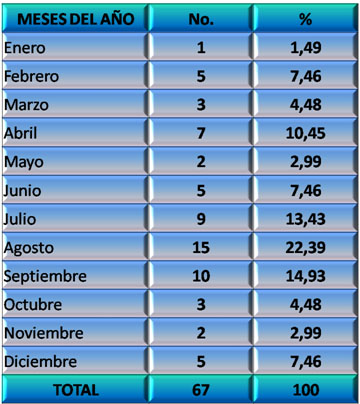
Tabla 9. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según mecanismo de producción del evento traumático. Parroquia Santa Rosalía. Caracas. Enero 2007 a enero de 2009.

Tabla 10. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según circunstancias en las que se produjo el evento traumático. Parroquia Santa Rosalía. Caracas. Enero

Tabla 11. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según puntuación de la Escala de Coma de Glasgow. Parroquia Santa Rosalía. Caracas. Enero
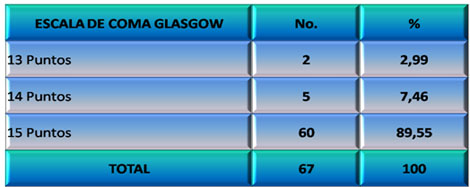
Tabla 12. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según medios de diagnóstico utilizados al inicio y a los tres meses de seguimiento. Parroquia Santa Rosalía. Caracas. Enero
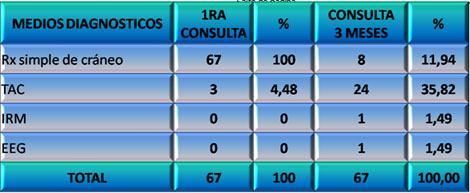
Tabla 13. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según otras lesiones asociadas. Parroquia Santa Rosalía. Caracas. Enero
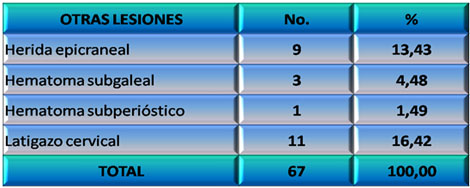
Tabla 14. Distribución de los pacientes con Daño Cerebral Traumático Ligero (DCTL) y Síndrome Postconmocional (SPC) según su evolución a los 6 meses del evento traumático a través de la Escala Evolutiva de Glasgow. Parroquia Santa Rosalía. Caracas. Enero
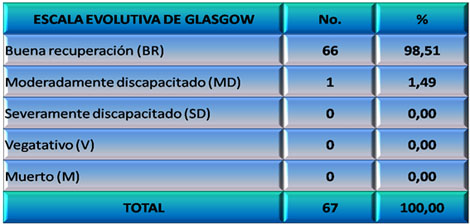
REFERENCIAS BIBLIOGRÁFICAS
1. Pereira Riverón R, Fernández Benítez SA, de Jongh Cobo E, Menéndez Ramírez D, Roig Fabré E. Médicos de la Familia ante los traumatismos del Sistema Nervioso: ¿Pueden disminuir la mortalidad? Rev Cubana Med Gen Integr 1998; 14 (5): 504 – 509.
2. Arciniegas DB, Anderson CA, Topkoff J, McAllister TW. Mild traumatic brain injury: a neuropsychiatric approach to diagnosis, evaluation, and treatment. Neuropsychiatric Disease and Treatment 2005; 1(4): 311–327.
3. Langlois JA, Rutland-Brown W, Thomas KE. Traumatic brain injury in the United States: emergency department visits, hospitalizations, and deaths. Atlanta: Centers for Disease Control and Prevention, National Center for Injury Prevention and Control; 2004.
4. Finkelstein EA, Corso PS, Miller TR. The incidence and economic burden of injury in the United States. New York: Oxford Univ Pr; 2006.
5. Gómez González J, Briceño-Iragorry L. Trepanaciones históricas y prehistóricas en Venezuela. Gac Méd Caracas 2007; 115(4): 1-8.
6. Krivoy A, Krivoy J, Krivoy M. Aspectos neuroquirúrgicos parciales del Papiro de Edwin Smith. Gac Méd Caracas 2002; 110 (3): 1-9.
7. Broca P. Sur l’age des sujets a la trépanation chirurgicale néolithique. Bull Soc Antrop (Paris) 1876; 11: 338.
8. Gorman I. Naselinie Ukrainy epokhu Mezolita i Neolita, Moscú: Grana F. Rocca Editores Gran-Al; 1966.
9. Celsus, Aulus Cornelius. De Medicina. Cambridge, Mass: Harvard University Press; 1935-1938.
10. Acosta Ortiz P. Caso de compresión general tratado por craneotomía. Gac Méd Caracas 1893; 1(8): 61-63.
11. Razetti L. Herida penetrante del cráneo por arma blanca. Gac Méd Caracas 1898; 6: 64.
12. Razetti L. Traumatismo craneocerebral. Gac Méd Caracas 1924; 31: 68-69.
13. Peña S. Perspectivas de la Accidentalidad Vial en el Mapa Epidemiológico de Venezuela. 2004
14. Cassidy JD, Carroll LJ, Peloso PM, Borg J, von Holst H, Holm L, Kraus J, Coronado VG. Incidence, risk factors and prevention of mild traumatic brain injury: results of the WHO Collaborating Centre Task Force on Mild Traumatic Brain Injury. Journal of Rehabilitation Medicine 2004: 28-60.
15. Sterr A, Herron KA, Hayward C, Montaldi D. Are mild head injuries as mild as we think? Neurobehavioral concomitants of chronic post-concussion syndrome. BMC Neurology 2006; 6: 7.
16. Mild Traumatic Brain Injury Committee, Head Injury Interdisciplinary Special Interest Group, American Congress of Rehabilitation Medicine. Definition of mild traumatic brain injury. J Head Trauma Rehabil 1993; 8(3): 86-8.
17. Giannone Tortolero AE, Morillo Castro JL, Castro Rodríguez MJ, Olivera Ventura ML. Traumatismo craneal cerrado menor: manejo inicial y tratamiento: Hospital Universitario Dr. Alfredo Van Grieken Coro. Arch Venez Pueric Pediatr 2006; 69(3): 108-112.
18. Hernández Trujillo EA, Caltagirone R. Hallazgos electrocardiográficos en pacientes con trauma craneoencefálico en el Hospital Universitario de Los Andes de Mérida, Venezuela. 2002 [Internet] [Revisado: 15/07/2009] Disponible en: http://www. biblioteca. universia. net/irA Recurso. do?page =http%3ª %2F%2F platon. serbi. ula.ve %2Fli brum%2Fl ibrum_ula% 2Fver.php %3Fndoc %3D223 773& id=37759340
19. Mendoza D, Rojas V, Larocca N, Pereda Y. Pseudotumor cerebral como complicación de traumatismo craneoencefálico: presentación de un caso clínico. Bol Hosp. Niños J. M. de los Ríos 2002; 38(3): 39-42.
20. Rivero I, Seco L. Traumatismos Craneoencefálicos. [Internet] [Revisado: 15/07/2009] Disponible en: http://www. reu medunal. edu.co/ revista fm
21. Azpurua Eraso L. Traumatismos craneoencefálicos en niños. [Internet] [Revisado: 15/07/2009] Disponible en: (Buscar vínculo)
22. Cushman JG, Agarwal N, Fabian TC, Garcia V, Nagy KK, Pasquale MD, et al. Practice Management Guidelines for the Management of Mild Traumatic Brain Injury: The East Practice Management Guidelines Work Group; 2003.
23. National Center for Injury Prevention and Control. Centers for Disease Control and Injury Prevention: Report to Congress on Mild Traumatic Brain Injury in the United States: Steps to Prevent a Serious Public Health Problem. Centers for Disease Control and Prevention. Atlanta, GA; 2003.
24. Levin HS, Mattis S, Ruff RM, Eisenberg HM, Marshall LF, Tabaddor K, High WM Jr, Frankowski RF. Neurobehavioral outcome following minor head injury: a three-center study. Journal of Neurosurgery 1987; 66: 234-243.
25. Iverson GL. Outcome from mild traumatic brain injury. Curr Opin Psychiatry 2005; 18:301-17.
26. Schretlen DJ, Shapiro AM. A quantitative review of the effects of traumatic brain injury on cognitive functioning. Int Rev Psychiatry 2003; 15: 341-9.
27. Belanger HG, Curtiss G, Demery JA, Lebowitz BK, Vanderploeg RD. Factors moderating neuropsychological outcomes following mild traumatic brain injury: a meta-analysis. J Int Neuropsychol Soc 2005; 11: 215-27.
28. Binder LM, Rohling ML, Larrabee J. A review of mild head trauma. Part I: Meta-analytic review of neuropsychological studies. Journal of Clinical and Experimental Neuropsychology 1997; 19: 421-431.
29. Dikmen S, McLean A, Temkin N. Neuropsychological and psychosocial consequences of minor head injury. Journal of Neurology, Neurosurgery, and Psychiatry 1986; 49: 1227-1232.
30. Dikmen S, Machamer J, Temkin N. Mild head injury: facts and artifacts. J Clin Exp Neuropsychol 2001; 23: 729-38.
31. Dikmen SS, Machamer JE, Winn HR, Temkin NR. Neuropsychological outcome at 1-year post head injury. Neuropsychology 1995; 9: 80-90.
32. Blostein P, Jones SJ. Identification and evaluation of patients with mild traumatic brain injury: results of a national survey of level I trauma centers. J Trauma 2003; 55: 450-3.
33. Ruff RM, Jurica P. In search of a unified definition for mild traumatic brain injury. Brain Inj 1999; 13: 943-52.
34. Esselman PC, Uomoto JM. Classification of the spectrum of mild traumatic brain injury. Brain Inj 1995; 9: 417-24.
35. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 4th ed. Text revision. Washington (DC): APA; 2000.
36. Rimel RW, Giordani B, Barth JT, Boll TJ, Jane JA. Disability caused by minor head injury. Neurosurgery 1981; 9: 221-8.
37. Tellier A, Della Malva LC, Cwinn A, Grahovac S, Morrish W, Brennan-Barnes M. Mild head injury: a misnomer. Brain Inj 1999; 13: 463-75.
38. Rutherford WH. Postconcussion symptoms: relationship to acute neurological indices, individual differences, and circumstances of injury. In: Levin HS, Eisenberg HM, Benton AL, editors. Mild head injury. New York: Oxford Univ Pr; 1989. p. 217-28.
39. Ingebrigtsen T, Waterloo K, Marup-Jensen S, Attner E, Romner B. Quantification of post-concussion symptoms 3 months after minor head injury in 100 consecutive patients. Journal of Neurology 1998; 245: 609-612.
40. Erichsen JD. On concussion of the spine, nervous shock and other obscure injuries to the nervous system. Baltimore: William Wood & Co; 1886.
41. Jones E, Fear NT, Wessely S. Shell Shock and Mild Traumatic Brain Injury: A Historical Review. Am J Psychiatry 2007; 164: 1641–1645.
42. Amat E. Estudio clínico de los síndromes depresivos postraumáticos. Revisión de 50 casos. Rev Esp Oto-Neuro-Oftalmología y Neurocirugía 1967; XXVI: 112-37.
43. Mott FW. Special discussion on shell shock without visible signs of injury. Proc R Soc Med 1916; 9: i–xxiv.
44. Mott FW. The microscopic examination of the brains of two men dead of commotion cerebri (shell shock) without visible external injury. BMJ 1917; 2: 612–615.
45. Myers CS. A contribution to the study of shell shock. Lancet 1915; 1: 316–320.
46. Salmon TW. The care and treatment of mental diseases and war neuroses (“shell shock”) in the British army. Ment Hyg 1917; 1: 509–547.
47. Turner WA. Cases of nervous and mental shock observed in the base hospitals in France. J R Army Med Corps 1915; 24: 343–352.
48. Sloggett A. Director General of Army Medical Services War Diary. UK National Archives, WO95/45, Nov 25; 1916.
49. Shephard B. “Pitiless psychology”: the role of prevention in British military psychiatry in the Second World War. Hist Psychiatry 1999; 10: 491–542.
50. Schaller WF: After-effects of head injury, the post-traumatic concussion state, and the post-traumatic psychoneurotic state. JAMA 1939; 113: 1779–1785.
51. Watson MR, Fenton GW, McClelland RJ, Lumsden J, Headley M, Rutherford WH. The postconcussional state: neurophysiological aspects. Br J Psychiatry 1995; 167: 514-21.
52. Boake C, McCauley SR, Levin HS, Pedroza C, Contant CF, Song JX, et al. Diagnostic Criteria for Postconcussional Syndrome After Mild to Moderate Traumatic Brain Injury. J Neuropsychiatry Clin Neurosci 2005; 17 (3): 350 – 356.
53. World Health Organization: The ICD-10 Classification of Mental and Behavioral Disorders: Clinical Descriptions and Diagnostic Guidelines. Geneva, World Health Organization; 1992.
54. World Health Organization: The ICD-10 Classification of Mental and Behavioral Disorders: Diagnostic Criteria for Research. Geneva, World Health Organization; 1993.
55. Brown SJ, Fann JR, Grant I. Postconcussional disorder: time to acknowledge a common source of neurobehavioral morbidity. J Neuropsychiatry Clin Neurosci 1994; 6: 15-22.
56. American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition. Washington, DC, American Psychiatric Association; 1994.
57. Werner C, Engelhard K. Pathophysiology of Traumatic Brain Injury. British Journal of Anaestesia 2007; 99(1): 4-9.
58. Shaw NA. The neurophysiology of concussion. Progress in Neurobiology 2002; 67: 281–344.
59. Bayly PV, Cohen TS, Leister EP, Ajo D, Leuthardt E, Genin GM. Deformation of the human brain induced by mild acceleration. J Neurotrauma. 2005 August; 22(8): 845–856.
60. Pudenz RH, Shelden CH. The Lucite calvarium – a method for direct observation of the brain. Journal of Neurosurgery 1946; 3: 487–505.
61. Graham DI, Adams JH, Nicoll JAR, Maxwell WL, Gennarelli TA. The nature, distribution and causes of traumatic brain injury. Brain Pathology 1995; 5: 397–406.
62. Holbourn AHS. The mechanics of head injuries. Lancet 1943: 438–441.
63. Levi L, Guilburd JN, Lemberger A, Soustiel JF, Feinsod M. Diffuse axonal injury: analysis of 100 patients with radiological signs. Neurosurgery 1990; 27: 429-432.
64. Christman CW, Grady MS, Walker SA, Holloway KL, Povlishock JT. Ultrastructural studies of diffuse axonal injury in humans. Journal of Neurotrauma 1994; 11: 173-186.
65. Stone JR, Singleton RH, Povlishock JT. Intra-axonal Neurofilament Compaction Does Not Evoke Local Axonal Swelling in all Traumatically Injured Axons. Experimental Neurology 2001; 172: 320-331.
66. Yaghmai A, Povlishock J. Traumatically induced reactive change as visualized through the use of monoclonal antibodies targeted to neurofilament subunits. Journal of Neuropathology and Experimental Neurology 1992; 51: 158-176.
67. Povlishock JT. Traumatically induced axonal injury: pathogenesis and pathobiological implications. Brain Pathol 1992; 2: 1–12.
68. Povlishock JT. Pathophysiology of neural injury: therapeutic opportunities and challenges. Clin Neurosurg 2000; 46:113–26.
69. Povlishock JT, Becker DP, Cheng CL. Axonal change in minor head injury. J Neuropathol Exp Neurol 1983; 42: 225–42.
70. Povlishock JT, Becker DP, Miller JD. The morphopathologic substrates of concussion? Acta Neuropathol (Berl) 1979; 47: 1–11.
71. Povlishock JT, Christman CW. The pathobiology of traumatically induced axonal injury in animals and humans: a review of current thoughts. J Neurotrauma 1995; 12: 555–64.
72. Povlishock JT, Jenkins LW. Are the pathobiological changes evoked by traumatic brain injury immediate and irreversible? Brain Pathol 1995; 5: 415–26.
73. Obrenovitch TP, Urenjak J. Is high extracellular glutamate the key to excitotoxicity in traumatic brain injury? J Neurotrauma 1997; 14: 677–98.
74. Arciniegas DB. The cholinergic hypothesis of cognitive impairment caused by traumatic brain injury. Curr Psychiatry Rep 2003; 5: 391–9.
75. Dikranian K, Cohen R, Mac Donald C, Pan Y, Brakefield D, Bayly P, et al. Mild traumatic brain injury to the infant mouse causes robust white matter axonal degeneration which precedes apoptotic death of cortical and thalamic neurons. Exp Neurol 2008 June; 211(2): 551–560.
76. Bramlett HM, Dietrich WD. Pathophysiology of cerebral ischemia and brain trauma: similarities and differences. J Cereb Blood Flow Metab 2004; 24: 133–50.
77. DeWitt DS, Prough D. Traumatic cerebral vascular injury: the effects of concussive brain injury on the cerebral vasculature. J Neurotrauma 2003; 20: 795–825.
78. Rodriguez-Baeza A, Reina-De La Torre F, Poca A, Marti M, Garnacho A. Morphological features in human cortical brain microvessels after head injury: a three-dimensional and immunocytochemical study. Anat Rec Part A 2003; 273A: 583–93.
79. McIntosh TK, Smith DH, Meaney DF, Kotapka MJ, Gennarelli TA, Graham DI. Neuropathological sequelae of traumatic brain injury: relationship to neurochemical and biochemical mechanisms. Lab Invest 1996; 74: 315–42.
80. Scremin OU, Jenden DJ. Cholinergic modulation of cerebral cortical blood flow changes induced by trauma. J Neurotrauma 1997; 14: 573–86.
81. Armstead WM. Differential activation of ERK, p38, and JNK MAPK by nociceptin/orphanin FQ in the potentiation of prostaglandin cerebrovasoconstriction after brain injury. Eur J Pharmacol 2006; 529: 129–35.
82. Cunningham AS, Salvador R, Coles JP,. Physiological thresholds for irreversible tissue damage in contusional regions following traumatic brain injury. Brain 2005; 128: 1931–42.
83. Kelly DF, Korndestani RK, Martin NA. Hyperemia following traumatic brain injury: relationship to intracranial hypertension and outcome. J Neurosurg 1996; 85: 762–71.
84. Langfitt TW, Weinstein JD, Kassell NF. Cerebral vasomotor paralysis produced by intracranial hypertension. Neurology 1965; 15: 622–41.
85. Martin NA, Patwardhan RV, Alexander MJ. Characterization of cerebral hemodynamic phases following severe head trauma: hypoperfusion, hyperemia, and vasospasm. J Neurosurg 1997; 87: 9–19.
86. Sakas DE, Bullock MR, Patterson J, Hadley D, Wyper DJ, Teasdale GM. Focal cerebral hyperemia after focal head injury in humans: a benign phenomenon? J Neurosurg 1995; 83: 277–84.
87. Kelly DF, Martin NA, Kordestani R. Cerebral blood flow as a predictor of outcome following traumatic brain injury. J Neurosurg 1997; 86: 633–41.
88. Tavazzi B, Signoretti S, Lazzarino G. Cerebral oxidative stress and depression of energy metabolism correlate with severity of diffuse brain injury in rats. Neurosurgery 2005; 56: 582–9.
89. Verweij BH, Muizelaar JP, Vinas F, Peterson PL, Xiong Y, Lee CP. Impaired cerebral mitochondrial function after traumatic brain injury in humans. J Neurosurg 2000; 93: 815–20.
90. Bullock R, Zauner A, Woodward JJ. Factors affecting excitatory amino acid release following severe human head injury. J Neurosurg 1998; 89: 507–18.
91. Robertson CS, Bell MJ, Kochanek PM, et al. Increased adenosine in cerebrospinal fluid after severe traumatic brain injury in infants and children: association with severity of injury and excitotoxicity. Crit Care Med 2001; 29: 2287–3393.
92. Floyd CL, Gorin FA, Lyeth BG. Mechanical strain injury increases intracellular sodium and reverses Naþ/Ca2þ exchange in cortical astrocytes. Glia 2005; 51: 35–46.
93. Yi JH, Hazell AS. Excitotoxic mechanisms and the role of astrocytic glutamate transporters in traumatic brain injury. Neurochem Intern 2006; 48: 394–403.
94. Obrenovitch TP, Urenjak J. Is high extracellular glutamate the key to excitotoxicity in traumatic brain injury? J Neurotrauma 1997; 14: 677–98.
95. Bayir H, Kagan VE, Borisenko GG. Enhanced oxidative stress in iNOS-deficient mice after traumatic brain injury: support for a neuroprotective role of iNOS. J Cereb Blood Flow Metab 2005; 25: 673– 4.
96. Chong ZZ, Li F, Maiese K. Oxidative stress in the brain: novel cellular targets that govern survival during neurodegenerative disease. Prog Neurobiol 2005; 75: 207–46.
97. Shao CX, Roberts KN, Markesbery WR, Scheff SW, Lovell MA. Oxidative stress in head trauma in aging. Free Radic Biol Med 2006; 41: 77–85.
98. Povlishock JT, Becker DP. Fate of reactive axonal swellings induced by head injury. Lab Invest 1985; 52: 540–552.
99. Pettus EH, Christman CW, Giebel ML. Traumatically induced altered membrane permeability: its relationship to traumatically induced reactive axonal change. J Neurotrauma 1994; 11: 507–522.
100. Blumbergs PC, Scott G, Manavis J. Topography of axonal injury as defined by amyloid precursor protein and the sector scoring method in mild and severe closed head injury. J Neurotrauma 1995; 12: 565–572.
101. Adams JH, Doyle D, Ford I. Diffuse axonal injury in head injury: definition, diagnosis and grading. Histopathology 1989; 15: 49–59.
102. Choi DW. Ischemia-induced neuronal apoptosis. Curr Opin Neurobiol 1996; 6: 667–72.
103. Eldadah BA, Faden AI. Caspase pathways, neuronal apoptosis, and CNS injury. J Neurotrauma 2000; 17: 811–29.
104. Chamelian L, Reis M, Feinstein A. Six-month recovery from mild to moderate Traumatic Brain Injury: the role of APOE-e4 allele. Brain Advance Access published October 20, 2004.
105. Friedman G, Froom P, Sazbon L, Grinblatt I, Schochina M, Tsenter J. Apolipoprotein E-ɛ4 genotype predicts a poor outcome in survivors of traumatic brain injury. Neurology 1999; 52: 244–8.
106. Crawford FC, Vanderploeg RD, Freeman MJ, Singh S, Waisman M, Michaels L. APOE genotype influences acquisition and recall following traumatic brain injury. Neurology 2002; 58: 1115–18.
107. Teasdale GM, Nicoll JA, Murray G, Fiddes M. Association of apolipoprotein E polymorphism with outcome after head injury. Lancet 1997; 350: 1069–71.
108. Lichtman SW, Seliger G, Tycko B, Marder K. Apolipoprotein E and functional recovery from brain injury following postacute rehabilitation. Neurology 2000; 55: 1536–9.
109. Chiang MF, Chang JG, Hu CJ. Association between apolipoprotein E genotype and outcome of traumatic brain injury. Acta Neurochir (Wien) 2003; 145: 649–54.
110. Jordan BD, Relkin NR, Ravdin LD. Apolipoprotein E e4 associated with chronic traumatic brain injury in boxing. JAMA 1997; 278: 136–40.
111. Nathoo N, Chetty R, van Dellen JR. Genetic vulnerability following traumatic brain injury: the role of apolipoprotein E. Mol Pathol 2003; 56: 132–6.
112. Arciniegas DB, Topkoff JL, Filley CM. Apolipoprotein-E4 in association with persistent neurophysiologic impairment after mild traumatic brain injury. J Neuropsychiatry Clin Neurosci 2003; 15: 276.
113. Rapoport M, Wolf U, Herrmann N, Kiss A, Shammi P, Reis M. Traumatic Brain Injury, Apolipoprotein E-e4, and Cognition in Older Adults: A Two-Year Longitudinal Study. J Neuropsychiatry Clin Neurosci 2008; 20 (1): 68-73.
114. Bell JD, Ai J, Chen Y, Baker AJ. Mild in vitro trauma induces rapid Glur2 endocytosis, robustly augments calcium permeability and enhances susceptibility to secondary excitotoxic insult in cultured Purkinje cells. Brain 2007; I30: 2528-2542.
115. Park E, McKnight S, Ai J, Baker AJ. Purkinje cell vulnerability to mild and severe forebrain head trauma. J Neuropathol Exp Neurol 2006; 65: 226–34.
116. Middleton FA, Strick PL. The cerebellum: an overview. Trends Neurosci 1998; 21: 367–9.
117. Middleton FA, Strick PL. Basal ganglia and cerebellar loops: motor and cognitive circuits. Brain Res Brain Res Rev 2000; 31: 236–50.
118. Manni E, Petrosini L. A century of cerebellar somatotopy: a debated representation. Nat Rev Neurosci 2004; 5: 241–9.
119. Middleton FA, Strick PL. Anatomical evidence for cerebellar and basal ganglia involvement in higher cognitive function. Science 1994; 266: 458–61.
120. Middleton FA, Strick PL. Cerebellar projections to the prefrontal cortex of the primate. J Neurosci 2001; 15: 700–12.
121. Petrosini L, Leggio MG, Molinari M. The cerebellum in the spatial problem solving: a co-star or a guest star? Prog Neurobiol 1998; 56: 191–210.
122. Lalonde R, Strazielle C. The effects of cerebellar damage on maze learning in animals. Cerebellum 2003; 2: 300–9.
123. Raghupathi R. Cell death mechanisms following traumatic brain injury. Brain Pathol 2004; 14: 215–222.
124. Butler TL, Kassed CA, Pennypacker KR. Signal transduction and neurosurvival in experimental models of brain injury. Brain Res Bull 2003; 59: 339–351.
125. Gaetz M. The neurophysiology of brain injury. Clin Neurophysiol 2004; 115: 4–18.
126. Dutton RP, McCunn M. Traumatic brain injury. Curr Opin Crit Care 2003; 9: 503–509.
127. Goldstein LB: Neuropharmacology of TBI-induced plasticity. Brain Inj 2003; 17: 685–694.
128. Rothman MS, Arciniegas DB, Filley CM, Wierman ME. The Neuroendocrine Effects of Traumatic Brain Injury. J Neuropsychiatry Clin Neurosci 2007; 19 (4): 363-372.
129. Moore BW. A soluble protein characteristic of the nervous system. Biochem Biophys Res Commun 1965; 19: 739-744.
130. Santamaria-Kisiel L, Rintala-Dempsey AC, Shaw GS. Calcium–dependent and –independent interactions of the S100 protein family. Biochem J 2006; 396: 201-214.
131. Sadaghat F, Notopoulos A. S100 protein family and its application in clinical practice. Hippokratia 2008; 12(4): 198-204.
132. Gerlach R, Demel G, Konig HG. Active secretion of S100B from astrocytes during metabolic stress. Neuroscience 2006; 141: 1697-1701.
133. de Boussard CN, Lundin A, Karlstedt D, Edman G, Bartfai A, Borg J. S100 and cognitive impairment after mild traumatic brain injury. J Rehabil Med 2005; 37: 53-57.
134. Biberthaler P, Linsenmeier U, Pfeifer KJ. Serum S-100B concentration provides additional information for the indication of computed tomography in patients after minor head injury: a prospective multicenter study. Shock 2006; 25: 446-453.
135. Muller K, Townend W, Biasca N. S100B serum level predicts computed tomography findings after minor head injury. J Trauma 2007; 62: 1452-1456.
136. Morochovi R, Racz O, Kitka M, Pingorov S, Cibur P, Tomkov D, et al. Serum S100B protein in early management of patients after mild traumatic brain injury. Eur J Neurol 2009 May 12. [Epub ahead of print].
137. Netto CB, Conte S, Leite MC. Serum S100B protein is increased in fasting rats. Arch Med Res 2006; 37: 683-686.
138. Kavesdi E, Lackl J, Bukovics P, Farkas O, Czeiter E, Szell D, et al. Update on protein biomarkers in traumatic brain injury with emphasis on clinical use in adults and pediatrics. Acta Neurochir (Wien) 2009 Aug 4. [Epub ahead of print].
139. Ruan S, Noyes K, Bazarian JJ. The economic impact of S-100B as a pre-head CT screening test on emergency department management of adult patients with mild traumatic brain injury. J Neurotrauma 2009 May 4. [Epub ahead of print].
140. Williams DH, Levin HS, Eisenberg HM. Mild head injury classification. Neurosurgery 1990; 27: 422–428.
141. Belanger HG, Vanderploeg RD, Curtiss G, Warden DL. Recent Neuroimaging Techniques in Mild Traumatic Brain Injury. J Neuropsychiatry Clin Neurosci 2007; 19 (1): 5-20.
142. Laatsch LK, Thulborn KR, Krisky CM. Investigating the neurobiological basis of cognitive rehabilitation therapy with fMRI. Brain Inj 2004; 18: 957–974.
143. Teasdale G, Jennett B. Assessment of coma and impaired consciousness. A practical scale. Lancet 1974 2: 81–84.
144. King NS, Crawford S, Wenden FJ, Moss NEG, Wade DT. The Rivermead Post Concussion Symptoms Questionnaire: a measure of symptoms commonly experienced after head injury and its reliability. J Neurol 1995; 242: 587-592.
145. Potter S, Leigh E, Wade D, Fleminger S. The Rivermead Post Concussion Symptoms Questionnaire: A Confirmatory factor analysis. J Neurol 2006; 253(12): 1603-1614.
146. Eyres S, Carey A, Gilworth G, Neumann V, Tennant A. Construct validity and reliability of the Rivermead Post Concussion Symptoms Questionnaire. Clinical Rehabilitation 2005; 19: 878-887.
147. Spitzer WO, Skovron ML, Salmi LR. Scientific monograph of then QTF on whiplash-associated disorders: redefining whiplash and its management. Spine 1995; 20(8S): 1-73.
148. Jennett B, Bond M. Assessment of outcome after severe brain damage: A practical scale. The Lancet 1975; l: 480-484.
149. Crawford C, Wenden FJ, Wade DT. The Rivermead head injury follow up questionnaire: a study of a new rating scale and other measures to evaluate outcome after head injury. Journal of Neurology Neurosurgery and Psychiatry 1996; 60: 510-514.
150. Sorenson S, Kraus J. Occurrence, severity and outcomes of brain injury. J Head Trauma Rehabil 1991; 6: 1–10.
151. Kraus JF, McArthur DL, Silberman TA. Epidemiology of mild brain injury. Semin Neurol 1994; 14: 1–7.
152. Sosin DM, Sacks JJ, Smith SM. Head injury-associated deaths in the United States from1979 to 1986. JAMA 1989; 262: 2251–55.
153. Cohen BA, Inglese M, Rusinek H, Babb JS, Grossman RI, Gonen O. Proton MR Spectroscopy and MRI-Volumetry in Mild Traumatic Brain Injury. Am J Neuroradiol 2007; 28: 907–13.
154. Schanberger M, Ponsford JL, Reutens D, Beare R, O'Sullivan R. The relationship between age, injury severity and MRI findings following traumatic brain injury. J Neurotrauma 2009 Jul 22. [Epub ahead of print]
155. Preiss-Farzanegan SJ, Chapman B, Wong TM, Wu J, Bazarian JJ. The relationship between gender and postconcussion symptoms after sport-related mild traumatic brain injury. PMR 2009 Mar; 1(3): 245-53.
156. Sumas ME, Narayan RK. Head Injury. In: Grossman RG, Loftus CM, eds. Principles of Neurosurgery. 2nd Ed. Philadelphia: Lippincott-Raven; 1999. p. 126-180.
157. Jacobson RR. The postconcussional syndrome: physiogenesis, psychogenesis and malingering. An integrative model. J Psychosom Res 1995; 39: 675-93.
158. Menegazzi JJ, Davis EA, Sucov AN, Paris PM. Reliability of the Glasgow Coma Scale when used by emergency physicians and paramedics. J Trauma 1993; 34: 46-48.
159. Norwood SH, McAuley CE, Berne JD, Vallina VL, Creath RG, McLarty J. A prehospital Glasgow Coma Scale score ≤ 14 accurately predicts the need for full trauma team activation and patient hospitalization after motor vehicle collisions. J Trauma 2002; 53: 503-507.
160. Jennet B, Teasdale G. Early assessment of impaired consciousness. In: Jennet B, Teasdale G, eds. Management of Head Injuries. 3rd ed. Philadelphia: FA Davis Co; 1981. p. 77-93.
161. Manessiez O, Aufort S, King JP, Menjot de Champfleur N, Benatia P, Taourel P. Indications du scanner cérébral chez les patients présentant un traumatisme crânien bénin. J Radiol 2007; 88: 567-71.
162. Kenichiro O, Kojiro W, Takahara T, Shirotani T. Indications for Computed Tomography in patients with mild head injury. Neurol Med Chir (Tokyo) 2007; 47: 291-298.
163. Borg J, Holm L, Cassidy JD. Diagnostic procedures in mild traumatic brain injury: results of the World Health Organization Collaborating Centre Task Force on mild traumatic brain injury. J Rehabil Med 2004; 43: S61–75.
164. Eisenberg HM, Levin HS. Computed tomography and magnetic resonance imaging in mild to moderate head injury, in Mild Head Injury. Edited by Levin HS, Eisenberg HM, Benton AL. New York: Oxford University Press; 1989. p. 133–141.
165. Jenkins A, Teasdale G, Hadley MD. Brain lesions detected by magnetic resonance imaging in mild and severe head injuries. Lancet 1986; 2: 445–446.
166. Levin HS, Amparo E, Eisenberg HM. Magnetic resonance imaging and computerized tomography in relation to the neurobehavioral sequelae of mild and moderate head injuries. J Neurosurg 1987; 66: 706–713.
167. Hofman PA, Stapert SZ, van Kroonenburgh MJ. MR imaging, single-photon emission CT, and neurocognitive performance after mild traumatic brain injury. Am J Neuroradiol 2001; 22: 441–449.
168. Hughes DG, Jackson A, Mason DL, et al: Abnormalities on magnetic resonance imaging seen acutely following mild traumatic brain injury: correlation with neuropsychological tests and delayed recovery. Neuroradiology 2004; 46: 550–558.
169. Hayes RL, Dixon CE. Neurochemical changes in mild head injury. Semin Neurol 1994; 14: 25–31.
170. Miller L. Neuropsychology and pathophysiology of mild head injury and the postconcussion syndrome: clinical and forensic considerations. J Cogn Rehabil 1996; 14: 8–23.
171. Povlishock JT, Coburn TH. Morphopathological change associated with mild head injury, in Mild Head Injury. Edited by Levin HS, Eisenberg HM, Benton AL. New York: Oxford University Press; 1989. p. 37–53.
172. Bigler ED. Neuropsychological results and neuropathological findings at autopsy in a case of mild traumatic brain injury. J Int Neuropsychological Soc 2004; 10: 794–806.
173. Oppenheimer DR. Microscopic lesions in the brain following head injury. J Neurol Neurosurg Psychiatry 1968; 31: 299–306.
174. Mittl RL, Grossman RI, Hiehle JF. Prevalence of MR evidence of diffuse axonal injury in patients with mild head injury and normal head CT findings. Am J Neuroradiol 1994; 15: 1583–1589.
175. Blumbergs PC, Scott G, Manavis J, Wainwright H, Simpson DA, McLean AJ. Staining of amyloid precursor protein to study axonal damage in mild head injury. Lancet 1994; 344: 1055-1056.
176. Gaetz M. The neurophysiology of brain injury. Clinical Neurophysiology 2004; 115: 4-18.
177. Umile EM, Sandel ME, Alavi A, Terry CM, Plotkin RC. Dynamic imaging in mild traumatic brain injury: support for the theory of medial temporal vulnerability. Archives of Physical Medicine and Rehabilitation 2002; 83: 1506-1513.
178. Blinman TA, Houseknecht E, Snyder C, Wiebe DJ, Nance ML. Postconcussive symptoms in hospitalized pediatric patients after mild traumatic brain injury. J Pediatr Surg 2009 Jun; 44(6): 1223-8.
179. McAllister TW. Mild traumatic brain injury and the postconcussive syndrome. In Silver JM, Yudofsky SC, Hales RE, eds. Neuropsychiatric of traumatic brain injury. Washington DC: American Psychiatric Press; 1994. p. 357-392.
180. Alexander MP. Mild traumatic brain injury: pathophysiology, natural history and clinical management. Neurology 1995; 45: 1253-60.
181. Pelegrín Valero C, Fernández Guinea S, Tirapu Ustarroz J, Muñoz Céspedes JM. Diagnóstico diferencial del síndrome posconmocional. Rev Neurol 2001; 32(9): 867-884.
182. Sigurdardottir S, Andelic N, Roe C, Jerstad T, Schanke AK. Post-concussion symptoms after traumatic brain injury at 3 and 12 months post-injury: a prospective study. Brain Inj 2009 Jun; 23(6): 489-97.
183. Vanderploeg RD, Belanger HG, Curtiss G. Mild traumatic brain injury and posttraumatic stress disorder and their associations with health symptoms. Arch Phys Med Rehabil 2009 Jul; 90(7): 1084-93.
184. Travis RL. Hyperextension and Hyperflexion Injuries of the Cervical Spine. In: Youmans JR, Becker DP, Dunsker SB, Friedman WA, Hoffman HJ, Smith RR, Wilson CB, Eds. Youmans Neurological Surgery. 4th ed. (CD-ROM)
185. Barret K, Buxton N, Redmond AD. A comparison of symptoms experienced following minor head injury and acute neck strain (whiplash injury). J Accid Emerg Med 1995; 12: 173-176.
186. Binder LM. A review of mild head trauma. Part II. Clinical implications. J Clin Exp Neuropsychology 1997; 19: 432-57.