Una mujer de 74 años ingresó en nuestro hospital para evaluación de cuadro constitucional, debilidad generalizada, y síndrome diarreico. Tenía larga historia de diabetes mellitas tipo 2 e hipertensión arterial. Durante su estancia hospitalaria se demostró marcada hipokaliemia de carácter refractario, colestasis y masa hepática. La actividad de renina plasmática basal, aldosteronemia y los valores de ACTH y cortisoluria mostraron criterios bioquímicos de síndrome de Cushing ACTH-dependiente.
Presentación de un caso: Síndrome de Cushing ectópico agudo secundario a carcinoma indiferenciado de la vía biliar.
Autores:
Dr. Saturnino Suárez Ortega. Medicina Interna.
Dr. Vielka Arango Guerra. Medicina Familiar y comunitaria.
Dra. Isadora Bermell Manglano. Digestivo.
Dr. Agustín Rey López. Anatomía Patológica.
Dr. José Miguel Sánchez Hernández. Medicina Interna.
Dr. Ruben Pestana. Radiología.
Dra. Belén Alonso Ortiz. Medicina Interna.
Dr. Pedro Betancor León. Medicina Interna.
Resumen:
Una mujer de 74 años ingresó en nuestro hospital para evaluación de cuadro constitucional, debilidad generalizada, y síndrome diarreico. Tenía larga historia de diabetes mellitas tipo 2 e hipertensión arterial. Durante su estancia hospitalaria se demostró marcada hipokaliemia de carácter refractario, colestasis y masa hepática. La actividad de renina plasmática basal, aldosteronemia y los valores de ACTH y cortisoluria mostraron criterios bioquímicos de síndrome de Cushing ACTH-dependiente.
Otros estudios hormonales relacionados con apudomas fueron negativos. Por biopsia guiada por eco de la masa hepática se demostró carcinoma altamente indiferenciado, y tras ello se procedió a realizar gammagrafía con octeótride y tratamiento combinado con ketoconazol y octeótride. Se logró el control de la diarrea pero no de la hipokaliemia. Se comenta la rareza del síndrome de Cushing ectópico agudo, con el dominio de manifestaciones bioquímicas frente a las clínicas, como expresión de un síndrome paraneoplásico vinculado de un modo preferente a neoplasias de índole neuroendocrina.
Abstract:
A 74-year-old woman was admitted in our hospital for evaluation of constitutional syndrome, generalizated weakness, and diarrhea. She had a long history of type 2 diabetes and arterial hypertension. During the hospital stage refractory hypokalemia, colestasis and hepatic mass were demonstrated. The activity basal plasmatic rennin and aldosteronemia were normal and an ACTH-dependent Cushing syndrome was confirmed. Other hormonal studies related to apudomas were negative. By biopsy guided by ultrasonic study of the hepatic mass showed an highly undifferentiated carcinoma. A gammagraphy with octeotride was negative. With treatment with ketoconazol and octeotride the cortisol and kalemia levels didn´t modify. The control of the diarrhea was obtained with octeotride. We comments the peculiarity of the acute ectopic Cushing syndrome, with the dominion of biochemical opposite clinical manifestations. It´s a preferred way like expression of paraneoplasic syndrome of neuroendocrine neoplasia.
Palabras clave: Hipokaliemia. Cushing ectópico agudo. Carcinoma indiferenciado de la vía biliar.
Key words: Hypokaliemia. Ectopic acute Cushing´s syndrome. Biliar way carcinoma.
Introducción:
El Cushing ectópico es una situación clínica causada por un tumor secretante de hormona adrenocorticotrópica (ACTH), ubicado fuera de la glándula pituitaria o de las glándulas adrenales (1). El síndrome de Cushing se debe a un exceso de hormonas glucocorticoides por un período de tiempo variable, siendo el nivel hormonal y la duración del mismo los que matizan la expresión clínica, dominando en las formas agudas las anomalías bioquímicas y en las crónicas el morfotipo clásico del síndrome (2,3). El 15% de los casos de síndrome de Cushing corresponde a la forma ectópica, causada por tumores que secretan hormona adrenocorticotrópica, y de ellos sólo un 15% representan un Cushing ectópico agudo (4,5). Otras causas del síndrome de Cushing son la producción excesiva de ACTH por la hipófisis (la más frecuente), un tumor de la glándula adrenal y la administración crónica de corticoides.
Si bien las neoplasias pulmonares son la causa más frecuente de ACTH ectópica (6,7) otros tumores pueden secretar ACTH, aunque ocurre con muy poca frecuencia, como son: carcinoma de células pequeñas, tumores de células de los islotes del páncreas, feocromocitoma, timomas, carcinoma medular del tiroides. La localización en la vía biliar podría sugerir origen pancreático, suprarrenal derecho u otras localizaciones de la vía biliar (vesícula o colédoco). Se presenta un caso de Síndrome de Cushing ectópico agudo en un paciente en edad geriátrica, que debutó con síndrome constitucional, diarrea y marcada debilidad, siendo ésta expresión de hipokaliemia severa y refractaria caso propio), en el contexto de un carcinoma altamente indiferenciado de la vía biliar.
Caso clínico:
Mujer de 74 años, que en el curso de los 3 meses previos experimenta deterioro general con dificultades para la movilización y encamamiento. Dos meses después aparece síndrome diarreico, con una media de 4-5 deposiciones líquidas al día, sin productos patológicos, sin fiebre ni dolor abdominal. Valorada de urgencias se objetiva marcada hipocaliemia, decidiéndose ingreso para estudio. Entre sus antecedentes personales figuran transfusión previa, con serología negativa para los virus B y C de la hepatitis. Colelitiasis. Diabetes mellitas tipo 2, hipertensión arterial e hiperlipidemia, por lo que recibía tratamiento con insulina, metformina, atorvastatina, torasemida y valsartán. Una analítica general realizada 4 meses antes no mostraba alteraciones.
A la exploración clínica se objetiva escasa colaboración, con facies engrosada. Tendencia al sueño. Palidez, sin ictericia. No rigidez de cuello. Tetraparesia fláccida. Hipoventilación global. Tonos cardíacos apagados y rítmicos con soplo sistólico eyectivo aórtico grado II. Abdomen: globuloso, sin claras megalias ni ascitis. No fetor hepático ni asterixis. Edemas grado 2. No se explora estación, marcha y cerebelo.
De la analítica destaca: Kaliemia inicial 1,7 mEq/l manteniendo cifras entre 2 y 2.5 mEq/l. Ph: 7.52; PCO2: 47 mm Hg; Bicarbonato: 38.3 mEq/l. Bilirrubina total de 1.87 mg/dl con fracción directa de 1,24. GOT 88 U/l; GPT 75 U/l. GGT 3078 U/l. Fosfatasas alcalinas: 825 U/l y LDH 1029 U/l. Alfafetoproteína de 300 ng/ml (valores normales hasta 10). Resto de un protocolo general, que incluye coagulación vitamina B12, otros marcadores tumorales y hormonas tiroideas normal o negativo. Cortisol basal de 98.4 mcg/dl, ACTH basal de 279 pg/ml (valores normales hasta 52). Niveles de glucagón, insulina y VIP (péptido intestinal vasoactivo) fueron normales. Orina de 24 horas, 1800 cc, Cr 376 mg. Proteinuria 320. Cortisoluria: 1771,2 mcg (VN hasta 176). Estudio de heces negativo.
La radiografía de tórax mostró Cardiomegalia con elevación de hemidiafragmas y en la eco abdominal se apreció masa en el territorio de la vesícula biliar que se extiende a nivel intrahepático. Un TAC de cráneo fue normal. La RNM abdominal mostró: en el lugar teórico de la vesícula biliar, que se prolonga en el hígado, masa heterogénea, de 11x8x14 cm, con áreas hipercaptantes y otras hipocaptantes. Asimismo múltiples lesiones intrahepáticas (Figura 2) y un nódulo de 2.2. cm subcutáneo en el hipocondrio derecho y la PAAF guiada por eco de la masa intrahepática demostró tejido necrótico, con pequeños nidos de células altamente indiferenciadas compatible con carcinoma muy indiferenciado, no pudiéndose demostrar gránulos (Figura 3). El curso clínico ha sido tormentoso, dominado por la parálisis flácida, secundaria ésta a la hipocaliemia, y la misma en el contexto de un Cushing ectópico de rápida evolución y cuadro diarreico, sin respuesta a la combinación de dosis altas de espirolactona, ketoconazol y potasio. La diarrea se controló tras un ensayo con Sandostatin. Tras realizar una gammagrafía con octeótride que resultó negativa se decidió actitud paliativa.
Discusión: El caso presentado reúne criterios de Cushing ectópico agudo. La clínica de debilidad generalizada de inicio brusco, en el contexto de hipokaliemia severa junto a los datos bioquímicos y técnicas de imagen son compatibles con un hipercortisolismo de etiología ectópica. El cuadro diarreico, probablemente vinculado a sustancias hormonales, se controló con Sandostatín. En base al síndrome constitucional, las técnicas de imagen y la biopsia de masa biliar, se demuestra carcinoma de células altamente indiferenciado, sugestivo de ser primario de la vía biliar y manifestado clínicamente de modo dominante por el síndrome paraneoplásico (secreción ectópica de ACTH).
Aspectos a considerar en el caso presentado que apoyan la etiología paraneoplásica del síndrome de Cushing ectópico son el carácter agudo, la ausencia del morfotipo clásico de síndrome de Cushing junto a las severas manifestaciones bioquímicas aún en ausencia de gránulos neuroendocrinos en las células neoplásicas, circunstancia que podría estar condicionada por la agresividad de la neoplasia con gran componente necrótico (8). A ello hay que añadir el rápido deterioro, la elevación de la alfafetoproteína, y una respuesta parcial a la asociación de espirolactona, ketoconazol y octeótride (9). El origen primario de la neoplasia está vinculado a la vía biliar, pero por la expresión del TAC de abdomen, los hallazgos anatomopatológicos y el teorema de Bayes sugieren un origen pancreático más que en otros elementos de la vía biliar (10).
El planteamiento bioquímico del cuadro a nivel hormonal en el caso presentado no exige grandes investigaciones. Un aumento de la ACTH y cortisoluria junto a la hipokaliemia severa y la alcalosis metabólica, en ausencia de morfotipo cushingoide, son suficientes para hablar del Síndrome Cushing ectópico agudo, y la determinación del CRF haría distinción entre el aumento ectópico primario de ACTH o de CRF, pero el estatus clínico determinó la no realización del CRF, cuya elevación sólo representa el 1% de los casos de Cushing ectópico (11). La presencia de Kaliuria inapropiada (mayor de 30 mEq/día en presencia de hipokaliemia) apoya el diagnóstico de hiperaldosteronismo primario en el contexto de síndrome de Cushing, el cual explica así mismo el difícil control de la HTA, aún coexistiendo con diarrea (12). Este hipercortisolismo, determinaría una potente acción mineralcorticoide, debido a que con cifras tan elevadas la enzima 17-beta-OH-esteroide-deshidrogenasa no logra que todo el cortisol (hormona con acción mineralcorticoide) pase rápidamente a cortisona (ésta no tiene acción mineralcorticoide), y que explica tanto los hiperaldosteronismos del síndrome de Cushing, del abuso de regaliz y una forma familiar de hiperaldosteronismo (13).
Las pruebas para diferenciar el Síndrome de Cushing ACTH-dependiente hipofisario del ectópico son revisadas periódicamente, según aparecen nuevas técnicas bioquímicas y de imagen (14-16). Se ha señalado que en el síndrome de Cushing por ACTH ectópica existe un mayor aumento de cortisol y de ACTH y más hipokalemia que en el hipofisario (17,18). La determinación de péptidos como calcitonina, gastrina, péptido intestinal vasoactivo, glucagón, HCG, alfafetoproteína y CEA puede ser orientativos ya que están aumentados en un 70% de los síndromes de Cushing por ACTH ectópica (19). Como la probabilidad a priori de que un síndrome de Cushing ACTH-dependiente sea causado por Enfermedad de Cushing es del 85% las pruebas a realizar deben tener gran eficacia diagnóstica para que sean útiles (20).
Un importante aspecto a comentar es la hipertensión crónica de la paciente, que a pesar del deterioro, necesita tratamiento para su control, sin duda está en relación con el efecto mineralcorticoide del cortisol (Tabla I). En todas las formas de Cushing existe hipertensión, cuando los niveles de cortisol superan la capacidad de la enzima 17-beta-hidroxideshidrogenasa para pasar a cortisona, surgiendo un hiperaldosteronismo en el que es el cortisol el mineralcorticoide (21). Ello explica la refractariedad al tratamiento antihipertensivo convencional de la hipertensión y la imposibilidad de controlar la hipokaliemia, salvo que se actúe inhibiendo la esteroidogénesis, que en el caso presentado no se ha logrado con el ketoconazol.
Aunque el Cushing ectópico crónico se detecta ocasionalmente y casi siempre en el contexto de un carcinoide bronquial (22), no ocurre lo mismo con el Cushing ectópico agudo. Éste subyace sobre una clínica de establecimiento brusco y con grave deterioro. Es por ello por lo que probablemente determina poca utilidad para el paciente el hacer el diagnóstico. Aún así puede orientar a terapias paliativas, que van más allá del tratamiento antihipertensivo estándar, inhibiendo la síntesis de cortisol con combinaciones de Ketoconazol, aminoglutetimida o metirapona, así como combinaciones con octeótride. Con esta visión hemos analizado este caso encuadrado en el complejo engranaje fisiopatológico y diagnóstico del síndrome de Cushing endógeno, que nos ayuda a mantener activa la búsqueda de procesos no habituales, aunque pensando que no sean tan desafortunados. Y siempre teniendo en mente que son más frecuentes las manifestaciones atípicas de las enfermedades frecuentes que las manifestaciones frecuentes de las enfermedades raras.
Figura 1:
Eco abdominal: Se aprecia masa intrahepática de ecogenicidad heterogénea, donde se realiza la PAAF (punción-aspiración de aguja fina) diagnóstica.
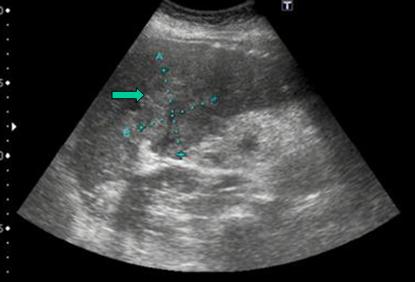
Figura 2
RNM Abdomen: Se aprecia la masa referida en la eco.
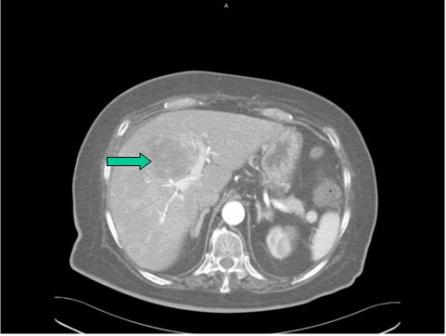
Figura 3:
Biopsia de Masa hepática: gran componente de necrosis con proliferación de células atípicas, alta relación núcleo-citoplasmática con cromatina hipercromática y granular. Papanicolaou. Aumento original 400X.
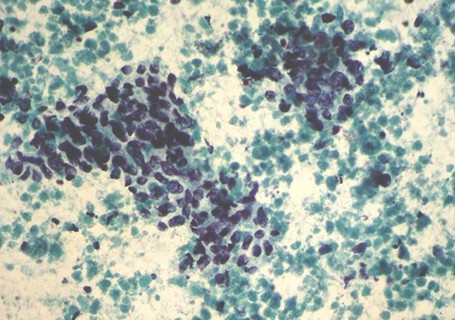
Tabla I:

Referencias bibliográficas:
1. Isidori AM, Lenzi A. Ectopic ACTH syndrome. Arq Bras Endocrinol Metabol. 2007 Nov; 51(8): 1217-25.
2. Pivonello R, De Martino MC, De Leo M, Lombardi G, Colao A. Cushing's Syndrome. Endocrinol Metab Clin North Am 2008; 37(1): 135-49.
3. Moreira-Andres MN, del Canizo Gomez FJ, Hawkins Carranza F. Actualización en el diagnóstico y diagnóstico diferencial del síndrome de Cushing. Rev Clin Esp 2003; 203: 142-54.
4. Beauregard C, Dickstein G, Lacroix A. Classic and recent etiologies of Cushing's syndrome: diagnosis and therapy. Treat Endocrinol, 2002; 1: 79-94.
5. Leinung MC, Young WF, Whitaker MD et al. Diagnosis of corticotropin-producing bronchial carcinoid tumors causing Cu-shing’s syndrome. Mayo Clin Proc 1990; 65: 1314-21.
6. Hage R, de la Riviere AB, Seldenrijk CA, et al. Update in pulmonary carcinoid tumors: a review article. Ann Surg Oncol 2003; 10: 697-704
7. Suárez Ortega S, Arkuch Saade ME, Limeres González MA, Lemes Castellano A, Bautista Suárez G, Díaz Formoso J. Hipertensión arterial de reciente diagnóstico secundaria a Síndrome de Cushing ectópico agudo: presentación de un caso. Hipertensión 2004; 21(7): 360-3.
8. Carey R. M., Varma S. K., Drake C. R, et al. Ectopic secretion of corticotropin-releasing factor as a cause of Cushing's syndrome. A clinical, morphologic, and biochemical study. N Engl J Med 1984; 311: 13-20.
9. Parthiban A, Sundaram DS, Reddy DJ, Girinath MR, Prabhakaran R, Chidambaranathan N. Octreotide and ketoconazole for persistent ectopic ACTH Cushing's disease due to mediastinal carcinoid. J Assoc Physicians India, Feb 1995; 43: 140.
10. Ohno Y, Sakai T, Miyata T. Case of pancreatic endocrine tumor associated with Cushing's síndrome. Nippon Shokakibyo Gakkai Zasshi 2007; 104(10): 1526-32.
11. Chrousos GP, Schulte HM, Oldfield EH, Gold PW, Cutler GB, Loriaux DL. The corticotropin-releasing factor stimulation test. An aid in the evaluation of patients with Cushing's syndrome. N Engl J Med 1984; 310: 622-26.
12. Torpy DJ, Mullen N, Ilias I, et al. Association of hypertension and hypokalemia with Cushing's syndrome caused by ectopic ACTH secretion: a series of 58 cases. Ann N Y Acad Sci 2002; 970: 134-44.
13. Ulick S. Editorial: cortisol as mineralocorticoid. J Clin Endocr Metab 1996; 81: 1307-8.
14. - Corrigan DF, Schaaf M, Whaley RA, Czerwinski CL, Earll J M. Selective venous sampling to differentiate ectopic ACTH secretion from pituitary Cushing's syndrome. N Engl J Med 1977; 296: 861-2.
15. Miyachi Y. Pathophysiology and diagnosis of Cushing's syndrome. Biomed Pharmacother, 2000; 54(Suppl 1): 113s-117s.
16. Boscaro M, Barzon L, Sonino N. The diagnosis of Cushing's syndrome: atypical presentations and laboratory shortcomings.Arch Intern Med 2000; 160: 3045-53.
17. Newell-Price J, Trainer P, Besser M, Grossman A. The diagnosis and differential diagnosis of Cushing´s syndrome and pseudocushing states. Endocr Rev 1998; 19: 647-72.
18. Suárez S, Zarzalejos JM, Delgado J, Alonso B, Pérez Correa S, Conde A. Seudo-Cushing alcohólico: presentación de un caso. Endocrinol Nutr 2004; 51: 126-8.
19. Howlett TA, Rees LH. Is it possible to diagnose pituitary-dependent Cushing-disease?. An Clin Biochem 1985; 22: 550-8.
20. Raff H, Findling JW. A physiologic approach to diagnosis of the Cushing syndrome. Ann Intern Med 2003; 138: 980-91.
21. Fernández-Rodríguez E, Villar-Taibo R, Pinal-Osorio I, Cabezas-Agrícola JM, Anido-Herranz U, Prieto A, Casanueva FF, Araujo-Vilar D. Severe hypertension and hypokalemia as first clinical manifestations in ectopic Cushing's syndrome. Arq Bras Endocrinol Metabol 2008; 52(6): 1066-70.
22. Scanagatta P, Montresor E, Pergher S, et al. Cushing's syndrome induced by bronchopulmonary carcinoid tumours: a review of 98 cases and our experience of two cases. Chir Ital 2004; 56: 63-70.