Mycoplasma Pneumoniae es un reconocido patógeno del aparato respiratorio implicado frecuentemente en infecciones altas y bajas tanto en niños como en adultos. Es también responsable de numerosas y variadas manifestaciones extrapulmonares siendo las complicaciones neurológicas las más frecuentes.
Si bien antiguamente se describía la asociación entre infección respiratoria por Mycoplasma Pneumoniae – compromiso neurológico como algo débil; actualmente existen múltiples publicaciones que confirman dicha asociación gracias al advenimiento de nuevas técnicas de diagnóstico.
Complicaciones neurológicas asociadas a Mycoplasma Pneumoniae.
Dr. Damián Andrés Clemente. Médico Pediatra. Certificado por Sociedad Argentina de Pediatría y la Universidad de Buenos Aires.
INTRODUCCIÓN
Mycoplasma Pneumoniae es un reconocido patógeno del aparato respiratorio implicado frecuentemente en infecciones altas y bajas tanto en niños como en adultos.
Es también responsable de numerosas y variadas manifestaciones extrapulmonares siendo las complicaciones neurológicas las más frecuentes.
Si bien antiguamente se describía la asociación entre infección respiratoria por Mycoplasma Pneumoniae – compromiso neurológico como algo débil; actualmente existen múltiples publicaciones que confirman dicha asociación gracias al advenimiento de nuevas técnicas de diagnóstico.
GENERALIDADES
Los Mycoplasmas fueron descriptos por primera vez en el año 1898 por Nocard y Roux, al observar que la pleuroneumonía del ganado vacuno era causada por organismos que pasaban filtros capaces de retener bacterias.
Estos microorganismos de pequeño tamaño (150-250nm), pertenecen a la clase Mollicutes; son procariotas que se caracterizan por carecer de pared celular y estar rodeados de una membrana celular deformable que contiene esteroles. A su vez, la familia Mycoplasmataceae, abarca a los microorganismos que infectan y colonizan seres humanos. Esta familia de microorganismos requiere de colesterol para su crecimiento; algunos hidrolizan urea, oxidan ácidos grasos de cadenas cortas a través de la B-oxidasa o degradan azúcares durante sus procesos glucolíticos.
Mycoplasma Pneumoniae, descripta en 1962 como agente etiológico de la neumonía atípica primaria, comparte la mayoría de las características pertenecientes a esta familia de microorganismos; excepto que se desarrolla bien en medios aerobios, fermenta glucosa como principal fuente de energía y crece en agar formando colonias que se asemejan a las moras, a diferencia del resto de los Mycoplasmas que forman colonias con una zona central densa y una periférica de menor densidad. 1
Otra característica a tener en cuenta, es que como carecen de pared celular no resultan afectados por los antibióticos B-lactámicos y no son visibles por tinción Gram.
Patogenia
Los Mycoplasmas causarían infecciones principalmente como parásitos extracelulares, adhiriéndose a las células ciliadas y no ciliadas. La adherencia de Mycoplasma Pneumoniae al epitelio respiratorio se considera un paso esencial en la colonización del tejido y la subsiguiente patogénesis de la enfermedad.
Los sucesos posteriores aún están poco claros, pero pueden incluir citotoxicidad directa de sustancias elaboradas como peróxido de hidrógeno o citólisis por respuesta inflamatoria mediada por quimiotaxis de células mononucleares o reacción antígeno-anticuerpo. 2
Epidemiología
La mayor parte de los casos de infección por Mycoplasma ocurre en forma aislada como brotes familiares. Pueden causar microepidemias, y representan el 25 al 75% de las neumonías en este contexto. Mycoplasma Pneumoniae es un reconocido patógeno causante de enfermedad respiratoria que afecta chicos en edad escolar y jóvenes adultos.
Las tasas de incidencia se observan con mayor frecuencia entre los 5 y 20 años; con una incidencia pico en otoño y en climas templados. Niños menores de 3 años, presentan con mayor frecuencia clínica respiratoria alta, y en cambio, entre los 5 y los 20 años predomina la bronquitis y la neumonía.3 Sin embargo la mayoría de los investigadores están de acuerdo en que la neumonía por Mycoplasma Pneumoniae es infrecuente en edad escolar. Estudios serológicos realizados en el pasado ofrecieron evidencia de que esta infección del tracto respiratorio bajo es más frecuente en pacientes de 20-30 años y recientes estudios avalan dicha evidencia.
Transmisión
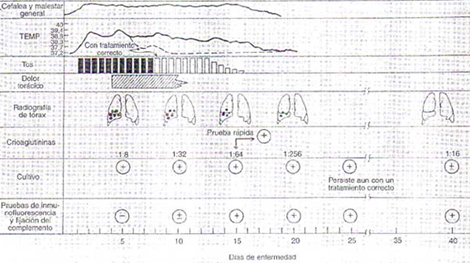
Se disemina de un paciente a otro a través de gotas respiratorias producidas por la tos. Tienen un período de incubación de 2 a 3 semanas, luego del cual la enfermedad tiene un comienzo insidioso, que consiste en: fiebre, malestar general, cefalea y tos. Siendo esta última, relevante en la infección por Mycoplasma. Usualmente es una tos no productiva, pero ocasionalmente puede ser mucoide o mucopurulenta. La frecuencia y severidad de la tos aumenta luego de los dos primeros días y puede ser causa de debilidad. Con la persistencia de la tos, se desarrolla dolor paraesternal, relacionado más que nada al esfuerzo muscular producido por la tos que a la presencia de derrame paraneumónico, al que rara vez se asocia. La fiebre es en general alta (38.8 a 40ºC) y se asocia a mucho malestar y escalofríos. (cuadro 1) 2
Si bien pueden auscultarse sibilancias en esta entidad, en un estudio con niños asmáticos, la presencia de sibilancias mostró una correlación negativa con el aislamiento de Mycoplasma Pneumoniae en comparación con virus respiratorios.
El Mycoplasma Pneumoniae se cultiva frecuentemente a partir de muestras de pacientes convalecientes durante las 8 semanas siguientes a la recuperación clínica.
Las localizaciones extrapulmonares del microorganismo implican su diseminación a otros tejidos posterior a la infección respiratoria. Entre ellas, se ha observado complicaciones cardíacas, dermatológicas, musculoesqueléticas, hematológicas y neurológicas; siendo estas últimas las que nos interesan y sobre las cuales haremos mención en el desarrollo del presente trabajo, por ser las manifestaciones extrapulmonares más frecuentes de la infección por Mycoplasma Pneumoniae. 4
Cuadro 1 – Principales manifestaciones clínicas de la neumonía por Mycoplasma Pneumoniae
Mandel; Bennett. Enfermedades infecciosas principios y prácticas. 4ª Edición. Ed. Panamericana, 1997
COMPLICACIONES NEUROLÓGICAS ASOCIADAS A MYCOPLASMA PNEUMONIAE
Las manifestaciones neurológicas secundarias a infección por Mycoplasma Pneumoniae, se producen por compromiso del sistema nervioso central (SNC) y sistema nervioso periférico (SNP), determinando un amplio espectro de presentaciones, desde irritación meníngea leve a enfermedad neurológica severa.
Aunque las enfermedades del sistema nervioso central y periférico se observan en el 7% de los enfermos hospitalizados, solamente alrededor del 0.1% de los mismos corresponden a infección por Mycoplasma Pneumoniae. Se dice que la incidencia de las complicaciones neurológicas en pacientes que presentan infección respiratoria por Mycoplasma Pneumoniae es del 1 por 1000. 5
Entre las manifestaciones neurológicas descriptas con mayor frecuencia se destacan la meningoencefalitis, la meningitis aséptica, la encefalitis. Si bien estas manifestaciones, que afectan sobre todo a niños de entre 5 y 15 años, son muy variadas e incluyen: mielitis transversa, cerebelitis, crisis convulsivas, psicosis, neuropatía de nervios craneanos y periféricos, Síndrome. de Guillán Barré, parálisis de Bell y la encefalitis diseminada aguda, entre otras.
Los signos respiratorios se presentan en uno de cada diez casos y preceden a las complicaciones entre uno a treinta días aproximadamente; aunque alrededor del 20% de los pacientes no tienen síntomas respiratorios previos, sobre todo en lactantes.
Las lesiones suelen predominar sobre sustancia blanca supratentorial y a veces puede asociarse a la lesión del núcleo gris central.
Este compromiso neurológico puede revertir completamente o dejar un déficit residual, que en ocasiones es severo. Si bien el pronóstico de las manifestaciones neurológicas, en el contexto de infección por Mycoplasma Pneumoniae, es favorable; algunos autores hacen referencia a tasas de mortalidad del 10% y de secuelas graves en un 20% de los supervivientes. Cuando se compara con otras etiologías, la encefalitis por Mycoplasma Pneumoniae se asocia a un aumento significativo (de hasta 7 veces) el riesgo de muerte y secuela neurológica grave, siendo la encefalitis herpética quien apenas la supera. 4
Encefalitis
Definición: La encefalitis se define como un proceso inflamatorio del parénquima cerebral, que casi siempre es agudo, aunque también puede tratarse de una encefalomielitis postinfecciosa, una enfermedad degenerativa crónica o una infección por virus lentos.
Etiología: Los virus constituyen las principales causas de encefalitis. Durante las temporadas de epidemia (verano u otoño) los Arbovirus y los Enterovirus son patógenos comunes. El virus del Herpes Simple es la causa más común de encefalitis esporádica y ocurren durante todo el año. Otros virus capaces de producir encefalitis son: Varicela, Epstein-Barr, Citomegalovirus, Rubéola, Parotiditis, Sarampión, Adenovirus, etc. Entre las causas no virales de encefalitis encontramos al Micoplasma Pneumoniae. (Ver cuadro 2) 2
Patogenia: Los agentes infecciosos pueden producir signos y síntomas relacionados con el sistema nervioso central (SNC) por compromiso directo o indirecto del tejido nervioso. La invasión del sistema nervioso central (SNC) puede ser por varias vías siendo la más frecuente la hematógena. Una vez en el sistema nervioso central (SNC) solo pueden infectarse células seleccionadas, lo que da origen a variaciones en las manifestaciones clínicas. La infección neuronal puede producir una actividad comicial que, según las áreas afectadas, puede ser parcial o generalizada. La infección de la oligodendroglia puede causar desmielinización sola.
La infección cortical o la tumefacción parenquimatosa reactiva pueden dar origen a cambios en el estado de conciencia y la infección de neuronas específicas del tronco encefálico puede producir coma o insuficiencia respiratoria. La infección de la microglia y de los macrófagos puede producir disfunción neurológica a través de efectos indirectos sobre la función neuronal. En cuanto a la enfermedad desmielinizante aguda que complica a los exantemas virales o a las infecciones respiratorias, se piensa que está relacionada con una sensibilización de la persona infectada a la mielina central.
Clínica: Las infecciones limitadas a las leptomeninges se manifiestan con signos y síntomas de irritación meníngea (cefalea, rigidez de nuca, pleocitosis). Si el proceso meníngeo es crónico, como en el caso de la tuberculosis, los síntomas y signos pueden ser de una hidrocefalia comunicante (cefaleas, náuseas y vómitos, deterioro del sensorio, paraparesia espástica) y/o de infarto localizado secundario a vasculitis.
La encefalitis además se caracteriza por causar alteraciones de la conciencia: la hipersomnia leve puede progresar hasta la confusión, el estupor y el coma. En general desarrollan signos neurológicos focales y las convulsiones son comunes. La hipertensión endocraneana puede producir edema de papila y parálisis de los nervios craneanos tercero y sexto.
En la encefalomielitis postinfecciosa el intervalo temporal entre la infección viral primaria y el comienzo atribuibles al sistema nervioso central (SNC) varía entre 2 y 12 días. La instalación a menudo es brusca, con deterioro del sensorio o convulsiones.
Encefalitis por Mycoplasma Pneumoniae
Si bien la prueba del compromiso del sistema nervioso central en la neumonías por Mycoplasmas se describe como algo débil 2, varios artículos publicados en los últimos años demuestran dicha asociación.
En la revista Clinical Infectious Diseases 2001 se publicó un artículo basado en un estudio prospectivo de 5 años de niños con encefalitis aguda, evidenciándose infección por Mycoplasma Pneumoniae en 50 (31%) de 159 pacientes. En 11 (6.9%) de ellos Mycoplasma Pneumoniae fue determinado como la probable causa al detectarse por la técnica de PCR en el líquido cefalorraquídeo (LCR). 6
Otro artículo publicado en el Jornal Microbiology Inmunology Infectious 2002 describe un estudio retrospectivo de 111 casos de encefalitis agudas diagnosticadas en el período Abril 1997/ Marzo 2000 en el National Taiwán University Hospital. El agente etiológico fue identificado en 50 (45%) pacientes y se evidenció infección por Mycoplasma Pneumoniae en 17 (15%) pacientes. 7
Cuadro 2 – Etiologías de encefalitis en la infancia
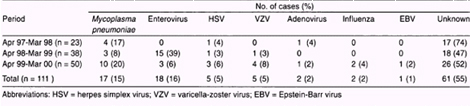
Wen-Chuan L.; et al. Mycoplasma Pneumoniae Encephalitis in Chilhood. J Microbiol Inmunol Infect 2002; 35:173-178.
Hay evidencia de coinfección en algunos casos de encefalitis asociada a Mycoplasma Pneumoniae con al menos un microorganismo más. Se plantea que diversas infecciones virales del aparato respiratorio generarían cierto efecto citotóxico en el epitelio respiratorio facilitando de este modo la invasión por Mycoplasma Pneumoniae.
Dado que una causa frecuente de encefalitis aguda es la infección por enterovirus, en el trabajo realizado en el National Taiwán University Hospital, se realizó una comparación entre las manifestaciones clínicas y de laboratorio en ambos grupos, surgiendo como datos interesantes el hecho de que el 94% de los afectados por enterovirus presentaron un líquido cefalorraquídeo (LCR) patológico contra un 33% de los afectados por Mycoplasma Pneumoniae y de estos últimos el 100% presentó electroencefalograma (EEG) y neuroimágenes patológicas, contra un 78% y 88% respectivamente en los casos de encefalitis causadas por enterovirus (ver cuadro 3).
Las alteraciones más comunes detectadas en el electroencefalograma (EEG) es la aparición de ondas lentas difusas. Los hallazgos en neuroimágenes (TAC, RNM) son variados siendo las más frecuentes: edema difuso, lesiones hemisféricas focales, aumento del tamaño ventricular, etc.
Cuadro 3 – Comparación entre infección por Mycoplasma Pneumoniae y enterovirus
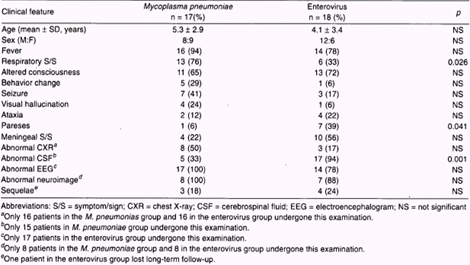
Wen-Chuan L.; et al. Mycoplasma Pneumoniae Encephalitis in Childhood. J Microbiol Inmunol Infect 2002; 35:176.
Los síntomas respiratorios pueden ser muy discretos y ausentarse en aproximadamente el 20% de los casos. Las manifestaciones neurológicas en la encefalitis asociada a Mycoplasma Pneumoniae (ver cuadro 4) son variadas, siendo las más frecuentes la alteración de la conciencia, convulsiones, letargo, cambios de la personalidad, signos meníngeos y alucinaciones visuales entre otras.
Cuadro 4 – Manifestaciones neurológicas de la encefalitis por Mycoplasma Pneumoniae
Wen-Chuan L.; et al. Mycoplasma Pneumoniae Encephalitis in Chilhood. J Microbiol Inmunol Infect 2002; 35:175.
Encefalomielitis diseminada aguda
Definición: La Encefalomielitis Diseminada Aguda (EMDA) es un cuadro caracterizado por una desmielinización aguda del sistema nervioso central (SNC) siendo característico el compromiso multifocal de la sustancia blanca. Es una enfermedad monofásica con pronóstico favorable, la recuperación lleva varias semanas y a veces es completa. Pueden quedar déficit neurológicos permanentes en forma de atrofia óptica, ligero retraso mental, deficiencia de nervios craneales.
Epidemiología: Los microorganismos responsables de este cuadro son varios entre los que se encuentra el Micoplasma Pneumoniae. (Cuadro 5) La presentación de la Encefalomielitis Diseminada Aguda (EMDA)A muestra cierta distribución estacional siendo su mayor prevalencia en invierno, coincidiendo con la distribución estacional de muchos de los agentes etiológicos. 8
Los estudios epidemiológicos han mostrado que la Encefalomielitis Diseminada Aguda (EMDA) es más frecuente en el adulto joven y niños, es excepcional antes de los 3 años de edad y no existe diferencia por sexo. Su incidencia es mayor en los países en desarrollo y en los que utilizan vacunas contra la rabia con tejido neural de origen animal.
Patogenia: Probablemente un mecanismo autoinmune mediado por linfocitos T contra la proteína básica de la mielina desencadenado por una infección o vacuna sería la base fisiopatogénica.
En la Encefalomielitis Diseminada Aguda (EMDA) existe evidencia de inflamación: el hemograma muestra frecuentemente leucocitosis con linfocitosis, la eritrosedimentación se encuentra acelerada y la proteína c reactiva aumentada. El líquido cefalorraquídeo (LCR) muestra aumento de linfocitos con proteínas aumentadas aunque frecuentemente el LCR es normal. En algunos casos existen bandas oligoclonales e indicarían síntesis intratecal de inmunoglobulinas. 4
Clínica: Los síntomas neurológicos de la Encefalomielitis Diseminada Aguda (EMDA) son precedidos por diferentes síntomas inespecíficos (fiebre, nauseas, vómitos, cefaleas) que se desarrollan entre la infección o vacunación que desencadena el proceso hasta la aparición de los mismos. La duración de esta fase prodrómica varía entre 4 a 21 días aproximadamente. 4
La presentación clínica de la Encefalomielitis Diseminada Aguda (EMDA) es generalmente polisintomática. En un artículo publicado por Dale y col. en el cual se estudiaron 48 niños con desmielinización diseminada del sistema nervioso central (SNC) de los cuales 28 presentaron Encefalomielitis Diseminada Aguda (EMDA); se describe que el 91% se presentó de forma polisintomática. La alteración del nivel de conciencia es el signo más frecuente (71% de los casos en el artículo mencionado), seguido por signos motores piramidales, ataxia, disartria, alteración de pares craneanos, neuritis óptica generalmente bilateral, mielitis transversa, convulsiones entre otros, indicando un importante compromiso del parénquima cerebral, nervios ópticos y médula espinal.
Puede haber una rápida progresión con signos y síntomas de coma y rigidez de descerebración. Existen también variantes y casos atípicos como la variedad hemorrágica. (Síndrome de Weston Hurst) 8,9
Neurodiagnóstico: El electroencefalograma (EEG) muestra alteraciones en casi todos los casos siendo éstas inespecíficas. En el artículo publicado por Dale y col. se realizó EEG a 21 pacientes de los cuales sólo 1 fue normal. 9 Los hallazgos más frecuentes son exceso difuso de ondas lentas observables también en casos de encefalitis. 4
Las neuroimágenes son indispensables para establecer el diagnóstico de esta entidad. La tomografía computada (TC) puede ser normal por lo muchas veces no es suficiente para establecer el diagnóstico de Encefalomielitis Diseminada Aguda (EMDA). La resonancia magnética (RM) en cambio, muestra tempranamente imágenes compatibles con desmielinización. 4
En el artículo anteriormente citado se realizaron TC en 19 niños siendo el 59% informadas como anormales, sin embargo todos estos pacientes tuvieron una resonancia magnética (RM) con lesiones diseminadas en sistema nervioso central (SNC). 9
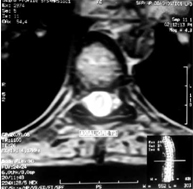
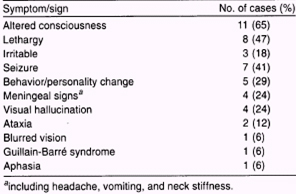
Característicamente las lesiones en la resonancia magnética (RM) aparecen como áreas parcheadas hiperintensas en T2, algunas de ellas se refuerzan tras la administración de gadolinio, afectan principalmente la sustancia blanca y menos frecuentemente la sustancia gris (tálamo y ganglios de la base). Las lesiones no presentan efecto de masa y pueden acompañarse de edema perifocal de diferente intensidad. 4 La asimetría de las lesiones que comprometen la sustancia blanca es característica en contraste con las que afectan a la sustancia gris que suelen ser simétricas. 9, 10 (Figuras 1, 2, 3)
Figura 1 - Señal hiperintensa en paciente con ADEM con Mielitis transversa
Garg R K. Acute disseminated encephalomyelitis. Postgraduate Medical Journal. 2003; 79:11-17.
Figura 2. MRI findings in 1 case demonstrating typical asymmetric supratentorial lesions (top row, initial study; bottom row, 8 weeks later). Lesions are bilateral cortical and subcortical, hyperintense on FLAIR (left) and mildly hypointense on noncontrast T1 (middle, arrow) with no mass effect. Postcontrast imaging (right) shows a variable enhancement pattern including homogeneous enhancement of 1 lesion and ring enhancement of another. Eight weeks later, the lesions are nearly resolved on noncontrast studies (bottom row); enhancement was no longer seen (not shown).
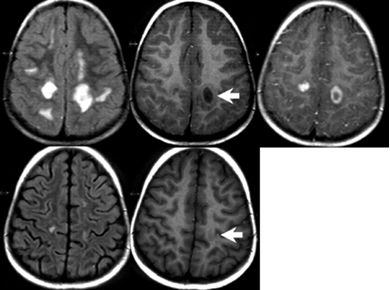
Garg R K. Acute disseminated encephalomyelitis. Postgraduate Medical Journal. 2003; 79:11-17.
Figure 3 MRI of patient a week before a febrile illness. T1 (A) and T2 (B) images showing extensive bilateral demyelination of white matter of frontal lobes. This 20 year woman presented with bilateral vision loss, cerebellar manifestations, and with extensive pyramidal signs.
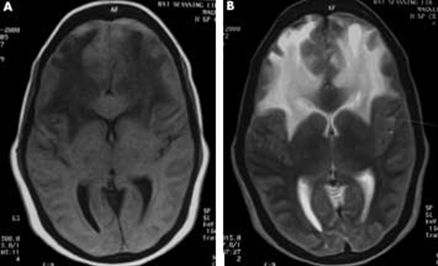
Garg R K. Acute disseminated encephalomyelitis. Postgraduate Medical Journal. 2003; 79:11-17.
Cuadro 5 - Agentes etiológicos de Encefalomielitis Diseminada Aguda (EMDA)

Chavez A.; David P.; Norambuena X. Mendoza C.; Jodorovsky M. Manifestaciones neurológicas asociadas a infección por Mycoplasma Pneumoniae. Rev Chil Infect. 2004; 21(3):223-228.
El pronóstico no es siempre favorable, algunos autores hacen referencia a tasas de mortalidad del 10% y de secuelas graves en un 20% de los sobrevivientes. En el artículo de Wen-Chan et al7, si bien el 82% de los pacientes se recupero completamente, un 18% sufrió secuelas neurológicas severas: Epilepsia, hidrocefalia y déficit neurológico global. 11
Mielitis transversa
Definición: Es un proceso inflamatorio del sistema nervioso central (SNC) caudal que suele afectar a toda la médula espinal a un determinado nivel. El compromiso medular puede instalarse en forma aguda o sub-aguda.
Etiología: Las causas son variadas, entre ellas encontramos: el compromiso tumoral, las malformaciones arteriovenosas ó enfermedades vasculares (causas más frecuentes en adultos que en niños); sin embargo, la mielitis transversa suele desarrollarse luego de cuadros infecciosos. Entre los agentes virales se incluyen: Varicela zoster, virus Herpes Simple, Citomegalovirus, Epstein-Bar, Influenza y el VIH. Entre las infecciones bacterianas a las que se suele asociar encontramos; infecciones de piel, otitis media aguda y las neumonías por Mycoplasma Pneumoniae. Este último agente, en los últimos años, ha sido descripto en numerosos casos de mielitis transversa aguda, convirtiéndose en una de las complicaciones neurológicas más frecuentes luego de la encefalitis y meningoencefalitis. 12
Patogenia: Durante la fase aguda de la infección provocaría la desmielinización de nervios espinales, mientras que en los cuadros post-infecciosos, se pondrían en juego mecanismos del sistema inmunológico.
En líneas generales, cuanto más rápida es la instalación de la mielitis, peor es el pronóstico. Se vio que una forma de mielitis transversa aguda y de rápida progresión, señala a veces el primer ataque de una esclerosis múltiple. Sin embargo estudios realizados muestran que la mayoría de las personas que la padecen no tienden a desarrollarla.
Clínica: Comienza con trastornos sensitivos en los miembros inferiores, como debilidad, entumecimiento u hormigueo en los pies, que en ocasiones es asimétrico, para luego comprometer los cuatro miembros produciendo una parálisis flácida con compromiso esfinteriano. Estos síntomas suelen asociarse a dolor radicular o dorsalgia localizada.
Al comenzar el proceso, las piernas se debilitan progresivamente y se establece un nivel de sensibilidad que señala el nivel superior de afectación medular, que generalmente se sitúa en la región dorsal media o alta. Según el nivel de lesión medular puede producir paraplejia o cuadriplejia.
El comienzo de los síntomas suele ser brusco. Se observa déficit neurológico máximo habitualmente 24 a 48 hs después de la aparición del primer síntoma. El cuadro en general evoluciona durante unas 3 semanas, pero puede ser rápidamente evolutivo. 13
La tasa de mayor incidencia se da entre los 10 y 19 años y entre los 30 y 39 años de edad.
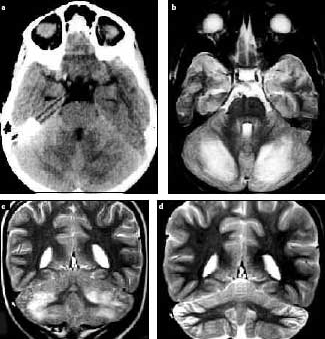
En el año 2002, en la revista de Neurología, fue reportado un caso de un niño de 10 años que comenzó con lumbalgias y dolor en el miembro inferior derecho, que se agravó y perdió progresivamente la marcha en un lapso de 24 horas 12. Al examen físico presentaba paraparesia con fuerza muscular conservada en miembros superiores, reflejo aquiliano disminuido, con el resto de los reflejos osteotendinosos conservados y sensibilidad álgica disminuida por debajo del nivel D4-D6 con sensibilidad térmica conservada. Se hizo el diagnóstico de mielitis transversa aguda basándose en los datos clínicos y apoyado por las imágenes de la resonancia magnética (RM), que mostraba hiperseñal en T2 a nivel de médula dorsal y cono medular, con ausencia de captación de contraste. (Fig 3 – Fig 4)
Figura 3. Resonancia magnética (RM), cortes sagitales en T 1 (a) y T 2 (b), que muestran condensación e hiperseñal extensa en T2 en la médula dorsal y cono medular. En el estudio contrastado no se detectaron focos captadores.
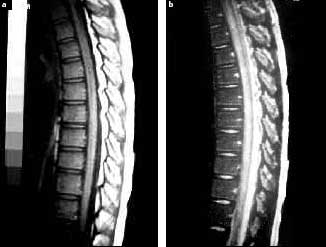
Cunha J. et al. Infección por Mycoplasma Pneumoniae.
Tres casos con complicaciones neurológicas. 2002;34:1053-6
Figura 4. a) TAC cerebral que revela áreas hipodensas de límites mal definidos en la sustancia blanca de los hemisferios cerebelosos, con aparente efecto de masa sobre el IV ventrículo; b y c) Extensas áreas de hiperseñal en T 2 en ambos hemisferios cerebelosos, casi simétricos, que afectaba sobre todo la sustancia blanca profunda, sin modificación después de administración de contraste. d) RM a las 10 semanas. Muestra desaparición casi total de las lesiones y persisten algunos focos de hiperseñal subcorticales y dilatación de algunos surcos hemisféricos cerebelosos.
Cunha J. et al. Infección por Mycoplasma Pneumoniae.
Tres casos con complicaciones neurológicas. 2002;34:1053-6
Se le realizaron serologías en sangre y líquido cefalorraquídeo (LCR), que resultaron negativas para HSV, VSZ, CMV, EBV, coxackievirus, adenovirus, Treponema pallidum, brucella, Rickettsia, Borrelia, HBV, HCV y para HIV. Resultando positivas las serologías para Mycoplasma Pneumoniae.
Otro caso de mielitis transversa asociado a infección por Mycoplasma Pneumoniae fue descripto pero, a diferencia del caso anterior, presentaba una resonancia magnética normal y no se pudo aislar el germen en líquido cefalorraquídeo. La serología para otros gérmenes dio negativa y se obtuvieron títulos positivos para Mycoplasma Pneumoniae. 14
Esto muestra la escasa asociación que suele hacerse entre Mycoplasma Pneumoniae y manifestaciones neurológicas, lo que implica un sub-diagnóstico de dicho germen como su agente etiológico.
Síndrome de Guillain-Barré
Definición: es un desorden autoinmune que abarca un grupo heterogéneo de entidades patológicas y clínicas.
Etiología: El 70% de los pacientes refiere el antecedente de infecciones en los 15 días previos de la enfermedad, dentro de las más frecuentes se encuentran las infecciones respiratorias bacterianas y virales. El patógeno identificado con mayor frecuencia en infecciones precedentes en el síndrome de Guillain-Barré es el Campylobacter Jejuni (26-36%), le sigue el Epstein-Bar (10%) y el Citomegalovirus (5%) junto con el Mycoplasma Pneumoniae (5%). Se han reportado casos en niños con neumonitis por Mycoplasma Pneumoniae, que han desarrollado parálisis ascendente con evidencia electromiográfica de neuropatía periférica desmielinizante compatible con Síndrome de Guillain-Barré. La amplitud del potencial de acción muscular era reducida pero la latencia motora distal, la velocidad de conducción motora, los potenciales de acción de nervios sensitivos y las ondas F se encontraban en rango normal. Estudios de necropsia mostraron degeneración símil Walleriana para axones motores exclusivamente. Los cambios observados a nivel nodal y periaxonal podrían ser reversibles, lo que explicaría la rápida recuperación en algunos de los casos. 15
Clínica: El síndrome de Guillain-Barré es la causa más frecuente de parálisis generalizada flácida. La Polirradiculopatía Desmielinizante Inflamatoria Aguda (AIPD) es la forma más frecuente de presentación. El cuadro comienza por lo general con parestesias en los pies que se propagan a las manos, seguido luego de unos días por el síntoma cardinal de esta neuropatía que es la debilidad muscular simétrica y progresiva, la cual afecta inicialmente los músculos distales de los miembros inferiores y en forma ascendente compromete los miembros superiores y músculos respiratorios. El dolor en la región lumbar y los miembros es frecuente y en ocasiones muy intenso.
Al examen físico los hallazgos más característicos son la debilidad simétrica de los miembros, con reflejos disminuidos y ausentes. Sin embargo, los reflejos tendinosos pueden estar preservados o exagerados. La hiperreflexia usualmente se observa en la fase de recuperación y ocasionalmente en la fase aguda. Este hallazgo se asocia significativamente a la presencia de anticuerpos anti-GM1 y a una forma menos severa de la enfermedad.
A pesar de las parestesias y el dolor, el examen sensitivo es normal o sólo demuestra una leve hipoestesia en los pacientes más afectados.
En los casos más severos puede haber compromiso respiratorio, lo que obliga a la asistencia respiratoria mecánica, y disfunción autonómica que se manifiesta por taquicardia fija y fluctuaciones de la tensión arterial. Es común la debilidad muscular en territorio de pares craneanos que se manifiesta como paresia facial bilateral, oftalmoparesia y trastornos deglutorios.
Durante observaciones retrospectivas a pacientes que desarrollaron el Sme. de Guillain-Barré a partir de infecciones por Mycoplasma Pneumoniae, en los que se buscaron anticuerpos anti-gangliosidos, se pudo constatar que todos habían presentado infecciones respiratorias anteriores y también contaban con un número elevado de anticuerpos anti-Mycoplasma Pneumoniae.
Las manifestaciones más frecuentes observadas en estos pacientes después de infección por Mycoplasma Pneumoniae fueron: la debilidad en miembros, la parálisis facial bilateral, y las disfunciones autonómicas. 16
MECANISMOS FISIOPATOGÉNICOS
La fisiopatología de estas complicaciones neurológicas agudas, centrales y periféricas, no están completamente dilucidadas.
La invasión directa del sistema nervioso central (SNC) se sugiere por la presencia del germen en el cultivo del líquido cefalorraquídeo (LCR), el cual puede ser normal en uno de cada diez casos, y queda confirmado por la detección del ADN micoplasmático por PCR. Sin embargo la positividad de la PCR en líquido cefalorraquídeo (LCR) no necesariamente implica la invasión del parénquima cerebral. Solo algunas técnicas como la inmunohistoquímica y la liberación de ácidos nucleicos in situ, demostrarían convincentemente la invasión del tejido cerebral por este organismo
Un estudio realizado, encontró correlación entre la positividad de la PCR y la aparición precoz de signos de encefalitis luego de los primeros días de la micoplasmosis. Es por estas formas precoces de encefalitis, que las quinolonas, por su pasaje meníngeo y por su mejor concentración sobre el tejido cerebral, han sido lógicamente propuestas como tratamiento.
Otro mecanismo propuesto sería la producción de un fenómeno autoinmune, en donde el Mycoplasma Pneumoniae es presentado a neutrófilos y macrófagos a través de receptores de superficie, para dar inicio a la fagocitosis, activación de factores de complemento y liberación de citoquinas. La respuesta inflamatoria generada activa los mecanismos de respuesta linfocítica más específica destinada a remover al antígeno microbiano a través de la producción de anticuerpos. Por este mecanismo formarían complejos inmunes que se depositarían en las estructuras del sistema nervioso central (SNC), explicando de esta manera aquellos casos en los que no se logra demostrar la presencia del agente. 17
Este proceso autoinmune estaría relacionado con un desarrollo más tardío de las complicaciones neurológicas, y probablemente se corresponda con aquellos síntomas prodrómicos de más de 5 a 7 días de duración, y con la presencia de numerosos autoanticuerpos dirigidos contra constituyentes del tejido cerebral; de tipo anticentriolos y antigangliósidos o anticuerpos antigalactocerebrosidasa (GalC).
En un estudio japonés 18, donde se estudiaron pacientes que desarrollaron neuropatía axonal motora aguda después de una infección por Mycoplasma Pneumoniae, se pudo observar la asociación de la misma con la producción de anticuerpos anti-GM1 y anti-GalC. La GalC es el mayor glicolípido que conforma la mielina de nervios periféricos, se sabe que existe un epitope GalC presente en el Mycoplasma Pneumoniae.
A su vez, un estudio inmunohistoquímico mostró axones selectivamente marcados con anticuerpos IgM anti-GM1 en pacientes durante la fase aguda de la enfermedad. Estos hallazgos implicarían que los anticuerpos IgM anti GM1 serían necesarios para el desarrollo de la disfunción axonal y evidenciarían que el epitope GM1 se encuentra presente en el Mycoplasma Pneumoniae, lo que indicaría la existencia de mimetismo molecular entre la bacteria y el tejido nervioso periférico.
Otros anticuerpos antiglicolípidos, además de estos anticuerpos, fueron reportados en Smes. de Guillán Barré asociados a infecciones por Mycoplasmas, como los anticuerpos IgM anti-SLPG,en pacientes en los que se demostró una marcada demora en la velocidad de conducción motora, dispersión temporal y anticuerpos IgG anti-GM1b.
Existe a su vez una hipótesis acerca de una eventual neurotoxina. Esta teoría se sustenta en las manifestaciones neurológicas inducidas en ratones o pavos por infección por otros Mycoplasmas. No obstante, hasta el momento no se ha identificado ninguna neurotoxina producida por Mycoplasma Pneumoniae. 4, 12
DIAGNOSTICO
Establecer una asociación entre infección por Mycoplasma Pneumoniae y las manifestaciones neurológicas es complejo debido a que es difícil asegurar una infección por este agente y, por otra parte, la patogenia de estos cuadros neurológicos aún no está aclarada.
Diferentes artículos publicados utilizan como criterios diagnósticos los siguientes 6:
Infección probable:
· Detección de Mycoplasma Pneumoniae en líquido cefalorraquídeo (LCR) por medio de PCR, cultivo o ambos; con o sin confirmación serológica
· Detección de Mycoplasma Pneumoniae en muestras de garganta por PCR, cultivo o ambos con confirmación serológica.
Infección posible:
· Evidencia serológica de infección por Mycoplasma Pneumoniae con cultivos y PCR negativos de líquido cefalorraquídeo (LCR) y garganta y ausencia de evidencia convincente para otro potencial agente etiológico
· Resultados de cultivos o PCR positivos para Mycoplasma Pneumoniae en garganta con serología negativa
Infección indeterminada:
· Serología positiva que evidencie infección por Mycoplasma Pneumoniae con cultivos y PCR negativos en líquido cefalorraquídeo (LCR) y garganta y con evidencia convincente que implique al menos 1 patógeno más implicado.
Métodos de diagnóstico
Cultivo: Para identificar a Mycoplasma Pneumoniae en cultivos se necesitan medios especiales y enriquecidos (caldo o agar) obteniéndose buenos resultados en un 40-90% y su práctica dura 21 días. Aislar al Mycoplasma Pneumoniae en una persona con manifestaciones clínicas compatibles sugiere su papel causal. El microorganismo puede ser excretado durante varias semanas de las vías respiratorias después de una infección aguda a pesar del tratamiento adecuado, es por ello que aislarlo quizá no equivalga a infección aguda.
Serología: La detección de IgM e IgG se realiza actualmente por métodos de inmunofluorescencia e inmunoanálisis enzimático. A pesar de que la presencia de IgM confirma que hubo en fecha reciente infección por Mycoplasma Pneumoniae, persisten en el suero varios meses, por tal razón no obligadamente indican la presencia de infección actual.
El diagnóstico serológico se puede hacer al demostrar un incremento cuádruple o mayor del título de anticuerpos entre las muestras de suero de fase aguda y convalecencia cuando se utiliza el método de fijación de complementos.
Durante el período 1996-2002 se realizaron estudios serológicos para Mycoplasma Pneumoniae en 32 laboratorios de Polonia, en la mayoría de estos laboratorios la infección por Mycoplasma Pneumoniae fue confirmada por la técnica de fijación de complemento. El resultado del test fue aceptado como positivo, cuando los títulos de anticuerpos eran mayores o iguales a 60 ó si presentaban un incremento significativo de títulos de anticuerpos durante la enfermedad. 19
En cerca de la mitad de los niños con neumonía causada por Mycoplasma Pneumoniae, al comenzar la segunda semana de la enfermedad, se detectan criohemaglutininas séricas en títulos de 1:32 o mayores. El incremento cuádruple del título de dichas aglutininas, en muestras de suero en fase aguda y de convalecencia, se observa más a menudo en niños con infecciones graves por Mycoplasma Pneumoniae que en aquellos con infecciones menos severas. Este método, sin embargo, es poco específico, por lo que no se concede tanta importancia al uso de esta prueba.
Identificación del genoma: Se realiza mediante la utilización de sondas genéticas o reacción en cadena de la polimerasa (PCR). 20
TRATAMIENTO
Debido a que los mecanismos involucrados en el desarrollo de las complicaciones neurológicas como consecuencia de la infección respiratoria por Mycoplasma Pneumoniae son probablemente heterogéneos, se ha planteado su tratamiento en base a los posibles mecanismos fisiopatogénicos.
El uso de antimicrobianos, entre los que se destacan antibióticos como los macrólidos y las quinolonas, estaría indicado sólo en aquellos niños que presentan un pródromo corto de la enfermedad (menor de 5 ó 7 días), en los que se plantea que hay invasión directa del sistema nervioso central (SNC). 4
Por otro lado, el posible origen inmunológico de estas complicaciones ha conducido a sugerir que el tratamiento con corticoesteroides podría ser beneficioso.
Se han reportado casos de encefalitis con una importante respuesta a la terapia con corticoesteroides, sobre todo en aquellos casos de mayor severidad. También se ha establecido la eficacia del tratamiento con corticoides en la mielitis transversa asociada a Mycoplasma Pneumoniae. Sin embargo, el uso de estos para el tratamiento de esta enfermedad no ha sido evaluado prospectivamente. Pero, debido a los potenciales beneficios que representa acortar la duración de la inflamación del parénquima cerebral con la terapia a corto plazo de corticoesteroides, esta debe ser considerada en aquellos pacientes en los cuales la invasión directa del sistema nervioso central (SNC) por Mycoplasma Pneumoniae, así como la presencia de otros agentes etiológicos han sido descartadas. 21
Otros tratamientos que fueron propuestos, sobre todo en las formas más severas o con un curso más tórpido de la enfermedad, son la terapia con inmunoglobulinas por vía intravenosa y la plasmaféresis.
También han sido descriptos casos de encefalitis y necrosis estriatal, cuyas manifestaciones clínicas fueron de pacientes con encefalopatía y síntomas extrapiramidales; que incluían rigidez, bradikinesia y temblor. En algunos de estos casos ha sido de ayuda el uso de levodopa para mejorar dicha sintomatología.
CONCLUSIÓN
Las complicaciones neurológicas asociadas a infecciones por Mycoplasma Pneumoniae son las más frecuentes dentro de las manifestaciones extrapulmonares. Entre las mismas se describen: Mielitis transversa, convulsiones, sindrome de Guillain-Barré, encefalitis diseminada aguda, parálisis de nervios craneanos, meningitis asépticas, meningoencefalitis y encefalitis, siendo esta última observada con mayor frecuencia en la edad pediátrica.
La patogenia de estas manifestaciones neurológicas aún no ha sido totalmente dilucidada, sin embargo las teorías más prevalentes son:
- Invasión directa de sistema nervioso central (SNC) por Mycoplasma Pneumoniae
- Mecanismos autoinmunes
- Neurotoxicidad
Dada la amplia gama de manifestaciones neurológicas asociadas a la infección por Mycoplasma Pneumoniae y, considerando que estas son las manifestaciones extrapulmonares más frecuentes, es importante tener en cuenta a dicha infección como posible etiología de cuadros neurológicos con causa difícil de establecer, especialmente cuando estos son precedidos de un síndrome respiratorio febril. Esto, nos permitiría llegar a un diagnóstico de certeza, ofrecer un tratamiento oportuno y así disminuir la severidad de la enfermedad minimizando el riesgo de secuelas a las cuales se asocia.
Tras la lectura de múltiples artículos de reciente publicación, podemos deducir que el bajo número de casos reportados, no indicaría que fueran pocas las manifestaciones neurológicas asociadas a infecciones por Mycoplasma Pneumoniae, sino que evidencia una falta de sospecha de dicho germen como su agente etiológico.
RESUMEN
Los micoplasmas han sido conocidos por muchos años como causa importante de enfermedades en veterinaria. Posteriormente, la especie Mycoplasma Pneumoniae fue reconocida como agente etiológico de neumonía atípica, siendo este, el micoplasma que se aísla más frecuentemente en humanos.
Las principales afecciones provocadas por dicho germen, corresponden a infecciones del tracto respiratorio, tanto altas como bajas, de diversa severidad. A su vez, es responsable de numerosas manifestaciones extrapulmonares: cardíacas, mucocutáneas, hematológicas, osteoarticulares, renales, digestivas; además de manifestaciones neurológicas, que constituyen los cuadros extrapulmonares más frecuentes, determinando un amplio espectro clínico desde una afección leve del sistema nervioso central (SNC) hasta una enfermedad neurológica severa.
Los mecanismos patogénicos involucrados en dichas manifestaciones neurológicas, son aún motivo de estudio; sin embargo, basándose en investigaciones realizadas en los últimos años, cobran mayor fuerza las hipótesis que involucran la invasión directa del sistema nervioso central (SNC), como la encefalitis, y los mecanismos autoinmunes que se observarían en aquellas con pródromo prolongado, como la encefalitis diseminada aguda, el síndrome de Guillain-Barré y la mielitis transversa.
El diagnóstico de certeza de estas afecciones se realiza por PCR que demuestra la presencia de Mycoplasma Pneumoniae en secreciones respiratorias o en líquido cefalorraquídeo.
Teniendo en cuenta la importancia que un tratamiento temprano representa para minimizar la severidad de las complicaciones neurológicas, es necesario que los profesionales tengan presente a la hora de efectuar el diagnóstico, al Mycoplasma Pneumoniae como posible patógeno.
BIBLIOGRAFÍA
1. Rivero-Tapia J.; Cedillo-Ramirez M.; Vega-Benitez M. Mycoplasmas y su importancia médica. Rev Boimed. 2001;12:262-271.
2. Mandel; Bennett. Enfermedades infecciosas principios y prácticas. 4ta. Edición. Ed. Panamericana, 1997.
3. Reyes; Aristazabal; Leal. Neumonología Pediátrica. 4ta Edición. Editorial Panamericana; 2001:311-317.
4. Chavez A.; David P.; Norambuena X. Mendoza C.; Jodorovsky M. Manifestaciones neurológicas asociadas a infección por Mycoplasma Pneumoniae. Rev Chil Infect. 2004; 21(3):223-228.
5. Sakoulas G. Brainstem and Striatal encephalitis complicating Mycoplasma Pneumoniae Pneumonia: posible benefit of intravenous inmunoglobilin. The Peadiatric Infectious Disease Journal. 2001; 20:543-545.
6. Bitnum A.; Lee Ford-Jones E.; Patric M.; Mac Gregor D.; Nelson S.; Jhonson G.; et al. Acute chidhood encephalitis and Mycoplasma Pneumoniae. Clinical Infectious Diseases. 2001; 32:1674-1684.
7. Wen-Chuan L.; Ping-Ing L.; Chun-Yi L.; Yu-Chia H.; Hsin-Pao L.; Chin-Yun L.; Li-Min H. Mycoplasma Pneumoniae Encephalitis in Chilhood. J Microbiol Inmunol Infect 2002; 35:173-178.
8. Murthy R.; Fadin H.; Cohen M.; Bakshi R. Acute disseminated encephalomyelitis in children. Pediatrics 2002. August. 100(2):99 e 21.
9. Dale R. C.; De Sousa C.; Chong W. K.; Cox T. C. S.; Harding B. and Neville B. G. R. Acute disseminated encephalomyelitis multiphasic disseminated encephalomyelitis and multiple esclerosis in children. Brain. 2000. December; 123(12):2407-2422.
10. Garg R K. Acute disseminated encephalomyelitis. Postgraduate Medical Journal. 2003; 79:11-17.
11. American Academy of Pediatrics. Mycoplasma infections. In pickering LK : Red book : report of the committee on Infections Diseases. 25 ed. Elk Grove Village, IL : American Academy of Pediatrics; 2000.
12. Cunha J.; Madalena C.; Gimarâes P.; Sousa A.; Temudo T. Infección por Mycoplasma Pneumoniae.Tres casos con complicaciones neurológicas. 2002;34:1053-6
13. Swaiman K. F. Neurología Pediátrica. Principios y prácticas. 2da edición en español. Madrid, España, 1998: 674-679; 681-682.
14. Candler, P.M.; Dale, R.C. Three cases of central nervous system complications associated with Mycoplasma Pneumoniae. Pediatric Neurology. 2004. 31(2):133-138.
15. Udaya Seneviratne. Guillain-Barré syndrome. Postgraduate Medical Journal. 2000 December; 76:774-782
16. Maw J.; Chattophadyay A.; Griffiths P.; Baxter P. Acute central and peripheral demyelinitation associated with Mycoplasma Pneumoniae. Pediatr Neurol. 2005; 29:236-241.
17. Gomier J.; Retornaz K. Blanc P.; Minodier P. L´Infection extrapulmonaire Mycoplasma Pneumoniae. Archives de Pediatrie. 2005; 12. Disponible en: www.sciencedirect.com (http://france.elservier.congdirect/ARCPED/).
18. Susuki K.; Odaka M. Mori M. Hirata K. Yuki N. Acute motor axonal neuropathy after Mycoplasma Pneumoniae infection. Neurology. 2004; 62:949-956
19. Restawicki W.; Kalizewski S. Japielski M and Cierrczynski R. Changes in the epidemiological of Mycoplasma Pneumoniae infections in Poland. Europen Journal of Epidemiology. 2003;18: 1663-1164.
20. Socan M.; Ravnik I.; Benana P.; Dovo P.; Zakotnik B.; Maja S.; Igor R. et al. eurological Syntoms in patients whose cerebrospinal fluid is culture and/or polymerase Caín reaction positive for Mycoplasma Pneumoniae. Clinical Infectious Diseases. 2001; 32: e31-e35.
21. Todd C. Corticosteroids in the treatment of severe mycoplasma encephalitis in children. Crit Care Med. 2002; 30(4):925-927
22. Nelson W.E.; Behrman R.E.; and Kliegman R. Nelson Text Book of Pediatrics. 2004 Book News, Inc., Portland, OR.