El Síndrome Hemolítico Urémico (SHU) es un grupo heterogéneo de desórdenes con un espectro de severidad variable. Se caracteriza por la tríada de anemia hemolítica microangiopática, trombocitopenia e insuficiencia renal aguda (es su causa más frecuente en la población infantil). Se ha clasificado en la forma clásica o asociada a diarrea (D+) y la atípica o no asociada a diarrea (D-). Esta clasificación tiene repercusiones importantes ya que etiología, curso clínico y pronóstico de ambas entidades son diferentes. Las manifestaciones neurológicas ocurren en el 30% de los casos.
Síndrome Urémico Hemolítico. Complicaciones Neurológicas
Dr. Damián Andrés Clemente. Médico Pediatra
Buenos Aires, Argentina
RESUMEN
El Síndrome Hemolítico Urémico (SHU) es un grupo heterogéneo de desórdenes con un espectro de severidad variable. Se caracteriza por la tríada de anemia hemolítica microangiopática, trombocitopenia e insuficiencia renal aguda (es su causa más frecuente en la población infantil). Se ha clasificado en la forma clásica o asociada a diarrea (D+) y la atípica o no asociada a diarrea (D-). Esta clasificación tiene repercusiones importantes ya que etiología, curso clínico y pronóstico de ambas entidades son diferentes. Las manifestaciones neurológicas ocurren en el 30% de los casos.
Pueden vincularse a alteraciones metabólicas (edema cerebral), las cuales deben presumirse en presencia de hiponatremia dilucional y son rápidamente reversibles después de diálisis. Si el enfermo no tiene sobrehidratación, deben sospecharse lesiones por microangiopatía trombótica de arteriolas y capilares. Incluyen cambios conductuales, convulsiones, encefalopatías, ceguera, ataxia, afasia, hemiparesia, rigidez de descerebración, etc. No existe terapia que se haya mostrado eficaz para prevenir o limitar el proceso microangiopático y consecuentemente afectar el curso de la enfermedad. Existen datos acerca del beneficio de la nefrectomía bilateral, basándose en la evidencia que la ablación elimina el mayor sitio de fragmentación del factor de von Willebrand, limita la activación de las plaquetas y protege a los pacientes de una diseminación de las lesiones microvasculares. La nefrectomía bilateral detiene la progresión de la enfermedad en pacientes plasma – resistentes con signos neurológicos y coma. En cuanto a la hiponatremia, es la presencia de síntomas y no la duración de la hiponatremia lo que guía el tratamiento.
INTRODUCCIÓN
Hemos decidido realizar una revisión bibliográfica sobre síndrome urémico hemolítico, y sus complicaciones neurológicas. Si bien el compromiso renal es la alteración más constante de este síndrome, se trata de una enfermedad multisistémica que afecta otros órganos (intestino, corazón, cerebro, etc.). Dentro del compromiso extrarrenal la afectación del sistema nervioso central (SNC) es significativa no solo por su incidencia, sino también por la posibilidad de secuelas neurológicas discapacitantes. Otro de los motivos que nos llevo a tratar este tema es la frecuencia con que vemos pacientes con esta patología internados en las salas de nuestra institución hospitalaria.
Del material obtenido de esta búsqueda pudimos recabar gran cantidad de información acerca de las características generales de dicho síndrome, pero encontramos pocos estudios sobre las complicaciones neurológicas en particular.
Los estudios encontrados se basan en experiencias con escaso número de pacientes y los datos que arrojan si bien son coincidentes entre sí, aun no han sido completamente evaluados. Nuestro interés también radicó en las posibles etiologías de este síndrome para poder evaluar más adelante posibles tratamientos o tratar de prevenir tanto las complicaciones neurológicas como de otros posibles órganos de choque, y así evitar la morbimortalidad del mismo.
CARACTERÍSTICAS GENERALES
El síndrome urémico hemolítico (SUH) es un grupo heterogéneo de entidades similares con etiologías, expresión clínica y severidad variables. Todas se caracterizan por la presencia de anemia hemolítica microangiopática, trombocitopenia y falla renal aguda. De hecho, el síndrome urémico hemolítico (SUH) es la causa más frecuente de insuficiencia renal aguda en los niños pequeños y su incidencia está en aumento. 1
Se distinguen seis categorías etiológicas:
1) infantil clásico,
2) postinfeccioso,
3) hereditario,
4) inmunológico,
5) secundario,
6) endocrino.
Las formas infantil y postinfecciosa son las más habituales, la infantil es precedida por un pródromo viral/diarreico y tiene un pronóstico relativamente bueno. La postinfecciosa cursa muchas veces con diarrea y puede estar causada por virus (ECHO, adenovirus, rotavirus, Coxsackie, varicela, HIV, Epstein Barr, gripe, etc) o bacterias como salmonella, campylobacter, Shigella, streptococcus pneumoniae, Yersinia y principalmente Escherichia coli O157:H7 verotoxigénico. Existe una incidencia estacional con predominio en la parte media del verano. Las hamburguesas poco cocidas parecen ser un vehículo fundamental para las epidemias de Escherichia coli O157:H7 transmitida por alimentos, lo que sugiere un reservorio epizoótico.
Se cree que en la forma hereditaria interviene una deficiencia de prostaciclina y anormalidades en el manejo del factor de Von Willebrand. Tiene un patrón heterogéneo de herencia y se presenta como síndrome urémico hemolítico (SUH) o como púrpura trombocitopénica trombótica (PTT) en varios miembros de una misma familia. Tiene un pronóstico generalmente malo, la insuficiencia renal crónica o la muerte son reportadas en el 50 al 100% de los casos.
La forma inmunológica se identifica por disminución del factor C3 del complemento. Las formas secundarias pueden ser causadas por lupus eritematoso sistémico, esclerodermia, hipertensión maligna, inmunosupresión, quimioterapia, ciclosporina, mitomicina, intoxicación por dietilenglicol, etc. Las causas endocrinas incluyen embarazo y la ingesta de anticonceptivos orales. 2
Desde el punto de vista clínico se pueden distinguir dos formas de síndrome urémico hemolítico (SUH). La que comienza como una gastroenteritis, con fiebre, dolor abdominal, vómitos y diarrea a menudo sanguinolenta, se considera como síndrome urémico hemolítico (SUH) D + o típico. Se presenta en forma esporádica, casos aislados en la comunidad o en pequeños brotes epidémicos en grupos familiares o institucionales y en niños generalmente sanos en buen estado nutricional. Más raramente se presenta como una infección respiratoria alta que se sigue 5 a 10 días después de palidez, letargia, irritabilidad, debilidad y oliguria, esto se conoce como síndrome urémico hemolítico (SUH) D - o atípico. Se da en casos esporádicos o concomitantes, especialmente en formas familiares y recurrentes. Sin embargo también se han reportado casos no precedidos por diarrea y asociados a Escherichia coli productora de verotoxina. Los lactantes con diarrea prominente tienen mucho mejor pronóstico que los niños con un pródromo respiratorio y sin síntomas gastrointestinales. Un tercio de los pacientes con síndrome urémico hemolítico (SUH) atípico tienen compromiso del sistema nervioso central al inicio de la enfermedad, con convulsiones y alteraciones de la conciencia que persisten a pesar de la corrección de la hipertensión y las complicaciones metabólicas de la insuficiencia renal. 1,2,3
Al examen físico suele haber deshidratación, edemas, petequias, palidez, hepatoesplenomegalia y gran irritabilidad. Casi todos desarrollan anemia hemolítica Coombs negativa e insuficiencia renal aguda con hematuria microscópica y proteinuria (1 –2 g/dl). Un tercio de los pacientes presenta anuria y dos tercios de ellos desarrollan hipertensión arterial. La hipercalcemia es habitual, junto con una significativa uremia y acidemia. 30 a 50% de los pacientes requieren diálisis.
Las manifestaciones neurológicas ocurren en el 30% de los casos. Incluyen cambios conductuales generalizados, convulsiones motoras, encefalopatías, ceguera, ataxia, afasia, hemiparesia, rigidez de descerebración, etc, que serán tratadas en el transcurso del texto. 2
El compromiso extrarrenal es el mayor determinante de la morbimortalidad en esta enfermedad. El compromiso trombótico de grandes vasos y la afección multiorgánica son poco frecuentes, pero tienen un alto grado de mortalidad en la etapa aguda. Otros órganos que pueden afectarse son el páncreas (diabetes insulinodependiente), corazón (miocarditis, infarto), hígado (hepatitis), músculo (rabdomiolisis), pulmón (edema, hemorragia). Los dos parámetros con mayor valor pronóstico son la duración del fallo renal (mayor de 14 días) y la afectación neurológica concomitante, siendo este último el más determinante. 4
El diagnóstico de síndrome urémico hemolítico (SUH) se sustenta en la tríada de anemia hemolítica microangiopática, trombocitopenia e insuficiencia renal aguda. Generalmente la hemoglobina se encuentra en el intervalo 5 - 9 g/dl. El frotis revela células “en casco”, esquistocitos y eritrocitos fragmentados que son característicos pero no patognomónicos. Los valores de LDH están incrementados reflejando no sólo hemólisis sino también isquemia tisular. Los niveles de haptoglobina son bajos o indetectables, hay hemoglobina libre circulante, los reticulocitos aumentan, todos son indicadores de la acelerada disrupción y producción de hematíes. La prueba de Coombs es negativa (salvo en el síndrome urémico hemolítico (SUH) asociado a neumonía por neumococo), los leucocitos aumentan hasta 30.000/mm3. La trombocitopenia está presente en el 90% de los casos. En la orina suele aparecer microhematuria y proteinuria mínimas. La urea y la creatinina están elevadas según el grado de insuficiencia renal. El ionograma puede mostrar hiperkalemia en pacientes oligoanúricos, e hiponatremia dilucional por sobrehidratación. La detección de hiperglucemia importante y sostenida es índice de daño pancreático. El coagulograma generalmente es normal. La biopsia rara vez está indicada (insuficiencia renal mayor a 2 semanas), y se contraindica en pacientes plaquetopénicos. 1
La lesión histológica específica del SUH/PTT consiste en un engrosamiento de la pared vascular de capilares y arteriolas, con edema y desprendimiento de las células endoteliales de la membrana basal y acumulación de un material algodonoso en el subendotelio. En el síndrome urémico hemolítico (SUH) los microtrombos están confinados casi exclusivamente al riñón, es por eso que el fallo renal es la característica predominante. En la púrpura trombocitopénica trombótica (PTT), el cerebro es el órgano involucrado principalmente y aparentemente los microtrombos se forman y dispersan rápidamente, produciendo síntomas neurológicos intermitentes. 5
FISIOPATOGENIA
La fisiopatología general de la enfermedad está en la mayoría de los casos referida a la insuficiencia renal aguda. La caída del filtrado glomerular por la microtrombosis glomerular y otros factores que se consideran luego, lleva a la retención de productos azoados y ácidos inorgánicos, lo que produce elevación de la urea, la creatinina, el ácido úrico y los fosfatos, con disminución del bicarbonato (acidosis metabólica) y en casos de anuria hiperkalemia. Puede también haber sobrehidratación con hiponatremia dilucional, y si no la hay, el paciente siempre está propenso a desarrollarla si recibe excedentes de sal.
La presencia de hematíes fragmentados, reticulocitosis, aumento de la bilirrubina, trombocitopenia y lesiones de microtrombosis dieron lugar, según Luis Voyer, a dos teorías patogénicas:
1) la noxa causante de la enfermedad produciría hemólisis y esto por liberación de tromboplastina, desencadenaría coagulación intravascular diseminada con consumo de plaquetas, microtrombosis y daño de parénquimas.
2) la noxa causal produciría una lesión ulcerativa del endotelio. Sobre esta lesión se depositaría fibrina, plaquetas y se formarían microtrombos que llevarían a la consecuente lesión de parénquimas. La hemólisis ocurriría por la ruptura mecánica de los hematíes contra las paredes rugosas de los pequeños vasos que presentan su luz estrechada.
Hoy en día se conoce que puede haber un daño hemolítico primario además de la ruptura mecánica de los hematíes secundaria a los depósitos de fibrina. Se considera que la hemólisis y el daño endotelial pueden ocurrir en forma independiente y a la vez interrelacionados.
En cuanto a las manifestaciones neurológicas, deben diferenciarse aquellas vinculadas a alteraciones metabólicas de aquellas otras consecuencias de microtrombosis o hemorragias. Las primeras, de origen metabólico, se deben principalmente al edema cerebral; se presentan por lo general tempranamente, al iniciarse el período de estado con oliguria. Pueden presumirse en presencia de hiponatremia dilucional y son rápidamente reversibles después de diálisis con soluciones hipertónicas. También pueden ocurrir en pacientes que reciben bicarbonato de sodio y sobrecarga de aportes hídricos. Si el enfermo no tiene sobrehidratación o si ésta se controla mediante diálisis hipertónica y las manifestaciones neurológicas están presentes y se mantienen en los días subsiguientes, incluso agravándose o con signos de focalización, se deben sospechar las lesiones de microtrombosis o hemorragia encefálica. La mayoría de las veces el componente neurológico de convulsiones, obnubilación, signos de foco, amaurosis, coma o acentuada irritabilidad está precedido por las alteraciones metabólicas. 4
Alteraciones metabólicas
Hiponatremia: se la define como la disminución de la concentración de sodio por debajo de 135 mEq/l. En el caso del síndrome urémico hemolítico (SUH) se trata de una hiponatremia en la que el sodio corporal está elevado pero el aumento del agua corporal total es mayor (hipervolemia). Se produce una expansión intersticial e intravascular, y el edema se desarrolla cuando la ingesta de agua y sodio excede la capacidad renal de excretarlo. La limitación en la capacidad de excreción de agua y sodio es la resultante de la caída del filtrado glomerular. El grado de hipervolemia se relaciona directamente con el ingreso de agua y sal en exceso con respecto a las pérdidas extrarrenales.
Los síntomas de la hiponatremia pueden ser náuseas, vómitos, cefaleas, debilidad muscular, letargia, ataxia, psicosis, etc. Cuando el edema cerebral es severo y hay aumento de la presión intracraneal, se pueden presentar convulsiones, coma, herniación tentorial y depresión respiratoria. 6
Alteraciones vasculares
El término microangiopatía trombótica (MAT) se refiere a una lesión estructural de la pared vascular de arteriolas y capilares principalmente, con engrosamiento de la misma, trombosis plaquetaria intraluminal y obstrucción parcial o completa de la luz vascular. La presencia de trombocitopenia y anemia hemolítica son características constantes de la microangiopatía trombótica (MAT) y reflejan el consumo y la disrupción de plaquetas y hematíes en la microvasculatura. Se presenta tanto en el síndrome urémico hemolítico (SUH) como en la púrpura trombocitopénica trombótica (PTT), dos entidades patológicamente indistinguibles pero clínicamente diferentes. La injuria a las células endoteliales es el factor principal y probablemente inicial en la secuencia de eventos que llevan a la MAT.
AGENTES IMPLICADOS EN LA ACTIVACIÓN Y EL DAÑO ENDOTELIAL
Toxinas
En los casos de síndrome urémico hemolítico (SUH) asociados a infección por enterobacterias productoras de citotoxinas, la localización de las lesiones estaría dada por la presencia de receptores celulares para dichas citotoxinas.
Se sabe que Shigella dysenteriae tipo 1 produce la shiga toxina 1 (Stx), y que Escherichia coli 0157:H7 es productor de verotoxina (VT), también llamada toxina shiga like. Éstas toxinas se fijan a receptores celulares produciendo la muerte celular por inhibición de la síntesis proteica.
Luego de la ingestión oral de alimentos o agua contaminada, la Escherichia coli 0157:H7 se adhiere a las células epiteliales de la mucosa intestinal a través de una proteína externa de membrana llamada intimina. Produce una lesión característica de adhesión y esfácelo destinada a prevenir la expulsión del microorganismo. La rotura consecuente del borde en cepillo es suficiente para ocasionar diarrea sanguinolenta. Sumado a esto, la bacteria produce grandes cantidades de verotoxina (VT), la cual atraviesa las células epiteliales polarizadas gastrointestinales, probablemente a través de la vía transcelular, para luego llegar a la circulación general. La forma de transporte de la toxina desde el intestino hacia el resto de los órganos es aún desconocida, no obstante nunca fue detectada toxina libre en circulación en los pacientes con síndrome urémico hemolítico (SUH). Un estudio reciente reveló in vitro una rápida unión de la verotoxina (VT) a los leucocitos polimorfonucleares (PMN), no así a los hematíes, plaquetas y monocitos. El receptor de los polimorfonucleares (PMN) para la verotoxina (VT) tiene 100 veces menor afinidad por la toxina que el receptor de alta afinidad presente en las células endoteliales glomerulares. Como consecuencia de ello, al menos in vitro, los polimorfonucleares (PMN) cargados de toxina transfieren el ligando a las células epiteliales glomerulares, lo que promueve la muerte celular. Si este proceso ocurriese in vivo se podría explicar el rápido clearance plasmático de la toxina y su consecuente liberación a los órganos blanco donde ejerce su efecto citopático.
Las verotoxinas (VT) se unen a las células blanco a través de un glicolípido neutro Gb3 y la globotetraosylceramida Gb4, y producen inhibición de la síntesis proteica por medio de una glicosidasa –N específica. La exposición al TNF alfa incrementa en la superficie celular la expresión de Gb3 ya que el mismo media la unión e internalización de la toxina por endocitosis.
Un conjunto de estudios sugieren que el aumento de la producción de citoquinas, activación de los polimorfonucleares (PMN) y el aumento en la actividad oxidativa potencia los efectos citopáticos directos de la verotoxina (VT), todo lo cual sirve para amplificar el daño vascular y alterar el fenotipo normal de tromborresistencia de las células endoteliales.
Existe evidencia experimental que demuestra la coincidencia en los sitios de expresión de la Gb3 con los sitios de daño tisular producidos por la verotoxina (VT). Un estudio reciente en mandriles, los cuales comparten con los humanos idéntica distribución del receptor Gb3 gastrointestinal y renal, demostró que ante la inyección de verotoxina (VT) se produce una injuria directa a las células endoteliales de la microcirculación gastrointestinal y renal; y que este evento precede a la trombosis microvascular, la trombocitopenia y la hemólisis. En este modelo animal, los cambios estructurales que se asemejan a los hallazgos de necropsias de niños con síndrome urémico hemolítico (SUH) y compromiso neurológico, fueron también detectados en el sistema nervioso central a pesar de la baja expresión de receptores Gb3 en este órgano.
Endotoxinas
Ante una infección por Escherichia coli, las endotoxinas bacterianas (lipopolisacáridos) se sinergizan en el daño inicial a los órganos blanco. Los lipopolisacáridos susceptibilizan a las células endoteliales a la apoptosis cuando son expuestas a cantidades picomolares de verotoxina (VT); además activan a los polimorfonucleares (PMN) que liberan TNFa, IL-1, elastasa y radicales libres, que son altamente tóxicos para el endotelio microvascular.
Complejos inmunes
En pacientes con SUH/PTT han sido demostrados tanto en plasma como en suero, anticuerpos dependientes de complemento, que son citotóxicos para las células endoteliales. En las formas familiares recidivantes se han observado hipocomplementemias persistentes no sólo en enfermos con síndrome urémico hemolítico (SUH), sino también en pacientes sanos. Estudios de HLA dieron haplotipo A3 B7. Existe posiblemente en estos casos un condicionamiento genético en la patogenia de la enfermedad.
En la forma endemoepidémica, en un 40% de los casos se ha visto hipocomplementemia transitoria y su persistencia se dio en casos que presentaron peor evolución.
Pérdida de la tromborresistencia fisiológica
Todas las propiedades del endotelio vascular normal están alteradas en el síndrome urémico hemolítico (SUH). Las células endoteliales sintetizan muchas sustancias involucradas en la coagulación y fibrinólisis, incluyendo prostaciclinas, óxido nítrico, trombomodulina, inhibidor del activador tisular de plasminógeno y proteína S. Se han reportado alteraciones en los valores de estas sustancias en pacientes con SUH/PTT.
En cuanto a las prostaglandinas están las de acción antiagregante plaquetaria y vasodilatadora como la PGI2 o prostaciclina y la PGE2 y las de acción antagónica como la PGF2 y el tromboxano A2, que normalmente mantienen un equilibrio, desempeñando un papel fundamental para regular fenómenos de coagulación y hemodinamia. Trastornos metabólicos y diversos medicamentos alteran la síntesis de prostaglandinas. En algunos casos de síndrome urémico hemolítico (SUH) hereditarios hay evidencias de defectos primarios, disminuida capacidad del suero para inducir la producción de prostaciclinas tisulares. En las formas endemoepidémicas, que son las de más frecuente observación, desequilibrios primarios de este sistema no desempeñan un rol significativo, pero pueden ocurrir alteraciones secundarias. Se ha demostrado que la verotoxina (VT) aumenta la liberación de PGI2 en monocapa de células endoteliales microvasculares y este efecto es independiente de la estimulación por TNF alfa y lipopolisacáridos. En cambio, la verotoxina (VT) no promueve la liberación de PGI2 en las células endoteliales de grandes vasos a menos que las mismas fueran preestimuladas con TNF alfa o lipopolisacáridos. Se ha observado también que la verotoxina (VT) purificada de Escherichia coli 0157:H7 inhibe la síntesis de prostaciclinas por células endoteliales.
Entonces, ha sido referida tanto una acción estimuladora como inhibidora del plasma de pacientes urémicos sobre la producción de PGI2. Estas discordancias pueden interpretarse en relación a condiciones experimentales utilizadas en los ensayos biológicos.
Adhesión leucocitaria al endotelio dañado
Por evidencia clínica y experimental ha sido documentado que la interacción entre leucocitos y células endoteliales dañadas es importante para el desarrollo de la injuria microvascular en los casos de síndrome urémico hemolítico (SUH) asociado a verotoxina (VT). Los neutrófilos de los niños en etapa aguda del síndrome urémico hemolítico (SUH) se adhieren a células endoteliales in vitro más firmemente que los neutrófilos normales, e inducen una injuria celular mediante la degradación de la fibronectina de las células endoteliales, posiblemente por la liberación de proteasas específicas de neutrófilos. Entre los mediadores inflamatorios que son liberados por los neutrófilos adheridos al endotelio se encuentran los radicales libres del oxígeno, que demostraron tener un efecto citotóxico directo sobre el endotelio vascular. La producción excesiva de anión superóxido por los neutrófilos de los pacientes con síndrome urémico hemolítico (SUH) está a favor de colocar a los radicales libres del oxígeno en un papel importante en la génesis del daño endotelial inducido por neutrófilos.
Alteraciones de la fibrinolisis
En el plasma de los pacientes con síndrome urémico hemolítico (SUH) están significativamente aumentados respecto de los controles sanos los niveles de: activador del plasminógeno tisular, inhibidor del activador del plasminógeno tisular, factor de von Willebrand y productos de degradación del fibrinógeno. Están elevados también los inhibidores de la fibrinolisis y su persistencia estaría asociada a una mala evolución.
En individuos normales, el factor de von Willebrand se forma en grandes multímeros ultralargos debido a la polimerización de la subunidad nativa en las células endoteliales y megacariocitos, siendo luego almacenado como tal. Los multímeros ultralargos generalmente no alcanzan la circulación, ya que son rápidamente reducidos por clivaje a multímeros más pequeños luego de su secreción.
En pacientes con SUH/PTT, a diferencia de los sujetos sanos, se detectaron en plasma multímeros ultralargos circulantes, los cuales in vitro son capaces de inducir agregación plaquetaria más eficientemente que los multímeros normales. Esto se interpretó como una evidencia de su rol patogénico en la trombosis microvascular. No obstante, pruebas directas de ello no han sido jamás provistas; por el contrario, toda evidencia disponible es contraria a la posibilidad de que estos multímeros ultralargos presentes en la circulación puedan generar trombosis microvascular. Además los mismos multímeros ultralargos del factor de von Willebrand fueron hallados en neonatos y fetos, en tanto que desaparecen dentro de los primeros meses de vida indicando un rol menos eficiente del clivaje fisiológico al nacimiento, que logra su completo desarrollo más tardíamente.
Síndrome urémico hemolítico (SUH) asociado a neuraminidasa
Es una enfermedad rara pero potencialmente fatal, que puede complicar cuadros de neumonía o, menos frecuentemente, de meningitis causada por neumococo y probablemente por algunos virus. La neuraminidasa rompe el ácido siálico de los eritrocitos, plaquetas y endotelios exponiendo al antígeno T para el cual existen anticuerpos naturales en la fracción IgM del plasma. Esto desencadena poliaglutinación con hemólisis y reacción de Coombs positiva, trombocitopenia y trombosis.
El cuadro clínico es severo, con distrés respiratorio, anuria, compromiso neurológico y coma. 5
TROMBOSIS MESENTÉRICA Y ACCIDENTE CEREBROVASCULAR (ACV) HEMORRÁGICO EN PACIENTES CON SUH ENTEROPÁTICO
En un archivo argentino de pediatría del 2001, se presentan 2 niños con síndrome urémico hemolítico (SUH) asociado a diarrea, el primero con accidente cerebrovascular con extenso sangrado occipital y el segundo debutó con trombosis de arteria mesentérica que requirió urgente resección del íleon terminal hasta la unión rectosigmoidea. Ambos padecieron insuficiencia renal grave y tuvieron buena evolución clínica posterior.
Paciente 1
Niño de 2 años, previamente sano, derivado a la sección de terapia intensiva con diagnóstico de síndrome urémico hemolítico (SUH) de 14 días de evolución. Había debutado con diarrea mucosanguinolenta seguida de insuficiencia renal, oligoanuria de 14 días (urea 300mg/dl; creatinina 10mg/dl), anemia hemolítica, plaquetopenia hipertensión arterial moderada. Medicado con cefotaxime y amikacina por sospecha de sepsis. 4 días antes de su derivación presentó convulsiones tónico-clónicas generalizadas y focalizadas secundarias a accidente cerebrovascular hemorrágico témporo-parieto-occipital derecho, confirmado por tomografía. Las mismas se controlaron con una dosis de carga de fenobarbital y difenhidramina.
Al ingreso en la terapia se constató: urea 400 mg/dl, creatinina 10 mg/dl, plaquetas 50.000/mm3, hematocrito 21%, hemorragia digestiva, hipertensión arterial moderada (140/90 mmHg), Glasgow 10/15, hemiparesia izquierda y anopsia bilateral confirmada con potenciales evocados. Por serología se confirmó verotoxina tipo 2 positiva. Evolucionó con fallo multiorgánico, requirió diálisis peritoneal por 21 días, nifedipina y propanolol. Presentó Quick de 40%, KPTT 65 segundos y requirió dos transfusiones de crioprecipitados, cuatro de glóbulos rojos, dos de plaquetas, plan de plasma 10 ml/kg/día dos días asociado a vitamina K. Necesitó soporte inotrópico y nutrición parenteral.
A los 34 días la hemiparesia mejoró pero persistió la anopsia bilateral. Al decimoprimer mes de tratamiento no presentaba secuelas motoras, había mejorado la agudeza visual, la función renal era normal, estaba normotenso y sin proteinuria, en tratamiento con enalapril.
Paciente 2
Niña de 2 años y 8 meses, previamente sana, ingresó por deshidratación leve secundaria a gastroenteritis con deposiciones mucosanguinolentas de 72 hs de evolución. El laboratorio mostró microhematuria con función renal normal, coprocultivo con Escherichia coli enteropatógena y Klebsiella pneumoniae, hemocutivos y urocultivos negativos. No se aisló la verotoxina.
A las 24 horas de internación se derivó a la terapia intensiva por presentar shock séptico, abdomen sugestivo de peritonitis que requirió sección de íleon terminal por trombosis mesentérica. Evolucionó con fallo multiorgánico, urea de 260 mg/dl, creatinina de 7 mg/d, al tercer día requirió hemodiafiltración (4 días) y hemodiálisis (15 días). Recibió inotrópicos y asistencia respiratoria mecánica (6 días). Requirió cinco transfusiones de glóbulos rojos, tres de plaquetas y una de plasma por diátesis hemorrágica concordante con 40.000 plaquetas/mm3, hematocrito 21%, Quick 55%, KPTT 60 segundos.
Al sexto día de internación presentó convulsiones y se realizó impregnación con fenobarbital. Se completó el estudio con electroencefalograma (EEG) que mostraba ondas lentas sin foco; la TAC informó atrofia cerebral y el fondo de ojos era normal. A los 8 días comenzó con hipertensión arterial 150/90 mmHg que se controló con nifedipina. Luego de 1 año de evolución la paciente recuperó su función renal normotensa sin medicación, sin secuelas neurológicas y con recuperación del tránsito intestinal.
Podemos decir que el compromiso extrarrenal es el mayor determinante de muerte en la etapa aguda del síndrome urémico hemolítico (SUH), y a su vez, influye en la morbilidad a largo plazo. La causa de muerte es generalmente por intercurrencia infecciosa o grave compromiso neurológico, cardíaco o intestinal. El compromiso del sistema nervioso central se asocia por lo general a trastornos hidroelectrolíticos y compromiso microangiopático. El accidente cerebrovascular hemorrágico, al igual que el compromiso trombótico de grandes vasos del tubo digestivo es ocasional.
Si bien la mortalidad del síndrome urémico hemolítico (SUH) en la actualidad ha disminuido, cuando se presenta fallo multiorgánico en niños oscila entre 50 y 84%. Probablemente el tratamiento precoz agresivo, que incluya hemodiafiltración o diálisis peritoneal, manejo de la hipertensión arterial, trastornos hidroelectrolíticos, hemorrágicos, digestivos y la rehabilitación para la recuperación neurológica favorecería la buena evolución en estas patologías de tan elevada morbimortalidad. 7
COMPLICACIONES NEUROLÓGICAS / NEUROFISIOLOGÍA DEL SÍNDROME URÉMICO HEMOLÍTICO (SUH)
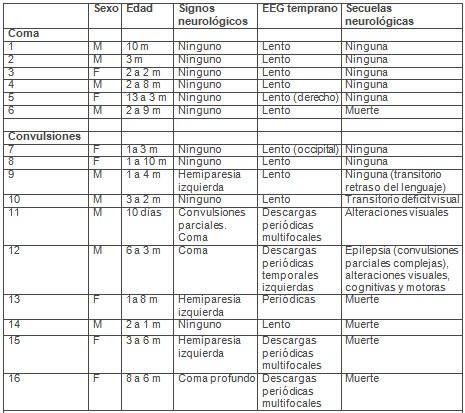
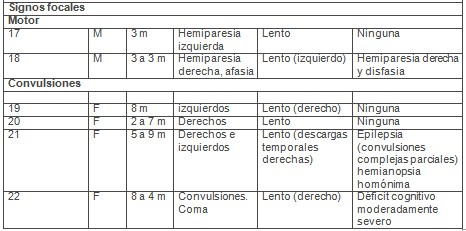
Se realizó un estudio en un hospital pediátrico en Londres, con 22 niños (11 niños y 11 niñas, edad promedio de 3.3 años) con síntomas gastrointestinales y hallazgos diagnósticos coincidentes con el diagnóstico de síndrome urémico hemolítico (SUH). 5 de ellos tenían cultivos positivos (E. coli en 3, rotavirus en 1 y Shigella en el restante). Todos ellos presentaron algún signo de compromiso neurológico durante la fase aguda del síndrome urémico hemolítico (SUH) y fueron sometidos a una investigación neurofisiológica. Se realizaron electroencefalogramas (EEG) y potenciales evocados. El tiempo de seguimiento fue de 4.4 años.
Cinco de los 22 niños murieron durante la fase aguda de la enfermedad. 14 de ellos presentaron convulsiones, 6 coma o irritabilidad, y signos de foco neurológico (afasia, hemiparesia) en los 2 restantes.
Diez de los 22 pacientes presentaron signos de foco motor post-ictal. En el seguimiento, 7 de los 18 sobrevivientes tuvieron secuelas neurológicas, incluyendo convulsiones parciales complejas, déficit cognitivo, defectos visuales corticales, hemiparesia, afasia. En 10 de ellos no hubo secuelas neurológicas, 2 tuvieron algún tipo de alteración transitoria dentro del año siguiente a la enfermedad.
Se observó que la presencia de convulsiones se asocia con mayor índice de mortalidad o secuelas neurológicas a largo plazo.
Durante la fase aguda del síndrome urémico hemolítico (SUH) una variedad de signos focales y generalizados se observan en el electroencefalograma (EEG). En los que sobrevivieron se observó un enlentecimiento generalizado de la actividad, que no se asoció con secuelas neurológicas a largo plazo. Alteraciones periódicas del electroencefalograma (EEG) fueron asociadas con mayor morbimortalidad.
En 4 pacientes se vio enlentecimiento lateralizado hacia un hemisferio. Uno de ellos mostró severo deterioro cognitivo, otro hemiparesia y disfasia. Descargas focales de la región temporal fueron vistas en 2 pacientes, que luego presentaron epilepsia con convulsiones parciales y complejas.
Los potenciales evocados visuales mostraron reducción de las amplitudes en 3 pacientes.
Con este estudio es posible demostrar que un proceso cerebral específico o la presencia de descargas epilépticas focales pueden detectarse tempranamente con electroencefalograma (EEG), donde se evidencian anormalidades regionales especialmente en las regiones temporales y occipitales. 8
FACTORES CLÍNICOS Y PRONÓSTICOS
Se realizó en España un estudio con 10 niños que padecieron síndrome urémico hemolítico (SUH), la edad media de los pacientes era de 26 meses, haciendo una valoración de los factores clínicos pronósticos de la enfermedad. La distribución de sexos fue de 6 mujeres y 4 varones.
Se apreció la elevada incidencia de todos los casos durante los meses cálidos del año. Los días de evolución en su domicilio hasta que se llegó al diagnóstico oscilaron entre 2 y 30 días. Los principales síntomas de inicio fueron: postración y algún vómito esporádico (en todos los casos), diarrea con sangre (80%), palidez y fiebre (70%) y dolor abdominal (60%). El síntoma más precoz que motivó la consulta fue la diarrea en 7 de los 10 casos.
En la exploración y exámenes complementarios de los días iniciales se destacó: púrpura cutánea en un 30%, hipertensión arterial en un 90%, oligoanuria en el 70% (diuresis inferior a 0,5 ml/kg/h) y oliguria en los restantes. En la bioquímica urinaria se vio: proteinuria (80%) y hematuria (70%). En el resto de las pruebas existía anemia en un 90%, leucocitosis mayor a 15.000/mm3 en un 70%, trombocitopenia en el 90%, creatinina mayor a 2 mg/dl en el 90% e hiperkalemia en el 50%.
La duración de la oliguria fue muy variable, oscilando entre menos de 5 días en cuatro casos, hasta superar los 30 días en 2 casos, uno de los cuales quedó en programa de diálisis y luego fue trasplantado. En nueve de los diez casos se usó la diálisis peritoneal como tratamiento del síndrome urémico hemolítico (SUH). Otro de los aspectos terapéuticos fueron las transfusiones hemáticas que se administraron a todos los pacientes, en tres de los casos también se usó plasma fresco durante la primera semana.
Se practicó biopsia renal en 6 pacientes, en 4 se demostró una microangiopatía de tipo glomerular, en uno de tipo arterial y en otro múltiple.
Las manifestaciones extrarrenales más frecuentes (tabla) fueron las neurológicas: convulsiones el 30%, en el 80% se realizó electroencefalograma (EEG) que fue patológico en la mitad de los casos. También en la mitad de los casos se efectuó TAC, siendo en tres de ellos anormales (atrofia cortical en dos, y córtico – subcortical en una). En un caso se presentó a los 35 días del ingreso un cuadro suboclusivo secundario a necrosis cólica. Un paciente (lactante) debutó con un edema de pulmón secundario a hipertensión arterial severa que había pasado inadvertida durante más de un mes.
En cuanto a las secuelas (tabla), dos pacientes quedaron con una insuficiencia renal crónica grave, uno de ellos fue trasplantado y falleció al poco tiempo, el otro quedó con mala función renal (aclaramiento de creatinina de 20). Respecto a las de tipo neurológico, tres pacientes han quedado con secuelas, uno con un trazado de electroencefalograma (EEG) hipsarrítmico, otro con una grave encefalopatía y un tercero con ligero retraso psicomotor (coeficiente intelectual de 80), en los tres había traducción morfológica en la TAC con atrofia cortical de distinto grado.
Si agrupamos a los pacientes en función de la oliguria inicial, se ve que en los que tuvieron oliguria inferior a 7 días se respeta el buen pronóstico, mientras que cuando ésta es prolongada o hay anuria, las repercusiones renales o neurológicas son más severas. Entonces desde el punto de vista pronóstico, la duración de la oliguria puede ser un punto de referencia importante, pero debe ir asociada a otros indicadores de mal pronóstico: hipertensión mantenida y difícil de controlar, patrón anatomopatológico y las manifestaciones neurológicas.
Para poder definir estrictamente las secuelas, el seguimiento debe ser prolongado, ya que algunas lesiones pueden detectarse en fases posteriores. En este estudio, los dos pacientes con secuelas mínimas (hipsarritmia bajo control terapéutico y sin deterioro neurológico y proteinuria inicial), aparecieron al cabo de meses y años respectivamente.
Las distintas opciones terapéuticas no parecen haber mejorado los resultados de un control precoz de la HTA, la insuficiencia renal aguda y las complicaciones neurológicas.
Parece que a medida que se conoce mejor el cuadro, diagnosticándose en forma más precoz y con un tratamiento más completo, las cifras de mortalidad han disminuido del 15 al 5% en los últimos años; mientras que las secuelas se mantienen entre el 15 25%, siendo la mitad de ellas neurológicas y la otra de tipo renal. Con todo esto se enmarca al síndrome urémico hemolítico (SUH) fuera del ámbito exclusivamente nefrológico para pasar a ser una entidad cuya base terapéutica es el tratamiento del fallo renal, pero cuyo sustrato patogénico es el de un cuadro multisistémico con depósitos de fibrina en la microcirculación que origina trombosis intravascular. 9
TRATAMIENTO
No existe ninguna terapia que se haya mostrado eficaz para prevenir o limitar el proceso microangiopático y consecuentemente afectar el curso de la enfermedad. El tratamiento debe ser sintomático: medidas de soporte, control de la anemia, insuficiencia renal, hipertensión arterial y disbalance de agua y electrolitos. Los agentes antidiarreicos pueden incrementar el riesgo de megacolon tóxico. El uso de antibióticos para tratar la infección por Escherichia Coli O157:H7 han demostrado aumentar 17 veces el riesgo de síndrome urémico hemolítico (SUH), ya que la injuria a la membrana bacteriana inducida por el antibiótico podría favorecer la liberación de grandes cantidades de toxina preformada. En caso de diarrea sanguinolenta por cepas de E. Coli distintas a la O157H7 o por otras bacterias como Shigella dysenteriae tipo 1, el uso de tratamiento antibiótico empírico acorta la duración de la diarrea, disminuye el índice de complicaciones y reduce el riesgo de transmisión de la enfermedad. En la actualidad la infección por Escherichia Coli O157 no confiere inmunidad y no existe disponible ninguna vacuna humana.
Los niños con síndrome urémico hemolítico (SUH) asociado a la verotoxina (VT) de Escherichia Coli generalmente se recuperan espontáneamente y no requieren terapia con plasma, a diferencia de los adultos en quienes siempre debe ser intentado para minimizar el riesgo de secuelas o muerte.
El recuento de plaquetas y el nivel sérico de LDH son los marcadores más sensibles para monitorear la respuesta a la terapia con plasma, aunque no existen parámetros clínicos que puedan predecir de forma precisa la duración del tratamiento. La decisión de continuar o suspender la terapia es empírica. La rápida exacerbación de la actividad de la enfermedad es común luego de la discontinuación del tratamiento, y se manifiesta por reducción del recuento de plaquetas, requiriendo retomar la terapia con plasma.
En algunos casos la actividad de la enfermedad no se detiene a pesar de la intensificación del recambio plasmático por lo que son necesarios tratamientos alternativos. La esplenectomía ha producido remisión sólo en algunos pacientes. Existen datos acerca del beneficio de la nefrectomía bilateral, basándose en la evidencia que la ablación elimina el mayor sitio de fragmentación del factor de von Willebrand, limita la activación de las plaquetas y protege a los pacientes de una diseminación de las lesiones microvasculares. 1,4
La nefrectomía bilateral detiene la progresión de la enfermedad en pacientes plasma – resistentes con signos neurológicos y coma. La infusión de plasma o el recambio, resulta efectivo para detener la enfermedad en la mayoría de los casos. Sin embargo, en el 20% de los casos de adultos la manipulación del plasma no dio resultados. La esplenectomía fue realizada en pacientes con síndrome urémico hemolítico (SUH) severo, pero un estudio reciente con un número importante de individuos mostró una alta tasa de mortalidad y mayor duración de la enfermedad en aquellos que fueron esplenectomizados comparados con los que recibieron sólo plasma. La Sociedad Internacional de Nefrología realizó nefrectomía bilateral a 4 pacientes con diagnóstico de síndrome urémico hemolítico (SUH) severo, resistente al plasma. Éste es definido como hemólisis persistente, recuento bajo de plaquetas y signos neurológicos (incluido coma en 2 casos). La cirugía fue seguida de normalización del número de plaquetas y completa remisión de la enfermedad en 2 semanas. Esto resulta sugestivo de que la microvasculatura renal es el principal sitio de consumo plaquetario en el síndrome urémico hemolítico (SUH), al menos en las formas más severas de éste. Las pacientes de este estudio fueron 2 mujeres de 26 años, una de 25 años y una niña de 11 años. Todas ellas presentaron manifestaciones extrarrenales como convulsiones, encefalopatía hipertensiva, hemorragia retinal bilateral, edema de papila, confusión, alteraciones de la visión, cefaleas, entre otras. Todas asociadas a recuento bajo de plaquetas, signos de microangiopatía trombótica con principal afectación de los capilares y arteriolas glomerulares e hipertensión arterial refractaria al tratamiento. La nefrectomía bilateral fue realizada en pacientes con complicaciones neurológicas potencialmente mortales.
Antes de decidir realizar la cirugía, todos los pacientes recibieron plasmaféresis. Ninguno de ellos mostró normalización del recuento de plaquetas ni de los valores de LDH. A pesar de ser tratados con tres drogas antihipertensivas, incluidos los IECA, la presión arterial no pudo ser controlada. La función renal se fue deteriorando progresivamente. Al momento de la nefrectomía los pacientes presentaban trombocitopenia y signos de enfermedad activa con severo compromiso retinal y neurológico. Muchos vasos estaban completamente obstruidos con trombos y fragmentos de glóbulos rojos. En todos los casos el post – quirúrgico fue bueno. Ningún paciente tuvo hemorragias que requirieran transfusión. Una semana después de la cirugía se normalizó la presión arterial, y los signos neurológicos fueron disminuyendo. La remisión hematológica se logró dos semanas después, y los pacientes evolucionaron sin signos de enfermedad activa. Se tomaron muestras de sangre antes y después de la plasmaféresis y antes y después de la nefrectomía, para dosificar factor de von Willebrand (vWF) y su multímero. Durante la fase aguda de la enfermedad la concentración del factor de von Willebrand (vWF) fue mayor a la normal en 2 pacientes, y dentro del rango normal en otros 2 pacientes. La nefrectomía no indujo ningún cambio significativo en la concentración plasmática de dicho factor. En cambio el multímero vWF se encontraba anormalmente alto en los 4 pacientes durante la fase aguda, y en los 4 disminuyó considerablemente su valor hasta estar uniformemente normalizados post nefrectomía. En estos 4 pacientes la terapéutica con plasma falló en el control de la trombocitopenia y en inducir la remisión de la enfermedad.
Todos mostraron deterioro de la función renal y signos neurológicos, y 3 de ellos hipertensión resistente al tratamiento. Basándose en los resultados de las biopsias que informan un gran atrapamiento de plaquetas en la microvasculatura renal, concluyen que el consumo de plaquetas es un proceso que ocurre principalmente en dicho órgano. Si se asume esa teoría como correcta, entonces la nefrectomía bilateral podría mejorar el recuento de plaquetas y limitar el progreso de la enfermedad. 10 En la era precedente a la terapia con plasma, varios estudios han remarcado que la sobrevida podría mejorar con aspirina o dipiridamol, se sugirió su uso como efectivo en reducir el riesgo trombótico saciado con la trombocitosis de rebote lograda por la terapia con plasma o para reducir el índice de recaídas después del retiro de la terapia con plasma. Sin embargo el análisis comparativo de dos series grandes de adultos demostró que la combinación de terapia con plasma y agentes antiplaquetarios no producía ningún efecto adicional sobre el pronóstico de la enfermedad. Debido a que estos agentes incrementan el riesgo de sangrado asociado a trombocitopenia, su uso no es actualmente recomendado. Las mismas consideraciones se aplican a la prostaciclina, heparina y agentes fibrinolíticos como estreptoquinasa y uroquinasa.
Las transfusiones de plaquetas están contraindicadas debido a que pueden alimentar el proceso trombótico y su uso se recomienda solamente para pacientes con sangrado activo o procedimientos invasivos. En cuanto a la hiponatremia, es la presencia de síntomas y no la duración de la hiponatremia lo que guía el tratamiento. La hiponatremia que se desarrolla en menos de 48 horas acarrea mayor riesgo de compromiso agudo del sistema nervioso central y secuelas neurológicas permanentes si la misma no es corregida. Por lo tanto, si la hiponatremia es sintomática, se desarrolla en menos de 48 horas y el Na es menor de 125 mEq/l, el tratamiento debe instaurarse rápidamente ya que el riesgo de edema cerebral agudo es importante. El objetivo consiste en aumentar la concentración de Na en 3 a 5 mEq/l por encima de la concentración de Na plasmático en la que aparecieron los síntomas, a un ritmo de aumento de 2 mEq/l/hora, hasta la desaparición de los mismos, ya que la corrección completa de la natremia es un riesgo para el paciente. La corrección debe realizarse con cloruro de sodio hipertónico al 3%.
Los mEq de Na a reponer resultan de considerar como volumen de distribución del Na hipertónico al agua corporal total. El Na administrado expande el volumen extracelular pero el efecto osmótico también se ejerce en el líquido intracelular. Una vez controladas las manifestaciones del sistema nervioso central por la hiponatremia aguda, se prosigue con la corrección a un ritmo de 1 – 2 mEq/l/hora no superando en 36 horas una concentración de Na mayor de 135 mEq/l. En un estudio realizado por el Dr. Voyer, el tratamiento en el período agudo del síndrome urémico hemolítico (SUH) estuvo fundamentalmente basado en el control de las alteraciones fisiopatológicas. La restricción de agua y sal, las transfusiones de sedimento globular, la diálisis peritoneal y el adecuado aporte calórico proteico fueron las medidas que se aplicaron principalmente.
Nunca se implementaron medidas terapéuticas con la intención de actuar sobre la patogenia de la enfermedad. Vale decir que no se usó heparina como anticoagulante, ni aspirina como antiagregante plaquetario, ni agentes fibrinolíticos, ni se buscó aumentar los niveles de prostaciclinas mediante transfusiones de plasma fresco o de plasmaféresis. Esta conducta está basada en el hecho de que después de las primeras observaciones se tuvo conocimiento bastante claro de lo que es la fisiopatología de una enfermedad que presenta un período agudo esencialmente autolimitado y que en la mayoría de los casos es reversible, las ventajas del tratamiento fisiopatológico se hicieron pronto evidentes en la sobrevida. Actualmente la mortalidad del síndrome urémico hemolítico (SUH) es inferior al 3%. El tratamiento fisiopatológico permite a los enfermos sobrellevar el período de oligoanuria evitando la sobrehidratación que lleva a hipertensión volumen – dependiente, daño neurológico e insuficiencia cardíaca.
En la etapa aguda el tratamiento está dirigido al manejo del fallo renal agudo, anemia, las alteraciones neurológicas y gastrointestinales. Debe priorizarse la resolución de los desequilibrios hidroelectrolíticos, corregir la deshidratación secundaria a diarrea y vómitos teniendo en cuenta el fallo renal con la posibilidad de sobrehidratación. El aporte hídrico debe estar limitado a las pérdidas insensibles más las concurrentes y reponer el déficit previo.
La hiponatremia generalmente es dilucional por insuficiencia renal aguda o por una combinación de ésta más excesivas pérdidas gastrointestinales tratadas con inadecuada rehidratación con soluciones con bajo aporte de sodio; lo que puede dar síntomas neurológicos o acentuar los ya existentes.
Son indicaciones de iniciar con urgencia diálisis peritoneal en el paciente anúrico: la hiperkalemia severa, la acidosis metabólica grave, la hiponatremia sintomática, la insuficiencia cardíaca y / o edema agudo de pulmón por hipervolemia y el compromiso neurológico.
La diálisis programada precoz se introduce cuando la oligoanuria se prolonga, se acentúan los síntomas urémicos y no es posible lograr un adecuado aporte nutricional. Los procedimientos de hemodiálisis, hemofiltración y hemodiafiltración están reservados para aquellos casos en los que es imposible utilizar la vía peritoneal por existir perforación intestinal o peligro de que ésta suceda.
La hiperfosfatemia se trata con quelantes (carbonato de calcio, hidróxido de aluminio).
Es imprescindible implementar un precoz y adecuado aporte nutricional a fin de atenuar el hipercatabolismo producido por el síndrome urémico hemolítico (SUH). El uso de sonda nasogástrica es un recurso útil para asegurar el cumplimiento del plan dietético.
La transfusión de glóbulos rojos sedimentados está indicada cuando los valores de hemoglobina son inferiores a 7 g/dl y el hematocrito menor de 21%.
La administración de plaquetas se reserva para casos de sangrado activo importante o ante la necesidad de realizar procedimientos invasivos quirúrgicos, por el riesgo de agravar la microangiopatía trombótica.
El síndrome convulsivo debe ser tratado con lorazepam 0.1 mg/kg/dosis endovenoso y / o difenilhidantoína 15 mg/kg/dosis endovenosa asociados a la diálisis peritoneal.
El uso de heparina no es efectivo y puede aumentar el riesgo de morbilidad por sangrado. Tampoco han demostrado utilidad los agentes fibrinolíticos, prostaciclinas, antioxidantes o gammaglobulina. El uso de antibióticos está contraindicado por el aumento de la liberación de verotoxina (VT) por la Escherichia coli, y de antiperistálticos ya que favorecen su absorción. 4
Tabla 1: síndrome urémico hemolítico (SUH), sintomatología, analítica inicial y tratamiento (10 casos).
Síntomas iniciales, n=10
Postración y vómitos: 10
Diarrea con sangre: 8
Palidez: 7
Fiebre: 7
Dolor abdominal: 6
Síntomas extrarrenales
Convulsiones: 3
Edema pulmonar: 1
Oclusión intestinal: 1
IRA/diálisis peritoneal
Menos de 7 días: 4
Menos de 14 días: 1
Entre 14 y 30 días: 3
Más de 30 días: 1
Tabla 2: síndrome urémico hemolítico (SUH). Secuelas (seguimiento 31,7 meses).
Nefrológicas
IRC terminal: 1
IRC + HTA: 1
Proteinuria: 1
Asintomáticos: 6
Neurológicas
Encefalopatía grave: 1
Encefalopatía mínima: 1
Hipsarritmia: 1
Asintomáticos: 6
Globales
Secuelas graves: 2
Secuelas leves: 2
Asintomáticos: 5
No control: 1
IRC: insuficiencia renal crónica
HTA: hipertensión arterial
Tabla 3: Pronóstico y afectación neurológica inicial
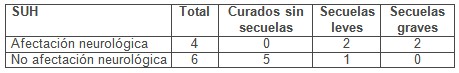
Tabla 4: características clínicas y del electroencefalograma (EEG) de 22 niños con síndrome urémico hemolítico (SUH)
Encefalopatía generalizada
CONCLUSIONES
Las manifestaciones neurológicas del síndrome urémico hemolítico (SUH) se deben a alteraciones vasculares y metabólicas. Las metabólicas son consecuencia del edema cerebral debido a la hiponatremia dilucional, aunque también pueden producirse en pacientes que reciben bicarbonato de sodio y sobrecarga del aporte hídrico. En este caso, las manifestaciones neurológicas se producen tempranamente y son rápidamente reversibles después de la diálisis. Las alteraciones vasculares se deben a la microangiopatía trombótica, que consiste en una lesión estructural de la pared vascular de arteriolas y capilares con engrosamiento de las mismas, trombosis plaquetaria intraluminal y obstrucción de la luz vascular. En esta situación, las manifestaciones neurológicas son tardías.
Las alteraciones neurológicas se producen en el 30% de los pacientes con síndrome urémico hemolítico (SUH). Son el mayor determinante de muerte en la etapa aguda de la enfermedad, e influyen en la morbilidad a largo plazo. Nos basamos en un trabajo con 22 pacientes en el que se obtuvieron los siguientes resultados: el 66% (14 pacientes) presentó convulsiones, el 27% (6 pacientes) coma o irritabilidad y el 10% (2 pacientes) signos de foco neurológico. Del total de pacientes, el 45% (10 pacientes) presentó signos de foco motor post-ictal, y durante el seguimiento el 31% (7 pacientes) tuvo secuelas neurológicas (convulsiones parciales complejas, déficit cognitivo, defectos visuales corticales, hemiparesias, afasias), el 10% (2 pacientes) presentó secuelas neurológicas el año posterior a la enfermedad y el 45% (10 pacientes) no presentó secuelas. También se observó que las convulsiones se asocian con mayor índice de secuelas y mortalidad a largo plazo.
No hay tratamiento que se haya mostrado eficaz para prevenir o limitar el curso de la enfermedad. El mismo debe ser sintomático. Es importante el tratamiento precoz con diálisis, el manejo de la hipertensión, los trastornos hidroelectrolíticos, hemorrágicos y digestivos, y la rehabilitación neurológica. Gracias a un buen manejo se puede disminuir la mortalidad de la enfermedad y sus secuelas.
En la actualidad se comenzó a implementar la nefrectomía bilateral en pacientes con mala respuesta a la plasmaféresis, obteniéndose buenos resultados ya que se vio que en todos los casos después de la cirugía se normalizó la presión arterial, ningún paciente tuvo hemorragias severas y los signos neurológicos fueron disminuyendo. Este tratamiento fue aplicado en un escaso número de pacientes y aún se encuentra en etapa de evaluación.
BIBLIOGRAFÍA
1. Behrman R, Kliegman R, Jonson H. Nelson Tratado de Pediatría. Mc Growhill Ed. Tomo II. 2000. 16º edición. Cap526, págs 1733 - 1734
2. Kenneth F. Neurología Pediátrica Principios y Prácticas. 2º edición. Ed Mosby. 1996. Tomo II. Cap 46, págs 841 – 842.
3. Cavagnaro F, Gana J y Lagomarsino E. Síndrome hemolítico Urémico: experiencia en un centro pediátrico. Rev. Med. Chile 2005. Vol. 133. Nº 7 (781-787).
4. Voyer Luis, Rivas Marta, Ibarra Rurico. Síndrome Urémico hemolítico. López libreros editores, Bs As 1996
5. Ruggenenti P, Chiurchiu C y Remuzzi P. Microangiopatía trombótica, síndrome urémico hemolítico y púrpura trombótica trombocitopénica. 2º congreso internacional de nefrología por internet. Disponible en: www.uninet.edu/ cin2001/ html/ remuzzi/ remuzzi.html. Agosto 2006.
6. Comité Nacional de Nefrología Pediátrica. Nefrología Pediátrica. Sociedad Argentina de Pediatría. Bs. As. 2003. Cap 16.
7. Anguita A, Grimoldi I, Dieser P y col. Trombosis mesentérica y accidente cerebrovascular hemorrágico en pacientes con síndrome urémico hemolítico enteropático. Arch. Argent. Pediatr. 2001; 99, 6 (530-532).
8. Eriksson K, Boyd S y Tasker R. Acute neurology and neurophysiology of haemolytic-uraemic syndrome. Arch. Dis. Child 2001; 84 (434-435).
9. Palomeque Rico A, Pastor Duran X, Molinero Egea C y Roca Gonzalez A. Síndrome hemolítico urémico. Valoración de factores clínicos y pronósticos. An. Esp. Pediatr. 1993; 39, 5 (391-394).
10. Remuzzi G, Galbusera M, Rizzoni G y col. Bilateral nephrectomy stopped disease progression in plasma-resistant hemolytic uremia síndrome with neurological signs and coma. Kidney International 1996; Vol. 49 (282-286).