Actualmente el consumo de pescado es ampliamente reconocido por sus grandes beneficios, ya que constituye una importante fuente de nutrientes esenciales como los ácidos grasos poliinsaturados. Numerosas organizaciones de salud recomiendan a la población general ingerir pescado dos veces a la semana. Por otro lado, el pescado puede también contener mercurio, la mayor parte en forma de metilmercurio. Generalmente los peces y la vida silvestre, están expuestos principalmente al metilmercurio, más que a otras formas químicas del mismo elemento, y la vía más importante es a través de la dieta. Los peces que concentran mercurio, también contienen ácidos grasos poliinsaturados de cadena larga, que pueden beneficiar tanto a la embarazada como a su bebé. Las recomendaciones para el consumo de pescado durante la gestación, deben tomar en cuenta las bondades nutricionales del pescado, así como los potenciales daños por la exposición al mercurio.
Consumo de pescado y exposición al metilmercurio. Riesgos y beneficios durante el embarazo.
Fish consumption and methylmercury exposure. Risks and benefits during pregnancy
Dr. Luis A. Caballero. Instituto Nacional de Nutrición, División de Salud Pública
RESUMEN
Actualmente el consumo de pescado es ampliamente reconocido por sus grandes beneficios, ya que constituye una importante fuente de nutrientes esenciales como los ácidos grasos poliinsaturados. Numerosas organizaciones de salud recomiendan a la población general ingerir pescado dos veces a la semana. Por otro lado, el pescado puede también contener mercurio, la mayor parte en forma de metilmercurio. Generalmente los peces y la vida silvestre, están expuestos principalmente al metilmercurio, más que a otras formas químicas del mismo elemento, y la vía más importante es a través de la dieta. Los peces que concentran mercurio, también contienen ácidos grasos poliinsaturados de cadena larga, que pueden beneficiar tanto a la embarazada como a su bebé. Las recomendaciones para el consumo de pescado durante la gestación, deben tomar en cuenta las bondades nutricionales del pescado, así como los potenciales daños por la exposición al mercurio.
Palabras clave: Consumo de pescado, mercurio, metilmercurio, ácidos grasos n-3, embarazadas
ABSTRACT
Fish consumption today is widely recognized as highly beneficial since it constitutes a good source of several essential nutrients such as polyunsaturated fatty acid (n-3 PUFA). Several health organizations recommend eating fish twice a week for the general population. On the other hand, fish may also carry a certain load of mercury, most of which occurs in the form of methylmercury (MeHg). Under most conditions, fish and wildlife are exposed primarily to MeHg rather than to other chemical forms of Hg, and the route of exposure is primarily through the diet. The same fish that concentrate mercury contain long-chain polyunsaturated fatty acids that may benefit both the pregnant women and her infant. Recommendations for fish consumption during pregnancy should take into account the nutritional benefits of fish as well as the potential harms from mercury exposure.
Key words: Fish consumption, mercury, methylmercury, n-3 fatty acids, pregnant women
INTRODUCCIÓN
Algunos nutrientes presentes en el pescado y otros productos del mar, proveen efectos beneficiosos en el desarrollo cerebral, entre ellos, el hierro, yodo, selenio y ácidos grasos poliinsaturados de cadena larga n-3, principalmente eicosapentanoico y docosahexanoico. Sin embargo el metilmercurio, un contaminante hallado en alimentos del mar y pescado de agua dulce, tiene un efecto tóxico a nivel neurológico [Choi, 2008].
El daño causado por el metilmercurio en la etapa fetal tanto en animales como en el hombre, se caracteriza por un decrecimiento celular (hipoplasia) y microcefalia, donde el peso cerebral se puede reducir a la mitad o a dos tercios del normal; alteración en la migración celular que resulta en displasia y alteración de la citoarquitectura cerebral; gliosis. Se ha demostrado en el ciclo celular, la inhibición mitótica tanto in vivo como in vitro [Faustman, 2002].
El mecanismo por el cual el mercurio entra en la cadena alimentaria es desconocido en su exactitud y puede variar en los diferentes ecosistemas. Las bacterias que procesan sulfato en el ambiente juegan un importante rol, ya que convierten el mercurio inorgánico en metilmercurio, una sustancia altamente tóxica. El metilmercurio contenido en las bacterias puede ser consumido por el siguiente eslabón en la cadena, o ser excretado al agua donde puede ser fácilmente absorbido por el plancton, que a la vez puede ser alimento para otras especies. Entre los ambientes que favorecen la producción de metilmercurio en Estados Unidos se encuentran ciertos pantanos, lagos con bajo pH del centro norte y noreste, parte de los Everglades en Florida, costas pantanosas a lo largo del Golfo de México, Bahía de San Francisco y Océano Atlántico [USGS, 2000].
La industria contribuye con emisiones de mercurio al ambiente, y entre las más contaminantes destacan las factorías de cloro con tecnologías anticuadas y dañinas del siglo XIX, como las de células de mercurio. Un 90% de las plantas de cloro en Estados Unidos emplean nueva tecnología libre de mercurio, sin embargo en Europa 60% de estas plantas aún trabajan con tecnología de células de este metal [Winalski, 2005].
El estudio de sedimentos provenientes de altos lagos ubicados cerca de Huancavelica, Perú, han revelado que la polución por mercurio ocurrió muchísimo antes de la revolución industrial, unos 1400 años antes de la era cristiana, en esta zona del Nuevo Mundo donde se hallan los mayores depósitos de este metal [Cooke, 2009].
El mercurio se localiza en los peces, muy unido a la proteína de los tejidos, incluido el muscular. No existe un método de cocción que reduzca su cantidad en la comida. Los primeros síntomas de envenenamiento son incoordinación motora y sensación de quemadura y hormigueo en dedos de manos y pies; al aumentar los niveles de mercurio, la habilidad para caminar, hablar, ver y oír pueden verse afectadas [Minnesota Department of Health, 2001].
En 2001 la FDA recomendó evitar el consumo de tiburón, blanquillo (familia Malacanthidae), caballa del Atlántico occidental (Scomberomorus cavalla) y pez espada (Xiphias gladius) debido a su alto contenido de mercurio, a mujeres embarazadas y en periodo de lactación así como a niños pequeños [FDA/EPA, 2004; FDA, 2006].
El 19 de Marzo de 2004, la FDA y EPA anunciaron conjuntamente, recomendaciones a los consumidores, para reducir la exposición a elevados niveles de mercurio en mujeres próximas a embarazarse, mujeres preñadas, en lactación y en niños pequeños. Se aconsejó no consumir tiburón, pez espada, caballa, blanquillo, por su alto contenido de mercurio; consumir 12 onzas -dos comidas en promedio- a la semana de pescados y mariscos bajos en mercurio como: atún light enlatado, salmón, abadejo, bagre y crustáceos como camarones y langostinos. Como el atún albacora contiene mayor cantidad de mercurio que el atún light enlatado, deben consumirse hasta 6 onzas a la semana, una comida en promedio. Invita además, a estar pendientes de las alertas locales sobre la seguridad del pescado proveniente de lagos, ríos y costas; si tal alerta no es conocida, no excederse de 6 onzas, una comida semanal, del pescado capturado por la familia o amigos en aguas locales y no consumir otro tipo de pescado esa semana [Saulo, 2004; FDA/EPA, 2004].
Al comienzo de 2005 fueron introducidos nuevos niveles máximos de la UE para mercurio total en alimentos para consumo humano y para animales. Los niveles máximos actuales de la UE para mercurio total en pescado aparecen en la Regulación de Comisión 78/2005, vigente desde el 9 de Febrero 2005. El Nivel Máximo de Mercurio (mg/kg peso húmedo) es de 0,50 sin embargo para las especies citadas a continuación ese valor es de 1 mg/kg peso húmedo: rape (Lophius sp.), pez gato del Atlántico (Anarhichas lupus), bonito del Atlántico (Sarda sarda), anguila (Anguilla anguilla), emperador, reloj anaranjado, candil (Hoplostethus sp.), granadero de roca (Coryphaenoides rupestris), fletan del Atlántico (Hippoglossus hippoglossus), aguja azul (Makaira sp.), gallo del norte (Lapidorhombus sp.), salmonete de fango (Mullus sp.), lucio (Esox lucius), tasarte (Orcynopsis unicolor), capellán (Trisopterus minutus), pailona (Centroscymnus coelolepis), rayas (Raja sp.), gallineta dorada (Sebastes marinus, Sebastes mentalla, Sebastes viviparus), pez vela (Isthiophorus platypterus), pez cinto (Lepidopus caudatus, Aphanopus carbo), besugo, pandora (Pagellus sp.), tiburón (todas las especies), escolar negro o palometa pintada (Lepidocybium flavobrunneum, Ruvettus pretiosus, Gempylus serpens), esturión (Acipenser sp.), pez espada (Xiphias gladius), atún (Thunnus sp., Euthynnus sp., Katsuwonus sp.) [FIN, 2006].
En la mayoría de los países amazónicos, las autoridades de salud pública no han emitido directrices relacionadas al consumo de pescado, posiblemente debido en parte a la importancia del valor nutricional de este alimento y la consideración de que los efectos en la salud atribuidos al mercurio, son menos severos que otros problemas sanitarios existentes [Passos, 2008].
CONTAMINACIÓN DULCEACUÍCOLA:
Estudios pioneros en la región de Tapajós, mostraron que los suelos del Amazonas constituyen el mayor reservorio natural de mercurio, el cual es liberado en cantidades importantes en los ecosistemas acuáticos, a través de la erosión de los suelos y filtraciones resultantes de prácticas de deforestación, talas y quemas para actividades agrícolas o de ganadería. Una fuente adicional de mercurio al ambiente, es producida por la deforestación y erosión, así como por el empleo de este metal en la explotación aurífera [Passos, 2008].
La contaminación de peces por metales pesados en Colombia ha sido estudiada principalmente en la cuenca del río Magdalena y sus afluentes, donde se han encontrado niveles de contaminación por mercurio, con valores superiores a la norma colombiana ICONTEC-1443 de un valor máximo permisible 0,5 μg/g en pescado fresco, congelado o refrigerado. La alta contaminación del río Magdalena es consecuencia de actividades industriales como la minería aurífera y petroquímica, desarrolladas en esta cuenca.
Las concentraciones más altas se encontraron en músculo de especies carnívoras como Hoplias malabaricus (moncholo), Ageneiosus caucanus (doncella) y Caquetaia kaussi (mojarra amarilla). En especies detritívoras como Triportheus magdalenae también se hallaron altos niveles, por la precipitación del metal en el sedimento donde obtienen gran parte de su alimento estos peces. Especies iliófagas como Prochilodus magdalenae (bocachico) presentaron concentraciones más bajas de mercurio [Mancera-Rodríguez, 2006].
En la República Checa se evaluó el contenido de mercurio en músculo de Abramis brama, Perca fluviatilis y Leuciscus cephalus, pescados durante 1999, 2002 y 2003 en el río Elbe, uno de los más importantes ríos europeos, con una longitud de 1103 kilómetros y una cuenca que cubre también territorios de Alemania. El valor más alto se halló en Leuciscus cephalus: 2,56 mg/kg, una especie omnívora y con gran voracidad por peces pequeños, una característica a la que se atribuye su alta acumulación de mercurio. El promedio de la concentración de mercurio en Abramis brama, Perca fluviatilis y Leuciscus cephalus estuvo en el rango 0,172-0,852 mg/kg, 0,077-1,07 mg/kg y 0,141-1,631 mg/kg respectivamente [Žlábek, 2005].
En un estudio conducido en este mismo país durante 2002 y 2004 en el río Elbe, se determinó en músculo de 88 especimenes, el mercurio total y metilmercurio. Mercurio total se halló en Leuciscus cephalus, Perca fluviatilis y Abramis brama en un rango de 0.05-1,96 mg/kg, 0,09-1,46 mg/kg y 0,35-0,82 mg/kg respectivamente; metilmercurio se halló en Leuciscus cephalus, Perca fluviatilis y Abramis brama dentro del rango 0,04-2,11 mg/kg, 0,1-1,73 mg/kg y 0,371-0,650 mg/kg respectivamente. Altos niveles de mercurio total y metilmercurio se identificaron en peces cercanos a la ciudad de Pardubice, un importante centro químico industrial, posible fuente de contaminación mercurial. No se hallaron diferencias significativas entre el contenido de mercurio total, metilmercurio y sexo, aunque si con el peso y edad del pez [Maršálek, 2006].
Otros investigadores analizaron en Leuciscus cephalus, procedentes de cuatro ríos de Moravia, la acumulación de mercurio inorgánico y metilmercurio en cinco tejidos: músculo, branquias, hígado, riñón y piel. El tejido con mayor contenido de mercurio total fue el muscular y de ese mercurio total un 83,6% - 92% es metilmercurio. El músculo de ejemplares extraídos del río Jihlava contenía 0,962±0,450 mg/kg materia seca, de mercurio total. El alto contenido de mercurio en músculo del citado pez, y también en el sedimento y muestras de zoobentos del río Jihlava son pruebas de contaminación antropogénica [Houserova, 2006].
En Brasil se estudió la concentración de mercurio en peces y cabello humano, en São Gabriel de Cachoeira y Barcelos, dos poblaciones ubicadas en los márgenes del Río Negro. Este es uno de los principales tributarios del Río Amazonas, con una longitud de 1700 km y drena un área correspondiente al 10% de los siete millones de km2 de la cuenca del Amazonas. Una importante actividad minera del oro se efectúa en el alto Río
Negro, en Colombia. Los análisis realizados por espectrometría de absorción atómica, mostraron en São Gabriel de Cachoeira un promedio de 0,453 μg/g (0,039-3,921 μg/g) en 140 muestras de 9 especies carnívoras y de 0,102 μg/g (0,003-0,552 μg/g) en 76 muestras de 2 especies no carnívoras; en 157 muestras de cabello se obtuvo un promedio de 13,025 μg/g (0,303-83,116 μg/g). En Barcelos se obtuvo un promedio de 0,459 μg/g (0,062-1,930 μg/g) en 126 muestras de 8 especies carnívoras y de 0,097 μg/g (0,018-0,184 μg/g); en 147 muestras de 6 especies no carnívoras; en 242 muestras de cabello se hallo un promedio de 9,671 μg/g (0,0719-52,049 μg/g).
Puede observarse una mayor concentración de mercurio en cabello de los pobladores de São Gabriel de Cachoeira en comparación con Barcelos, explicable por la mayor actividad minera en el entorno de la primera población. Se tomaría en cuenta el transporte de mercurio a través del viento, las corrientes de agua, la lluvia y probablemente los suelos de esta cuenca naturalmente contaminados, con la bioacumulación en los organismos de la cadena alimentaria. Concluyeron que la población de esta cuenca vive con el riesgo de exposición al mercurio a través del consumo de pescado por largo tiempo, aunque pareciera que la contaminación por mercurio del Río Negro, no es solo causada por la explotación minera y por lo que tendría además un origen natural [Santos, 2003].
CONTAMINACIÓN EN AVES ACUÁTICAS Y MAMÍFEROS:
Una concentración promedio de mercurio de 2,09 mg/kg con un rango de 0,12-13,66 mg/kg se detectó en aves capturadas en Octubre 1997 y Enero, Abril y Noviembre 1998, al norte del Lago de Maracaibo. Las mayores concentraciones se hallaron en Octubre 1997, en un ave migratoria, tirra canalera (Sterna maxima): 4,02 mg/kg y en las especies residentes turillo (Charadrius collaris): 4,75 mg/kg y cotúa olivácea (Phalacrocorax brasilianus): 4,57 mg/kg [Pirela, 2005].
La población de aves acuáticas, particularmente especies del orden Ciconiformes, ha declinado precipitadamente en el sur de Florida y en los Everglades desde 1930. Hubo una reducción mayor de 90% en el número de parejas anidando de gabán (Mycteria americana), garzeta (Ardea albus), corocoro blanco (Eudocimus albus) y garcita blanca (Egretta thula). Aunque las causas pueden ser atribuidas a la pérdida del hábitat, cambios en el hidroperiodo y salinización de áreas de alimentación en estuarios, la toxicidad del metilmercurio ha sido propuesta como un factor contribuyente. Concluyen los investigadores en esta reciente revisión, que el peso de la evidencia indica que la reproducción es el parámetro demográfico más afectado por la exposición de aves al metilmercurio [Scheuhammer, 2007].
La intoxicación por metilmercurio en mamíferos puede producir efectos neurológicos como letargia, ataxia, parálisis en extremidades, tremor, convulsiones y muerte. Especies predadoras de peces tienen alto riesgo de acumulación de metilmercurio, como el visón (Mustela sp.), nutria (Lutra sp.), oso polar (Ursus maritimus) y focas (Phocidae sp., Liliaceae sp.) [Scheuhammer, 2007].
En animales de laboratorio, la exposición intrauterina al metilmercurio produce aumento en la mortalidad intrauterina, alteraciones en el desarrollo y desorganización de la arquitectura cerebral, dependiendo de la dosis y tiempo de exposición. El cerebelo, una estructura responsable del balance y la coordinación motora en mamíferos, es uno de los más importantes blancos de la toxicidad por metilmercurio. Como las células predominantes en el cerebelo, las células granulosas y de Purkinje son producidas o maduradas en los roedores durante las primeras semanas postpartum, los procesos de desarrollo, como proliferación, diferenciación, migración y sinaptogénesis y otros, se ven más afectados a la exposición al tóxico en este periodo [Johansson, 2007].
El cerebro es particularmente susceptible al efecto del stress oxidativo, una situación presente cuando hay un desbalance entre la generación de radicales libres y el sistema antioxidante que protege a las células, donde se incluyen a manera de ejemplo enzimas como peroxidasa, superoxidodismutasa y compuestos no enzimáticos como el glutatión [Duchen, 2000].
Una sustancial elevación de los niveles de calcio, posterior a la exposición al metilmercurio se ha hallado en varios tipos de células; el efecto protector de quelantes o bloqueadores de los canales de calcio se han reportado in vitro y también in vivo [Gasso, 2001].
La elevación de la concentración del calcio intracelular puede también agravar el daño causado por los radicales libres [Johansson, 2007].
Dependiendo del tipo celular y de las condiciones de exposición -dosis y duración- al metilmercurio se puede inducir la apoptosis y muerte celular. Bajas dosis de metilmercurio in vitro, ha inhibido la diferenciación neuronal de células totipotenciales [Tamm, 2006].
IMPACTO HUMANO EN AMBIENTES DULCEACUÍCOLAS:
En la población minera aurífera del Guainía, Orinoquia colombiana, los valores de mercurio en sangre en los mineros osciló entre 6,9-168 μg/L y entre los individuos indirectamente expuestos 17,7-100,8 μg/L, mientras que en el cabello de los mineros fluctuó entre 3-89,2 μg/L y entre los expuestos indirectamente 2,8-48,7 μg/L [Idrovo, 2001].
Aunque el promedio de consumo de pescado de agua dulce en la República Checa sea de 1 kg per cápita/año y no represente mayor amenaza, los pescadores y sus familias pueden ser la excepción y alcanzar un consumo de 10 kg per cápita/año, lo que aumenta el índice de riesgo para estos últimos, dado el alto contenido de mercurio en especies indicadoras [Žlábek, 2005].
El contenido de mercurio en cabello se utiliza como un bioindicador de exposición al mercurio. Una evaluación se realizó en 15 comunidades ribereñas en la amazonía de Bolivia, en un área afectada por la intensa minería aurífera, donde la contaminación por mercurio del agua, sedimentos y pescado había sido previamente reportada. Se halló una mediana de 4 μg/g. La mediana fue 4,4 μg/g en las madres y 3,9 μg/g en niños, aunque las diferencias en las medianas no fueron significativas. En las mujeres la relación entre el contenido de mercurio en cabello y status nutricional fue negativa, pero ésta desaparece al tomar en cuenta la etnicidad y actividad de subsistencia [Benefice, 2008].
En la región del Pantanal en Brasil, se estudió en 129 hombres y mujeres mayores de 17 años de edad, los efectos de bajos niveles de metilmercurio en las funciones neurosicológicas. Previamente se conoció que el pescado consumido en esta zona, contenía un promedio de 0,7 μg/g en la parte comestible de especies carnívoras y un promedio de 0,08 μg/g en especies herbívoras. El promedio de los niveles de mercurio en cabello fue de 4,2±2,4 μg/g; el rango osciló entre 0,56 y 13,6 μg/g; la mediana fue de 3,7 μg/g. Un 25% de los individuos mostraron una concentración de mercurio por encima del nivel de referencia de la OMS, el cual es de 6 μg/g. Los niveles de mercurio en cabello se asociaron con detectables alteraciones en el desarrollo de pruebas de velocidad motora fina, destreza manual y concentración. La magnitud de estos efectos se incrementó con la concentración de mercurio en cabello, compatible con un efecto dosis dependiente en adultos, aunque un estudio longitudinal es necesario para determinar el rol del tiempo de exposición en estos hallazgos. Estudios previos han hallado menor desempeño en algunas pruebas que incluyeron concentración, velocidad motora fina y memoria verbal, en niños expuestos al metilmercurio durante su desarrollo prenatal al compararlos con los no expuestos [Yokoo, 2003].
La transferencia transplacentaria de mercurio se evaluó en 1510 mujeres y sus recién nacidos, en tres hospitales de Itaituba, en el estado brasileño de Pará. El promedio en sangre de la concentración de mercurio en las madres fue 11,53 μg/L y 16,68 μg/L en sangre del cordón en recién nacidos. La mayor concentración de mercurio se halló en las madres con 31-40 años: 14,37 μg/L y en sus recién nacidos: 21,87 μg/L. En todos los grupos de edad materna, los promedios de mercurio resultaron menores que en los hallados en sus hijos. El mercurio en sangre materna mostró una fuerte y positiva correlación con la edad (r =0,812; p=0,002) y una correlación positiva, pero débil, con la frecuencia del consumo de pescado (r =0,2518; p<0,01). Otras investigaciones en el Amazonas, han encontrado una significativa correlación entre los niveles de mercurio en madres y niños, donde por ejemplo el mercurio en cabello y en leche materna, se asoció con altos niveles de mercurio en el cabello de los niños [Santos, 2007].
En 171 pobladores (mayores de 15 años, no embarazadas, sin historia de exposición al mercurio inorgánico en minas de oro o por amalgamas) de siete comunidades del Río Tapajos, en el Amazonas brasileño, se estudió la relación entre el consumo de pescado y los niveles de mercurio total, orgánico e inorgánico en sangre y en orina. Se determinó un consumo promedio de pescado, de 7,4 comidas a la semana. En promedio el mercurio total en sangre fue 38,6±21,7 μg/L; el promedio de mercurio orgánico o metilmercurio fue 33,6±19,4 μg/L; el promedio de mercurio inorgánico fue 5±2,6 μg/L. El promedio de mercurio en orina fue 7,5±6,9 μg/L, con 19,9% de personas con valores por encima de 10 μg/L. El mercurio inorgánico en sangre se relacionó significativamente con el número de comidas basadas en peces carnívoros pero no con el de peces no carnívoros; se relacionó negativamente con el consumo de frutas y se incrementó con la edad. El mercurio urinario se relacionó significativamente con el consumo de peces carnívoros, con una tendencia negativa ante el consumo de frutas. Estos hallazgos destacan la importancia de conocer la toxicidad potencial del mercurio inorgánico en poblaciones con elevado consumo de pescado, no sometidas a exposición ocupacional o amalgamas dentales [Passos, 2007].
El alimento más frecuentemente consumido por comunidades indígenas habitantes del alto Orinoco y de la subcuenca del Ventuari, es el casabe, un producto derivado de la yuca (Manihot spp.), seguido del pescado. La yuca contiene cantidades variables de linamarina, una sustancia que al ser hidrolizada genera ácido cianhídrico, un tóxico capaz de producir parálisis, neuropatías y muerte. Los aminoácidos azufrados escasos en la yuca pero abundante en el pescado, favorecen la metabolización del ácido cianhídrico en tiocianato, un compuesto menos tóxico. El consumo regular de proteínas de origen animal, ricas en aminoácidos azufrados, permitirían el ancestral consumo de yuca y sus derivados por los pueblos indígenas de la cuenca del Orinoco, sin que aparezcan envenenamientos y neuropatías, como suele ocurrir en algunos países africanos [Caballero, 2008].
Recientes estudios han mostrado una fuerte relación entre el consumo de pescado y la exposición al mercurio, la cual es significativamente modificada por el consumo de frutas. Lo anterior podría indicar una posible interacción toxicoquinética promovida por la ingesta de frutas [Passos, 2008].
En las selvas lluviosas del Amazonas, una extensa área de 7,8 x 106 km2, numerosas etnias y pobladores locales “ribeirinhos”, dependen fundamentalmente de los productos de la yuca y del pescado para alimentarse. Éstos poseen sustancias tóxicas como la linamarina y monometilmercurio, en la yuca y pescado respectivamente. El contenido de linamarina depende entre otros, de la variedad vegetal y de su procesamiento mientras que el metilmercurio se acumula mayormente en los peces predadores. Sin embargo pocos estudios se han dirigido, a esclarecer el rol del mercurio inorgánico emitido por actividades de la minería aurífera o del mercurio orgánico o inorgánico procedente del suelo, en la metilación del mercurio y su paso a través de la cadena alimenticia en el Amazonas. Biomarcadores de exposición a tóxicos, como tiocianato sérico proveniente de la ingesta de yuca o de mercurio en cabello proveniente de la ingesta de pescado, no han mostrado hasta ahora ser predictores clínicos de neuropatías en “ribeirinhos”. El pescado es un abundante recurso sin sustitutos en el Amazonas y consideran los investigadores, que en un escenario de insuficientes servicios de salud y ambiente malsano, los hábitos de alimentación basados en el consumo de pescado son parte de una estrategia de supervivencia, por lo que recomendaciones para modificarlos no son justificables. Cambios en el consumo de pescado podría causar una disrupción en las adaptaciones metabólicas de macro y micronutrientes [Dorea, 2003].
IMPACTO HUMANO POR CONSUMO DE PESCADOS Y OTRAS ESPECIES MARINAS:
En San Francisco, California, se evaluó el contenido de mercurio en sangre y cabello de 89 personas, 82 de ellas presentaron una concentración mayor de 5 μg/L, el valor máximo permitido por la Agencia de Protección Ambiental (EPA) y la Academia Nacional de Ciencias. En sangre, el promedio fue de 14,5 μg/L; la mediana 11,2 μg/L; el rango osciló entre 2 y 89,5 μg/L. El promedio de 66 mujeres fue 15 μg/L (SD=15) y el de hombres 13 μg/L (SD=5). El rango de edades fue 27- 87 años, con un incremento no significativo de mercurio relacionado con el de la edad. El contenido de mercurio en cabello osciló en el rango de 1,55 a 14,81 μg/g, por encima de 1 μg/g, el valor máximo permitido por EPA y la Academia Nacional de Ciencias. Del consumo de treinta tipos de peces, el pez espada mostró la más alta correlación (Correlación de Pearson=0,71, p=0,001) con la concentración de mercurio [Hightower, 2003].
El promedio del consumo de pescado en una región de España, fue de 73,9 g/d, los hombres consumieron en promedio 88,6 g/d y las mujeres 55,1 g/d. Las especies mayormente consumidas fueron merluza y pescadilla (Merluccius merluccius), jurel (Trachurus trachurus), anchoas (Engraulis encrashicholus) y otras de peces blancos. Sin embargo atún (Thunnus tynnus) y bonito del Atlántico (Sarda sarda), las especies de mayor tamaño, presentaron el más alto contenido de mercurio, lo que refleja la bioacumulación de mercurio en la cadena alimenticia. El contenido promedio de mercurio en los hematíes fue 17,9 μg/kg, con 19,8 μg/kg en hombres y 16,3 μg/kg en mujeres. Se halló una relación estadísticamente significativa entre el consumo de pescado y la cantidad de mercurio en glóbulos rojos. Concluyen que 99,9% de los individuos tuvieron un consumo semanal de mercurio por debajo de los niveles tolerables aceptados por la legislación española y la OMS [Sanzo, 2001].
En California se observó, una rápida disminución -en tres semanas- de la concentración sanguínea de mercurio de 67 personas que se abstuvieron o redujeron ampliamente su consumo de pescado con alto o moderado consumo de mercurio; esta disminución continuó lentamente en el tiempo. La rata promedio en la declinación de los 67 pacientes fue de 4,4% por semana [Hightower, 2003].
El cuerpo puede tomar aproximadamente 70 días, para remover la mitad del metilmercurio presente [OTIS, 2004].
Posterior a las advertencias del 2001 y 2004, parte de la población nativa de Alaska se encontró sin alternativas, dado que dependen fundamentalmente de la pesca como fuente de proteínas. A partir de 2002 la División de Salud Pública de Alaska, emprendió un biomonitoreo para conocer el contenido de mercurio en cabello humano de 150 embarazadas y 52 mujeres en edad reproductiva. En embarazadas, la mediana y el promedio fueron 0,47 mg/kg y 0,72 mg/kg respectivamente.
En mujeres en edad reproductiva, la mediana y el promedio fueron 0,64 mg/kg y 1,12 mg/kg respectivamente. Del total de mujeres, 81% presentó valores de mercurio menores a 1,2 mg/kg, el valor de referencia EPA. Concluyen los investigadores que estas advertencias nacionales, enfatizaron los riesgos pero subestimaron los beneficios del consumo de pescado, lo que acarrea la ya existente evidencia, del reemplazo de dietas tradicionales por alimentos menos saludables [Scott, 2005].
El metilmercurio, que puede afectar adversamente el desarrollo neurológico del niño y la contaminación de los peces con mercurio son las razones por las cuales se han dado numerosas advertencias. Por otro lado, los nutrientes del pescado, especialmente los ácidos grasos poliinsaturados de cadena larga n-3, afectan pero en la dirección opuesta el mismo tipo de resultados. Esta situación puede ser un clásico ejemplo de confusión, donde los factores que afectan un resultado están asociados a un mismo tipo de alimento. Es por ello, que el manejo de riesgos y la comunicación en salud debe reconciliar las advertencias contra los contaminantes con las recomendaciones de la ingesta de nutrientes [Budz-Jorgensen, 2007].
El consumo moderado de pescado, particularmente de especies con alto contenido de ácido eicosapentanoico (EPA) y docosahexanoico (DHA) reducen el riesgo de muertes por enfermedad coronaria. Por ello los potenciales riesgos por el consumo de pescado, deben ser considerados en el contexto de los posibles beneficios. Existe la evidencia de los beneficios entre las mujeres en edad reproductiva, del consumo moderado de pescado 1-2 veces a la semana, exceptuando algunas especies. Evitar un moderado consumo de pescado atendiendo a confusas alertas sobre los riesgos y beneficios, podría resultar en un exceso de miles de muertes atribuibles a la enfermedad coronaria y un subóptimo neurodesarrollo de los niños [Mozaffarian, 2006].
Cuando la exposición a un tóxico ocurre con un alimento, que a su vez está asociado con ventajosos nutrientes o nutrientes esenciales, como es el caso del metilmercurio en pescado, puede ocurrir la subestimación de la toxicidad por mercurio y los beneficios del pescado [Choi, 2008].
CONTAMINACIÓN EN ESPECIES MARINAS:
Algunos investigadores consideran la formación de metilmercurio en los océanos, como consecuencia de una desmetilación de dimetilmercurio más que por una metilación de mercurio inorgánico. Plantean además la hipótesis de la producción de metilmercurio en el fondo de los mares y sedimentos, donde la concentración de mercurio suele ser poco afectada por la actividad humana [Kraepiel, 2003].
Un estudio realizado en Bermuda, en 43 especies de peces en su mayoría predadores y pelágicos, mostró las más altas concentraciones de mercurio en músculo fresco de Xiphias gladius y marlin azul (Makaira nigricans): 3,31μg/g y 3,10μg/g respectivamente; le siguen por su alto contenido en mercurio Caranx ruber, Caranx crisos y Mycteroperca bonaci. Los menores valores se hallaron en Cypselurus heteruros, Paranthias furcifer y Khyposus sectactatrix con 0,035μg/g, 0,035μg/g y 0,038μg/g. Cinco muestras de atún (Thunnus sp.) tuvieron un contenido promedio de 0,35μg/g aunque el rango osciló entre 0,21-0,70. Señalan los autores, que la población general y en particular las embarazadas de esta isla deben conocer estos datos, para minimizar el riesgo debido a la exposición al mercurio [Dewailly, 2008].
El análisis de 38 especímenes de tiburón Carcharhinus signatus, del Atlántico brasileño, reveló un promedio en la concentración de mercurio de 1,742 mg/kg, un valor mayor al máximo permitido para peces carnívoros por la legislación de Brasil: 1 mg/kg peso húmedo [Gomes, 2004].
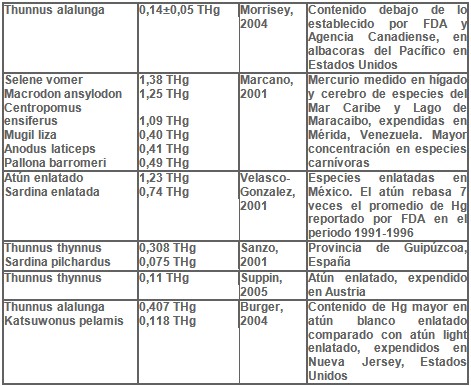
Se determinó la concentración de mercurio total (orgánico e inorgánico) en hígado y cerebro de 12 especies de peces procedentes de costas venezolanas del Mar Caribe y del Lago de Maracaibo, expendidos en el mercado de la ciudad de Mérida, ubicada en la región andina, una zona con antecedentes de deficiencia de yodo. La mayor concentración se halló en especies carnívoras, Selene vomer (lamparosa), Macrodon ansylodon (curvina) y Centropomus ensiferus (robalito) con 1,38μg/g, 1,25μg/g y 1,09μg/g peso seco respectivamente; la menor concentración se halló en Mugil liza (lisa), Anodus laticeps (manamana) y Pallona barromeri (sardina) con 0,40μg/g, 0,41μg/g y 0,49μg/g peso seco respectivamente. Sardina y lisa son peces omnívoros y manamana es especie detrívora. Los valores registrados en peces carnívoros superan los valores recomendados por la OMS [Marcano, 2001].
Se evaluó el contenido de mercurio total y metilmercurio en músculo de albacora (Thunnus alalunga) y atún aleta azul (Thunnus thynnus) procedente del Mediterráneo. La concentración de mercurio total en albacora fue en promedio 1,17 mg/kg peso húmedo con un rango de 0,84-1,45 mg/kg peso húmedo y en atún aleta azul se obtuvo un promedio de 1,18 mg/kg peso húmedo dentro del rango 0,16-2,59 mg/kg peso húmedo. La concentración total de mercurio excedió los máximos niveles establecidos por la Comisión Europea (1 μg/g peso húmedo) en 78,6% de albacora y en 61,1% de atún aleta azul analizados. El porcentaje de metilmercurio en ambas especies fue 91% del mercurio total [Storelli, 2002].
En expendios de Viena y Burgenland, Austria, se determinó el contenido de mercurio, plomo y cadmio en 93 muestras de 21 especies de pescado procedente del Mar Mediterráneo y Atlántico Norte. El promedio de la concentración de mercurio fue 0,14 mg/kg. El valor más alto de mercurio se encontró en escolar (Lepidocybium flavobrunneum) con promedio de 0,63 mg/kg, seguido de pez espada (Xiphias gladius) con promedio de 0,42 mg/kg y halibut (Hippoglossus hippoglossus) con promedio de 0,29 mg/kg. El valor más bajo se halló en sardina (Sprattus sprattus) con 0,014 mg/kg peso húmedo. Todos estos valores de mercurio, son menores a los niveles permisibles de 1 mg/kg [Suppin, 2005].
Atunes aleta azul del Atlántico (Thunnus thynnus) capturados durante Abril en aguas de Malta y Libia fueron trasladados a una granja en el mar Adriático, y durante 6-7 meses fueron alimentados con arenque descongelado (Clupea harengens) y sardina (Sardinops melanosticus). En Noviembre ejemplares de atún, con un peso entre 100 y 300 kg fueron sacrificados, tomándose 29 muestras de músculo y 15 de hígado. En músculo la mediana de mercurio total fue de 0,899 μg/g peso húmedo con un rango de 0,490-1,809 μg/g peso húmedo, mientras que en hígado la mediana fue de 1,165 μg/g peso húmedo y un rango de 0,324-3,248 μg/g peso húmedo. El contenido de mercurio total en seis muestras de sardina tuvo un rango de 0,050-0,072 μg/g peso húmedo y en dos muestras de arenque de 0,020-0,053 μg/g peso húmedo. En atún, el 41% de las muestras de músculo analizadas, estuvieron por encima del máximo nivel de mercurio permitido por la Comisión Europea: 1 μg/g peso húmedo [Srebocan, 2007].
El atún enlatado es frecuentemente consumido en Arabia Saudita, por lo que Ashraf reportó en un estudio el contenido de mercurio en 57 muestras. Se halló un contenido promedio de 0,31 μg/g, un rango de 0,18-0,86 μg/g y del total de muestras, 46 presentaron valores menores de 0,55 μg/g, límite recomendado por WHO/FAO [Ashraf, 2004].
El contenido de mercurio total en músculo de atún albacora (Thunnus alalunga) capturado en costas de California, Oregon y Washington fue determinado por espectrofotometría de absorción atómica de vapor frío. Se obtuvo un promedio de 0,14±0,05 μg/g, y un rango de 0,03-0,26 μg/g en 91 muestras. Se halló correlación positiva entre la concentración de mercurio total y el largo y peso del animal. Durante el año 2003 el Estado de California alertó a los consumidores sobre el riesgo a la salud por el contenido de mercurio en atún, pez espada y tiburón. En Marzo de 2004, la Agencia de Protección Ambiental y la FDA recomendaron consumir un límite de 12 onzas a la semana de pescado bajo en mercurio como camarones, langostinos, atún light enlatado y salmón; y un consumo no mayor de 6 onzas de atún albacora enlatado (atún blanco) o filete de atún. Sin embargo los resultados muestran en estas pequeñas albacoras del Pacífico, un contenido de mercurio por debajo de los niveles permitidos por la FDA: 1,0 μg/g de metilmercurio y de la Agencia Canadiense de Inspección de Alimentos: 0,5 μg/g de mercurio total [Morrissey, 2004].
La concentración de mercurio en atún aleta amarilla (Thunnus albacares) capturado en el Pacífico ecuatorial y subtropical de Hawaii, mostró una disminución no significativa entre los años 1971 y 1998. Las muestras de 1971, tuvieron un rango de 0,09-1.32 mg/kg, con un rango en el peso de los atunes de 10-97,5 kg; durante 1998 el rango de la concentración de mercurio fue 0,012-0,68 mg/kg, con un rango de 27,2-70,8 kg en el peso de los animales [Kraepiel, 2003].
LOS PECES, AVES, MAMÍFEROS, EL HOMBRE E INVERTEBRADOS COMO INDICADORES BIOLÓGICOS DE METALES PESADOS:
Los peces por representar varios niveles de la cadena alimentaria acuática, son excelentes indicadores de contaminación por metales pesados, ya que pueden bioacumular y biomagnificar a través de ella altas concentraciones de estos elementos. Un ejemplo claro es el mercurio, el cual es bioamplificado casi en su totalidad por los peces en forma de metilmercurio, altamente tóxico y de fácil fijación en el tejido muscular y adiposo [Mancera-Rodríguez, 2006].
Sin embargo otras especies han sido propuestas como bioindicadores. Pirela recomienda la cotúa olivácea (Phalacrocorax brasilianus) como bioindicador de contaminación ambiental por mercurio en el Sistema del Lago de Maracaibo en Venezuela, dado que esta ave es abundante, residente y es también consumida por pobladores locales [Pirela, 2005].
Águilas calvas y águilas pescadoras son aves piscívoras que experimentan una gran exposición al mercurio en algunos ambientes de Norteamérica, y deben ser consideradas para conocer más sobre los potenciales efectos dañinos sobre su reproducción [Bowerman, 1994; DesGranges, 1998].
Leuciscus cephalus ha sido seleccionado para monitorear la bioacumulación de mercurio en ecosistemas de ríos, por tratarse de un pez omnívoro, que se alimenta de algas, plantas acuáticas, semillas terrestres, larvas, pequeños peces y moluscos [Houserova, 2006].
Se seleccionó la sardina como bioindicador para monitorear la concentración de 24 elementos traza, dada su amplia distribución costera. La concentración de Mg, Cr, Zn, As, Sr, In, Pb y Bi resultó mayor en sardinas del Pacífico japonés (Sardinops melanosticus) comparadas con sardinas de las costas del Pacífico en Estados Unidos (Sardinops sagax). La concentración de Mg fue la más alta de todos los elementos analizados, atribuyéndose a que el Mg es un constituyente de la clorofila, presente en el fitoplancton, el mayor aporte de la dieta, tanto de la sardina japonesa como americana. La determinación de mercurio total se realizó por espectrometría de absorción atómica de vapor frío, no obteniéndose correlación positiva con el largo de horquilla y hallándose valores más elevados en Kochi, Japón [Hayase, 2009].
En Arabia Saudita se determinó el nivel de metales pesados: Pb, Cd, Ni, Cu, Zn, Cr y Fe en salmón, sardina y atún enlatado. Los resultados indican que el pescado enlatado y en particular el atún, presentan concentraciones dentro de los límites permisibles por WHO/FAO [Ashraf, 2006].
En 108 niños de 6-12 años de la región central de Venezuela, no expuestos a contaminación mercurial industrial, se determinó mediante el método de absorción atómica en frío, la concentración del metal en la orina y la corregida tomando en cuenta la creatinina urinaria. Se tomaron muestras casuales matutinas de orina. El objetivo era disponer de valores basales que ayuden a establecer los valores permisibles de mercurio en niños. La media geométrica fue 1,18 μg/L y de 1,22 μg/g creatinina para la corregida. La legislación venezolana establece valores umbrales permisibles menores de 5 μg/g de creatinina y menores de 4 μg/L para la población general. Un niño presentó una concentración de mercurio en orina superior al límite permisible menor a 5 μg/g creatinina. Ha de tomarse en cuenta que 36% de la muestra refirió tener amalgamas dentales, con un promedio de cuatro restauraciones por niño [Agreda, 2008].
Invertebrados como los moluscos son conocidos por su capacidad de bioconcentrar metales pesados, por lo que se utilizan en evaluaciones de ambientes acuáticos. Un aumento sostenido en la concentración de mercurio se ha detectado en mejillón (Perna viridis) y en ostra (Crassostrea sp.). Ello podría resultar de la influencia de actividad minera en las cuencas del alto y medio Orinoco, en especies colectadas a considerable distancia en aguas del Mar Caribe, al oriente de Venezuela [Salazar-Lugo, 2009; Rojas de Astudillo, 2002].
SARDINA Y ATÚN, PESCADOS DE ALTO CONSUMO:
La sardina se desarrolla rápidamente, desova varias veces al año y su abundancia varía frecuentemente atendiendo a las condiciones marinas.
La sardina es consumida en forma fresca, ahumada, salada o en latas. Las especies mas comunes son la sardina española o redonda (Sardinella aurita), brasilera (Sardinella brasiliensis) y japonesa (Sardinella zunasi). S. aurita alcanza 31 cm de largo, forma grandes cardúmenes en aguas subtropicales, habita en el Atlántico oriental desde el Mediterráneo y el Mar Negro hasta Sudáfrica y en el Atlántico occidental desde Cape Cod en Massachussets hasta Argentina, incluyendo el Caribe; siendo Venezuela, Senegal, Rusia, Ucrania y Ghana las principales fuentes. S. brasiliensis crece hasta un máximo de 25 cm, se halla en el Atlántico occidental, desde el Golfo de México hasta Uruguay, incluyendo el Caribe; Brasil es la mayor fuente y en Venezuela cobra una gran importancia comercial esta especie. S. zunasi es más pequeña, llega a medir 5-8 cm, se distribuye en el Pacífico occidental desde el sur de Japón hasta Taiwán, siendo Corea del Sur la mayor productora de sardina japonesa.
Entre las especies más comunes de atún podemos citar, el atún de ojo grande (Thunnus obesus), atún aleta azul (Thunnus thynnus), atún albacora (Thunnus alalunga), atún aleta amarilla (Thunnus albacares), atún skipjack (Katsuwonus pelamis). El atún de ojo grande alcanza los 2,4 m y 210 kg de peso, crece y se reproduce rápidamente, aunque sus poblaciones han sido reducidas por la sobreexplotación pesquera; habita en aguas tropicales y subtropicales del Atlántico, Océano Indico y Pacífico, ausente en el Mar Mediterráneo. Las principales fuentes están en Japón y Taiwán, seguidas de España y Corea. T. thynnus se localiza en los océanos Atlántico y Pacífico, donde se pesca intensivamente, amenazando sus poblaciones; llega a medir 3,8 m y pesar hasta 680 kg. En el Atlántico oriental se encuentra desde Noruega hasta las Islas Canarias, incluyendo el Mediterráneo y Mar Negro, en el Atlántico occidental se halla desde Labrador y Newfoundland hasta el Golfo de México y el Mar Caribe.
En el Pacífico, desde el Golfo de Alaska hasta Baja California y México y desde el sur del Mar de Okhotsk hasta el norte de Filipinas, siendo también reportado en Sudáfrica. Hay una importante población de atún aleta azul en Venezuela y Brasil. T. alalunga es una de las especies más veloces, alcanza un largo de 1,5 m y se encuentra en aguas tropicales y templadas de todos los océanos y en el Mar Mediterráneo. El atún blanco enlatado se elabora con albacora. Las principales fuentes de atún albacora son Japón, Taiwán, España y Estados Unidos, aunque la mayor cantidad de atún enlatado expendido en Estados Unidos proviene de Tailandia, Indonesia y Ecuador. T. albacares se desarrolla y reproduce rápidamente, puede medir 2,7 m y pesar 200 kg, vive en aguas tropicales y subtropicales de todos los océanos pero está ausente en el Mediterráneo. Su carne es muy baja en grasa, por lo que además de consumirse fresco es enlatado como atún light o ligero. K. pelamis es un atún de menor tamaño, aunque de veloz crecimiento y alta tasa reproductiva. Forma grandes cardúmenes en aguas superficiales, acompañado de aves marinas, tiburones y ballenas. Tailandia, Filipinas y Ecuador proveen la mayor parte de atún enlatado skipjack de bajo contenido calórico [EDF, sin fecha].
CONTENIDO DE MERCURIO EN ATÚN Y SARDINA ENLATADA:
El atún enlatado es uno de los pescados más consumidos en Estados Unidos, representando alrededor de 20-25% de todos los productos marinos consumidos en este país y alcanzando un consumo per cápita de 1,5 kg en 2000-2001, procedente en su mayoría del Pacífico. Un análisis de 168 muestras de atún enlatado comercializado en Nueva Jersey, mostró un mayor contenido promedio de mercurio total en atún blanco 0,407 mg/kg peso húmedo, que mayormente es atún albacora (Thunnus alalunga), al compararlo con el atún light, que generalmente es atún skipjack (Katsuwonus pelamis) con un promedio de 0,118 mg/kg peso húmedo. El contenido promedio 0,407 mg/kg hallado en atún blanco, es significativamente más alto que el valor que asigna el FDA al atún enlatado 0,17 mg/kg. Del atún blanco, 25% de las muestras excedieron 0,5 mg/kg. No hubo diferencia significativa, en los niveles de mercurio en atún enlatado en aceite al compararlo con el enlatado en agua; el drenaje del agua o aceite no afecta los niveles de mercurio, ya que su contenido en estos líquidos es muy bajo. Las muestras de atún blanco adquiridas en el año 2001, presentaron un promedio más alto de mercurio, al compararlo con los demás años del mismo periodo estudiado 1998-2003. La mayoría de los enlatados de atún blanco se identificaron como albacora y solo una cuarta parte de los enlatados mostraron el país de origen, usualmente Tailandia, algunos Nueva Guinea o las Filipinas [Burger, 2004].
Atún fresco en filete y atún albacora enlatado, contienen mayor cantidad de mercurio que el atún light enlatado, por lo que la FDA recomienda solo 6 onzas de atún albacora enlatado o atún fresco en filete por semana [OTIS, 2004].
El promedio de mercurio en 6 marcas de atún enlatado (7 muestras por marca) en México fue de 1,23 mg/kg, con 36% de las 42 muestras analizadas con valores mayores de 1 mg/kg. Se obtuvieron valor mínimo de 0,18 mg/kg y máximo de 4,52 mg/kg. El contenido promedio de mercurio rebasa siete veces el promedio reportado por la FDA de 1991 a 1996, que fue de 0,17 mg/kg en Estados Unidos.
El promedio de mercurio en 6 marcas de sardina enlatada (7 muestras por marca) en México fue de 0,74 mg/kg, con solo 14% de las 42 muestras analizadas con valores mayores de 1 mg/kg. Se obtuvieron valor mínimo de 0,14 mg/kg y máximo de 4,74 mg/kg. Atún y sardina son los principales productos pesqueros de amplio consumo en este país [Velasco-González, 2001].
En España, un estudio realizado en la provincia de Guipúzcoa, analizó el contenido de mercurio en crustáceos, moluscos y en 18 especies de peces; 29 muestras de atún enlatado en aceite (Thunnus thynnus) mostraron una mediana de 223,3 μg/Kg; 36 muestras de atún no enlatado (Thunnus thynnus) presentaron una mediana 308 μg/kg, resultando esta especie con los valores más altos. En 24 muestras de sardina (Sardina pilchardus) se obtuvo una mediana de 75,7 μg/kg y en 11 muestras de sardina enlatada en aceite 63,6 μg/kg [Sanzo, 2001].
En 37 muestras de atún enlatado (Thunnus thynnus) expendidas en Austria, se halló una concentración de 0,11 mg/kg; en 12 muestras de atún fresco de la misma especie se halló un contenido de 0,19 mg/kg [Suppin, 2005].
MERCURIO, CONSUMO DE PESCADO Y EMBARAZO:
El crecimiento del cerebro humano se acelera desde el tercer trimestre del embarazo hasta alrededor de los 18 meses después del nacimiento, y durante este periodo es muy grande la demanda de ácidos grasos poliinsaturados de cadena larga n-3. Al existir insuficiencia de los mismos y otros nutrientes, resulta déficit en el desarrollo cerebral [Innis, 1991].
El consumo promedio de pescado en una cohorte de embarazadas danesas fue de 27 g/d. Se comparó el efecto del consumo de pescado magro y del pescado graso en el crecimiento fetal. El salmón, arenque, caballa, trucha, halibut de Groenlandia (Reinhardtius hippoglossoides) se consideran peces grasos, mientras que bacalao, abadejo, solla, platija y aguja son peces magros. Se halló un significativo incremento en el riesgo de baja talla para la edad gestacional, bajo peso y baja talla al nacer entre las mujeres que consumieron pescado graso cuatro veces al mes, comparadas con las que no consumieron pescado graso. El incremento de la circunferencia cefálica no fue significativo. No se observó asociación con el consumo de pescado magro; la asociación inversa encontrada en el consumo total de pescado puede ser explicado por el consumo de pescado graso. Una explicación para la asociación inversa observada en el pescado graso, pudiera ser la presencia de contaminantes, donde pudiera cumplir un rol el metil mercurio, que también puede estar presente en pescado magro. Organoclorados y hexaclorobencenos, potencialmente presentes en peces, han sido relacionados en otros estudios con reducción del crecimiento fetal. Concluyen los investigadores de esta cohorte de Dinamarca, que debe moderarse el consumo de pescado graso en las embarazadas [Halldorsson, 2007].
El metilmercurio atraviesa la placenta y puede hallarse en la sangre del bebé, en niveles tan altos como el de la madre. El cerebro del bebé es el órgano más sensible a la exposición de metilmercurio y como el cerebro continúa su desarrollo durante todo el periodo de embarazo, la exposición en cualquier momento del embarazo es de gran interés. Los estudios sobre la catástrofe de Minamata en Japón, donde madres fueron expuestas a muy altos niveles de metilmercurio por consumir pescado contaminado, mostraron en sus niños, parálisis cerebral, retardo mental, disminución del tamaño cefálico y alteraciones musculares. No existen datos que sugieran, la relación causal por la exposición de metilmercurio en el padre y la aparición de defectos al nacimiento o retardo mental en niños [OTIS, 2004].
Se recomienda a una embarazada que se halla excedido en su consumo semanal de pescado, limitar su consumo de pescado en la semana siguiente o en las siguientes dos semanas [OTIS, 2004].
Un alto consumo de pescado durante el embarazo se ha asociado con mejoría cognitiva en niños, aunque altos niveles de mercurio se ha asociado con un efecto contrario. En Massachusetts se examinó la asociación del consumo de pescado durante la preñez con el contenido de mercurio en cabello y desarrollo cognitivo de niños de 5,5-8,4 meses de edad (promedio 6,5 meses) mediante la prueba de memoria de reconocimiento visual. El promedio del contenido de mercurio en cabello fue 0,55 μg/g, con un rango de 0,02-2,38 y con más de 10% de las muestras por encima de 1,2 μg/g. El alto consumo de pescado se asoció con alto desempeño cognitivo, por cada ración semanal adicional de pescado la prueba de reconocimiento visual subió 4 puntos, aunque un incremento de 1 μg/g de mercurio se asoció con una disminución de 7,5 en el puntaje de la prueba cognitiva [Oken, 2005].
Sin embargo un estudio llevado a cabo en madres e hijos en la República de las Seychelles, un archipiélago ubicado en el Océano Indico, reveló un mejor desempeño en cuatro de las seis pruebas empleadas para evaluar el neurodesarrollo, en niños de 66 meses que tuvieron los mayores valores de exposición prenatal y postnatal al metilmercurio. El contenido de mercurio total de 350 muestras, de 25 especies de peces, estuvo dentro del rango 0,004-0,75 mg/kg. El promedio de mercurio total en cabello de las embarazadas fue 6,8 mg/kg y en el cabello de los niños a los 66 meses de edad, 6,5 mg/kg. Estos niveles de exposición en Seychelles, son típicos de poblaciones que dependen del pescado como fuente principal de proteínas y calorías. Este controversial estudio contrasta con el realizado en las Islas Faroe, donde se halló déficit cognitivo asociado con la exposición prenatal al mercurio, en niños de 7 años. Los investigadores destacan una diferencia capital, referida a la fuente de exposición al metilmercurio, pescado oceánico en las Seychelles, mientras que en las Islas Faroe son las ballenas pilotos (Globicephala sp.). El promedio de 1,6 mg/kg en los niveles de metilmercurio en la carne de ballena piloto, es 10 veces mayor al encontrado en el pescado consumido en Seychelles [Davidson, 1998].
En la isla Mediterránea de Menorca, España, se evaluó la relación entre el consumo de pescado y otros productos marinos durante el embarazo con el desarrollo neurológico de los niños. Los hijos cuyas madres reportaron consumir pescado >2-3 veces a la semana durante su preñez, que recibieron lactancia materna por menos de 6 meses, presentaron significativamente mayor puntuación en las pruebas cognitivas y de desarrollo motor a la edad de 4 años, comparados con aquellos niños cuyas madres reportaron un consumo ≤ 1 vez a la semana. En contraste, el consumo de otros alimentos marinos durante el embarazo se asoció con menor puntaje en las pruebas cognitivas, verbales y numéricas a la edad de 4 años en sus hijos [Mendez, 2008].
Se mantiene la hipótesis que trata parcialmente de explicar la positiva asociación entre el consumo de pescado durante el embarazo y el desarrollo de los niños, mediante la presencia de DHA, un ácido graso n-3 con alta concentración en pescado, aunque en menor concentración en otros productos marinos [Oken, 2005; Oken, Radesky, 2008].
Se usó prospectivamente la información sobre la dieta y niveles de mercurio en embarazadas de Massachusetts, para examinar los riesgos y beneficios de la ingesta materna de pescado en el desarrollo de los niños a los tres años de edad. El consumo materno de pescado se correlacionó directamente con el contenido de mercurio total en eritrocitos, cuyo promedio fue de 3,8 ng/g con un rango 0,03-21,9. Mercurio en cabello se correlacionó con mercurio total en eritrocito y con el consumo de pescado. Un incremento de 1 mg/kg de mercurio en cabello se asoció con un incremento de 4,5 ng/g en mercurio eritrocitario. El consumo materno mayor de de dos raciones semanales se asoció con alta puntuación en la prueba WRAVMA, que evalúa el desarrollo visual espacial y motor, comparados con niños de madres que no consumieron pescado. Niños de un grupo de madres que reportaron el consumo de atún enlatado al menos dos veces semanales, obtuvieron mayor puntuación en las pruebas PPVT, que evalúa vocabulario, y WRAVMA, comparados con los de madres que no consumieron atún. Altos valores de mercurio eritrocitario materno, se asociaron con los peores desempeños de los niños en las pruebas. El promedio de consumo de DHA+EPA fue 154 mg/d, de los cuales 128 mg/d provinieron del pescado. Por cada consumo materno de 100 mg/d de DHA+EPA, los niños presentaron un escore más alto en las pruebas WRAVMA y PPVT. Por todo lo anterior, concluyen los investigadores que las recomendaciones para el consumo de pescado durante la preñez, deben tomar en cuenta los beneficios nutricionales así como los potenciales daños por la exposición al mercurio [Oken, Radesky, 2008].
En embarazadas de Massachusetts se halló una disminución en el consumo de pescado, tales como atún enlatado, pescados azules como sardinas, salmón, pez espada, macarela y otros como bacalao, abadejo, halibut, posterior a las recomendaciones federales emitidas en Enero de 2001, para limitar la exposición al mercurio. El consumo total de pescado se redujo hasta aproximadamente 1,4 raciones al mes, aunque no hubo cambio en el consumo de mariscos. También disminuyó la proporción de mujeres que consumían más de tres raciones semanales de pescado. Dados los beneficios que el consumo de estos pescados puede aportar a la madre e hijo, se desconocen las implicaciones en la salud pública que puede traer la disminución en la ingesta reportada en la presente investigación [Oken, 2003].
Embarazadas suecas mostraron una disminución en el consumo de pescado, que alcanzó un promedio de 0,5 g/d, atendiendo a las recomendaciones dadas en la consulta prenatal, durante el segundo o tercer mes de gestación, para reducir el consumo fresco de especies predadoras y de algunas enlatadas como el atún. Un 88% de las mujeres recibieron la información, comparado con un 30% hallado en 1990, pocos años antes del presente estudio. El contenido de mercurio total en cabello presentó una mediana de 0,35 mg/kg, con un rango de 0,07-1,5 mg/kg, y se asoció significativamente con metilmercurio en sangre del cordón umbilical, que presentó una mediana de 1,3 μg/L, con un rango de 0,10-5,7 μg/L. Ambas determinaciones en cabello y cordón umbilical, se incrementaron con el aumento del consumo de especies marinas. El contenido de mercurio inorgánico en sangre del cordón, tuvo una mediana de 0,15 μg/L, con un rango de 0,03-0,53 μg/L, y se incrementó significativamente con el aumento del número de amalgamas dentales. Sin embargo solo 14% de las embarazadas exhibían más de 10 amalgamas, comparado con 37% de estudios previos, lo que puede traducirse en una mejoría del estado de la salud dental. Dos embarazadas de esta investigación, cuyo consumo de pescado fue mayormente enlatado, dos veces por semana, presentaron concentraciones de 2,3 y 2,6 μg/L de metilmercurio en sangre del cordón, y del total de especies marinas consumidas, 58% y 81% correspondió al atún enlatado [Ask, 2003].
En otra investigación llevada a cabo en 20 madres suecas y sus hijos, se determinó metil mercurio y mercurio inorgánico en sangre, así como el mercurio total en leche materna. El metilmercurio en sangre materna se incrementó desde el parto, mediana 0,45 μg/L con un rango 0,24-1,5 μg/L, hasta una mediana de 0,60 μg/L con un rango 0,20-1,6 μg/L a las trece semanas postpartum. El metilmercurio en sangre materna se asoció con metilmercurio en sangre del cordón, donde se halló una mediana de 0,99 μg/L con un rango 0,52-3,8 μg/L y con metilmercurio en sangre del bebé a los 4 días, hallándose una mediana de 1,1 μg/L con un rango 0,62- 4,4 μg/L, aunque las concentraciones sanguíneas del cordón y del bebé fueron mayores al doble al compararlas con las de la madre. La concentración de metilmercurio en sangre del bebé decreció desde el cuarto día hasta la decimotercera semana, cuando se encontró una mediana de 0,38 μg/L con un rango 0,1-1,1 μg/L. No se halló una asociación significativa entre el consumo de pescado y el contenido de metilmercurio en sangre materna o del bebé. Habría que considerar el limitado consumo de pescado, particularmente de especies potencialmente altas en metilmercurio por estas mujeres. La concentración de mercurio inorgánico en sangre de los bebés, mediana 0,09 μg/L con un rango 0,02-0,34 μg/L, fue muy similar al hallado en las madres al momento del parto y a los cuatro días. A las trece semanas, la concentración de mercurio inorgánico decreció en los niños, mediana 0,05 μg/L con un rango 0-0,13 μg/L. El contenido de mercurio inorgánico en las madres se correlacionó significativamente con el número de amalgamas dentales al momento del parto.
El mercurio total en leche materna decreció significativamente desde el día cuatro, calostro con una mediana de 0,29 μg/L con un rango 0,06-2,1 μg/L, hasta una mediana de 0,14 μg/L con un rango 0,07-0,37 μg/L a las seis semanas, mostrándose una correlación entre el mercurio total en leche materna con el número de amalgamas, pero no con el consumo de pescado. No se halló en el presente estudio, asociación significativa entre el contenido de metilmercurio en sangre materna y en leche materna, probablemente por la baja exposición de las madres al metilmercurio pero que es más alta al mercurio inorgánico por las amalgamas. Esta investigación demuestra que la exposición del infante al metilmercurio y mercurio inorgánico a través de la leche materna es baja, comparada con la exposición durante los últimos periodos fetales [Ask, 2005].
El consumo de pescado durante el embarazo y los niveles de mercurio en sangre materna y del cordón umbilical fue analizado en Polonia. El promedio de la concentración de mercurio en sangre del cordón fue marcadamente mayor que en sangre de la madre: 1,09 μg/L vs. 0,83 μg/L. Alrededor del 90% de los recién nacidos mostraron concentraciones de mercurio menores de 2 μg/L, mientras que 90% de las madres mostraron niveles de mercurio por debajo de 1,6 μg/L. Hubo significativa correlación entre niveles de mercurio en sangre del cordón y en sangre de la madre. El promedio de los niveles de mercurio en sangre del cordón de recién nacidos de madres que reportaron consumo de pescado en el tercer trimestre, fue significativamente mayor comparado con recién nacidos de madres que no consumieron pescado durante el último trimestre del embarazo. Concluyen los investigadores que los bebés en este país, están expuestos a moderados niveles de mercurio antes del nacimiento y que el consumo de pescado durante el embarazo contribuye significativamente con la exposición prenatal al mercurio [Jędrychowski, 2007].
Aunque el estudio realizado en madres y sus recién nacidos del estado de Pará, en Brasil, no encontró signos atribuibles a la concentración de mercurio en neonatos, los altos niveles del metal en sangre del cordón, debe dirigir la atención a la acumulación intrauterina de mercurio y las potenciales consecuencias para los niños que viven en ambientes contaminados. Adicionalmente, se debe tomar en cuenta la transferencia postnatal de mercurio de la madre al niño, a través de la leche materna [Santos, 2007].
En dos distritos de Bretaña, en Francia, se evaluó la asociación del consumo de pescado de mar y mariscos con el embarazo. El promedio mensual de comidas con productos marinos fue 7,6 de las cuales 4,6 contenían pescado y 3 mariscos. Estos resultados, especialmente un mayor consumo local de mariscos en relación al promedio del país, apuntan a características regionales. Asumiendo que una porción de pescado sea 135 g y una porción de mariscos 200 g, correspondería con un consumo promedio de 20,4 g/d de pescado y 19,7 g/d de mariscos. Una cuarta parte de las mujeres consumieron pescado por lo menos dos veces a la semana. La mayoría de las mujeres consumieron mariscos, moluscos y crustáceos menos de una vez al mes. Factores individuales se asociaron con el aumento en el consumo de productos marinos, tales como el incremento en la edad y el nivel educativo. Se halló ante el incremento en la frecuencia de consumo de pescado, una disminución del riesgo de bebés pequeños para su edad gestacional; este riesgo fue significativamente alto en las mujeres que consumieron mariscos dos veces a la semana o más, comparadas con las que lo hicieron una vez al mes. Cada comida adicional mensual incluyendo pescado, se relacionó con un pequeño pero significativo incremento de 0,02 semanas en el tiempo de gestación. Ninguna asociación se observó con el peso al nacer y nacimiento pretérmino. Sin embargo en esta investigación no se discriminaron las especies de pescado en grasos o no y no se determinaron ácidos grasos ni contaminantes como el mercurio. Los investigadores apoyan la hipótesis del impacto positivo del alto contenido de ácidos grasos poliinsaturados de cadena larga en pescados y mariscos, que equilibrarían en parte el impacto dañino de algunos contaminantes como metales y organoclorados, frecuentemente detectados en alta concentración en especies filtradoras como los mariscos [Guldner, 2007].
En 182 embarazadas de las Islas Faroe, se determinó en sangre la concentración de ácidos grasos y contaminantes marinos. La mitad de las mujeres reportaron consumir pescado durante su embarazo, al menos tres veces por semana; por lo menos una vez al mes, alrededor del 60% reportó el consumo de carne de ballena y un poco más de la mitad grasa de ballena. La concentración de ácidos grasos en suero materno, presentó un promedio que triplicó al del suero del cordón umbilical. La duración de la gestación mostró una fuerte asociación positiva con la concentración sérica de ácido docosahexanoico en el cordón. El peso al nacer mostró una correlación positiva, con la concentración sérica en el cordón de ácido eicosatrienoico (ETA) y docosapentanoico y una asociación negativa con el ácido eicosapentanoico. El peso al nacer también pareció declinar ante el aumento de la concentración de policlorobifenilos (PCB). Concluyen además los autores, que el peso al nacer ajustado con la edad gestacional, puede disminuir ante altos niveles en la ingesta de ácidos grasos poliinsaturados [Grandjean, 2001].
Las implicaciones en el desarrollo sicomotor, ante la exposición prenatal a metilmercurio y policlorobifenilos (PCB) ha sido objeto de revisión. A diferencia del metilmercurio que es transferido al niño principalmente a través de la placenta, los policlorobifenilos (PCB) se transfieren vía leche materna en mucha mayor cuantía que por la placenta, representando una mayor amenaza postnatal para los niños. El potencial neurotóxico de los policlorobifenilos (PCB) fue por primera vez reconocido durante 1968, cuando enfermaron japoneses que habían ingerido aceite de arroz contaminado con estas sustancias. Niños de madres taiwanesas que ingirieron aceite de arroz contaminado con policlorobifenilos (PCB), mostraron anormalidades en el neurodesarrollo y menor índice IQ. La presencia en el arroz japonés, de altos niveles de cadmio, suma otro factor de confusión a ser considerado [Nakai, 2002].
Algunos estudios sugieren que el beneficio por el incremento materno en el consumo de pescado, puede ser mayor si la mujer escoge pescado bajo en metilmercurio. Recientes estudios indican además, que no hay asociación entre la exposición al timerosal contenido en vacunas y desórdenes del espectro autista. La colocación de amalgamas en embarazadas no se asoció con parto pretérmino, bajo peso al nacer o alteraciones en el desarrollo en niños británicos a la edad de 15 meses [Oken, 2008].
La Tabla 1 muestra en forma resumida, los resultados del contenido de mercurio en diversas especies de peces, procedentes de diferentes lugares geográficos y que fueron analizados por varios investigadores.
RECOMENDACIONES GENERALES:
• Incentivar el uso de tecnologías limpias en explotaciones mineras, de hidrocarburos y agrícolas [Mancera- Rodríguez, 2006].
• Se recomienda que las mujeres continúen con el consumo de pescado durante el embarazo, aunque deben escoger las especies con menores niveles de mercurio [FDA/EPA, 2004; FDA, 2006; Oken, 2008].
• Más investigación es necesaria para conocer los riesgos y beneficios de la ingesta de pescado durante el embarazo [Budtz-Jørgensen, 2007].
• Debe investigarse con mayor detalle, el efecto del consumo de pescado magro o graso, en el crecimiento fetal [Halldorsson, 2007].
• Mayor conocimiento se requiere, sobre los mecanismos toxicoquinéticos involucrados en la eliminación de mercurio por el niño durante sus primeros años de vida [Santos, 2007].
• Debe examinarse la toxicidad potencial del mercurio inorgánico en altos consumidores de pescado [Passos, 2007].
• Niveles de contaminantes tienen que ser monitoreados en otras especies marinas como los mariscos [Guldner, 2007].
• Una potencial interacción selenio-mercurio debe ser ampliamente investigada [Mozaffarian, 2006].
• Explorar la relación entre el consumo de pescado u otros productos marinos durante el embarazo y el desarrollo neurológico en niños [Méndez, 2008].
• Los mayores efectos según el sexo, en animales de experimentación a la exposición de metilmercurio (roedores machos) han de ser clarificados [Vahter, 2006].
• La posible interacción entre diferentes tóxicos como metilmercurio y policlorobifenilos (PCB) y el riesgo de sus efectos en el neurodesarrollo necesita conocerse mejor [Johansson, 2007].
• El potencial efecto de las frutas del Amazonas, para contrarrestar la toxicidad del mercurio, merece mayor interés [Passos, 2008].
• El monitoreo de mercurio en atún enlatado es necesario, especialmente en los países productores [Burger, 2004].
• Para dilucidar la neurotoxicidad del metilmercurio y los policlorobifenilos (PCB), deben considerarse otros factores según la región, como lo puede ser el contenido de cadmio en el arroz japonés [Nakai, 2002].
• La razón bioquímica de la toxicidad inducida por el metilmercurio aún no es bien entendida y ha de analizarse [Faustman, 2002].
TABLA 1. CONTENIDO DE MERCURIO EN PESCADO 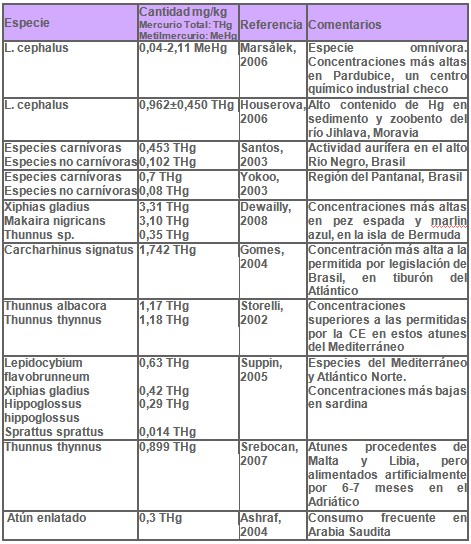
FUENTE: Datos compilados por Luis Caballero 2010
Referencias:
1. Agreda O, Pieters M, Seijas D. Niveles basales de mercurio en orina en escolares del Municipio San Diego, Edo. Carabobo. Gac Méd Caracas 2008; 116(3):212-218
2. Arnold S, Lynn T, Verbrugge L, Middaugh J. Human biomonitoring to optimize fish consumption advice: Reducing uncertainty when evaluating benefits and risks. American Journal of Public Health 2005; 95(3): 393-397
3. Ashraf W, Seddigi Z, Abulkibash A, Khalid M. Levels of selected metals in canned fish consumed in Kingdom of Saudi Arabia. Environmental Monitoring and Assessment 2006; 117(1-3):271-279
4. Ashraf W. Levels of selected heavy metals in tuna fish. The Arabian Journal for Science and Engineering 2006; 31(1A):89-92
5. Ask K, Vahter M, Berglund B, Nikiasson B, Blennow M, Sandborgh-Englund G. Transport of methylmercury and inorganic mercury to the fetus and breast-fed infant. Environmental Health Perspectives 2005; 113(10):1381-1385
6. Ask K, Vahter M, Peterson-Grawé K, Glynn A, Cnattingius S, Darnerud P, Atuma S, Aune M, Becker W, Berglund M. Methyl mercury and inorganic mercury in Swedish pregnant women and in cord blood: Influence of fish consumption. Environmental Health Perspectives 2003; 11(4):637-641
7. Benefice E, Luna S, Lopez R. A nutritional dilemma: fish consumption, mercury exposure and growth of children in Amazonian Bolivia. International Journal of Environmental Health Research 2008; 18(6):415-427
8. Bowerman W, Evans E, Giesy J, Postupalsky S. Using feathers to assess risk of mercury and selenium to bald eagle reproduction in the Great Lakes Region. Arch Environ Contam Toxicol 1994; 27: 294-298
9. Budtz-Jørgensen E, Grandjean P, Weihe P. Separation of risks and benefits of seafood intake. Environmental Health Perspectives 2007; 115(3):323-327
10. Burger J, Gochfeld M, Mercury in canned tuna: white versus light and temporal variation. Environmental Research 2004; 96:239-249
11. Caballero L. Excreción urinaria de yodo (yoduria) en escolares de comunidades indígenas de la cuenca del Río Orinoco en Venezuela. Revista Electrónica Portales Médicos 2008; 3(5)
12. Choi A, Cordier S, Weihe P, Grandjean P. Negative confounding in the evaluation of toxicity: The case of methylmercury in fish and seafood. Crit Rev Toxicol. 2008; 38(10):877-893
13. Cooke C, Balcom P, Biester H, Wolfe A. Over three millennia of mercury pollution in the Peruvian Andes. Proceedings of the National Academy of Sciences 2009; 106(22):8830-8834
14. Davidson P, Myers G, Cox C, Axtell C, Shamlaye C, Sloane-Reeves J, Cernichiari E, Needham L, Choi A, Wang Y, Berlin M, Clarkson T. Effects of prenatal and postnatal methylmercury exposure from fish consumption on neurodevelopment outcomes at 66 months of age in the Seychelles Child Development Study. JAMA 1998; 280(8):701-707
15. DesGranges J, Rodrigue J, Laperle M. Mercury accumulation and biomagnification in ospreys (Pandion haliaetus) in the James Bay and Hudson Bay regions of Quebec. Arch Environ Contam Toxicol 1998; 35: 330-341
16. Dewailly É, Rouja P. Balancing the risks and benefits of local fish consumption in Bermuda. Unité de recherché en santé publique du CHUL (CHUK)Québec, Canada/ Department of Conservation Services-Government of Bermuda. 2008
17. Dorea J. Fish are central in the diet of Amazonian riparians: should we worry about their mercury concentrations? Environmental Research 2003; 92:232-244
18. Duchen M. Mitochondria and Ca (2+) in cell physiology and pathophysiology. Cell Calcium 2000; 28: 339-348
19. EDF (Environmental Defense Fund). Find a fish. http://www. edf. org/ page.cfm ?tagID =1540 (Accesado: 2010-03-28)
20. Faustman E, Ponce R, Ou Y, Mendoza M, Lewandowski T, Kavanagh T. Investigations of methylmercury-induced alterations in neurogenesis. Environmental Health Perspectives 2002; 110 (suppl 5): 859-864
21. FDA (Food and Drug Administration), EPA (Environmental Protection Agency). What you need to know about mercury in fish and shellfish Advice for women who might become pregnant, women who are pregnant, nursing mothers, young children. 2004. http://www. fda.gov/ Food/ Foodsafety/ Product-Specific Information/ seafood/ food borne Pathogens contaminants/ Methyl mercury/ ucm11 5662.htm (Accesado: 2010-03-20)
22. FDA (Food and Drug Administration). Mercury levels in commercial fish and shellfish. 2006. http://www. fda.gov/ Food /Foodsafety/ Product-Specific Information/ Seafood/ Foodborne Pathogens Contaminants/ Methyl mercury/ ucm115 644.htm (Accesado: 2009-10-28)
23. FIN Fact Sheet: Legislación sobre contaminantes, Marzo 2006. http://www. iffo.net /intranet /content/ archivos/ 134.pdf (Accesado: 2009-12-14)
24. Gasso S, Cristofol R, Selema G, Rosa R, Rodriguez-Farre E, Sanfeliu C. Antioxidant compounds and Ca (2+) pathway blockers differentially protect against methylmercury and mercuric chloride neurotoxicity. J Neurosci Res 2001; 66:135-145
25. Gomes A, Vieira V, Veiga C, Teixeira R, Santana F. Total mercury in the night shark, Carcharhinus signatus in the western equatorial Atlantic ocean. Brazilian Archives of Biology and Technology 2004; 47(4):629-634
26. Grandjean P, Bjerve K, Weihe P, Steuerwald U. Birthweight in a fishing community: significance of essential fatty acids and marine food contaminants. International Journal of Epidemiology 2001; 30: 1272-1278
27. Guldner L, Monfort C, Rouget F, Garlantezec R, Cordier S. Maternal fish and shellfish intake and pregnancy outcomes: A prospective cohort study in Brittany, France. Environmental Health 2007; 6(33)
28. Halldorsson Th, Meltzer H, Thorsdottir I, Knudsen V, Olsen S. Is high consumption of fatty fish during pregnancy a risk factor for fetal grow retardation? A study of 44,824 Danish pregnant women. American Journal of Epidemiology 2007; 166(6):687-696
29. Hayase D, Horai S, Isobe T, William T, Takahashi S, Omori K, Tanabe S. Monitoring trace elements in coastal waters using sardine as a bioindicator. Interdisciplinary Studies on Environmental Chemistry-Environmental Research in Asia, Eds., Y. Obayashi, T. Isobe, A. Subramanian, S. Suzuki and S. Tanabe, pp. 187-175. 2009
30. Hightower J, Moore D. Mercury levels in high-end consumers of fish. Environmental Health Perspectives 2003; 111(4):604-608
31. Houserova P, Kuban V, Spurny P, Habarta P. Determination of total mercury and mercury species in fish and aquatic ecosystems of Moravian rivers. Veterinarni Medicina 2006; 51(3):101-110
32. Idrovo A, Manotas L, Villamil de García G, Ortíz J, Silva E, Romero S, Azcárate C. Niveles de mercurio y percepción de riesgo en una población minera aurífera del Guainía (Orinoquia colombiana). Biomédica 2001; 21:134-141
33. Innis S. Essential fatty acids in growth and development. Prog Lip Res 1991; 30: 39-103
34. Jędrychowski W, Perera F, Rauh V, Flak E, Mróz E, Pac A, Skolicki Z, Kaim I. Fish intake during pregnancy and mercury level in cord and maternal blood at delivery: An environmental study in Poland. International Journal of Occupational Medicine and Environmental Health 2007; 20(1):31-37
35. Johansson C, Castoldi A, Onishchenko N, Manzo L, Vahter M, Ceccatelli S. Neurobehavioural and molecular changes induced by methylmercury exposure during development. Neurotoxicity Research 2007; 11 (3,4):241-260
36. Kraepiel A, Keller K, In H, Malcolm E, Morel F. Sources and variations of mercury in tuna. Environmental Science Technology 2003; 37(24):5551-5558
37. Mancera N, Álvarez R. Estado del conocimiento de las concentraciones de mercurio y otros metales pesados en peces dulceacuícolas de Colombia. Acta Biológica Colombiana 2006; 11(1):3-23
38. Marcano V, Troconis A. Evaluación del contenido de mercurio en el pescado expendido en la ciudad de Mérida, Venezuela. Rev. Ecol. Lat. Am. 2001; 8(2):15-24
39. Maršálek P, Svobodová Z, Randak K. Total mercury and methylmercury contamination in fish from various sites along the Elbe River. Acta Vet. Brno 2006; 75:579-585
40. Mendez M, Torrent M, Julvez J, Ribas N, Kogevinas M, Sunyer J. Maternal fish and other seafood intakes during pregnancy and child neurodevelopment at age 4 years. Public Health Nutrition 2008; 12(10):1702-1710
41. Minnesota Department of Health. Methylmercury in fish. 2001. http://www. health.state. mn.us/ divs/eh/ esa/hra/ fishfact /methylme. html (Accesado: 2009-10-28)
42. Morrissey M, Rasmussen R, Okada T. Mercury content in Pacific troll-caught Albacore Tuna (Thunnus alalunga). Journal of Aquatic Food Product Technology 2004; 13(4)
43. Mozaffarian D, Rimm E. Fish intake, contaminants, and human health evaluating the risks and the benefits. JAMA 2006; 296(15):1885-1899
44. Nakai K, Satoh H. Developmental neurotoxicity following prenatal exposure to methylmercury and PCBs in humans from epidemiological studies. Tohoku J Exp Med. 2002; 196:89-98
45. Oken E, Bellinger D. Fish consumption, methylmercury and child neurodevelopment. Curr Opin Pediatr 2008; 20(2):178-183
46. Oken E, Kleinman K, Berland W, Simon S, Rich-Edwards J, Gillman M. Decline in fish consumption among pregnant women after a national mercury advisory. Obstet Gynecol 2003; 102(2):346-351
47. Oken E, Radesky J, Wright R, Bellinger D, Amarasiriwardena C, Kleinman K, Hu H, Gillman M. Maternal fish intake during pregnancy, blood mercury levels, and child cognition at age 3 years in a U.S. cohort. American Journal of Epidemiology 2008; 167(10):1171-1181
48. Oken E, Wright R, Kleinman K, Bellinger D, Amarasiriwardena Ch, Hu H, Rich-Edwards J, Gillman M. Maternal fish consumption, hair mercury, and infant cognition in a U.S. cohort. Environmental Health Perspectives 2005; 113(10):1376-1380
49. OTIS (Organization of Teratology Information Specialists). Methylmercury and pregnancy. 2004. www. otis pregnancy. org (Accesado: 2009-10-28)
50. Passos C, Mergler D, Lemire M, Fillion M, Guimarães J. Fish consumption and bioindicators of inorganic mercury exposure. Science of the Total Environment 2007; 373:68-76
51. Passos C, Mergler D. Human mercury exposure and adverse effects in the Amazon: a review. Cad. Saúde Pública 2008; 24 Sup 4:S503-S520
52. Pirela D, Casler C. Concentraciones de mercurio en tejidos de aves acuáticas, en el norte del sistema del Lago de Maracaibo. Boletín del Centro de Investigaciones Biológicas 2005; 39(2):108-127
53. Pouzaud F, Ibbou A, Blanchemanche S, Grandjean P, Krempf M, Philippe H, Verger P. Use of advanced cluster analysis to characterize fish consumption patterns and metylmercury dietary exposures from fish and other sea foods among pregnant women. Journal of Exposure Science and Environmental Epidemiology 2010; 20(1):54-68
54. Rojas de Astudillo L, Chang Y, Agard J, Bekele I, Hubbard R. Heavy metals in green mussel (Perna viridis) and oysters (Crassostrea sp.) from Trinidad and Venezuela. Arch Environ Contam Toxicol 2002; 42(4):410-415
55. Salazar-Lugo R. Estado de conocimiento de las concentraciones de cadmio, mercurio y plomo en organismos acuáticos de Venezuela. Revista Electrónica de Veterinaria 2009; 10(11):1-15
56. Santos E, Jesus I, Câmara V, Brabo E, Jesus M, Fayal K, Fróes C. Correlation between blood mercury levels in mothers and newborns in Itaituba, Pará State, Brazil. Cad. Saúde Pública 2007; 23 Sup 4: S622-S629
57. Santos E, Sá G, Jesus I, Brabo E, Câmara V, Lima M, Faial K, Mendes R, Mascarenhas A. Mercury in Negro River, Amazonas, Brazil-Preliminary study of exposure indicators in fish and human populations. Proceedings of the International Workshop on Health and Environmental effects of mercury, December 2003. Universidade Federal do Pará, Belém, Brazil
58. Sanzo J, Dorronsoro M, Amiano P, Amurrio A, Aguinagalde F, Azpiri M, EPIC Group of Spain. Estimation and validation of mercury intake associated with fish consumption in an EPIC cohort of Spain. Public Health Nutrition 2001; 4(5):981-988
59. Saulo A. Methylmercury in fish. Food Safety and Technology 2004; FST-2b. College of Tropical Agriculture and Human Resources, University of Hawai i at Mānoa
60. Scheuhammer A, Meyer M, Sandheinrich M, Murray M. Effects of environmental methylmercury on the health of wild birds, mammals, and fish. Ambio 2007; 36(1):12-18
61. Srebocan E, Pompe J, Prevendar A, Ofner E. Mercury concentrations in captive Atlantic bluefin tuna (Thunnus thynnus) farmed in the Adriatic Sea. Veterinarni Medicina 2007; 52(4):175-177
62. Storelli M, Giacomimelli R, Marcotrigiano G. Total and methylmercury residues in tuna-fish from the Mediterranean Sea. Food Additives Contaminants 2002; Part A 19(8):715-720
63. Suppin D, Zahlbruckner R, Krapfenbauer-Cermak Ch, Hassan-Hauser Ch, Smulders F. Mercury, lead and cadmium content of fresh and canned fish collected from Austrian retail operations. Ernahrung/Nutrition 2005; 29
64. Tamm C, Duckworth J, Hermanson O, Ceccatelli S. High susceptibility of neural stem cells to methylmercury toxicity: effects on cell survival and neuronal differentiation. J Neurochem 2006; 97: 69-78
65. U.S. Geological Survey. Mercury in the environment. Fact Sheet 146-00 October 2000. http://www. usgs.gov /themes/ factsheet/ 146-00/index. html (Accesado: 2009-12-07)
66. Vahter M, Åkesson A, Lidén C, Ceccatelli S, Berglund M. Gender differences in the disposition and toxicity of metals. Environ Res 2007; 104(1): 85-95
67. Velasco O, Echavarría S, Pérez M, Villanueva I. Contenido de mercurio y arsénico en atún y sardinas enlatadas mexicanas. Rev. Int. Contam. Ambient. 2001; 17(1):31-35
68. Winalski D, Mayson S, Savitz J. Poison plants: Chlorine factories are a major global source of mercury. Oceana, 2005.
69. Yokoo E, Valente J, Grattan L, Schmidt S, Platt I, Silbergeld E. Low level methylmercury exposure affects neuropsychological function in adults. Environmental Health: A Global Access Science Source 2003; 2
70. Žlabek V, Svobodová Z, Randák T, Valentová O. Mercury content in the muscle of fish from the Elbe River and its tributaries. Czech J. Anim. Sci. 2005; 50(11):528-534