La hemostasia es el proceso fisiológico mediante el cual se previene y controla la extravasación de sangre en el sistema vascular. Un sistema hemostático eficiente requiere la acción cooperadora de distintos componentes: un sistema vascular íntegro, una adecuada función plaquetaria y un sistema de coagulación apto para generar trombina y culminar en la formación del coágulo de fibrina, el cual será removido mediante el sistema plasminógeno-plasmina; todo lo anterior regulado por el sistema de inhibidores fisiológicos.
Sistema de coagulación
Hildebrando Romero Sandoval
La hemostasia es el proceso fisiológico mediante el cual se previene y controla la extravasación de sangre en el sistema vascular. Un sistema hemostático eficiente requiere la acción cooperadora de distintos componentes: un sistema vascular íntegro, una adecuada función plaquetaria y un sistema de coagulación apto para generar trombina y culminar en la formación del coágulo de fibrina, el cual será removido mediante el sistema plasminógeno-plasmina; todo lo anterior regulado por el sistema de inhibidores fisiológicos.
El objetivo final del sistema de coagulación es la formación de un coágulo o red de fibrina, para evitar el sangrado en el sitio de la lesión. Es un proceso dinámico y complejo donde participan numerosas proteínas plasmáticas: los factores de la coagulación (representados en números romanos); éstos circulan en sangre como zimógenos (inactivos). Cuando se desencadena el mecanismo de la coagulación, estas proteínas se activan adquiriendo actividad enzimática, mientras que otros (FV y FVIII) actúan como cofactores y su función consiste en potenciar la acción de los otros factores.
La mayoría de los procesos de activación se realizan sobre la superficie celular, la cual es importante no sólo por la presencia de los fosfolípidos en la membrana celular, sino también por la expresión de receptores de proteínas, y de servir de anclaje a los diferentes componentes del sistema (factores), donde los iones Ca2+ actúan como puentes entre la proteína y los fosfolípidos aniónicos, presentes en dichas membranas celulares. De una manera compleja y coordinada todos estos componentes interaccionan para generar una enzima clave: la trombina, la cual actúa sobre el fibrinógeno para generar la red de fibrina, que junto al tapón plaquetario y otras células sanguíneas van a conformar el coágulo.
En los últimos años se ha intentado explicar la coagulación in vivo mediante un modelo celular, adjudicándole a la célula un rol fundamental, y se deja al sistema de contacto que explique la coagulación de la sangre in vitro; de igual modo se discute otro modelo llamado: micropartículas.
Modelo celular de la hemostasia.
Propone que la coagulación ocurre en tres fases superpuestas: iniciación o inicial, amplificación y propagación.
Iniciación.
El principal iniciador fisiológico de la coagulación es el factor tisular (FT) y ocurre en todas aquellas células que presenten esta factor (es una proteína integral de la membrana). El FT se encuentra presente en células extravasculares como los fibroblastos, en la membrana de la célula endotelial y en los monocitos; en condiciones normales el FT no se expresa, pero al producirse un daño endotelial, por acción de estímulos físicos o químicos; se favorece su expresión. El FT se une al FVII y es activado por diferentes proteasas a FVIIa, formándose el complejo FT-FVIIa, el cual activa el FIX a FIXa y el FX a FXa. El factor Xa puede activar el FV a FVa. El factor Xa que permanece sobre la superficie celular, se une al FVa, formando el denominado complejo “protrombinasa” que cliva la protrombina para generar trombina en pequeñas cantidades y muy importante para la activación de más FV, FVIII y plaquetas, presente en la siguiente fase de amplificación. El factor Xa que se libera de la superficie celular, pierde su entorno protector de la célula, y es rápidamente inhibido por la antitrombina (AT) y por el inhibidor del factor tisular (TFPI).
Amplificación.
La ruptura del vaso permite que las plaquetas y los factores plasmáticos entren en contacto con la matriz extravascular, así las plaquetas se adhieren a los elementos que conforman la matriz, como el colágeno a través del FvW al sitio de la lesión, allí se activan parcialmente y se ubican en el sitio de exposición del FT.
Las pequeñas cantidades de trombina, generada sobre las células portadoras de FT, amplifican el proceso procoagulante, por tres mecanismos:
1. Aumentan la adhesión celular
2. Producen la activación plaquetaria y la agregación irreversible: exponiendo receptores como el complejo glicoproteico GPIIbIIIa y la liberación de elementos intraplaquetarios que consolidan el tapón hemostático
3. Estas pequeñas cantidades de trombina son suficientes para activar al FV (plasmático e intraplaquetario liberado por los gránulos alfa) a FVa, el FVIII a FVIIIa y el FXI a FXIa.
Una vez que la trombina se une a receptores plaquetarios como PAR ( receptores activados de proteasas), receptores no PAR (GIb/IX), desencadena las acciones ya mencionadas, favorece el ensamblaje de los complejos procoagulantes “tenasa” y “protrombinasa”, sobre la superficie plaquetaria e inicia así la fase de propagación; la cual genera suficiente cantidad de trombina.
Propagación.
En la fase anterior, las pequeñas cantidades de trombina iniciaron la activación plaquetaria, con la consecuente liberación del contenido de los gránulos alfa de las plaquetas hacia el medio circundante y la reacción “flip-flop” (que involucra los fosfolípidos de la membrana). En la reacción “flip-flop”, las plaquetas pueden reordenar su membrana de forma que los fosfolípidos como la fosfatidilserina, localizada en el interior de la célula, aparezca hacia el exterior, la cual sirve de anclaje mediante los iones Ca2+ para los complejos procoagulantes “tenasa” (IXa/VIIIa) y “protrombinasa” (Xa/Va).
Se debe recordar que las superficies aniónicas no sólo se expresan en las membranas plaquetarias sino que también están en otras superficies celulares: restos celulares y componentes del endotelio. En el proceso de activación plaquetaria además de la exposición de fosfatidilserina se activan otros receptores de superficie, de allí que se considere actualmente que los receptores específicos de la superficie plaquetaria coordinan el ensamblaje de los complejos procoagulantes.
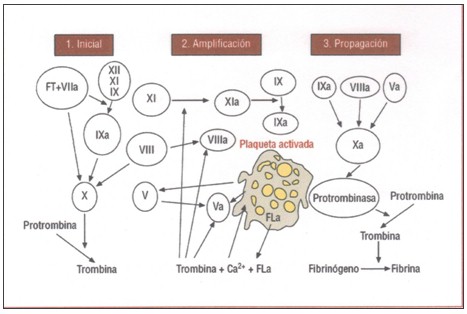
Fig. 1. Modelo celular de la coagulación
Así, cuando el factor IXa llega a la superficie plaquetaria forma el complejo tenasa junto al factor VIIIa. Este factor IXa proviene de 2 mecanismos:
1. Activación del FIX por FT/FVIIa sobre la célula portadora de FT y difusión del FIXa hacia la superficie plaquetaria (este factor no es inhibido por la antitrombina u otros inhibidores circulantes).
2. Activación del FIX por el FXIa, mediante dos vías: la primera sería la unión del FXI a las plaquetas y su activación por la trombina generando FIX y la segunda es la activación del FXI a través de la fase de contacto de la coagulación (vía intrínseca).
Una vez ensamblado el complejo FIX/VIIIa sobre la superficie plaquetaria, el FX es activado a FXa y junto a su cofactor FVa, forman el complejo “protrombinasa”, produciendo lo que se denomina “el estallido” de trombina, en cantidades suficientes para formar el coágulo de fibrina. El modelo celular presentado no considera la activación del sistema de coagulación a partir de la denominada “fase de contacto” (modelo tradicional de las vías extrínsecas y intrínsecas), sino que ocurre simultáneamente con la iniciada por el FT, pero a diferente velocidad.
Sistema de contacto de la hemostasia.
El sistema de contacto está formado por: FXII, precalicreína (PK), FXI y quininógeno de alto peso molecular (HMWK). La unión del factor XII plasmático a superficies cargadas negativamente induce su autoactivación que desencadena la activación del sistema de contacto. El factor XIIa adquiere actividad proteolítica, siendo sus sustratos principales el FXI y precalicreína, generando XIa y calicreína. El FXI y PK están en el plasma formando un complejo con el HMWK, que también tiene afinidad por superficies cargadas negativamente, por lo tanto actúa como cofactor y facilita la interacción de la enzima (FXIIa) con sus sustratos (FXI y PK).
La calicreína (K) generada puede activar más FXII y también hidrolizar al HMWK, liberando un fragmento denominado bradiquinina y dejando al resto de la molécula como un quininógeno activo de menor peso molecular, con mayor afinidad de unión a superficies con cargas negativas y por lo tanto mayor fijación de los sustratos para el FXIIa. La bradiquinina es un mediador vasoactivo y proinflamatorio, que induce la liberación de t-PA y prostaciclinas de la célula endotelial, por lo tanto, el FXI se activa por la trombina en un “feed-back” positivo y también por el sistema de contacto.
El FXIa convierte al FIX en IXa, el cual junto a su cofactor VIIIa, activa al FX a FXa. Esta última activación (FX a FXa) también se produce por acción del FT-FVIIa, pero la ejercida por el complejo FIXa-FVIIIa es de mayor eficacia. De aquí surge la importancia del déficit de FVIII y FIX, responsables de la hemofilia A y B respectivamente.
Se conocen deficiencias en las proteínas involucradas en el sistema de contacto (PK, HMWK, FXII) las cuales no están asociadas con episodios de sangrado. El sistema de contacto explica la coagulación de la sangre in vitro. Finalmente la trombina generada por el complejo protrombinasa, cliva los fibrinopéptidos A y B del fibrinógeno, generando una red de fibrina que inicialmente es soluble y por acción del FXIIIa (una transglutaminasa), y en presencia de Ca2+, se transforma en fibrina insoluble que es el coágulo estable (la misma trombina es la que activa al FXIII a FXIIIa).
La activación del sistema de coagulación debe estar regulada por otro sistema: el de los inhibidores fisiológicos. Los más importantes son: el TFPI (inhibe el complejo FT-VIIa y el FXa), la antitrombina (inhibe la trombina, FXa, FIXa, FXIa, FXIIa), el cofactor II de la heparina (inhibe la trombina), el C1-inhibidor (inhibe FXIIa, FXIa, calicreína), el sistema trombomodulina PC-PS (inhibe FV, FVa, FVIIIa). Ya una vez conformado el coágulo y localizado en el sitio de la lesión, el sistema plasminógeno-plasmina se encarga de la disolución del mismo, donde actúa como un sistema fibrinolítico y facilita la reparación del vaso.
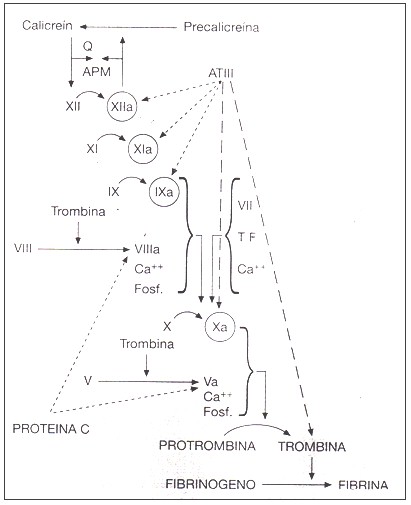
Fig. 2. Sistema de contacto de la coagulación
Sistema de micropartículas. Activación del sistema de coagulación
Por consenso internacional (2004) se define a las micropartículas como: partículas plasmáticas menores a 1 µ de diámetro, portadoras de antígenos de superficie de sus células de origen, es decir, sus características proteómicas y receptores de superficie. Son fragmentos celulares que se encuentran circulando y que se originan a partir de células endoteliales, plaquetas, eritrocitos y monocitos.
Cuando estas células son activadas por estímulos físicos o químicos (hipoxia, estrés, IL-6, TNFα) se produce una reorganización del citoesqueleto de membrana, con la consiguiente formación de vesículas y liberación de las micropartículas, es decir, durante su formación se modifica la bicapa lipídica de la membrana, exponiendo una superficie rica en fosfolípidos cargados negativamente (micropartículas), las cuales constituyen el soporte para la unión de los factores y complejos de la coagulación (función de las plaquetas).
Se ha demostrado que las micropartículas puede expresar factor tisular (actividad procoagulante), por lo tanto pueden iniciar y mantener la coagulación, ya no solo en el sitio de la injuria, sino donde se localizan estas micropartículas (endotelio, plaquetas, leucocitos).
Bibliografía
1. Concepción A, Almagro D. Estado actual del mecanismo de la coagulación sanguínea. Rev Cubana Hematol Immunol Hemoter. 2001; 17(2):77-89
2. Furie B, Furie BC. Mechanism of trombosis formation. N Engl J Med. 2008; 359(9):938-49
3. Gailani D, Renné T. Intrinsic pathway of coagulation and arterial thrombosis. Arterioscler Thromb Vasc Biol. 2007; 27:2507-2513
4. Davie EW,Ratnoff OD. Waterfall sequence for intrinsic blood cltting. Sicence.1964; 145:1310-1312
5. Kordich LC. Concepto actual del sistema de coagulación. ICLIAD. 2009; 50 (sup.2):35-38
6. Macfarlane RG. An enzyme cascade in the blood clotting mechanism, and its function as a biological amplifier.Nature.1964; 202:498-499
7. Monroe DM, Hoffman M. What does it take to make the perfect clot? Arterioscler Thromb Vase Biol. 2006; 26(1):41-48
8. Morel O, Toti F, Hugel B, Bakouboula B, Camoin-Jau L. Procoagulant Microparticles: Disrupting the vascular homeostasis equation? Arterioscler Thromb Vasc Biol. 2006; 26(12):2594-2604
9. Mackman N. Role of tissue factor in homeostasis and thrombosis. Blood Cells Mol Dis. 2006; 36(2):104-7
10. Ngo JC, Huang Mm Roth DA. Crystal structure of human factor VIII: implications for the formation of the factor IXa-factor VIIIa complex. Structure 2008; 16:597-606
11. Tesselaar ME, Romjiim FP, Van Der Linden IK. Microparticle-associated tissue factor activity: a link between cancer and thrombosis? J Thromb Haemost 2007; 5:520-527