El estrés metabólico origina un estado de inmunodepresión en los pacientes. Este proceso empeora su pronóstico, por lo que es vital luchar contra él. Existen unos compuestos, denominados genéricamente inmunonutrientes, que mejoran el estado inmunológico en cuadros de estrés metabólico de diversa etiología: la glutamina, la arginina, los nucleótidos y los ácidos grasos omega-3. Diversos estudios clínicos corroboran sus efectos beneficiosos en este campo.
Efecto de los inmunonutrientes en el paciente con estrés metabólico
María del Rocío Catalina García. Diplomada en Nutrición Humana y Dietética. Universidad de Valladolid. Estudiante de Enfermería. Universidad de Valladolid.
Resumen
El estrés metabólico origina un estado de inmunodepresión en los pacientes. Este proceso empeora su pronóstico, por lo que es vital luchar contra él. Existen unos compuestos, denominados genéricamente inmunonutrientes, que mejoran el estado inmunológico en cuadros de estrés metabólico de diversa etiología: la glutamina, la arginina, los nucleótidos y los ácidos grasos omega-3. Diversos estudios clínicos corroboran sus efectos beneficiosos en este campo.
Palabras clave: inmunonutrientes, estrés metabólico, sistema inmune, glutamina, arginina, nucleótidos, ácidos grasos omega 3.
Abstract
Metabolic stress causes a state of immunosuppression in patients. This process worsens their prognosis, so it is vital to combat it. There are some compounds, generically called immunonutrients, which improve the immune status in boxes of various metabolic stress etilogía: glutamine, arginine, nucleotides and omega-3 fatty acids. Several clinical studies confirm its benefits in this field.
Key words: immunonutrients, metabolic stress, the immune system, glutamine, arginine, nucleotides, omega-3 fatty acids.
INTRODUCCIÓN
El estrés metabólico es la respuesta que el organismo tiene ante una situación de agresión (sepsis, cirugía, traumatismo, cáncer…). Existe un notable aumento del gasto metabólico basal, que se acompaña de un intenso catabolismo proteico, por lo que el balance nitrogenado del sujeto se torna negativo (la degradación proteica supera la síntesis). Por tanto, se produce un aumento de la proteolisis muscular y de la gluconeogénesis y glucogenolisis, con el fin de obtener glucosa. Sin embargo, aunque sea paradójico, existe una intolerancia periférica a la glucosa que no permite una correcta utilización de ésta por parte de los tejidos. Esto genera un cuadro de hiperglucemia, que a su vez desencadena la elevación de la insulina plasmática.
La masiva utilización de las proteínas como sustrato energético provoca un aumento de la producción de urea. La movilización de triglicéridos desde el tejido adiposo es muy acusada y la grasa se convierte en la principal fuente de energía en estrés metabólico. Esto se traduce en un coeficiente respiratorio de 0,7-0,8.
La respuesta metabólica al estrés se desencadena por la acción combinada de mediadores inflamatorios y hormonas catabólicas. Cualquier lesión orgánica origina un proceso inflamatorio, en el que la liberación de citoquinas (TNF-, IL-1, IL-2, IL-6, INF…) juega un papel primordial. Además, aumenta la producción de prostaglandinas de la serie 2. Como consecuencia de todo ello, se produce un cuadro de inmunosupresión en estos pacientes.
En los primeros momentos tras la agresión, hay una elevación de los niveles de ACTH, catecolaminas (adrenalina y noradrenalina), corticoides y glucagón. El aumento de la insulina, hormona anabolizante, es más tardío. Se postula que la aumentada liberación de hormonas contrarreguladoras (catecolaminas, cortisol, glucagón) bloquea el efecto de la insulina. La IL-6 provoca una síntesis hepática a favor de las proteínas reactantes de fase aguda, en detrimento de la albúmina, prealbúmina, transferrina y proteína transportadora de retinol.
Todos los esfuerzos de los profesionales sanitarios van a estar encaminados a moderar el estado catabólico, la respuesta inflamatoria y el estado inmunosupresor, para conseguir una evolución más favorable del paciente. A estos efectos, se está estudiando la eficacia de la administración de anticuerpos anti-TNF y de hormona del crecimiento. Diversos estudios confirman que el empleo de ciertos nutrientes, como la glutamina, la arginina, los nucleótidos y los ácidos grasos omega-3, en cuadros de estrés metabólico de diversa etiología, mejora el estado inmunológico del sujeto. A continuación, detallaremos los efectos de cada uno de ellos.
EFECTOS DE LOS INMUNONUTRIENTES SOBRE EL SISTEMA INMUNITARIO
GLUTAMINA:
La glutamina es un aminoácido considerado en circunstancias normales como no esencial, ya que el organismo puede sintetizarlo. Cuando existe estrés metabólico, no se pueden cubrir las necesidades únicamente con la síntesis endógena, por lo que es necesario aportarlo. De esta forma, la glutamina constituye uno de los llamados aminoácidos condicionalmente esenciales.
Es el aminoácido más abundante en el plasma y en el tejido muscular, constituyendo un 60% del mismo. La concentración de glutamina en la sangre y en el músculo disminuye tras cualquier proceso que entrañe un estrés metabólico. Su descenso muscular se debe a un aumento de la demanda de este aminoácido en la ruta neoglucogénica hepática.
La glutamina es el sustrato energético preferente de células con alta capacidad de proliferación, como las del epitelio intestinal, las células del sistema inmune, las del túbulo renal y los eritrocitos. Éstos la emplean como fuente principal de energía. Además, este aminoácido estimula la ornitina descarboxilasa, enzima necesaria para la proliferación eritrocitaria.
Los enterocitos utilizan la glutamina como sustrato energético preferente y su degradación origina: amonio, alanina y citrulina, que es un precursor de la arginina. En condiciones normales, el epitelio intestinal consume el 30% de la glutamina circulante en plasma; sin embargo, en situación de agresión, como este aminoácido se transporta principalmente al hígado para obtener energía, su aporte a la luz intestinal es deficitario, y esto deriva en una atrofia de las vellosidades y un aumento de la permeabilidad intestinal. El componente inmunológico del tracto intestinal está formado por el tejido linfoide asociado al intestino (GALT). Si la mucosa se altera debido al déficit de glutamina, este tejido inmunitario también se verá afectado de manera negativa y con ello, la eficacia del sistema inmune en general.
El músculo y el pulmón son los principales donantes de glutamina y el intestino es el receptor fundamental, en condiciones estándar. Cuando existe una situación de estrés, son las células inmunitarias y el hígado los destinatarios prioritarios, en detrimento del intestino, e incluso el riñón dona glutamina para intentar compensar el gran catabolismo imperante.
En experimentos in vitro, se ha observado que la administración de glutamina en pacientes con estrés metabólico atenúa la masiva depleción tisular, reduce la atrofia intestinal y promueve el funcionamiento del epitelio intestinal. Diversos estudios clínicos han demostrado que el aporte suplementario de glutamina mejora el balance nitrogenado, acorta la estancia hospitalaria, estimula el crecimiento de la mucosa intestinal, potencia la proliferación linfocitaria y modera la liberación de citoquinas proinflamatorias. Además, se postula que es un potente inhibidor de la NO-sintasa, por lo que regularía la inflamación y el shock séptico.
ARGININA:
Es un aminoácido condicionalmente esencial, pues aunque en condiciones normales, el organismo es capaz de sintetizarlo, en situación crítica, se convierte en esencial, ya que la síntesis no cubre los requerimientos. A partir de este aminoácido, se genera óxido nítrico, que interviene en la inhibición de la agregación plaquetaria y la regulación de la termogénesis, tiene un demostrado efecto vasodilatador y favorece la diferenciación de los linfocitos Th1. Además, es citotóxico, pues es capaz de exterminar diversos microorganismos patógenos, y citostático, al inhibir el crecimiento de éstos. Se postula que el óxido nítrico también tiene función tumoricida, pudiendo eliminar células tumorales.
La arginina participa activamente en el ciclo de la urea y su conversión en ornitina contribuye a la formación de poliaminas, moléculas clave en los procesos de crecimiento y diferenciación celular. Diversos estudios confirman que la suplementación de arginina produce una disminución de la inmunosupresión en pacientes catabólicos. Además, se ha observado una mejoría en la respuesta de linfocitos T, NK y macrófagos, aumento de la secreción de IGF-I, insulina y catecolaminas, favorece la cicatrización tisular por estimulación de la síntesis de colágeno y mejora el balance nitrogenado. Es de todos los aminoácidos, el que posee mayor potencia estimuladora de la insulina.
Las fuentes alimentarias de glutamina y arginina son aquéllas ricas en proteínas: las carnes, los pescados, los huevos, los lácteos.
NUCLEÓTIDOS:
Son moléculas que intervienen en procesos muy importantes de la bioquímica humana. Constan de la unión de un nucleósido con un grupo fosfato. El primero está a su vez formado por una pentosa, que puede ser ribosa o desoxirribosa y una base nitrogenada, púrica (adenina, guanina) o pirimidínica (timina, citosina, uracilo). Forman parte de diversos compuestos: moléculas de alta energía (ATP), segundos mensajeros celulares (AMPc), material genético de los organismos vivos (ADN y ARN), cofactores enzimáticos (NAD, FAD, NADP)… Algunas fuentes alimentarias de purinas son los mariscos, las vísceras y los pescados grasos.
Se ha descrito que los nucleótidos facilitan la instauración de las bifidobacterias en el tracto intestinal y constituyen un estímulo trófico de la mucosa digestiva. Además favorecen la absorción del hierro y la síntesis hepática de lipoproteínas HDL. En experimentación animal, se ha observado que la administración de nucléotidos produce un aumento en la producción de inmunoglobulinas y una menor incidencia de infecciones y mortalidad.
ÁCIDOS GRASOS OMEGA-3:
Las grasas constituyen el nutriente con más aporte calórico, 9 kcal/g; pero además de su función energética, hay que destacar su intervención en la composición de las membranas celulares y la biosíntesis de eicosanoides a partir de ellas. Los triglicéridos son ésteres formados por glicerol y ácidos grasos. Estos últimos se pueden clasificar atendiendo a dos criterios: el número de dobles enlaces que tengan y la longitud de la cadena. Por consiguiente, existen ácidos grasos de cadena corta (CCA), de dos a cuatro carbonos; de cadena media (MCA), de seis a doce carbonos, y de cadena larga (LCA), de catorce a veinticuatro carbonos.
Según el grado de instauración, encontramos ácidos grasos saturados (sin dobles enlaces), monoinsaturados (con un doble enlace) y poliinsaturados (con más de un doble enlace), los cuales se dividen en omega-6 y omega-3, donde se incluyen los ácidos grasos esenciales linoleico y alfa-linolénico respectivamente. Los saturados los encontramos fundamentalmente en la grasa de los lácteos, en las carnes, en grasas de origen animal y en el aceite de coco y palma. Los monoinsaturados predominan en el aceite de oliva. Los poliinsaturados de la serie omega-6 se hallan en los aceites de semilla (girasol, maíz, germen de trigo…) y los omega-3 están presentes en los pescados grasos (salmón, trucha, sardina, atún…).
Nos centraremos en el estudio de los ácidos grasos de la serie omega-3 por su inclusión en los llamados inmunonutrientes, aunque se comentarán algunos aspectos de los omega-6, por su influencia en la inmunidad. Los w3 más significativos son: el ácido alfa-linolénico, el ácido eicosapentaenoico (EPA) y el docosahexaenoico (DHA).
Ya hemos comentado que los ácidos grasos forman parte de la bicapa lipídica. Del tipo de ácidos grasos de la dieta dependerá la composición de las membranas celulares, determinando su naturaleza y la actividad de los receptores. De esta forma, los ácidos grasos insaturados proporcionan mayor fluidez a la membrana, mientras que los saturados confieren rigidez.
Centrándonos ya en el campo de la inmunología, el concepto clave sobre los ácidos grasos, que resume todo lo que se detallará a continuación, es su influencia en el estado inmunitario: los w3 tienen un potencial efecto antiinflamatorio, los w6 son proinflamatorios e inmunosupresores y los monoinsaturados, de la serie w9, tienen efecto neutro.
Los ácidos grasos poliinsaturados (omega-6 y omega-3) son precursores de los eicosanoides (prostaglandinas, prostaciclinas, tromboxanos y leucotrienos), sustancias con una participación capital en el funcionamiento del sistema inmune. Los w6 son precursores de las prostaglandinas y tromboxanos de la serie 2 (PGE2, PGI2, TXA2) y leucotrienos de la serie 4 (TLB4), de máxima actividad inmunosupresora y proinflamatoria. Los w3 lo son de prostaglandinas de la serie 3 (PGE3, PGI3, TXB3) y leucotrienos de la serie 5 (LTB5), con una menor actividad proinflamatoria. Además, los w3 tienen la capacidad de disminuir la producción de PGE2 y TLB4, por lo que disminuyen IL -1 y TNF-, potentes precursores inflamatorios.
Estudios in vitro han demostrado que las prostaglandinas de la serie 2 aumentan la producción de citoquinas proinflamatorias e inhiben la síntesis de IgM y la actividad de macrófagos y linfocitos NK. Por el contrario, las de serie 3 no poseen estos efectos inmunosupresores. TLB4 es un importante mediador de la respuesta inflamatoria, mientras que LTB5 es unas diez veces menos potente.
Otro aspecto a destacar es que el estado inflamatorio propiciado por los eicosanoides altera numerosas funciones de los linfocitos, como la secreción de anticuerpos, la producción de linfocinas y la actividad citotóxica.
A la luz de estos datos, se demuestra que los ácidos grasos omega-6, debido a su perfil de eicosanoides, poseen efecto inmunosupresor y proiinflamatorio. Para afirmar el efecto antiinflamatorio de los w3 es necesario añadir algunas matizaciones. Estos ácidos grasos sí que producen compuestos con actividad proinflamatoria, como los LTB5, pero su efecto es mucho menor que los generados por la vía de los w6. Además, el resto de eicosanoides formados no poseen acción inflamatoria, por lo que el resultado neto es un efecto antiinflamatorio.
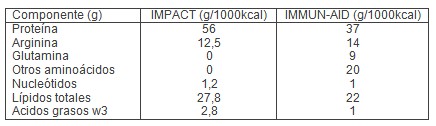
FÓRMULAS INMUNOPOTENCIADORAS
En la actualidad, disponemos de dos fórmulas de nutrición artificial que incluyen en su composición los cuatro inmunonutrientes detallados en el presente trabajo: Impact (éste exento de glutamina) e Immun-aid. A continuación, se detallarán distintos estudios que muestran los efectos de ambos preparados.
• En 1992, Ziegler et al. estudiaron el efecto de la glutamina en humanos. Se realizó un estudio doble ciego en 24 trasplantados de médula ósea que recibían suplementación de glutamina por vía parental, comparándolos con un grupo control, formado por 21 integrantes, que recibía una fórmula isocalórica y normoproteica, libre de glutamina, mediante soporte nutricional parenteral. Se observó una menor incidencia de infecciones en el grupo que recibía glutamina (3 afectados en este grupo, frente a 9 del grupo control) y un acortamiento del tiempo de estancia en el hospital (el grupo de estudio permaneció de media 29 días, mientras que el control estuvo de media 36 días). Además, Ziegler y Young realizaron un estudio en animales de experimentación sobre los beneficios de la suplementación de glutamina. Los resultados determinaron efectos positivos en el 80%.
• Schloreb y Amase determinaron en pacientes sometidos a trasplante de médula ósea que el tiempo de hospitalización era menor en aquéllos que recibían suplementación con glutamina.
• Un metaanálisis de 14 ensayos aleatorizados hasta el año 2000 establece la relación entre el aporte de glutamina y la mortalidad, complicaciones y tiempo de hospitalización. Los estudios fueron divididos según el tipo de paciente (crítico o quirúrgico), la vía de administración de la nutrición (enteral o parenteral) y la dosis aportada (mayor o menor de 0,2 g/kg/día). Se excluyeron trabajos acerca de pacientes en edad pediátrica o sometidos a quimioterapia o trasplante de médula. Se determinó que la glutamina produce una disminución del tiempo de estancia hospitalaria, una menor prevalencia de infecciones y una reducción de la mortalidad. Las diferencias entre los grupos no fueron significativas, aunque con respecto a la mortalidad, se observó un mayor beneficio en enfermos que recibían glutamina por vía parenteral a una dosis superior a 0,2 g/kg/día. La tasa de infecciones fue algo menor en el grupo de quirúrgicos que en el de críticos.
• Gouters et al., elaboraron un estudio randomizado con 84 pacientes críticos, a los que dividieron en dos grupos. Uno era el grupo control y el otro recibía una dosis de 0,3 g/kg/día de glutamina por vía parenteral. Observaron una significativa reducción de la mortalidad en este último grupo (un 40% de defunciones frente a un 67% en el grupo control).
• En 1997, Griffith et al Nutrition realizaron un estudio en pacientes críticos comparando los efectos de la administración de nutricional parenteral enriquecida en glutamina (0,28 g/kg/día), con una parenteral de composición estándar, normoproteica e isocalórica. La mortalidad en el tiempo de estancia en la UCI fue de 17 pacientes del grupo de glutamina y 22 del grupo control. Sin embargo, a los 6 meses la diferencia en la tasa de defunciones era mucho mayor: 18 en el grupo de glutamina, frente a 28 del grupo control. Este estudio demuestra que la administración de glutamina no sólo mejora la evolución de los pacientes a corto plazo, sino que la tendencia continúa en el tiempo.
• Un estudio publicado por Houdijk et al. engloba a 60 pacientes politraumatizados que reciben soporte nutricional enteral. 29 de ellos reciben una fórmula enriquecida en glutamina, mientras que a los otros 31 se les administra un preparado estándar (grupo control). Se observó una menor incidencia de infecciones en el grupo de la glutamina: 5 neumonías, frente a 14 en el control y 2 bacteriemias, frente a 13 en el control. Además se demostró una menor tasa de mortalidad a los seis meses y una mejora de la capacidad del sistema inmunitario, en los pacientes que recibieron el suplemento de glutamina.
• En 1999 fue publicado por Gadek CCM un estudio realizado en pacientes con distrés respiratorio agudo. Se administró a un grupo una fórmula enteral enriquecida en EPA y -linolénico, mientras que el grupo control recibió, también por vía enteral, un preparado estándar. Se observó una importante mejora en la evolución del distrés respiratorio agudo, en los pacientes suplementados con los ácidos grasos. Además se determinó una disminución de los días sometidos a ventilación mecánica, del tiempo de estancia en UCI, del número de fallos orgánicos y de la tasa de mortalidad.
• En un estudio realizado en pacientes que habían sufrido una resección intestinal, se demostró que aquéllos que recibían una fórmula enteral rica en ácidos grasos w3 desarrollaban menos complicaciones digestivas que los que únicamente recibían un preparado estándar. El grado de susceptibilidad a las infecciones era similar en ambos grupos.
• Un metaanálisis realizado por Beale et al. agrupa 12 estudios y 1482 pacientes críticos. Se demuestra que aquéllos que recibieron una fórmula inmunomoduladora presentaron una disminución del tiempo de estancia hospitalaria y de las complicaciones infecciosas; aunque no se observó ningún beneficio en cuanto a la tasa de mortalidad. Estos resultados fueron más positivos en el subgrupo de pacientes quirúrgicos.
• Senkal et al. observaron en pacientes sometidos a cirugía gastrointestinal, a los que se administraba la fórmula inmunomoduladora Impact por vía enteral, que los niveles de IL-6 y TNF- no incrementaban. El grupo control recibía un preparado estándar y sus integrantes sí presentaban un aumento de las citadas citoquinas. También se observó que el grupo estudio presentaba un aumento de la IL-2 menor que el grupo control. Esto se traduce en que esta fórmula puede atenuar la respuesta inflamatoria desencadenada por la cirugía. En otro estudio realizado en pacientes quemados, no se produjo ninguna mejora ni en la tasa de mortalidad, ni en el tiempo de estancia hospitalaria, tras la administración de Impact.
• Moore et al. encontraron que pacientes con traumatismo que eran suplementados con Inmun-aid desarrollaban menos abcesos abdominales y la incidencia de fracasos multiorgánicos era menor.
• En 1998, Galban et al. elaboraron un estudio randomizado sobre los beneficios de la administración de Impact en pacientes sépticos. 181 pacientes fueron enrolados, de los cuales 176 fueron escogidos atendiendo a los criterios de inclusión y exclusión. De ellos, 89 recibieron Impact por vía enteral y 87, la fórmula control Nutrodip Proteina. Los pacientes se clasificaron en subgrupos atendiendo a la puntuación APACHE II. Las variables estudiadas fueron: mortalidad en UCI, estancia en UCI, días en ventilación mecánica, infecciones nosocomiales adquiridas, complicaciones de la nutrición enteral y diversos parámetros nutricionales. El estudio se restringió al período de estancia en UCI, por lo que no se pudieron obtener datos acerca de la evolución posterior. Se emitieron las siguientes conclusiones: la mortalidad resultó significativamente menor en los pacientes que recibieron la fórmula inmunomoduladora, sobre todo en el subgrupo con menor puntuación de APACHE II (10-15 puntos); no se hallaron grandes diferencias en la estancia media ni en los días de ventilación mecánica; el número de bacteriemias y de infecciones nosocomiales fueron menores en los pacientes con Impact; no existieron diferencias en los parámetros nutricionales ni en las complicaciones digestivas.
CONCLUSIONES GENERALES
A la luz de los estudios recogidos, podemos afirmar que los inmunonutrientes poseen eficacia en el tratamiento de los pacientes con estrés metabólico y ejercen un efecto positivo sobre el estado del sistema inmune. Sin embargo, es necesario que se sigan realizando estudios para determinar las dosis adecuadas en cada caso clínico y se defina un protocolo adecuado para la administración de dichos preparados.
BIBLIOGRAFÍA:
• Miján de la Torre, A. Nutrición clínica. Bases y fundamentos. Editorial Doyma. (T. 3-8-18-21).
• Matáix, J. Alimentación y Nutrición Humana.
• Barbosa, R; Wolfe, B. Perioperative feeding (T. 20). Nutrition and Inmunology. Ed. Humana Press.
• www.uninet. edu/cimc99 /seminarios/ galban/inmunonutri_archivos/v3_ document.htm
• www.membres.lycos.fr/trinche/INMUA2.htm