Se realizó una investigación descriptiva y transversal para determinar la prevalencia de la hiperestesia dentinaria en adultos del sector La Naya, ASIC Santa Cruz del Este en el período comprendido desde octubre-diciembre del 2009. El universo del estudio estuvo constituido por 560 pacientes de ambos sexos comprendidos entre las edades de 15 a 58 años de edad que acudieron a consulta por cualquier afección. De estos, 90 presentaron la enfermedad los que constituyeron la muestra del estudio al aplicárseles los criterio de inclusión y exclusión. Se consideraron variables como edad, sexo, prevalencia, distribución, dientes afectados, caras afectadas, severidad, respuesta según estímulos y factores desencadenantes.
Prevalencia de la hiperestesia dentinaria en La Naya. ASIC Santa Cruz del Este. 2009.
Dr. Alexander González Mateo. Especialista 1er Grado en Estomatología General Integral. Master en Salud Bucal Comunitaria. Master en Atención de Urgencias en Estomatología. Profesor instructor.
Dra. Alicia de los Ángeles Céspedes Ruiz. Master en Salud Bucal Comunitaria. Profesor instructor.
Dr. Franklin Lafargue Gainza. Especialista 1er Grado en Estomatología General Integral. Master en Atención de Urgencias en Estomatología. Profesor instructor
Resumen
Se realizó una investigación descriptiva y transversal para determinar la prevalencia de la hiperestesia dentinaria en adultos del sector La Naya, ASIC Santa Cruz del Este en el período comprendido desde octubre-diciembre del 2009. El universo del estudio estuvo constituido por 560 pacientes de ambos sexos comprendidos entre las edades de 15 a 58 años de edad que acudieron a consulta por cualquier afección. De estos, 90 presentaron la enfermedad los que constituyeron la muestra del estudio al aplicárseles los criterio de inclusión y exclusión. Se consideraron variables como edad, sexo, prevalencia, distribución, dientes afectados, caras afectadas, severidad, respuesta según estímulos y factores desencadenantes.
El examen bucal se realizó en condiciones óptimas en el punto estomatológico. La información fue procesada en el sistema Microsoft Excel a partir de los cuales se obtuvieron tablas estadísticas en las que se aplicaron medidas de resumen como índices y porcentajes. Se concluye con una alta prevalencia, fundamentalmente en premolares por Vestibular, predominando como factor desencadenante la recesión gingival. Se recomienda trabajar en la prevención de los factores de riesgo modificables y realizar estudios de prevalencia de la hiperestesia dentinaria en otras áreas.
Introducción
La hiperestesia dentinaria se define como una respuesta exagerada frente a los estímulos sensitivos, táctiles, térmicos, químicos u osmóticos que afectan a la dentina expuesta con túbulos abiertos y permeables. Se presenta como una sensación dolorosa de intensidad variable, desde leve a moderada, que puede llegar a convertirse en una molestia constante. Cualquier alteración del complejo dentino-pulpar, sino es tratada puede actuar como irritante y desencadenar un proceso inflamatorio pulpar. Es una afección común, por lo que un gran número de pacientes acuden a la consulta aquejados de ella. 1
La experiencia vinculada a motivos de dolor por hipersensibilidad dentinaria y los métodos para aliviarla o impedirla no son fenómenos recientes. Rajes, médico árabe de casi 875 años d.C. reconoció por primera ocasión, el dolor relacionado con la recesión gingival, que se producía casi siempre en personas mayores y escribió “puede ser un trastorno complicado en ciertas personas y simple en otras”, dando a entender que el dolor generado por estas recesiones podía llegar a ser agudo. 2
Tal vez la primera observación científica que pueda vincularse con una mejor comprensión fisiológica de la hipersensibilidad dentinaria fue la descrita por Leeuwen Hoek en 1678, quien afirmó que la dentina contenía túbulos transparentes muy delgados, los cuales en grupos de 600 no excedían el espesor de un cabello de la barba de un hombre. 2
A mediados del siglo XIX, Blandy empezó a hablar sobre lo que se convertiría en un futuro en la teoría hidrodinámica. El sugirió que la dentina consta de túbulos huecos, llenos con un líquido secretado por la pulpa, el cual al recibir una presión aplicada externamente, genera un movimiento de compresión sobre la pulpa nerviosa interna, sometiéndola a una especie de presión hidrostática, cuya magnitud es posible cuantificar.
Además, concluyó que cualquier disminución en el espesor del esmalte, que descubra alguna porción dentinaria, aumenta la sensación dolorosa provocada por esa presión externa. 2
Alfred Gysi en 1900, afirmó que los conductos dentales minúsculos carecen de sustancias nerviosas, pero que en el límite interno de la dentina alrededor de los odontoblastos hay una red abundante de fibras nerviosas más delgadas. Propuso que el movimiento de líquido en los conductos dentales minúsculos en cualquier dirección producía una sensación de dolor en los nervios entremezclados con los odontoblastos. Esto dio cabida a la teoría de la transducción odontoblástica. 2
A mediados del decenio de 1930, Charles Bodecher y Edgard Applebaum, concluyeron que en los dientes jóvenes, en los cuales la mineralización aún no es completa, lo líquidos fluyen con facilidad desde la pulpa. No obstante en dientes de más edad, la formación de dentina secundaria puede sellar los extremos internos de los túbulos dentinarios en la cámara pulpar, haciendo menos permeable esta zona al paso de líquidos en cualquier dirección. 2
En 1930, Louis I. Grossman fue de los primeros en definir la hipersensibilidad dentinaria como una reacción dolorosa o raramente sensible de la dentina expuesta ante una irritación. 2
La hipersensibilidad dentinaria ha sido descrita en el pasado como un enigma ya que es frecuentemente encontrada y aún poco entendida. Hay también una falta de consenso en la literatura con relación a la terminología utilizada para describir la condición.
El diagnóstico clínico se realiza a través del interrogatorio a pacientes y familiares, el dolor es referido. La hipersensibilidad dentinaria se manifiesta cuando hay un estímulo que actúa sobre la o las piezas dentarias, estos estímulos pueden ser físicos, químicos o mecánicos. Cualquier sustancia, ácida, dulce, fría o caliente desencadenará las molestias durante unos segundos e incluso hay casos que aspirando aire por la boca ya les produce una sensación dolorosa. 3
Si tocamos la pieza dentaria con cualquier instrumento, también provocaremos la sensación dolorosa, así por ejemplo los pacientes relatan provocarse la sensibilidad dolorosa con el propio cepillo de dientes o pasando la uña por la parte cervical del diente (cuello dentario). En la clínica buscamos las zonas con hipersensibilidad con una sonda exploradora y muchas veces causa dolor al paciente al tocar dichas zonas. 3
El inconveniente que más frecuentemente se plantea en el blanqueamiento de dientes vitales es la hiperestesia dentinaria, tanto en el tratamiento domiciliario como en el realizado en la consulta dental; de tal forma que, aunque en muy pocas ocasiones, puede llegar a ser motivo de suspensión del tratamiento blanqueador. 3
Otros defectos o condiciones de enfermedad, tales como dientes agrietados y caries dental pueden generar el dolor dental, por lo tanto las decisiones de tratamiento recaen en el diagnóstico diferencial para atribuir correctamente el dolor dental a la hipersensibilidad dentinaria. 4
La hipersensibilidad dentinaria es un problema de salud bucal en la población adulta, la cual aflige típicamente individuos en el rango de edad entre 20 y 49 años, especialmente de 30 a 39 años. 5
Numerosos estudios que han incluido evaluaciones clínicas por examinadores entrenados en estudios con pacientes, han reportado figuras de prevalencia en el rango del 15 al 20%. Sin embargo, se han reportado niveles altos hasta de 75% para individuos en la práctica general y hasta de 98% en pacientes con terapia periodontal.
La hipersensibilidad dentinaria es más comúnmente observada en las regiones vestibulares cervicales de los caninos y premolares, sitios que también son los más susceptibles a la recesión gingival. 5
Cerca del 57% de los pacientes han reportado estar afectados por esta condición que potencialmente altera la calidad de vida. 4
En la medida en que se espera que la incidencia de la hipersensibilidad dentinaria se eleve como resultado de cambios en las dietas, mayor expectativa de vida, y mayor retención de la dentición, surge una necesidad inminente de estrategias de manejo efectivo que proporcionen una acción rápida y representen alternativas realistas y prácticas para la mayoría de personas que sufren esta condición. 4
Uno de cada cuatro pacientes dentales tiene superficies dentales hipersensibles. Se estima que 40 millones de norteamericanos se quejan de hipersensibilidad dental una y otra vez y alrededor de 10 millones sufren hipersensibilidad crónica. 6
El impacto de la hipersensibilidad dentinaria en la salud dental general en un individuo particular, puede correlacionarse al final con el grado de incomodidad experimentado. 7
La hiperestesia dentinaria está asociada con la exposición de la dentina a la cavidad bucal, La sensibilidad dentinaria no está, en principio, relacionada con dolor de origen pulpar resultante de alteraciones patológicas provocada por agentes nocivos. Este aspecto es fundamental para el diagnóstico diferencial entre sensibilidad dentinaria y otras alteraciones patológicas de la pulpa.
Durante la anamnesis del paciente debe ser consideradas: historia del dolor, cronología, naturaleza, localización, irradiación, factores de exacerbación y de reducción del dolor. Deben realizarse pruebas de percusión, palpación, térmicas, eléctricas, examen radiográfico de los diente y de tejidos adyacentes. 8
El cemento es por otro lado, fácilmente removido después de la recesión gingival por fuerzas químicas o físicas como la instrumentación de la superficie radicular durante procedimientos de raspaje y cepillado agresivo, conduciendo a la exposición de la dentina subyacente.
El consumo de comidas y bebidas erosivas como parte de la dieta, comunes hoy en día, también se cree, que contribuyen al proceso de localización de la lesión (exposición de la dentina) por la pérdida del esmalte. 9
Actualmente la teoría hidrodinámica es la más aceptada comúnmente sugiere que la hipersensibilidad dentinaria ocurre cuando un estímulo externo, como el aire frío, induce un cambio en el flujo del fluido dentro de los túbulos dentinales. Esto en cambio, resulta en un cambio de presión a través de la dentina la cual activa la respuesta nerviosa, causando la sensación dolorosa. 10
Desde sus orígenes la humanidad ha luchado contra el dolor en todas sus manifestaciones. Existen entonces diferentes métodos para calmar la odontalgia originada en la dentina: unas empíricas y otras científicas. Pierre Fauchard, en 1728, informó que Hipócrates fue el primero en aconsejar el uso regular de dentífrico con base de carbonato de calcio.
En 1866, Francis propuso usar revestimientos cavitarios para fomentar la producción de dentina secundaria. Así a medida que ha transcurrido la historia diferentes métodos han aparecido para tratar la hiperestesia dentinaria. 10
El tratamiento para esta afección se basa en la aplicación de sustancias desensibilizantes que disminuyan o eliminen el dolor, y productos capaces de estimular la formación de dentina que oblitere los canalículos dentinarios expuestos al medio bucal; la severidad de la hipersensibilidad debe tenerse en cuenta a la hora de escoger el tratamiento a seguir.
Diversos agentes y métodos se han empleado para actuar sobre dolores somáticos como la hiperestesia dentinal, entre ellos el flúor. La incorporación de iones flúor a la estructura del esmalte aumenta su resistencia, reduce la desmineralización, incrementa la remineralización, actúa por reemplazo iónico cambiando la hidroxiapatita por flúor-apatita, una forma más acidorresistente, resultados éstos obtenidos en investigaciones realizadas en Cuba, así como internacionalmente. 11
La incorporación de la terapia láser en esta afección se basa en su efecto analgésico y estimulante del trofismo de la pulpa dental, estimula la circulación pulpar, facilita la rápida formación de dentina secundaria, estimulando los procesos metabólicos que incluyen remineralización de la dentina; estos efectos pueden potenciarse si se combina la técnica láser con flúor. 12-15
Se han utilizado diferentes desensibilizantes como fenoles, sales de estroncio, nitrato de plata, formaldehído, oxalato de potasio, flúor en diferentes formas y concentraciones, Barniz copal, Hidróxido de calcio, propóleos, y se reporta en la literatura la utilización de los cianoacrilatos. 3
En la consulta estomatológica hemos atendido con bastante frecuencia pacientes afectados por hiperestesia dentinaria, y como los estudios de prevalencia de la misma son escasos nos decidimos a realizar esta investigación para responder a la siguiente interrogante ¿cómo, cuando y donde se presenta esta afección con más frecuencia?
Objetivo
Determinar la prevalencia de la hiperestesia dentinaria en la población adulta de 15-58 años del sector La Naya. ASIC Santa Cruz del Este en el período de septiembre- diciembre del 2009.
Hipótesis
Con esta investigación lograremos determinar la prevalencia de la hiperestesia dentinaria en la población adulta del Sector La Naya, ASIC Santa Cruz del Este en el período de septiembre- diciembre del 2009.
Marco Teórico
- Histofisiología del Complejo Dentino-Pulpar
La pulpa dental es un tejido conectivo que está situado en un ambiente único ya que se encuentra encerrada en una cámara rígida de dentina mineralizada. La composición y estructura de la pulpa son bastante diferentes de las de la dentina. Sin embargo, los dos tejidos están en relación íntima embriológica y funcionalmente; por ello son considerados como un complejo funcional indisociable, el complejo pulpo-dentinario.
El complejo pulpo-dentinario es un concepto importante para entender la patobiología de la dentina y de la pulpa. Durante el desarrollo, las células pulpares producen dentina, nervios, y vasos sanguíneos. Aunque la dentina y la pulpa tienen diferentes estructuras y composiciones, una vez formadas reaccionan frente al estímulo como una unidad funcional.
La exposición de la dentina a través de la atrición, el trauma, o la caries produce reacciones pulpares profundas que tienden a reducir la permeabilidad dentinal y a estimular la formación de dentina adicional. Estas reacciones son llevadas a cabo con cambios en los fibroblastos, nervios, vasos sanguíneos, odontoblastos, leucocitos, y el sistema inmune. 16
El Complejo dentinopulpar es una unidad topográfica, pues el tejido pulpar queda formando parte de la dentina a través de la prolongación odontoblástica, por lo cual reaccionan en conjunto, así veremos que un agente agresor que afecte a la dentina tendrá inmediata respuesta pulpar. Los canalículos dentinarios además del contenido celular, presentan fibras de colágeno, fluido dentinario (con función inmunológica, rico en inmunoglobulinas, con alto contenido en sodio y bajo en potasio).
Este fluido es básico para transmitir los estímulos desde la dentina a la pulpa., a los receptores ubicados en el límite dentinopulpar (teoría hidrodinámica de Brannstrom), estimulando las fibras A Delta, dando dolor localizado, brusco y breve.
La Pulpa
Como todo tejido conjuntivo tiene células, fibras y sustancia fundamental, dispuestas en zonas distintas desde el punto de vista histológico y funcional. Se encuentra la zona de odontoblastos que sintetizan, secretan y mineralizan la dentina durante toda la vida. Además funcionan como una capa de protección de la pulpa pues los odontoblastos, se comunican entre sí y con las otras células pulpares, mediante 3 tipos de uniones intercelulares (uniones impermeables, adherentes y comunicantes o gap), debido a la presencia de la fibronectina (que es una proteína mediadora de la adhesión celular).
Esto explica porqué el daño al odontoblasto afecta a otras células, pudiendo dar hasta una reacción pulpar. Se produce la formación de la dentina esclerótica, frente al avance de la caries y cuando éste es mayor, se forma dentina terciaria (elaborada a partir de células pulpares profundas).
Por debajo está la zona oligocelular con abundante irrigación: plexo capilar subodontoblástico e inervación.: Plexo nervioso de Raschkow. Subyacente se encuentra la zona rica en células con elevada proporción de fibroblastos, macrófagos y linfocitos. Además aquí están las células indiferenciadas o de reserva cerca de los vasos en estado de reposo en las P normales, que pueden convertirse en macrófagos, fibroblastos e incluso en odontoblastos. Se han descripto otras células de defensa: células dendríticas que conjuntamente con los macrófagos, participan en la inmunovigilancia.
La Pulpa está equipada por células de Inmunidad Inespecífica (macrófagos y células dendríticas) y por células de Inmunidad Específica: los linfocitos T y B.
Luego está la zona central o Pulpa propiamente dicha formada por sustancia fundamental, células y fibras sin estratificarse, con vasos, nervios y rica en fibroblastos.
Desde el punto de vista funcional forma sustancia fundamental y fibras. Dicha sustancia fundamental altamente polimerizada, con proteoglucanos (ácido hialurónico, dermatán sulfato y condroitinsulfato), glucoproteínas (fibronectina) y agua no libre sino en un sistema hidrocoloidal, regulando el transporte metabólico, influyendo así en la vitalidad pulpar. Por su bajo grado de permeabilidad, confinando localmente el aumento de la presión intrapulpar. Lo cual explica el avance circunferencial de la inflamación pulpar. Existe además un transporte de fluidos desde el área afectada hacia fuera del diente por los vasos linfáticos y por reabsorción de los vasos sanguíneos del tejido adyacente, que ayuda a confinar el avance de la inflamación conjuntamente con la alta polimerización de la sustancia fundamental
Funciones de la Pulpa
Como todo tejido conjuntivo cumple 4 funciones:
Formativa:
El órgano pulpar en su función de formar dentina es el único en la economía encerrado en un espacio que él mismo reduce con el tiempo, lo cual hace de él un órgano especial que no responde de igual manera que otro tejido conjuntivo, pues está limitado en su capacidad de aumentar de volumen, durante los episodios de vasodilatación.
Función nutritiva:
Mantiene la vitalidad pulpar, aportando oxígeno y nutrientes para el metabolismo de los odontoblastos y demás elementos celulares por el transporte transcapilar. Se describe una microcirculación pulpar terminal, dada por arteriolas meta-arteriolas, anastomosis arterio-venosas, capilares y vénulas, acompañados de nervios mielínicos y amielínicos. Las anastomosis arterio-venosas son importantes en la regulación de la microcirculación, permitiendo la recuperación de la inflamación local leve, porque al abrirse, desvían la sangre de la zona lesionada, disminuyendo así la presión tisular, restaurándose el flujo sanguíneo. Se han descripto vasos linfáticos, los cuales después de salir de la pulpa se unen a los del ligamento periodontal y drenan a los ganglios linfáticos regionales (submentonianos, submaxilares y cervicales) Las últimas investigaciones afirman que la circulación de la Pulpa es el parámetro más exacto para evaluar la vitalidad pulpar. Se estudia por flujometría Doppler Laser.
Función sensitiva:
Por su rica inervación, la pulpa cumple con 2 funciones: de control vasomotor (dada por el sistema simpático) y de defensa dado por el papel protector del dolor (fibras nerviosas mielínicas A delta y amielínicas tipo C). Las fibras A delta tienen un campo receptivo localizado en la interface dentinopulpar, y en dentina profunda. Estas son activadas por el mecanismo hidrodinámico, causando un dolor agudo, corto y bien localizado. Son responsables de la sensibilidad dentinaria, tienen bajo umbral de estimulación, rápida conducción y responden al pulpómetro.
Las fibras C amielínicas (87% en los premolares) tienen un campo receptor localizado en toda la Pulpa. Son activadas por mediadores inflamatorios, por lesiones nocivas al tejido pulpar y por aplicación prolongada de calor. Son de lenta conducción y de alto umbral de excitación. Son responsables del dolor espontáneo, intenso, constante, insoportable, difícil de localizar, asociado a mayor grado de lesión tisular.
Además, el factor nervioso nos ha introducido en el concepto de inflamación neurogénica, como respuesta potencial de protección del complejo dentinopulpar. Los estudios de Olgart, Fazekas, Alquist, muestran que la activación de los nervios sensitivos por lesión tisular, activación del complemento y por reacciones Ag – Ac, provocan la liberación de neuropéptidos vasoactivos de las terminaciones nerviosas como la sustancia pulpar, neuroquinina A y CGRP. Estos neuropéptidos dan vasodilatación, aumento de la permeabilidad capilar, y aumento de la presión intrapulpar; estos cambios vasculares representan un reflejo defensivo.
Función defensiva:
El complejo dentinopulpar puede defenderse de diferentes agentes agresivos. Los odontoblastos ponen en marcha mecanismos defensivos como el dolor dentinario, la esclerosis dentinaria, y la dentina reparativa, dirigidos a disminuir la permeabilidad dentinaria, pues la dentina se vuelve permeable cuando pierde el esmalte y el cemento. Mientras que en la pulpa se desencadena una respuesta defensiva inmunitaria, caracterizada por linfocitos, plasmocitos y macrófagos más vasodilatación, es decir un infiltrado crónico constituido por células inmunocompetentes, en respuesta a las toxinas bacterianas que actúan a distancia a través de la dentina, a sustancias antigénicas, a distintas macromoléculas que difunden desde la dentina infectada y afectada, provocando daño a las células pulpares. Estas sustancias son removidas por las células fagocitarias. Los macrófagos por sí solos son capaces de frenar la agresión bacteriana cuando es leve, conjuntamente con la microcirculación, venas y linfáticos. Si eliminamos el agresor tempranamente por ejemplo Caries, esta reacción inicial defensiva desaparece, es reversible. Todo esto pasa desapercibido desde el punto de vista clínico por el paciente, Se debe a la acción de los linfocitos T supresores, recuperándose así la normalidad funcional de la pulpa. Además, rodeando esta respuesta defensiva, existe proliferación de pequeños vasos sanguíneos y de fibroblastos, así como deposición de fibras colágenas. Este modelo de respuesta se considera un proceso inflamatorio reparativo, por ello es reversible. 17
La dentina
Es un tejido conectivo mineralizado, que forma el eje estructural del diente, proveyéndolo de la forma y rigidez necesaria para funcionar efectivamente durante la masticación por ende es una parte primordial del mismo. Facilita con su grado de elasticidad que el esmalte quede protegido de los distintos impactos masticatorios. Además, la estructura tubular de la dentina provee conductos para el paso de solutos y solventes a través de la misma. Sin embargo, pese a su importancia son pocos los estudios que versen sobre la nanoestructura de los cristales de la dentina humana; la mayoría de los estudios al respecto se han realizado en dientes de animales y por lo mismo son pocos los conocimientos que se tienen sobre los cristales de hidroxiapatita de la dentina humana. Alrededor de 1926, usando difracción de rayos X y análisis químicos, la fase mineral del esmalte, dentina y hueso fue identificada como un fosfato de calcio con una estructura de apatita.
Sin embargo, la noestoiquiometría y la asociación de numerosos elementos traza y menores con las apatitas biológicas causa investigaciones científicas continuadas y varios puntos de vista. Después de décadas de esfuerzos, la composición y estructura de estos minerales biológicos permanece pobremente caracterizada a nivel molecular. La principal dificultad es que el desorden estructural significante es comúnmente encontrado en tejidos duros biológicos y por consiguiente la utilidad de las técnicas de difracción es muy limitada. El equipo de Pasteris sugiere que hay una imposición bioquímica del estado específico de cristalinidad e hidroxilación, incorporando (CO3)2- y limitando el grupo (OH-). También estudiaron hueso (carece de grupo hidroxilo) y esmalte (hidroxilado), concluyendo que el (OH-) en la apatita afecta la interfase mineral-colágena en hueso, y que el contraste entre los tejidos refleja las diferentes necesidades para solubilidad entre las fases biológicas de apatitas; el bajo contenido de OH- en hueso puede permitir su disolución, en tanto que el alto contenido de OH en esmalte incrementa su capacidad buffering.
De lo anterior concluimos que la concentración de fósforo disminuye en tejidos más mineralizados, en tanto que la concentración de Calcio aumenta., también se observaron las bandas de amida I y III, las cuales son representativas de la conformación de la colágena. La dentina está compuesta por cristales nanométricos de hidroxiapatita en una matriz colágena. Las fibras de colágena tienen entre 50 y 100 nm de diámetro y están orientadas perpendicularmente a la dirección de la formación de la dentina. El arreglo de los nanogramos de la dentina es diferente en la predentina y en zonas intermedias. 18
Relación funcional entre la pulpa y la dentina
• La pulpa es capaz de crear dentina fisiológicamente y en respuesta a un estímulo externo.
• La pulpa contiene nervios que aportan la sensibilidad dentinaria.
• El tejido conectivo pulpar es capaz de responder a lesiones dentinarias, sin ser estimulado directamente.
• La encapsulación de la pulpa dentro de la dentina crea un ambiente que influencia negativamente su potencial de defensa. 16
Reacción nerviosa
No existe una prueba contundente de que la actividad provocada por el estímulo dental y registrada por los electrodos en la dentina o las ramas nerviosas dentales provenga de una fuente intradentaria. Excepto tal vez por la serotonina, muchas sustancias vasoactivas involucradas en el dolor, como la sustancia P, el péptido relacionado con genes (CGRP) y la neurocininas A y B (NKA, NKB), brandicina e histamina, a menudo están relacionadas estrechamente con los vasos sanguíneos, los cuales no parecen tener un efecto directo en las fibras pulpares A-delta aferentes, aunque pudieran activar fibras pulpares C aferentes. Los polipéptidos vasoactivos se pueden liberar en la pulpa durante la inflamación, por destrucción del tejido (exposición pulpar, temperaturas elevadas de corte, reacciones antígeno-anticuerpo con activación del complemento) o por activación antidrómica del nervio dentario inferior.
Algunas veces la estimulación de nervios simpáticos y los cambios en el riego sanguíneo alteran la actividad pulpar aferente, por lo que estas sustancias modifican el riego sanguíneo, de tal manera que intervienen en los mecanismos periféricos que fundamentan el dolor dentario agudo. Todos los péptidos favorecen la vasodilatación y la extravasación del plasma, pero no todos se localizan en fibras y en neuronas; estos péptidos tienen una repercusión clínica que contribuye al fenómeno denominado inflamación neurógena.
En el sistema nociceptor de Lewis se presenta la utilidad de la inflamación neurógena, que consiste en el mecanismo defensivo neurógeno periférico mediante el cual se elimina materia tóxica (endógeno o exógeno por incremento local del riego sanguíneo hístico) y se lleva a cabo la producción de líquidos intersticial y el drenaje linfático. No obstante, la inflamación excesiva puede tener efectos destructores en vez de acción de apoyo, como sucede en otras partes del cuerpo humano. Se debe recordar que la pulpa dental posee más neuronas amielínicas que mielinizadas. Los vasos dilatados pueden disminuir el riego sanguíneo o pulpar luego de un incremento pasajero en el riego citado.
La pulpa dental se encuentra en un ambiente de adaptabilidad baja; cualquier incremento en su volumen, por dilatación vascular o filtración de líquidos a través de los capilares después de la dilatación, podría aumentar la presión hística, que comprimiría las vénulas locales, incrementando la resistencia postcapilar y disminuyendo el riego sanguíneo. La disminución en el riego sanguíneo pudiera reducir el aclaramiento de productos tóxicos o bacterianos nocivos y permitir acumulación en un ciclo de retroalimentación positiva hasta valores que activan la reacción inflamatoria. La inflamación neurógena puede, bajo algunas circunstancias, fomentar y sostener la sensibilidad dental en vez de permitir su resolución.
Cuando se estimulan los nociceptores, se liberan neurotransmisores como la sustancia P, el péptido relacionado con genes (CGRP) y la neurocinina (A) de manera central.
Es importante considerar la particularidad de la dentina en cuanto a la permeabilidad; si esta estructura dental fuese permeable, sería poco probable que presentara sensibilidad importante. La dentina no es permeable por dos motivos: primero, la dentina reparativa tiene, por lo general, menos cantidad de nervios para la dentina; segundo, la dentina presenta menor cantidad de túbulos que la primera. Las sustancias penetran a través de la dentina por dos mecanismos, la difusión, gracias a la cual se transportan sustancias de una zona de concentración elevada a otra de concentración baja, y el transporte colectivo o filtración. El movimiento de líquido masivo ocurre de una zona con presión hidrostática alta a otra de presión hidrostática baja.
La conductancia hidráulica es el inverso de la resistencia, es decir, la dentina con conductancia alta presenta resistencia baja. Lo que regula la conductancia hidráulica dentinaria es la longitud tubular, la cantidad de túbulos por unidad de área, la presión aplicada, la viscosidad del líquido y el radio de los túbulos elevados a la cuarta potencia. Obviamente, si la dentina fuera tubular, la conductancia hidráulica sería cero y la dentina no permitiría migraciones de líquido y, por lo tanto, serían insensibles. La dentina gruesa presenta conductancia hidráulica menor que la delgada. 19
Diferentes Conceptos y Terminologías de la Hiperestesia Dentinaria.
Los términos hipersensibilidad dentinaria e hipersensibilidad dental han sido cuestionados ya que la dentina por sí misma no es sensible; los estímulos, cuando son aplicados a la dentina, evocan una respuesta de la pulpa. Los términos sensibilidad dentinal cervical y sensibilidad dental cervical han sido también utilizados como descriptores basados en la localización para diferenciarlos de otros tipos de dolor dental. 20
Una definición de hipersensibilidad dentinaria fue primero sugerida en 1983 y acordada en un taller internacional para el diseño y conducción de estudios clínicos para el tratamiento de esta condición. La definición establece que “la hipersensibilidad dentinaria es caracterizada por un dolor corto, agudo que proviene de la dentina expuesta en respuesta a los estímulos típicamente térmicos, de evaporación, táctiles, osmóticos y químicos, la cual no puede ser adscrita a ninguna otra forma de defecto dental o patología”.
El término “patología” fue entonces reemplazado por “enfermedad” por el Comité Asesor Canadiense en Hipersensibilidad Dentinaria en 2002. La definición proporciona una descripción de la condición e identifica la hipersensibilidad dentinaria como una entidad clínica distinta la cual capacita al clínico para hacer un diagnóstico diferencial de la condición. 20
Otros autores como Curro y Dababaneh, la definen como una respuesta exagerada de dolor a un estímulo que en condiciones normales es inocuo.
Se describe como dolor, una experiencia sensorial molesta que puede variar por el componente emocional individual del paciente. Es por esto que el dolor es una condición muy difícil de ser cuantificado o medido.
Según los términos de dolor descritos por Merskey para la International Association for the Study of Pain (IASP), la hipersensibilidad dental se ubica bajo el término de alodinia. La alodinia es un estado crónico con exacerbaciones agudas. La cronicidad en el caso dental, concluye cuando se restaura el defecto del esmalte o el cemento. Curro y col, sugieren que el término adecuado para la hipersensibilidad dentinal debería ser “alodoncia¨, el cual une los términos de alodinia con el de hipersensibilidad dentinal 2.
Otros autores como Berman definieron a la hipersensibilidad dentinal con el nombre de dentinalgia para poderlo distinguir de la pulpalgia o pulpitis. En la dentinalgia el dolor cede al remover el estímulo, mientras que en la pulpitis el dolor se mantiene y requiere de tratamiento endodóntico. 2
También la definen como «una condición en la que la exposición a estímulos térmicos, táctiles y/o químicos, de la dentina de un diente afectado, da inicio a síntomas que van desde un fugaz y leve dolor, hasta un dolor prolongado y severo». 21
También se sugirió el término sensibilidad radicular; el cual fue adoptado en el taller de la Federación Europea de Periodontología en el año 2002, para describir la hipersensibilidad asociada con la enfermedad periodontal y su tratamiento. 22
Clasificación
La sensibilidad dentinaria la podríamos clasificar en:
• Hiperestesia Dentinaria Primaria o Esencial
Intervendrían factores anatómicos, predisponentes, somáticos o psíquicos desconocidos que influyen en el dolor dentinario.
Podríamos afirmar aquí que en éste tipo de dolor no ha habido maniobras terapéuticas de ningún tipo ni de periodoncia ni de operatoria dental principalmente.
Estudios señalan a la hipersensibilidad dental como causa de dolor que afectan a las personas de la tercera década de la vida y va aumentando en frecuencia debido a la enfermedad periodontal.
La hiperestesia dentinaria es la tendencia de los dientes a reaccionar ante estímulos. El dolor procede de la dentina expuesta como respuesta típica a estímulos químicos, térmicos, táctiles u osmóticos que no pueden explicarse como procedentes de ningún tipo de patología o defecto dental.
En diversos estudios sobre tratamiento de la hiperestesia dentinaria se incluyen pacientes que no tengan: caries, lesión periodontal activa o restauración; no estar sometido a trauma de la oclusión ni servir de apoyo de ningún tipo de prótesis, el o los dientes experimentales por tanto queda patente que la causa de la hiperestesia es desconocida o no hay causa aparente.
Estos criterios de inclusión están justificados en base a tratar la hiperestesia estrictamente primaria.
La hiperestesia dentinaria primaria o esencial, es una entidad en si misma y se trata de una entidad clínica propia que se manifiesta como una hipersensibilidad dolorosa de la superficie radicular expuesta sin lesión patológica de los tejidos duros dentarios, por lo tanto se localiza en los cuellos de los dientes (próximo a la encía), y en la zona de la raíz, requiriéndose en este tipo de hipersensibilidad dos factores, uno que el esmalte y el cemento dejen al aire la dentina o material dentario que está dentro del propio diente y la otra causa es la recesión gingival, es decir el diente en su parte próxima a la encía, está al descubierto y los pacientes refieren dolor al tomar alimentos fríos o calientes.
• Hiperestesia Dentaria o Secundaria
Aunque los síntomas serán los mismos, las causas son diversas y múltiples. En general, se considera que en el diente o dientes que manifiestan dolor ha habido intervención por parte de un operador o bien es debida a patología dentaria.
Se considera secundaria cuando existe un trastorno, patología o intervención dentaria previa, conocida o no que conduce a hipersensibilidad dentaria, aquí ya son causas de manipulación sobre los dientes como pueden ser: tallado de piezas para colocar coronas o puentes, raspado para tratar lesiones de periodontitis, cepillado incorrecto, lesiones por bruxismo nocturno (rechinar los dientes al frotarlos unos contra otros), erosiones químicas por ácidos (pacientes que gustan de tomar ácidos como limón puro, directamente sobre los dientes), pacientes a los que se les ha realizado empastes por caries que tenían en sus piezas, en todos estos casos la dentina está en contacto con los agentes físicos o químicos y se transmiten a la pulpa dentaria provocando el dolor dentario.
Diremos pues que, bien sea una hiperestesia dentaria primaria o, una hipersensibilidad dentinaria secundaria motivada por alguna de las causas que hemos descrito, el síntoma fundamental es el dolor y, es un dolor que tiene la duración del estímulo, es decir, si se retira el estímulo desaparece el dolor, estos estímulos son normalmente cambios térmicos (frío-calor), bien seco o en forma de líquido, así mismo pueden ser causa de dolor los ácidos, los dulces y alimentos salados, así como el cepillado dental, sobre todo si es inadecuado. 23
- Hipótesis que académicamente explican la patogenia de la sensibilidad dentinal
1. Teoría del mecanismo transductor:
Existen nervios y terminaciones nerviosas a lo largo de los odontoblastos de los túbulos dentinales, en predentina y dentina. Es por ello, que el dolor puede ser transmitido desde la unión amelocementaria hasta las terminaciones nerviosas cerca de la pulpa dental, a través de la membrana plasmática del proceso odontoblástico o por el movimiento del líquido que rodea el mismo.
2. Teoría de la modulación:
Bajo un estímulo irritante sobre la dentina, los odontoblastos se lesionan con la posterior liberación de una variedad de agentes neurotransmisores como las proteínas vasoactivas y aminas productoras de dolor.
3. Teoría de control de entrada y vibraciones:
Cuando se irrita la dentina, todos los nervios pulpares se activan por vibraciones. Las fibras mielínicas voluminosas pueden resistir y acomodarse a las sensaciones, por el contrario, las fibras más pequeñas no lo hacen y transmiten el dolor.
4. Teoría hidrodinámica:
Cuando se aplica un estímulo externo a la dentina se origina un movimiento del líquido tubular dentinal, el cual va a estimular los procesos nerviosos en la zona pulpar de la dentina transmitiendo el impulso doloroso. El calor produce expansión y desplazamiento del líquido al interior del túbulo dentinal, por el contrario, el frío y el tacto actúan de forma inversa para producir el dolor. 24
- Factores Desencadenantes
La hipersensibilidad dentinaria puede ocurrir por diversas causas, entre ellas están la abrasión, 25 erosión, 26 atrición, la colocación de restauraciones con técnicas adhesivas, el blanqueamiento, la recesión gingival 27 y el tratamiento periodontal. 28
Recesión Gingival
La recesión del tejido marginal gingival es definida como el desplazamiento del margen gingival apical a la unión cemento-esmalte con la exposición de la superficie radicular al ambiente oral. Otros autores la definen como la migración apical del margen gingival a lo largo de la superficie radicular. Carranza afirma que la recesión consiste en la exposición de la superficie radicular por una desviación apical en la posición de la encía. Para comprender cuál es su significado, es preciso diferenciar entre las posturas real y aparente de la encía. La posición real corresponde al nivel de la inserción epitelial en el diente, mientras que la aparente es la altura de la cresta del margen gingival, así la posición real de la encía, no su ubicación aparente, determina la gravedad de la recesión. La encía que presenta recesión se encuentra a menudo inflamada, pero puede ser normal excepto por su posición. La recesión se localiza en ocasiones en un diente en una sola superficie, en un grupo de dientes o puede generalizarse a través de la boca.
• Epidemiología y Etiología de la Recesión Gingival
La recesión gingival aumenta con la edad. Su incidencia varía desde 8% en los niños hasta 100% luego de los 50 años de edad. Informes recientes indican que hay una prevalencia substancial en el aumento de las recesiones en la población mundial, incrementándose significativamente después de la quinta década. Esto motiva a que ciertos investigadores supongan que la recesión es un proceso fisiológico vinculado con el envejecimiento. Sin embargo, aún no se presentan pruebas convincentes sobre un cambio fisiológico de la inserción gingival. La migración apical gradual es, con mucha probabilidad, el resultado del efecto acumulativo de una afección patológica menor, los traumatismos menores directos y repetidos a la encía, o ambos. En poblaciones que presentan buenas medidas de higiene oral las recesiones marginales son más frecuentes en las superficies bucales y parece ser más común en dientes unirradiculares que en molares. En contraste las recesiones se encuentran cerca de todas las superficies dentarias en los pacientes comprometidos periodontalmente. Al mismo tiempo, se ha enfocado la atención en los aspectos etiológicos, implicando muchos factores en la recesión gingival. Al menos tres tipos de recesiones gingivales pueden considerarse: recesiones asociadas a factores mecánicos, predominantemente técnicas de cepillado inadecuadas, frenillos traccionantes y factores iatrogénicos, recesiones asociadas a lesiones inflamatorias inducidas por placa bacteriana, en casos de dehiscencias asociadas a periodonto delgado y en casos de dientes en mal posición, y recesiones asociadas a formas generalizadas de enfermedad periodontal destructiva.
Su etiología está determinada por una serie de factores predisponentes y desencadenantes. Los factores predisponentes pueden ser anatómicos y asociados a trauma oclusal. Los anatómicos incluyen escasa encía adherida, mal posición dentaria y apiñamiento, prominencia radicular, dehiscencias óseas e inserción alta de frenillos que causan la tracción del margen gingival. Los asociados a trauma oclusal abarcan anatomía del tejido óseo alveolar circundante a la raíz del diente e intensidad y duración del trauma.
Los factores desencadenantes abarcan inflamación, cepillado traumático, laceración gingival, iatrogenia, márgenes subgingivales, diseño inadecuado de aparatología removible y movimientos ortodónticos no controlados. Si bien el cepillado de los dientes es importante para la salud de la encía, realizarlo defectuosamente puede causar recesión gingival, con tendencia a ser más frecuente y grave en los pacientes con encía comparativamente sana, poca placa bacteriana e higiene bucal adecuada. La posición de los dientes en el arco, la angulación entre la raíz y el hueso y la curvatura mesiodistal de la superficie dental, también afectan la tendencia a la recesión. Varios aspectos de la recesión gingival la hacen relevante en términos clínicos. Las superficies radiculares expuestas son susceptibles a la caries. El desgaste del cemento exhibido por la recesión deja una superficie dentinaria subyacente muy sensible, en especial al tacto. La hiperemia pulpar y los síntomas concomitantes pueden aparecer también por la exposición de la superficie radicular. La recesión interproximal crea espacios donde la placa, los alimentos y las bacterias pueden acumularse. Con base en observaciones clínicas sin ningún soporte metodológico, se consideraba que la encía queratinizada era necesaria para conservar la salud gingival, prevenir la recesión marginal gingival y mantener los niveles de inserción, ha sido cuestionada la necesidad para incrementar la cantidad de encía queratinizada, ya que se ha demostrado que mínimas cantidades son modicompatibles con condiciones periodontales saludables, siempre y cuando exista un adecuado control de placa bacteriana. Este hallazgo fue corroborado histológicamente por Wennstrom, al demostrar que las zonas desprovistas de encía queratinizada respondían en igual forma a la agresión de la placa bacteriana que aquellas provistas con adecuadas bandas queratinizadas. Con esto se desvirtúo el argumento de la necesidad de la encía queratinizada para el mantenimiento de la salud gingival. Wennstron aclaró, cómo dientes desprovistos de encía queratinizada en presencia de buena higiene oral, mantenían los niveles de inserción clínica sin presentar signos de retracción gingival durante largos períodos de tiempo, cuando se comparaban con dientes control con encía queratinizada
• Clasificación
Para agrupar las recesiones gingivales existen dos clasificaciones reportadas en la literatura, la de Sullivan y Atkins y la de Miller. Sullivan y Atkins clasificaron la recesión gingival en cuatro categorías morfológicas: superficial estrecho, superficial-amplio, profundo-estrecho y profundo-amplio. Por otra parte, Miller en 1985 determinó la siguiente categorización de las recesiones gingivales: Clase I, recesión de tejido marginal que no se extiende hasta la unión mucogingival, no hay pérdida de hueso ni de tejido blando en el área interdentaria. Clase II, consiste en una recesión de tejido marginal que se extiende apical a la línea mucogingival; no hay pérdida de tejido interproximal. Clase III, existe una retracción de tejido marginal gingival que se extiende apical a la unión mucogingival, en dientes con pérdida de altura del periodonto proximal. Clase IV, es una recesión de tejido marginal que se extiende apical a la línea mucogingival con pérdida ósea grave y de tejido blando a nivel interdental. 29
Alteraciones del esmalte: atrición, erosión y abrasión dental
En los últimos años se ha registrado un aumento considerable de alteraciones que cursan con perdida de la estructura dental debido a procesos no cariogénicos. Esta patología ya se había observado en restos arqueológicos pertenecientes a épocas anteriores a la aparición de la caries dental, y se manifiesta como desgates dentales.
Atrición:
El término proviene del latín atterere, atrivi, attritum, que significa frotar contra algo. Se define como el desgaste fisiológico del diente debido al contacto de las superficies dentales durante la masticación y puede afectar tanto las superficies oclusales e incisales como las interproximales.
Tradicionalmente el grado de atrición se ha relacionado con la edad del individuo. La intensidad en este tipo de desgaste se asocia a hábitos parafuncionales como el bruxismo, que se considera la principal causa de atrición en los seres humanos.
Se manifiesta mediante la aparición de facetas de desgaste es decir superficies dentales lisas perfectamente pulidas que coinciden con el diente antagonista. Se localiza principalmente en los bordes incisales y las cúspides de los molarse. En atriciones severas se expone el tejido dentinario que al ser más blando y menos mineralizado que el esmalte, incrementa el índice de desgaste. La atrición como fenómeno fisiológico no requiere tratamiento. Cuando el individuo presenta una pérdida considerable de estructura dental a causa de un habito bruxista, está indicada una placa de descarga.
Erosión dental
Es la perdida de tejido duro dental debido a agentes químicos, con exclusión de los ácidos provenientes del metabolismo bacteriano
Factores etiológicos extrínsecos que se asocian a la erosión dental:
• Ocupacional o medio ambiental
• Dieta
• Fármacos
• Estilo de vida
Factores intrínsecos:
• Alteraciones gastrointestinales (úlcera péptica, gastritis crónica, hernia de hiato)
• Alteraciones del Sistema nervioso central con una presión intracraneal elevada (encefalitis, neoplasma)
• Alteraciones neurológicas (migrañas, enfermedad de Meniere)Alteraciones metabólicas o endocrinas (cetoacidosis diabética)
• Efectos colaterales de algunos fármacos (agentes quimioterápicos, estrógenos, bloqueadores beta.)
• Alcoholismo crónico
• Embarazo
• Anorexia, bulimia y otros trastornos de la alimentación
En los últimos años la ingesta de frutas y bebidas dietéticas, se ha incrementado de manera desmesurada debido a la obsesión por una forma de vida más saludable y por los cánones de belleza actuales. Por este motivo el estilo de vida y los hábitos dietéticos, como el tipo de alimentación, así como la frecuencia con la que se consumen ciertos alimentos, son factores muy importantes en la etiología de la erosión dental. Hay estudios que relacionan la erosión dental con determinados fármacos con un pH bajo. Otro ejemplo son los broncodilatadores que contienen esteroides. También los comprimidos efervescentes pueden contribuir a la erosión dental cuando se toman de manera excesiva se realiza un uso anormal como el acido acetil salicílico (aspirina), la vitamina C o los suplementos de hierro. Asimismo pueden acusar erosión los ácidos utilizados para disolver cálculos renales o los suplementos de acido clorhídrico en pacientes que padecen aclorhidria.
Entre los factores intrínsecos se encuentran aquellas alteraciones que cursan con reflujo gástrico persistente y regurgitaciones, como la hernia de hiato, o con vómitos crónicos, en el caso del alcoholismo crónico u otras patologías del sistema nervioso central. También se relacionan con la erosión dental las alteraciones metabólicas o endocrinas, como el hipertiroidismo, o trastornos de la alimentación, como son la anorexia nerviosa o la bulimia, en los que son frecuentes los vómitos autoinducidos.
Existen pocos estudios sobre la prevalencia de la erosión dental en la población. Su etiología multifactorial y los diversos índices de desgaste utilizados en los estudios hacen difícil poder comparar resultados. Dugmore y Rock establecen una prevalencia del 59. 7% en una población de 12 años en la que un 2. 7% presenta exposición dentinaria. Otros estudios epidemiológicos determina la prevalencia en niños entre el 2 y el 57%.
Clínicamente la erosión dental se identifica por la presencia de superficies cóncavas y redondeadas. La superficie dental suele quedar lisa y mate. Las restauraciones permanecen intactas, por lo que se ve el tejido subyacente desgastado. El patrón de desgaste en la erosión a causa de la dieta depende del hábito; si existe un consumo excesivo de cítricos, la perdida de tejido dental afecta principalmente a las caras incisales y vestibulares de los incisivos superiores. Si se debe a reflujos gástricos, e desgate aparece en las superficies palatinas de los dientes anterosuperiores. En erosiones producidas por causa ocupacional las superficies afectadas son las expuestas al medio, es decir las superficies vestibulares de los dientes superiores
Los casos más graves de erosión dental se asocian a la regurgitación del jugo gástrico, cuyo pH es aproximadamente de 1 a 2, mientras que la mayoría de los ácidos de la dieta alcanzan un pH de 3, por lo que se manifiestan clínicamente menos lesivas.
Abrasión
El término abrasión deriva del latín abredere, abrasi, abrasum, que significa raspar, y hace referencia a la pérdida de sustancia o estructura por proceso mecánicos. La abrasión dental se define como el desgaste patológico resultado de un proceso anormal, habito o sustancias abrasivas ajenas al aparato estomatognático.
Existen curiosos ejemplos de tribus africanas con costumbres que provocan un desgaste dental limando los dientes de forma artificial. También las civilizaciones mayas o incas limaban o perforaban sus dientes utilizando carborundo como método abrasivo. Sin embargo la abrasión dental se debe principalmente a causas ocupacionales o a un hábito higiénico inadecuado. Los individuos que trabajan en ambientes que contienen algún tipo de polvo abrasivo, por ejemplo en minas de carbón o en la construcción, presentan más desgastes en las superficies dentales expuestas. Otros profesionales como los carpinteros, sastres y músicos también pueden presentar algún tipo de abrasión dental debido a su ocupación. Por otra parte el uso de un cepillo inapropiado con cerdas muy duras, un cepillado horizontal demasiado vigoroso o el empleo de un dentífrico muy abrasivo pueden causar también importantes abrasiones en los dientes. Las lesiones se localizan sobre todo en el margen gingival, en la unión del esmalte y el cemento. Este desgaste se acentúa cuando el individuo presenta recesión gingival y se expone el tejido dentinario, lo cual puede producir hipersensibilidad dentinaria. 30
Tratamiento periodontal
Se ha observado que la terapia periodontal es uno de los tratamientos que ocasionan mayor hipersensibilidad dentinaria (84%) comparado con las otras disciplinas odontológicas. Es por ello, que especialmente el raspado y alisado radicular se ha considerado como un factor importante en la etiología de la hipersensibilidad dentinaria.
El raspado y alisado radicular es un procedimiento indispensable para el tratamiento de la enfermedad periodontal. Sin embargo, no sólo son eliminadas las bacterias y el cálculo de la superficie radicular, sino también el cemento y partes de la dentina. Esta técnica descubre los túbulos dentinarios y al estar los túbulos expuestos al medio bucal, la dentina se ve afectada por una gran variedad de estímulos tales como: bacterias, químicos y estímulos mecánicos.
Muy pocos estudios se han realizado para evaluar la Hipersensibilidad Dentinaria posterior al raspado y alisado radicular. Sobral y col en un estudio realizado en Sao Paulo demostraron que de 32 pacientes que manifestaron Hipersensibilidad Dentinaria, el 41% había recibido tratamiento periodontal y de éstos, un 29% se le había realizado cirugía periodontal. Hasting reportó que la Hipersensibilidad Dentinaria posterior a la cirugía periodontal puede durar hasta meses o indefinidamente. 31
Cuando la dentina es expuesta y sus túbulos están abiertos, se incrementa la permeabilidad de la misma, y por ende el paciente siente hipersensibilidad.
En el caso de realizar cirugía periodontal además del raspado y alisado radicular, el ácido para acondicionar la superficie puede ser usado en forma inadecuada y si por otra parte, la zona tratada no queda bien protegida por el colgajo, ésta puede quedar expuesta a la agresión bacteriana. Adicionalmente se ha comprobado que el raspado de la superficie dental no sólo deja una capa de frotis, sino que las bacterias pueden ser "forzadas" a entrar en los túbulos por la acción del instrumento a medida que se mueve en la superficie del diente.
También se ha reportado, la aparición de hipersensibilidad dentinaria en la fase de mantenimiento periodontal.
Estudios sugieren que la presencia de placa dental promueve el aumento del diámetro de los túbulos dentinarios, a su vez el flujo de fluidos se ve estimulado y se produce la hipersensibilidad dentinaria. 22
Los dientes con compromiso periodontal tienen un mayor porcentaje de bacterias viables dentro de los túbulos dentinarios, lo que puede causar una respuesta inflamatoria dentro de la pulpa que a su vez se manifiesta como hipersensibilidad dentinaria. 32
De igual forma, la hipersensibilidad dentinaria se ha asociado al control inadecuado de la placa, porque al tener los túbulos dentinarios expuestos, y no remover completamente la placa, las bacterias penetran a través de estos túmulos, descalcifican la dentina y hacen que el diámetro de los túmulos sea mayor. 32
Cepillado dental traumático
El uso de un cepillo inapropiado con cerdas muy duras, un cepillado horizontal demasiado vigoroso puede provocar la pérdida de tejido dentario (esmalte). Al exponerse tejido dentinario al medio bucal, se puede producir hipersensibilidad dentinaria. Factores anatómicos: La unión amelocementaria, en la mayoría de los casos, es una unión estrecha, pudiendo presentarse cemento o viceversa. Existe también una relación entre ambos tejidos en que tanto cemento como esmalte se afrontan sin solución de continuidad. Pero existe un porcentaje de casos en que existe una terminación independiente del cemento y el esmalte, produciéndose un espacio entre ambos tejidos, que constituye dentina expuesta.
Cuando existe dentina expuesta al medio bucal, no necesariamente debemos encontrarnos con un cuadro de hipersensibilidad dentinaria. En piezas dentarias que han estado con su dentina expuesta por largo tiempo, se produce una obliteración de los túbulos dentinarios con dentina esclerótica, sobre todo si se trata de pacientes mayores de 40 años de edad, ya que con el transcurrir de los años se va produciendo en forma fisiológica este fenómeno.
Ahora bien, cuando los túbulos se encuentran expuestos y abiertos, pueden estar parcialmente ocluidos por barro dentinario, situación que disminuye la sintomatología del cuadro. 33
El cepillo por sí solo tiene poco efecto sobre la dentina: toma varias horas de cepillado constante in Vitro para eliminar la capa de frotis dentinario o para que dicha capa se vuelva a formar (estos experimentos representan años de cepillado normal).
Los dentífricos, sus abrasivos y, hasta cierto punto, el detergente de la pasta común, el sulfato láurico de sodio, causan desgaste de la dentina. Basándose en datos de laboratorio, una revisión asociada concluyó que, bajo circunstancias normales, el cepillado dental con la mayoría de los dentífricos tiene poco o ningún efecto sobre el esmalte y efectos clínicamente no significativos en la dentina.
Sin embargo, estudios sugieren que los hábitos excesivos de cepillado o el abuso de éste pueden causar pérdida patológica de dentina. 34
Existen varias formas de incorporar el ión flúor como tratamiento de la hiperestesia dentinal entre ellas: enjuagatorios bucales con soluciones fluoradas, aplicación de lacas, geles, barnices y desde hace varios años se emplea láser con este fin. 11 Varios estudios respaldan la eficacia del flúor como agente desensibilizante. 35-39
El nitrato de potasio (5%), el cloruro de Potasio (3. 75%) y el citrato de Potasio (5. 5%) son usados intercaladamente en el tratamiento de la hiperestesia, ya que cada una provee 2% de ion potasio, su ingrediente activo 4. Estudios clínicos han mostrado que las cremas dentales que contienen cada uno de estos ingredientes son efectivas en reducir la hipersensibilidad dentinaria. 40-46
Los datos publicados muestran que productos tales como Gluma y Duraphat, están clínicamente probados para proporcionar alivio de la sensibilidad después de una o más aplicaciones. 47
Las cremas dentales basadas en cloruro de estroncio estuvieron disponibles antes del desarrollo de los productos basados en potasio, y han sido extensamente sustituidas por estos. Las cremas dentales que contienen fluoruro de estaño han mostrado ser efectivas en reducir la sensibilidad a las 4 a 8 semanas de uso, dos veces al día. 35
En una revisión publicada en 2007, Markowitz y Pashley 48 sugirieron que las nuevas tecnologías deberían atacar las causas subyacentes tanto como los síntomas de la hipersensibilidad dentinaria.
Específicamente ellos propusieron aumentar la densidad mineral de la superficie de la dentina expuesta, mientras que obturando y sellando los túbulos abiertos con un material parecido a la dentina, que contenga calcio y fosfato, podrían incrementar su resistencia al desgaste, así como al ataque erosivo, bloqueando la difusión a través de los túbulos abiertos en la subsuperficie dentinal.
Más aún, ellos sugieren que el tratamiento para la hipersensibilidad dentinaria ideal aceleraría y conllevaría a un proceso desensibilizante propio de la naturaleza de oclusión de los túbulos dentinales abiertos. 47
Varias décadas de investigación sobre los mecanismos que subyacen el proceso natural de la oclusión de la dentina y el papel de la saliva en el transporte de calcio y fosfato dentro de los túbulos dentinales, de Kleinberg y colaboradores, han resultado en el desarrollo y la validación de un nuevo tratamiento para la hipersensibilidad dentinaria, de uso en el consultorio.
Este tratamiento, una pasta de profilaxis desensibilizante basada en Arginina al 8%, un aminoácido presente naturalmente en la saliva, bicarbonato, una sustancia buffer, y carbonato de calcio, una fuente de calcio, ha sido mercadeada en los EEUU para el manejo de la hipersensibilidad dentinaria durante los procedimientos de profilaxis administrados profesionalmente. 4
Estudios clínicos han mostrado que este tratamiento es efectivo para proveer alivio instantáneo de la sensibilidad, cuando se bruñe en los dientes sensibles después de la profilaxis dental. 4,49-55
Muchos métodos de imágenes de actualidad han sido utilizados para dilucidar el mecanismo de acción de la tecnología Arginina-carbonato de calcio in vitro. Estudios de microscopía de barrido laser con focal (CLSM) han mostrado que la pasta desensibilizante con Arginina-carbonato de calcio es altamente efectiva en ocluir los túbulos dentinales abiertos. No se observa ninguna oclusión dentinal con una pasta que contiene carbonato de calcio solo, o con una pasta que contiene Arginina con un abrasivo de calcio alternativo, dihidrato de fosfato dicálcico (Dical). Más aún, estudios de CLSM, han mostrado que la oclusión lograda es resistente al ataque ácido. 51
Imágenes de microscopía electrónica de barrido de alta resolución (SEM) han verificado que la pasta desensibilizarte con Arginina-carbonato de calcio proporciona completa oclusión de los túbulos dentinales abiertos, e imágenes de criofractura han mostrado que el tapón alcanza una profundidad de dos micrones dentro del túbulo. Rayos X de energía dispersa (EDX), usados para mapear químicamente las superficies ocluidas, han mostrado que el material que está en la superficie dentinal y el que está ocluido dentro de los túbulos dentinales consiste principalmente en calcio y fosfato.
La Espectroscopía Electrónica para análisis químicos (ESCA) ha mostrado datos cuantitativos los cuales han verificado estas observaciones y, adicionalmente, han identificado la presencia de carbonato. 51
La Microscopía de Fuerza Atómica (AFM) ha fundamentado adicionalmente este mecanismo del bloqueo. Especímenes no tratados mostraron la fina estructura helicoidal de la dentina inter-tubular, así como los túbulos que estaban completamente abiertos. Los especímenes tratados con la pasta de profilaxis desensibilizante mostraron que la estructura helicoidal en la superficie de la dentina no era más visible, como resultado de una superficie cubierta y los túbulos estaban herméticamente sellados. 51
Juntos, estos estudios clínicos y de mecanismo de acción han demostrado claramente que la pasta desensibilizante de Arginina carbonato de calcio reduce la hipersensibilidad dentinaria sellando y obturando los túbulos dentinales. 49-55
Laser y sus propiedades
La palabra laser es acrónimo de Light Amplification by Stimulated Emission of Radiation, teniendo sus principios básicos postulados por Einstein en 1917 y puestos en práctica por primera vez por el físico Theodor Maiman en 1960. La base física de la función del laser es la interacción entre los fotones y los electrones de cámara externa del átomo. Esta acción recíproca da origen a una radiación electromagnética que por sus propiedades especiales se caracteriza por distribución de intensidad en forma de espectro () Dentro de los principales láser utilizados en odontología están: argón, CO2, erbio, holmio, neodimio, y algunos de diodo. El laser de argón (= 488nm y 514,5nm) tiene alta absorción por la hemoglobina, melanina e hemosiderina. De esta forma, ese laser es bastante utilizado en el diagnóstico de caries, blanquimiento dental, fotopolimerización de resinas, hemostasia y cirugías. El laser de CO2 (= 9,3 Wm; 9,6 Wm e 10,6 Wm) es bastante utilizados para cirugías en tejido blando. El laser de neodimio (= 1,064 m) és utilizado para reducir la microflora intracanal, dolencias periodontales, reducción de hipersensibilidad dentinaria, lesiones herpéticas, como también la coagulación. El laser de holmio (= 2,064 m) es utilizado tanto en tejidos dentales duros como también en la prevención de caries y preparación cavitaria. El láser de erbio (= 2,94 m; 2,79 m e 2,78m) es el más adecuado para tejido dental duro. 56
Diseño Metodológico
Tipo de estudio:
Se realizó un estudio descriptivo transversal para determinar la prevalencia de la hiperestesia dentinaria en la población adulta de 15-58 años del sector La Naya. ASIC Santa Cruz del Este en el período de septiembre-diciembre del 2009.
Universo y muestra:
El universo del estudio estuvo constituido por 560 de ambos sexos comprendidos entre las edades de 15 a 58 años de edad que acudieron a consulta por cualquier afección. De estos, 90 presentaron la enfermedad los que constituyeron la muestra del estudio.
Consideramos pacientes con hiperestesia dentinaria aquellos que al realizarle exploración mecánica con explorador y al aire comprimido referían dolor o molestias y que no presentaran otra afección a ese nivel.
Criterios de inclusión:
• Consentimiento del paciente a participar en la investigación y de su representante en el caso de los menores de 18 años. (Anexo I y II)
• Que se encuentre en el grupo de edades de 15 a 58 años.
• Que presentara la enfermedad
Criterios de exclusión:
• Negación del paciente o del representante en caso de los menores de 18 años a participar en la investigación.
• Que presente alguna discapacidad física o mental.
• Que no presentara la enfermedad
Consideraciones éticas:
Para llevar a cabo nuestra investigación se tuvieron en cuenta algunas consideraciones éticas relacionadas con las personas objeto de estudio:
• Se solicitó la aprobación de los padres en los pacientes menores de 18 años por escrito y su apoyo a la investigación de la que fueron objeto sus hijos, luego de explicarles que los procederes no constituyen riesgo para la salud de estos.(anexo I)
• Se solicitó a los pacientes mayores de 18 años su aprobación por escrito y apoyo a la investigación (Anexo II)
Para lograr el objetivo propuesto se estudiaron las siguientes variables:
Sexo: en sus dos categorías biológicas.
• Masculino
• Femenino
Edad: medida en años cumplidos. Se agruparon en los siguientes grupos
• 15-25
• 26-36
• 37-47
• 48-58
Prevalencia: según aparición o no de la enfermedad
• Sanos
• Enfermos
Distribución: según número de dientes afectados
• Localizado: cuando se encontraba en uno o dos dientes
• Generalizado: cuando afectaba a 3 dientes o más
Dientes afectados: según grupos dentarios afectados
• Incisivos
• Caninos
• Premolares
• Molares
Caras del diente afectadas
• Vestibular
• Lingual o palatina
• Oclusal y/o incisal
Severidad: según la intensidad del dolor referido por el paciente
• Leve
• Moderada
• Severa
Respuesta de hipersensibilidad dentinaria según diversos estímulos: según respuesta positiva o negativa al estímulo
Estímulos:
• Calor
• Dulce
• Ácido
• Cepillado
• Frío
Factores desencadenantes: se consideran aquellos que pueden influir en la aparición de la entidad
• Recesión gingival: desplazamiento apical del margen libre de la encía.
• Cepillado traumático: se consideró aquel que se realiza enérgicamente con cepillo de cerdas duras, de forma horizontal y/o ha provocado una recesión gingival.
• Alteraciones del esmalte: se consideró la presencia o no de abrasión cervical, atricción y/o erosión dental
• Alimentos ácidos: se consideró a aquellos pacientes que ingerían varias veces al día estos alimentos ya fuera en su forma natural y/o bebidas y comidas con pH bajo (refrescos gaseosos y otros)
• Tratamiento periodontal: se consideró aquellos pacientes que reciben o recibieron tratamientos periodontales. (raspado y alisado radicular y/o colgajos)
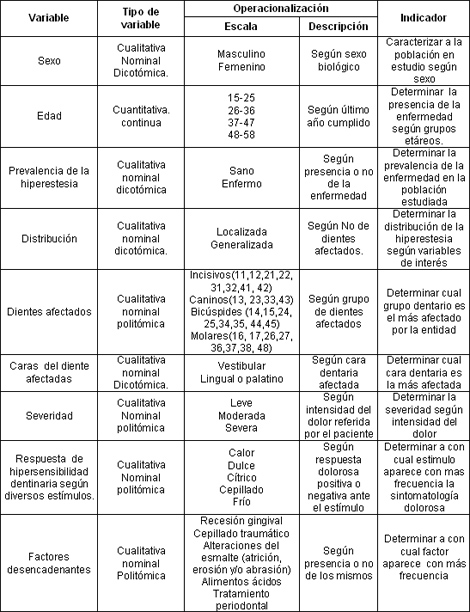
Operacionalización de las variables:
Técnicas y Procedimientos.
• De recolección de la información
Se llevó a cabo una detallada revisión bibliográfica acerca del tema. A partir del cual se diseñó el formulario para la recolección de la información (anexo III), el cual fue llenado con los datos recogidos en el examen bucal y el interrogatorio.
El examen bucal se realizó en el sillón dental donde se utilizó instrumental de diagnóstico (explorador y jeringa de aire comprimido para determinar la presencia o no de la patología objeto de estudio).
• De procesamiento y análisis
Luego de recopilada de forma manual la información necesaria se creó una base de datos computarizados con el Excel del Microsoft Office 2003 y se confeccionaron los cuadros estadísticos y los gráficos. Como medida resumen se utilizó el porcentaje
Los resultados se mostraron en tablas de distribución de frecuencias, expresados en número y por ciento. Se procesaron con el paquete estadístico SPSS versión 13.0.
• De elaboración y síntesis de los resultados
Se efectuó la descripción de cada tabla, las que se compararon con los hallazgos de otros autores sobre la base de un análisis inductivo y deductivo; esto nos permitió dar salida al objetivo propuesto, llegar a conclusiones y emitir las recomendaciones, pertinentes.
Análisis y discusión de los resultados
Varias son las enfermedades que llevan a los pacientes a acudir a una consulta de urgencias estomatológicas, pero la gran mayoría corresponde a afecciones que producen sintomatología dolorosa. Es evidente que en estos casos, para una correcta indicación de tratamiento, es de suma importancia el establecimiento de un diagnóstico más preciso. De este modo, el profesional deberá buscar la correlación de la sintomatología dolorosa con otros aspectos clínicos. 57 La hiperestesia dentinaria es una de estas enfermedades.
El gráfico 1 muestra que del total de la población estudiada el 16% se encontró afectada por hiperestesia dentinaria, elevada prevalencia que coincide con otros estudios 58-60 que plantean cifras que fluctúan desde un 3% hasta inclusive un 57%. Stevens 59 en su estudio encontró una prevalencia del 36%
Gráfico 1. Prevalencia de la hiperestesia dentinaria
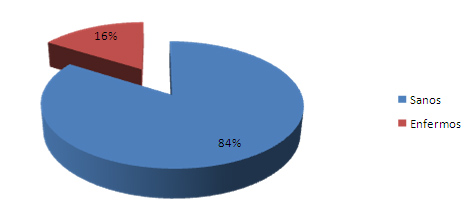
Fuente: Formulario
La Hiperestesia Dentinaria (H.D) tiene una etiología multifactorial y variaciones en su prevalencia, la mayoría de las personas con Hiperestesia Dentinaria están entre los 20 y los 50 años de edad. 60
El sexo es una variable que aporta características peculiares, la resistencia o no a determinada enfermedad es más frecuente en un sexo que en otro, imprime propiedades distintivas, estéticas y estilos de vida diferenciados. 61
La distribución porcentual de los sujetos que reportaron hipersensibilidad de acuerdo a edad y sexo se indica en la Tabla 1 donde se observa que el femenino es el más afectado con 59 pacientes para un 65. 6% fundamentalmente entre las edades de 37-47 seguido por el grupo de 26-36 años, con descenso considerable en la 6ta década esto puede deberse probablemente a cambios escleróticos en los túbulos dentinarios disminuyendo su diámetro gradualmente con la edad.
Stevens 59 también encontró que esta entidad alcanza un nivel máximo entre la 4ta y 5ta década de vida siendo las mujeres las más afectadas.
Romero 31, Hernández y Martínez 11 y Gilliam y col. 62 en sus investigaciones también encontraron que el sexo femenino fue el más afectado aunque estos dos últimos estudios obtuvieron mayor prevalencia en las edades de 29-39 años y 20-29 respectivamente.
Estos resultados contrastan con los descritos por Bamise y col63, Al-Wahadni y Linden 64 donde el género masculino manifestó mayor hipersensibilidad que los pacientes femeninos. Por otra parte Chabansky y col 65,66 no encontraron diferencias en cuanto al género.
Tabla 1. Distribución de la hiperestesia según edad y sexo
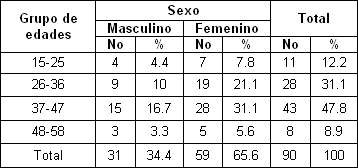
Fuente: Formulario
El Gráfico 2 muestra la hiperestesia dentinaria según su distribución en la cavidad bucal, siendo la localizada la predominante con un 92.2% (83 pacientes).
Estos resultados coinciden con lo hallado por Stevens 59 en su investigación la cual obtuvo un 76%.
Gráfico 2. Hiperestesia dentinaria según su distribución
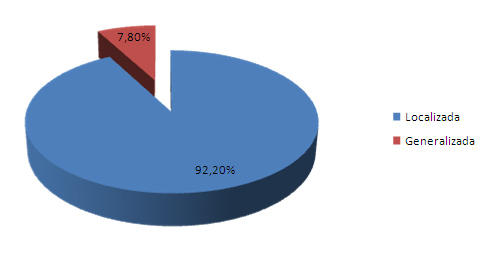
Fuente: Formulario
En la tabla 2 vemos que la hiperestesia localizada predominó en el grupo de 37-47 años (47. 8%), seguido por el de 26-36 años (31. 1%). Estos resultados coinciden con los encontrados por Stevens 59 (26. 5%)
Tabla 2. Distribución de la hiperestesia por grupos de edades
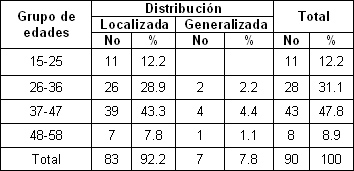
Fuente: Formulario
En la tabla 3 se observa la distribución de la hiperestesia según sexo, la localizada predominó en el sexo femenino con un 65. 1%, en la generalizada también predominaron las féminas.
Stevens 59 encontraron resultados similares en su estudio ya que plantean que las mujeres tienden a ser más afectadas que los hombres, si se sabe que la higiene de ellas es por lo general mejor, desde una temprana edad y el cepillado intenso está asociado a esta entidad.
Tabla 3. Distribución de la hiperestesia dentinaria según sexo
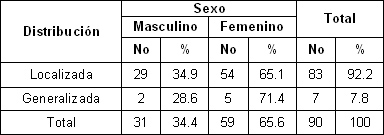
Fuente: Formulario
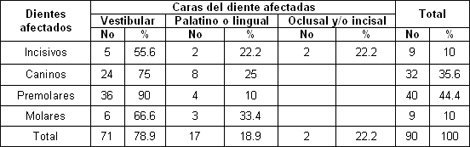
La cara más afectada fue la Vestibular con 71 casos para un 78. 9% dentro de la cual la localizada fue la más observada (tabla 4), la cara vestibular de los dientes es la que más expuesta a los diferentes factores que pueden influir en la aparición de la hiperestesia y este fenómeno ocurre más frecuentemente de forma localizada.
Esto coincide con lo encontrado por Stevens59. No es sorprendente que el área bucocervical tenga una mayor predisposición a la hiperestesia ya que los factores erosivos y abrasivos por si solos o en combinación tienen una mayor probabilidad de impactar en este lugar produciendo la exposición dentinaria. Sobral67 obtuvo resultados similares. También coincide con lo planteado por Martínez y col68 y Walters69. Bamise y col63 en su investigación encontraron que la cara más afectada fue la oclusal seguida por la cervical.
Tabla 4. Hiperestesia dentinaria según caras del diente afectadas
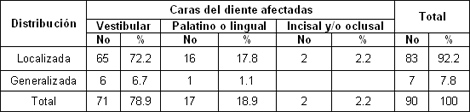
Fuente: Formulario
El gráfico 3 representa la hiperestesia según grupos dentarios afectados, siendo los premolares los que ocupan la primera posición con un 44. 4%. Coincidiendo con lo hallado por Stevens59 (36%). También coincide con lo planteado por Martínez y col68, Walters69, Gilliam62 y Rees70, 71.
En otro estudio realizado en Hong Kong72 este último autor encontró que los dientes más afectados fueron los incisivos. También difiere de nuestros resultados lo hallado por Bamise63 al prevalecer en su estudio los molares como los dientes más afectados
Gráfico 3. Hiperestesia dentinaria según grupos dentarios afectados
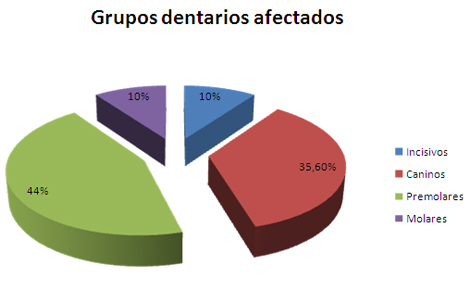
Fuente: Formulario
En la tabla 5 se relacionan los dientes afectados según la localización de esta entidad en las caras dentales observando que los grupos de dientes más afectados son los premolares seguidos por los caninos por su cara Vestibular. Stevens59 y Sobral67 encontraron resultados similares.
También coincide con lo planteado por Martínez y col68, Walters69 y Rees70, 71.
Tabla 5. Hiperestesia dentinaria según grupos dentarios afectados y Caras del diente afectadas
Fuente: Formulario
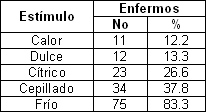
La distribución de los sujetos evaluados de acuerdo a la respuesta de hipersensibilidad dentinaria según diversos estímulos se muestra en la Tabla 6.
Un hallazgo interesante fue que el 83. 3% de los pacientes manifestaron que las bebidas frías fueron el principal estímulo desencadenante de la hipersensibilidad dentinaria, posiblemente debido a lo reportado por Pashley73, quien explica que la aplicación del frío provoca una contracción volumétrica más rápida del líquido dentinario.
Esta diferencia de cambios volumétricos produce presiones intrapulpares negativas que desplazan a los mecanorreceptores y producen la hipersensibilidad más rápido que cualquier otro estímulo.
De este 90% que consideraron al frío como principal estímulo desencadenante de la hipersensibilidad
Estos resultados soportan las publicaciones realizadas por Gilliam62, Bamise63 Chabansky y coll65, 66, Gillam y col74, Ress 70, 71,72, Clayton y col. 75 y Romero31
Tabla 6. Distribución de los pacientes de acuerdo a la respuesta de hipersensibilidad dentinaria según diversos estímulos.
Fuente: Formulario
Durante mucho tiempo y hasta la actualidad el dolor ha sido un tema de amplia de controversia y mucho interés tanto en la medicina como en la odontología. Así pasó de ser un síntoma estudiado generalmente como parte de una patología determinada a un cuadro nosológico con características propias La Asociación Internacional para el Estudio del Dolor (IASP), lo define como: Experiencia sensorial o emocional desagradable, asociada a daño tisular real o potencial, o descritos en términos de dicho daño. 76
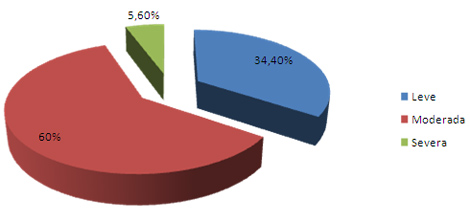
El gráfico 4 muestra la hiperestesia según la severidad del dolor: la moderada fue la más frecuente, seguida de la leve con 60% y 34.4% respectivamente. Estos resultados difieren de lo encontrado por Fernández 77 en su estudio en el cual predominó la hiperestesia leve (61. 7%)
Gráfico 4. Hiperestesia dentinaria según severidad del dolor
Fuente: Formulario
El cepillado excesivo (particularmente en áreas de recesión gingival), el sarro, la cirugía de recesión gingival), el sarro, la cirugía periodontal, el pulido de las superficies de la raíz y la exposición a comidas ácidas o productos químicos pueden provocar exposición de la dentina. Por regla general, la mayoría de las superficies del diente no deberían estar expuestas a un nivel de pH menor de seis. Los niveles de PH más bajos pueden causar una pérdida directa de la estructura del diente, desmineralización y reblandecimiento de la superficie. Además los ácidos pueden disolver fácilmente las capas de manchas que a menudo sirven de obturadores en los extremos orales de los túbulos dentinales. Estas capas, compuestas de cemento microcristalino y escombros triturados de dentina, son el resultado de cortar las superficies adyacentes del diente o del pulido rutinario de los dientes o de restauraciones 7.
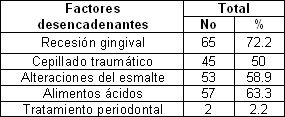
En la tabla 7 se relacionan los factores desencadenantes de esta afección con el sexo. La recesión gingival es el factor que principalmente ocasiona esta urgencia.
Tabla 7. Factores desencadenantes de la Hiperestesia dentinaria.
Fuente: Formulario
La recesión gingival es considerada el principal factor predisponente para la hipersensibilidad dentinaria. 78
La recesión gingival al dejar expuesto el limite amelocementario facilita la exposición de los túbulos dentinarios al medio bucal, esto representa la posibilidad de que el flujo de fluidos y por tanto la hipersensibilidad, puede aumentar por la pérdida de dentina a través de los procesos de desgaste dental, suponiendo que dicho desgate no induzca procesos reparativos de la dentina. Esto coincide con lo hallado por Stevens59 y Bamise79. Señalar como dato interesante el papel de los alimentos ácidos. Ya que obtuvimos que un 63. 3% de los pacientes refirieron tener este tipo de alimentos en su dieta diaria.
El régimen alimentario tiene un importante papel en la prevención de las enfermedades bucodentales, Se considera que los problemas de erosión dental van en aumento. La evidencia disponible indica que las bebidas gaseosas, una importante fuente de ácidos en la dieta en los países desarrollados, son un factor causal relevante. 80 El ácido más usado en los refrescos de cola es el fosfórico, que es un acido orgánico muy acidificante de la sangre. Los refrescos con sabor a frutas suelen llevar ácidos orgánicos propios de la fruta, tal como el málico y el cítrico.
Estudios realizados en Venezuela muestran que las bebidas gaseosas se consumen en un alto porcentaje.
En cuanto a los otros factores predisponentes encontrados, Pickles 30 coincide con este estudio al plantear que el cepillado de dientes está asociado con la hiperestesia dentinaria y que quienes usan el cepillo con dentífricos abrasivos tienen más posibilidad de presentar hiperestesia que el que no lo usa. Desgraciadamente, hasta el momento hay una falta de datos de estudios clínicos aleatorios controlados para demostrar una relación causal entre el cepillado dental e hiperestesia dentinaria.
En síntesis los resultados de este estudio, revelan que la hiperestesia está bastante generalizada por lo que hay que continuar enfatizando la necesidad de instruir a los pacientes y a la comunidad en los factores que predisponen la aparición de la misma.
Conclusiones
La prevalencia de la hiperestesia fue elevada alcanzando el 16% de la población de 15-58 años de edad del sector La Naya, asociada a la recesión gingival, fundamentalmente en premolares por Vestibular.
Recomendaciones
• Realizar labores de prevención sobre los factores de riesgos susceptibles a ser modificados como el cepillado traumático y la ingesta de alimentos ácidos para disminuir la incidencia de la enfermedad.
• Realizar estudios de prevalencia en otras áreas del municipio para comparar los resultados.
Anexo I
Consentimiento informado
Estimado compañero(a). Por este medio solicitamos de Ud. su aprobación para participar en un estudio sobre la hiperestesia dentinaria. Necesitamos su cooperación para realizar un examen clínico donde se le realizarán pruebas, la cual aportará mucho al trabajo y que será motivo de un estudio científico.
----------------------------------------------------
Nombres y Apellidos
Anexo II
Consentimiento informado
Por este medio yo __________________________________ doy mi conformidad y/o la de mi hijo para formar parte de esta investigación, con el objetivo de conocer algunos aspectos de su salud bucal, no constituyendo un riesgo para su salud.
_________________________________
Firma del padre o tutor
Anexo III
Formulario
Prevalencia de la hiperestesia dentinaria. Sector La Naya. ASIC Santa Cruz del Este
Nº de orden ____________
Nombre(s) y Apellidos:
_________________________________________________
Sexo:
- Masculino ( )
- Femenino ( )
Edad:
- 15-25 ( )
- 26-36 ( )
- 37-47 ( )
- 48-58 ( )
Prevalencia:
- Sanos ( )
- Enfermos ( )
Distribución
- Localizado ( )
- Generalizado ( )
Dientes afectados
- Incisivos ( )
- Caninos ( )
- Premolares ( )
- Molares ( )
Caras afectadas
- Vestibular ( )
- Lingual o Palatino ( )
- Oclusal y/o incisal
Severidad del dolor:
- Leve ( )
- Moderada ( )
- Severa ( )
Respuesta positiva frente a estímulo:
- Calor ( )
- Dulce ( )
- Acido ( )
- Cepillado ( )
- Frío ( )
Factores desencadenantes:
- Resección gingival ( )
- Cepillado traumático ( )
- Alteraciones del esmalte ( )
- Alimentos ácidos ( )
- Tratamiento periodontal ( )
Bibliografía
1. Díaz D, González G, Abreu J, Gutiérrez S, Cabañas C. Flores E. Guías prácticas clínicas de enfermedades pulpares y periapicales. En: Colectivo de autores. Guías Prácticas de Estomatología. La Habana: Editorial Ciencias Médicas, 2003. P: 76-127
2. Sabillón I, Castrillón N. Hipersensibilidad Dentinal. (on-line.) Pontificia Universidad Javeriana. Bogotá. 2006. Obtenible en: http://javeriana.edu.co/ academia pg endodoncia/ art_revision/ revision_ 2006/i_a_revision 24.html (Consulta febrero 2010)
3. Barroso Palomino M. Hiperestesia dentinaria. Revista de Ciencias Médicas La Habana (seriada en línea) 2008; 14 (1) Disponible en: http://www. cpicmha.sld. cu/hab/ Vol14_1_08/ hab07108.htm
4. Cummins D. La Eficacia de un Nuevo Dentífrico que Contiene Arginina al 8%, Carbonato de Calcio y 1450 ppm de Flúor para Proporcionar Alivio Instantáneo y Duradero de la Hipersensibilidad Dentinaria. J Clin Dent; 2009; 20(4):109–114
5. Pashley DH, Tay FR, Haywood VB, Collins MC, Drisko CL: Dentin hypersensitivity: Consensus-based recommendations for the diagnosis and management of dentin hypersensitivity. Inside Dent 2008, 4(9):1–35.
6. Compañía Stafford Miller Internacional. Etiología de la sensibilidad en la superficie del diente. Revista Colombiana de Periodoncia (ON-LINE)2 Obtenible en: http://www. encolombia.com/ periodoncia4_ etiologia1.htm (Consulta diciembre 2009)
7. Heaton LJ, Carlson CR, Smith TA, Baer RA, de Leeuw R: Predicting anxiety during dental treatment using patients’ self-reports: Less is more. JADA 2007 138:188–195
8. Reny C, Franco J, Yamaguti P, Marly L, Pimentel F. Hiperestesia Dentinária: OPÇÕES DE TRATAMENTO MANAGEMENT OF DENTIN HYPERESTHESIA. Revista Dentística (on line) 2009 janeiro / março; 18: 29-34.
9. Zero DT, Lussi A: Erosion. Chemical and biological factors important to the dental practitioner. Int Dent J 2005; 55 (Suppl):285–290
10. West NX: Dentine hypersensitivity. In: Dental Erosion, Lussi A. Oral Sci 2006; 20: 173–189.
11. Hernández S. Martínez Y. Laserterapia en hiperestesia dentina. Publicaciones Científicas revistaciencias.com (pág. Web) RevistaCiencias.com. 2007 http://www. revistaciencias. com/ publicaciones/ EEZlVZVFE AjlDTFbxB.php
12. Kumar NG, Mehta DS.Short-term assessment of the Nd:YAG laser with and without sodium fluoride varnish in the treatment of dentin hypersensitivity--a clinical and scanning electron microscopy study. J Periodontol. 2005 Jul;76(7):1140-7
13. Kara C, Orbak RComparative evaluation of Nd:YAG laser and fluoride varnish for the treatment of dentinal hypersensitivity.. J Endod. 2009 Jul;35(7):971-4
14. Vieira AH, Passos VF, de Assis JS, Mendonça JS, Santiago SL.Clinical evaluation of a 3% potassium oxalate gel and a GaAlAs laser for the treatment of dentinal hypersensitivity. Photomed Laser Surg 2009 Oct; 27(5):807-12.
15. Schweiz Monatsschr Zahnmed.Comparative study in desensitizing efficacy using the GaAlAs laser and dentin bonding agent. J Dent. 2008 Jun; 36(6):392-5.
16. Queralt R, Durán-Sindreu F, Ribot J, Roig M. Manual de Endodoncia. Parte 4. Patología pulpo-periapical. Rev Oper Dent Endod 2006;5:24 obtenible en: http://www. infomed.es/rode/ index.php? option=com_content &task=view&id=85&Itemid=1
17. Alonso M, Añana N, Beovide V, Capurro S, Carzoglio J, Cossetti, Et al. Alteraciones pulpares y sus complicaciones. Facultad de Odontología: Montevideo – Uruguay. 2010 (pág. web) obtenible en www.odon.edu.uy/biblioteca/altpulp.doc 2010 (consulta febrero 2010)
18. Cortés García M, Garcés Ortiz M, Reyes Gasga. Nanoestructura de la dentina humana. IX Congreso Nacional de Microscopía 9 – 13 de noviembre de 2008 Guanajuato, Gto. Obtenible en http://www. amemi.org/ Docs/simposia_ biologia/carteles/35_ Nanoestructura _de_la_ dentina_ humana.pdf Asociación Mexicana de Microscopía A.C.
19. Paredes Farrera, Fernández J Descripción neuroanatómica del dolor en cavidad oral. Rev Mex de Odontología Clínica, Año 1, Número1. (revista electrónica) (Consulta febrero 2010) obtenible en http://www.intramed. net/contenidover.asp? contenidoID=54137
20. Nathoo E. Delgado Y.P. Zhang W. DeVizio D. Cummins. Mateo L. Comparación de la Eficacia para Proporcionar Alivio Instantáneo de la Hipersensibilidad Dentinaria de una Nueva Crema Dental que Contiene Arginina al 8%, Carbonato de Calcio y 1450 ppm de Flúor en Relación con una Crema Dental de Referencia para la Sensibilidad con Ion Potasio al 2% y 1450 ppm de Flúor, y una Crema Dental Control con 1450 ppm de Flúor: Un Estudio Clínico de Tres Días en New Jersey, USA. J Clin Dent 2009; 20 (4)123–130
21. Cabezas H, Álvarez S, Hipersensibilidad Dentinaria: Enfoques. Acerca de su Diagnóstico y Tratamiento. Revista Dental de Chile 2002; 93 (2): 20-24
22. Romero I, Escalona L, Acevedo A. Teorías y factores involucrados en la hipersensibilidad dentinaria. Acta Odontológica Venezolana (revista on-line) 2009; 47(1). (consulta abril 2010) obtenible en: www. actaodontologica. com/ediciones/ 2008/1/ teorias_factores_ etiologicos_ hipersensibilidad_ dentinaria.asp
23. Peña S. Prevalencia de la hiperestesia dentinaria en el área del Policlínico Eduardo Mesa Llull. (Tesis para optar por el título de especialista 1er grado EGI). Facultad de Estomatología Santiago de Cuba. 2008
24. Ardila Medina CM. Hipersensibilidad dentinal: Una revisión de su etiología, patogénesis y tratamiento. Av. Odontoestomatol 2009; 25 (3): 137-146.
25. Bueno L. Efectos lesivos del control mecánico de la placa microbiana. Rev Fundac Juan José Carraro 2005; 10(20): 36-38.
26. Barbour ME, Rees GD. The role of erosion, abrasión and attrition in tooth wear. J Clin Dent. 2006; 17(4):88-93.
27. Walters PA. Dentinal Hypersensitivity: A review. J Contemp Dent Pract 2005 may; 6(2): 107-117.
28. Vaitkeviciene I, Vaitkevicius R, Paipaliene P, Zekonis G. Morphometric análisis of pulpal myelinated nerve fibers in human teeth with chronic periodontitis and root sensitivity. Medicina (Kaunas). 2006; 42(11): 914-22
29. Ardila Medina CM. Recesión gingival: una revisión de su etiología, patogénesis y tratamiento. Av Periodon Implantol. 2009; 21, 2: 35-43.
30. Cuenca M, Baca P. Odontología prevntiva y comuniatria 3ra E. Barcelona, España: Masson; 2005
31. Romero I, Escalona L, Acevedo A. Frecuencia de hipersensibilidad dentinaria posterior al raspado y alisado radicular en un grupo de pacientes evaluados en el postgrado de periodoncia de la Facultad de Odontología UCV. Estudio Piloto. Acta odontol. venez [online] dic 2008, 46(3):284-288. Obtenible
32. Kocher T, Fanghänel J, Schwahn C, Rühling A. A new ultrasonic device in maintenance therapy: perception of pain and clinical efficacy. J Clin Periodontol 2005; 32: 425-429.
33. Rivera S, Navarro H Hipersensibilidad Dentinaria: Enfoques Acerca de su Diagnóstico y Tratamiento. Revista Dental de Chile 2002; 93 (2): 20-24
34. Martin Addy, Bristol, RU. Hipersensibilidad dentinaria: nuevas perspectivas sobre un antiguo problema. International Dental Journal (2002) 52, 367–375
35. Schiff T, Saletta L, Baker RA, Winston JL, He T: Desensitizing effect of a stabilized stannous fluoride/sodium hexametaphosphate dentifrice. Compend Contin Educ Dent 2005 Sep; 26 (9 Suppl):35–40.
36. Day T, Einwag J, Hermann JS, He T, Anastasia MK, Barker M, Zhang Y. .A clinical assessment of the efficacy of a stannous-containing sodium fluoride dentifrice on dentinal hypersensitivity. J Contemp Dent Pract 2010 Jan 1;11(1):E001-8
37. Singal P, Gupta R, Pandit N. 2% sodium fluoride-iontophoresis compared to a commercially available desensitizing agent. J. Periodontol. 2005 Mar; 76(3):351-7
38. Ritter AV, de L Dias W, Miguez P, Caplan DJ, Swift EJ Jr. Treating cervical dentin hypersensitivity with fluoride varnish: a randomized clinical study. J Am Dent Assoc 2006 Jul;137(7):1013-20; quiz 1029
39. Winston AE, Charig AJ, Thong S. Mechanism of action of desensitizing fluoride toothpaste delivering calcium and phosphate ingredients in the treatment of dental hypersensitivity. Part III: Prevention of dye penetration through dentin vs a calcium- and phosphate-free control. Compend Contin Educ Dent. 2010 Jan-Feb; 31(1):46-8, 50-2.
40. Hu D, Zhang YP, Chaknis P, Petrone ME, Volpe AR, DeVizioW: Comparative investigation of the desensitizing efficacy of a new dentifrice containing potassium citrate: An eight-week clinical study. J Clin Dent 2004; 15(1):6–10.
41. Wara-aswapati N, Krongnawakul D, Jiraviboon D, Adulyanon S, Karimbux N, Pitiphat W: The effect of a new toothpaste containing potassium nitrate and triclosan on gingival health, plaque formation and dentine hypersensitivity. J Clin Periodontol 2005; 32:553–558.
42. Jalalian E,Meraji N,MirzaeiM: A comparison of the efficacy of potassium nitrate and Gluma desensitizer in the reduction of hypersensitivity in teeth with full-crown preparations. J Contemp Dent Pract 2009;10:66–73,
43. Docimo R, Montesani L, Maturo P, Costacurta M, Bartolino M, DeVizio W, Zhang YP, Dibart S. Desensitizing efficacy of a new toothpaste containing 5. 5% potassium citrate: a 4-week clinical study. Am J Dent. 2007 Aug; 20(4):209-11.
44. Haywood VB, Cordero R, Wright K, Gendreau L, Rupp R, Kotler M, Littlejohn S, Fabyanski J, Smith S Brushing with a potassium nitrate dentifrice to reduce bleaching sensitivity. J Clin Dent. 2005; 16(1):17-22.
45. Tay LY, Kose C, Loguercio AD, Reis A. Assessing the effect of a desensitizing agent used before in-office tooth bleaching. J Am Dent Assoc. 2009 Oct; 140(10):1245-51.
46. Leight RS, Sufi F, Gross R, Mason SC, Barlow AP. Dentinal hypersensitivity: a 12-week study of a novel dentifrice delivery system comparing different brushing times and assessing the efficacy for hard-to-reach molar teeth. J Clin Dent. 2008; 19(4):147-53.
47. Kakaboura A, Rahiotis C, Thomaidis S, Doukoudakis S: Clinical effectiveness of two agents on the treatment of tooth cervical hypersensitivity. Am JDent 2005; 18:291–295.
48. Markowitz K, Pashley DH: Discovering new treatments for sensitive teeth:The long path from biology to therapy. J Oral Rehabil 2007; 35:300–315.
49. Hamlin D,Williams KP, Delgado E, Zhang YP, DeVizioW,Mateo LR: Clinicalevaluation of the efficacy of a desensitizing paste containing 8.0% arginineand calcium carbonate for the in-office relief of dentin hypersensitivityassociated with dental prophylaxis. Am J Dent 2009; 22 (Spec) No A: 16A–20A.
50. Panagakos F, Schiff T, Guignon A: Dentin hypersensitivity: Effective treatment with an in-office desensitizing pastes containing 8.0%arginine and calcium carbonate. Am J Dent 2009; 22 (Spec ) No A:3A–7A,
51. Petrou I, Heu R, Stranick M, Lavender S, Zaidel L, Cummins D, Sullivan RJ, Hsueh C, Gimzewski JK: A breakthrough therapy for dentin hypersensitivity How dental products containing 8% arginine and calcium carbonate work to deliver effective relief of sensitive teeth. J Clin Dent, 2009; 20 (1) (Spec):23-31.
52. Ayad F, Ayad N, Zhang YP, DeVizio W, Cummins D, Mateo LR: Comparing the efficacy in reducing dentin hypersensitivity of a new toothpaste containing 8.0% arginine, calcium carbonate, and 1450 ppm fluoride to a commercial sensitive toothpaste containing 2% potassium ion: An eight-week clinical study on Canadian adults. J Clin Dent 2009; 20 (1)(Spec Iss):10–16,
53. Docimo R, Montesani L, Maturo P, Costacurta M, Bartolino M, DeVizio W, Zhang YP, Cummins D, Dibart S, Mateo LR: Comparing the efficacy in reducing dentin hypersensitivity of a new toothpaste containing 8.0%arginine, calcium carbonate, and 1450 ppm fluoride to a commercial sensitive toothpaste containing 2% potassium ion: An eight-week clinical study in Rome, Italy. J Clin Dent 2009;20(1) (Spec Iss):17–22,
54. Ayad F,Ayad N,Delgado E, Zhang YP, DeVizio W, Cummins D, Mateo LR: Comparing the efficacy in providing instant relief of dentin hypersensitivity of a new toothpaste containing 8.0% arginine, calcium carbonate, and 1450 ppm fluoride to a benchmark desensitizing toothpaste containing 2% potassium ion and 1450 ppm fluoride, and to a control toothpaste with 1450 ppm fluoride: A three-day clinical study in Mississauga, Canada. J Clin Dent 2009; 20(4):115–122.
55. Schiff T, Delgado E, Zhang YP, DeVizio W, Cummins D, Mateo LR: The clinical effect of a single direct topical application of a dentifrice containing 8.0% arginine, calcium carbonate, and 1450 ppm fluoride on dentin hypersensitivity: The use of a cotton swab applicator versus the use of a fingertip. J Clin Dent 2009; 20(4):131–136
56. Almeida Barros J. Análisis de la influencia do calor residual na adesão dentinária após a irradiação com o laser de Er,Cr:YSGG.Dissertação apresentada como parte dos requisitos para obtenção do Grau de Mestre Profissional na área de Lasers em Odontologia São Paulo 2007. Consulta (abril 2010) Obtenible en http://www.ipen.br/ conteudo/ upload/ 200804171 106140.MPLO%20 Dissertacao %202007%20-%20 Juliana%20de%20 Almeida%20 Barros.pdf
57. Vázquez de León, Mora Pérez, Palenque Guillemí, Sexto Delgado, Cueto Hernández. Actualización sobre afecciones pulpares. Revista Electrónica de las Ciencias Médicas en Cienfuegos ISSN:1727-897X Medisur 2008; 6(3)
58. Flynn J, GallowayR, Orchordson R. The incidence of hypersensitive teeth in the west of Scotland. J Dent 2005; 13: 230-236
59. Stevens Y. Prevalencia de la hiperestesia dentinaria en el área de salud Policlínico Eduardo Mesa. 2006. Tesis para optar por el titulo de máster en Urgencias Estomatológicas.
60. Martín-Pero L, Buendía R. Revision de conceptos: Hipersensibilidad Dentinaria. Revista Higienistas. (On-line) colegio de profesional de higienistas dentales de la comunidad de Madrid. 2005 Obtenible en: http://www. revistahigienistas. com/02principios. asp (consulta mayo 2010)
61. Montes de Oca M. Estado gingival de los escolares de la escuela secundaria básica “Manuel Ascunce Domenech. Trabajo para optar por el primer grado en EGI. Facultad de Estomatología Santiago de Cuba 2008
62. Gillam DG, Aris A, Bulman JS, Newman HN, Ley F. Dentine hypersensitivity in subjects recruited for clinical trials: clinical evaluation, prevalence and intra-oral distribution. J Oral Rehabil. 2002 Mar;29(3):226-31.
63. Bamise CT, Olusile AO, Oginni AO, Dosumu OO. The prevalence of dentine hypersensitivity among adult patients attending a Nigerian teaching hospital. Oral Health Prev Dent. 2007;5(1):49-53.
64. Al-Wahadni A, Linden GJ. Dentine hypersensitiity in Jordanian dental attenders: A case control study. J Clin Periodontol 2002; 29: 688-693.
65. Chabansky MB, Gillam DG, Bulman JS. Clinical evaluation of cervical dentine sensitivity in a population of patients referred to a specialist Periodontology department: a pilot study. J Oral Rehabil 1997; 24: 666-672.
66. Chabansky MB, Gillam DG, Bulman JS, Newman HN. Prevalence of cervical dentine sensitivity in a population of patiens referred to a specialist Periodontology Departmet. J Clin Periodontol 1996; 23:989-992.
67. Sobral M; Carvalho R; Garone N. Prevalência de hipersensibilidade dentinária cervical / Prevalence of cervical dentine hypersensitivity. Rev. odontol. Univ. Säo Paulo; 9(3):177-81, jul.-set. 1995
68. Martinez j, Faus V, Faus J, Fernandez J, Mateos B. dentinal sensitivity: Concept and methodology for its objective evaluation. Med. Oral Patol Oral Cir Bucal, 2008 mar1, 13(3): 201-6
69. Walters P. dentin hypersensitivity: A review. The journal of contemporary dental practice, 2005 may, 6(2)
70. Rees JS. The prevalence of dentine hypersensitivity in general dental practice in the UK. J Clin Periodontol. 2000 Nov; 27(11):860-5.
71. Rees JS, Jin LJ, Lam S, Kudanowska I, Vowles R. The prevalence of dentine hypersensitivity in a hospital clinic population in Hong Kong. J Dent. 2003 Sep; 31(7):453-61.
72. Rees JS, Addy M. A cross-sectional study of buccal cervical sensitivity in UK general dental practice and summary review of prevalence studies. Int J Dent Hygiene 2004; (2): 64-69
73. Pashley DH. Mechanisms of dentine sensitivity. Dent Clin North Am 1990; 34: 449-473
74. Gillam DG, Seo JS, Bulman JS. Perceptions of dentine hypersensitivity in a general practice population. J Rehabil 1999; 26:710-714
75. Clayton DR, Mc Carthy D. A study of the prevalence and distribution of dentine sensitivity in a population of 17-58-year-old serving personnel on an RAF base in the Midlands. J Oral Rehabil 2002; 29: 14-23
76. Tufino J. Dolor en odontología (monografía). © Monografias.com S.A. 2005 (consulta enero 2010) obtenible en: http://www. monografias. com/trabajos 26/dolor-odontologia/ dolor-odontologia. shtml
77. Fernández Gerpe; Martín Reyes; Arias Herrera; Paz Latorre. Eficacia de la tintura de propóleo al 20% en el tratamiento de la hiperestesia dentinaria. Archivo Médico de Camagüey 2007; 11(5) Clínica Estomatológica Provincial Docente “Ismael Clark y Mascaró”. Camagüey.
78. Drisko CH: Oral hygiene and periodontal considerations in preventing and managing dentine hypersensitivity. Int Dent J 2007; 57:399–403.
79. Bamise CT, Olusile AO, Oginni AO An analysis of the etiological and predisposing factors related to dentin hypersensitivity. J Contemp Dent Pract. 2008 Jul 1; 9(5):52-9
80. Moynihan Paula J. The role of diet and nutrition in the etiology and prevention of oral diseases. Bull World Health Organ [serial on the Internet]. 2005 Sep [cited 2010 June 03]; 83(9): 694-699. Available from: http://www. scielosp. org/scielo. php?script=sci_ arttext&pid=S0042 -968620050 00900015 &lng=en. doi: 10. 1590/S0042-9 6862005 000900015.
81. DEL REA, Sara Irene, FAJARDO, Zuleida, SOLANO, Liseti et al. Patrón de consumo de alimentos en niños de una comunidad urbana al norte de Valencia, Venezuela. ALAN. [online]. sep. 2005, vol. 55, no. 3 [citado 08 Junio 2010], p. 279-286. Disponible en:
82. Pickles MJ, Hunter ML, Addy M, et al. The role of toothpastes and toothbrushes in the etiology of tooth wear. Int Dent J 2002; 52: 399 – 405