Las infecciones constituyen actualmente la principal amenaza vital en los pacientes tras una agresión térmica severa, siendo la principal causa de morbi-mortalidad de estos pacientes. La incidencia de infección en los pacientes quemados varía mucho de unas unidades de quemados a otras, y se halla claramente asociada al porcentaje de superficie corporal quemada (SCQ).
Se realizó un estudio retrospectivo de 107 pacientes ingresados en la unidad de quemados del Hospital Hermanos Ameijeiras en el período de Enero de 2006 hasta Diciembre 2008, con el diagnóstico de quemaduras, los que fueron estratificados según el porcentaje de Superficie corporal quemada. La morbilidad por sepsis fue del 24.3% en el total de la muestra y la mortalidad por sepsis de un 72%. Los gérmenes más frecuentes aislados fueron los gram negativos, el Acinetobacter sp, la Klebsiella Pneumoniae y la Pseudomona aeruginosa. El mapa epidemiológico de la unidad varió con respecto a años anteriores.
Caracterización de la Sepsis en la unidad de quemados del Hospital “Hermanos Ameijeiras”. Período 2006 – 2008.
Dra. Yamilé León Rodríguez. Especialista 1er Grado en Cirugía Plástica y caumatología
Dr. Rafael Rodríguez Garcell. Especialista 1er Grado en Cirugía Plástica y caumatología. Master en Enfermedades infecciosas.
RESUMEN:
Las infecciones constituyen actualmente la principal amenaza vital en los pacientes tras una agresión térmica severa, siendo la principal causa de morbi-mortalidad de estos pacientes. La incidencia de infección en los pacientes quemados varía mucho de unas unidades de quemados a otras, y se halla claramente asociada al porcentaje de superficie corporal quemada (SCQ).
Se realizó un estudio retrospectivo de 107 pacientes ingresados en la unidad de quemados del Hospital Hermanos Ameijeiras en el período de Enero de 2006 hasta Diciembre 2008, con el diagnóstico de quemaduras, los que fueron estratificados según el porcentaje de Superficie corporal quemada. La morbilidad por sepsis fue del 24.3% en el total de la muestra y la mortalidad por sepsis de un 72%. Los gérmenes más frecuentes aislados fueron los gram negativos, el Acinetobacter sp, la Klebsiella Pneumoniae y la Pseudomona aeruginosa. El mapa epidemiológico de la unidad varió con respecto a años anteriores.
ÍNDICE:
1. Introducción
2. Marco Teórico
3. Objetivos
4. Material y Método
5. Discusión y Resultados
6. Conclusiones
7. Recomendaciones
8. Bibliografía
9. Anexos
INTRODUCCIÓN:
Reciben el nombre de quemaduras las lesiones tisulares de origen térmico producidas por agentes físicos, químicos o biológicos que actúan con intensidad y persistencia suficientes como para producir dichas lesiones en un grado variable. Las quemaduras pueden producir distintos tipos de lesiones que van desde el eritema local, hasta la destrucción completa del organismo, dependiendo ello de la intensidad y persistencia del agente causal y su gravedad está determinada por la profundidad, extensión y localización. 1
Las lesiones por quemaduras producen respuestas tanto locales como sistémicas. Localmente existen las tres zonas descritas por Jackson en 1947. Primeramente una zona de coagulación que ocurre en el punto máximo de daño, en la cual hay una perdida irreversible del tejido debido a la coagulación de las proteínas constituyentes; luego encontramos la zona de éxtasis que es caracterizada por disminución de la perfusión tisular siendo potencialmente salvable con medidas adecuadas de cuidado y perfusión. Por último encontramos la zona de hiperemia en donde la perfusión se encuentra aumentada. Aquí el tejido es invariablemente recuperable a menos que la sepsis severa y la hipoperfusión prolongada contribuyan a su deterioro. 2
La liberación de citoquinas y otros mediadores inflamatorios en el sitio de la injuria producen un efecto sistémico en las quemaduras de más del 30 a 40% de superficie corporal quemada (SCQ). Desde el punto de vista cardiovascular hay incremento de la permeabilidad capilar, lo que lleva a la salida de proteínas intravasculares y fluidos al espacio intersticial; ocurre vasoconstricción esplácnica y periférica con deterioro de la contractilidad miocárdica posiblemente debida a la liberación del factor de necrosis tumoral α. Estos cambios, junto a la pérdida de fluidos desde la quemadura resultan en hipotensión sistémica e hipoperfusión de órganos.
A nivel pulmonar la liberación de mediadores causan broncoconstricción y síndrome de distrés respiratorio agudo en quemados graves.
El metabolismo basal incrementa hasta tres veces su estado original lo cual unido a la hipoperfusión esplácnica condicionan la necesidad de una agresiva alimentación enteral para disminuir el catabolismo y mantener la integridad intestinal. 2 Desde el punto de vista inmunológico se describen cambios no específicos de la inmunidad mediada por células y la humoral.
En 1923 Cumin escribió: “…Las quemaduras no constituyen una lesión simple. Se trata de una enfermedad muy complicada. La variación en gravedad se traduce en diversas afecciones que muestran caracteres definidos, resultados variables y complicaciones especiales”. 1
El impacto de una quemadura llega de súbito y en cuestión de minutos la vida de la persona cambia para siempre. La recuperación implica meses o años de agobiante trabajo por parte del paciente, de sus familiares y de los profesionales. Las lesiones por quemaduras se diferencian de las producidas en una operación quirúrgica habitual, porque estás últimas requieren menor tiempo de recuperación y suelen producir menos sufrimiento para el paciente.
Cuando las quemaduras son extensas, producen una de las más graves formas de estrés, de las que padecen los seres humanos. No hace mucho tiempo, las posibilidades de sobrevivir a una quemadura de gran importancia eran muy escasas, y la respuesta del organismo frente a esas quemaduras sólo en casos excepcionales era capaz de hacerle recuperar su integridad. Los progresos en el tratamiento inmediato del paciente quemado, el transporte y las técnicas de reanimación han reducido notablemente la mortalidad temprana. Sin embargo, estos progresos no han disminuido los índices de morbilidad y mortalidad que afectan a la población de los pacientes quemados en las etapas posteriores de su evolución. Se estima que la infección es la causa primaria, o al menos la que más contribuye, en el 75% de todas las muertes ocurridas en pacientes quemados. 2
Investigaciones recientes han demostrado que existe una relación directamente proporcional entre la extensión de la quemadura y la disfunción inmunológica. Además, la inmunosupresión que sigue a una quemadura grave se relaciona con la morbilidad y mortalidad de esos pacientes. La mayoría de ellos mueren debido a septicemias y sus complicaciones. 2
Las infecciones todavía son fuente son fuente primaria de morbilidad y mortalidad en pacientes quemados. Las lesiones por quemaduras alteran la barrea cutánea normal y, debido a que son lesiones de superficie, resultan potencialmente susceptibles a la colonización e infección por una multitud de microorganismos ambientales, los cuales coexisten normalmente con el ser humano. La microflora cutánea, por lo general de escasa densidad, cambia después de la lesión en hospitalizados con quemaduras predominan microorganismos nosocomiales más virulentos. Las quemaduras deterioran notablemente los mecanismos de defensa sistémicos del individuo; el daño de la respuesta inmunitaria se correlaciona con la profundidad y extensión de la quemadura; el paciente por lo tanto, permanece con particular vulnerabilidad a las infecciones microbianas de todo tipo, hasta que se presenta la cicatrización.
En 1833 Ballingall, refiriéndose a los pacientes con quemaduras extensas, que la muerte ocurría entre las 3 y 6 semanas de la quemadura con el individuo “... hundiéndose en un estado turbulento, agotado por el profuso exudado del material de una extensa superficie supurada". 3
Desde entonces el manejo de los pacientes con quemaduras ha evolucionado de tal manera que niños y adultos jóvenes pueden tener una sobre vida superior al 80% en quemaduras superiores ó iguales al 70% de la superficie corporal pero aun las infecciones constituyen actualmente la principal amenaza vital en los pacientes que superan la fase inicial de shock-resucitación tras una agresión térmica severa, siendo la principal causa de morbi-mortalidad de estos pacientes. Aunque clásicamente la herida cutánea ha sido el primer foco de sepsis, su importancia ha disminuido notablemente debido a significativos avances en el manejo de la herida (escarectomías e injertos precoces, antimicrobianos tópicos, vigilancia microbiológica agresiva, mejor uso de antibioticoterapia, etc.), emergiendo la infección pulmonar como foco séptico relevante y origen más frecuente de muerte por causa infecciosa. Son varios los factores que favorecen el desarrollo de infecciones en el paciente con quemaduras.
La agresión térmica destruye la primera y más importante barrera defensiva del organismo, la piel y las mucosas, perdiéndose su protección mecánica, bioquímica (ácidos grasos) e inmunológica (secreción de IgA). Se pierde la flora normal de piel y mucosas, abriendo paso a la colonización por gérmenes más virulentos. La perfusión en la escara y tejidos próximos es claramente insuficiente, dificultando la llegada de defensas humorales y celulares y de los antibióticos sistémicos; en éste sentido, la infección de la escara se comporta como un absceso.
La incidencia de infección en los pacientes quemados varía mucho de unas unidades de quemados a otras, y se halla claramente asociada al porcentaje de superficie corporal quemada (SCQ), así en pacientes con un porcentaje mayor del 30% ó 40%4,5, la infección es la norma, además la incidencia de infección también aumenta con las edades extremas de la vida, enfermedad concomitante, etc.
Se deprime la respuesta inmune sistémica, de forma proporcional a la severidad de la agresión. Ésta afecta a prácticamente todos los componentes del sistema inmunológico y se correlacionan con las complicaciones infecciosas y supervivencia de los quemados.
La infección de la herida por quemadura es de difícil interpretación, por ello debe ser monitorizado cualquier cambio que pueda reflejar infección. El margen del eritema frecuentemente supera el lugar de quemadura y por sí mismo no indica infección. Sí son indicativos los cambios de color, la aparición de eritema o edema violáceo en tejido normal circundante, la repentina separación de la escara respecto al tejido subcutáneo o la formación de nuevas escaras. La aparición de coloración verdosa sobre la herida o grasa subcutánea, o el desarrollo de ectima gangrenoso sugiere infección por P. aeruginosa. Cambios en la temperatura corporal, hipotensión, taquicardia, confusión mental, neutropenia o neutrofilia, trombocitopenia y fallo renal, nos están indicando desarrollo de sepsis. Sin embargo, y debido a la profunda alteración que ocurre en la homeostasis por la quemadura en sí misma y la propia inflamación subyacente, la apreciación de estos cambios es compleja. 6
Dada la dificultad de evaluar la herida por quemadura desde la base de la observación clínica y los datos de laboratorio, la biopsia es necesaria para el diagnóstico de infección. El momento de la toma de biopsias puede ser guiado por los propios cambios clínicos, pero muchos centros recomiendan tomarlas de forma rutinaria cada 48 horas. La muestra biopsiada debe ser examinada buscando evidencia histológica de invasión bacteriana, además de cuantificarla microbiológicamente por cultivo. 6
No debemos olvidar que los cultivos obtenidos a partir de frotis de superficie únicamente son reflejo de la presencia de microorganismos del ambiente hospitalario, nos indican colonización nosocomial, pero no son indicativos de etiología infecciosa. Aun así, los cultivos rutinarios de la herida y vía respiratoria son esenciales, ya que permiten conocer la flora que coloniza al enfermo y orientan la antibioterapia empírica precoz y efectiva cuando aparece la infección. El aislamiento del paciente con quemaduras se muestra como una medida eficaz en la prevención de las infecciones que sufre el paciente.
El aislamiento se muestra útil no solamente en la disminución de las infecciones, sobre todo por gérmenes gran negativos, sino también en el retardo en su aparición. También ha sido demostrada una disminución de la mortalidad de los pacientes quemados que fueron aislados durante su hospitalización en comparación a los que no estuvieron ingresados en camas aisladas.
La presencia de gérmenes de origen endógeno en la colonización bacteriana de la quemadura, sobre todo enterobacterias gran negativas, apoyan la idea de que la descontaminación digestiva selectiva puede ser útil en la disminución de las infecciones severas en pacientes críticos. Recientes estudios han demostrado la utilidad de esta técnica en pacientes quemados, por lo que la descontaminación selectiva del tracto digestivo debe ser considerada para la prevención de la infección en los pacientes con quemaduras graves.
No obstante, a pesar de adoptarse estrictas medidas de aislamiento, o descontaminación, no debe olvidarse que el paciente quemado está constantemente expuesto a multitud de gérmenes. El uso correcto de la antibioterapia en estos pacientes, gravemente inmunodeprimidos, es esencial. Ningún antibiótico puede eliminar a todos los potenciales patógenos, y el uso injustificado de antibioterapia de amplio espectro solo consigue seleccionar gérmenes multirresistentes y hongos. No existe una pauta antibiótica universalmente eficaz; la elección dependerá de la situación clínica, flora y patrones de sensibilidad prevalentes en la unidad en cada momento, así como de los gérmenes aislados previamente en el paciente. Los cultivos rutinarios de la herida y vía respiratoria son esenciales, ya que permiten conocer la flora que coloniza al enfermo y orientan la antibioterapia empírica precoz y efectiva cuando aparece la infección. 6
La antibioterapia profiláctica sistémica postquemadura está contraindicada, pues aumenta el riesgo de infecciones graves más precoces y por microorganismos resistentes. En principio, solo está indicada la profilaxis antibiótica perioperatoria en dos situaciones: Tras escarectomías y tras la realización de cierto tipo de injertos, pudiendo ser útil cefazolina/vancomicina asociada aminoglucósido (variable según la flora prevalente), la cual debe ser corta (una hora previa a la intervención y 2-3 dosis posteriormente) a fin de evitar resistencias. 6
Por último, diremos que la infección constituye la causa principal de muerte en el quemado (una vez excluido el síndrome de inhalación) lo que puede suponer del 50-75% de las muertes de pacientes quemados ocurridas en el hospital. 6
Utilizando como punto de partida la información presentada, y sirviéndonos de referencia estudios previamente publicados, pretendemos dar a conocer la incidencia de sepsis en nuestra unidad de quemados así como los principales gérmenes que la producen. Comparando estos resultados con el estudio anterior realizado en nuestro servicio, teniendo en cuenta que el mapa epidemiológico cambia de una unidad de quemados a otra y en el tiempo en la misma unidad.
MARCO TEÓRICO:
Las quemaduras son lesiones hísticas de variable extensión y profundidad, que representan un sitio susceptible de colonización oportunista por microorganismos de origen exógeno y endógeno. La destrucción de la piel permite la invasión bacteriana y constituye un medio de cultivo ideal para estos microorganismos 7,8,9. Con independencia de la etiología, la evolución, manejo terapéutico, y respuesta individual de cada organismo; la sepsis en sus distintas manifestaciones forma parte del cuadro fisiopatológico del gran quemado y constituye una de las complicaciones más graves que se puede presentar en este tipo de paciente. 10
Factores del quemado que influyen en el desarrollo de la infección:
En los pacientes quemados, se producen una serie de fenómenos que favorecen la infección. 11
Destrucción de las barreras mecánicas (piel y mucosas) a los microorganismos. Barreras que no sólo actúan mecánicamente, sino que también impiden o, dificultan la adherencia y multiplicación de los gérmenes, mediante descamación, emisión de ácidos grasos (que inhiben el crecimiento de los microorganismos, sobre todo si son Gram positivos), IgA secretoria, etc.
Destrucción de la flora residente (flora de nuestra piel y mucosas) que inhibe por competencia nutritiva, bacteriocinas, etc. la implantación de otra flora distinta.
Pérdidas proteicas. Estas barreras destruidas permiten pérdida de proteínas, anticuerpos, factores de coagulación, etc., y además, sus restos constituyen un buen caldo de cultivo de los microorganismos.
Disminución de inmunoglobulinas, aunque la más afectada es la IgG, bien por acumulación de ésta en él epitelio quemado tras su extravasación, bien por pérdida, etc. Además también están alteradas en su funcionalidad, con buena respuesta a unos antígenos, pero no a otros. 12
Disminución de fibronectina, glicoproteína que se encuentra en el plasma y en la matriz extracelular de muchos tejidos. Se comporta como opsonina frente a S. aureus y es necesaria para un adecuado funcionamiento reticuloendotelial. Es característico su descenso en estadios presépticos de estos pacientes.
Consumo de complemento, pues los productos de la quemadura activan la vía alternativa del complemento, produciendo una depleción de factores. Además, el sistema también funciona anormalmente. Por último, todo ello produce una disminución en la activación de los macrófagos. 13
Alteración de la inmunidad celular, como lo demuestran varios hechos:
Retraso en el rechazo de injertos, lo que puede aprovecharse para cubrir temporalmente la superficie quemada, con aloinjertos, a pesar de ser preferibles los homos o autoinjertos.
Reducción de la respuesta a diversos antígenos y a mitógenos.
Si bien el número de linfocitos T y B es normal, la relación T4/T8 está disminuida (inmunodepresión).
Se cree que toda la alteración funcional de los linfocitos se debe a productos derivados de la quemadura que circulan por el plasma (he aquí que se intente su eliminación por plasmaféresis).
Reducción y déficit funcional de las células fagocíticas: los neutrófilos están parcialmente desactivados, como demuestra la pérdida de granulaciones, déficit del quimiotactismo y motilidad, reducción de lisozima en los gránulos así como de la producción de peróxido de oxígeno y superóxido, disminución de la capacidad de agregación de los leucocitos, etc.
Todo esto aparece con mayor frecuencia en pacientes con superficie corporal quemada (SCQ) mayor del 40%7, aunque no se conoce bien el factor o factores presentes en el suero de los quemados que originan estos déficit. 14,15
Clasificación clínica y microbiológica de las infecciones en el paciente quemado
Es difícil al haber grandes diferencias en la superficie y profundidad de las quemaduras de distintos pacientes, así como en diversas zonas de un mismo paciente; además, a veces evolucionan peor zonas aparentemente sanas que otras con descarga de material purulento. Por último, las infecciones en quemados pueden proceder no de la quemadura, sino de las diversas instrumentaciones y manipulaciones necesarias para el tratamiento del paciente.
Aunque no hay un acuerdo unánime en las definiciones de las infecciones de estos pacientes, creemos que la clasificación de Mc Millan4 es útil y pedagógica.
Infección no invasiva de la quemadura: Suele ocurrir en gran parte de los quemados, en alguna zona de la superficie traumatizada. En general se trata de una sola bacteria, que a veces permite el crecimiento de otras bacterias u hongos en muy pequeño número. Esto puede diferenciar de la colonización de la quemadura, realizada generalmente por varias bacterias sin un claro predominio de ninguna. En nuestra experiencia 16 produce el 50-55% de las infecciones en «quemados críticos» y casi el 100% de las infecciones en «quemados no críticos».
La escara desvitalizada puede contener desde unas pocas potencias de 10, hasta 101° microorganismos por gramo de tejido, sin evidencia de invasión. Sin embargo, cuando esta infección local sobrepasa las defensas del sujeto, la infección se hace invasiva. Este gran número de bacterias sobre la escara origina (por los enzimas de degradación que producen) la hidrólisis de aquella. También puede dar síntomas sistémicos, si emiten toxinas que atraviesan el tejido de granulación y pasan a circulación general.
Los criterios de esta infección no invasiva, varían con la edad, tamaño y profundidad de la quemadura, pero, en general, se caracteriza por una rápida separación de la escara muerta o gran exudación de la zona quemada. Los recuentos bacterianos en biopsias de la escara son superiores a 105 gérmenes/gramo, mientras que las del tejido sano adyacente ofrecerán recuentos inferiores a dicha cifra. Los síntomas son moderados: picos bajos de fiebre y leucocitosis ligera sin desviación izquierda.
El control de esta infección hace que no progrese a la fase siguiente.
Infección invasiva de la quemadura sin bacteriemia: Se considera que existe invasión, cuando en biopsias del tejido sano contiguo a la quemadura, existen más de 105 bacterias/gramo (pudiendo llegar a 10'° ó 10' l). El estado clínico del paciente varía según el género y especie invasora. En general, el tejido de granulación está edematoso, pálido y evoluciona a seco, costroso y necrótico, en un enfermo que previamente había presentado un drenaje abundante por la quemadura (en esta evolución participan las trombosis de los vasos que irrigan la zona). Los picos febriles son abundantes y hay leucocitosis con desviación izquierda. En casos muy graves, la temperatura y los leucocitos pueden estar por debajo de la normalidad, el paciente responde cada vez menos y puede llegar al shock séptico.
Todo este cuadro clínico ocurre sin confirmación de microorganismos en sangre, y puede deberse a la difusión de toxinas desde las bacterias 18. Esta infección requiere un vigoroso tratamiento, pues muchas veces conduce a septicemia, siendo difícil separar ambos tipos de infección, pues no siempre que existe bacteriemia puede confirmarse esta bacteriológicamente, como referiremos en el punto siguiente.
Infección invasiva con bacteriemia y bacteriemias de otra etiología: Puede originarse desde una escara colonizada (vía linfática) o tras una infección invasiva. También las bacterias pueden alcanzar directamente los vasos por instrumentación, etc., realizada en la zona quemada o en una adyacente. En nuestra experiencia 16 estas infecciones suponen el 30-35% de todas las detectadas en nuestros pacientes críticos, y son prácticamente inexistentes en quemados no críticos.
La clínica es similar a la de la infección invasiva sin bacteriemia pero con hemocultivos positivos. Para su diagnóstico deben realizarse hemocultivos seriados en los picos febriles, y a pesar de todo, no siempre se pueden recuperar los patógenos, pero suele haber una correlación entre hemocultivo positivo y clínica de sepsis.
Otras infecciones: Son menos frecuentes. En nuestra unidad constituyen el 1520% del total de las infecciones. 16
4.1.-Infección respiratoria: Al mejorar la terapia y por ende la supervivencia de los quemados, da tiempo a que se manifiesten los problemas respiratorios, sobre todo los derivados de inhalación 18, de ahí que se observen dichos problemas con creciente frecuencia.
En estos pacientes (aún sin síndrome de inhalación) hay en primer lugar una hiperventilación que posteriormente evoluciona a hipoventilación, originando atelectasias y, a veces, bronconeumonías 8, a lo que contribuye la menor movilidad de la caja torácica, descenso de la función mucociliar y destrucción de las vías aéreas. En la inhalación, además de lo anterior, contribuyen a la obstrucción, los productos de ésta.
No hay que olvidar que otro origen de la infección pulmonar puede ser una tromboflebitis infectada 19 que produce una diseminación hematógena de microorganismos.
4.2.- Tromboflebitis infectada: Puede constituir hasta el 5% de las infecciones 17, con gran mortalidad. Puede producirse en los vasos traumatizados por el calor, electricidad, etc., o bien, a partir del lugar de perfusión de líquidos intravenosos, si no se toman las medidas adecuadas 20,21.
4.3.- Endocarditis: En hemocultivos positivos reiterados sin otra fuente (venosa o en zona quemada), o bien modificación de los ruidos cardíacos. Una- eco cardiografía puede confirmar el diagnóstico. 5
4.4.- Polimiositis: En quemados de origen eléctrico (estos pacientes también pueden tener infecciones secundarias en vísceras dañadas por el trauma eléctrico).
4.5.- Condritis supurativa: Sobre todo el cartílago auricular. El reblandecimiento y asimetría del cartílago de la oreja quemada sugieren el diagnóstico. Si no se detiene la infección puede progresar a mastoides y producir absceso intracraneal. 6
4.6.- Infección ocular: Si hay ulceración o perforación de la córnea, pueden infectarse con mucha facilidad. 6
Patógenos: evolución y tipo:
Evolución:
En la época preantibiótica, el mayor agente patógeno en estos pacientes era el Streptococcus B-hemolítico grupo A (o S. pyogenes). A partir de 1945, con el uso de la penicilina, desaparece como patógeno principal.
Después (años 50), S. aureus y bacilos Gram negativos son los que producen la mayor parte de las infecciones en quemados, y más, tras el tratamiento con sulfamidas. El S. aureus podía recuperarse hasta del 75% de los pacientes que morían de septicemia.
En la década de los 60, Pseudomonas aeruginosa se convierte en el patógeno principal de las quemaduras, desplazando a los gérmenes más prevalentes en la década anterior, fruto de la selección originada por los antibióticos de amplio espectro.
A las Pseudomonas se unen en la siguiente década, S. aureus meticilinresistentes, Cándida y hongos ambientales (mucor, Aspergillus). También se observan infecciones por virus como herpes virus. Todo ello se debe a una mayor presión antibiótica.
En la actualidad, por último, tenemos como principales agentes patógenos Pseudomona aeruginosa (muchas veces polirresistente), S. aureus meticilinresistentes, enterococos, enterobacterias con gran resistencia a antibióticos y hongos, sobre todo del género Cándida; todos estos microorganismos suelen aislarse más, tras terapias prolongadas o con antibióticos de amplio espectro.
Principales tipos de agentes patógenos
S. pyogenes:
Su incidencia es muy reducida en la actualidad. Sin embargo es un microorganismo muy transmisible y puede originar infecciones letales.
El principal factor predisponente es que el propio enfermo sea portador orofaríngeo de S. pyogenes. De aquí que lo más frecuente es que se tenga endemias y no epidemias (asociadas estas a portadores entre el personal sanitario).
La clínica consiste en un rápido deterioro de la quemadura, con dolor, enrojecimiento, induración e inflamación. Aparece un borde rojo, que se extiende desde el margen de la quemadura e invade tejido normal. A las pocas horas comienza con síntomas sistémicos: fiebre alta, taquicardia, leucocitosis con desviación izquierda (aunque todo esto ocurre en situación preterminal).
S. aureus:
Originan pocas septicemias (1% según Mc Manus). S. aureus es un microorganismo de virulencia moderada pero fácil transmisión, por lo que puede infectar o colonizar gran número de enfermos, e incluso sobrevive mucho tiempo en los fómites (por lo que estos pueden ser vehículo de infección). Sin embargo, la principal vía de transmisión cruzada es a través de las manos del personal sanitario. Por otra parte, también el personal sanitario puede ser fuente de S. aureus-que infecte á enfermos. Pero,-en general, las infecciones endógenas, en las que el paciente se autoinfecta con su propia flora, son mucho más importantes, por su frecuencia, que las cruzadas.
La clínica de infección de la quemadura por S. aureus es insidiosa, excepto si se trata de infección invasiva, produciendo rápida disolución del tejido de granulación, fiebre, leucocitosis, desorientación severa y a veces, íleo paralítico. Puede sobrevenir shock, pero no siempre es de etiología infecciosa en este tipo de enfermos.
Un factor importante que predispone a la infección por estas bacterias es la deficiente función antiestafilocócica de los neutrófilos del paciente quemado, y más en pacientes con superficie corporal quemada (SCQ) mayor del 30%4.
Pseudomona aeruginosa:
No es un germen con gran patogenicidad, pero por la posibilidad de crecer en cualquier zona húmeda, con sólo trazas de materia orgánica, y su gran resistencia a antibióticos, se convierte en un patógeno oportunista típico, que infecta a quemados, sobre todo en la fase de inmunosupresión. Los factores predisponentes a estas infecciones desde el punto de vista inmunológico son: anormalidad en la función de los neutrófilos, déficit de opsoninas y consumo del complemento (que suele ocurrir en las quemaduras y más si están muy colonizadas por Pseudomonas). Además de la gran capacidad de supervivencia, ya comentada, este microorganismo produce un gran número de factores patógenos (exotoxinas, endotoxinas, estearasas, factores de difusión, leucocidinas, proteasas, etc.) por lo cual, si producen infección invasiva, ésta puede ser devastadora.
La fuente de Pseudomonas aeruginosa suele ser el tracto gastrointestinal de los propios enfermos. También pueden aislarse Pseudomonas del entorno del quemado, pero, en general, estas cepas son distintas de las que han originado infecciones en la unidad 4. Pero hay dos fómites que pueden participar como vehículos de infecciones cruzadas (e incluso como reservorio de Pseudomonas): el equipo de hidroterapia y el respirador. Se evita añadiendo lejía tras el baño de cada enfermo, en el primer caso, y con desinfección y reposición diaria de tubuladuras y limpieza y llenado diario del frasco humidificador 21. Si exceptuamos los dos fómites comentados, la vía general de transmisión cruzada de estos gérmenes son las manos del personal sanitario.
La clínica típica de infección de quemadura por Pseudomonas consiste en el desarrollo en aquella de un pigmento verde, con descarga de material purulento durante 2-3 días. Después, la escara se seca y la infección avanza al tejido de granulación previamente sano, donde también origina exudación verdosa. Tras esto, se decolora y aparecen áreas de necrosis. En zonas alejadas de la quemadura infectada pueden desarrollarse áreas necróticas (estigma gangrenoso), que indican septicemia. En todo este proceso, la temperatura es normal o incluso subnormal, y el paciente está bien orientado hasta el estadio terminal.
Otros Gram negativos:
Según Mc Manus4, producen el 16% de las infecciones invasivas, aunque, en general, no son muy patógenos, por lo que para originar infección, el sujeto debe estar en inmunosupresión, difundiendo desde su hábitat normal (tubo digestivo) tras una selección por terapia antibiótica.
La difusión entre enfermos se hace preponderantemente por las manos del personal sanitario, aunque pueden colaborar algunos fómites como el equipo de hidroterapia mal desinfectado.
Los factores favorecedores de infección son similares a los de las Pseudomonas: un déficit funcional en los neutrófilos, anticuerpos y complemento.
La clínica consiste en un deterioro del tejido de granulación que sé hace edematoso y pálido; si la infección se difunde a sangre, aparece gran aumento de temperatura y leucocitosis. En estadios terminales puede observarse lo contrario: leucopenia e hipotermia.
Anaerobios:
Poco frecuentes, se observan más frecuentemente en quemados de origen eléctrico.
Hongos:
Producen el 10-15% de las infecciones 16 y éstas se han distribuido de forma similar entre quemaduras y septicemias: Como refiere Mc Millan23 originan con bastante frecuencia infecciones invasivas (20%).
Los factores predisponentes principales de la infección fúngica son la inmunosupresión (sobre todo en linfocitos T4) y la terapia prolongada con antibióticos, y más, si son de amplio espectro, pues en el intestino suprimen la flora normal y permiten un sobrecrecimiento de levaduras. Otros hongos como Mucor, Aspergillus, etc., tienen origen ambiental, y si bien son muy poco frecuentes, cuando originan infección ésta es muy grave.
Las septicemias pueden originarse bien en la quemadura, desde la que invade el tejido sano y por ende los vasos sanguíneos, bien desde el tubo digestivo sobrecolonizado por estos microorganismos.
La invasión de hongos desde la quemadura se diagnostica por visualización de las hifas en biopsias del tejido sano adyacente.
La clínica es poco llamativa, sin modificación de la temperatura ni leucocitosis. Sólo se sospecha, al ver un tejido de granulación seca, plana y de color amarillento o naranja.
Virus:
Se han descrito herpesvirus y citomegalovirus, como en otros inmunodeprimidos, pero su significado patogénico real no se conoce 4. La mayoría de estas infecciones son autolimitadas y desaparecen en 7-10 días. 6
A partir de 1992, un grupo de expertos 24, con el fin de unificar criterios clínicos y de investigación, definió los procesos patológicos relacionados con la respuesta inflamatoria del organismo a la invasión bacteriana o a la agresión por diferentes noxas. Se definen pacientes en varios estadios de infección, bacteriemia, sepsis, sepsis severa, choque séptico y con Síndrome de Disfunción Orgánica múltiple (SDOM).Se propone un nuevo término: Síndrome de Respuesta Inflamatoria Sistémica, para describir un estado de inflamación generalizada que ocurre a consecuencia de una amplia variedad de agresiones (bacterianas o no),tanto exógenos como endógenas al organismo humano.
El Síndrome de Respuesta Inflamatoria Sistémica (SIRS) por sus siglas en inglés. Expresa clínicamente, la presencia de una Inflamación Endotelial Sistémica Generalizada, independientemente de la causa que la produce, cursa implícitamente con alteraciones y sintomatología locales y a distancia. Los criterios que se incluyen en el síndrome, son signos comunes a muchos padecimientos críticos.
El Síndrome de Respuesta Inflamatoria Sistémica (SIRS) se identifica clínicamente, por tres o más de las condiciones siguientes:
1. Fiebre o hipotermia: Temperatura = o > de 38°C o = o < de 36°C.
2. Taquicardia: Frecuencia cardiaca = o >de 90/min.
3. Taquipnea: Frecuencia Respiratoria =o > de 20/min o PaCO2 < de 32.
4. Conteo de leucocitos: Leucocitos = o > de 12,000 o < de 4,000 o > 10% de "bandas", en la cuenta diferencial.
Se define como Sepsis a la respuesta sistémica a la infección, o en otras palabras, como aquel Síndrome de Respuesta Inflamatoria Sistémica que resulta como consecuencia de un proceso infeccioso demostrado. Y se definen además los distintos estadios:
INFECCIÓN: Proceso inflamatorio originado en la presencia de gérmenes o por la invasión de los mismos a tejidos, normalmente estériles.
BACTERIEMIA: Presencia de microorganismos viables en el torrente sanguíneo. Puede equipararse a la presencia de virus (viremia), hongos (funguemia).
SEPSIS: Síndrome de Respuesta Inflamatoria Sistémica originado por un proceso infeccioso.
CRITERIOS DE SEPSIS: Un foco infeccioso probable más 3 criterios de Síndrome de Respuesta Inflamatoria Sistémica (SIRS).
SEPSIS SEVERA: Criterios de Sepsis más Hipotensión (PAS < 90 mmHg).
SHOCK SÉPTICO: Criterios de Sepsis más uno de los siguientes:
Hipotensión persistente a pesar de administración de líquidos e inotrópicos.
Hipoperfusión (Oliguria, alteraciones del sensorio o acidosis láctica)
Síndrome de disfunción orgánica:
PRIMARIA: Cuando la agresión inicial ocasiona alteración en la función de un órgano.
SECUNDARIA: Cuando la alteración en la función de un órgano no puede atribuirse a la agresión inicial y se considera consecuencia del Síndrome de Respuesta Inflamatoria Sistémica (SIRS) o de la Sepsis.
La utilización de tales definiciones introduce una evolución progresiva de la gravedad en la sepsis entendida desde la infección como primer eslabón, hasta el shock séptico como el último y definitivo. Esta idea queda de manifiesto al comprobar una creciente coexistencia de eventos que comprometen la vida del enfermo (hemocultivos positivos, síndrome de distrés respiratorio del adulto, coagulación intravascular diseminada, insuficiencia renal), conforme avanzamos en el espectro de definiciones. 25 No cabe duda acerca del esfuerzo empleado por la Conferencia de Consenso del ACCP/SCCM para armonizar criterios, y permitir así, acabar con la lacra que ha caracterizado a las diferentes publicaciones médicas vertidas para evaluar el efecto de diversas medidas terapéuticas aplicadas en la sepsis y el shock séptico la falta de definición en la selección de grupos homogéneos de pacientes y por ella, concluir grandes diferencias de mortalidad (10-90%) en sus resultados. 26
No obstante, este problema semántico no parece todavía estar del todo resuelto y desde luego siguen surgiendo voces críticas que claman la necesidad de precisar todavía más el contexto clínico que envuelve al paciente con una sepsis. 27-31 En efecto, según tales voces, las definiciones propuestas por la Conferencia de Consenso de la ACCP/SCCM adolecen de ser todavía demasiado amplias. Así, si para definir Síndrome de Respuesta Inflamatoria Sistémica (SIRS) bastan dos criterios, cualquier paciente ingresado en la UCI presentaría tal patología al presentar una taquipnea superior a 20 respiraciones por minuto y una taquicardia de más de 90 latidos por minuto.
En este sentido, en un estudio publicado en el año 199532 de 3708 pacientes ingresados en tres UCIS y en tres plantas de hospitalización general, 2527 (68%) cumplían criterios de Síndrome de Respuesta Inflamatoria Sistémica (SIRS) y posiblemente, por tanto, se cometería un error al seleccionar a un grupo de población sin el suficiente riesgo para que se incluyan en estudios sobre sepsis.
Las conclusiones aportadas por un nuevo Consenso sobre sepsis, esta vez Europeo, y publicadas en 1994, pretendieron matizar más aún las definiciones aportadas tres años atrás por los norteamericanos y establecer con ello criterios más rigurosos en la selección de los pacientes que fueran a ser incluidos en los futuros ensayos clínicos destinados a evaluar las novedades terapéuticas en el shock séptico. 32
La sepsis es un fenómeno que comienza con la infección protagonizada por un microorganismo que invade al huésped atravesando sus barreras epiteliales (piel o mucosas). Antes de que los antibióticos se prodigasen, los microorganismos más frecuentes eran los gram positivos, especialmente el Streptococcus pyogenes y el Staphylococcus áureas. Sin embargo, con la introducción paulatina de los antibióticos de amplio espectro los microorganismos gram negativos (Escherichia coli, Klebsiella, Enterobacter, Proteus y Pseudomonas aeruginosa) fueron protagonizando la mayoría de las infecciones causantes de sepsis.
En el momento actual, por la aparición de cepas de estafilococos resistentes a antibióticos, la incidencia de sepsis causada por ambos tipos de gérmenes parece haberse igualado en la mayoría de los hospitales. La sepsis y el shock séptico, por último, también pueden ser causados por virus, hongos, Rickettsias, protozoos o metazoos 33. Si la respuesta inflamatoria del huésped es adecuada la infección se controla y los microorganismos o sus toxinas son eliminados o neutralizados. Sin embargo, si la respuesta es localmente insuficiente, ésta se perpetúa por mecanismos moleculares que la tornan excesiva o incontrolada y acaban afectándose órganos distantes del foco infeccioso inicial.
Estos mecanismos moleculares que, teóricamente, deberían tener finalidad defensiva, ponen de manifiesto la imperfección de un sistema inmunitario que en determinadas circunstancias se vuelve contra uno mismo de forma suicida 34. El sistema inmunitario opera con elementos celulares que interactúan entre sí utilizando mediadores y receptores químicos. Una de las familias de mediadores mejor conocidas son las citoquinas proinflamatorias (Factor de necrosis tumoral [TNF], Interleucina-1 [IL-1], Interleucina-6 [IL-6]), las cuales son liberadas a la circulación sanguínea y causan la activación de varias células, como neutrófilos, monocitos, macrófagos, plaquetas y células endoteliales. Así mismo, son también responsables de la activación de las cascadas proteicas plasmáticas: coagulación, fibrinolisis, complemento y calicreína-quinina; de mediadores lipídicos: eicosanoides (metabolitos del Ácido araquidónico) y Factor activador de plaquetas (PAF); y por fin, de radicales de oxígeno y óxido nítrico.
Pronto se comprobó que, de forma simultánea, en esta respuesta orgánica también se producían citoquinas antiinflamatorias (Interleucina- 10 [IL-10]), antagonistas de citoquinas (antagonista del receptor de la IL-1 [IL-1Ra] y receptores solubles del TNF [sTNF-R]).35,36
Consecuentemente, es importante acabar desterrando ideas pasadas que concebían la presencia de los microorganismos en la sangre como la principal causante de la morbimortalidad en la sepsis. 37 Nadas más lejos de la realidad. Hoy día se sabe que la infección por sí misma no es la causa de las repercusiones sistémicas, sino que es la propia respuesta del organismo a la infección la que origina la mayoría de los problemas del paciente.
Desde un punto de vista fisiopatológico, la pregunta que cabe realizarse es cómo se interpreta una respuesta orgánica en la que se comprueba la presencia de elementos moleculares de signos contrarios: citoquinas proinflamatorias y antiinflamatorias. La teoría esgrimida por R.C. Bone38 pretende aclarar la incógnita suscitada: la respuesta proinflamatoria intensa contribuye al inicio y al mantenimiento de la sepsis, pero también se produce una respuesta compensatoria antiinflamatoria que pretende restaurar la homeostasis. Cuando se produce una excesiva cantidad de mediadores proinflamatorios que apocan la respuesta antiinflamatoria el resultado sería una progresiva respuesta inflamatoria sistémica con fracaso multiorgánico. Por el contrario, una respuesta antiinflamatoria excesiva causaría inmunosupresión, que también sería considerada causa de fallo multiorgánico. Por lo expuesto, parece que el fracaso terapéutico estriba en la enorme dificultad que conlleva el equilibrio inmunológico entre dos fuerzas de sentido contrario que son estimuladas al mismo tiempo por un agente exógeno al individuo 9.
Estudiaremos a continuación, y de forma detallada, los diferentes mediadores, exógenos y endógenos, implicados en los mecanismos fisiopatogénicos de la sepsis y el shock séptico.
MEDIADORES EXÓGENOS
Endotoxina
La endotoxina o lipopolisacárido (LPS) es un componente estructural de la membrana externa de las bacterias gram negativas y es el factor microbiano, entre los que activan la respuesta inflamatoria, mejor caracterizado y estudiado, considerándosele el mediador exógeno más importante del shock séptico. 40-42 Estructuralmente está formada por dos dominios químicamente diferentes, uno hidrofílico (antígeno 0 y núcleo central) y otro hidrofóbico (lípido A). Este último, de composición semejante en todas las enterobacterias, es el principal responsable de la toxicidad del LPS 43.
Cuando la endotoxina es inyectada en animales de experimentación, provoca un estado muy parecido al del shock séptico, con hipotensión y disfunción orgánica. Este trastorno en la homeostasis hemodinámica está relacionado, en gran parte, con la liberación masiva de una amplia variedad de mediadores endógenos merced a la capacidad que tiene el LPS para unirse y activar diferentes tipos celulares (macrófagos, células endoteliales y plaquetas) y sistemas enzimáticos del medio extracelular (sistema del complemento, cascada de la coagulación y el sistema kalicreína-cinina)44. Más detalladamente, el LPS se puede unir a varias moléculas de superficie de células de mamíferos pero la única proteína de unión que le permite efectuar una señal funcional patológica en las células es CD14 que se expresa en monocitos, macrófagos, granulocitos y con menor intensidad en linfocitos B.45
En el plasma, el LPS puede unirse a proteínas como la proteína enlazante de LPS (LBP), formando un complejo que favorece y aumenta la sensibilidad del receptor CD14 al LPS.46 El resultado de la interacción LPS-receptor CD14 potencia la fosforilación y activación de quinasas intracelulares, en concreto, proteína tiroxina quinasas (PTK) y MAP quinasa, del inglés, Mytogen Activated Protein quinasa. Las quinasas activadas modulan la expresión genética de la célula incrementando, en este caso, los niveles de ARN mensajero que codifican proteínas tales como las citoquinas, receptores de citoquinas, moléculas de adhesión, proteínas de fase aguda, factor tisular o la enzima sintasa NO (Óxido Nítrico) inducible. 47,48 Es decir, como resultado final se obtiene la liberación de mediadores que activan, intensifican y perpetúan la respuesta inflamatoria que de esta forma, puede volverse incontrolada.
Además de activar a monocitos, granulocitos y linfocitos B, LPS también estimula células CD14 negativas, como son las células endoteliales y los fibroblastos. Este efecto parece ser mediado por CD14 soluble que es liberado por los monolitos en dos formas: alfa y beta. Estas dos formas solubles de receptor permiten una función activadora a distancia.
Exotoxinas:
Los microorganismos habitualmente implicados en la secreción de exotoxinas con capacidad de provocar síndromes de hipotensión y de shock son el Staphyilococcus áureas (síndrome del shock tóxico provocado por la exotoxina TSST-1) y el Streptococcus pyogenes (exotoxina A). Las exotoxinas de ambos pertenecen al grupo de los superantígenos, dotados de una gran capacidad de estimulación del sistema inmunitario induciendo una importante proliferación no específica de linfocitos T y producción de citoquinas. 49
Peptidoglicanos:
Son compuestos elementales de la pared celular de todas las bacterias. La infusión de peptidoglicanos en animales de experimentación induce fiebre y cambios hemodinámicos comparables a los inducidos por la endotoxina, aunque de menor intensidad.
MEDIADORES ENDÓGENOS
Sistema del complemento:
La activación del sistema del complemento en el shock séptico puede ser producida por LPS, por lesión directa extensa de los tejidos blandos, o por interacción con el sistema de coagulación (conversión de C1 a C1 activado por el factor Hageman activado) o con los sistemas fibrinolíticos (conversión de C1 a C1 activado por plasmina). La activación del complemento es importante, porque aumenta la permeabilidad del endotelio y produce la degranulación de los mastocitos con liberación de sustancias vasodilatadores (acciones mediadas por las anafilotoxinas C3a y C5a). Así mismo C5a es un potente quimioatrayente estimulando la migración, adherencia y agregación de las células polimorfonucleares con lo que potencia a los neutrófilos en su lesión oxidativa y proteolítica del endotelio.
Sistema de la coagulación:
La sepsis se acompaña frecuentemente de coagulación intravascular diseminada (CID).36 La consecuencia de este acontecimiento fisiopatológico sin freno puede ser fatal por el acumulo de microtrombos en la microcirculación de cualquier órgano, que impiden la normal circulación de la sangre y el normal intercambio de oxígeno y nutrientes. En su patogenia concurren. 50,51
a) Un aumento de la activación de la coagulación,
b) Una depresión de los mecanismos inhibidores de la coagulación.
c) Una inhibición del sistema fibrinolítico.
La cascada de la coagulación se activa, bien por la vía extrínseca, por medio del factor tisular producido por fagocitos mononucleares y las células endoteliales, o bien por la vía intrínseca, al activar el LPS directamente al factor H a g e m a n. Las alteraciones de la función de los mecanismos inhibidores de la coagulación se atribuyen a la disminución de antitrombina III (AT-III) y a la inhibición del sistema proteína C-proteína S. AT-III es rápidamente consumido por la progresiva formación de trombina. La proteína C se activa mediante la formación de un complejo con trombina, trombomodulina, una proteína endotelial, y proteína S. En la sepsis, el TNF inhibe la síntesis de trombomodulina endotelial, por lo que disminuye la actividad antitrombogénica de la proteína C 52. La inhibición del sistema fibrinolítico se debe al incremento en la concentración plasmática del inhibidor del plasminógeno activado tipo I (PAI-1), acontecimiento observado a la hora de la administración de LPS.
En la sepsis se produce un estado de máxima sensibilización de las plaquetas, responsable de que éstas expresen en su superficie moléculas de adhesión 53, que desempeñan una función fundamental en la agregación de las plaquetas entre sí y en su adhesión al endotelio vascular y a los neutrófilos.
Estos conglomerados son retenidos en la microcirculación y agravan la perfusión de los órganos. Esta sensibilidad plaquetaria viene mediada por sustancias inflamatorias de fase aguda, como fibrinógeno, derivado de proteína C reactiva, complemento e IL-6.
En la agregación plaquetaria al endotelio también participa activamente el endotelio mediante la expresión de endotelina-1 (ET-1).54 ET-1 induce la liberación de factor Von Willebrand por las células endoteliales que contribuye a la adherencia de la plaqueta al endotelio. Además ET-1 estimula la actividad fosfolipasa y la liberación de Tromboxano A2, conocido factor por favorecer la vasoconstricción y la agregación plaquetaria.
Así mismo en la sepsis se produce el factor activador plaquetario (PAF), fosfolípido producido por numerosas células como macrófagos, neutrófilos, plaquetas y células endoteliales en respuesta a diferentes estímulos tanto inmunológicos como no inmunológicos. Entre sus efectos se citan la inducción de agregación plaquetaria y trombosis intravascular.
Sistema Kalicreína–cinina:
La activación del sistema de contacto de la coagulación (vía intrínseca de la coagulación, mediada por el LPS al activar al factor XII de Hageman) genera bradicinina a partir de cininógeno. La bradicinina es un potente hipotensor, acción mediada por el óxido nítrico y la prostaciclina liberados por el endotelio vascular, inducido por la bradicinina.
Metabolitos del ácido araquidónico:
El LPS estimula la capacidad de los macrófagos para producir metabolitos del ácido araquidónico 55, genéricamente denominados eicosanoides, bien por la vía de la ciclooxigenasa sintetizándose las diferentes prostaglandinas (PG) y tromboxanos (TX), bien por la vía de la lipooxigenasa produciéndose los leucotrienos (LT). Este efecto podría estar mediado por la activación directa de la fosfolipasa de membrana por parte del TNF-alfa. Como mecanismo de retroalimentación, estos eicosanoides han demostrado in vitro su capacidad de modular la producción de citoquinas, así como alguno de los efectos de dichas sustancias sobre las células diana. 34
Los principales eicosanoides hoy día implicados en la mediación de los efectos de la endotoxina son el Tromboxano A2 (TXA2), la prostaciclina (PGI2), la prostaglandina E2 (PGE2) y el leucotrieno B4 (LTB4).
Citoquinas: cuando se descubrió en 1985 que una citoquina, TNF-alfa, producía los mismo síntomas que la endotoxemia, esto es, fiebre, hipotensión arterial, acidosis metabólica, hipertrigliceridemia y taquicardia la investigación se polarizó hacia el estudio de las citoquinas como mediadores centrales en las consecuencias deletéreas de la infección. 56,57 Según mencionamos anteriormente, en la infección incontrolada que ocasiona una sepsis existe una liberación simultánea de citoquinas de signos contrapuestos: proinflamatorias y antiinflamatorias. Es, precisamente, la falta de equilibrio en la secreción de las mismas el detonante, si no se detiene a tiempo, que conduce a los dos grandes trastornos hemodinámicas precursores del fallo irreversible en cadena de todos los órganos de la economía: el fallo cardíaco como bomba y la alteración de la microcirculación. Las citoquinas proinflamatorias TNF-alfa e IL-1 son los principales mediadores endógenos de la sepsis. 58,59 Ambas citoquinas tienen diferente estructura y receptores aunque sus actividades biológicas se superponen y son sinérgicas. El TNF-alfa es secretado mayoritariamente por los macrófagos estimulados por la endotoxina, si bien también puede ser sintetizado por otras células como monocitos, mastocitos, células Kupffer, astrocitos, estimulados, no sólo por la endotoxina sino también por exotoxinas, virus, antígenos de hongos y parásitos, fracción C5a del complemento y complejos antígeno anticuerpo. Existen dos formas de IL-1: alfa y beta, que se unen a los mismos receptores y tienen idénticos efectos biológicos. La forma alfa rara vez se encuentra en los líquidos corporales en forma soluble, al contrario que la forma beta. En la sepsis la forma beta alcanza elevadas concentraciones plasmáticas, aunque por lo regular son inferiores a las que alcanza el factor TNF-alfa.
Una propiedad fundamental de estas citoquinas proinflamatorias es inducir en las células que activan la expresión de una variedad de genes que implican a la microcirculación y al ambiente tisular más próximo. 33 Es decir, “genes inflamatorios”, cuya activación traduce la síntesis de otros miembros de la familia de las citoquinas y la síntesis de enzimas encargadas, a su vez, de la regulación de mediadores inflamatorios de pequeño peso molecular. Tales mediadores son las prostaglandinas, los leucotrienos y el óxido nítrico.
En este sentido, la IL-1 y el TNF-alfa son potentes inductores de la expresión genética que codifica la síntesis de fosfolipasa A2 tipo 2 y la ciclooxigenasa-2, enzimas, ambas, determinantes en la síntesis de prostaglandinas y leucotrienos. 47 Ensayos clínicos con humanos en los que se administró dosis reducidas de IL-1 y TNF-alfa advirtieron que éstos experimentaban fiebre, dolores de cabeza y artromialgias, síntomas que se desvanecían con la administración de un antiinflamatorio inhibidor de la ciclooxigenasa. 60 Adicionalmente, la IL-1 y el TNFalfa son potentes inductores de la expresión genética que codifica la síntesis de sintasa NO inducible, con el correspondiente aumento en la producción endotelial de NO, máximo responsable de la hipotensión vascular que acontece en la sepsis. 61-63
La IL-6, también citoquina proinflamatoria, aumenta en el plasma de los pacientes con sepsis y sus concentraciones más elevadas se encuentran en los casos de shock séptico. 64 Curiosamente, sí existe una correlación entre la severidad del cuadro clínico de la sepsis y el nivel de esta citoquina en la sangre; dato, que no se aprecia al considerar los niveles de TNF-alfa e IL-1.
Resulta contradictorio el papel de esta citoquina, cuyos niveles en plasma son proporcionales a la severidad del cuadro clínico, pero cuyas funciones biológicas no parecen dotarla de un papel primordial en la activación de la respuesta inflamatoria. Así, se observa “in vitro” que lejos de potenciar la síntesis de PGD, la frena mediante la supresión de la expresión genética celular de la ciclooxigenasa. 65-67
En conclusión, a pesar del aparente efecto beneficioso de la IL-6 frenando la síntesis de mediadores intermedios de la inflamación, ¿cómo es posible que sea la citoquina cuyos niveles sanguíneos elevados se relacionan de una forma más directa con la gravedad del cuadro? Sin duda, nos encontramos ante un dilema pendiente de solución.
El aumento de la producción y liberación de las citoquinas proinflamatorias se acompaña de la elevación plasmática de las concentraciones de citoquinas antiinflamatorias y de antagonistas de las citoquinas. 68
Dentro de las citoquinas antiinflamatorias cabe destacar a la IL-4, la IL-10, la IL-13 o el Factor transformador de crecimiento beta (TGF-beta). Todas ellas suprimen la expresión genética de las citoquinas inflamatorias, IL-1 y TNF-alfa. Junto a éstas existe además en la sepsis una expresión aumentada de antagonistas de las citoquinas. Entre ellos es obligado citar a los antagonistas del TNF-alfa llamados receptores solubles de TNF (sTNF-I y sTNF-II)61 y a un antagonista natural de IL-1, que es el antagonista de su receptor, el IL-1ra.69,70 Los primeros, son fragmentos de dos receptores de TNF de membrana que se liberan en la circulación y al unirse a TNFalfa inhiben sus actividades biológicas. El segundo, es un miembro de la familia IL-1 que se libera en la circulación sanguínea e impide que IL-1 se una a sus receptores. Desgraciadamente, estos efectos aparentemente apaciguadores atribuidos a los antagonistas de las citoquinas, demostrados ampliamente “in vitro”, no se han sucedido de éxitos terapéuticos cuando han sido testados en diferentes estudios randomizados dobles ciego. 71,72 Un argumento frecuentemente barajado para tales resultados es la falta de precocidad en la aplicación de las terapias que son ensayadas. 31 En efecto, desafortunadamente los signos clínicos habitualmente reveladores de una sepsis son secundarios a la propia respuesta productora de citoquinas del huésped; en consecuencia, reducir su síntesis una vez han hecho acto de presencia resulta inútil, por cuanto en este momento, las citoquinas ya han “explotado” el complejo sistema inflamatorio del organismo.
Entre las agresiones no infecciosas que pueden producir Síndrome de Respuesta Inflamatoria Sistémica (SIRS) se encuentran las quemaduras extensa de ahí la dificultad y la importancia del diagnostico de la sepsis en estos paciente lo que implica un monitoreo constante
La infección de la herida por quemadura es de difícil interpretación, por ello debe ser monitorizado cualquier cambio que pueda reflejar infección. El margen del eritema frecuentemente supera el lugar de quemadura y por sí mismo no indica infección. Sí son indicativos los cambios de color, la aparición de eritema o edema violáceo en tejido normal circundante, la repentina separación de la escara respecto al tejido subcutáneo o la formación de nuevas escaras. La aparición de coloración verdosa sobre la herida o grasa subcutánea, o el desarrollo de ectima gangrenoso nos sugiere infección por P. aeruginosa. Cambios en la temperatura corporal, hipotensión, taquicardia, confusión mental, neutropenia o neutrofilia, trombocitopenia y fallo renal, nos están indicando desarrollo de sepsis. Sin embargo, y debido a la profunda alteración que ocurre en la homeostasis por la quemadura en sí misma y la propia inflamación subyacente, la apreciación de estos cambios es compleja.
Dada la dificultad de evaluar la herida por quemadura desde la base de la observación clínica y los datos de laboratorio, la biopsia es necesaria para el diagnóstico de infección. El momento de la toma de biopsias puede ser guiado por los propios cambios clínicos, pero muchos centros recomiendan tomarlas de forma rutinaria cada 48h. La muestra biopsiada debe ser examinada buscando evidencia histológica de invasión bacteriana, además de cuantificarla microbiológicamente por cultivo.
No debemos olvidar que los cultivos obtenidos a partir de frotis de superficie únicamente son reflejo de la presencia de microorganismos del ambiente hospitalario, nos indican colonización nosocomial, pero no son indicativos de etiología infecciosa. Aun así, los cultivos rutinarios de la herida y vía respiratoria son esenciales, ya que permiten conocer la flora que coloniza al enfermo y orientan la antibioticoterapia empírica precoz y efectiva cuando aparece la infección.
OBJETIVOS:
General:
Caracterizar la sepsis en la unidad de quemados del Hospital Clínico Quirúrgico Hermanos Ameijeiras en el período comprendido entre febrero de 2006 y diciembre de 2008.
Específicos:
1- Determinar la morbilidad por sepsis en los pacientes ingresados en dicho período.
2- Determinar la mortalidad por sepsis en los pacientes ingresados en dicho período.
3- Identificar los gérmenes aislados con más frecuencia en los pacientes objeto de estudio.
4- Conocer si hubo o no variación en el tiempo en el mapa epidemiológico de la unidad de quemados del Hospital Hermanos Ameijeiras.
MATERIAL Y MÉTODO:
Se realizó un estudio retrospectivo descriptivo lineal de una muestra constituida por 107 pacientes ingresados en la unidad de quemados del hospital Hermanos Ameijeiras con el diagnóstico de quemaduras entre Febrero de 2006 y Diciembre de 2008, el dato primario se obtuvo de revisar las historias clínicas, las planillas de protocolos de atención al quemado, los informes del comité de infecciones y el mapa microbiológico de la sala confeccionado por el departamento de microbiología mediante el programa GALEN de SOFTEL.
Criterios de Inclusión:
Todos los pacientes ingresados en la unidad de quemados del hospital hermanos Ameijeiras con el diagnóstico de quemaduras entre Febrero de 2006 y Diciembre de 2008.
Variables y su operacionalización: Las variables estudiadas son:
La edad: Se agrupó la edad del paciente de acuerdo a los siguientes grupos:
< 20 años
20-29 años
30-39 años
40-49 años
50-59 años
>de 60 años
El sexo de los pacientes se consideró según sexo biológico: femenino y masculino.
La mortalidad: Se tuvo en cuanta la mortalidad en toda la muestra de estudio y la mortalidad en el grupo de los pacientes con sepsis.
La morbilidad: Se consideró según la presencia de sepsis o no en toda la muestra estudiada. Definida está de acuerdo con los siguientes criterios:
Infección documentada por hemocultivo o evidencia clínica de un foco séptico con cultivo positivo, más la presencia de tres o más de las condiciones que se relacionan a continuación.
1. Fiebre o hipotermia: Temperatura > de 38°C o < de 36°C.
2. Taquicardia: Frecuencia cardiaca > de 90/min.
3. Taquipnea: Frecuencia Respiratoria > de 20/min o PaCO2 < de 32/min.
4. Conteo de leucocitos: Leucocitos > de 12,000 o < de 4,000 o > 10% de "bandas", en la cuenta diferencial.
Presencia de gérmenes: Se recogió información sobre el tipo de germen encontrado en el servicio durante el período de estudio según los informes del comité de infecciones y el mapa microbiológico de la sala confeccionado por el departamento de microbiología mediante el programa GALEN de Softel.
La superficie corporal quemada estratificada en:
A. < de20%SCQ
B. 20-39%SCQ
C. 40-59% SCQ
D. 60-79%SCQ
E. >80% SCQ
Procedimientos para el análisis estadístico
Con la información obtenida se creó una base de datos que fue procesada por medio del paquete estadístico SPSS versión 10.0. Se emplearon medidas de resumen de estadística descriptiva para su mayor organización (frecuencias absolutas y porcentajes). Se utilizó una computadora en la que se aplicaron los programas Excel y Microsoft Word 2003.
Los resultados obtenidos se ilustraron en forma de tablas y gráficos para su mejor comprensión.
RESULTADOS Y DISCUSIÓN
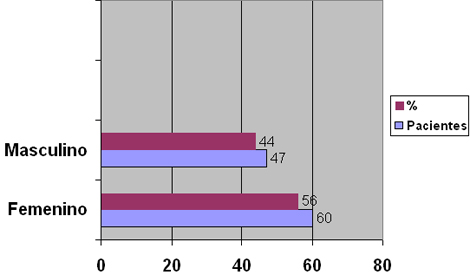
La serie de estudio estuvo constituida por 107 pacientes, en la que prácticamente no existe diferencia en cuanto a sexo según puede apreciarse en la Tabla 1(gráfico 1)
Tabla Nº 1. Distribución de la muestra según sexo
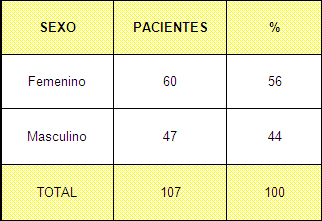
Fuente: Planillas de protocolo de la sala de quemados del Hospital Hermanos Ameijeiras.
El comportamiento de la incidencia de quemaduras en cuanto a esta variable no tiene una tendencia significativa en pacientes adultos según se recoge en la literatura internacional dependiendo de las características socioeconómicas del lugar donde se realice el estudio y puede existir predominio de uno u otro sexo pero sin grandes diferencias, las estadísticas nacionales de nuestro país en los últimos años se comporta igual aunque con una discreto predominio del sexo femenino en las provincias orientales debido fundamentalmente a accidentes en la cocina y a suicidio que es más frecuente en las mujeres. 7
La mayoría de los pacientes se encuentran entre los 20 y los 49 años de edad (Tabla 2) o sea población económicamente activa más expuesta a accidentes, lo que se corresponde con estudios nacionales e internacionales.
Tabla Nº 2. Distribución de los pacientes por grupos de edades.
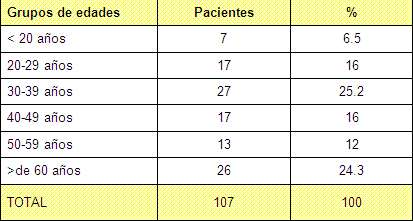
Fuente: Planillas de protocolo de la sala de quemados del Hospital Hermanos Ameijeiras.
Tabla Nº 3. Distribución general según diagnóstico de sepsis o no
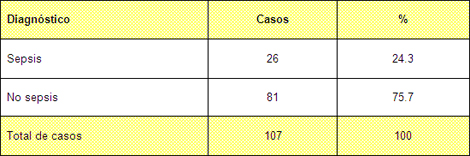
Fuente: Planillas de protocolo de la sala de quemados del Hospital Hermanos Ameijeiras.
En la Tabla 3 presentamos la distribución general de la muestra de acuerdo con la presencia de sepsis o no, como se aprecia el 24.3% de los pacientes presentó un cuadro séptico, mientras que la mayoría no presentó esta complicación. Esto difiere de publicaciones internacionales. 65,66 Consideramos que este resultado está en relación con que más del 50% (tabla 4) de los pacientes ingresados en el período de estudio en nuestra sala (81 pacientes), se encuentran en el rango de menos del 10% de la Superficie corporal quemada y en este estrato está descrito que no se presenta esta entidad debido a la poca repercusión sistémica de la quemadura. 67,68 En otros servicios del país no es así, pero al ser nuestra unidad centro de referencia nacional y no corresponderse a un área de salud determinada, ingresan pacientes de diferentes municipios y provincias con por cientos de superficie corporal quemada por debajo de un 10% pero que son casos de alta complejidad ya sea por el agente etiológico o por ser quemaduras hipodérmicas de poca extensión pero que se encuentran en zonas especiales, también por acompañarse de otras patologías o en edades extrema que en nuestra serie es un 24.3% solo superada por el grupo comprendido entre los 20 y los 39 años.
Fuente: Planillas de protocolo de la sala de quemados del Hospital Hermanos Ameijeiras.
Consideramos útil mostrar la mortalidad general de nuestra serie (tabla 4) dado que después analizaremos la morbilidad y la mortalidad por sepsis que son los objetivos de nuestro trabajo, como se aprecia es baja aunque al desglosarla en por cientos de superficie corporal quemada varia para cada estrato. Es muy difícil realizar comparaciones entre diferentes series pues existen muchas escalas de gravedad debido a que son múltiples los factores que influyen en el pronóstico de paciente con quemaduras. 69,70 Entre ellos destacan: edad, extensión de la quemadura, profundidad de la lesión, etiología, afectación de las vías respiratorias, enfermedades intercurrentes y localización de la quemadura, por lo que mortalidad, se convierte en factor multidependiente, pero de gran importancia en la toma de decisiones en paciente quemado.
Con la intención de conocer la tasa de supervivencia de pacientes quemados, se desarrolló a final de los años cuarenta el concepto de LA50, que indica la extensión de las quemaduras que resulta mortal en el 50% de los casos ajustada a una muestra de edad. Gracias a ello, se ha podido ir conociendo cómo la LA50 que en 194971 se situaba en el 47% de la superficie corporal total en pacientes adultos jóvenes, ha ido descendiendo para situarse en el 63% de la superficie corporal total a final de la década de los años setenta o en el 81% de la superficie corporal total en el estudio publicado en 1995 por la American Burn Association. No obstante, la tasa de mortalidad de una unidad de quemados debe ajustarse a los factores de riesgo asociados a la quemadura, y no debe ser considerado como un parámetro indicativo de la efectividad de las terapias en ella administradas.
Los dos factores que se han relacionado más directamente con la mortalidad del paciente quemado han sido la edad y el porcentaje de superficie corporal quemada. Así, por ejemplo, el número de pacientes que fallecieron en la Unidad de Quemados del Hospital Universitario Virgen del Rocío de Sevilla durante 1995 fue de 9, lo que supone una tasa de mortalidad global aproximada del 3.78%.72
Existen otros índices pronósticos 24-27, en nuestro país es de uso generalizado el del profesor Harley Borges Muñio conocido como clasificación Cubana de pronóstico de vida que toma en cuenta la extensión y la profundidad. 73
Como todos los autores están de acuerdo en que la extensión de la quemadura es sin duda el más determinante a la hora de realizar un pronóstico de vida en el paciente quemado, y como la mayoría de los trabajos que se encuentran en la literatura se basan en esto, nosotros estratificamos nuestra serie en los rangos habituales en que son presentados estos trabajos.
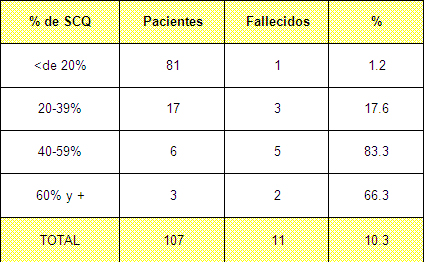
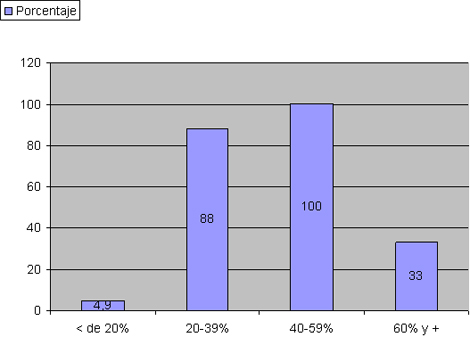
Tabla Nº 5. Morbilidad por sepsis según porcentaje de superficie corporal quemada (SCQ).
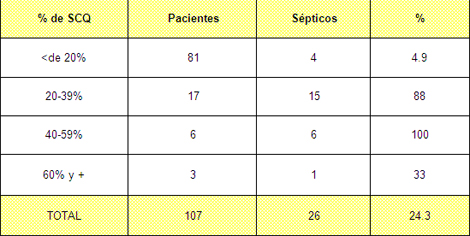
Fuente: Planillas de protocolo de la sala de quemados del Hospital Hermanos Ameijeiras.
En la tabla 5 y gráfico 2 se muestran los porcentajes de sepsis desglosada por los diferentes estratos, como se puede apreciar en los pacientes con menos de un 20% de superficie corporal quemada (SCQ) la tasa es de 4.9% producto de que las lesiones con esa extensión tienen muy poca repercusión sistémica 75,76 y en esos casos la sepsis se desarrolla por condiciones pre existentes a las quemadura como pueden ser enfermedades concomitantes o edad avanzada que en nuestra muestra el 24.3% corresponde con mayores de 60 años.
El porcentaje va aumentando en la medida en que aumenta la superficie corporal quemada y luego desciende bruscamente al llegar a los 60% y + de superficie corporal quemada (SCQ). En quemaduras menores, el proceso inflamatorio queda limitado a la herida en sí. En las quemaduras mayores la injuria local es tal, que el paciente apenas logra sobrevivir la primera etapa, como para desarrollar una sepsis, en ellos se desencadena la liberación de mediadores a la circulación, resultando en una respuesta sistémica, la cual está caracterizada por hipermetabolismo, inmunosupresión y síndrome de respuesta inflamatoria sistémica. 77-79
En muchos pacientes con quemaduras de más del 30% de superficie corporal quemada (SCQ) de compromiso de la superficie corporal total, virtualmente todas las funciones inmunes específicas (Mediadas por células y humorales) y no específicas (leucocitos polimorfonucleares, macrófagos) se ven dañadas, por lo que deben ser tratados como inmunocomprometidos. Aunque las primeras 48 horas luego de la injuria térmica están usualmente libres de infección, la cascada inflamatoria es inmediatamente activada. La liberación de histamina desde el sitio de la injuria lleva a la activación del complemento y liberación de la xantinooxidasa, resultando en la activación de células inflamatorias y de la liberación de citoquinas tales como el TNF e interleuquinas.
El tejido quemado es la principal fuente de mediadores inflamatorios y es por eso que la respuesta inflamatoria es directamente proporcional a la extensión de la quemadura 80,81, en nuestro caso la disminución de la tasa al llegar al 60% de superficie corporal quemada (SCQ) se debe a que este tipo de paciente en nuestro medio fallece en los primeros 5 días etapa previa al inicio de las complicaciones infecciosas.
Los porcientos de sepsis en grandes quemados (los mayores de un 30% de SCQ) en nuestro servicio, es inferior a los reportes de otros países y de otras series reportadas 82-85 y coincide con otros 86-88 consideramos que esto está en dependencia de varios factores, en primer lugar la cantidad de ingresos al año, no es elevada y no coinciden muchos pacientes en la unidad por lo que la infección cruzada disminuye además de que las características constructivas de nuestra unidad permiten un aislamiento adecuado de los pacientes al encontrarse en habitaciones individuales.
El aislamiento del paciente con quemaduras se muestra como una medida eficaz en la prevención de las infecciones que sufre el paciente 89. El aislamiento se muestra útil no solamente en la disminución de las infecciones, sobre todo por gérmenes Gram negativo, sino también en el retardo en su aparición. También ha sido demostrada una disminución de la mortalidad de los pacientes quemados que fueron aislados durante su hospitalización en comparación a los que no estuvieron ingresados en camas aisladas 90. La estabilidad del personal médico y de enfermería incluso el personal auxiliar de limpieza que se encuentra entre 12 y 23 años de trabajo en la unidad, permitiendo un adecuado cumplimiento de las normas higiénico sanitarias.
También considero que el papel fundamental lo constituye el tratamiento quirúrgico precoz 81-83 que está ampliamente demostrado disminuye la mortalidad y la sepsis, en nuestra unidad se realiza la táctica quirúrgica activa desde el año 1990 y de forma precoz, o sea entre el tercero y el quinto día siempre que el paciente se encuentre hemodinámicamente estable, aunque no siempre es posible realizarlo completamente, pues tenemos serias limitaciones logísticas fundamentalmente por la escasez de sustitutos temporales de piel lo que hace que los resultados en ocasiones no son del todo exitoso.
Tabla Nº 6. Mortalidad de los casos sépticos
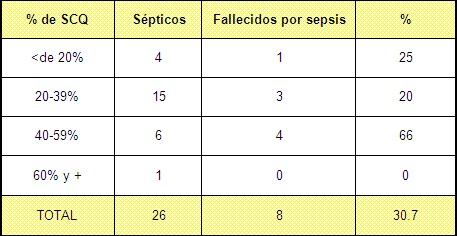
Fuente: Planillas de protocolo de la sala de quemados del Hospital Hermanos Ameijeiras
Como puede apreciarse en la tabla 6 de los 26 casos que desarrollaron una sepsis, fallecieron a causa de la misma el 30,7%, aunque al estratificarse esta variable nos percatamos que también está en dependencia de la extensión de la quemadura alcanzando su máxima expresión en el grupo del 40 al 59% de superficie corporal quemada (SCQ) en el que todos los que adquieren la sepsis mueren a consecuencia de la misma. Va decreciendo en la medida en que es menor la extensión de la quemadura debido a que las alteraciones metabólicas son menores 54,75,76, y en el grupo de mayor extensión, o sea, los mayores del 60% de superficie corporal quemada (SCQ), porque en nuestro medio estos pacientes fallecen antes del quinto día y no llegan a desarrollar una sepsis.
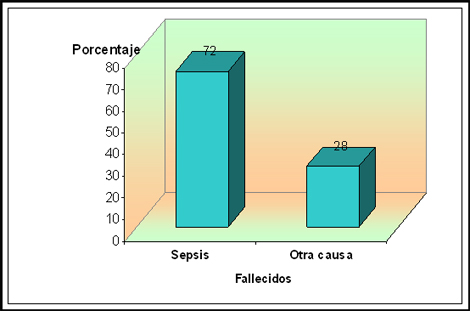
Tabla Nº 7. Fallecidos por sepsis distribuidos según el porcentaje de superficie corporal quemada (SCQ)
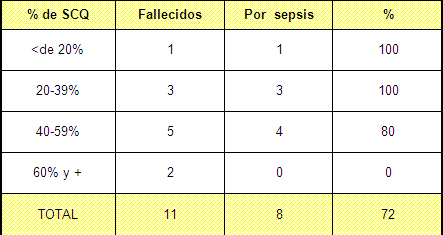
Fuente: Planillas de protocolo de la sala de quemados del Hospital Hermanos Ameijeiras.
Al analizar la mortalidad general de nuestra serie encontramos que fallecieron 11 pacientes que representa un 10,3% (tabla 4), una mortalidad baja, pero cuando analizamos que de esos fallecidos, 8, que representan un 72% mueren a causa de la sepsis (tabla 7) apreciamos que la sepsis tiene un significado muy importante en la mortalidad de los pacientes atendidos en nuestra unidad de quemados y que se corresponde con el de otras unidades con similares características a la nuestra. 67,68 En esta tabla se ilustra que hasta una extensión entre el 20 y el 59% de superficie corporal quemada (SCQ) la mortalidad por esta causa gira en torno al 100%, para luego caer a cero, pensamos que cuando aumenten los recursos tecnológicos es muy posible que se aumente la mortalidad por sepsis debido a que en el grupo extremo sobrevivirían más paciente y otros que fallecerán tendrían más larga estadía pero seguramente adquirirá algún tipo de sepsis en el transcurso de su evolución. Ver gráfico 3.
Para estudiar el Objetivo 3 confeccionamos la siguiente tabla:
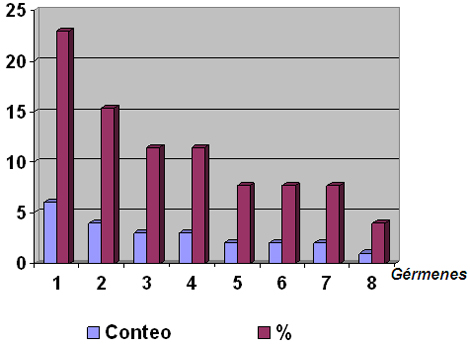
Tabla Nº 8. Principales gérmenes aislados en la unidad en el período de estudio
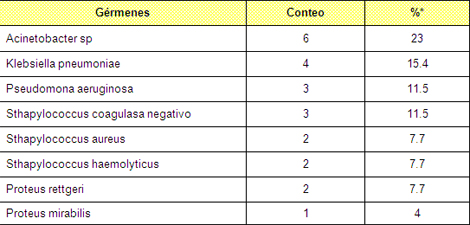
Fuente datos del GALEN DE SOFTEL
Porcentaje según en número de sepsis (26 casos)
Observamos que en el período analizado predominaron los gérmenes gram negativos, con el Acinetobacter sp encabezando el grupo con un 23%, seguido por la Klebsiella pneumoniae y la pseudomona aeruginosa (ver gráfico #4). Los resultados son similares a los obtenidos en otros estudios 75-78, que reportan un alza en la colonización e invasión de las heridas quirúrgicas por gérmenes gram negativos y específicamente en los pacientes quemados, y la bacteria que más frecuentemente crece en el cultivo es el Acinetobacter sp. Sin embargo en estudios realizados por el Dr. Rafael Rodríguez Garcel en nuestra unidad de quemados, en el período precedente a nuestro trabajo, obtuvo un resultado diferente con predominio de los gram +, lo que confirma lo descrito en la literatura de que la flora microbiana de las unidades de quemados varia en el tiempo. 74
Los gérmenes gram +, como las variedades de Staphylococcus han cedido terreno en su protagonismo de antaño aunque no han desaparecido del mapa epidemiológico de la unidad de quemados. Antes de que los antibióticos se prodigasen, los microorganismos más frecuentes eran los gram positivos, especialmente el Streptococcus pyogenes y el Staphylococcus áureas. Sin embargo, con la introducción paulatina de los antibióticos de amplio espectro los microorganismos gram negativos (Escherichia coli, Klebsiella, Enterobacter, Proteus y Pseudomonas aeruginosa) fueron protagonizando la mayoría de las infecciones causantes de sepsis.
CONCLUSIONES:
La morbilidad por sepsis en los pacientes ingresados, en el período en estudio fue baja (24.3%), la cuarta parte de la muestra.
La mortalidad por sepsis en dicho período fue alta, de los fallecidos (11 pacientes), el 72%(8 pacientes) fue por sepsis.
Los gérmenes más frecuentes aislados en la unidad en ese período de tiempo fueron el Acinetobacter sp, Klebsiella Pneumoniae y Pseudomona Aeruginosa dentro de los gram – y el estafilococo coagulasa negativo como gram positivo.
El mapa epidemiológico de la unidad de quemados del Hospital Hermanos Ameijeiras cambió en el tiempo, con predominio de gérmenes gram negativos, a diferencia de años anteriores donde predominaban los gram positivos.
RECOMENDACIONES:
Realizar un estudio prospectivo diseñado de tal manera que permita identificar los factores de riesgos de sepsis específicos de esta unidad de quemado para poder trazar una estrategia que permita disminuir la morbimortalidad por sepsis en este tipo de pacientes.
ANEXOS
Gráfico Nº. 1
Distribución de la muestra según sexo
Fuente: Tabla 1
Gráfico Nº. 2
Morbilidad por sepsis según porcentaje de superficie corporal quemada (SCQ)
Fuente: Tabla 5
Gráfico Nº. 3
Porcentaje de pacientes fallecidos según causas.
Fuente: Tabla 7
Gráfico Nº. 4
Principales gérmenes aislados en la unidad en el período de estudio
Fuente: Tabla 7
Leyenda
1. Acinetobacter sp
2. Klebsiella pneumoniae
3. Pseudomona aeruginosa
4. Sthapylococcus coagulasa negativo
5. Sthapylococcus aureus
6. Sthapylococcus haemolyticus
7. Proteus rettgeri
8. Proteus mirabilis
BIBLIOGRAFÍA
1. Freddi O, Kestens G, Quemaduras Graves. En: Lovesio Carlos: Medicina Intensiva. 5ª Edición. Editorial El Ate-neo. Buenos Aires. 2001. 805- 816
2. Hettiarrafchy SH, Dziewolski P. Pathophisiology and ty-pes of burns. BMJ. 2004. 328; 1427-1429
3. Marko P, Layon J. Caruso L. et al Burn Injuries. Current O-pinion in Anaesthesiology 2003, 16:183–191
4. McManus, W. F.; Goodwin, C. W.; Manson, A. D.; Pruitt, B. A.: «Burn wound infection». J. Trauma. 21: 753. 1981.
5. Yurt, R. W.; Shires, G. T.: aBurls In: Principies and practice of infectious diseases». Second Ed. Manden. G. L.. Douglas, R. G. and Bennett. J. E. Ed. New York. 1985.
6. ARYA SC., AGARWAL N., «Nosocomial infections in adult intensive-care units».Lancet.2003 Aug 9;362(9382):493-
7. Del sol A. Las quemaduras y sus diferentes aspectos. C. De La Habana: Ed.Científico Técnica.1990; 18: 31-46.
8. Song W, Lee KM, Kang HJ, Shin DH. Microbiology aspects of predominat bacteria isolated from the burn patients in Korea. Burns. 2001;27 (2): 136 -139.
9. Sanyal SC, Mokaddas EM, Grang RK. Microbiology of septicemia in burn patients. Annual Burns and fire desease.2004;11(1): 19-22.
10. Tang H, Zhaofan X, Liu S, Chen Y, Ge S. The experiense in the treatment of patients with extensive full- thicknes burns. Burns; 2005; 25(8): 757-9.
11. Gelfand, J. A.: «Infections in boro patients: A paradignm for cutaneous infection in the paticnt at riskrr. Arn. J. Med. 76: 158, 1984.
12. Alexander, C. L.; Ogle, C. K.; Stinnett, J. D.; Me Millan,B.G.: «A sequential prospective analysis of inmunologic abnormalities and infection following severe thermal injury». Aun. Surg. 188: 809, 1978.
13. Bjornson, A. B.; Altemier, W. A.; Bjornson, H. S.: «Complement opsoninsand che immune response to bacterial infection in burned patients». Ann. Surg.191:323, 1980.
14. Mc Cabe, W. P.; Rebuck, J. W.; Kelly, A. P.; Ditmars,D. M.: «Leukocyte response as a monitor of immunodepre si, in burn patients». Arch. Surg. 106: 155, 1973.
15. Grogan, J. B.: «Suppressed in vitro chemotaxis of burn neutrophil»,. J. Trauma. 16: 985, 1976.
16. Warden, J. D.; Mason, A. D.; Pruitt, B. A.: «Evaluation of leukocyte chcmotaxis in vitro in thermally injury patients. J.C.». lnrese. 54: 1001, 1974.
17. Herruzo Cabrera, R.; García Caballero, J.; Lenguas Pintado, R.; Damián, R.; García Torres, V.; Rey Calero, J.:«Estudio Epidemiológico de la Infección Hospitalaria en un centro de quemados, durante los años 1984-1985». Comunicatión al XI Internacional Congress of Preventive and Social Medicine. Madrid, 2006.
18. Moncrief, J. A.; Teplitz, C.: « Changing concepts in burn sepsis». J Trauma., 4: 233, 1964.
19. Divincenti, F. C.; Pruitt, B. A.; Reckler, J. M.: « Inhalation injuries». J. Trauma. 11: 109, 1971.
20. Pruitt, B. A.; Flemma, R. J.; Divincenti, F. C.; Foley, F. D.: « Mason Pulmonary complications in burn patient: A comparative study of 697 patients». J. Thorac. Cardiovasc. Suig. 59: 7, 1970.
21. Pruitt, B. A.; Me Manus, W. F.; Kim, S. H.; Treat R. C.: «Diagnosis and treatment of cannularelated intravenous sepsis in burn patients». Ann. Surg. 191: 546. 1980.
22. Normas para el control de la Infección Hospitalaria. Comisión de Infecciones del Hospital «La Paz». 1986. Mc Millan, B. G.; Holder, I. A.; Alexander, J. W.: «Infections of burn wounds. In: Hospital Infections». Second Ed. Bennett, J. V. and Brachman, P. S. Ed. Little Brown, Boston, 1986.
23. Mc Millan, B. G.; Holder, I. A.; Alexander, J. W.: «Infections of burn wounds. In: Hospital Infections». Second Ed. Bennett, J. V. and Brachman, P. S. Ed. Little Brown, Boston, 1986.
24. Santos C.E de los: Historia del tratamiento de las quemaduras. 1ed. En: Guía básica para el tratamiento del paciente quemado. Santo Domingo: Alfa & Omega; 1999. p. 17-24.
25. Santos CE de los: Perfil de unidades en América Latina. Servicio de quemados. Consideraciones para su planificación y operación en países con bajo desarrollo socioeconómico. El Hospital (publicación periódica en línea) 2004 Abril Disponible en: http://www. El Hospital.com
26. Barret JP, Herdon D.Avances y tendencias en el tratamiento de niños con quemadura. Acta Pediatr Mex 1999:34-40. Disponible en: http//www.imbiomed.com/
27. Borges Muñio H, Garcia Ramos R, et al.Manual de procedimientos de diagnóstico y tratamiento em caumatología y cirugía plástica, T1.Ciudad de la Habana. Editora Pueblo y Educación; 1984:31-34.
28. Steinstraesser L. Thermal injury induces expression of CD4 inhuman skins.Burns 2002; 28:223-30.
29. Mc Clave S.The effects of inmune enchancing diets on mortality, hospital ling of stay, duration of mechanical venttilation an other parameters.J Parenter Enter Nutrr 2001; 25:44-50; 58.
30. Gutierez Salgado J, Carrera Gomez J.Sindrome de respuesta inflamatoria sistémica definición, comentarios fisiopatológicos e importancia en cirugía plástica.Cir Plast 1998; 18: 53-Disponible en: http://www.imbiomed.com.mx
31. Bracho F.La respuesta inmunológica a las quemaduras. En: MEDICRIT 2005; 2:17-20 Disponible en: www.medicrit.com
32. Efron P, Moldawer L.Citokines and wound healing.The rol of cytokine and anticytokine therapy in the repair response.J Burn Care Rehabil 2004; 25:149-60.
33. Sánchez Álvarez R. Caracterización de indicadores bioquímicos de estrés oxidativo en pacientes quemados muy graves.RTev Cubana Invest Biomed.2000; 19:164-7.
34. Rangel Gaspar H.Sindrome compresivo fasiocutaneo en quemaduras: Cir Plas 2003; 13:25-9.Disponible en: http://www.imbiomed.com.
35. Hettiarafchy SH,Dziewolsky P. Pathophisiology and types of burns.BMJ 2004;328:1427-9
36. Kang HJ,Kim JH,Lee EH.Change of complement system predicts the outcome of patients with severe thermal injury.J Burns Care 2003;24: 148-53
37. Martindale R.Use of immune enchancing diets in burns. J Parenter Enter Nutr 2001;25:24-6
38. Cuenca-Pardo J, Álvarez DJ, Serrano CJM.: Fase inflamatoria en el paciente quemado. Cir Plást 2001; 11: 90-7.
39. Wang GQ.The clinical significance of the SRIS scoring sistemin severly burned patients.Ann Burns Fire Disasters 1999; 12:2004.
40. Ogura H, Hasshiguchi N,Tanaka H.Long tem enchanced expression of hest shock proteins and decelerated apoptosis in polymorfonuclesr linkocytes fron mayor burn patients.J Burns Care Rehabil 2003;23:103-9.
41. Rangel Gaspar H.Infección en quemaduras:Cir Plas 2005;15:111-17.Disponible en: http://medigraphi.com
42. Losada H, Manterola C.SRI, sepsis y SDOM.una visión quirúrgica.Rev Chil Cir 2004; 56:31- Álvarez F, Martínez M: Decálogo de normas para la utilización de antibióticos en pacientes Críticos.Disponible en: http://www.doyma.es el 16/06/2007.
43. Sánchez R, Monserrat J. Balance entre citocinas pro y antiinflamatorias en estados sépticos.Disponible en. http://www.doyma.es el 16/06/2007.
44. Cuenca-Pardo J, Álvarez-Díaz C: Fase inflamatoria en el paciente quemado. Cir Plas, 11: 2001, 90 – 97.. Disponible en http://medigraphic.com
45. Álvarez F, Martínez M: Decálogo de normas para la utilización de antibióticos en pacientes Críticos.Disponible en: http://www.doyma.es el 16/06/2007.
46. Sánchez R, Monserrat J. Balance entre citocinas pro y antiinflamatorias en estados sépticos.Disponible en. http://www.doyma.es el 16/06/2007.
47. Cuenca-Pardo J, Álvarez-Díaz C: Fase inflamatoria en el paciente quemado. Cir Plas, 11: 2001, 90 – 97.. Disponible en http://medigraphic.com
48. Betancourt M: Mortalidad infantil por quemaduras y síndrome de respuesta inflamatoria sistémica. Rev Med IMSS 2004; 42 (2): 103-108
49. Istre GR, Mc Coy MA, Osbron L, Barnard JJ, Bolton A: Deaths and injuries from house fires. N Engl J Med 2001; 344(25):1911-1916.
50. Müller MJ, Pegg SP, Rule MR. Determinants of death following burn injury. Br J Surg 2001; 88 (4):583-587.
51. Calder F. Four year of burn injuries in Red Cross Hospital in Afghanistan. Burn 2002; 28:563-568.
52. Laloë V. Epidemiology and mortality of burns in General Hospital of Eastern Sri Lanka. Burn 2002; 28 (8):778-781.
53. Mukerji G, Chamania Sh, Gupta P, Gupta S. Epidemiology of paediatric burns in Indore, India.Burn 2001;27(1):33-38.
54. Anlat R, Ozerdem OR, Dalay C, Kesiktas E, Acarturk S, Seydauoglu G. A restrospective analysis of 1083 Turkish patients with serious burns. Burn 2002; 28(3):239-243.
55. Mohammad-Reza A, Abdolaziz RL, Ali-Reza T, Javad S, Reza D. Epidemiology and mortality of burns in the South West of Iran. Burn 2001; 27(3): 219-226.
56. Lemos A. T.O. Costa. Infecções no paciente queimado. In.. Comissão de Controle de Infecção Hospitalar CCIH Hospital das Clinicas da UFMG. Manual de infecção hospitalar, epidemiologia, prevenção e controle. Rio de janeiro Medisi.. 2001, 1116-26.
57. Alderson P, Bunn F, Lefebvre C, Li Wan Po A, Li L, Roberts I, et al. The Albumin Reviewers. Solución de albúmina humana para la reanimación y expansión de volumen en pacientes críticos. En: La Cochrane Library plus en español.Oxford, número 4, 2004. Update Software Ltd.
58. Cuenca J, Álvarez C: Efectividad de la Unidad de Quemados del Hospital de traumatología Dr. Víctor de la Fuente Narváez.Estudio Comparativo.Cir Plas, 12, 3, 2002: 104 -8
59. Annane D, Sebille V, Troche G, Raphael JC, Gajdos P, Bellissant E: A 3-level prognostic classification in septic shock based on cortisol levels and cortisol response to corticotropin. JAMA 2000; 283:1038-45.
60. Ariasa F. Frutos M: Utilización y rendimiento de los hemocultivos en una unidad de cuidados intensivos medicoquirúrgica. Med Intensiva 2003; 27(10):647-52
61. Garnacho J: Conceptos y definiciones. En: "Guías para el tratamiento de las infecciones relacionadas con catéteres intravasculares de corta permanencia en adultos" de la Conferencia. Reconsenso: Infecciones por Catéter SEIMCSEMICYUC Madrid: Drug Farma 2002: 13-18.
62. Pascual A.Etiopatogenia y factores de riesgo. Conferencia de Consenso Infección por Catéter SEIMC-SEMICYUC. Madrid:Drug Farma 2002:43-55.
63. Fernández, E.M. García, F. Sandoval G, Quemaduras en la infancia. Valoración y tratamiento BOL PEDIATR 2001; 41: 99-105,
64. Martindale, R: Use of immune enhancing diets in burns. Journal of parenteral and enteral nutrition; 2001(25):24-26
65. Mc Clave Stephen MD. The effects of inmune enhancing diets on mortality, hospital lingth of stay, duration of mecharucal ventilation and other parameters. J.P.E.N; 2001(25); 44-50.
66. Lin E, Calvanos S, Lowry S. Inflammatory cytokines and cell response in surgery. 2000; 127: 117-126.
67. Crisol F, Gómez P, Palao R. Gran Quemado. En: Carrasco-Jiménez MS. Emergencias Médicas II. Madrid: Arán Ediciones 2000; 1195-1208.
68. Freddi O, Kestens G, Quemaduras Graves. En Lovesio Carlos: Medicina Intensiva. 5ª Edición. Editorial El Ate-neo. Buenos Aires. 2001. 805- 816
69. Hettiarrafchy SH, Dziewolski P. Pathophisiology and ty-pes of burns. BMJ. 2004. 328; 1427-1429
70. Marko P, Layon J. Caruso L. et al Burn Injuries. Current O-pinion in Anaesthesiology 2003, 16:183–191
71. Efron P. Moldawer L, Cytokines and Wound Healing: The rol of cytokine and anticytokine therapy in the repair response. J Burn Care Rehabil. 2004; 25: 149-160
72. Kang HJ, Kim JH, Lee EH. Change of Complement System Predicts the outcome of patients with severe thermal injury. J. Burn Care Rehabil. 2003; 24: 148-153
73. Miquet R LM. Estudio inmunológico en pacientes quemados. (Tesis para optar por el título de Especialista de 1er. Grado en Cirugía Plástica y Quemados. Ciudad de La Habana: Hospital Clínico Quirúrgico Hermanos Ameijeiras,1990.
74. Rodriguez Garcel R. Estudio de la sepsis en pacientes quemados. Disponible en: www.portalesm{edicos.com/publicaciones/1331/1nov2008.
75. PRUITT BA Jr., McMANUS AT., KIM SH, GOODWIN CW., «Burn wound infections: current status».World J Surg. 1998 Feb;22(2):135-45.
76. WURTZ R., KARAJOVIC M., DACUMOS E., JOVANIC B., «Nosocomial infections in a burn intensive care unit».Burns. 1995 May;21(3):181-4.
77. MAYHALL CG., «The epidemiology of burn wound infections: then and now».Clin Infect Dis. 2003 Aug 15;37(4):543-50.
78. GARRIDO G., MADERO R., HERRUZO R., GARCÍA-CABALLERO J., «Infección nosocomial en una UCI: análisis multivariante de los factores de riesgo». Med Clín. (Barc.) 1997; 108: 405-409.
79. NASSER S., MABROUK A., MAHER A., «Colonization of burn wounds in Ain Shams University Burn Unit».Burns. 2003 May;29(3):229-33.
80. Efron P. Moldawer L, Cytokines and Wound Healing: The rol of cytokine and anticytokine therapy in the repair response. J Burn Care Rehabil. 2004; 25: 149- 160.
81. Kang HJ, Kim JH, Lee EH. Change of Complement System Predicts the outcome of patients with severe thermal injury. J. Burn Care Rehabil. 2003; 24: 148-153
82. Ogura H. Hasshiguchi N. Tanaka H et al. Long term enhanced expresión of heat shock proteins and decelerated apoptosis in polymorfonuclear leukocytesfrom major burn patients. J Burn Care Rehab 2002; 23:103-109
83. Luterman, A.; Daeso, C. C.; Curreri, P. W.: «Infections in boro patients»Am.J. Med. 81: 45, 1986.
84. Marshall, J.C. Clinical trials of mediator-directed therapy in sepsis: What have we learned? Intensive Care Med 2000; 26 (Suppl. 1): 75-83.
85. Mock, C.N., Jurkovich, G.J., Dries, D.J., Maier, R.V. Clinical significance of antibiotic endotoxin-releasing properties in trauma patients. Arch Surg 1995; 130: 1234-1241.
86. Brun-Bruisson, C. The epidemiology of the systemic inflammatory response. Intensive Care Med 2000; 26 (Suppl. 1): 64-74
87. Danilla S, Pastén J A, Fasce G, Díaz V, Iruretagoyena M. Mortality trends from Burn Injuries in Chile: 1954-1999. Burns 2004. 30(4), 348-356.
88. Dr. César Cárcamo Quezada. Atención Integral del Gran Quemado. 2006