La aterosclerosis es la principal causa de mortalidad en el mundo desarrollado y se predice que representará la principal causa de muerte en países en desarrollo. Entre sus manifestaciones clínicas se incluyen, infarto del miocardio, falla cardiaca, accidente cerebro vascular y enfermedad arterial periférica. Un modelo animal, es aquel mediante el cual se puede investigar la fisiología, comportamiento, procesos patológicos espontáneos o inducidos, que presenten semejanza con el humano u otras especies. Desde 1908, el colesterol de la dieta ha sido conocido como un factor dominante en la génesis de aterosclerosis. El conejo rápidamente desarrolla severa hipercolesterolemia en respuesta a la manipulación dietética, que lo conlleva a presentar aterosclerosis. Llevamos a cabo esta corta revisión referida al conejo de laboratorio, un animal que ha sido ampliamente utilizado en el campo de investigación de la aterosclerosis.
El conejo, un modelo animal para el estudio de la aterosclerosis. Una corta revisión
Rabbit, an animal model of atherosclerosis study. A short review
Caballero Luis. División de Salud Pública, Instituto Nacional de Nutrición.
Caballero-Gómez Luisana. Estudiante Licenciatura en Química, Universidad Simón Bolívar
RESUMEN
La aterosclerosis es la principal causa de mortalidad en el mundo desarrollado y se predice que representará la principal causa de muerte en países en desarrollo. Entre sus manifestaciones clínicas se incluyen, infarto del miocardio, falla cardiaca, accidente cerebro vascular y enfermedad arterial periférica. Un modelo animal, es aquel mediante el cual se puede investigar la fisiología, comportamiento, procesos patológicos espontáneos o inducidos, que presenten semejanza con el humano u otras especies. Desde 1908, el colesterol de la dieta ha sido conocido como un factor dominante en la génesis de aterosclerosis. El conejo rápidamente desarrolla severa hipercolesterolemia en respuesta a la manipulación dietética, que lo conlleva a presentar aterosclerosis. Llevamos a cabo esta corta revisión referida al conejo de laboratorio, un animal que ha sido ampliamente utilizado en el campo de investigación de la aterosclerosis.
Palabras clave: Aterosclerosis, colesterol, conejos, modelos animales
ABSTRACT
Atherosclerosis is the leading cause of death in the developed world, and atherosclerosis is predicted to be the leading cause of death in the developing world. Clinical manifestations of atherosclerosis include myocardial infarction, heart failure, stroke, and peripheral artery disease. Animal models are considered to be those where physiology, behavior and spontaneous or induced pathological processes are similar to human or other species problems. Dietary cholesterol has been known as a dominant factor in the genesis of atherosclerosis since 1908. The rabbit rapidly develops severe hypercholesterolemia leading to premature atherosclerosis in response to dietary manipulation. This short review refers to the laboratory rabbit, an animal that has been widely used in the field of atherosclerosis research.
Key words: Atherosclerosis, cholesterol, rabbits, animal models
Introducción
La aterosclerosis es una enfermedad inflamatoria de la pared arterial que involucra mecanismos de inmunidad humoral y celular. La disfunción del endotelio vascular y la retención de lipoproteínas en la íntima arterial, han sido señalados como eventos tempranos en la aterogénesis [Rodríguez y col., 2009]. El proceso inflamatorio produce una lesión proliferativa de las capas íntima y media arterial, tras la formación de capas fibroadiposas, que terminan por invadir la luz de las arterias y, en combinación con procesos trombóticos, comprometen la funcionalidad circulatoria (Anexos: Figura I, II y III). Las placas fibroadiposas elevadas en la íntima arterial, conocidas como ateromas, producen estenosis, especialmente en la aorta y arterias coronarias y cerebrales [Gil y col., 2007].
Una extensa revisión [Stocker y Keaney, 2004] ha focalizado recientemente el rol de los procesos oxidativos en la aterosclerosis.
Antígenos bacterianos y virus se han asociado con la aterosclerosis como potenciales causantes, añadiéndole un mayor nivel de complejidad en el análisis de la patofisiología de la aterosclerosis [Milioti y col., 2008].
El primer estudio realizado en conejos y relacionado con la aterosclerosis, fue reportado a principios del siglo veinte [Ignatowski, 1908].
Diversos animales como el cerdo, mono, hámster, conejillo de indias, pollo y conejo, se han empleado para estudiar los mecanismos implicados en el desarrollo de aterosclerosis. Sin embargo por razones de costos e infraestructura, y debido a que el conejo de laboratorio presenta hipercolesterolemia, a los pocos días de la administración de una dieta alta en colesterol, siendo además muy sensible a la inducción de lesiones ateromatosas, este animal es el mayormente utilizado por los investigadores, para el estudio de aterosclerosis, principal causa de mortalidad en la sociedad occidental [Gil y col., 2007].
Taxonomía
Oryctolagus cuniculus (Linnaeus, 1758)
La raza de conejo Nueva Zelanda es la más utilizada en la investigación [Yanni, 2004; Bocan y col., 1993]. Los conejos fueron considerados roedores hasta 1912, pero diferencias en su dentición resultó en el establecimiento de un nuevo orden: Lagomorpha. Los miembros de este orden, poseen 6 incisivos, en contraste los roedores tienen solo 4 incisivos. La clasificación taxonómica del conejo es: Reino Animal, Phylum Chordata, Clase Mammalia, Orden Lagomorpha, Familia Leporidae, Género Oryctolagus, Especie cuniculus [Tislerics, 2000; Fox, 1974].
Existen más de 100 razas de conejos, siendo Nueva Zelanda y Dutch, las más comúnmente usadas en laboratorio. Hay además variedades empleadas en laboratorio, incluyendo el conejo Watanabe, que tiene una predisposición genética para elevados niveles de lipoproteínas de baja densidad (LDL).
Manejo del conejo
El consumo diario de alimento es aproximadamente el 5% del peso del animal, mientras el consumo diario de agua representa alrededor del 10% del peso. La dieta típica en el conejo de laboratorio contiene aproximadamente 15% de proteína, 40-50% de carbohidratos, 2% de grasa vegetal y 15-25% de fibra [Harkness y Wagner, 1980; Yanni, 2004].
Se ha reportado que las hembras son menos propensas a la inducción de lesiones arterioscleróticas en comparación con los conejos machos. La protección de las hembras parece deberse a la presencia de altas concentraciones de estrógenos [Holm y col., 1998].
Con el objetivo de evitar el maltrato de los animales de laboratorio, existen regulaciones que deben ser acogidas por los investigadores [NIH Guide for the care and use of laboratory animals, 1966; Technical Expert Working Group for the revision of directive 86/609/EEC on the protection of animal used for experimental and other scientific purposes, 2003].
Manifestaciones clínicas de aterosclerosis
Infarto del miocardio, falla cardiaca, apoplejía, enfermedad de arterias periféricas [Werner y Nickenig, 2006].
Epidemiología de las enfermedades cardiovasculares
Actualmente las enfermedades cardiovasculares son la principal causa de morbilidad y mortalidad en la población adulta. La arteriosclerosis es una condición patológica que precede a la mayoría de los episodios cardiovasculares. La hiperlipidemia es reconocida como un importante factor de riesgo de arteriosclerosis. LDL son componentes del colesterol que son altamente asociadas con el incremento en el riesgo de enfermedades cardiovasculares [de Castro y col., 2009].
En la mayoría de países europeos, las enfermedades cardiovasculares contribuyen con alrededor del 40% de todas las causas de mortalidad [Kromhout, 2001]. Se estima [Murria y Lopez, 1997] que para el año 2020, la cardiopatía isquémica representará la primera causa de discapacidad y mortalidad en el mundo.
La información epidemiológica de aterosclerosis no coronaria, se halla menos disponible comparada con la de la enfermedad cardiaca coronaria [Pasternak y col., 2004], y los estudios epidemiológicos, patofisiológicos y terapéuticos en la aterosclerosis no coronaria, ha tendido a focalizarse en territorios individuales más que en el árbol vascular en su totalidad. Aunque es importante entender las diferencias críticas entre los diferentes territorios, es también importante que los investigadores reconozcan los vínculos entre los territorios vasculares, conociendo que la aterosclerosis es una enfermedad sistémica.
Resulta preocupante, que en comparación con las enfermedades notificables, las enfermedades cardiovasculares tienen una relativa baja prioridad en la agenda global de la salud, por lo que esta situación requiere adicional interés [Gersh y col., 2010].
Modelo animal
El modelo animal ideal en la enfermedad cardiovascular deberá reproducir a sujetos humanos, metabólica y patofisiológicamente, para permitir estudios fisiológicos y metabólicos; además deberá desarrollar las etapas finales de la enfermedad comparable a las presentadas en humanos. Dada la compleja naturaleza multifactorial de la enfermedad cardiovascular, ninguna especie animal resultará apropiada para todos los estudios. El conejo requiere de una dieta alta en colesterol para desarrollar la patología cardiovascular, sin embargo no es un animal modelo para investigar el síndrome metabólico [Russel y Proctor, 2006].
La información obtenida a partir de los modelos animales requiere el análisis de su aplicabilidad a la patología humana, y por ello la información obtenida en ambos contextos debe ser complementaria. En la actualidad la experimentación animal es un requisito legal encaminado a garantizar la seguridad antes de introducir fármacos y diversos procedimientos diagnósticos y terapéuticos en la clínica. Conejos alimentados con dietas altas en colesterol, se han empleado ampliamente para analizar la formación y evolución de las lesiones ateroscleróticas, así como su regresión al modificar la dieta o recibir tratamiento farmacológico [Chorro y col., 2009].
Los animales manipulados genéticamente permiten la sobre exposición de un producto génico determinado o su no expresión, y se les identifica como animales transgénicos y knockout, respectivamente [Flores-Pérez y Pérez-Martínez, 2006].
Mediante la transgénesis, se puede alterar el genoma del mamífero así como transmitir las modificaciones a través de la línea germinal. Aunque los procedimientos son técnicamente posibles en grandes animales, por razones de costo, tiempo y consideraciones de manejo, la investigación básica en el área cardiovascular, se ha limitado al ratón y en menor número de casos al conejo [Dalloz y col., 2001].
En la tecnología knockout, se remplaza el ADN endógeno en un punto previamente definido con ADN mutado, valiéndose de la recombinación homóloga para insertar el ADN en regiones específicas de estos genes, ello propicia la inactivación del producto génico. Se obtienen así animales que carecen del producto génico o que poseen mutación; su utilidad está centrada en determinar si un gen posee una función crítica. El ratón es el animal knockout más empleado en los estudios de endotelio [Flores-Pérez y Pérez-Martínez, 2006].
Se han generado conejos transgénicos, en los cuales se han sobreexpresados algunos genes involucrados en el metabolismo de las lipoproteínas del plasma. Ejemplo de ello, líneas que sobreexpresan lipasa hepática (normalmente deficiente en conejos al compararlo con otros animales como la rata), apolipoproteína E, apolipoproteína B, apolipoproteína A [Taylor y Fan, 1997; Sun y col., 2002].
El conejo fue seleccionado por el National Human Genome Research Institute, para secuenciar su genoma completo, y así aumentar nuestro conocimiento de elementos estructurales y funcionales del genoma humano e incrementar el valor experimental del conejo, como un modelo animal para las enfermedades humanas [NCBI, sin fecha].
Se han desarrollado conejos Nueva Zelanda modificados genéticamente, que expresan la Apo A-1 humana, lecitincolesterol-aciltransferasa, lipasa hepática; y cepas de conejos Watanabe con hiperlipemia hereditaria (WHHL), que expresan la Lp (a) humana [Yanni, 2004; Bosze y col., 2003].
Los conejos WHHL tienen una mutación natural (delección de 4 codones) en el gen para el receptor de LDL, que lo convierte en no funcional y provoca altos niveles séricos de LDL y aterosclerosis pronunciada [Kronemberg, 2009].
Se desarrolló un modelo animal (conejos WHHLCA), que presenta las típicas placas ateromatosas en las coronarias, similares a las halladas en humanos. Posteriormente se desarrolló un modelo animal (conejos WHHLMI) para la investigación del infarto cardíaco espontáneo [Shiomi y col., 2003; Ito y col., 2004]. Se espera que estos animales contribuyan al estudio de las enfermedades isquémicas coronarias y al hallazgo de nuevos terapias.
Investigadores hindúes [Madhumathi y col., 2006], ante el elevado costo de conejos WHHL, seleccionaron conejos Nueva Zelanda para inducirles experimentalmente aterosclerosis, resultando un apropiado costo-efectivo modelo animal.
Se obtuvo un modelo de conejo transgénico para la cardiomiopatía hipertrófica [Marian y col., 1999], mediante la mutación en el gen de la cadena pesada de la miosina β. Estos animales desarrollan hipertrofia cardiaca, desorganización en miocitos y miofibrillas, incremento en el contenido de colágeno intersticial y alta incidencia de muerte prematura.
Suplementación con aceites vegetales o colesterol
Se alimentaron durante 9 semanas a un grupo de conejos con una dieta enriquecida con aceite crudo de palma (grupo experimental), y con aceite de maíz (grupo control). En el grupo experimental se halló un aumento no significativo de los triglicéridos y del colesterol total plasmático. El aceite crudo de palma contiene mayor relación de ácido grasos saturados/poliinsaturados, produciendo diferencias en el contenido de ácido palmítico y ácido linoleico de los triglicéridos [Alfonzo y Ortiz, 2001].
Se reportó correlación positiva entre ingesta de ácidos grasos saturados, niveles altos de colesterol en el suero y mayor incidencia de infartos al miocardio en el hombre; pero no todos los ácidos grasos saturados tienen el mismo efecto hipercolesterolémico, el ácido mirístico es cuatro veces más aterogénico que el laúrico y el palmítico [Jeremiach, 1978].
Conejos alimentados con una dieta libre de colesterol, pero rica en grasas saturadas y celulosa como fibra dietética, presentaron severos ateromas que disminuyeron al cambiar la celulosa por alfalfa [Kritchevsky y col., 1977].
Se demostró que conejos alimentados con aceite de palma, presentaban alto grado de aterosclerosis [Vles, 1978].
Un factor a tomar en consideración, al evaluar el efecto de diferentes aceites comestibles en los lípidos de la sangre, es el tiempo durante el cual son alimentados los conejos. Es así como a los dos meses de una dieta enriquecida con colesterol, no se produjeron cambios en el contenido de colesterol total plasmático al comparar una dieta con aceite de palma y otra con aceite de maíz; sin embargo a los seis meses el colesterol total aumentó en ambos grupos [Torrealba y col., 1996].
Resulta interesante conocer que la población de países mediterráneos, especialmente en la isla de Creta, tienen más baja mortalidad por enfermedades isquémicas del corazón, que la población que vive en otras partes de Europa o Estados Unidos. Una diferencia es el alto consumo en los países mediterráneos, y que llega a ser excesivo en la isla de Creta, de aceites monoinsaturados como el aceite de oliva [Simons, 1986].
Una búsqueda sistemática en MEDLINE se llevó a cabo [Mente y col., 2009], para hallar estudios de cohorte prospectivos o ensayos aleatorios que investigaran los niveles de exposición dietaria en relación con la enfermedad coronaria.
Utilizaron las pautas de Bradford Hill para obtener un índice de causalidad basado en cuatro criterios (fuerza, consistencia, temporalidad y coherencia) para cada nivel de exposición dietaria en estudios de cohorte. Hallaron una fuerte evidencia que sostiene, asociaciones válidas entre factores de protección, donde se incluye la ingesta de vegetales, frutos secos y alimentos de la dieta mediterránea, y patrones dietarios de calidad y la enfermedad coronaria.
La ingesta de una dieta enriquecida con colesterol y grasa, no solo induce aterosclerosis en el conejo, también afecta el sistema de defensa antioxidante, que incluye las enzimas superóxido dismutasa, catalasa y glutatión peroxidasa. Sin embargo, la administración de una dieta enriquecida con grasas insaturadas, como aceite de oliva y de pescado, mejoraron el perfil del sistema antioxidante hepático [Aguilera y col., 2003].
Se ha reportado, que la administración de aceite de oliva en conejos con elevado colesterol, reduce la trombogenicidad vascular del subendotelio, incrementa la actividad antitrombótica en el endotelio y disminuye el porcentaje de la pared ocupada por células espumosas [de la Cruz y col., 2000; Tsantila y col., 2007].
En un estudio realizado durante cuatro meses, se alimentaron conejos con aceite crudo de palma y otro grupo con aceite de maíz. Las concentraciones del colesterol total en plasma aumentaron significativamente con ambos aceites; la concentración de la fracción de lipoproteínas de alta densidad (HDL, llamado también colesterol bueno) aumentó significativamente con el aceite de palma pero no con el de maíz; los triglicéridos aumentaron significativamente en la dieta a base de aceite de maíz. Sin embargo no se deben extrapolar estos resultados al hombre, como por ejemplo el aumento de HDL en conejos por el aceite de palma, ya que la ingesta de colesterol en la dieta humana es variable, y factores genéticos, ejercicio y medicamentos influyen en su concentración plasmática [Scorza y col., 2003].
El aceite de palma y sus derivados, contienen apreciables cantidades de tocotrienoles, en particular de γ-tocotrienol que puede reducir la concentración del colesterol plasmático, mediante la inhibición de la enzima hidroximetil glutaril coenzima A (HMG-CoA) reductasa hepática que regula la síntesis de colesterol, lo cual también pudiera modificar la estructura y estabilidad de la HDL [Cottrell R, 1991; Gapor y col., 1983].
Influye en los resultados, el tipo de aceite de palma empleado. El aceite refinado de palma, contiene menor cantidad de antioxidantes como tocoferoles y tocotrienoles que el aceite crudo de palma [Caron y White, 2001].
La ingesta de diferentes tipos de ácidos grasos influye en la formación de trombos en el hombre, siendo los saturados como el esteárico y el mirístico, los más trombogénicos y que están presentes en mayor proporción en las grasas de origen animal [Trevisan y col., 1990].
El reemplazo de ácidos grasos saturados por monoinsaturados como el oleico presente en el aceite de oliva, produce una reducción de la trombosis en las personas. Sin embargo, el aceite de palma, el cual contiene 50% de ácido palmítico (saturado), no aumentó la agregación plaquetaria al ser administrado por largo tiempo a ratas y conejos [Scorza y col., 1999].
Se piensa que la composición del aceite de palma, con 37% de ácido oleico (monosaturado) y con 12% de ácido linoleico (poliinsaturado), puede influir en la concentración del colesterol plasmático y en su efecto para generar trombosis [Hornstra y Lussemburg, 1975].
Se reportó en conejos alimentados con dietas suplementadas con aceite crudo de palma o maíz durante cuatro meses, mayores daños morfológicos en la aorta torácica y abdominal en los animales suplementados con aceite de maíz. Ello podría explicarse por el efecto protector inducido por el aceite de palma en el aumento del HDL y por el alto contenido de antioxidantes, como ß-caroteno y tocotrienoles en comparación con otros aceites [Aster y col., 2004].
En un experimento donde se suplementó a los conejos durante tres meses, con colesterol, aceite de oliva y aceite de maíz, no cambió significativamente la concentración de triglicéridos ni de colesterol al compararlos con el grupo control. Sin embargo los conejos del grupo control y los que recibieron aceite de maíz, requirieron mayor cantidad de colesterol en la dieta para mantener semejantes los niveles de colesterol en los tres grupos [Leth-Espensen y col., 1988].
Afectación vascular
El primer estudio prospectivo e intervencional que demostró una sustancial reducción de lesiones ateroscleróticas, llevado a cabo en conejos alimentados con colesterol fue reportado en 1957. Luego de tratamientos intravenosos con fosfatidilcolina, las placas fueron aisladas, mucho más pequeñas que al inicio y gran parte de las reservas de colesterol fueron removidas. La idea de revertir el ateroma, ha tenido gran resistencia durante décadas. Ello es debido al hecho de que el avanzado ateroma en humanos y modelos animales, tiene componentes que dan la impresión de permanencia, como necrosis, calcificación y fibrosis. La regresión de la aterosclerosis, generalmente requiere fuertes medidas para mejorar el perfil de las lipoproteínas del plasma, tales como la reducción de la concentración de apolipoproteína B en el plasma [Williams y col., 2008].
El área de lesiones ateroscleróticas en la aorta fue significativamente menor en animales con aterosclerosis inducida por la dieta y que recibieron diacilglicerol, en comparación con los que recibieron triacilglicerol. El hígado de los conejos que recibieron diacilglicerol, mostró menores concentraciones de triacilglicerol y mayor actividad de la carnitina palmitoiltransferasa que los alimentados con triacilglicerol. El efecto antiaterogénico de los diacilgliceroles, puede estar relacionado a un aumento del metabolismo lipídico hepático y a un más eficiente clearance lipídico postprandrial [Ota y col., 2007].
Condiciones de stress conllevan a la excesiva formación de radicales libres. La exposición de los lípidos de la membrana celular a los radicales libres, estimula el proceso de peroxidación [Halliwell y Gutteridge, 1984].
Malondialdehido (MDA) es uno de los indicadores más frecuentemente usados en la peroxidación lipídica. Valores aumentados de MDA se han reportado en patologías cardiovasculares [Draper y col., 1986].
El stress producido por inanición incrementó la peroxidación lipídica y alteró el perfil lipídico en conejos [Lata y col., 2002].
Casos esporádicos de opacidad corneal con lesiones ateromatosas en la íntima de la aorta, arterias coronarias, bronquiales y renales, se presentaron en conejos de laboratorio Nueva Zelanda, libres de patógenos específicos, y que recibieron una dieta con 10% de pescado blanco. Por microscopía electrónica se apreciaron en el estroma corneal, posibles cristales de colesterol [Sebesteny y col., 1985]. El reemplazo por una dieta contentiva de 10% de harina de gramíneas, resultó en la prevención de las lesiones y síntomas. Esta situación pone en evidencia el cuestionamiento, sobre la decisión de emplear productos de origen animal para alimentar especies herbívoras.
Pacientes hiperlipidémicos muestran alteraciones en la vascularización ocular. Se analizó en conejos, el efecto de la normalización de los valores de colesterol sérico, en el daño inducido por hipercolesterolemia en la vascularización de la coroides [Salazar y col., 2007], hallándose que la normalización de los valores de colesterol no fue suficiente para revertir el daño en la coroides, compatible con una isquemia crónica que puede conllevar a la degeneración retiniana.
Animales suplementados durante doce semanas con 0,5% y 1% de colesterol, mostraron un incremento significativo de colesterol a partir de la cuarta semana. El grupo suplementado con 1% de colesterol, presentó estrías adiposas en ambas carótidas [Alfonso y col., 2001].
En animales alimentados con dietas altas en colesterol, se halló que el etinil-estradiol y los estrógenos conjugados de equino, redujeron la aterosclerosis en 35% en el arco aórtico y en 75-80% en la aorta abdominal y torácica [Yanni, 2004].
La información aportada por imágenes (Anexos: Figuras IV y V) de resonancia magnética obtenidas in vivo [Sharma y col., 2004] en conejos con aterosclerosis inducida, mostró correlación con la histopatología de las capas de la pared aórtica y tamaño de la placa. Estas investigaciones permitirían entender más la patogénesis de la coronariopatía aguda.
La inducción del Factor Tisular (TF) por aldehídos, podría contribuir a la severidad de la aterogénesis, dado el efecto demostrado por hexanal y 2,4-decadional (2,4-DEF), dos aldehídos apolares derivados de la peroxidación de ácidos grasos poliinsaturados, en el incremento de la expresión del Factor Tisular (TF) [Cabré y col., 2003].
Conejas ovariectomizadas, con dieta alta en colesterol y que recibieron tibolona [Castelo-Branco y col., 2003], redujeron la extensión de lesiones ateroscleróticas en aorta; esta reducción no se relacionó con los tenores de lípidos en sangre.
Se investigó el efecto del tratamiento con fenofibrato durante cuatro semanas, en la expresión del Factor Tisular (TF) y las modificaciones celulares posteriores a la ruptura de la placa mediante angioplastia con balón en conejos ateromatosos. El fenofibrato disminuyó in vivo la expresión del Factor Tisular (TF) y el contenido de colesterol en arterias ilíacas; mejoró significativamente la reendotelialización y modificó la distribución celular en la placa, con un incremento de su estabilización [Jeanpierre y col., 2009].
En arterias femorales de conejos ateroscleróticos, licofelone, una droga antiinflamatoria que inhibe la 5-lipooxigenasa y la ciclooxigenasa, redujo la inflamación y la formación de neoíntima, de manera más marcada que el rofecoxib, un inhibidor selectivo de la ciclooxigenasa-2. Además licofelone atenuó la infiltración neointimal por macrófagos en la lesión aterosclerótica [Vidal y col., 2007].
Se indujo mediante el empleo de simvastatina [Patel y col., 2001], la regresión de la hipertrofia y fibrosis, además mejoró la función cardiaca en conejos transgénicos.
Se evaluó el efecto de fluvastatina en conejos hipercolesterolémicos [Camera y col., 2002], evidenciándose una reducción de la tendencia protrombótica mediada por la inhibición de la síntesis de TF.
Al investigar la acción de las estatinas [Zawadzki y col., 2007], se halló una asociación de la dislipidemia con un cambio en el balance TF/TFPI y de la actividad del Factor Tisular (TF) en el potencial trombótico de la placa. Las estatinas corrigen este desequilibrio principalmente el decrecimiento del Factor Tisular (TF) de la placa junto con las lipoproteínas aterogénicas de la sangre.
Los monocitos y macrófagos son las células hematopoyéticas que mayormente expresan el Factor Tisular (TF). Sin embargo, después de disminuir estas células mediante la irradiación de los animales con Cesio 137 y al reducir en 50% el Factor Tisular (TF), no evidenciaron la afectación en el desarrollo de lesiones arterioscleróticas en ratones [Tilley y col., 2006], a diferencia de lo que ocurre en conejos.
La calcificación vascular se ha implicado en el infarto al miocardio, inestabilidad y rigidez de la pared aórtica y fallas en prótesis biológicas. Sin embargo, se halló una disminución de aterosclerosis en conejos sometidos a una dieta aterogénica y suplementada con calcio [Hsu y Culley, 2006]. Estos investigadores proveyeron a conejos, una dieta que contenía 0,5% de colesterol, 2% de aceite de maní y ajustaron el contenido de calcio de la dieta, que normalmente es de 1% y lo llevaron a 0,5% o 3%. Los animales suplementados con calcio, disminuyeron significativamente en 41% las lesiones e inhibió la calcificación en 62%, en los segmentos de aorta evaluados. La deficiencia del mineral incrementó significativamente las lesiones y ocasionó una pequeña pero significativa calcificación, no hallada en los grupos de conejos que siguieron una dieta normal en calcio. La suplementación con calcio produjo una disminución significativa del 30% en el colesterol sérico, mientras que la deficiencia de calcio incrementó el colesterol sérico en 57%.
Se examinó el efecto de la lipoproteína A humana, en cultivos de células musculares lisas de aorta de conejos transgénicos WHHL, hallándose un incremento en la actividad de la fosfatasa alcalina y aumento en la acumulación de calcio [Sun y col., 2002].
Estudios in vitro han mostrado que antioxidantes como las vitaminas C y E, β-caroteno y selenio, reducen la peroxidación lipídica y el daño por radicales libres, los cuales son importantes intermediarios en la patogénesis de la aterosclerosis. Vitaminas del complejo B, incluyendo folato, vitamina B-6 y vitamina B-12, disminuyeron las concentraciones de homocisteína, un independiente factor de riesgo de enfermedades cardiovasculares, en estudios observacionales. Sin embargo, un meta-análisis llevado a cabo recientemente en humanos [Bleys y col., 2006], no mostró evidencia del efecto protector de la suplementación con vitaminas y minerales antioxidantes o vitaminas del complejo B, en la progresión de aterosclerosis.
Suplementación con productos naturales
En conejos con una dieta alta en colesterol, se logró la inhibición de la progresión de aterosclerosis [Yamakoshi y col., 2000] posterior a la administración de un extracto de isoflavonas sin contenido proteico de soya. Estos resultados sugieren, según los investigadores, que la acción antioxidante de las isoflavonas y sus metabolitos, inhiben la oxidación de las LDL, y de este modo ejercen un efecto antiaterosclerótico.
Se investigaron los efectos del yogurt de soya suplementado con isoflavonas, en el perfil lipídico y desarrollo de aterosclerosis en conejos con hipercolesterolemia. Se encontró una disminución significativa, de 38,1% en el colesterol total promovido por el consumo de yogurt de soya; la extensión de lesiones arterioscleróticas en aorta torácica y abdominal se redujo mayormente tras el consumo de yogurt con isoflavonas [Cavallini y col., 2009].
Se evaluó en conejos hipercolesterolémicos, el efecto de la ingesta diaria de un producto de soya fermentada por Enterococcus faecium y Lactobacillus jugurti, en los niveles séricos de colesterol total, fracción HDL y triglicéridos. El grupo que recibió el producto fermentado disminuyó 18,46% la concentración de colesterol total y aumentó 17,8% la fracción HDL. Sin embargo las concentraciones de triglicéridos mostraron diferencias no significativas [Rossi y col., 2000].
La suplementación con Spirulina platensis, demostró por primera vez [Cheong y col., 2010] sus efectos protectores en el perfil lipídico y en la prevención de atherosclerosis en conejos con hipercolesterolemia inducida. Disminuyó en la aorta la superficie intimal, y el colesterol total y triglicéridos séricos se redujeron significativamente. Después de ocho semanas, la suplementación con 5% de espirulina, disminuyó en 41,2% las LDL, asimismo se incrementó el HDL desde las dos a ocho semanas, tras la suplementación con 1% o 5% de espirulina. Previamente se había reportado [Nagaoka y col., 2005] en espirulina que una nueva proteína, C-ficocianina, que contiene gran cantidad de cistina, podría inducir una fuerte actividad hipocolesterolémica en ratas.
Un producto natural de Piper sarmentosum, una hierba conocida por sus propiedades antiinflamatorias y antioxidantes, demostró actividad antiaterogénica [Amran y col., 2010], redujo el engrosamiento de la túnica íntima y disminuyó la lesión aterosclerótica en conejos con hipercolesterolemia.
Estudios epidemiológicos han mostrado una disminución del riesgo de enfermedades cardiovasculares, ante la ingesta de una alta cantidad de polifenoles. Se halló una disminución de la oxidación plasmática de LDL, atribuible a los polifenoles del vino tinto [Wakabayashi, 1999].
Algunos efectos físicos
En conejos alimentados con una dieta alta en grasa y colesterol se presentaron evidencias correlacionadas entre la aviación y la patogénesis de aterosclerosis [Luo y col., 2010]. Los niveles de colesterol total y LDL en el grupo experimental sometido a aceleración, fue significativamente mayor comparado con el grupo control. Los valores de HDL en el grupo experimental no mostraron diferencias significativas con el grupo control. Los triglicéridos aumentaron significativamente a las ocho semanas del experimento y disminuyeron significativamente a las doce semanas en los animales sometidos a aceleración positiva. En el grupo experimental, el contenido de monóxido de carbono en el endocardio y la actividad de la hemooxigenasa-1 en células endoteliales de la aorta, fueron significativamente más altos que en los controles, en la cuarta, octava y decimosegunda semana.
Conejos sometidos a inmovilización forzada por dos horas diarias durante siete días, produjo un significativo aumento en los niveles séricos de malondialdehido (MDA), colesterol total, LDL, VLDL y triglicéridos. Se halló una positiva correlación del incremento de MDA con el incremento del colesterol total, LDL, VLDL y triglicéridos; la correlación del malondialdehido (MDA) con el HDL resultó negativa [Lata y col., 2004]. Estos resultados permiten predecir un incremento de la susceptibilidad a la arteriosclerosis en conejos, como resultado del stress por inmovilización.
Influencia de algunos minerales
Los hallazgos sobre los efectos del hierro en la aterogénesis son controversiales. Es así como se evidenció, posterior a la sobrecarga de hierro en conejos hipercolesterolémicos, aumento en el desarrollo de lesiones ateroscleróticas al compararlos con el grupo de animales hipercolesterolémicos que no recibieron hierro [Araujo y col., 1995].
Se investigó [Dabbagh y col., 1997] en conejos alimentados con una dieta que contenía 1% de colesterol, tanto la sobrecarga de hierro mediante la inyección con hierro dextrano como la deficiencia de hierro provocada por flebotomía, en el desarrollo de aterosclerosis. La sobrecarga de hierro disminuyó los niveles de colesterol en el plasma, además disminuyó significativamente la formación de lesiones en 56%. Esta investigación mostró por primera vez, que la deficiencia de hierro por flebotomía no mejora el desarrollo de aterosclerosis en conejos hipercolesterolémicos.
La suplementación con hierro dextrano vía intramuscular, zinc y cobre vía oral, en conejos que recibieron una dieta alta en colesterol, presentaron niveles significativamente más bajos de lípidos séricos, comparados con el grupo de conejos hipercolesterolémicos que solo recibieron la sobrecarga de hierro [Rashtchizadeh y col., 2008]. Los valores más altos entre los animales hiperlipidémicos, se observaron en los que solo recibieron repetidas inyecciones de hierro dextrano y en los suplementados con zinc sin sobrecarga de hierro. Concluyen estos investigadores, que la interacción entre el cobre y el zinc, podría modular la génesis de la aterosclerosis, mediante su influencia en la capacidad antioxidante celular y del perfil lipídico sérico.
Hiperlipidemia en conejos infectados
Una dieta aterogénica se empleó en conejos de la especie Sylvilagus floridanus, infestados con el agente causal de la enfermedad de Chagas, Tripanosoma cruzi. Los niveles de CT, LDL y HDL fueron significativamente menores en este grupo de animales al compararlos con los que solo recibieron dieta aterogénica. La disminución de CT podría deberse a una capacidad disminuida del hígado infectado y/o a una mayor peroxidación de LDL por efecto de la infección, con la consecuente eliminación biliar de colesterol. La disminución de los niveles séricos de HDL, pudiera actuar como potente agente aterogénico [Alarcón, 2004].
Conejos hipercolesterolémicos que recibieron endotoxinas de Escherichia coli vía intravenosa, exhibieron una significativa aceleración de la aterosclerosis. Estos datos apoyan el concepto de que la aterosclerosis tiene un componente inmunopatológico, por lo que un agente infeccioso puede asumir particular importancia en su iniciación o progresión [Lehr y col., 2001].
Sin embargo la administración repetida de lipopolisacáridos bacterianos en conejos con una dieta hipercolesterolémicos [Kerttula y col., 1986], no tuvo efecto en la progresión de la aterosclerosis.
Chlamydia pneumoniae puede infectar células del sistema respiratorio o cardiovascular, incluyendo epitelio pulmonar, macrófagos alveolares, monocitos circulantes y endotelio vascular. Conejos hiperlipidémicos desarrollaron cambios aórticos consistentes con lesiones tempranas de aterosclerosis, posterior a una infección respiratoria con C. pneumoniae [Fong y col., 1997; Muhlestein, 2000]. La idea de que infecciones contribuyan al desarrollo de la placa aterosclerótica y enfermedades cardiovasculares, no es un concepto nuevo, pero resulta extremadamente difícil de probar categóricamente. Una larga lista de asociaciones y evidencias, correlacionan la infección de C. pneumoniae con la aceleración de enfermedades cardiovasculares [Belland y col., 2004].
Podemos concluir, que a un siglo de los primeros hallazgos de Ignatowski, y disponiendo actualmente con los avances de la genómica, el desarrollo de cultivos celulares y de otros experimentos in vitro, el conejo de laboratorio, manejado bioéticamente, seguirá brindando respuestas en beneficio de la salud del hombre y los animales.
ANEXOS
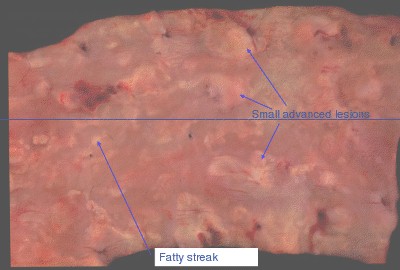
Figura I: Aorta humana aterosclerótica
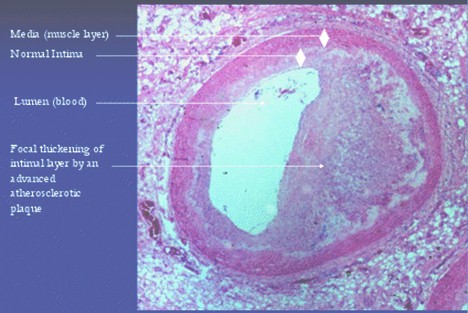
Figura II: Arteria coronaria humana con aterosclerosis
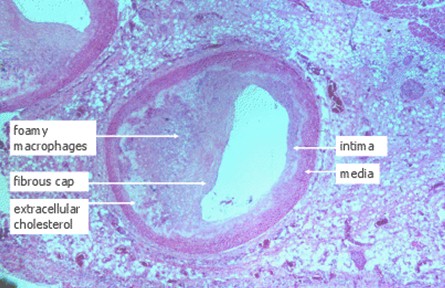
Figura III: Arteria coronaria humana con aterosclerosis avanzada.
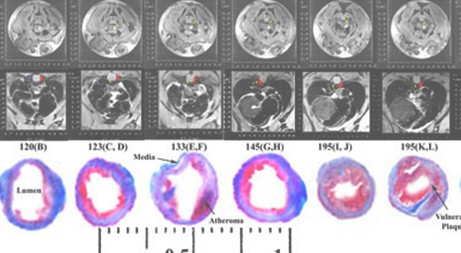
Figura IV: Imágenes por Resonancia Magnética de arteria coronaria aterosclerótica de conejo y de muestras histopatológicas
Fuente: Sharma and Singh. Thrombosis Journal 2004; 2:5
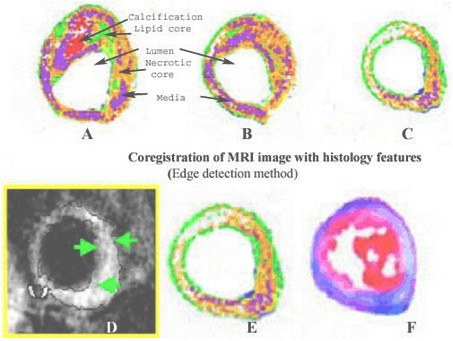
Different artery atheroma features are represented on coronary artery postsegmented feature map images for distinct plaque components and media layer (first and second panels on top). The combinations of different signal intensities (panels A-F) predict the distinct color-coded plaque feature(s) by using robust VTK program. At bottom, a proton density in vivo MRI image (left panel) shows dark areas of fibrous layer (arrow), lipid rich regions (gray areas open arrow). T2 parametric in vivo image (left panel) is shown with corresponding postsegmented image (middle panel) with corresponding coronary artery histology section showing different areas corresponding with varying T2 ranges for different atheroma components shown in Table 6. On histology sections, matrix appears bluish, calcification show gaps, atheroma as red and continuous fibrous layer.
Figura V: Imágenes arteria coronaria aterosclerótica de conejo
Fuente: Sharma and Singh.Thrombosis Journal 2004; 2:5
Referencias
1. Aguilera C, Mesa M, Ramírez-Tortosa M, Quiles J, Gil A. Virgin olive and fish oils enhance the hepatic antioxidant defence system in atherosclerotic rabbits. Clinical Nutrition 2003; 22(4):379-384
2. Alarcón M, Añez N, Calderón L, Matousek A. Evaluación de la ingesta de colesterol en conejos infectados con Tripanosoma cruzi. Kasmera 2004; 32(2):117-126
3. Alfonso M, Almeida G, Quintela A, Carballo R. Evaluación de un posible modelo experimental de aterosclerosis carotídea en conejos hipercolesterolémicos. Rev Cubana Invest Biomed 2001; 20(3):192-196
4. Alfonso Pérez C, Ortiz H. The relationship between the degree of dietary-induced hypercholesterolemia in the rabbit and atherosclerotic lesion formation. Atherosclerosis 2001; 102:9-22
5. Amran A, Zakaria Z, Othman F, Das S, Raj S, Nordin M. Aqueous extract of Piper sarmentosum decreases atherosclerotic lesions in high cholesterolemic experimental rabbits. Lipids in Health and Disease 2010; 9(1):44
6. Araujo J, Romano E, Brito B, Parthé V, Romano M, Bracho M. Iron overload augments the development of atherosclerotic lesions in rabbits. Arterioscler Thromb Vasc Biol 1995; 15:1172-1180
7. Aster M, Scorza T, Gallardo L, Hamana N. Alteraciones bioquímicas en conejos alimentados con aceite de palma y maíz y su relación con los hallazgos morfológicos. Revista de la Facultad de Medicina 2004; 27(1)
8. Belland R, Ouellette S, Gleffers J, Byrne G. Chlamydia pneumoniae and atherosclerosis. Cellular Microbiology 2004; 6(2):117-127
9. Bleys J, Miller E, Pastor-Barriuso R, Appel L, Guallar E. Vitamin-mineral supplementation and the progression of atherosclerosis: a meta-analysis of randomized controlled trials. The American Journal of Clinical Nutrition 2006; 84:880-887
10. Bocan T, Mueller S, Mazur M, Uhlendorf P, Brown E, Kieft K. Efectos del aceite crudo de palma en los lípidos plasmáticos de conejos. Revista de la Facultad de Medicina 1993; 24(1)
11. Bosze Z, Hiripi L, Carnwath J, Niemmann H. The transgenic rabbit as model for human diseases and as a source of biologically active recombinant proteins. Transgenic Research 2003; 12:541-553
12. Cabré A, Girona J, Vallvé J, Masana L. Aldehydes mediate tissue factor induction: A possible mechanism linking lipid peroxidation to thrombotic events. Journal of Cellular Physiology 2003; 198(2): 230-236
13. Camera M, Vincenzo T, Comparato C, Baetta R, Rossi F, Fuortes M, Ezekowitz M, Paoletti R, Tremoli E. Cholesterol-induced thrombogenicity of the vessel wall: Inhibitory effect of fluvastatin. Thrombosis and Haemostasis 2002; 87(4):748-755
14. Caron M, White M. Evaluation of the antihyperlipidemic properties of dietary supplements. Pharmacotherapy 2001; 21(4)
15. Castelo-Branco C, Sanjuán A, Ascaso C, Colodrón M, Blϋmel J, Casals E, Ordi J, Vanrell J. Tibolone inhibits aortic atherosclerotic lesion formation in oophorectomized cholesterol-fed rabbits. Experimental Clinical Cardiology 2003; 8(1):21-25
16. Cavallini D, Abdalla D, Vendramini R, Bedani R, Bomdespacho L, Pauly-Silveira N, Valdez G, Rossi E. Effects of isoflavone-supplemented soy yogurt on lipid parameters and atherosclerosis development in hypercholesterolemic rabbits: a randomized double-blind study. Lipids in Health and Disease 2009; 8:40
17. Cheong S, Kim M, Sok D, Hwang S, Kim J, Kim H, Lee J, Kim Y. Spirulina prevents atherosclerosis by reducing hypercholesterolemia in rabbits fed a high-cholesterol diet. J Nutr Sci Vitaminol 2010; 56:34-40
18. Cottrell R. Introduction: nutritional aspects of palm oil. J Clin Nutr 1991; (53):989S-100S
19. Dabbagh A, Shwaery G, Keaney J, Frei B. Effect of iron overload and iron deficiency on atherosclerosis in the hypercholesterolemic rabbit. Arteriosclerosis, Thrombosis, and Vascular Biology 1997; 17:2638-2645
20. Dalloz F, Osinka H, Robbins J. Genetically modified animal models in cardiovascular research. Revista Española de Cardiología 2001; 54(6): 764-789
21. de Castro M, Veiga A, Pacheco M. Plasma lipid profile of experimentally induced hyperlipidemic New Zealand white rabbits is not affected by resveratrol. The Journal of Applied Research 2009; 9(1):18-22
22. de La Cruz J, Villalobos M, Carmona J, Martín-Romero M, Smith-Agreda J, de la Cuesta F. Antithrombotic potential of olive oil administration in rabbits with elevated cholesterol. Thrombosis Research 2000; 100(4):305-315
23. Draper H, McGirr L, Haldey M. The metabolism of malondialdehyde. Lipids 1986; 21:305-307
24. Flores-Pérez F, Pérez-Martínez M. Avances en el estudio de la fisiología y patología endotelial en modelos animales. Vet. Méx. 2006; 37(2):239-261
25. Fong I, Chiu B, Viira E, Fong M, Jang D, Mahoney J. Rabbit model for Chlamydia pneumoniae infection. J Clin Microbiol 1997; 35:48-52
26. Fox R. Taxonomy and genetics. En: The Biology of the Laboratory Rabbit. (Weisbroth S, Flatt R and Kraus A, eds.) Academic Press, San Diego, 1974, pp. 1-22
27. Gapor A, Berger K, Hashimoto T et al. Effects of processing on the content and composition of tocopherols and tocotrienols in palm oil. In: Pushparajah E, Rajadurai M, eds. The palm oil product technology in the eighties. Kuala Lumpur: Incorporated Society of planters 1983:145-156
28. Gersh B, Sliwa K, Mayosi B, Yusuf S. Novel therapeutic concepts: the epidemic of cardiovascular disease in the developing world: global implications. European Heart Journal 2010; 31(6):642-648
29. Gil A, Ramírez M, Aguilera M, Mesa M. Modelos experimentales de enfermedad cardiovascular. Nutrición Hospitalaria 2007; 22(2):169-177
30. Halliwell B, Gutteridge J. Lipid peroxidation, oxygen radicals, cell damage and antioxidant therapy. Lancet 1984; 1:1396-1397
31. Harkness J, Wagner J. Biología y clínica de conejos y roedores.1980. Editorial Acribia
32. Holm P, Andersen H, Arroe G, Stender S. Gender gap in aortic cholesterol accumulation in cholesterol-clamped rabbits. Role of endothelium and mononuclear cell interaction. Circulation 1998; 98: 2731-2737
33. Hornstra G, Lussemburg RN. Relationship between the type of dietary fatty acid and arterial thrombosis tendency in rats. Atherosclerosis 1975; 22:499-516
34. Hsu H, Culley N. Effects of dietary calcium on atherosclerosis, aortic calcification and icterus in rabbits fed a supplemental cholesterol diet. Lipids in Health and Disease 2006; 5:16
35. Hur S, Du M, Nam K, Williamson M, Ahn D. Effect of dietary fats on blood cholesterol and lipid and the development of atherosclerosis in rabbits. Nutrition Research 2005; 25(10):925-935
36. Ignatowski A. Influence of animal food on the organism of rabbits. St Petersburg Izvest Imp Voyenno-Med Akad 1908; 16:154-176
37. Ito T, Yamada S, Shiomi M. Progression of coronary atherosclerosis relates to the onset of myocardial infarction in an animal model of spontaneous myocardial infarction (WHHLMI rabbits). Exp Anim 2004; 53(4):339.346
38. Jeanpierre E, Tourneau T, Zawadzki C, Van Belle E, Mouquet F, Susen S, Ezekowitz M, Staels B, Jude B, Corseaux D. Beneficial effects of fenofibrate on plaque thrombogenicity and plaque stability in atherosclerosis rabbits. Cardiovascular Pathology 2009; 18(3):140-147
39. Jeremiach S. Dietary and serum lipids in the multifactorial etiology of atherosclerosis. Arch. Surg.1978; 113:21-25
40. Kerttula Y, Vaara M, Pyhälä L, Sariola H, Kostiainen E, Huttunen J. Effect of bacterial lipopolysaccharide on serum lipids and on the development of aortic atherosclerosis in rabbits. Atherosclerosis 1986; 59(3):307-312
41. Kritchevsky D, Tepper S, Williams D, Story J. Experimental atherosclerosis in rabbits fed cholesterol free diets parts (interaction of animal or vegetable protein with fiber). Atherosclerosis 1977; 26:397-403.
42. Kromhout D. Epidemiology of cardiovascular diseases in Europe. Public Health Nutr 2001; 4(2B):441-457
43. Kronenberg G. Williams Tratado de Endocrinología. Editorial EdiDe, SL / Elsevier, Barcelona. España, 2009, págs. 1816-1617
44. Lata H, Ahuja G, Narang A, Walia L. Effect of immobilisation stress on lipid peroxidation and lipid profile in rabbits. Indian Journal of Clinical Biochemistry 2004; 19(2):1-4
45. Lata H, Ahuja G, Narang A. Effect of starvation stress on lipid peroxidation and lipid profile in rabbits. Indian J. Physiol. Pharmacol. 2002;46:371-374
46. Lehr H, Sagban T, Ihling C, Zähringer U, Hungerer K, Blumrich M, Reinfenberg K, Bhakdi S. Immunopathogenesis of atherosclerosis Endotoxin accelerates atherosclerosis in rabbits on hypercholesterolemic diet. Circulation 2001; 104(8):914-920
47. Leth-Espensen P, Stender S, Ravn H, Kjeldsen K. Antiatherogenic effect of olive and corn oils in cholesterol-fed rabbits with the same plasma cholesterol levels. Arteriosclerosis 1988; 8:281-287
48. Luo H, Chen Y, Wang J. Effects of positive acceleration on the metabolism of endogenous carbon monoxide and serum lipid in atherosclerotic rabbits. Journal of Cardiovascular Disease Research 2010; 1(2):75-80
49. Madhumathi B, Venkataranganna M, Gopumadhavan S, Rafiq M, Mitra S. Induction and evaluation of atherosclerosis in New Zealand white rabbits. Indian Journal of Experimental Biology 2006; 44:203-208
50. Marian A, Wu Y, Lim D, McCluggage M, Youker K, Yu Q et al. A transgenic rabbit model for human hypertrophic cardiomyopathy. J Clin Invest 1999; 104(12): 1683-1692
51. Mente A, de Koning L, Shannon H, Anand S. A systematic review of the evidence supporting a causal link between dietary factors and coronary heart disease. Arch Intern Med 2009; 169(7):659-669
52. Milioti N, Bermudez-Fajardo A, Penichet M, Oviedo-Orta E. Antigen-induced immunomodulation in the pathogenesis of atherosclerosis. Clinical and Developmental Immunology 2008; 2008(1)
53. Muhlestein J. Chlamydia pneumoniae-induced atherosclerosis in a rabbit model. J Infect Dis 2000; 181(Suppl.3):S505-S507
54. Murray C, Lopez A. Mortality by cause for eight regions of the world: Global Burden of Disease Study. Lancet 1997; 349(9061):1269-1276
55. Nagaoka S, Shimizu K, Kaneko H, Shibayama F, Morikawa K, Kanamaru Y, Otsuka A, Hirahashi T, Kato T. A novel protein C-phycocyanin plays a crucial role in the hypocholesterolemic action of Spirulina platensis concentrate in rats. J Nutr 2005; 135:2425-2430
56. NCBI. Rabbit Genome Resources. Accesado: 18, Julio 2010. Disponible en: http://www.ncbi. nlm.nih.gov/ projects/ genome/ guide/rabbit/
57. NIH Guide for the care and use of laboratory animals. ILAR, National Research Council, 1966
58. Ota N, Soga S, Hase T, Tokimitsu I, Murase T. Dietary diacylglycerol induces the regression of atherosclerosis in rabbits. The Journal of Nutrition 2007; 137:1194-1199
59. Pasternak R, Chair M, Criqui M, Cochair M, Benjamin E, Fowkes G, Isselbacher E, McCullough P, Wolf P, Zheng Z. Atherosclerotic vascular disease conference Writing Group I: Epidemiology. Circulation 2004; 109:2605-2612
60. Patel R, Nagueh S, Tsybouleva N, Abdellatif M, Lutucuta S, Kopelen H et al. Simvastatin induces regression of cardiac hypertrophy and fibrosis and improves cardiac function in a transgenic rabbit model of human hypertrophic cardiomyopathy. Circulation 2001; 104:317-324
61. Rashtchizadeh N, Ettehad S, DiSilvestro R, Mahdavi R. Antiatherogenic effects of zinc are associated with cooper in iron-overload hypercholesterolemic rabbits. Nutrition Research 2008; 28(2):98-105
62. Rodríguez G, Mago N, Rosa F. El papel de la inflamación en la aterogénesis. Investigación Clínica 2009; 50(1):109-129
63. Rossi E, Vendramini R, Carlos I, Ueiji I, Squinzari M, Silva S, Valdez G. Effects of a novel fermented soy product on the serum lipids of hypercholesterolemic rabbits. Arquivos Brasileiros de Cardiología 2000; 74(3):213-216
64. Russell J, Proctor S. Small animal models of cardiovascular disease: tools for the study of the roles of metabolic syndrome, dyslipidemia, and atherosclerosis. Cardiovascular Pathology 2006; 15(6):318-330
65. Salazar J, Ramírez A, Hoz R, Rojas B, Ruiz E, Tejerina T, Triviño A, Ramírez J. Alterations in the choroid in hypercholesterolemic rabbits: reversibility after normalization of cholesterol levels. Exp Eye Res 2007; 84(3):412-422
66. Scorza T, Martucci A, de Ron A. Derivados de aceite de palma con concentraciones diferentes de ácido palmítico y antioxidantes. Efectos sobre lípidos plasmáticos y agregación plaquetaria. Arch. Latinoamer. Nut.1999; 49:20-25
67. Scorza T, Romero E, Vásquez J, Antequera R, Talise M, Duarte M. Influencia de la administración a largo plazo de aceites de palma y maíz en la dieta sobre la vasoconstricción y vasodilatación arterial de la aorta del conejo. Archivos Venezolanos de Farmacología y Terapéutica 2003; 22( 2)
68. Sebesteny A, Sheiraidah G, Trevan D, Alexander R, Ahmed A. Lipid keratopathy and atheromatosis in an SPF laboratory rabbit colony attributable to diet. Laboratory Animals 1985; 19:180-188
69. Sharma R, Singh R. MRI of coronary artery atherosclerosis in rabbits: Histopathology-MRI correlation and atheroma characterization. Thrombosis Journal 2004; 2
70. Shiomi M, Ito T, Yamada S, Kawashima S, Fan J. Development of an animal model for spontaneous myocardial infarction (WHHLMI rabbits). Arterioscler Thromb Vasc Biol 2003; 23:1239-1244
71. Simons L. Interrelations of lipids and lipoproteins with coronary artery disease mortality in 19 countries. Am J Cardiol.1986; 57: 5G-10G
72. Stocker R, Keaney J. Role of oxidative modifications in atherosclerosis. Physiological Reviews 2004; 84(4):1381-1478
73. Sun H, Unoki H, Wang X, Liang J, Ichikawa T, Arai Y, Shiomi M, Marcovina S, Watanabe T, Fan J. Lipoprotein (a) enhances advanced atherosclerosis and vascular calcification in WHHL transgenic rabbits expressing human apolipoprotein (a). The Journal of Biological Chemistry 2002; 277(49):47486-47492
74. Sun Y, Lu N, Parmley W, Hollenbeck C. Effect of cholesterol diet on vascular function and atherogenesis in rabbits. Proceedings of the Society for Experimental Biology and Medicine 2000; 224:166-171
75. Taylor J, Fan J. Transgenic rabbit models for the study of atherosclerosis. Frontier in Bioscience 1997; 2:298-308
76. Technical Expert Working Group for the revision of directive 86/609/EEC on the protection of animal used for experimental and other scientific purposes. Final report subgroup on ethical review. Bruselas: Comisión Europea; 2003
77. Tilley R, Pedersen B, Pawlinski R, Sato Y, Erlich J, Shen Y, Day S, Huang Y, Eitzman D, Boisvert W, Curtiss L, Fay W, Mackman N. Atherosclerosis in mice is not affected by a reduction in Tissue Factor expression. Arteriosclerosis, Thrombosis, and Vascular Biology 2006; 26:555
78. Tislerics A. Oryctolagus cuniculus. Animal Diversity Web. 2000. Accesado: 18, Julio 2010. Disponible en: http://animaldiversity. ummz.umich. edu/site/ accounts/ information/ Oryctolagus_ cuniculus.html
79. Torrealba de Ron A, Scorza T, Hamana N, Colmanares de Cuervo E. Efectos del aceite de palma crudo en la dieta en conejos. Revista de la Facultad de Medicina 1996; 19(1):63-67
80. Trevisan M, Krogh J, Frudenheim J. Consumption of olive oil, butter and vegetable oils and coronary heart disease risk factors. JAMA 1990; 263:688-692
81. Tsantila N, Karantonis H, Perrea D, Theocharis S, Lliopoulos D, Antonopoulou S, Demopoulos C. Antithrombotic and antiatherosclerotic properties of olive oil and olive pomace polar extracts in rabbits. Mediators of Inflammation 2007; 2007(1):1-11
82. Vidal C, Gómez-Hernández A, Sánchez-Galán E, González A, Ortega L, Gómez-Gerique J, Tuñón J, Egido J. Licofelone, a balanced inhibitor of cyclooxygenase and 5-lipoxygenase, reduces inflammation in a rabbit model of atherosclerosis. The Journal of Pharmacology and Experimental Therapeutics 2007; 320(1):108-116
83. Vles R. Rabbit atherosclerosis model. Rev. Fr. Corps. Gras.1978; 25:289-295
84. Wakabayashi Y. Effect of red wine consumption on low-density lipoprotein oxidation and atherosclerosis in aorta and coronary artery in Watanabe heritable hyperlipidemic rabbits. J Agric Food Chem 1999; 46:4724-4730
85. Werner N, Nickenig G. Influence of cardiovascular risk factors on endothelial progenitor cells: limitations for therapy? Arterioscler Thromb Vasc Biol 2006; 26(2):257-266
86. Williams K, Feig J, Fisher E. Rapid regression of atherosclerosis insights from the clinical and experimental literature. Nature Clinical Practice Cardiovascular Medicine 2008; 5(2):91-102
87. Yamakoshi J, Piskula M, Izumi T, Tobe K, Saito M, Kataoka S, Obata A, Kikuchi M. Isoflavone aglycone-rich extract without soy protein attenuates atherosclerosis development in cholesterol-fed rabbits. The Journal of Nutrition 2000; 130(8):1887-1893
88. Yanni A. The laboratory rabbit: an animal model of atherosclerosis research. Laboratory Animals 2004; 38:246-256
89. Zawadzki C, Susen S, Richard F, Haulon S, Corseaux D, JeanPierre E, Vincentelli A, Lucas C, Torpier G, Martin A, Van Belle E, Staels B, Jude B. Dyslipidemia shifts the tissue factor/tissue factor patway inhibitor balance toward increased thrombogenicity in atherosclerotic plaques: Evidence for a corrective effect of statins. Atherosclerosis 2007; 195(2):e117-e125