Se realizó un estudio transversal descriptivo, con el objetivo de valorar el comportamiento del Síndrome Coronario Agudo (Angina Inestable e Infarto Agudo del Miocardio), en los pacientes con este diagnóstico ingresados en la sala de Terapia Intensiva del Centro de Diagnóstico Integral Libertad, municipio Ricaurte, estado Cojedes, desde Enero del 2006 hasta Abril del 2007. La muestra fue de 44 pacientes, lo cual coincidió con el total de enfermos que presentaron esta entidad. La historia clínica se convirtió en el registro primario de la investigación donde se encontraban reflejados los criterios clínicos, eléctricos y enzimáticos necesarios para el diagnóstico del Síndrome Coronario Agudo. Los resultados se expresaron en el texto y se trabajó con tablas de distribución de frecuencia, de contingencia y gráficos.
Comportamiento del Síndrome Coronario Agudo en la Terapia Intensiva del Centro de Diagnóstico Integral Libertad desde Enero del 2006 hasta Abril del 2007.
Dr. Nguyen Castro Gutiérrez. Especialista de 1er grado en Medicina Interna. Especialista de 2do grado en Medicina Intensiva y Emergencias. Profesor instructor de Medicina Interna.
Coautor: Dra. Surrianis Marrero Mesa. Especialista Medicina General Integral. Residente de Medicina Intensiva y Emergencias. Profesora instructora
Republica Bolivariana de Venezuela. Misión Médica Cubana. Barrio Adentro
Trabajo para optar por el título de Máster en Urgencias Médicas.
Venezuela 2007
RESUMEN:
Se realizó un estudio transversal descriptivo, con el objetivo de valorar el comportamiento del Síndrome Coronario Agudo (Angina Inestable e Infarto Agudo del Miocardio), en los pacientes con este diagnóstico ingresados en la sala de Terapia Intensiva del Centro de Diagnóstico Integral Libertad, municipio Ricaurte, estado Cojedes, desde Enero del 2006 hasta Abril del 2007. La muestra fue de 44 pacientes, lo cual coincidió con el total de enfermos que presentaron esta entidad. La historia clínica se convirtió en el registro primario de la investigación donde se encontraban reflejados los criterios clínicos, eléctricos y enzimáticos necesarios para el diagnóstico del Síndrome Coronario Agudo. Los resultados se expresaron en el texto y se trabajó con tablas de distribución de frecuencia, de contingencia y gráficos.
Predominaron los pacientes masculinos (59,1%) y los comprendidos entre 51 y 70 años de edad con un 68.2%, los factores de riesgo que más incidieron en estos enfermos fueron la Hipertensión Arterial (54.5%), Diabetes Mellitus (40.9%) y la Hipertrofia Ventricular Izquierda (36.4%).A su vez la Hipertensión Arterial y la Hipertrofia Ventricular Izquierda con el 50% cada una, fueron más frecuentes en los infartados, mientras que la Hipertensión Arterial (66.7%), la Diabetes Mellitus (33.3%) y la Hipercolesterolemia (33.3%) lo fueron en los anginosos. La Aspirina, los Nitritos y la Heparina se emplearon en el 100% de los anginosos, en el infarto agudo después de la Aspirina (87,5%), el Captopril (68,7%) fue el más utilizado, predominaron los complejos ventriculares prematuros (43,75%), el edema pulmonar (18,75%) y la taquicardia ventricular (12,5%) entre los vivos, mientras que el shock cardiogénico (100%) fue la complicación que se presentó en los fallecidos.
INTRODUCCIÓN:
El Síndrome coronario agudo y dentro de ello el Infarto agudo del miocardio es considerado una de las primeras causas de muerte en el mundo desarrollado a pesar de los avances tecnológicos, en EUA se ha observado una disminución progresiva de su incidencia del 40%, y esto se debe a una política de educación de la población en aspectos preventivos sobre los factores de riesgo coronario, más que a la disponibilidad de recursos técnicos. En los países en vías de desarrollo inciden otros factores primordiales como son la desnutrición, las enfermedades infectocontagiosas, la escasez de recursos técnicos y humanos, la disminución de la expectativa de vida y la poca confiabilidad de los registros estadísticos, se puede deducir entonces que en estos países existe un subregistro en lo que se refiere a Cardiopatía Isquémica, por lo tanto es un fenómeno subyacente y no ausente (1).
En todos los países que son suficientemente ricos para mantener un sistema de estadísticas vitales fiable, las enfermedades del aparato circulatorio son la principal causa de muerte, constituyendo del 25 al 45% de todas las muertes. La mayoría de estas muertes son de causa aterosclerótica. En particular, entre el 10 y el 30% de todas las muertes en el hombre y algo menos en la mujer son producidas por la cardiopatía isquémica. En España, unas 130.000 de las 350.000 muertes anuales son de causa directa cardiovascular, de las cuales más de 36.000 son debidas a la cardiopatía isquémica. Estas cifras absolutas aumentarán en los próximos años, simplemente debido al aumento de la población anciana. En términos relativos, la tasa bruta de mortalidad por cardiopatía isquémica en España en el año 1993 era 105 por 100.000 habitantes entre los hombres y 47 por 100.000 habitantes en las mujeres la mortalidad y la incidencia de cardiopatía isquémica aumentan con la edad de forma exponencial, especialmente en la mujer, de manera que aunque las tasas de mortalidad coronaria a los 40 años son 7 veces inferiores en la mujer que en el hombre, esta diferencia se reduce a 2 a los 70 años. Si bien la cardiopatía isquémica es poco frecuente, aunque no inexistente, en la mujer joven y de edad media, es un problema de salud importante en la mujer de edad avanzada (1,2).
Aunque la creencia generalizada es que ésta es una enfermedad del ejecutivo varón, la realidad es que se trata de una enfermedad que afecta sobre todo a los grupos sociales menos favorecidos. Así, por ejemplo, en el Reino Unido se ha podido demostrar una inversión del gradiente social de la enfermedad durante la segunda mitad del siglo XX. La mortalidad por cardiopatía isquémica varía geográficamente de forma considerable. Estas variaciones tienden a reflejar el nivel de industrialización de los países, pero hay excepciones notables como Japón y Francia. En España, la mortalidad coronaria es ligeramente superior a la francesa y es la segunda más baja de toda Europa, siguiendo el patrón de otros países mediterráneos. En Latinoamérica, aunque los datos son menos fiables, el patrón de frecuencia tiende a ser el de los países mediterráneos, excepto en Cuba donde la mortalidad es superior.
Estos datos concuerdan con los estudios longitudinales realizados en EE. UU., según los cuales los emigrantes hispánicos, especialmente centroamericanos, muestran por ahora una menor incidencia y mortalidad que otros grupos étnicos de origen caucásico, a pesar de tener una mayor prevalencia de diabetes. Por otro lado, los estudios anatomopatológicos internacionales basados en autopsias realizados en los años sesenta y otros más recientes, muestran una distribución geográfica del grado y gravedad de las lesiones aterosclerosas similar a la distribución geográfica mostrada por la mortalidad según las estadísticas vitales. Las variaciones en la mortalidad coronaria se explican en parte, aunque no totalmente, por las variaciones concomitantes de la prevalencia y distribución de los factores de riesgo clásicos. En la mayoría de países existen además variaciones regionales en la frecuencia de enfermedad coronaria. En España, la mortalidad por esta enfermedad es significativamente más alta en las regiones del sur y en las insulares (1,2,3).
En el último tercio del siglo XX, se produjeron cambios notables en la distribución mundial de la mortalidad por cardiopatía isquémica. Ésta ha disminuido a un ritmo medio de un 2 por 100 anual en la mayoría de países anglosajones, escandinavos y otros países del ámbito de la OCDE, mientras que ha aumentado a un ritmo parecido o incluso superior en los países del centro y el este de Europa, de manera que actualmente presentan las mayores tasas de mortalidad coronaria, con un impacto negativo considerable en la expectativa de vida de estos países. En España, la mortalidad por cardiopatía isquémica aumentó de forma moderada entre los años sesenta y setenta, pero se ha mantenido estable desde entonces, con una cierta tendencia no significativa a la disminución en los últimos cinco años (2,4).
Los estudios epidemiológicos de base poblacional han confirmado que la incidencia de infarto agudo de miocardio bien definido tiene una distribución geográfica similar al mostrado por las estadísticas de mortalidad. Estos estudios muestran para España una tasa anual de ataque de infarto de miocardio de 287 por 100.000 habitantes a finales de los años ochenta, la cual contrasta con una tasa de 862 por 100.000 en Escocia. La incidencia de infarto es siempre superior en el varón. La letalidad del infarto agudo de miocardio a los 28 días de la aparición de los primeros síntomas oscila entre el 38 y el 60% según el país. En España se sitúa alrededor del 40%. El 35% de todos los infartos letales, lo son dentro de la primera hora de aparición de los síntomas, y el 55% muere dentro de las primeras 24 horas. A pesar de tener una menor incidencia de infarto agudo, la letalidad por el mismo es casi siempre mayor en las mujeres, especialmente en los países de menor incidencia, por causas aún no bien determinadas.
La prevalencia de angina de esfuerzo estable en la edad media de la vida en la población general se sitúa entre el 3 y el 5% y, contrariamente a la incidencia de infarto, la angina estable es tan prevalente o incluso más en la mujer que en el hombre. La existencia de signos de isquemia en el electrocardiograma de reposo es un factor pronóstico de muerte prematura (1,3,4)
En nuestro municipio contamos con una sala de cuidados intensivos dotada con equipos de alta tecnología como ventiladores artificiales volumétricos, monitores invasivos, jeringas perfusoras, bombas de infusión, medicamentos Trombolíticos, antiarrítmicos, fármacos de última generación, contamos además dentro de los recursos humanos con tres médicos residentes de medicina general, con diplomado de terapia intensiva y un especialista en medicina interna y medicina intensiva, el personal de enfermería está compuesto por dos licenciados y dos técnicos verticalizados en la atención del paciente grave.
El síndrome coronario agudo es la principal causa de ingresos en nuestra sala de terapia intensiva, representando el 25% de todas las patologías, dentro de este síndrome el infarto agudo del miocardio es la principal causa de muerte y de invalidez en los enfermos que la padecen, además los exámenes complementarios tanto invasivos como no invasivos que se realizan en ellos son muchas veces inaccesibles por su poca disponibilidad y alto costo económico, como son la ecocardiografía, ergometría, coronariografía, ventriculografía entre otros. Por todo lo anterior es objetivo de nuestra investigación estudiar los factores de riesgo del Síndrome coronario agudo, así como el manejo terapéutico, las complicaciones y la mortalidad de los pacientes ingresados en nuestro centro con esta entidad, con el propósito de alcanzar un mayor conocimiento científico por parte del personal médico y una mejor educación de la población sobre este problema de salud.
La función básica del sistema cardiovascular es la de bombear la sangre para transportar el oxígeno y otras sustancias nutritivas hacia los tejidos, eliminar los productos residuales y acarrear sustancias, como las hormonas, desde una parte a otra del organismo. Cualquier alteración del corazón y de los vasos (incluyendo los linfáticos) tiene interés no sólo por el trastorno que representa en sí mismo, sino también por los problemas de regulación general que puede acarrear como consecuencia del fallo de aporte de sangre y oxígeno a los tejidos (1).
El conocimiento de la disposición anatómica y de la fisiología de la circulación coronaria es necesario para comprender algunos aspectos de la mayoría de las enfermedades cardíacas y, muy en particular, del infarto de miocardio. La disposición anatómica varía de forma considerable entre los diversos individuos. La importancia clínica de las arterias coronarias radica en que la lesión aterosclerótica/trombótica de las mismas es la causa del infarto de miocardio y de la angina de pecho. Normalmente suele haber dos arterias coronarias principales: la izquierda, que nace del seno de Valsalva próximo a la valva aórtica anterior izquierda, y la derecha, que se origina en el seno de Valsalva colindante con la valva anterior derecha. La arteria coronaria izquierda, tras un curso de 0,5-2 cm entre la arteria pulmonar y la aurícula izquierda, se bifurca en una rama descendente anterior y otra denominada circunfleja. La rama descendente anterior (rama interventricular) desciende por el surco interventricular anterior, suele rodear la punta cardíaca y asciende por la cara posterior en un corto trecho. La rama circunfleja recorre el surco AV izquierdo y dobla hacia la izquierda y atrás.
La arteria coronaria derecha, tras discurrir entre la arteria pulmonar y la aurícula derecha, pasa por el surco aurículo-ventricular (AV) derecho hacia atrás y suele descender, como rama interventricular posterior, por el surco interventricular homónimo. En algunos casos, la rama interventricular posterior procede de la rama circunfleja de la arteria coronaria izquierda. Microscópicamente existen numerosas anastomosis entre las diversas ramas coronarias, que en casos de obstrucciones pueden hacerse muy evidentes en la angiografía como circulación colateral, capaz de funcionar de manera eficaz como un mecanismo de reserva (5,6).
Es importante conocer la fuente principal de aportación de sangre a las diversas regiones cardíacas. La porción anterior del tabique interventricular, las partes colindantes de las paredes anteriores de ambos ventrículos y la punta cardíaca están perfundidas por la rama descendente anterior. La mayor parte del ventrículo derecho, así como la porción posterior del tabique interventricular y la parte vecina de la pared posterior del ventrículo izquierdo, reciben el flujo sanguíneo de la arteria coronaria derecha. Por último, todo el ventrículo izquierdo restante está irrigado por la rama circunfleja. En cuanto al tejido específico de conducción, el nódulo sinusal recibe su sangre a partir de una arteria, que en el 55% de los casos proviene de la coronaria derecha, y en el 45% de la circunfleja. Dicha arteria también suministra el principal aporte de sangre a la musculatura auricular y al tabique interauricular. El nódulo AV está irrigado en el 90% de los casos por una rama posterior de la arteria coronaria derecha, mientras que el 10% proviene de la arteria circunfleja que también lleva sangre al fascículo de His, así como la parte más alta de sus ramas derecha e izquierda, en tanto que la parte distal es irrigada por ramas de la arteria descendente anterior (4, 6,7).
El flujo de sangre a través de las arterias del ventrículo izquierdo ocurre casi por completo durante la fase diastólica, debido a que la tensión intramiocárdica durante la sístole impide que el flujo coronario se produzca durante esta fase. En cambio, en el ventrículo derecho, debido a que ofrece poca tensión intramuscular durante la sístole, la sangre fluye en ambas fases de la circulación. Así, los factores que disminuyen la presión diastólica o el tiempo de diástole (taquicardias) repercuten sobre la circulación coronaria, en particular en el lado izquierdo (8,9).
La aterosclerosis es una enfermedad vascular que afecta a la capa íntima de las arterias de mediano y gran calibre. Se caracteriza por la acumulación de material lipídico y elementos celulares, sobre todo macrófagos y células musculares lisas (CML) en la capa íntima de las arterias. La hipótesis vigente sobre el origen de la aterosclerosis considera que es una respuesta inflamatoria especializada a diferentes formas de lesión de la pared. El carácter crónico del proceso inflamatorio conduce a la formación de placas que en fases avanzadas pueden ocluir las arterias (10,11).
La acumulación de lipoproteínas plasmáticas, especialmente lipoproteínas de baja densidad (LDL), parece ser uno de los primeros fenómenos en el desarrollo de lesiones ateroscleróticas. Las LDL retenidas en la pared sufren procesos de oxidación (LDLox) y generan productos con actividad quimiotáctica para los monocitos circulantes y las células musculares lisas (CML). Los monocitos son atraídos hacia la pared de los vasos, atraviesan el endotelio y una vez en la íntima se diferencian a macrófagos donde captan LDLox. La captación de LDLox se produce a través de los receptores scavenger (desescombro), receptores que no están sometidos a regulación, de modo que los macrófagos se cargan enormemente de lípidos y se convierten en células espumosas. La acumulación de células espumosas en la íntima produce las estrías grasas, lesión más incipiente de la clasificación de la American Heart Association que divide las lesiones ateroscleróticas en VIII fases o estadios (12).
En la aterogénesis intervienen múltiples factores de crecimiento, citoquinas y otras sustancias producidas por las células endoteliales, células musculares lisas (CML), macrófagos y linfocitos T, que regulan la respuesta inflamatoria y la proliferación celular. El resultado de la interacción de estos factores es una respuesta fibroproliferativa que hace evolucionar la estría grasa a placa aterosclerótica más compleja. En esta evolución juega un papel clave la proliferación de las células musculares lisas (CML) y la acumulación de proteínas de matriz extracelular que éstas sintetizan y segregan. El tejido conectivo sintetizado por las células musculares lisas (CML) forma una cubierta fibrosa, que en las lesiones avanzadas recubre al resto de componentes de la placa. Los síndromes coronarios agudos parecen estar más relacionados con la ruptura de las placas que con su progresión gradual hasta la oclusión completa de las arterias.
La ruptura o ulceración de las placas provoca la formación de trombos que pueden dar origen a complicaciones clínicas o bien contribuir al crecimiento de la placa de forma asintomática. La estabilidad de las placas depende del grosor y composición de su cubierta fibrosa, formada fundamentalmente por proteínas de matriz extracelular y sintetizadas por las células musculares lisas (CML) (colágeno tipo I y III, elastina y proteoglicanos). Al producirse la rotura de una placa aterosclerótica se exponen al flujo sanguíneo los elementos constituyentes que inducen la agregación plaquetaria y la formación de trombos. Muchos agonistas plaquetarios parecen actuar a través de la hidrólisis de los componentes fosfatidilinositol de la membrana de la plaqueta por la fosfolipasa C, movilizando calcio libre desde el sistema tubular denso de las plaquetas (13,14).
El sistema vascular se encuentra recubierto por una monocapa de células endoteliales que constituyen una barrera parcial que permite la entrada y salida de moléculas, entre ellas las LDL. Las LDL atraviesan el endotelio por un proceso, que se ve favorecido en los puntos de bifurcación y áreas de curvatura de las arterias. Ciertos factores de riesgo, como la hipertensión o la hipercolesterolemia, favorecen la penetración y la retención de las LDL en la íntima. Los proteoglicanos y glicosaminoglicanos presentes en la íntima interaccionan con las LDL, lo que favorece su retención y los procesos de modificación, tanto proteolíticos como oxidativos. En la oxidación de las LDL intervienen en un primer momento las células endoteliales, y posteriormente las células musculares lisas (CML) y los macrófagos. La oxidación de las LDL afecta tanto a los ácidos grasos, que pueden llegar a fragmentarse generando grupos aldehído y cetonas, como a las apoproteínas. Los intermediarios altamente reactivos que se generan en el proceso de oxidación se unen de modo covalente con la apoB, apoproteína mayoritaria de las LDL, modifican su carga global y generan nuevos epítopos. Estas LDL modificadas no son reconocidas por el receptor de las LDL nativas sino por los receptores scavenger de monocitos y células musculares lisas (CML). La acumulación masiva de LDLox en estas células las convierte en células espumosas (15).
El término disfunción endotelial hace referencia a cualquier alteración de la fisiología del endotelio que produzca una descompensación de las funciones reguladoras que éste realiza. Estas funciones se ejercen a través de una estricta regulación de factores que en algunos casos operan antagónicamente. Así, el endotelio regula el tono vascular mediante la producción de moléculas vasodilatadoras como el óxido nítrico (NO) y la prostaciclina (PGI2) y sustancias vasoconstrictoras como la endotelina y la angiotensina II. El endotelio también expresa proteínas de membrana que actúan como moléculas de adhesión para receptores específicos de monocitos y linfocitos T. Estas moléculas son selectinas (E-selectina, P-selectina).
La disfunción endotelial puede producir: a) un aumento de la permeabilidad, lo que facilita la acumulación de LDL en la íntima; b) una sobreproducción de las moléculas de adhesión y sustancias quimiotácticas, lo que facilita la unión y migración de monocitos, y c) una perturbación del balance entre los agentes vasoactivos o entre sus funciones pro- y anti-trombogénicas, con el consiguiente incremento de la adhesión de plaquetas. Son múltiples los factores que pueden provocar disfunción endotelial; los más estudiados incluyen sustancias inmunorreguladoras como el factor de necrosis tumoral (TNF) y la interleucina-1 (IL-1), toxinas bacterianas como el lipopolisacárido y, sobre todo, el colesterol y las LDLox (15,16).
El óxido nítrico (NO) liberado por el endotelio no sólo es importante para mantener el tono arterial sino que también evita la proliferación de las células musculares lisas (CML), disminuye la adhesión de monocitos y la agregación de plaquetas y preserva de la oxidación a las LDL (16).
Debido al carácter de respuesta inflamatoria-fibroproliferativa crónica del proceso aterosclerótico, los monocitos y linfocitos T juegan un papel clave tanto en su génesis como en la progresión de las lesiones. Probablemente el primer fenómeno celular detectable morfológicamente sea la adhesión focal de monocitos circulantes al endotelio y su migración a la íntima. El aumento de la unión de monocitos al endotelio, que se observa en las lesiones ateroscleróticas, se debe a un incremento de la expresión de las moléculas de adhesión mencionadas anteriormente, que son inducidas por agentes proaterogénicos. Los monocitos se adhieren al endotelio y penetran en la íntima, atraídos por las LDLox y otras sustancias quimiotácticas sintetizadas por el endotelio activado, como el MCP-1 (16,17).
La activación en la íntima de los monocitos a macrófagos es estimulada por las LDLox y diferentes moléculas producidas por los linfocitos T, las células endoteliales y las células musculares lisas (CML). Los linfocitos T producen interferón-gamma (INF-gamma) y factor de necrosis tumoral (TNF) que activan los monocitos, y factores estimuladores de la formación de colonias como el GM-CSF. Los macrófagos poseen la capacidad de fagocitar y eliminar sustancias nocivas, particularmente LDL modificadas. Los macrófagos captan grandes cantidades de LDLox y acumulan en el citoplasma el colesterol en forma esterificada. La captación de estas LDL modificadas se produce mediante los receptores scavenger. Los macrófagos acumulan grandes cantidades de colesterol y se convierten en células espumosas.
En las lesiones avanzadas destaca el papel de los macrófagos como fuente de factores de crecimiento, citoquinas y otras sustancias que actúan como factores quimiotácticos y estimulantes de la proliferación de las CML. En particular destaca el factor de crecimiento derivado de plaquetas (PDGF), la IL-I y el factor de necrosis tumoral (TNF). También producen el factor de crecimiento transformante beta (TGF-beta), que es un potente inductor de la síntesis y secreción de tejido conectivo en las células musculares lisas (CML). A los macrófagos y linfocitos T se les atribuye un papel activo en los procesos que contribuyen a la ruptura de las placas ateroscleróticas. Las placas, de localización normalmente excéntrica, son más vulnerables en las áreas bisagra o zonas de unión a la pared. En estas áreas abundan los macrófagos y linfocitos T. Estas células debilitan la cápsula fibrosa de las placas porque segregan factores que inhiben la síntesis de las proteínas de matriz (17,18).
Las células musculares lisas (CML) son el componente celular mayoritario de las lesiones ateroscleróticas jóvenes y de las placas reestenosadas posrevascularización. En las lesiones ateroscleróticas las células musculares lisas (CML) se encuentran desorganizadas y han perdido la capacidad de regular el tono vascular. Las células musculares lisas (CML) de la capa media son activadas por moléculas segregadas por el resto de células presentes en las lesiones ateroscleróticas. Las células musculares lisas (CML) experimentan una transformación fenotípica que afecta a su morfología y sobre todo a su función. Células musculares lisas (CML) de fenotipo contráctil no proliferativo se transforman en células que proliferan activamente, que migran atraídas por agentes quimiotácticos y que producen proteínas de matriz extracelular. La rotura espontánea de una placa aterosclerótica o la disrupción provocada por técnicas de revascularización, como la angioplastia, ocasiona la pérdida de los elementos antitrombóticos del endotelio (óxido nítrico (NO), PGI2, t-PA, etc.) y la exposición de estructuras de la pared que producen la formación de trombos. Las plaquetas al agregarse liberan el contenido de sus gránulos ricos en mitógenos que inducen la migración y proliferación de las células musculares lisas (CML) (17).
La migración de las células musculares lisas (CML) es controlada de forma redundante por un conjunto de moléculas que incluye el factor de crecimiento transformante beta (TGF-beta), la angiotensina II, la trombina y sobre todo el PDGF-BB. El factor de crecimiento derivado de plaquetas (PDGF) es producido por las plaquetas, las células endoteliales y los macrófagos. El factor de crecimiento derivado de plaquetas (PDGF) induce la expresión de proteasas que degradan la matriz extracelular como el activador del plasminógeno, plasmina, MMP-2 y MMP-9. La pérdida del endotelio producida por una lesión vascular hace que persista durante varias semanas la interacción de plaquetas con la pared, lo que produce una liberación permanente de factor de crecimiento derivado de plaquetas (PDGF). Con la pérdida del endotelio desaparece la inhibición que en condiciones normales ejerce el óxido nítrico (NO) sobre la proliferación de las células musculares lisas (CML). Además, la presencia de LDLox en las áreas lesionadas potencia la proliferación de las células musculares lisas (CML). Otros agentes como trombina y la angiotensina II promueven también la proliferación de las células musculares lisas (CML). La producción de matriz extracelular por las células musculares lisas (CML) es estimulada especialmente por el factor de crecimiento transformante beta (TGF-beta). Otros factores como la trombina y la angiotensina II, que activan la producción de PAI-1, facilitan la acumulación de matriz extracelular ya que reducen la lisis de las proteínas de matriz por la plasmita (18).
La formación de trombo coronario, frecuentemente secundaria a la rotura de placas ateroscleróticas, juega un papel fundamental en el desarrollo de los síndromes coronarios agudos. Asimismo, la trombosis mural en las zonas que presentan placas fisuradas, es un importante mecanismo en la progresión de la aterosclerosis incluso en ausencia de síntomas clínicos. Por tanto, el papel de las plaquetas y de los fenómenos de la coagulación son de suma importancia. Cualquiera de los mecanismos de activación plaquetaria induce la subsiguiente exposición de receptores de glucoproteína (GP) IIb-IIIa. Macromoléculas adhesivas como el fibrinógeno, el factor von Willebrand y la fibronectina se unen a glucoproteína (GP) IIb-IIIa y forman puentes de unión con otras plaquetas, desencadenando el proceso de agregación plaquetaria y la formación del trombo (19).
La cardiopatía isquémica es la consecuencia de la obstrucción del flujo sanguíneo de las arterias coronarias debido a la aterosclerosis y sus complicaciones y de la isquemia subsiguiente del miocardio. En los países occidentales este proceso empieza hacia la segunda década de la vida con la formación de las estrías grasas bajo la íntima de las grandes arterias. La aterosclerosis es un proceso generalizado, que puede manifestarse asimismo en el cerebro o en las extremidades inferiores y que progresa de forma clínicamente silente hasta la cuarta década de la vida en el hombre y unos diez años más tarde en la mujer. Es una enfermedad grave por cuanto los primeros síntomas son a menudo letales. Las manifestaciones clínicas pueden ser agudas como la muerte súbita y la isquemia aguda, generalmente asociada a las complicaciones trombóticas de la arteriosclerosis. La isquemia aguda puede conducir al infarto de miocardio. En una proporción considerable de casos, el infarto pasa clínicamente desapercibido. En otras ocasiones, a pesar de la presencia de dolor típico, no existe evidencia de infarto. En tales casos, la supervivencia a medio plazo se halla también reducida, por lo que será igualmente necesario adoptar medidas activas de prevención secundaria. La manifestación crónica más frecuente de la isquemia miocárdica es la angina estable de esfuerzo o dolor o malestar pasajero desencadenado por el aumento del trabajo cardíaco. Por último, la isquemia crónica puede conducir, particularmente en el anciano, a la insuficiencia cardíaca (20,21).
La cardiopatía isquémica es la principal causa de ingresos hospitalarios de todas las edades. En España, las formas crónicas y subagudas constituyen dos tercios de los ingresos por esta enfermedad, mientras que el infarto agudo de miocardio es la causa del otro tercio. La coronariopatía aterosclerosa es una enfermedad de causa multifactorial. En la pared arterial tienen lugar interacciones altamente complejas entre la lesión vascular, la respuesta inflamatoria, la oxidación lipídica, el estrés hemodinámico y la activación fibrinolítica. Todos estos procesos contribuyen al inicio, la progresión y la rotura aguda de la placa aterosclerótica. Las investigaciones de la última década han puesto de manifiesto que la aterosclerosis es el resultado de una reacción inflamatoria exagerada a la lesión endotelial y de las células del músculo liso de la pared arterial. La hipótesis lipídica de la aterosclerosis originalmente descrita por Virchow en 1856, ha sido parcialmente modificada por la hipótesis inflamatoria (22).
Las modificaciones en la concepción patogénica de la aterosclerosis, junto con la nueva generación de estudios epidemiológicos han conducido a la identificación de nuevos factores de riesgo y a la separación entre los factores de riesgo aterogénicos y los trombogénicos, a un mejor entendimiento entre las fases aguda y crónica de la oclusión vascular y a los nuevos conceptos de estabilización y regresión de la placa (1, 23).
Múltiples estudios epidemiológicos longitudinales han demostrado claramente que el consumo de cigarrillos aumenta el riesgo de cáncer de bronco-pulmonar, enfermedad vascular periférica, infarto de miocardio y muerte súbita. Dicho riesgo guarda relación con el número de cigarrillos, la duración del hábito y el tipo de tabaco, siendo inferior en los fumadores de pipa o cigarros. Cuando se abandona el hábito tabáquico, el riesgo de muerte coronaria decrece en un 50% al cabo de 2 años y se aproxima al de los no fumadores al cabo de 10 años. El efecto beneficioso del abandono del tabaco se ha observado tanto en población sana como en enfermos coronarios. El tabaco aumenta el riesgo coronario mediante la producción de dos efectos principales: aterogénicos (lesión endotelial, disminución del colesterol HDL, activación plaquetar y liberación de ácidos grasos libres) y trombogénicos (activación plaquetar, aumento del fibrinógeno, liberación de tromboxano y disminución de la producción de prostaciclina). Además, el tabaco contribuye a la isquemia del miocardio al desequilibrar la disponibilidad de oxígeno, mediante la activación simpaticoadrenal, la vasoconstricción y la producción de carboxihemoglobina debida al monóxido de carbono. El tabaco interactúa de forma fuertemente multiplicativa con otros factores de riesgo como la hipertensión arterial, la diabetes y el colesterol sérico. En particular, en la mujer premenopáusica consumidora de anticonceptivos orales, el consumo de cigarrillos aumenta considerablemente el riesgo de infarto (24).
La presión arterial, tanto la sistólica como la diastólica, aumenta el riesgo de infarto de miocardio, de accidente vascular cerebral, así como de insuficiencia cardíaca congestiva e insuficiencia renal. El riesgo aumenta de forma continua a lo largo del rango de presiones. Una gran parte de las lesiones endoteliales se produce en puntos de bifurcación arterial. La hipertensión agrava el estrés hemodinámico de estos puntos produciendo lesión endotelial y activación plaquetar y favoreciendo la permeabilidad a los lípidos. Además la hipertrofia ventricular izquierda secundaria a la hipertensión aumenta marcadamente el riesgo de isquemia miocárdica (25).
Existe una alta relación entre el colesterol sérico y la incidencia de cardiopatía coronaria tanto en los estudios epidemiológicos como en los estudios experimentales que demuestran la posibilidad de provocar aterosclerosis en algunas especies animales al aumentar el contenido en grasa saturada de la dieta. La relación es directa entre el colesterol de las lipoproteínas de baja densidad (LDL) e inversa con el colesterol unido a las lipoproteínas de alta densidad (HDL). Esta correlación está presente tanto en poblaciones de alta como las de baja incidencia. No existen poblaciones humanas donde la arteriosclerosis sea un problema masivo de salud donde los niveles medios de colesterol sérico de la población no sean también elevados. Sin embargo, poblaciones como la francesa presentan niveles de colesterol relativamente elevados pero una baja incidencia de cardiopatía isquémica (paradoja francesa). Hasta el momento actual se considera, pues, que el colesterol es una causa necesaria pero no suficiente para la arteriosclerosis. Por otro lado, existe una buena correlación entre la ingesta de ácidos grasos saturados en la dieta y la concentración de colesterol sérico y la incidencia y mortalidad coronarios. La reducción de la proporción de grasas saturadas de la dieta aparece, pues, aconsejable en los individuos con cifras de colesterol superiores a 200 mg/dL (26).
Algunas enfermedades que cursan con una alteración de los lípidos se acompañan de una incidencia elevada de aterosclerosis, como sucede en la hipercolesterolemia familiar o, en menor grado, en el mixedema. Los tres factores de riesgo clásicos contribuyen de forma independiente y sinérgica al riesgo de presentar enfermedad coronaria; el aumento moderado de dos o tres de estos factores supone un riesgo similar al de una hipercolesterolemia o una hipertensión arterial grave. En la práctica clínica diaria son más frecuentes los aumentos moderados, y debe actuarse sobre todos ellos si se desea prevenir las manifestaciones clínicas de la aterosclerosis. El objetivo debe ser pues la disminución del riesgo global cardiovascular, y no la reducción aislada de cifras (26,27).
La enfermedad se presenta con mayor frecuencia en ciertas familias, cuyos miembros son afectados incluso durante la juventud. Los factores genéticos y familiares pueden actuar a través de otros factores de riesgo: hiperlipemia familiar, diabetes, incidencia familiar de hipertensión arterial. No obstante, es posible que exista una predisposición hereditaria independiente de estos factores. La incidencia de enfermedad coronaria y de vasculopatía periférica se halla elevada en los diabéticos y en los pacientes con intolerancia a la glucosa. En las mujeres, la diabetes triplica la incidencia de cardiopatía coronaria e iguala su riesgo al de los varones no diabéticos. La diabetes produce una elevación de los lípidos sanguíneos y una mayor concentración de glucosaminoglucanos en la íntima arterial. La hiperglucemia contribuye de forma independiente al riesgo, y sus efectos se suman a los de los otros factores de riesgo, lo que obliga a corregirlos con energía, especialmente la hipertensión arterial, en cualquier paciente diabético (28).
Aunque la asociación entre obesidad y enfermedad coronaria parece clara, se duda de que el exceso de peso constituya un factor de riesgo independiente. Probablemente, este aumento del riesgo se explique a través de los otros factores, como la hipertensión y la dislipemia, que a menudo acompañan al exceso de peso. Todo ello no niega la importancia de corregir la obesidad en los pacientes coronarios. La evidencia científica de los nuevos factores de riesgo identificados en los últimos años, aunque sólida, es todavía incompleta para justificar la adopción de su identificación sistemática en la práctica clínica habitual, especialmente por no disponer todavía de intervenciones terapéuticas eficaces. En particular, y de confirmarse en el futuro, la hipótesis infecciosa de la arteriosclerosis supondría un cambio radical en la prevención y tratamiento de esta enfermedad masiva (29).
La isquemia es una situación producida por la deprivación de oxígeno y la eliminación inadecuada de los metabolitos; desde un punto de vista práctico, la isquemia del miocardio se debe casi siempre a una disminución del flujo sanguíneo a través de las arterias coronarias. Por este motivo, las manifestaciones clínicas y las consecuencias anatomopatológicas de la isquemia coronaria se denominan indistintamente cardiopatía isquémica o enfermedad coronaria. De igual forma, la reducción del flujo coronario es secundaria, en la mayoría de los casos, a lesiones aterosclerosas; ello explica que los términos cardiopatía coronaria y aterosclerosis coronaria, aunque no son sinónimos, se empleen como tales. Sin embargo, la embolia, el espasmo o la arteritis coronaria pueden ser otras causas de isquemia cuyos síntomas son, a menudo, indistinguibles de los producidos por la aterosclerosis (1).
La prevalencia de esta enfermedad varía ampliamente de unas áreas geográficas a otras; la cardiopatía isquémica continúa siendo la primera causa de mortalidad en la mayoría de los países industrializados, ocasionando entre el 12 y el 45% de todas las defunciones. Los datos del Seven Countries Study obtenidos del análisis de 12.770 varones en 18 comunidades de 7 países muestran que la tasa de mortalidad coronaria oscila entre 61 por 10.000 individuos y por 10 años en zonas rurales del Japón y 681 en el este de Finlandia, pasando por una tasa del 424 en los EE. UU. Aproximadamente un número similar de pacientes padece un infarto de miocardio no letal (3).
La mortalidad por cardiopatía isquémica en España en 1994 para los varones fue de 106,3 por 100.000, mientras que para las mujeres fue de 76,2. Las tasas ajustadas por edad para ese mismo año fueron del 98 y 43 por 100.000 habitantes respectivamente, lo que confirma el descenso que se viene observando en las dos últimas décadas. Estos datos indican una frecuencia relativamente baja en comparación con los países del norte y centro de Europa o con EE. UU. A pesar de ello, la enfermedad coronaria todavía constituye un grave problema sanitario y uno de los motivos de consulta más frecuentes en España (30).
El corazón es un órgano aerobio que depende totalmente del aporte continuo de oxígeno para su funcionamiento; el metabolismo cardíaco debe producir fosfatos de alta energía continuamente, ya que en cada latido se consume hasta el 5% del total de ATP y creatincinasa (CK) almacenados en el miocardio. Puesto que la producción de estas sustancias por la glucólisis anaerobia es muy limitada, la circulación coronaria ha de suministrar constantemente el oxígeno y los sustratos necesarios. La energía producida, y por tanto el oxígeno consumido por el miocardio, se destina en una mínima parte al mantenimiento de las funciones vitales de las células; en segundo lugar, a mantener el gradiente iónico indispensable para la actividad eléctrica y, por último, en mucha mayor proporción, a la actividad mecánica del miocardio. En consecuencia, el consumo miocárdico de oxígeno (M•VO2) varía de forma constante y es proporcional al número de contracciones (frecuencia cardíaca), a la contractilidad miocárdica y a la tensión generada en la pared del ventrículo; ésta, a su vez, se halla determinada principalmente por la presión aórtica y el radio de la cavidad ventricular (ley de Laplace). Es lógico, pues, que la hipertensión arterial, la dilatación de las cavidades cardíacas y la taquicardia aumenten el consumo miocárdico de oxígeno (M•VO2) (19).
El oxígeno llega al miocardio a través de las arterias coronarias en las cuales la sangre circula a favor del gradiente de presión que se establece entre la raíz de la aorta y el seno coronario (drenaje venoso coronario). El flujo coronario está limitado por dos tipos de factores: los factores mecánicos extrínsecos y las resistencias arteriales coronarias. La compresión que el miocardio circundante ejerce sobre las arterias intramiocárdicas durante la sístole reduce notablemente la circulación en aquéllas, sobre todo en el ventrículo izquierdo; en éste la circulación coronaria se produce casi exclusivamente en diástole y a favor de la presión diastólica aórtica (las situaciones que la reduzcan, como el shock cardiogénico o la insuficiencia aórtica, pueden causar isquemia). En segundo lugar, la presión diastólica intraventricular comprime el subendocardio y dificulta la irrigación de esta zona, susceptible siempre de presentar isquemia (1).
En el individuo sano, las arterias coronarias epicárdicas apenas ofrecen resistencia al flujo y constituyen prácticamente vasos de conducción; las resistencias coronarias se hallan localizadas en las arteriolas intramiocárdicas, cuyo flujo se haya regulado, además de por los factores mecánicos antes mencionados, por el tono arterial. Cinco factores regulan a su vez el tono arterial: la autorregulación, factores neurógenos, metabólicos, humorales y miógenos. Los primeros actúan a través del sistema nervioso vegetativo: los receptores betaadrenérgicos y el parasimpático transmiten estímulos vasodilatadores, mientras que los receptores al adrenérgicos provocan respuestas vasoconstrictoras. Sin embargo, la regulación del tono arterial es fundamentalmente metabólica a través de mediadores como la adenosina, que se libera en respuesta a un aumento del trabajo del miocardio o a la isquemia y determina una vasodilatación arterial y un aumento del flujo coronario. El segundo factor en importancia, tras la regulación metabólica, es el endotelio vascular (regulación humoral).
El endotelio normal libera sustancias vasoactivas, como la PGI2, el óxido nítrico y las endotelinas. El óxido nítrico, que es un potente vasodilatador y antiagregante plaquetario, se libera en respuesta a múltiples sustancias, como la acetilcolina o la serotonina; igualmente, cuando aumenta la velocidad del flujo sanguíneo en respuesta a un aumento del consumo de oxígeno, el endotelio libera óxido nítrico, lo que favorece la vasodilatación coronaria y el aumento normal del flujo. Se ha demostrado disfunción endotelial coronaria en pacientes con aterosclerosis, incluso en las arterias que aparecen normales en la angiografía; esta disfunción parece guardar una relación directa con la presencia y la gravedad de los factores de riesgo coronario (4).
Marco Teórico
La insuficiencia coronaria puede definirse como un desequilibrio entre la oferta coronaria y la demanda miocárdica de oxígeno. Las causas de insuficiencia coronaria son múltiples, pero todas ellas actúan a través de dos mecanismos, el aumento desproporcionado de las necesidades miocárdicas de oxígeno en presencia de un árbol coronario normal o una reducción del flujo sanguíneo por afección de los vasos coronarios. La estenosis aórtica, la hipertensión arterial y la miocardiopatía hipertrófica pueden determinar un aumento considerable de la masa miocárdica, y en consecuencia del consumo de oxígeno, provocando insuficiencia coronaria incluso cuando las arterias coronarias son normales. La frecuencia de la estenosis aórtica degenerativa o senil ha crecido en los últimos años con el envejecimiento de la población y debe tenerse en cuenta en el diagnóstico diferencial de la angina de pecho de los ancianos. De cualquier forma, el mecanismo más frecuente de isquemia es la reducción del flujo por una disminución u obstrucción de la luz arterial (4).
Una estenosis puede reducir el área transversal del vaso hasta un 80% sin que disminuya el flujo sanguíneo a dicha zona, siempre que el paciente permanezca en reposo y las demandas de oxígeno por parte del miocardio no sean excesivas. Sin embargo, cuando los requerimientos de oxígeno aumentan, estenosis incluso menores, que reducen la luz del vaso en un 50%, pueden impedir que el flujo aumente proporcionalmente, produciéndose una situación de déficit e isquemia. Cuando la reducción de la luz es mayor y el área resultante es inferior al 20%, el flujo arterial coronario en esta zona será insuficiente incluso en condiciones de reposo (4,31).
La causa más frecuente de insuficiencia coronaria es la reducción del flujo sanguíneo por lesiones aterosclerosas de las grandes arterias epicárdicas coronarias. Con menor frecuencia, la disminución del flujo se debe al espasmo, que puede localizarse en una placa aterosclerosa o, incluso, en arterias angiográficamente normales. La trombosis coronaria es una causa común de oclusión total de la arteria, y aunque en ocasiones puede producirse en un vaso libre de lesiones macroscópicas, los trombos se injertan en general sobre placas aterosclerosas no necesariamente obstructivas. Otras causas menos frecuentes de isquemia coronaria son las embolias, la disección espontánea, la enfermedad de los pequeños vasos y la arteritis (2,32).
La aterosclerosis es una enfermedad generalizada que se caracteriza por la formación de ateromas en la pared de las arterias de tamaño grande o intermedio; a diferencia de otras lesiones vasculares, se localiza fundamentalmente en la íntima arterial. La aterosclerosis es el resultado de una compleja interacción entre el flujo, la sangre y el propio vaso; interacción en la que intervienen, en mayor o menor grado, diferentes procesos como la inflamación endotelial, la proliferación de las células musculares lisas, degeneración y acumulación de lípidos, necrosis y calcificación. El Comité de Lesiones Vasculares de la American Heart Association ha propuesto dividir el proceso de desarrollo de la aterosclerosis en cinco fases, adoptando además la clasificación de las lesiones de Stary. La fase 1 incluye las lesiones I a III, que se caracterizan por la deposición de lípidos en la íntima con grados crecientes de células musculares lisas. Estos tipos de lesiones pueden observarse con frecuencia en individuos menores de 30 años.
La fase 2 incluye lesiones que, aunque no suelen ser estenóticas, tienen un alto contenido lipídico que las hace propensas a la ruptura, son los tipos IV y Va, que también reciben el nombre de lesiones vulnerables. En el tipo Va, el núcleo lipídico está cubierto por una cápsula fibrosa de cuya integridad depende la estabilidad de la placa. Como consecuencia de la fisuración o rotura de la cápsula fibrosa, estas lesiones pueden evolucionar, constituyendo las lesiones tipo VI; el hecho característico de éstas es la formación, sobre la lesión endotelial, de un trombo que reduce u ocluye totalmente la luz del vaso, lo que se traduce en clínica en un síndrome coronario agudo (fase 4). En ocasiones, el trombo no es oclusivo y la lesión progresa hasta la fibrosis (fase 3, lesiones tipo Vb y Vc). Finalmente, las lesiones coronarias pueden progresar hacia la calcificación (tipo VII) o fibrosis con ausencia de lípidos en su interior (tipo VIII), convirtiéndose en lesiones más estables (33,34).
Las investigaciones epidemiológicas sobre la aterosclerosis han sido muy numerosas durante los últimos 30 años y han demostrado que en los pacientes con enfermedad coronaria se presentan, con mayor frecuencia que en la población general, una serie de signos biológicos y hábitos adquiridos. Estos rasgos se denominan factores de riesgo coronario y su presencia en un individuo determinado aumenta la probabilidad de que éste padezca la enfermedad. Los más importantes, además de la edad y el sexo, son el tabaco, la hipertensión arterial y la dislipemia (23).
La incidencia de cardiopatía isquémica aumenta con la edad, siendo máxima entre los 50 y los 65 años y excepcional antes de los 35. Afecta en mayor grado el sexo masculino, de manera que en el grupo de edad inferior a 45 años es 10 veces más frecuente en los varones que en las mujeres; entre los 45 y los 60 años, 2 veces más en los varones, y en edades superiores tiende a igualarse. En la mujer, la menopausia y el uso de anticonceptivos orales aumentan el riesgo de enfermedad coronaria; estos últimos, que tienden a elevar la presión arterial y las lipoproteínas séricas, han demostrado una fuerte interacción con otros factores de riesgo, en particular el tabaco. Como ya se ha indicado, en condiciones normales las arterias coronarias epicárdicas apenas ofrecen resistencia al flujo sanguíneo. Sin embargo, estos vasos no son tubos rígidos, sino que cuentan con actividad espontánea y su tono varía por la influencia de estímulos nerviosos o farmacológicos. Estos cambios en el tono arterial son insuficientes para comprometer el flujo coronario, excepto cuando el calibre del vaso está reducido por lesiones aterosclerosas graves (1,23).
En algunos pacientes, las arterias coronarias desarrollan espasmos que pueden reducir e incluso interrumpir de manera transitoria el aporte de sangre a una zona del miocardio. El espasmo es una disminución localizada del diámetro del vaso, diferente del aumento generalizado del tono arterial antes mencionado. Con frecuencia ocurre sobre una placa de ateroma, y sólo el 10% de los pacientes en quienes se sospecha angina de pecho vasospástica tienen coronarias angiográficamente normales (35).
No se conoce con exactitud el mecanismo responsable del espasmo; se ha señalado que la aterosclerosis determinaría una reactividad especial de las arterias que facilitaría el espasmo. De igual forma se han sugerido mecanismos adrenérgicos y parasimpáticos, un aumento de la respuesta a la serotonina o la histamina y alteraciones de las prostaglandinas y del transporte de calcio en las células musculares de la pared vascular por cambios en la concentración de los iones hidrógeno; ninguna de estas teorías parece explicar todos los casos de espasmo coronario. La inhalación de cocaína puede provocar espasmo coronario; además determina un aumento de la presión arterial y de la frecuencia cardíaca que elevan el consumo de oxígeno. De esta forma, la cocaína puede provocar isquemia e incluso necrosis miocárdica (35).
Las placas aterosclerosas con un gran componente lipídico, una cápsula delgada y signos de inflamación (infiltración leucocitaria) sufren con frecuencia rotura o erosión de la íntima, por lo que se conocen como placas vulnerables. Las lesiones endoteliales favorecen la formación de trombos, que durante las primeras fases de la evolución de la placa –cuando su tamaño es pequeño– no comprometen en exceso la luz arterial y no modifican el grado de isquemia preexistente; de esta forma, el trombo se incorpora y la placa crece sin que se traduzca en un cuadro clínico definido. No obstante, si la luz del vaso ya está reducida inicialmente, un trombo puede alterar el equilibrio, desencadenar la isquemia y, en consecuencia, agravar el cuadro clínico. Si la obstrucción que produce es total y no existe circulación colateral a la zona o ésta es insuficiente, sobrevendrá la necrosis del miocardio. Así pues, la trombosis coronaria es la causa de gran parte de los infartos de miocardio y de un número apreciable de casos de angina inestable (32).
El endotelio desempeña un papel esencial en la regulación del tono arterial coronario. Diferentes situaciones clínicas, entre las que se incluyen la hipertensión y la hipercolesterolemia, pueden reducir la capacidad del endotelio para generar óxido nítrico y, en consecuencia, limitar la respuesta vasodilatadora de los vasos coronarios, tanto epicárdicos como prearteriolas. Se ha sugerido que este mecanismo puede ser responsable de la isquemia miocárdica en los pacientes con angina de pecho y arterias coronarias angiográficamente normales, el denominado síndrome X o angina microvascular. Idéntico mecanismo se ha invocado para explicar la isquemia miocárdica en pacientes posmenopáusicas con arterias coronarias normales y deficiencia de estrógenos. La angina microvascular es también frecuente en pacientes con hipertensión arterial e hipertrofia ventricular izquierda, en los que la coronariografía no muestra lesiones coronarias significativas (34,36).
En ocasiones, otras situaciones diferentes a la aterosclerosis o al espasmo pueden provocar isquemia y originar un cuadro clínico (angina, infarto de miocardio, muerte súbita) similar al de aquéllas. Estas causas poco frecuentes deben sospecharse en pacientes adolescentes o jóvenes, sin factores de riesgo coronario o con enfermedades generalizadas que afectan el sistema arterial. Las más frecuentes son las malformaciones congénitas de las arterias coronarias, la disección espontánea de éstas (suele ocurrir durante el embarazo), las vasculitis (poliarteritis nudosa, enfermedad de Wegener, enfermedad de Takayasu) y enfermedades metabólicas (amiloidosis) (37).
En los primeros segundos, tras el cese del flujo sanguíneo, se agotan el oxígeno y los fosfatos de alta energía en la zona isquémica; simultáneamente, el metabolismo se convierte en anaerobio. Como consecuencia, se alteran las propiedades elásticas del miocardio, cesa la actividad contráctil, disminuye el potencial de acción y aparecen cambios electrocardiográficos. Además, la isquemia provoca la liberación celular de sustancias como la adenosina, la serotonina, la histamina o la bradicinina y permite la acumulación de metabolitos ácidos y de potasio; se cree que alguna de estas sustancias, probablemente la adenosina, estimula las terminaciones nerviosas y provoca el dolor característico de la isquemia miocárdica. La isquemia miocárdica no se acompaña siempre de dolor anginoso, y en estos casos que se diagnostican a través de los cambios electrocardiográficos, se habla de "isquemia silente" (31).
Tras una fase de isquemia transitoria, el miocardio sufre un fenómeno de adaptación que lo hace más resistente a un nuevo episodio isquémico, es lo que se denomina "precondicionamiento isquémico". Incluso una isquemia transitoria de unos minutos de duración puede causar un trastorno metabólico y una depresión de la contractilidad prolongados que no se recuperan hasta transcurrida una semana (miocardio "aturdido"). Cuando por el contrario, se mantiene de forma crónica, la función contráctil de la zona isquémica está abolida o intensamente reducida, pero se normaliza cuando se restablece el flujo coronario (miocardio hibernado) (1, 31).
Otra consecuencia de la isquemia es la alteración de las propiedades eléctricas de las células cardíacas, al reducir la energía necesaria para el funcionamiento de la bomba de sodio; esta alteración eléctrica provoca a menudo arritmias cardíacas que pueden ser letales. Por último, la disminución del flujo coronario puede ser tan profunda que determine la muerte celular o necrosis miocárdica (38).
Así pues, el dolor coronario (angina de pecho), la disfunción diastólica y sistólica (y su consecuencia, la insuficiencia cardíaca), las arritmias (que pueden determinar la muerte súbita) o la necrosis (infarto de miocardio) son consecuencias de la isquemia y constituyen las formas de presentación habituales de la cardiopatía coronaria. En un paciente determinado, la enfermedad puede comenzar con cualquiera de ellas, y es habitual que en su evolución esté presente más de una (39).
La angina de pecho es la forma inicial de presentación en aproximadamente el 45% de los pacientes, el infarto de miocardio en el 42% y la muerte súbita en el 13%. La angina se define como el dolor, opresión o malestar, por lo general torácico, atribuible a la isquemia miocárdica transitoria. Es un concepto exclusivamente clínico y su diagnóstico se basa en las características y circunstancias que acompañan el dolor. El mecanismo que provoca la isquemia no siempre es el mismo; con frecuencia se trata de un aumento de las necesidades de oxígeno, provocado por los cambios en la presión arterial y la frecuencia cardíaca (ejercicio y emociones), en un paciente con lesiones aterosclerosas coronarias, mientras que en otras ocasiones el dolor sobreviene sin causa aparente, sugiriendo que se ha producido una reducción espontánea del aporte de oxígeno (1,39).
Como ya se ha mencionado, la angina es un concepto clínico y su diagnóstico se basa fundamentalmente en el interrogatorio del dolor. Cuando las características de éste sugieren su origen coronario, es necesario establecer el tipo de angina y, en consecuencia, la urgencia del tratamiento, así como las exploraciones indicadas para confirmar el diagnóstico. Las características que definen el dolor coronario son: el tipo, la localización, la irradiación, la duración, los factores desencadenantes y las circunstancias que lo alivian. En su forma habitual, los pacientes describen el dolor anginoso como una opresión, un peso o una sensación urente, localizado en la región retroesternal o en toda la cara anterior del tórax e irradiado hacia los brazos, el cuello o la mandíbula.
Las excepciones a esta descripción son numerosas; en ocasiones se trata de una molestia indefinida que dificulta la respiración o bien se localiza exclusivamente en el cuello, la mandíbula, los brazos o incluso en las muñecas. Los episodios de angina suelen iniciarse de forma gradual, alcanzan pronto su máxima intensidad y desaparecen también de forma paulatina en 1-10 min. En la angina de esfuerzo clásica, los síntomas presentan una clara relación con el ejercicio, en especial si éste se realiza tras las comidas o en un ambiente frío; las emociones pueden asimismo desencadenar la crisis. El cese de la actividad que provocó el dolor, el reposo o la administración de nitroglicerina sublingual determinan rápidamente su desaparición, excepto en algunas formas de angina (prolongada) en las que puede durar más de 30 min. Un dolor de menos de 30 segundos de duración o continuo durante todo el día rara vez es de origen coronario (1, 2,4).
La frecuencia con que la angina se presenta de forma atípica y el gran número de enfermedades que se manifiestan por dolor torácico exigen un diagnóstico diferencial cuidadoso y, a menudo, difícil. Los dolores punzantes, fugaces y localizados en el precordio suelen ser de origen psíquico. El dolor de la disección aórtica, del neumotórax y, en general, de los procesos que cursan con rotura o laceración de los tejidos, comienza de forma brusca y su intensidad es máxima desde el principio. Las circunstancias y los síntomas que acompañan al dolor son muy útiles en el diagnóstico diferencial. La relación con la ingesta de alimentos o la mejoría con alcalinos orientarán hacia un problema digestivo; los cambios de intensidad con los movimientos de los miembros superiores o el cuello y con la respiración o la posición corporal sugieren una radiculitis cervical o una pericarditis, respectivamente. Por el contrario, el dolor anginoso suele acompañarse de una sensación de angustia y gravedad y, en ocasiones, de sudación y palpitaciones. La disnea durante el dolor no es frecuente, pero su aparición indica una afección coronaria grave y es un signo de mal pronóstico. La presencia de un dolor localizado en la parte superior del tronco durante el ejercicio obliga a pensar en la enfermedad coronaria como causa de aquél (40).
Las circunstancias en que aparece el dolor anginoso indican en líneas generales el mecanismo que lo provoca y, a su vez, el conocimiento de éste permite individualizar el tratamiento. Atendiendo a estos criterios, se han propuesto diferentes clasificaciones. La Sociedad Española de Cardiología distingue tres tipos de angina: angina de esfuerzo, de reposo y mixta (2).
La angina de esfuerzo es provocada por la actividad física o por otras situaciones que implican un aumento de la demanda miocárdica de oxígeno. Suele ser breve y desaparecer al interrumpir el ejercicio o con la administración de nitroglicerina. Se denomina inicial si su antigüedad es inferior a un mes, progresiva si ha empeorado durante el último mes en cuanto a frecuencia, intensidad, duración o nivel de esfuerzo en que aparece, y, finalmente, estable si sus características y la capacidad funcional del paciente no se han modificado en el último mes. La angina de reposo se produce de manera espontánea, sin relación aparente con los cambios en el consumo de oxígeno del miocardio; su duración es variable y en ocasiones los episodios son muy prolongados y el cuadro simula un infarto de miocardio. La angina variante, vasospástica o angina de Prinzmetal es una variedad de la angina de reposo, caracterizada por una elevación transitoria del segmento ST del ECG durante las crisis. La angina mixta es aquella en la que coexisten la angina de esfuerzo y la de reposo, sin un claro predominio de una de ellas. La angina inicial, la progresiva y la de reposo son formas de evolución imprevisible y pronóstico variable, por lo que se agrupan bajo la denominación de angina inestable. Su tratamiento difiere en forma considerable del de la angina de esfuerzo estable, por lo que se estudian por separado (39,40).
El diagnóstico de la angina de esfuerzo estable se realiza por la relación entre el dolor coronario y el ejercicio. En general, el nivel de esfuerzo necesario para provocar la angina, o umbral de la angina, es constante durante largos períodos de tiempo, de forma que el paciente suele conocer de antemano qué actividades de su vida diaria la provocarán. En algunos casos, no obstante, el umbral puede variar a lo largo del día y presentarse el dolor con los primeros esfuerzos de la mañana, mientras que después se toleran ejercicios más vigorosos. Se admite que, en estos casos, los cambios en el tono arterial coronario modifican el grado de estenosis y, por tanto, la capacidad de esfuerzo (40).
Según su gravedad y la limitación funcional que impone al paciente, la angina de esfuerzo se divide en cuatro grados siguiendo la clasificación de la Canadian Cardiovascular Society (41):
Grado I. La actividad física no causa dolor; éste aparece con los esfuerzos extenuantes, rápidos o prolongados.
Grado II. Limitación leve de la actividad física; el dolor aparece al caminar con paso normal dos o más travesías o subir más de un piso.
Grado III. Limitación acusada de la capacidad funcional; el dolor se presenta al subir un piso o caminar con paso normal una travesía.
Grado IV. Incapacidad para llevar a cabo cualquier actividad física sin la aparición de angina; el dolor puede aparecer en reposo.
La exploración es con frecuencia normal, en especial una vez que ha pasado la crisis; una exploración cuidadosa permite descartar otras posibles causas de dolor torácico y detectar factores de riesgo coronario. Durante el acceso de angina el paciente puede aparecer pálido y con diaforesis. La frecuencia del pulso suele encontrarse aumentada, al igual que la presión arterial; la palpación del precordio puede revelar un doble impulso apical. La auscultación cardíaca puede ser normal, pero a menudo se ausculta un cuarto ruido y, con menor frecuencia, un soplo sistólico de insuficiencia mitral por disfunción transitoria del músculo papilar, un desdoblamiento paradójico del segundo ruido o un tercer ruido. La presencia de hipotensión arterial e insuficiencia cardíaca durante las crisis anginosas se ha señalado como signo de gravedad y con frecuencia se asocia a lesiones aterosclerosas coronarias graves e, incluso, afección del tronco principal de la coronaria izquierda, con isquemia de una amplia zona de miocardio. Todos estos signos remiten al desaparecer el dolor (1, 42).
Aproximadamente el 50% de los pacientes con angina crónica tienen un ECG normal durante el reposo y en ausencia de dolor; el resto puede mostrar los signos electrocardiográficos de un infarto de miocardio antiguo, una depresión del segmento ST o cambios isquémicos de la onda T. En algunos casos se añaden además signos de hipertrofia ventricular secundaria a hipertensión arterial, bloqueos de rama, etc. El registro del ECG durante la crisis de dolor es de gran utilidad; en estas circunstancias es frecuente la aparición de una depresión del segmento ST, cambios en el voltaje y polaridad de la onda T y, más rara vez, bloqueos de rama o trastornos del ritmo. Un ECG basal normal no permite descartar la enfermedad coronaria (un error frecuente en la práctica diaria); incluso durante las crisis anginosas el ECG puede permanecer sin cambios o presentar signos inespecíficos, si bien estos casos son poco frecuentes (2,43).
La prueba de esfuerzo estudia la respuesta clínica y electrocardiográfica a un ejercicio físico programado; constituye una prueba fundamental para el diagnóstico del paciente coronario y, además, proporciona datos sobre su pronóstico y capacidad funcional (v. Prueba de esfuerzo). La prueba de esfuerzo se considera positiva si provoca dolor o el segmento ST desciende al menos 1 mm (medido 0,08 seg después del punto J), adoptando una forma horizontal o descendente. La prueba de esfuerzo se utilizó inicialmente con fines diagnósticos, y está indicada en los siguientes casos: a) pacientes con dolor anginoso típico y ECG de reposo normal; b) presencia de dolores atípicos pero sospechosos de ser coronarios, y c) pacientes con ECG anormal pero sin angina. En los últimos años se ha empleado para valorar la capacidad funcional de los enfermos y su pronóstico. En los pacientes con angina estable se consideran signos de mal pronóstico la aparición precoz (menos de 6 min) de angina o cambios del segmento ST, la depresión de éste superior a 2 mm, la incapacidad para realizar un esfuerzo superior a 5 METS y el descenso de la presión arterial durante el esfuerzo. También resulta extraordinariamente útil para evaluar la respuesta al tratamiento; por todo ello una prueba de esfuerzo es obligada en todo paciente coronario (43).
La prueba de esfuerzo convencional tiene una sensibilidad y una especificidad limitadas para el diagnóstico de insuficiencia coronaria; la utilización simultánea de la gammagrafía con talio 201 o tecnecio-99 metaestable, mejora el valor diagnóstico de la prueba (v. Cardiología nuclear). Mediante la utilización de la técnica SPECT (tomografía computarizada de emisión de fotón único), introducida más recientemente, se pueden obtener imágenes individuales a diferentes ángulos predeterminados. Cuando el flujo coronario es normal, el radioisótopo se distribuye de forma uniforme. En el caso del talio, la captación por parte de las células miocárdicas se lleva a cabo a través de la bomba de sodio-potasio, por lo que requiere la integridad de la membrana. Por el contrario, los compuestos de tecnecio (Sestamibi Tc-99m, Tetrofosmin Tc-99m) difunden pasivamente a través de la membrana y su retención en el interior de la célula requiere un potencial mitocondrial negativo.
Cuando la perfusión está reducida en un área del miocardio, la gammagrafía muestra un defecto o "zona fría" que permite localizar la zona isquémica. La sensibilidad y la especificidad de la prueba de esfuerzo combinada con la gammagrafía con talio para diagnosticar enfermedad coronaria alcanzan el 90 y el 80%, respectivamente. Para los compuestos de tecnecio combinados con la técnica SPECT, estas cifras son 90 y 74%. Por su mayor coste, la ergometría con gammagrafía de perfusión miocárdica debe reservarse para los casos en que la prueba de esfuerzo no es concluyente, es decir, pacientes con angina típica y prueba de esfuerzo normal y enfermos con alteraciones basales del ECG que impiden su interpretación (bloqueo de rama, síndrome de Wolff-Parkinson-White [WPW]) (44).
Aproximadamente el 20-30% de los pacientes en los que está indicado practicar una ergometría, no pueden realizar un ejercicio físico adecuado. En estos casos se puede realizar una gammagrafía de perfusión isotópica tras la administración de dipiridamol o adenosina. Estos dos fármacos provocan una potente vasodilatación arterial y redistribución del flujo miocárdico que pone en evidencia las áreas mal perfundidas. La sensibilidad y especificidad con estas técnicas es similar a las de la ergometría (43,44).
El ecocardiograma constituye un método sensible e incruento para el diagnóstico de los defectos segmentarios de la contractilidad y la evaluación global de la función ventricular. De esta forma, el ecocardiograma es fundamental en la evaluación de la función ventricular residual en los pacientes que han sufrido un infarto de miocardio. Igualmente, permite el diagnóstico de las alteraciones de la contractilidad en enfermos con angina de pecho (miocardio hibernado). Además, se está utilizando en combinación con la prueba de esfuerzo para el diagnóstico de la isquemia miocárdica (ecocardiografía de estrés). Para ello, se valoran las alteraciones segmentarias de la contracción ventricular que aparecen durante el ejercicio como consecuencia de la isquemia (1,2).
Mediante la opacificación del ventrículo izquierdo y de las arterias coronarias, el cateterismo cardíaco permite el análisis de la función ventricular y el conocimiento del grado y la extensión de las lesiones coronarias. Así pues, las indicaciones principales de esta técnica son dos (1, 44):
1) El diagnóstico de la enfermedad en pacientes con un cuadro clínico y exploraciones incruentas dudoso o contradictorio.
2) El diagnóstico de la localización de las estenosis coronarias en pacientes en los que está indicada la revascularización (los que no responden al tratamiento médico o tienen signos clínicos de mal pronóstico).
En ocasiones puede utilizarse para evaluar el pronóstico de un paciente determinado; de cualquier forma, es una exploración que entraña cierto riesgo, por lo que debe emplearse de forma selectiva y no indiscriminada. El grado de afección coronaria observado durante la coronariografía en las diferentes series de angina estable publicadas varía ligeramente; en general, existe una proporción similar (25%) de pacientes con estenosis en una, dos o las tres arterias coronarias principales. El 5-10% muestra lesiones coronarias no obstructivas e incluso puede tener un árbol coronario angiográficamente normal. La función ventricular es normal en la mayoría de los pacientes con angina estable y sin antecedentes de infarto de miocardio (4).
El pronóstico de los pacientes con angina estable, y en general del enfermo coronario, depende del estado de la función ventricular y de la extensión de las lesiones coronarias. Aproximadamente un tercio de los pacientes con angina de esfuerzo de comienzo reciente quedan libres de síntomas de forma espontánea. En el estudio de Framingham, la mortalidad anual en la angina crónica estable fue del 4%. El sexo masculino, el antecedente de hipertensión y la presencia de arritmias se asocian a un mal pronóstico. Asimismo, la insuficiencia cardíaca ocasiona una elevada mortalidad, próxima al 12% anual. Otro factor de riesgo es la presencia de depresión del segmento ST en el electrocardiograma (ECG) basal. Por último, los pacientes con prueba de esfuerzo positiva a cargas bajas (5 METS) o a frecuencias cardíacas inferiores a 120 lat/min tienen una mortalidad del 15-20% anual y constituyen un grupo de alto riesgo en el que son frecuentes las lesiones del tronco común de la coronaria izquierda. Los pacientes de estos grupos de mal pronóstico deben referirse para cateterismo cardíaco y revascularización coronaria (45). Como ya se ha mencionado, la coronariografía permite una evaluación más precisa del pronóstico. Los enfermos con lesiones en un solo vaso coronario y función ventricular normal tienen una mortalidad anual del 0,6%, que asciende al 3,5% si la función ventricular es anormal. Estas cifras son, respectivamente, del 1,6 y 5,6% para los pacientes con afección de dos vasos, del 3,6 y 11% para los de tres y del 10 y 25% para los que presentan afección del tronco común de la coronaria izquierda (44).
Aliviar el dolor anginoso, prevenir nuevas crisis e interrumpir el progreso de la aterosclerosis coronaria constituyen los tres objetivos principales del tratamiento de la angina estable. Como en todo paciente coronario, el primer paso debe ser el control de los factores de riesgo, fundamentalmente el de la hipertensión arterial, el abandono del tabaco y la modificación de la dieta, que consiste en reducir el aporte de grasas y moderar el consumo de café y alcohol. La educación del paciente ocupa un lugar importante en esta enfermedad; es imprescindible informarle de su naturaleza e infundirle confianza, animándolo a desarrollar una vida normal; casi todos los pacientes con angina crónica pueden permanecer activos laboralmente, excepto los que desarrollan oficios especiales, como pilotos o conductores de vehículos de transporte público, o trabajos que requieren un esfuerzo físico muy intenso.
El paciente debe conocer los esfuerzos y las situaciones que le provocan angina para evitarlos, así como la importancia de no realizar actividades físicas intensas tras las comidas, con tiempo frío o durante una situación de estrés. Por el contrario, se le debe recomendar que practique regularmente ejercicio, de acuerdo con su sintomatología; en general, caminar 4-6 km diarios, cinco días por semana, es una medida prudente, pero algunos enfermos poco sintomáticos pueden realizar otros deportes como ciclismo o tenis, siempre no competitivos y sin que les causen estrés o les provoquen molestias. Los ejercicios isométricos deben desaconsejarse (46).
La nitroglicerina sublingual, en forma de comprimidos o aerosol, es el tratamiento de elección de las crisis anginosas, y el paciente debe recibir instrucción para utilizarla de forma adecuada. Los nitritos reducen el consumo de oxígeno miocárdico al disminuir el retorno venoso y la postcarga. Al mismo tiempo causan vasodilatación coronaria, un mecanismo que puede ser relevante cuando el espasmo desempeña un papel en la producción de la angina. La nitroglicerina debe administrarse tan pronto como aparezca el dolor e, incluso, utilizarse con carácter profiláctico si el paciente ha de realizar un esfuerzo que presumiblemente le ocasionará dolor. El comprimido se fracciona con los dientes y se deja debajo de la lengua, sin deglutir saliva durante unos instantes; cuando se toma por primera vez conviene hacerlo sentado o en decúbito, ya que algunos enfermos experimentan hipotensión y mareos con las dosis habituales (0,3-1 mg). El dolor suele aliviarse rápidamente, en 2-3 min, aunque en ocasiones es necesario administrar 2-3 comprimidos separados por un intervalo de 5 min. Si con estas medidas el dolor no cede, debe sospecharse la posibilidad de un infarto de miocardio (47).
Cuando las crisis ocurren de forma muy aislada o guardan una relación muy estrecha con ciertos esfuerzos –por ejemplo, la angina que ocurre por las mañanas con el primer esfuerzo del día (angina de primoesfuerzo) – puede controlarse fácilmente con nitratos de acción prolongada. Los preparados más útiles son los de mononitrato de isosorbide por vía oral y la nitroglicerina percutánea. El principal problema que presentan estos fármacos es el desarrollo de tolerancia, en especial a dosis altas y con administración continuada durante las 24 horas del día, por ello se aconseja dejar diariamente un período de tiempo sin fármaco. Por ejemplo, los parches de nitroglicerina se deben mantener durante 12 horas (47,48).
En los pacientes con angina de esfuerzo moderada o grave (capacidad funcional grados II a IV), los bloqueadores betaadrenérgicos son los fármacos de elección. Su efecto antianginoso se debe a la reducción del consumo de oxígeno provocada por la bradicardia y la disminución de la contractilidad que determinan. Además, los bloqueadores beta aumentan el flujo coronario al alargar la diástole, al mismo tiempo que reducen la taquicardia provocada por el ejercicio y controlan la presión arterial en los pacientes hipertensos. La elección de un determinado betabloqueante depende fundamentalmente de la experiencia; en algunos pacientes con asma bronquial o claudicación intermitente se utilizan preferentemente los cardioselectivos, aunque a dosis altas las diferencias entre los distintos tipos de bloqueadores betaadrenérgicos se atenúan. Pueden combinarse con los nitratos de acción prolongada o con los antagonistas del calcio, en especial el nifedipino, en las formas rebeldes al tratamiento.
Aproximadamente el 20% de los pacientes con angina no responden a los bloqueadores beta; además, existen múltiples contraindicaciones pulmonares (asma, enfermedad pulmonar crónica), cardíacas (insuficiencia cardíaca, bradicardia), circulatorias (claudicación) y neurológicas (depresión), entre otras. En estos casos los antagonistas del calcio son una buena alternativa, especialmente el verapamilo, que comparte con los bloqueadores beta los efectos bradicardizante e inotrópico negativo. Se ha observado una mejoría clínica, tanto con este fármaco como con el diltiazem, el amlodipino y el nifedipino, que se traduce en mayor capacidad de esfuerzo y menor consumo de nitroglicerina. Se ha sugerido, a partir de estudios retrospectivos y metaanálisis, que el nifedipino administrado en formas de liberación rápida puede aumentar la mortalidad, por lo que se desaconseja su utilización, excepto en combinación con los bloqueantes betaadrenérgicos (1, 4,48).
Actualmente se están ensayando nuevos fármacos en el tratamiento de la isquemia con mecanismos de acción diferente a los tres grupos clásicos. El nicorandil es un fármaco vasodilatador que promueve la apertura de los canales de potasio; no obstante, la evidencia clínica en favor de su utilización todavía es escasa. El estudio SAPAT, un ensayo aleatorizado y doble ciego, con más de 2.000 pacientes demostró que el ácido acetilsalicílico (AAS) a dosis bajas (75 mg/día) en pacientes con angina estable reducía en un 34% la incidencia de muerte e infarto de miocardio, confirmando de esta forma lo observado en otros grupos de pacientes coronarios. En pacientes que no pueden recibir aspirina, la ticlopidina ha demostrado ser una alternativa adecuada. Más recientemente, el clopidogrel, un fármaco similar a la ticlopidina pero sin la tasa de complicaciones hematológicas de ésta, ha mostrado un efecto discretamente superior a la aspirina en la prevención de complicaciones vasculares (reducción del 8%) (1,2).
En los pacientes en los que el tratamiento médico es ineficaz o en aquellos que consideran inaceptable la calidad de vida que éste les proporciona, la revascularización miocárdica mediante angioplastia coronaria transluminal percutánea (ACTP) o mediante cirugía con injerto venoso o arterial, consigue a menudo eliminar las crisis anginosas y simplificar la medicación. Además, se ha demostrado que la cirugía mejora la expectativa de vida en ciertos grupos de pacientes de alto riesgo con afección coronaria grave y disfunción ventricular izquierda. En 1977 Gruntzig introdujo una nueva forma de tratamiento de la isquemia miocárdica consistente en dilatar la lesión aterosclerosa mediante un catéter con un balón en su extremo. Actualmente la angioplastia con balón puede complementarse con otras técnicas como la aterectomía, y sobre todo el stent intracoronario, que han mejorado sensiblemente los resultados y permiten abordar lesiones complejas. A pesar de ello, en ciertos tipos de lesiones, excéntricas, calcificadas o con trombo, así como las localizadas en los ostia coronarios o en los injertos venosos, la tasa de éxito es menor y la incidencia de complicaciones mayor. En manos experimentadas, el porcentaje de éxitos sobrepasa el 90%, alcanzando el 98% en las lesiones concéntricas, no complicadas. En el 20-30% de los casos, dependiendo del tipo y localización de la lesión, se produce una reestenosis durante el primer año. La angioplastia coronaria está contraindicada en pacientes con lesiones difusas y distales o en las localizadas en el tronco común de la coronaria izquierda (49).
La cirugía de revascularización mediante injerto aortocoronario con vena safena o con la arteria mamaria interna constituye la intervención de cirugía cardíaca más frecuente en la actualidad y su eficacia en el tratamiento de la isquemia miocárdica está bien establecida. En la angina estable, la mortalidad operatoria oscila entre el 1 y el 3%, excepto para los enfermos con afección del tronco común de la coronaria izquierda o cirugía valvular combinada, en los que puede elevarse hasta el 10%. Los factores que indican mal pronóstico son la edad avanzada, la cirugía urgente, la insuficiencia renal, las afecciones del tronco común de la coronaria izquierda y la disfunción ventricular grave.
La incidencia de infarto peroperatorio oscila entre el 2 y el 5%, las infecciones peroperatorias entre el 1 y 5% y la incidencia de accidente vascular cerebral alcanza el 6%. Éstos son más frecuentes en pacientes de edad avanzada, diabéticos, con historia de enfermedad vascular periférica, afección neurológica previa o lesiones carotídeas significativas. En la mayor parte de los estudios, la supervivencia a los 5 años es del 90-95%, a los 10 años 80-90% y del 65-75% a los 15 años; estas cifras son más favorables cuando se utiliza como injerto la arteria mamaria, mientras que los resultados negativos a largo plazo correlacionan con un control inadecuado de la diabetes o la dislipemia, y la persistencia del hábito de fumar. Durante el primer año se ocluyen aproximadamente el 20% de los injertos y a los 15 años el 50% persisten permeables (50).
Nueve estudios controlados han comparado la eficacia de la cirugía de revascularización y la angioplastia en el tratamiento de la angina de esfuerzo; todos ellos incluyen pacientes de riesgo moderado, preferentemente con afección de dos o tres vasos coronarios, excluyendo enfermos con lesiones del tronco común de la coronaria izquierda y oclusiones completas. En estas circunstancias, ambas técnicas tienen una mortalidad a los 5 años similar, aunque la cirugía ofrece una revascularización más completa, un mayor número de pacientes quedan asintomáticos y la tasa de reintervenciones es inferior a la angioplastia. En el estudio BARI, además, en los pacientes diabéticos la mortalidad a los 5 años fue casi la mitad cuando se operaron que si se trataron mediante angioplastia coronaria. Ésta, por su parte, es mucho menos traumática y permite una recuperación más rápida (51).
Recientemente se ha sugerido que la revascularización transmiocárdica con láser alivia los síntomas y reduce la isquemia en pacientes con vasos inadecuados para la angioplastia o la revascularización directa con injerto. La técnica consiste en practicar, previa toracotomía lateral, múltiples canales en la zona isquémica mediante pulsos de láser sincronizados con el ECG. Aunque los canales parecen ocluirse con el tiempo, se sospecha que se desencadena un proceso de angiogénesis. La técnica tiene una mortalidad operatoria cercana al 9% y parece mejorar los síntomas y los signos de isquemia en la ergometría y la gammagrafía isotópica. De cualquier forma, debe considerarse una intervención en fase de investigación a la espera de resultados definitivos (51,52).
En el momento actual se considera que la revascularización miocárdica está indicada en los pacientes que, a pesar de un tratamiento farmacológico adecuado, continúan presentando angina de pecho que interfiere con su calidad de vida. Igualmente, se recomienda cuando la intensidad del tratamiento o sus efectos colaterales son inaceptables para el enfermo (1). La elección del método de revascularización: angioplastia percutánea o cirugía depende del tipo de lesión, de la calidad de los vasos y de la situación clínica del paciente En general, la angioplastia coronaria se considera de elección si las lesiones arteriales afectan a uno o dos vasos, son circunscritas, no calcificadas y técnicamente abordables. En las lesiones del tronco común de la coronaria izquierda, en la enfermedad de tres vasos, y en general en las lesiones complicadas o de difícil abordaje con la angioplastia, se prefiere la cirugía de revascularización. Además, ésta ha demostrado que mejora la supervivencia en diversos grupos de pacientes asintomáticos: enfermedad de tres vasos y disfunción ventricular, afección de la porción proximal de la descendente anterior y, sobre todo, enfermedad del tronco común de la coronaria izquierda. En todos ellos se considera indicada la cirugía independientemente de los síntomas, y siempre que se realice con cifras de morbi-mortalidad similares a las mencionadas en el apartado anterior (4).
Algunos tipos de angina de pecho se consideran formas inestables de la enfermedad coronaria, ya que su evolución es imprevisible y el pronóstico intermedio entre el de la angina de esfuerzo estable y el infarto de miocardio; en consecuencia, su tratamiento difiere sensiblemente del de la angina estable. Siguiendo las recomendaciones del NHLBI de los EE. UU., bajo el término de angina inestable se incluyen los siguientes tipos:
a) angina inicial o de comienzo reciente (duración de los síntomas inferior a dos meses con angina al menos de grado III (CCS);
b) angina de esfuerzo cuyas crisis dolorosas se han hecho más frecuentes durante los dos últimos meses, aumentando en una clase funcional o alcanzando el grado III (CCS) (angina progresiva);
c) angina de reposo, generalmente de duración superior a los 20 minutos (angina prolongada).
También se considera una forma de angina inestable la que ocurre tras el infarto agudo de miocardio, entre las primeras 24 horas y el primer mes de evolución (40).
Las características del dolor son similares a las de la angina estable y el diagnóstico se establece por los cambios en la frecuencia y en la duración de las crisis o en su falta de relación con el esfuerzo. Las crisis pueden presentarse varias veces al día o ser resistentes a la nitroglicerina, confiriendo un carácter de gravedad al cuadro. La exploración física puede ser normal en ausencia de dolor coronario, mientras que los hallazgos durante las crisis son similares a los descritos para la angina estable. En el ECG, la mayoría de los pacientes presentan alteraciones de la repolarización, en especial durante las crisis de dolor, en las que son muy frecuentes la depresión del segmento ST, el aplanamiento o la inversión de la onda T, la normalización de una onda T previamente negativa y, en ocasiones, la elevación transitoria del segmento ST.
No obstante, un ECG normal no excluye el diagnóstico de angina inestable, ya que esta circunstancia puede observarse hasta en el 4% de los pacientes que acuden a urgencias con este diagnóstico (42,43). Como ya se ha mencionado, la combinación de dolor en reposo, supradesnivel del segmento ST durante las crisis y arritmias caracteriza la angina vasospástica, variante o de Prinzmetal (35). Puesto que por definición en la angina inestable no se produce necrosis miocárdica, los valores plasmáticos de las enzimas CK y CKMB son normales, o al menos no alcanzan el doble del valor normal, que es el criterio que se utiliza para el diagnóstico de infarto de miocardio. No obstante, recientemente se ha observado que los niveles de las troponinas I y T, dos proteínas presentes en el aparato contráctil de los miocitos, pueden hallarse elevados. Igualmente, las elevaciones no diagnósticas de la CKMB conllevan peor pronóstico y se interpretan como evidencia de una pequeña necrosis sin traducción clínica. En el 8-10% de los enfermos con angina inestable la gammagrafía con pirofosfato de tecnecio es positiva en ausencia de otros signos clínicos, electrocardiográficos o enzimáticos de infarto de miocardio (1, 2, 3,4).
El pronóstico de la angina inestable es muy variable, aunque ha mejorado sensiblemente en los últimos años debido a los cambios en el tratamiento. Aproximadamente entre el 2 y el 5% de los pacientes fallecen durante el primer mes, y entre el 5 y el 15% padecen un infarto de miocardio. Durante el primer año la mortalidad puede alcanzar entre el 6 y el 15%. La evaluación del pronóstico en el paciente con angina inestable debe realizarse de forma continua, desde su ingreso en urgencias, con el fin de orientar el tratamiento. Se consideran pacientes con riesgo elevado aquellos con angina prolongada (más de 20 minutos), dolor en reposo acompañado de depresión mayor de 1 mm del segmento ST en el ECG o bien los pacientes en los que la crisis anginosa cursa con signos de insuficiencia cardíaca o hipotensión. La edad superior a 65 años, la diabetes, la disfunción ventricular previa, la recurrencia de las crisis a pesar del tratamiento adecuado y la elevación de la concentración plasmática de troponinas son también factores de mal pronóstico (53).
Debido a la elevada incidencia de infarto de miocardio y muerte súbita, los pacientes con angina inestable deben ingresar en el hospital con la máxima prioridad. El reposo absoluto, la administración de ansiolíticos y el tratamiento de los factores desencadenantes o agravantes, si los hubiera, constituyen medidas comunes a los distintos tipos de angina inestable. Varios estudios han demostrado que la administración de aspirina reduce la incidencia de infarto y la mortalidad en los meses siguientes; las dosis que se han mostrado eficaces oscilan entre 75 mg/día y 325 mg tres veces diarias (2,4). En pacientes alérgicos al ácido acetilsalicílico puede administrarse ticlopidina, 250 mg/día, o clopidogrel, 75 mg/día. Puesto que la aspirina inhibe sólo una de las múltiples vías por las que puede promoverse la activación de las plaquetas, éstas continúan activándose en respuesta a estímulos como la trombina, las catecolaminas o la fuerza de cizallamiento que se genera en las estenosis arteriales.
En los últimos años se han investigado diferentes fármacos capaces de bloquear los receptores de las glucoproteínas IIb/IIIa que constituyen la vía común, indispensable para la agregación plaquetaria. Estos fármacos son anticuerpos monoclonales como el abciximab, antagonistas no peptídicos como el tirofibán y lamifibán, o bien péptidos como la integrilina. Todos ellos se han mostrado eficaces para reducir las complicaciones de la angioplastia coronaria en pacientes de alto riesgo; además, el tirofibán ha sido aprobado recientemente para el tratamiento de la angina inestable de riesgo. Además de los antiagregantes, la heparina por vía intravenosa posee un efecto igualmente beneficioso sobre el pronóstico. Por el contrario, el tratamiento trombolítico no se ha mostrado eficaz. Por ello, la pauta más aceptada en la actualidad incluye la administración de heparina y AAS (54).
Si el paciente no recibía tratamiento previo, los fármacos de elección son los bloqueantes beta en combinación con los nitratos; en los casos en que existen contraindicaciones a los primeros se inicia con antagonistas del calcio. Las dosis deben aumentarse de modo progresivo y el tratamiento ajustarse según la respuesta; se pueden combinar antagonistas del calcio (en particular nifedipino y amlodipino) y bloqueadores beta si se alcanzan las dosis máximas tolerables de cualquiera de ellos sin conseguir el efecto deseado (1,2).
En los pacientes con angina previa que ya recibían tratamiento se aconseja mantener el mismo fármaco, aumentando la dosis si es posible o combinándolo con otro. Cuando las crisis anginosas son muy frecuentes (tres o más al día), prolongadas o se acompañan de cambios en el segmento ST se inicia simultáneamente la perfusión de nitroglicerina intravenosa y se mantiene hasta el control de los síntomas. Con estas medidas terapéuticas quedan asintomáticos entre el 70 y el 90% de los pacientes con angina inestable. En los casos en que el dolor persiste más de 48 horas a pesar de un tratamiento médico correcto, debe practicarse una coronariografía de urgencia; en algunos pacientes la implantación de un balón de contrapulsación intraaórtico permite controlar el dolor y realizar el estudio hemodinámico con menor riesgo. En estos pacientes están indicadas la cirugía o la angioplastia, según las lesiones coronarias que se encuentren. El tratamiento con antagonistas de los receptores de la glucoproteína (GP) IIb/IIIa previamente a la angioplastia reduce significativamente las complicaciones de ésta (55).
En los restantes enfermos, en los que el tratamiento farmacológico consigue controlar el dolor, debe practicarse una prueba de esfuerzo con el fin de evaluar el riesgo y seleccionar los que requieren coronariografía; algunos autores recomiendan practicar el estudio hemodinámico a todos los pacientes, incluso si se encuentran asintomáticos; no obstante, esta pauta más agresiva no se traduce en un mejor pronóstico según han demostrado diversos estudios. La prueba de esfuerzo no está indicada hasta que el paciente se ha estabilizado y las crisis anginosas han desaparecido; en este momento es de gran utilidad para detectar a los pacientes con lesiones coronarias graves candidatos a revascularización miocárdica. Incluso cuando se sigue un criterio conservador, la coronariografía se realiza en más del 50% de los casos de angina inestable, debido a la frecuencia de isquemia recurrente espontánea o provocada durante la prueba de esfuerzo. Cuando los síntomas recurren a pesar del tratamiento farmacológico adecuado, la coronariografía debe llevarse a cabo sin retraso (56).
El patrón angiográfico de la angina inestable no difiere, en cuanto a gravedad y distribución de las lesiones, del de la angina estable. La prevalencia de lesiones del tronco común de la coronaria izquierda se aproxima al 15%, y en la mayoría de estos casos existen además lesiones de dos o las tres arterias principales. A diferencia de lo que ocurre en los pacientes con angina de esfuerzo estable, las lesiones coronarias aparecen en la angiografía como excéntricas y de bordes irregulares, indicando la presencia de una placa ateromatosa complicada, es decir, con rotura y ulceración de la íntima, hemorragia y, a menudo, trombosis (1, 2, 3,4).
Infarto de miocardio
Con este término se designa la necrosis miocárdica aguda de origen isquémico, secundaria generalmente a la oclusión trombótica de una arteria coronaria. A pesar de algunas observaciones previas aisladas, se atribuye a Herrick la primera descripción del cuadro clínico del infarto de miocardio. Durante muchos años fue un diagnóstico poco frecuente, pero tras la difusión de la electrocardiografía clínica pasó a considerarse una de las primeras causas de muerte en muchos países. Su incidencia varía ampliamente de unas comunidades a otras, oscilando entre el 0,8 y el 7,5 por 1.000 habitantes y por año; existe un claro predominio entre los varones y su mayor incidencia se presenta entre los 55 y los 65 años. El infarto de miocardio es, además, la manifestación inicial de la enfermedad en alrededor de la mitad de los pacientes coronarios. No sólo es una enfermedad frecuente, sino altamente letal, cuya mortalidad durante la fase aguda se ha estimado entre el 20 y el 50% (1, 2,57).
La lesión histológica fundamental en el infarto de miocardio es la necrosis isquémica, ausente en la angina de pecho debido a que, en ésta, por la menor duración e intensidad de la isquemia, no se llega a la muerte celular. Tras la necrosis se producen la eliminación del tejido necrótico y la organización y cicatrización del infarto. En los infartos en los que se produce la reperfusión miocárdica aparece un tipo de necrosis consistente en bandas eosinófilas transversales en las fibras musculares cardíacas lesionadas, producidas por la hipercontracción de las miofibrillas (necrosis en bandas de contracción). Simultáneamente se inicia una reacción inflamatoria con un infiltrado leucocitario que persiste 2-3 semanas. Al comienzo de la segunda semana la zona es invadida desde la periferia por capilares y tejido conjuntivo; la producción de colágeno convierte el tejido de granulación en una cicatriz fibrosa en el término de 6 a 8 semanas (1).
El infarto provoca cambios en la arquitectura del ventrículo que influyen en la función ventricular residual. Estos cambios se denominan remodelado ventricular e incluyen la expansión de la zona necrótica y la hipertrofia y dilatación de la zona normal. La expansión y el adelgazamiento del área necrótica se inician en las primeras horas y se deben al deslizamiento y realineación de los miocitos; el grado de expansión depende directamente del tamaño del infarto y, por ello, se observa con mayor frecuencia en los infartos transmurales extensos, especialmente los de localización anterior. La expansión puede favorecer la rotura cardíaca y la formación de un aneurisma ventricular, una complicación que ocurre en el 8-20% de los infartos. El aumento de la tensión que se produce en la pared normal del ventrículo como consecuencia de la expansión, estimula la hipertrofia y dilatación del tejido sano, conduciendo al remodelado y a la disfunción ventricular (58).
El infarto puede abarcar todo el espesor de la pared, en cuyo caso se denomina transmural, o bien limitarse al tercio o a la mitad interna de ella, lo que se conoce como infarto subendocárdico o no transmural. La necrosis afecta, prácticamente en todos los casos, el ventrículo izquierdo, aunque puede extenderse al ventrículo derecho o a las aurículas; su tamaño oscila entre unos centímetros y el 50% o más de la masa ventricular. Las arterias coronarias presentan, en la mayoría de los casos (95%), lesiones ateromatosas obstructivas. En los infartos transmurales, la arteria que irriga la zona del infarto se encuentra ocluida con frecuencia por un trombo fresco, único, de unos 2-3 cm, adherido a una placa aterosclerosa, que casi siempre muestra lesiones agudas, como erosión, fisuración o rotura de la íntima y hemorragias (58).
La rotura de la placa es la circunstancia que desencadena el infarto, al exponer el colágeno subendotelial a la acción de las plaquetas y provocar su activación, la formación de agregados y la liberación de sustancias vasoactivas que, como el tromboxano, inducen espasmo y contribuyen a la oclusión del vaso. En algunos casos, existe simplemente una erosión sobre la placa, suficiente para iniciar el proceso de agregación plaquetaria. Todo ello, en definitiva, determina la formación de un trombo, que en el infarto transmural es rojo y oclusivo. En las horas y los días siguientes, el trombo sufre un proceso de lisis, de forma que la prevalencia de oclusión completa es del 50% a los 15 días y del 45% al mes (32).
En algunos pacientes se ha demostrado que el espasmo coronario puede causar infarto de miocardio; no obstante, esta circunstancia es, al parecer, rara. Finalmente, la disección aórtica o coronaria, una embolia, las anomalías congénitas de las arterias coronarias, su laceración por un traumatismo y la arteritis, entre otras causas, pueden reducir la perfusión hasta un nivel crítico, provocar isquemia y conducir a la necrosis miocárdica; no obstante, suelen ser mecanismos muy poco frecuentes. En los últimos años se han descrito con cierta frecuencia casos de infarto de miocardio por consumo de cocaína; esta droga provoca espasmo coronario, deprime la contractilidad y aumenta el consumo de oxígeno del miocardio (2).
Una vez producida la oclusión coronaria, la zona de miocardio irrigada por la arteria afecta queda isquémica; debido en parte a la presencia de colaterales que permiten cierto flujo de sangre, la necrosis no se establece de forma inmediata sino progresiva, desde el subendocardio hacia el epicardio. En resumen, la necrosis es un fenómeno dinámico y su extensión definitiva dependerá fundamentalmente de la masa ventricular irrigada por la arteria ocluida, de la existencia de colaterales, de la presencia de lesiones obstructivas en las arterias de las que parten dichas colaterales, de la posibilidad de una reperfusión miocárdica precoz por lisis espontánea o terapéutica del trombo y, en mucho menor grado, de las demandas de oxígeno del músculo isquémico (4).
El dolor es el síntoma dominante en la mayoría de los casos; sus características son similares en cuanto a calidad, localización e irradiación al de la angina; no obstante, suele ser más intenso y prolongado, no responde a la nitroglicerina y se acompaña de manifestaciones vegetativas. De cualquier forma, la intensidad del dolor y en general la gravedad del cuadro son muy variables y no guardan relación con la extensión y la importancia de la necrosis.
Aproximadamente en la mitad de los casos existe el antecedente de dolor anginoso en los días o semanas previos al infarto. Con frecuencia, estas molestias no se diagnostican correctamente y sólo a posteriori se catalogan de angina. El dolor no guarda relación con el esfuerzo y en más del 50% de los casos aparece cuando el paciente se halla en reposo, con frecuencia durante la noche y determina su despertar; es poco habitual que se presente tras un esfuerzo intenso o extenuante. La mayor incidencia de infarto ocurre durante la mañana, hacia las 9:00, y coincide con los cambios en la agregabilidad plaquetaria y en los valores de cortisol que ocurren a estas horas (1, 2, 3,4).
El cuadro clínico se acompaña casi constantemente de sudación fría, debilidad, náuseas, vómitos, angustia y sensación de muerte inminente. Todo ello confiere al cuadro una sensación de gravedad que lo diferencia de la crisis anginosa. Alrededor del 25% de los infartos de miocardio no se reconocen clínicamente; la mitad de ellos cursan de forma asintomática y el diagnóstico se realiza de forma retrospectiva al registrar un ECG; en el resto, el dolor es atípico o no está presente, pero pueden observarse otras manifestaciones clínicas debidas al síndrome vegetativo o a alguna de las complicaciones del infarto. Así, el dolor puede localizarse exclusivamente en los brazos o en el epigastrio; otras veces, por el contrario, los síntomas dominantes son las náuseas y los vómitos, que simulan un cuadro digestivo, o bien predominan la disnea, un síncope o un accidente vascular cerebral. La ausencia de dolor es más frecuente en los pacientes diabéticos y en los de edad avanzada (1, 2,59).
La exploración física es muy variable; durante los episodios de dolor, el paciente se encuentra pálido, sudoroso e intranquilo. El pulso suele ser rápido, excepto si existe bradicardia (muy frecuente durante las primeras horas) o bloqueo AV. La hipotensión es también habitual mientras persisten el dolor y la bradicardia; cuando se prolonga, debe sospecharse la posibilidad de un shock cardiogénico. De cualquier forma, la presión puede ser normal e incluso detectarse hipertensión secundaria a una descarga adrenérgica. La palpación precordial puede mostrar un doble impulso apical por discinesia ventricular; en la auscultación casi siempre se detectan un cuarto ruido y la disminución en la intensidad de los ruidos cardíacos; con menor frecuencia se ausculta un soplo sistólico de regurgitación mitral. En presencia de insuficiencia cardíaca pueden aparecer un tercer ruido con cadencia de galope, un desdoblamiento paradójico del segundo ruido y estertores pulmonares. La afección del ventrículo derecho se manifiesta por signos de fallo ventricular derecho, que incluyen ingurgitación yugular, hepatomegalia y reflujo hepatoyugular. Una exploración normal no descarta la existencia de un infarto de miocardio (1, 2,4).
Junto a la clínica y las determinaciones enzimáticas constituye un elemento fundamental para el diagnóstico del infarto agudo; además, permite analizar su evolución, localizar la necrosis y evaluar de forma aproximada su extensión. La génesis de los signos de isquemia, lesión y necrosis en el ECG se estudia detalladamente en Electrocardiografía. La interrupción experimental del flujo coronario determina, casi de manera instantánea, cambios en el ECG que inicialmente se circunscriben a la onda T; ésta aumenta de tamaño y se vuelve simétrica, lo que en electrocardiografía se denomina fase de isquemia. Unos minutos más tarde, si persiste la interrupción del flujo coronario, el segmento ST se desplaza hacia arriba y adopta una forma convexa que caracteriza la denominada fase de lesión. Hasta este punto los cambios en el ECG son idénticos a los de la angina variante y, como en ella, reversibles si se restablece el flujo arterial. En caso contrario se inicia la necrosis celular, que se manifiesta eléctricamente por ondas Q de amplitud superior al 25% del complejo QRS o de duración mayor de 0,04 segundos (1, 2,60).
En la mayoría de los pacientes, el primer ECG se registra un tiempo después del inicio de los síntomas y presenta, en las derivaciones que exploran directamente la zona del infarto, una combinación de los signos de isquemia y lesión. Con frecuencia aparecen ya ondas Q, que se hacen más evidentes en los trazados posteriores, al mismo tiempo que disminuye el voltaje de la onda R. En los días posteriores, el segmento ST desciende y puede llegar a normalizarse, mientras que la onda T se vuelve más negativa; con el tiempo, sin embargo, puede llegar a normalizarse. La onda Q, por el contrario, suele persistir definitivamente, excepto en una pequeña proporción de pacientes (6%) en los que el ECG puede llegar a ser normal. Las derivaciones electrocardiográficas que presentan onda Q, elevación del segmento ST e inversión de la onda T orientan sobre la localización del infarto. La localización del infarto puede tener importancia pronóstica; se acepta que, en general, los infartos anteriores tienen peor pronóstico, ya que se complican más a menudo con shock cardiogénico, aneurismas ventriculares y trastornos graves de la conducción intraventricular. Las derivaciones alejadas u opuestas a la zona necrosada muestran cambios electrocardiográficos indirectos o en espejo (ondas R altas, depresión del segmento ST y ondas T positivas) que son de utilidad en el diagnóstico de algunos infartos de localización posterior. El diagnóstico electrocardiográfico de infarto puede ser difícil en presencia de algunos trastornos de la conducción como el bloqueo de rama izquierda (4,60)
Algunos pacientes que presentan a su ingreso elevación del segmento ST y una gran proporción de aquellos que muestran depresión del segmento ST o alteraciones de la onda T no desarrollan ondas Q en los ECG posteriores. En estos casos, las determinaciones enzimáticas, el ecocardiograma y los estudios isotópicos permiten establecer el diagnóstico de necrosis y diferenciar el cuadro de la angina inestable. El infarto sin onda Q se había asimilado tradicionalmente a la necrosis no transmural. No obstante, no existe una correlación estricta entre los hallazgos electrocardiográficos y anatomopatológicos, de forma que algunos infartos sin onda Q aparecen en la autopsia como transmurales; por este motivo, los términos infarto subendocárdico y no transmural en la actualidad tienden a sustituirse por el de infarto sin onda Q. Dado que éste, en los momentos iniciales, antes de que el diagnóstico pueda establecerse con las enzimas, tiene un cuadro clínico idéntico al de la angina inestable, ambos síndromes suelen tratarse de una forma similar y se agrupan actualmente bajo el nombre de síndromes coronarios agudos (32).
Los signos electrocardiográficos de infarto de ventrículo derecho o de infarto auricular son más inespecíficos y a menudo el diagnóstico se basa exclusivamente en criterios clínicos; el primero suele dar elevación del segmento ST en la derivación V4R (quinto espacio intercostal y línea clavicular media del lado derecho), y el segundo depresión del espacio PR y arritmias (60).
El infarto de miocardio ocasiona diversas alteraciones humorales, como leucocitosis y aumento de la velocidad de sedimentación globular (VSG). No obstante, desde el punto de vista diagnóstico, sólo tiene importancia el aumento en la actividad sérica de ciertas enzimas, liberadas al torrente circulatorio como consecuencia de la necrosis. En la práctica se determinan tres de ellas, la CK, la transaminasa glutámico-oxalacética (ASAT) y la láctico-deshidrogenasa (LDH). La velocidad con que se activan es diferente para cada una de ellas; la más precoz es la CK (6-8 horas), intermedia la transaminasa glutámico-oxalacética (ASAT) (8-12 horas) y más tardía la LDH (24-48 h). Los valores de las dos primeras se normalizan al cabo de 3-4 días, mientras que la LDH permanece elevada entre 8 y 14 días. Es importante recordar que estas enzimas no son específicas del corazón, puesto que se encuentran en otros tejidos; por consiguiente, un valor anormal de cualquiera de ellas puede deberse a un proceso distinto al infarto. Así pues, para sustentar el diagnóstico de necrosis miocárdica se realizan determinaciones seriadas durante los primeros 3-4 días y se requiere que muestren la curva de ascenso y su normalización típica para cada una de ellas. La determinación de las isoenzimas de la CK y de la LDH facilita el diagnóstico y permite conocer si el aumento se debe específicamente a un infarto de miocardio, ya que las isoenzimas CK-MB y la LDH1 son casi exclusivas en el corazón.
Además, la primera puede estar anormalmente elevada en algunos casos en que la actividad de la CK total es normal. Recientemente se ha demostrado que ciertos marcadores como la mioglobina pueden ser más precoces o, como las troponinas T e I, más específicos que las enzimas utilizadas clásicamente. Los valores máximos de estas enzimas presentan una correlación discreta con la extensión de la necrosis y se han utilizado con fines pronósticos; no obstante, existen muchos factores diferentes que influyen en el grado de actividad enzimática, por lo que este parámetro sólo tiene un valor orientativo. En los últimos años se han desarrollado técnicas para la determinación de la mioglobina y la miosina; aunque todavía no se ha generalizado su uso, es posible que permitan un diagnóstico más precoz y tengan mayor especificidad que las enzimas clásicas (1, 2, 3,4).
El tejido necrótico del miocardio capta pirofosfato de tecnecio (99mTc) radiactivo, lo que permite detectar el infarto y estimar aproximadamente su extensión. La sensibilidad de esta técnica para detectar necrosis es del 85%, pero se reduce al 40% en los infartos sin onda Q. Las indicaciones de la gammagrafía con 99mTc se limitan a los casos en que el diagnóstico electrocardiográfico no es posible (bloqueo de rama izquierda, necrosis antigua). La ecocardiografía bidimensional constituye un método esencial para el diagnóstico del infarto de miocardio y sus complicaciones mecánicas, a la vez que permite una evaluación incruenta de la función cardíaca y del pronóstico. Aproximadamente en el 80% de los pacientes se obtienen registros de buena calidad, y en el 90% de éstos pueden detectarse alteraciones de la motilidad ventricular que confirman el diagnóstico de infarto. Por ello, está indicada en los pacientes con un cuadro sugestivo de infarto en los que el ECG es normal o presenta anormalidades que dificultan su interpretación (bloqueo de rama, síndrome de WPW). También debe realizarse con urgencia ante la sospecha de una complicación mecánica del infarto. Finalmente, antes del alta, la ecocardiografía proporciona una información fidedigna sobre el estado funcional del ventrículo (61).
La valoración hemodinámica del paciente con infarto agudo de miocardio puede realizarse en la actualidad fácilmente mediante catéteres flotantes con balón, dirigidos por el flujo sanguíneo. Los catéteres pueden introducirse hasta la arteria pulmonar a la cabecera del enfermo sin equipo de rayos X y permiten la determinación de las presiones de las cavidades derechas, la presión pulmonar enclavada (equivalente a la presión telediastólica del ventrículo izquierdo) y el gasto cardíaco. La monitorización hemodinámica está indicada cuando el infarto se complica con insuficiencia cardíaca, hipotensión, shock cardiogénico, taponamiento, rotura septal o del músculo papilar y, en general, cuando se requiere la administración de fármacos vasodilatadores o inotrópicos. Los hallazgos hemodinámicos tienen valor pronóstico, y el grado de disfunción ventricular se correlaciona con la mortalidad. En la fase aguda del infarto, la coronariografía sólo está indicada en los pacientes con angina postinfarto rebelde al tratamiento farmacológico y en aquellos con complicaciones mecánicas graves en los que se considera el tratamiento quirúrgico o la angioplastia. Cuando se realiza en las primeras horas del cuadro agudo se observa la oclusión de la arteria que irriga la zona necrosada en aproximadamente el 85% de los pacientes; este porcentaje disminuye de manera progresiva en los días siguientes como consecuencia de la lisis espontánea del trombo. El 25% de los enfermos tienen lesiones aterosclerosas circunscritas a una sola arteria coronaria, el 33% a dos, y otro porcentaje similar muestra lesiones obstructivas en los tres vasos principales. Las lesiones del tronco común de la coronaria izquierda son raras (1-3%), al igual que una coronariografía estrictamente normal (3%) (62).
El infarto de miocardio puede presentar una gran variedad de complicaciones, en particular durante los primeros días; su prevención y control constituyen los objetivos fundamentales del tratamiento durante la fase aguda. Las complicaciones suelen dividirse en eléctricas y mecánicas y su frecuencia y gravedad son muy variables. El 75-95% de los pacientes con infarto agudo de miocardio presentan alguna alteración del ritmo durante su estancia en la unidad coronaria; las más frecuentes son la extrasistolia ventricular, la bradicardia y la taquicardia sinusales. Prácticamente todos los pacientes presentan extrasístoles ventriculares durante las primeras 72 horas de infarto, y en la mayoría de los casos son inocuas; el único peligro radica en su capacidad para provocar taquicardia y fibrilación ventriculares, arritmias que se presentan en alrededor del 10 y el 6%, respectivamente, y que son letales si no se instaura enseguida el tratamiento adecuado. La bradicardia sinusal es muy frecuente durante las primeras horas, cuando la incidencia puede alcanzar el 30-40%; puede acompañarse de hipotensión y en ocasiones cede al suprimir el dolor. La taquicardia sinusal aparece en un tercio de los pacientes y se debe con frecuencia a la ansiedad, la persistencia del dolor o la insuficiencia cardíaca; se considera un signo ominoso cuando persiste pasadas las primeras horas.
Las extrasístoles auriculares son frecuentes y pueden constituir el único signo de infarto auricular; su único peligro radica en que pueden provocar flutter y fibrilación auriculares, los cuales, aunque benignos desde un punto de vista eléctrico, pueden agravar la situación clínica del paciente al reducir el gasto cardíaco. Otro grupo importante de arritmias frecuentes en el infarto de miocardio está constituido por el bloqueo AV. En el infarto de localización inferior suele ser suprahisiano y transitorio y responde bien al tratamiento farmacológico. Por el contrario, en el infarto anterior traduce por lo general una afección difusa del sistema intraventricular de conducción por la isquemia, es con frecuencia definitivo y entraña un mal pronóstico, incluso cuando se implanta un marcapasos. Los bloqueos de rama bifasciculares secundarios a un infarto agudo suelen traducir una necrosis extensa e indican mal pronóstico (63).
La insuficiencia cardíaca es la más frecuente entre las complicaciones mecánicas del infarto y se debe a la reducción de la masa contráctil del ventrículo izquierdo. Cuando la necrosis afecta más del 25% de ésta, aparecen los signos clínicos de fallo izquierdo; un infarto que afecte al 40% provocará shock cardiogénico. Aproximadamente el 50% de todos los pacientes con infarto de miocardio presenta signos de insuficiencia cardíaca durante la fase aguda y entre el 5 y 7% de shock cardiogénico. Las manifestaciones clínicas de fallo ventricular durante el infarto agudo de miocardio pueden limitarse a la auscultación de estertores pulmonares o de un tercer ruido o bien constituir el cuadro grave del shock cardiocirculatorio. La isquemia determina también una alteración de la distensibilidad ventricular, lo que provoca una elevación de la presión diastólica ventricular y favorece la aparición de los síntomas de congestión pulmonar. Otros factores, como la sobrecarga de volumen secundaria a otras complicaciones mecánicas o el desarrollo de un aneurisma ventricular, contribuyen a la aparición de insuficiencia cardíaca. Los signos de fallo ventricular derecho, como la ingurgitación yugular o el reflujo hepatoyugular, aparecen en una elevada proporción de casos de infarto inferior, indicando la afección del ventrículo derecho (64).
La insuficiencia cardíaca es un signo de mal pronóstico, y el grado de fallo ventricular durante la fase aguda se correlaciona con la mortalidad. La evaluación de la gravedad en la insuficiencia cardíaca y el shock que complican el infarto agudo de miocardio, así como la selección de la terapéutica adecuada, se debe realizar mediante la determinación del gasto cardíaco y las presiones endocavitaria (64,65).
El shock cardiogénico constituye la forma más grave del fallo ventricular izquierdo y se diagnostica por la aparición de hipotensión (presión arterial sistólica inferior a 90 mm Hg) junto a signos de hipoperfusión tisular (oliguria, obnubilación, piel fría y pálida), en ausencia de hipovolemia, dolor o una arritmia. Recientemente, el grupo de trabajo de la AHA/ACC ha sugerido definir como shock cardiogénico la presencia de un índice cardíaco inferior a 2,5 L/m/m2, una presión pulmonar enclavada superior a 18 mm Hg y una presión arterial inferior a 90 mm Hg. El shock es más frecuente en pacientes con infartos extensos de localización anterior, ancianos, del sexo femenino y con historia de infarto previo o diabetes. Su mortalidad es superior al 80-90% a pesar de los nuevos fármacos adrenérgicos y de las medidas de soporte mecánico como el balón de contrapulsación intraaórtico. En estudios no controlados, la angioplastia parece reducir la mortalidad del shock hasta cifras cercanas al 45% (66).
La rotura del miocardio como consecuencia de la isquemia y la necrosis puede producirse en tres localizaciones distintas. La rotura de la pared libre del ventrículo provoca la salida masiva de sangre al pericardio y un cuadro de taponamiento rápidamente letal a menos que pueda suturarse de inmediato; su traducción clínica suele consistir en una hipotensión profunda, con ausencia de pulsos, mientras el ECG permanece sin modificarse durante unos minutos (disociación electromecánica). Su incidencia en una serie prospectiva fue del 6% y la rotura de la pared libre es responsable del 10% de los fallecimientos en la fase aguda. La rotura puede localizarse también en el tabique interventricular y originar una comunicación entre ambos ventrículos que se traduce clínicamente por un soplo sistólico con frémito, irradiado al borde esternal derecho, y por un cuadro de insuficiencia biventricular grave. Su incidencia es del 0,5-3% y tiene una elevada mortalidad. Por último, la necrosis de un músculo papilar ocasiona un cuadro de regurgitación mitral y edema agudo de pulmón; la isquemia de menor intensidad, en la que el músculo no alcanza a romperse, puede provocar distintos grados de insuficiencia mitral. La rotura del músculo papilar es una situación muy grave que requiere cateterismo cardíaco y tratamiento quirúrgico (66).
Alrededor del 10-20% de los pacientes desarrollan un aneurisma o dilatación circunscrita en la zona necrótica, que forma una bolsa no contráctil, de pared delgada, que se distiende durante la sístole y resta eficacia a la contracción ventricular. Por lo general, se localizan en la pared anterior, se acompañan de trombosis mural y pueden provocar insuficiencia cardíaca.
La aparición de un doble impulso apical y la persistencia de la elevación del segmento ST en el ECG son los signos clínicos que permiten sospechar el diagnóstico; el ecocardiograma, la ventriculografía isotópica y el cateterismo cardíaco confirmarán su presencia. Como ya se ha mencionado, el remodelado que sufre el ventrículo tras el infarto determina una dilatación progresiva, con disminución de la función ventricular; de esta forma, incluso en ausencia de nuevos episodios isquémicos puede aparecer tardíamente insuficiencia cardíaca (60).
La tromboembolia pulmonar es una complicación rara en la actualidad. Con frecuencia (20%) se observan en los estudios ecocardiográficos trombos adheridos a la zona necrosada, las embolias sistémicas son raras y se detectan en la autopsia de, aproximadamente, el 10% de los pacientes fallecidos durante la fase aguda; los trombos pediculados, de gran tamaño y localizados en la cara inferior, tienen mayor tendencia a desprenderse. El 7% de los pacientes tratados con trombolíticos y el 20% de los no tratados presentan en los primeros días del infarto un frote pericárdico acompañado de un dolor claramente relacionado con los movimientos respiratorios y que en general se distingue con facilidad del dolor coronario. En esta fase del infarto, la pericarditis es una complicación benigna que sólo en los pacientes tratados con anticoagulantes puede plantear problemas al provocar un hemopericardio. Más tarde, a las 2-6 semanas del infarto, el 1-2% de los enfermos padecen una pericarditis, por lo general con derrame, acompañada de pleuritis o neumonitis, que recibe el nombre de síndrome de Dressler. Se trata de un proceso autoinmune que puede recurrir durante el primer año y requerir la administración de glucocorticoides e incluso la creación de una ventana pericárdica (2,4).
La mortalidad global del infarto de miocardio durante el primer mes del episodio agudo es del 30%; la mitad de estos fallecimientos se deben a trastornos del ritmo y se desencadenan en las primeras 2 h, generalmente antes de que el paciente haya recibido asistencia médica. Las muertes por arritmias son raras en la unidad coronaria; en estos pacientes ingresados, la insuficiencia cardíaca y las roturas constituyen las causas más frecuentes de mortalidad. Entre los pacientes ingresados la mortalidad es del 7-12% y depende fundamentalmente de la posibilidad de administrar tratamiento trombolítico, de la edad y de la gravedad del infarto. Son signos de mal pronóstico en esta fase del infarto la presencia de fallo izquierdo o shock, los bloqueos bifasciculares, los infartos anteriores de gran extensión, la taquicardia sinusal persistente, las arritmias ventriculares repetitivas rebeldes al tratamiento, la edad avanzada, el antecedente de infarto previo y la diabetes de difícil control (67).
Tratamiento de la fase aguda del infarto de miocardio
Está condicionado por varios factores, entre los cuales los más importantes son los siguientes:
1) En la mayoría de los casos la causa del infarto es la oclusión del vaso por un trombo, cuya lisis es posible espontánea o farmacológicamente.
2) La necrosis se establece en forma progresiva a lo largo de las primeras 4-6 horas y la reperfusión precoz puede reducir la extensión del área necrosada, que es el principal determinante del pronóstico.
3) Más del 50% de los fallecimientos por infarto se desarrollan en las primeras 2 horas y se deben a fibrilación ventricular, una causa fácilmente tratable en el hospital. Durante los primeros días persiste el riesgo de complicaciones eléctricas y mecánicas graves (1).
Los objetivos del tratamiento en esta fase del infarto son:
a) suprimir el dolor;
b) prevenir las arritmias, en especial la fibrilación ventricular;
c) reducir el tamaño de la necrosis, y
d) prevenir y tratar las complicaciones mecánicas, sobre todo la insuficiencia cardíaca y el shock cardiogénico.
Una vez superada esta fase, la evaluación del pronóstico a largo plazo, la prevención de nuevos episodios isquémicos y la rehabilitación funcional, social y laboral del paciente constituyen nuevos objetivos. El dolor del infarto agudo debe tratarse inmediatamente con cloruro o sulfato de morfina; la dosis inicial es de 2-3 mg por vía intravenosa, que puede repetirse cada 10 min hasta que desaparece el dolor o se alcanza la dosis máxima (10-15 mg cada 4-6 horas). Por esta vía la acción máxima se consigue a los 10-15 min y los efectos colaterales más graves son la depresión respiratoria, la hipotensión y la bradicardia. Si inicialmente la frecuencia cardíaca es lenta, puede emplearse en su lugar meperidina a dosis fraccionadas de 20-30 mg hasta un total de 100 mg cada 4-6 horas. El efecto analgésico de estos fármacos se potencia con la administración de sedantes del tipo del diazepam, 5-10 mg 3 veces al día. (1, 2, 3,4)
Antiarrítmicos
En los últimos años se ha abandonado el tratamiento profiláctico con lidocaína. Un metaanálisis de 14 ensayos controlados con más de 9.000 pacientes ha demostrado que aunque la lidocaína reduce en un 35% la incidencia de fibrilación ventricular, la mortalidad aumenta en un 38% (2).
Fibrinolíticos
Aunque son numerosos los fármacos y las intervenciones que, experimentalmente, reducen la extensión de la necrosis, sólo la fibrinólisis, la angioplastia coronaria y los bloqueadores betaadrenérgicos tienen importancia práctica. El mecanismo a través del cual actúan los trombolíticos en el infarto agudo de miocardio es la apertura de la arteria y, en consecuencia, la reducción del área necrótica. En efecto, se ha demostrado que tras la administración intravenosa del fármaco se consigue la recanalización de la arteria coronaria responsable del infarto entre el 40 y el 65%, dependiendo del trombolítico empleado. La mortalidad se correlaciona con el restablecimiento del flujo coronario, que llega a ser total en aproximadamente el 50% de los pacientes tratados con tPA.
El tratamiento trombolítico reduce la necrosis miocárdica, valorada mediante determinaciones enzimáticas, entre un 10 y un 20%; como consecuencia de lo anterior, la función ventricular mejora y la mortalidad de la fase aguda se reduce en un 20-30% (68). El tratamiento es tanto más eficaz cuanto más precozmente se administra: dentro de las primeras 6 horas del infarto los trombolíticos salvan 30 vidas por cada 1.000 pacientes tratados, y 20 cuando se administran entre las 7 y 12 horas del comienzo de los síntomas. El efecto sobre la mortalidad es todavía más acusado si el fármaco se administra dentro de la primera hora, con reducciones de la mortalidad entre el 40 y el 60%. De las diferentes pautas ensayadas, la administración de estreptocinasa a dosis de 1,5 millones de unidades en una hora y la pauta acelerada de alteplase (tPA) (100 mg en 60 min) son las más utilizadas en la actualidad.
En el momento actual, se están ensayando nuevos fibrinolíticos como el saruplase (activador del plasminógeno tipo urokinasa de cadena única), la estafilocinasa y otros obtenidos mediante manipulación de la molécula del tPA (reteplase [r-PA], laneteplase [n-PA] y TNK). Aunque todavía no han demostrado su superioridad respecto a los dos actualmente en uso, su facilidad de administración en bolus puede representar una ventaja en el futuro. Las principales complicaciones del tratamiento trombolítico son las hemorragias, especialmente la cerebral, que puede presentarse en el 0,5-1,5% de los casos, dependiendo del fármaco y la dosis empleados. La tasa de hemorragias es algo mayor para el tPA, sobre todo a dosis superiores a 100 mg. Las hemorragias de otra localización aparecen en el 20% de los casos, aunque sólo son importantes en el 5% de ellos. A pesar de estas complicaciones, el efecto beneficioso de los trombolíticos en el infarto de miocardio es claro, y la mortalidad hospitalaria del infarto en los pacientes tratados se ha reducido actualmente al 7-9% (69).
En resumen, el tratamiento trombolítico está indicado en los pacientes con dolor coronario de más de 30 minutos, que no cede con nitroglicerina, de cualquier edad, que acuden al hospital durante las primeras 6 horas posteriores al infarto y que presentan una elevación del segmento ST o bloqueo de rama izquierda en el ECG. Entre las 6 y 12 horas sólo se aconseja tratar a los pacientes en los que persisten el dolor y los signos electrocardiográficos de isquemia. Las contraindicaciones del tratamiento trombolítico se circunscriben fundamentalmente a los casos de diátesis hemorrágicas, antecedentes de hemorragia cerebral, intervenciones mayores recientes, úlcera gastroduodenal activa y retinopatía diabética, entre otras. Debe considerarse preferible el tratamiento con alteplase (tPA) en los pacientes de edad inferior a 75 años que presentan un infarto anterior o inferior extenso, de menos de 6 horas de evolución, así como en aquellos que han recibido previamente estreptocinasa. En el resto, puede administrarse estreptocinasa (68,69).
Varios estudios controlados, que han incluido casi 2.000 pacientes, han demostrado que la angioplastia coronaria primaria, en las primeras horas del infarto y sin tratamiento trombolítico previo, es superior a éste. Un metaanálisis de todos ellos demostró que la mortalidad en los pacientes tratados con angioplastia era del 4,5% en comparación con el 6,5% del grupo tratado con fibrinolíticos. Estas diferencias, no obstante, son modestas, y la disponibilidad limitada de la angioplastia, con las dificultades de orden logístico y económico determinan que los trombolíticos sean el tratamiento de elección en la mayoría de los pacientes. Por tanto, la angioplastia primaria está indicada dentro de las primeras 6-12 horas del infarto, cuando el paciente acude a un centro con laboratorio de hemodinámica y personal experimentado que puede llevar a cabo la técnica en menos de 90 min desde la llegada del paciente al hospital. Además, en aquellos enfermos con un riesgo de hemorragia elevado, y como consecuencia contraindicación a los fibrinolíticos, la angioplastia es la mejor alternativa. Varios estudios han revelado que la realización de una angioplastia coronaria sistemática tras la trombólisis, con el fin de disminuir la estenosis arterial coronaria residual, no ofrece ventajas y se acompaña de un número mayor de complicaciones (70).
El International Study on Infarct Survival 2 (estudio ISIS 2) demostró de una manera definitiva que la administración de AAS dentro de las primeras horas del infarto reduce la mortalidad en un 20% y su efecto se suma al de los trombolíticos; de esta forma, tan pronto se sospecha el diagnóstico de infarto, se recomienda administrar una dosis oral de 160-325 mg. El papel de los nuevos antiagregantes, especialmente los antagonistas de los receptores de glucoproteína (GP) IIb/IIIa se está estudiando en varios ensayos, y es posible que en el futuro, asociados a dosis bajas de fibrinolíticos, constituyan una alternativa terapéutica (70,71).
La eficacia de la heparina en el infarto agudo de miocardio ha sido motivo de controversia. Los resultados de los diferentes estudios que han abordado este problema son contradictorios, probablemente por las diferencias en las dosis y las vías de administración de la heparina. En un metaanálisis de los primeros estudios, que incluía 5.459 pacientes sin aspirina, 14% tratados con trombolíticos, la heparina redujo significativamente la mortalidad intrahospitalaria en un 25%. Los ensayos más recientes con una población de 68.000 pacientes tratados con aspirina y fibrinolíticos, han demostrado una reducción de mortalidad, de la tasa de reinfartos y de embolias pulmonares. La eficacia de la heparina, y sobre todo la tasa de complicaciones, guardan relación con el fibrinolítico utilizado; así pues, con el tPA se recomienda la administración de heparina por vía i.v. (bolus de 5.000 U, seguida de infusión para mantener el APTT entre 50 y 70 seg), mientras que no se ha demostrado su utilidad con la estreptocinasa. Recientemente, dos nuevos ensayos, Gusto 2b y TIMI-9b no pudieron demostrar superioridad de la hirudina sobre la heparina en pacientes con infarto de miocardio y elevación del segmento ST. De esta forma el papel de este antitrombótico de acción directa está por determinar, al igual que el de las heparinas de bajo peso molecular (72).
La administración temprana de bloqueadores betaadrenérgicos por vía intravenosa, seguida de mantenimiento por vía oral durante la hospitalización del paciente, reduce la mortalidad del infarto durante los primeros 7 días en un 15%; el efecto es máximo en los primeros 2 días, probablemente por la prevención de la rotura cardíaca y la fibrilación ventricular. Los ensayos GISSI-3 e ISIS-4 han demostrado que la administración precoz (en las primeras 24 h) de un inhibidor de la enzima convertidora de la angiotensina tiene un efecto beneficioso, aunque modesto, sobre la mortalidad reduciéndola en un 7%. Por tanto, se aconseja su administración en pacientes que tras recibir el tratamiento convencional con aspirina, fibrinolíticos y betabloqueantes, no presentan hipotensión, especialmente si el infarto es extenso (1,2).
En los pacientes que sobreviven a un infarto de miocardio persiste el riesgo de que se produzca un nuevo accidente coronario o la muerte de forma prematura. La mortalidad en los primeros 6 meses de convalecencia se sitúa alrededor del 10% y se estabiliza posteriormente en el 3-4% anual. A los 5 años, del 20 al 35% de los supervivientes de un infarto han fallecido. En este mismo período, el 13% de los varones y el 39% de las mujeres han desarrollado un nuevo infarto. Existe cierta evidencia en la literatura de que el pronóstico postinfarto de miocardio ha mejorado en los últimos años. Así, en los pacientes tratados con trombolíticos la mortalidad a los 6 meses es del 3-4% (73).
Los factores que determinan el pronóstico a largo plazo son fundamentalmente tres: el grado de disfunción ventricular residual, la gravedad de la afección coronaria, expresada por el número de arterias con lesiones, y la presencia de arritmias ventriculares graves. Así, el pronóstico es excelente en los pacientes con fracción de eyección normal (superior a 50%), que presentan una mortalidad a los 4 años del 4%. Por el contrario, los enfermos con fracción de eyección inferior al 30%, afección de los tres vasos y arritmias ventriculares repetitivas constituyen un grupo de riesgo elevado. Mención especial merecen los infartos sin onda Q; aunque la mortalidad durante el período de hospitalización es inferior a la del infarto con onda Q, la mortalidad a largo plazo, incluyendo la intrahospitalaria, es ligeramente superior para el infarto sin onda Q, 29% frente a 22% en un metaanálisis de los estudios más recientes (73,74).
OBJETIVOS:
General:
Describir el comportamiento del Síndrome Coronario Agudo en los pacientes ingresados en la sala de Terapia Intensiva con este diagnóstico, desde Enero del 2006 hasta Abril del 2007.
Específicos:
1. Distribuir los pacientes según grupo de edades y sexo.
2. Determinar cuáles son los principales factores de riesgo del Síndrome coronario agudo en estos pacientes.
3. Reflejar las formas clínicas del Síndrome coronario agudo, su relación con los factores de riesgo y con el tratamiento empleado en estos pacientes.
4. Relacionar las complicaciones y la supervivencia al egreso de los pacientes con síndrome coronario agudo.
MATERIAL Y MÉTODO:
Se realizó un estudio transversal descriptivo, con el objetivo de valorar el comportamiento del Síndrome Coronario Agudo (Angina Inestable e Infarto Agudo del Miocardio), en los pacientes con este diagnóstico ingresado en la sala de Terapia Intensiva del CDI Libertad, municipio Ricaurte, estado Cojedes, desde Enero del 2006 hasta Abril del 2007. La muestra ascendió a 44 pacientes lo cual coincidió con el total de enfermos que presentaron esta entidad y fueron hospitalizados en este servicio. La historia clínica se convirtió en el registro primario de la investigación donde se encontraban reflejados los criterios clínicos, eléctricos y enzimáticos necesarios para el diagnóstico del Síndrome Coronario Agudo. Los datos se recolectaron manualmente a través de la planilla de recolección de datos y se procesaron en una microcomputadora Pentium III, con ambiente de Windows XP, los textos se procesaron con Word XP y las tablas se realizaron con Excel XP, se trabajó con tablas de distribución de frecuencia, de contingencia y un gráfico.
Para la confección de las encuestas se emplearon las siguientes variables seleccionadas por el autor:
1,- Grupo de edades
2,- Sexo
3,- Factores de riesgo del síndrome coronario agudo
4,- Formas clínicas del síndrome coronario agudo
5,- Fármacos utilizados durante el ingreso
6,- Complicaciones
7,- Estado al egreso
Control Semántico
Angina Inestable: Engloba diversas formas clínicas de evolución imprevisible e incluye la angina de reposo, la angina de reciente comienzo grave (grados III y IV), la angina progresiva (con aumento en duración, intensidad, frecuencia de las crisis y/o cambio en el grado funcional) y la angina postinfarto (durante el primer mes postinfarto, excluidas las primeras 24 horas). La angina de reposo incluye la angina variante de Prinzmetal (vaso espasmo coronario con elevación reversible del ST) y la angina prolongada. La características y localización del dolor, que suele describirse como opresivo, sin variaciones con la respiración o los cambios de posición, en región centrotorácica o epigástrica, con ocasional irradiación a cuello y mandíbula, región ínter escapular, hombros y cara interna de brazos (más el izquierdo); 2) duración del dolor, desde escasos minutos hasta más de treinta (1,32).
Infarto Agudo del Miocardio: se define como la necrosis de una zona del miocardio producida por isquemia aguda y mantenida, y su causa más frecuente es la trombosis intracoronaria secundaria a la rotura de una placa de ateroma. El diagnóstico se basa en la presencia de dolor precordial, alteraciones del ECG y cambios enzimáticos El dolor suele ser de las mismas características y localización que el de la angina, aunque más prolongado e intenso, y suele acompañarse de sudoración, náuseas, mareo y a veces sensación de muerte inminente (1, 2, 3,4).
Factores de Riesgo: Se entiende por factores de riesgo a determinados signos biológicos, estilos de vida o hábitos adquiridos cuya presencia aumenta la probabilidad o el riesgo de presentar alguna de las manifestaciones clínicas de una enfermedad específica en los años subsiguientes. Aunque el concepto de factor de riesgo surgió a raíz del estudio de la epidemiología de las enfermedades cardiovasculares, se trata de un concepto genérico aplicable a otras enfermedades. Los factores de riesgo bien establecidos de la cardiopatía isquémica son el colesterol total sérico, la hipertensión arterial, el consumo de cigarrillos, la diabetes, la obesidad y actualmente la hipertrofia ventricular izquierda (HVI). Se les denomina actualmente factores de riesgo clásicos. La edad y el sexo no son factores de riesgo sino características de riesgo (1).
Definiciones Operacionales
Hipertensión Arterial: según el VII reporte del JNC todo paciente independientemente de su edad se considera hipertenso a partir de 139 mmHg de tensión sistólica y de 89 mmHg de tensión diastólica de forma sostenida o la toma en una ocasión de una tensión sistólica igual a 180 mmHg y diastólica de 110 mmHg.
Tabaquismo: todo paciente que consuma 10 o más cigarrillos diarios o que haya dejado de fumar en un tiempo menor de 3 años.
Hipercolesterolemia: cifras superiores a 6.7 mmol/l.
Hipertrigliceridemia: Valores superiores a 1.6 mmol/l.
Diabetes Mellitus: según criterios diagnósticos de la ADA: Hiperglicemias mayores o igual de 7 mmol/l en ayunas o hiperglicemias mayores o igual de 11.1 mmol/l postprandrial, con signos clínicos de la enfermedad.
Hipertrofia Ventricular Izquierda (HVI):
1. Criterios electrocardiográficos:
- Aumento del voltaje de las derivaciones izquierdas D1, AVL, V5 y V6.
- Onda R de AVL mayor de 12 mm.
- Onda R de V5 + onda S de V1 mayor de 35 mm.
2. Criterios radiológicos: -Aumento del índice cardiotorácico (Cardiomegalia).
DISCUSIÓN DE LOS RESULTADOS:
Tabla 1: Relación entre grupos de edades y sexo.
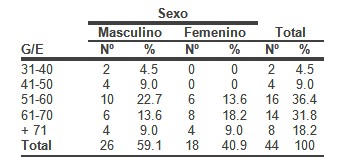
Fuente: encuesta a pacientes
La edad y el sexo están considerados por algunos autores como factores de riesgo coronarios a partir de los 50 años de edad y el masculino respectivamente, aunque en la actualidad existe una tendencia al aumento de la incidencia de esta enfermedad en las mujeres, quizás en relación con el consumo de cigarrillos. En estudios realizados por J. Masip, F. Vecilla y J. Páez, en el Hospital Cruz Roja de Barcelona, España, sobre la utilidad de la determinación de la saturación de oxígeno en la fase aguda del infarto agudo del miocardio, la edad media de los pacientes fue de 65 años, con un predominio del sexo masculino (75). En investigaciones realizados por C. Velayos, J.C. Martín y O. Reta, sobre la Angioplastia de rescate en pacientes con infarto agudo del miocardio, en el Servicio de Medicina Intensiva del Hospital Clínico San Carlos, Madrid, España, se evidencia que la edad promedio de los pacientes fue de 59.3 años, y el 80.8% de los pacientes fueron del sexo masculino (76).
Trabajos realizados por J. González, B. Obón, I. Gutiérrez, sobre Fibrinolisis en el infarto agudo del miocardio, en el Hospital Clínico de Zaragoza, se evidencia que la edad promedio de los pacientes estudiados fue de 76.83 años (77). Igualmente estudios acerca del Manejo actual del infarto agudo del miocardio de M.A. Taberna, E. Robles, P. Cañizares, en el Hospital de Segovia, reportan como edad media de los pacientes 69 años (78). En la tabla 1 donde se muestra la relación entre los grupos de edades y sexo, tenemos partiendo de este último que el más afectado fue el masculino con el 59.1%, el femenino alcanzó el 40.9% del total. Las edades comprendidas entre 51 y 70 años fueron en las que más incidió el síndrome coronario agudo, con 30 pacientes para un 68.2%.
Tabla 2: Factores de Riesgo del Síndrome Coronario Agudo.

Fuente: encuesta a pacientes
En el análisis de los factores de riesgo coronario M. Quintana, J.C. Sevilla, A. Simón, sobre la Hiperviscosidad sanguínea como predictor de tipo de evento coronario agudo en el Hospital Ntra. Sra. del Prado, España, se constató una mayor proporción de fumadores y de hipercolesterolémicos en el grupo estudiado (79). La Diabetes Mellitus con un 44% fue el factor de riesgo coronario que más se presentó en estudios realizados por M.C. Díaz, M. Sánchez, A. Vallejo, sobre Características clínicas y factores de riesgo asociados en pacientes con síndrome coronario agudo en el Servicio Medicina Intensiva del Hospital Universitario Insular, Las Palmas de Gran Canaria (80). En un estudio realizado en el Hospital Clínico Quirúrgico Gustavo Aldereguía Lima en la Provincia de Cienfuegos, Cuba, sobre Infarto Agudo del Miocardio y Auto cuidados, encontraron que la Hipertensión Arterial, el Tabaquismo, la Obesidad y la Diabetes Mellitus fueron los factores de riesgo coronario que más se presentaron en sus pacientes con un 91.6, 75.0, 20.0, y 11.6% respectivamente (81).
En la Unidad de Cuidados Intensivos del Hospital General Zona 1, en México, trabajos realizados por Eduardo Salazar Weil, sobre la Experiencia en el tratamiento del Síndrome Coronario Agudo, manifestó que el Tabaquismo con un 44%, la Hipertensión Arterial con el 42%, y la Hipertrofia Ventricular Izquierda con el 40% fueron los factores de riesgo coronario que predominaron, por su parte la Diabetes Mellitus, la Dislipidemia, y la Obesidad alcanzaron menores porcientos, con 32, 21, y 20% respectivamente (82). En nuestra investigación (tabla 2) encontramos que la hipertensión arterial (HTA), la Diabetes Mellitus, la hipertrofia ventricular izquierda y la hipercolesterolemia, fueron en este orden los factores de riesgo coronario que más afectaron a los pacientes con un 54.5%, 40.9%, 36.4% y 31.8% respectivamente. Por su parte la obesidad y el tabaquismo presentaron iguales porcientos (18.2%), mientras que la Hipertrigliceridemia fue el factor de riesgo menos detectado con un 13.6%.
Tabla 3: Formas clínicas y factores de riesgo coronarios.
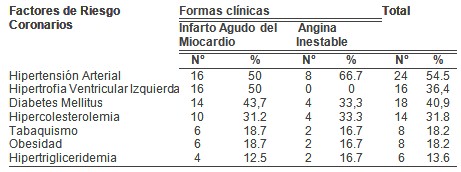
Fuente: encuesta a pacientes
Atendiendo a la relación entre las formas clínicas y los factores de riesgo del Síndrome coronario agudo (tabla 3), partiendo del análisis del infarto agudo del miocardio, predominaron la hipertensión arterial y la hipertrofia ventricular izquierda, con iguales porcientos (50%), seguida de la Diabetes Mellitus y la Hipercolesterolemia con un 43.7 y 31.2% respectivamente, la obesidad y el tabaquismo se vieron en 6 pacientes cada uno para un 18.7%, mientras que la Hipertrigliceridemia fue encontrada en 4 pacientes para un 12.5%. En cuanto a la Angina de pecho inestable se destacó la hipertensión arterial (HTA) con el 66.7%, seguida de la Diabetes Mellitus y la hipercolesterolemia con un 33.3% en cada caso, la Hipertrigliceridemia, la obesidad y el tabaquismo se vieron en dos pacientes para un 16.7% de los pacientes anginosos. En estudios comparativos de las formas clínicas del Síndrome Coronario Agudo en cuanto a sus factores de riesgo M.A. García, M.A. Rosero, R. Gimeno del Servicio de Medicina Intensiva. Hospital Universitario La Fe, Valencia apreciaron que en el grupo de infartados el Tabaquismo se presentó en el 28% contra un 16% en el grupo de anginosos, mientras que la Hipercolesterolemia predominó en estos últimos con un 42% sobre un 25% en los primeros (83).
En el Hospital Clínico Quirúrgico Dr. Joaquín Castillo Duany, en Santiago de Cuba, Cuba, en un estudio sobre Cardiopatía Isquémica y sus factores de riesgo, el Dr. Diego Nápoles destacó que la Hipertensión Arterial, la Hipertrofia Ventricular Izquierda y el Hábito de fumar con un 52, 44.3 y 35.8% respectivamente fueron los factores de riesgo coronario que predominaron en el Infarto Agudo del Miocardio, mientras que en la Angina de pecho el Tabaquismo con el 62%, seguido por la Hipercolesterolemia con un 48% y la Diabetes Mellitus con un 39.4% fueron los más destacados (84). Lisa I., en sus estudios sobre Epidemiología del Síndrome Coronario Agudo en el Salvador señala que la Hipertrofia Ventricular Izquierda diagnosticada en pacientes hipertensos fue un factor de riesgo destacado en el Infarto Agudo del Miocardio con el 45.8%, mientras que en la Angina de pecho la Hipercolesterolemia y la Diabetes Mellitus predominaron con el 52 y el 38% respectivamente (85).
Tabla 4: Formas clínicas y tratamiento empleado.
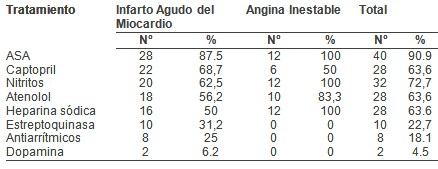
Fuente: encuesta a pacientes
Al relacionar el tratamiento médico empleado en cada forma clínica del Síndrome coronario agudo (tabla 4), partiendo del infarto agudo del miocardio, vemos que los fármacos más utilizados en este orden fueron: los Antiagregantes plaquetarios (ASA) con un 87.5%, IECA (Captopril) con un 68.7%, Nitritos (NTG) con un 62.5%, Beta bloqueadores (Atenolol) con un 56.2% y Anticoagulantes (Heparina) en un 50%, con menores porcientos se presentaron los Trombolíticos (Estreptoquinasa) con un 31.2%, Antiarrítmicos (Lidocaína) con un 25% y las Aminas vasopresoras (Dopamina) solo en un 6.2%. En el análisis de la Angina Inestable la Aspirina, la Nitroglicerina y la Heparina fueron utilizadas en los 12 pacientes atendidos por esta patología, para un 100%, seguido del Atenolol y del Captopril con un 83.3 y un 50% respectivamente).
En un estudio de manejo actual del Síndrome coronario agudo de Rey y Cortina en España (86), se realizó fibrinolisis (FB) al 67% de los infartos agudos de miocardio (IAM) con ST elevado. Los motivos principales de no practicar fibrinolisis (FB) fueron retrasos en el 70% de los casos y ausencia de criterios ECG en el 33%, similar a nuestra investigación donde la causa más frecuente de la suspensión de la trombolisis fue el tiempo de demora desde el comienzo de los síntomas hasta la llegada del paciente al servicio de urgencias mayor de 24 horas (36,15%) y la presencia de infarto agudo sin supradesnivel del ST (32,6%). La utilización de inhibidores glucoproteína (GP) IIb/IIIa en el infarto agudo de miocardio (IAM) no Q y la angina inestable por Ramirez y Vallejo, en estudios realizados en las Palmas, Gran Canaria el pasado año fue del 54 y 48% respectivamente.
Se trataron con beta-bloqueantes más del 50% de los IAM con ST elevado en los que se practicó fibrinolisis (FB) y el 75% de los infartos agudos de miocardio (IAM) no Q tratados con Inhibidores de la glucoproteína (GP) IIb/IIIa. En el caso de la angina inestable predominó el tratamiento con enoxaparina (92,5%), nitroglicerina (76,6%) y bisoprolol (54,2%). Se realizó cateterismo, y procedimientos invasivos en su caso, al 43% de los IAM con ST elevado, y al 55% de los infartos agudos de miocardio (IAM) no Q (87). En estudios efectuados por Manresa y Páez en Barcelona España sobre manejo terapéutico en las primeras horas del síndrome coronario plantean el uso combinado de nitroglicerina y de fraxiheparina en más del 90% de sus pacientes anginosos, en el caso del Infarto agudo con ST elevado, el metoprolol (68%), inhibidores de la glicoproteína IIb-IIIa (57%) y los Trombolíticos (52,0) se emplearon en más de la mitad de los casos, mientras que los antiarrítmicos (amiodarona y propafenona) se utilizaron en un 22% (88).
Tabla 5: Complicaciones y Estado al Egreso.
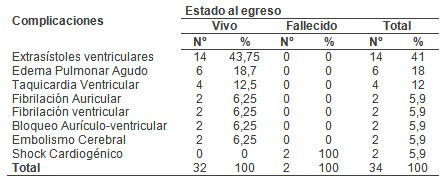
Fuente: encuesta a pacientes
En la tabla 5 se relacionan las complicaciones que presentaron los pacientes con Síndrome coronario agudo y el estado al egreso de los mismos, pudiéndose apreciar que las complicaciones más frecuentes en los pacientes vivos fueron los complejos ventriculares prematuros con un 43.7%, seguido por el edema pulmonar agudo con un 18.7% y la taquicardia ventricular con un 12.5%; la fibrilación ventricular, la fibrilación auricular, el bloqueo auriculoventricular y el embolismo cerebral representaron un 6.5% en cada caso, del total de complicaciones presentadas en los pacientes que sobrevivieron. El shock cardiogénico fue la complicación que se presentó en los fallecidos representando el 100%. En estudios realizados acerca de las complicaciones en el curso del Síndrome Coronario Agudo en el Hospital General Comandante Pinares, en Pinar del Río las complicaciones eléctricas con un 76.6% predominaron sobre las mecánicas con un 17.3%, las isquémicas con un 3.1% y las embólicas con un 1.5%.
Los infartos de cara anterior, así como los de ventrículo derecho fueron las principales causas de shock cardiogénico y muerte (89). En la revista española de cardiología del pasado año, en un artículo publicado por Froufe J., acerca de complicaciones en el Infarto Agudo del Miocardio, demostró que las taquiarritmias ventriculares con el 63.6% fueron las más frecuentes, mientras que las complicaciones embólicas y el shock cardiogénico fueron las más letales con un 92% del total de fallecidos (90). En estudios de mortalidad en los primeros 6 meses en pacientes con Síndrome Coronario Agudo realizados por M.C. Díaz, M. Sánchez, en el Hospital Universitario Insular, Las Palmas de Gran Canaria encontraron que de un total de 151 pacientes con síndrome coronario agudo (SCA), 15 (9,9%) fallecieron y 136 (90,1%) permanecieron vivos tras finalizar el estudio. De los fallecidos 7 (47%) ingresaron por angor inestable (AI), 3 (20%) por infartos agudos de miocardio (IAM) sin onda Q, y 5 (33%) por IAM con onda Q. La causa de muerte fue el shock cardiogénico en 5 casos, 1 falleció durante la realización de cateterismo cardíaco con parada cardíaca en disociación electromecánica (91).
CONCLUSIONES:
1. Los pacientes que más aportaron al estudio fueron los del sexo masculino y las edades comprendidas entre 51 y 70 años de edad.
2. Los principales factores de riesgo coronario que más afectaron a nuestros pacientes fueron la Hipertensión Arterial, la Diabetes Mellitus, la Hipertrofia Ventricular Izquierda y la Hipercolesterolemia.
3. La Hipertensión Arterial, la Hipertrofia Ventricular Izquierda y la Diabetes Mellitus fueron los factores de riesgo coronario que más incidieron en los pacientes con Infarto Agudo del Miocardio, mientras que en la Angina Inestable la Hipertensión Arterial fue la más frecuente.
4. Los Antiagregantes Plaquetarios fueron los medicamentos más utilizados en ambas formas clínicas del Síndrome Coronario Agudo, seguido por los Nitritos y los Anticoagulantes en el caso de la Angina Inestable, y de los IECA y Nitritos en el caso del Infarto Agudo del Miocardio.
5. Predominaron los Complejos Ventriculares Prematuros, el Edema Pulmonar Agudo y la taquicardia ventricular. El Shock Cardiogénico fue la complicación que se presentó en el fallecido.
ANEXOS
Gráfico 1. Complicaciones y estado al egreso.
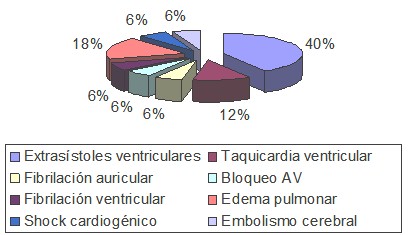
Encuesta:
1. Grupo de edades:
1.1- 30 a 40 años _____
1.2- 41 a 50 años _____
1.3- 51 a 60 años _____
1.4- 61 a 70 años _____
1.5- 71 y más _____
2. Sexo:
2.1- Masculino ____
2.2- Femenino ____
3. Factores de riesgo coronario:
3.1 Hipertensión arterial (HTA) ____
3.2 Tabaquismo ____
3.3 Hipercolesterolemia ____
3.4 Hipertrigliceridemia ____
3.5 Diabetes Mellitus ____
3.6 Obesidad ____
3.7 Hipertrofia de ventrículo izquierdo (HVI) ____
4. Formas clínicas del síndrome coronario agudo (SCA):
4.1 Angina de pecho inestable ____
4.2 Infarto agudo de miocardio (IAM) ____
5. Tratamiento médico empleado:
5.1 Antiagregantes plaquetarios ____
5.2 Nitritos ____
5.3 IECA ____
5.4 Trombolíticos ____
5.5 Betabloqueadores ____
5.6 Anticoagulantes ____
5.7 Antiarrítmicos ____
5.8 Aminas vasopresoras ____
6. Complicaciones:
6.1 Edema pulmonar ____
6.2 Shock cardiogénico ____
6.3 Complejos ventriculares prematuros ____
6.4 Taquicardia supraventricular paroxística ____
6.5 Taquicardia ventricular ____
6.6 Fibrilación ventricular ____
6.7 Bloqueo aurículo-ventricular (AV) de II y III grado ____
6.8 Embolismo cerebral ____
6.8 Fibrilación auricular ____
7. Estado al egreso:
7.1 Vivo ____
7.2 Fallecido ____
REFERENCIAS BIBLIOGRÁFICAS:
1- Rozman Farreras C. Tratado de Medicina Interna. España 2000; Cap 66, 67.
2- Hernández F, Sanz García RM, Sánchez V. Manual de Medicina Interna 12 de Octubre. Cardiología 1998; Cap 2.
3- Roca Goderich R. Temas de Medicina Interna. La Habana. Edit Ciencias Médicas; 2002. 1. p. 392- 418.
4- Cecil. Tratado de Medicina Interna. 20ª Edición. Vol.1. Cap. 31 Editorial Ciencias Medicas. La Habana. 1988. páginas 198-02, 209.
5- Silver SH, Leo PJ, Katapadi M. Serial electro cardiagrams for chest pain in pacients with initial no diagnostic electrocardiograms: implications for thrombolytic therapy. Acad Emerg Med 1996; 3 (2):
6- Colucci WS. Heart Failure: Cardiac Function and Dysfunction. En: Braunwald E, ed. Atlas of heart diseases, vol. 4. Filadelfia, Current Medicine, 1995.
7- Katz AM. Physiology of the heart. Nueva York, Raven Press, 1992.
8- Perloff JK. Physical Examination of the Heart and Circulation. Filadelfia, Saunders, 1990.
9- Schlant R. Chairman of Committee of Electrocardiography of Task force ACC/AHA. Guidelines for electrocardiography. Circulation 1991; 85:1221.
10- Navarro F. Análisis de la función diastólica del ventrículo izquierdo: relajación y distensibilidad. En: Iriarte MM, Sagastagoitia JD, eds. Insuficiencia cardíaca crónica. Barcelona, MCR, 1989; 137-162.
11- Opie LH. Mechanisms of cardiac contraction and relaxation. En: Braunwald E, ed. Heart Disease, 5.ª ed. Filadelfia, Saunders 1997; 360-393.
12- Young JB, Haas GJ, Starling RC. Insufficiencies cardíaca. En: ACCSAP. Adult Clinical Cardiology Self-Assessment Program. American College of Cardiology (ed. esp.). Barcelona, Medical Trends, 1998
13- Selwyn AP, Kinlay S, Creager M, Libby P, Ganz P. Cell dysfunction in atherosclerosis and the ischemic manifestations of coronary artery disease. American Journal of Cardiology, 1997; 79: 17- 23.
14- Fuster V, Ross R, Topol E, editors. Atherosclerosis and coronary artery disease. Filadelfia: Lippincott- Roven, 1996; 1097-1124.
15- Futterman LG, Lemberg L. Endothelium: the key to medical management of coronary artery disease. American Journal of Cardiology, 1997; 6: 159-167.
16- Abrams J. Role of endothelial dysfunction in coronary artery disease. American Journal of Cardiology, 1997; 79: 2- 9.
17- Kuller I, Borbani N, Funberg C, Gardin J. Prevalence of subclinical atherosclerosis and cardiovascular disease and association with risk factors in the Cardiovascular Health Study. Am J Epidemiol, 1994; 139: 1164- 1179
18- Poch E, Jiménez W, Feu F, Coca A, Boteu A, Bosch J, Rivera F, Revert L. Increased plasma endothelin concentration in atherosclerotic renovascular hypertension. Nephron 1995; 71: 291-296.
19- Fuster V, Badimon L, Badimon J, Chesebro J. The pathogenesis of coronary artery disease and acute coronary syndroms. N Engl J Med 1992; 326: 242- 250.
20- Constant J. Bedside Cardiology. 4.ª ed. Boston, Little Brown, 1993.
21- Giuliani ER, Gersh BJ, McGoon MD. Mayo Clinic Practice of Cardiology. 3.ª ed. Filadelfia, Mosby 1996.
22- Uretsky BF, Runge MS. Angina Unstable/ Diagnosis/ Therapy. Cardiology Clinic, 1999, May: 17 (2): XIII- XVII.
23- Masia R, Pera A, Marrugat J, Sola J, Vila J, Paresi M et al and the REGICOR investigators. High prevalence of cardiovascular risk factors in Gerona, Spain, a province with low myocardial infarction incidence. J Epidemiol Commun Health 1998; 52: 707-715.
24- Álvarez Sintes R. Temas de Medicina General Integral. La Habana. Editorial Ciencias Médicas, 2001. Cap 19. p. 536- 556
25- Stamler J, Samler R, Neaton JD. Blood pressure systolic and diastolic, and cardiovascular risk: US population Data. Arch Intern Med 1993; 153: 598-615.
26- Sheped J, Cobre SM, Ford I et al. Prevention of coronary heart disease with prevention men with hypercholesterolemia. New Eng J Med, 1995; 333: 1301.
27- Garber AM, Browner WS. Cholesterol screening guidelines. Consensus, evidence and common sense. Circulation 1997; 95: 1642- 1645
28- Hoffner SM, Miettinen H. Insulin resistance implications for type II Diabetes Mellitus and coronary heart disease. American Journal of Medicine, 1997; 103: 152- 162.
29- Grundy SM. Cholesterol and Obesity in coronary heart disease. The 21st century. Archives of Internal Medicine, 1997; 157: 1177- 1184.
30- Stewart RA, North FM, West TM et al. Depression and cardiovascular morbidity and mortality: cause or consequence.Eur Heart J. 2003 Nov; 24 (22):2027.
31- Médica Panamericana; 1991.p.555...Eagle Kim A, Haber E, De Sacntis R.W, Austin W.G. La práctica de la Cardiología. Normas del Massachussets General Hospital. 2ª ed. Buenos Aires
32- Braunwald E. Heart Disease. 5.ª ed. Filadelfia, Saunders, 1997
33- Grundy SC, Balady G, Criqui M, Fletcher G, Greenland P, Hinatzka L et al. When to start cholesterol- lowening therapy in patients when coronary heart disease. A statement for health care professionals from the American Heart Association Task Force on risk reduction. Circulation 1997; 95: 1683- 1685
34- Cruickshank JM. Clinical importance of coronary perfusion pressure in the hypertensive patient with left ventricular hypertrophy. Cardiology 1992; 81:283-290
35- Zaaks SM, Liebson PR, Calvin JE. Unstable angina and non Q wave myocardial infarction: Does the clinical diagnosis have therapeutic implications? J. Am Coll Cardiol 1999:33.
36- Hernández Padial L. Usefulness of total 12-lead QRS voltage for determining the presence of left ventricular hypertrophy in systemic hypertension. Am J Cardiol 1991; 68:261-262.
37- Galve E, Ordi J, Candell J, Soler Soler J. Enfermedades del tejido conectivo y corazón. Rev Esp Cardiol 1998; 51:232-242.
38- Bayés de Luna A, Cladellas M, Oter R, Torner P, Guindo J, Martí V et al. Interatrial conduction block and retrograde activation of the left atrium and paroxysmal supraventricular tachyarrhythmias. Eur Heart J 1988; 9:1112.
39-. Braunwald E. Heart Disease. A text of cardiovascular medicine. philadelphia: WB Saunders; 1998.
40- Braunwald E. Unstable angina: A classification. Circulation 1999; 80: 410- 414.
41-Canadian Cardiovascular Society. A classification of Unstable angina. Circulation 1998; 40: 325-336.
42-. Kunstman S, Corbalen R, Castro P, Rodríguez JA. Características clínicas y seguimiento de la angina inestable: Factores pronósticos de mortalidad. Rev Chilena Cardiol 2000; 12 (2): 72-77
43-. Kucharoya L, Cagan S. The electrocardiogram in coronary heard disease. Bratils Lek Lesty 1996;97 (7):138-146.
44- Committee on advanced cardiac imaging and technology, Council on clinical cardiology, Committee on newer imaging modalities, Council on radiology, American Heart Association. Potencial value of ultrafast computed tomography to screen for coronary artery disease. Circulation 1993; 87:2071.
45- Orecia A, Bailey K, Yawn BP. Effects of gender on long-term outcome of angina pectoris and myocardial infarction sudden expected death. JAMA 1996; 270: 2392-93.
46- Collins R, Peto R, Baigent C, Sleight P. Aspirin and heparin therapy in Unstable angina. N Engl J Med 1997;336:847-
47- Thompson CA, Danzell JD, Hanley HG. Advances in the pathogenesis and treatment of acute coronary syndromes. J LA State Med Soc 1999;151 (5):272-277.
48- Wallentin L, Ohlsson J, Swahn E, Karlson E, Lundin L, Landgren F, Saetre H. Low molecular weight heparin during instability in coronary arterydisease.Lancet1996;347 (9001):561-568.
49- Concha LS, Castano O. Angioplastia coronaria en la Angina Inestable en el Hospital Universitario de Caldos 1997-2000. Caldas Hospital Universitario; 1996.
50- Salazar WE. Cirugía de Revascularización en la Angina Inestable. Rev Med IMSS 1998;36 (5):345-348.
51- Quigley RL, Khandekar MN, Switzer SS, Salnger MH. Immediate hemodynamic effects of thrombolytic therapy on the ischemic myocardium. Catheter Cardiovasc Diagn 1996;38 (3):325-330.
52- Ocampo S, Solorio S, Rangel A, Madrid F, Romero MA, Carrillo AM. Revascularización coronaria con láser. Arch Inst Cardiol Mex 1999;69:222-227.
53- Coca A, de la Sierra A. Decisiones clínicas, terapéuticas y pronóstico de la Angina Inestable, 2.ª ed. Barcelona, Editorial JIMS S.A. 1998.
54- Turpie AG. Anticoagulants in acute coronaries syndromes. Am J Cardiol 1999;84 (5A):2M-6M.
55- Braunwald E, Antman EM, McCabe CH, Marble SJ, Canon CP. Dose ranging trial of enoxaparin for unstable angina: Results of TIMI IIA. J Am Coll
56- Velasco JA, Cosin J, López Sendon JC. La prevención secundaria del Infarto del Miocardio en España. Estudio PREVESE. Rev Española Cardiol 1997; Vol 50. p. 406-415.
57- Froufe J. Infarto agudo del miocardio, epidemiología. Rev Española de Cardiología 1998; 49:29-38.
58- Rozman C, Farrera Rozman. Medicina interna. España: Ediciones Doyma; 1999.
59- Rivas Estany E Manifestaciones clínicas en el IMA. Rev. Cubana Cardiol. Cir. Cardiovasc 1996; 2 (2): 149-50.
60- Rivas Estany E. Principales alteraciones eléctricas del Infarto del Miocardio. Rev. Cubana Cardiol Cir. Cardiovasc 1988; 2 (2-3): 104-17
61- Velasco Rami JA. Estudios invasivos en el Infarto agudo. Patrocinio de la Soc. Española de Cardiología. 7ma unidad didáctica: 7/98. Valencia. p. 3, 7-14,
62- López-Sendón JL, Bolger AF, Tamargo J, Ferreira I, Cruz Fernández JM. Valor pronóstico del cardiomonitoreo en el Infarto agudo. Barcelona, American Heart Association y Sociedad Española de Cardiología, 1997.
63- Guerra G, Martin H. Trastornos del ritmo en el infarto agudo del miocardio. Lima. Universidad Peruana Cayetano Heredia; 1997.
64- Leor J, Guldbourt O, Reicher K. Cardiogenic shock complicating acute myocardial infarction in patients without heart failure on admission: Incidence, patients. An Cardiol Argeil 2000; 43 (8): 443-51.
65- Iriarte MM, Olea JP, Sagastagoitia D, Murga N, Molinero E, Morillas M et al. Congestive heart failure due to hypertensive ventricular diastolic dysfunction. Am J Cardiol 1995; 76:43D-47D.
66- Fozzard HA, Markielsky JC. The electrophysiology of acute myocardial ischemia.Ann Rev Med 1998; 44: 275-80.
67- Lesperance F, Frasure- Smith, Talajic M, Bourrasa M.G. Five year risk of cardiac mortality in relation to initial severity and one-year changes in depression symptoms after myocardial infarction. Circulation 2002/ 05: 1049-53.
68- Califf RM, Newby LK. How much do we gain by reducing time to reperfusion therapy. Am J Cardiol 1996;78:8-15.
69- Smalling RW. Molecular biology plasminogen activators. Am J Cardiol1996;78 (Suppl12A):2-7
70- GUSTO Investigators. An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction. N Engl J Med 993;329:673-682
71- White HD, Barbash GI, Califf RM, Simes RJ, Granger CV. Age and outcome with contemporary thrombolytic therapy. Results from the GUSTO 1 Trial. Circulation 1996;94 (8):1826-1833.
72- Mark DB, Cowper PA, Berdowitz SD, Davidson RL, Turpie AG, Califf RM, Cohen M. Economic assessment of low molecular heparin versus un-fractionated heparin in acute coronary syndrome patients. Circulation 998;97 (17):1702-1707
73- Factores de riesgo, complicaciones y causas de muerte. Arq Bras Cardiol 2000;63 (2):255-60.
74- González I. Arritmias y trastornos de la conducción en el infarto agudo del miocardio. Monocardio 1997; 32: 66.
75- J. Masip, F. Vecilla, J. Páez, M. Gayà, R. Cañizares y R. Manresa Utilidad de la determinación de oxígeno por pulsioximetría en la fase aguda del Infarto del Miocardio. Unidad de Vigilancia Intensiva. Consorcio Sanitario de la Cruz Roja de Catalunya. Hospital Cruz Roja de Barcelona. Barcelona 2000; 54:55
76- C. Velayos, J.C. Martín, O. Reta, L.M. Prado y J. Ferrero. Angioplastia de rescate. Experiencia de 6 años. Servicio de Medicina Intensiva. Hospital Clínico San Carlos. Madrid 2001; 34: 43
77- J. González, B. Obón, I. Gutiérrez, B. Villanueva y C. López. Fibrinolisis en el Infarto Agudo del Miocardio. Servicio de Medicina Intensiva. Hospital Clínico Universitario. Zaragoza 2004; 22: 26
78- M.A. Taberna, E. Robles, P. Cañizares, S. Rey y J.J. Cortina. Manejo actual del Infarto Agudo del Miocardio. Hospital General de Segovia, Unidad de Cuidados Intensivos 2004; 17:25
79- M. Quintana, J.C. Sevilla*, A. Simón, G. Jiménez** y P. López. La hiperviscosidad sanguínea como predictor de tipo de evento Coronario Agudo. Hospital Ntra Sra. del Prado (Talavera); *Hospital de Figueres; **Hospital del INSALUD (Soria) 2002; 25:29
80- M.C. Díaz, M. Sánchez, A. Vallejo y D. González. Características clínicas y factores de riesgo coronario asociados en 150 pacientes con Síndrome Coronario Agudo. Servicio Medicina Intensiva. Hospital Universitario Insular. Las Palmas de Gran Canaria 2003; 47: 51
81- A. Hernández Cardoso. Infarto Agudo del Miocardio y Autocuidados. Hosp. Prov. Clin. Quir. Gustavo Aldereguía Lima Cienfuegos. Cuba 2004; 17: 21
82- E. Salazar Weil. Experiencia en el tratamiento del Infarto Agudo del Miocardio en una Unidad de Cuidados Intensivos. Hospital General de Zona 1, México. 2004; 22:28
83- M.A. García, M.A. Rosero, R. Gimeno, R. Clemente y M. Ruano. Frecuencia de hipoxemia y factores predictores en el Infarto Agudo del Miocardio. Servicio de Medicina Intensiva. Hosp Universitario La Fe. Valencia 2004; 15:21.
84- C. Diego Nápoles Riano. Cardiopatía Isquémica y sus factores de riesgo. Hospital Militar Clínico Quirúrgico Docente Dr. Joaquín Castillo Duany. Santiago de Cuba. Cuba. 2005; 17: 20.
85- Lisa I. Epidemiología del infarto agudo del miocardio en una ciudad del Salvador: Factores de riesgo, complicaciones y causas de muerte. Arq Bras Cardiol 2000; 63 (2): 255-60.
86- J. Rey, P. Cortina. Manejo actual del Síndrome Coronario Agudo. España 2002; 27: 32.
87- M.C. Díaz, M. Sánchez, A. Ramírez, F. Jiménez y A. Vallejo. Nuevos fármacos en el tratamiento del Síndrome Coronario Agudo. Servicio Medicina Intensiva y Unidad de Hemodinámica Hospital Universitario lnsular, Las Palmas de Gran Canaria 2004; 18:26.
88- J. Masip, F. Vecilla, J. Páez, M. Gayà, R. Cañizares y R. Manresa. Manejo terapéutico en las primeras horas del Síndrome Coronario Agudo. Unidad de Vigilancia Intensiva. Consorcio Sanitario de la Cruz Roja de Catalunya, Hospital Cruz Roja de Barcelona, España 2003; 26:32.
89- S. Fernández, L. Rodríguez, M. Rosendo. Complicaciones en el curso del Infarto Agudo del Miocardio. Hospital Comandante Pinares, Pinar del Río, Cuba 2002; 22:26.
90- Froufe J. Infarto agudo del miocardio complicado. Rev Española de Cardiología 1998; 49:29-38.
91- M.C. Díaz, M. Sánchez, A. Ramírez, F. Jiménez y A. Vallejo. Mortalidad en los primeros 6 meses en pacientes con Síndrome Coronario Agudo. Hospital Universitario Insular, Las Palmas de Gran Canaria, España 2005; 28:39.