El Helicobacter pylori es considerada cancerígeno tipo I por
Alteraciones histológicas gástricas por Helicobacter Pylori en pacientes dispépticos. Hospital Manuel Fajardo. Año 2009.
Dra. Anniuska Gigato Díaz. Especialista de primer grado en gastroenterología. Master en Enfermedades infecciosas
Dr. Rolando Martínez López. Especialista de segundo grado en gastroenterología. Máster en Enfermedades infecciosas
Dra. Lisset Diaz Diaz. Especialista de primer grado en gastroenterología.
Dr. C. Raúl Brizuela Quintanilla. Especialista de segundo grado en gastroenterología.
RESUMEN
El Helicobacter pylori es considerada cancerígeno tipo I por la OMS. Se realizó estudio descriptivo, prospectivo, con el objetivo de determinar las alteraciones histológicas gástricas en pacientes con síntomas dispépticos y Helicobacter pylori. El universo estuvo constituido por 220 pacientes con dispepsia, a quienes se realizó videoendoscopia, de mayo del 2009 a mayo del 2010. La muestra incluyó 127 pacientes entre 18 y 87 años, con promedio de 51 años. La prevalencia de infección por Helicobacter fue del 57,7%. Predominaron las féminas y las edades tempranas.
El síntoma predominante fue la acidez, mientras el diagnóstico endoscópico que mostró mayor asociación a la presencia de la bacteria fue la ulcera duodenal, seguido por la gastritis eritematosa, nodular, erosiva y el cáncer gástrico. La gastritis con metaplasia intestinal fue el diagnóstico histológico de mayor relevancia en relación con la presencia de la bacteria, seguido de la gastritis crónica superficial.
ÍNDICE
I. INTRODUCCIÓN
I.I Antecedentes históricos.
A finales del mes de marzo de 1545 el entonces Gobernador General de la ínsula Don Juanes de Ávila funda, en una construcción de madera y cubierta de guano, lo que sería el primer hospital de la Villa de San Cristóbal de La Habana, según consta en carta enviada por él a sus Majestades Católicas, en una de cuyas partes reza textualmente: “...apostrero de marzo de 1545 anzimismo he hecho el hospital desta villa”.
Según relata el Historiador Emilio Roig de Leuchsenring, estaba situado cerca de la manzana que hoy ocupa el Palacio de los Capitanes Generales y se piensa que sucumbió, quedando destruido durante la toma e incendio de la Ciudad, por el pirata francés Jacques de Sores el 10 de julio de 1555.
El hospital no fue reedificado hasta el 23 de Diciembre de 1596, fecha en que el gobernador de la isla, Juan Maldonado Barnuevo, compró con ese fin dos naves y una capilla situadas en el terreno aledaño al colegio de San Felipe y Santiago, del cual tomaría su nombre.
En los primeros días del mes de agosto de 1602 por Cédula Real, se concedió permiso a religiosos de la orden de San Juan de Dios, para radicarse en Las Indias y a cuatro de ellos en particular en La Habana, con el fin de hacerse cargo del Hospital. Ellos, en honor a su Patrono, le cambiaron el nombre por el de «San Juan de Dios». Es en esa época cuando comienza a prestar asistencia el primer médico de la villa, de quien sólo se conoce su nombre: Julio César.
Posteriormente y por Real Cédula del 24 de febrero de 1769, se hizo entrega del hospital a una administración civil en la persona de Don Tomás Mateo Cervales, retomando de nuevo el nombre de San Felipe y Santiago.
En 1859 se produce un derrumbe parcial de su estructura, por lo que en julio del año 1861 se ordena su traslado hacia los altos de la antigua cárcel de la Habana, en tanto se compraba una parcela del entonces Reparto Medina, donde se encuentra hoy la Heladería «Coppelia», con vistas a la construcción de un nuevo local.
Fue en estas paredes que adquirió su condición de Centro de Enseñanza Universitaria y en él prestaron servicios médicos ilustres como los Dres. Díaz Albertini, Raimundo Menocal y Don Tomás Romay.
Por sus aulas pasaron también hombres ilustres, que dejaron escritas bellas y heroicas páginas de nuestra Historia, como Fermín Valdés Domínguez y fueron sus alumnos los 8 Estudiantes de Medicina que serían fusilados el 27 de noviembre de 1871.
La primera piedra del nuevo Hospital se colocó el viernes 19 de Noviembre de 1880 y se concluyó su construcción, inaugurándose, el 8 de Febrero de 1886 con el nombre de «Reina Mercedes» en honor a la esposa del rey español Alfonso XII, figuras insignes dejaron en él sus huellas y fue su Director un grande de la Medicina Cubana, el Dr. Emiliano Núñez, quién en 1895, guardó prisión por tres años en la Isla de Fernando Poo a causa de sus ideales separatistas.
Al cesar la dominación española, el hospital «Reina Mercedes» cambió nuevamente su nombre, esta vez por el de «Nuestra Señora de las Mercedes» y comenzó a ser dirigido por un Patronato.
Era un centro público, de carácter religioso cuyas plazas se ganaban por oposición y que, junto al Hospital «Calixto García», constituían los únicos Hospitales Universitarios del país en aquel entonces.
En el año 1954 la zona había incrementado notablemente el nivel de polución, por lo que el Patronato que dirigía el hospital decidió vender el terreno y adquirir otro en un entorno más tranquilo, en la Loma del Príncipe, aledaño al Castillo del mismo nombre.
El Proyecto fue del Arquitecto Víctor Morales, en una extensión de 300 metros y 8 plantas. El nuevo inmueble fue inaugurado en el año 1958 manteniendo el nombre de «Nuestra Señora de las Mercedes» y siendo dirigido por el Dr. Luis Ortega Verde.
El 23 de Agosto de 1958 se efectúo una ceremonia de despedida del antiguo edificio, el cual fue catalogado como uno de los mejores y más funcionales de su tiempo por su estructura y distribución, sin obviar el hecho de haber sido el laboratorio donde prestigiosos médicos desarrollaron la práctica de importantes especialidades en el país:
• El Dr. Ángel Aballí desarrolló la Pediatría.
• El Dr. F. Domínguez Roldán introdujo la Radiología,
• El Dr. Raimundo Menocal inició el combate contra las Enfermedades de transmisión sexual (ETS)
• Dr. Nicolás Puente desarrolló la Oncología.
• Los Dres. Sánchez Toledo y Alberto Inclán desarrollaron la Ortopedia.
• La enfermera Miss Mary O`Donnell fundó la 1ra Escuela de Enfermeras de Cuba.
• El Dr. José Iglesias de la Torre fundó el 1er Departamento de Asistencia Social, etc.
Al triunfo de la Revolución el Hospital «Calixto García» y el Hospital «Nuestra Señora de las Mercedes» eran los únicos hospitales Universitarios del país y de sus claustros emergieron las células iníciales de los 14 Hospitales Docentes acreditados por la Junta de Gobierno Revolucionario en 1959, que sesionó en nuestro Anfiteatro. Unidos fungieron como Facultad de Ciencias Médicas #1 hasta 1984, en que se constituyó como un Complejo Hospital-Facultad independiente, con el nombre de «Comandante Manuel Fajardo».
Este nombre honra al hospital desde el 1ero. de Diciembre de 1960, debido al póstumo homenaje de la Junta de Gobierno de Hospitales Universitarios, quien decidió otorgarle dicho nombre en honor a la memoria del Comandante Dr. Manuel Fajardo Rivero, quien compartió las labores de Médico Cirujano y de Jefe Guerrillero durante la Guerra Revolucionaria y que recientemente había caído en combate en la Lucha Contra Bandidos en el Escambray el 29 de noviembre de 1960.
Con el decursar del tiempo y merced al desarrollo alcanzado, varios servicios del Hospital se desagregaron, convirtiéndose el Servicio de Radium en Instituto Nacional de Oncología y Radiobiología. El servicio de Endocrinología se convirtió en Instituto Nacional de Endocrinología y Enfermedades Metabólicas y lo mismo sucedió con el de Cardiología, que pasó a ser Instituto Nacional de Cardiología y Cirugía Cardiovascular.
Por otra parte y gracias a los esfuerzos del Dr. Armando de Córdoba, se creó el primer Hospital de Día Psiquiátrico del país y el Servicio de Dermatología, dirigido por el Dr. Alfredo Abreu se constituyó en Centro de Referencia Nacional.
Analizando pues la trayectoria histórica del Hospital Comandante Manuel Fajardo, podríamos concluir que no solamente fue el primero fundado en CUBA, sino que ha sido pionero en múltiples ramas de la Medicina y precursor de varios Institutos especializados que hoy distinguen al Sistema de Salud Cubano.
Actualmente, el hospital «Comandante Manuel Fajardo», es el hospital base del municipio Plaza de la Revolución y atiende a una población de 171 437 habitantes. Esta se caracteriza por presentar una pirámide poblacional regresiva y elevados índices de envejecimiento poblacional. Tal es así, que la población del municipio es considerada la más envejecida del país. (1)
I. II Antecedentes del tema.
La existencia de bacterias espirilares en el estómago de animales y seres humanos era conocida desde la segunda mitad del siglo pasado; dentro de los reportes principales figuran el de Bizzozero en 1893, seguido de Salomón en 1896. Ambos autores encontraron estos microorganismos en perros, gatos y ratones. Posteriormente, en 1906, Krienitz describió microorganismos semejantes en el jugo gástrico de pacientes con cáncer gástrico. Estos hallazgos fueron vistos con cierto escepticismo, pues las muestras fueron obtenidas post mortem y la contaminación podía haber sido responsable de la presencia de los microorganismos. Mientras tanto, Luger en 1921, llamó la atención sobre la ausencia de microorganismos en individuos saludables (2).
Por varios años continuaron produciéndose, aunque esporádicamente, reportes semejantes hasta que en 1938 Doenges y St. Louis reportaron la identificación de espiroquetas en el 43% de 242 estómagos humanos estudiados (2).
En 1983 los Dres. JB Warren y B Marshall (3,4) descubren un bacilo gram negativo curvo, flagelado, sobre el epitelio gástrico y que pronto lo asocian con la producción de gastritis y enfermedad ulcerosa péptica. Su motilidad, capacidad de producir ureasa (que por liberar amonio le permite neutralizar la acidez gástrica) y su unión a células epiteliales gástricas le permiten sobrevivir en un ambiente muy hostil.
Los hallazgos dejaron perplejos a muchos investigadores, entre otras razones, porque era admitido que las bacterias eran destruidas en el medio ácido del estómago, antes de que pudieran colonizar la mucosa gástrica y establecerse allí (2, 3).
Los investigadores confrontaron dificultades para lograr el crecimiento de estas bacterias “desconocidas”, en realidad redescubiertas en cultivos. En Abril de 1982, ambos autores habían intentado el cultivo de muestras de más de 30 pacientes, en todos los casos sin éxito. En ocasión de Semana Santa y de manera accidental, las placas de cultivo quedaron conservadas durante más de 5 días, en vez de los usuales 2 días. Al quinto día crecieron colonias, las denominaron Campylobacter, ya que tenían cierta semejanza con estas especies, que habían sido encontradas en el tracto gastrointestinal. No transcurrió mucho tiempo antes de que se advirtiera que estos microorganismos no pertenecían, realmente a ese género. De este modo, un nuevo género, Helicobacter, fue creado. Los hallazgos de Warren y Marshall fueron confirmados por gran número de investigadores de muchos países y, finalmente, el microorganismo fue denominado Helicobacter pylori (HP) (4).
El Helicobacter pylori (HP) ha sido uno de los microorganismos patógenos más estudiados de los últimos tiempos (más de 22.000 publicaciones científicas) y constituye el germen que más infecta al ser humano. Hay diferentes cepas que tienen distintas capacidades virulentas dadas por proteínas de adherencia a células epiteliales, así mismo como citotoxina vacuolizante y cag A. (5)
El Helicobacter pylori (HP) es un bacilo gramnegativo, curvado o espiral, de 0,5-1 µm de ancho y 2,5-4 µm de largo, tiene 4 - 6 flagelos unipolares en forma de penacho, es un microorganismo microaerófilo, con una temperatura óptima de crecimiento de 37șC, es oxidasa y catalasa positivo y destaca la producción de ureasa que lo diferencia significativamente del género Campylobacter. Posee una serie de determinantes de patogenicidad que están relacionados con su capacidad de permanecer en la mucosa del estómago, es móvil por la existencia de flagelos, que le permiten deslizarse a través de la mucosa gástrica. Se han descrito diferentes adhesinas que tienen un papel importante en la colonización, esta bacteria, parasita la mucosa gástrica (sobre todo la del antro), medio que le es hostil debido a la gran sensibilidad a los ácidos.
El microorganismo sobrevive en esta localización porque produce ureasa, que desdobla la urea en amonio y bicarbonato. Se neutraliza así el ph ácido y se origina un ambiente en el que el microorganismo puede sobrevivir. La ureasa, por tanto, es fundamental para que el helicobacter pylori colonice la mucosa gástrica, además de ser una importante fuente de nitrógeno para su desarrollo. Algunas cepas de Helicobacter pylori (HP) producen una citotoxina, que induce la vacuolización intracelular de células cultivadas y que podría jugar un papel importante en la patogénesis de la úlcera gástrica o duodenal (6).
La prevalencia de la infección por Helicobacter pylori (HP) varía con el status socioeconómico de la población. Es muy alta en África, Asia y muchas partes de América Central y del Sur, mientras es relativamente baja en el Norte y Oeste de Europa, Norteamérica y Australia. Los países subdesarrollados poseen tasas de prevalencia más altas que los países desarrollados (7). Esta infección se adquiere temprano en la vida; a la edad de 10 años, más del 50% de los niños de todo el mundo están infectados (8,9). El factor de riesgo más importante para la adquisición de esta infección bacteriana parece ser el bajo status socioeconómico de la familia del niño (7). Los factores asociados con una alta prevalencia de la infección incluyen el hacinamiento en la vivienda, compartir las camas y la ausencia de agua corriente en el hogar. (10,11).
La prevalencia de la infección por Helicobacter pylori (HP) en los adultos de cualquier edad en los países occidentales desarrollados oscila entre el 20 y el 40% y alcanza cifras del 60 al 80% en los países del Tercer Mundo (9,11). Estos datos indican, sin lugar a dudas, que la infección por esta bacteria ocupa el primer lugar, por su frecuencia, entre todas las infecciones bacterianas que afectan al género humano (12,13). Hoy en día no se conoce con exactitud cómo el Helicobacter pylori (HP) se transmite de una persona a otra. Es decir, la ruta de la infección continúa siendo un enigma que no se ha esclarecido completamente (14). Mientras la mayoría de las evidencias epidemiológicas indican que la transmisión se produce de persona a persona, la manera en que esto ocurre no ha podido ser precisada (15,16). Las evidencias acumuladas indican que la vía fecal-oral y adicionalmente la gastro-oral pudieran constituir las rutas más frecuentes de transmisión de la infección (14). Como ocurre en el resto del mundo, en Cuba son escasos los estudios realizados sobre prevalencia de la infección por Helicobacter pylori (HP) en población sana. Tampoco se ha profundizado en las alteraciones histológicas que puede producir el microorganismo en la mucosa gástrica.
La primera asociación de daño que se le atribuyó fue la gastritis crónica activa y de hecho todos los pacientes que albergan Helicobacter Pylori tienen este hallazgo. Luego se asoció a úlcera péptica tanto gástrica como duodenal. Su asociación a úlcera gástrica es del orden del 70-75% de los casos y en úlcera duodenal es casi del 100%. Posteriormente se le relacionó con la aparición de linfoma MALT (LM) gástrico y probablemente con adenocarcinoma gástrico. (5)
La gastritis es muy común, de tal forma que muchos investigadores piensan que es parte del proceso normal del envejecimiento. (17)
Sin embargo otros investigadores señalan que la gastritis puede representar la historia natural de la infección por Helicobacter Pylori. (18) Además los postulados de Koch para un organismo infectante han sido completados en el caso de gastritis por Helicobacter pylori. Por otro lado, a pesar de la alta prevalencia de gastritis asociada a Helicobacter pylori (HP) hasta el momento nunca se ha podido demostrar que la gastritis produzca sintomatología. No es extraño que la prevalencia de gastritis, gastritis activa asociada a Helicobacter Pylori e infección por esta bacteria sea alta.
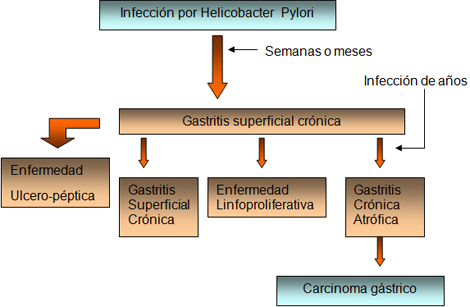
El Helicobacter pylori (HP) produce una gastritis crónica tipo B -antral, multifocal que puede, con el concurso de otros factores genéticos o ambientales sobre todo, evolucionar a Cáncer Gástrico (CG) pasando por una serie de alteraciones histológicas intermedias, sucesivas y progresivas, de importancia creciente por lo tanto. (19,20) El 40% aproximadamente de las gastritis crónicas superficiales se convierten en atróficas con el paso del tiempo. En la historia natural de la carcinogénesis gástrica se establece la siguiente evolución: Gastritis crónica superficial => Gastritis crónica atrófica (GCA) => Metaplasia Intestinal (MI) => Displasia (bajo grado y de alto grado) => Cáncer Gástrico. (20)
Algunos pacientes consultan por síntomas digestivos altos (acidez, pirosis, ardor, epigastralgia, meteorismo, flatulencia) siendo sometidos a estudios endoscópicos no encontrándose lesiones pero sí la presencia de Helicobacter Pylori; son catalogados como dispepsia no ulcerosa. Hay numerosos estudios bastante contradictorios al comparar resultados entre los tratados y no tratados. (21) Algunos meta análisis demuestran leve beneficio clínico de 4-15% en los erradicados versus los controles. (22) La recomendación actual es no tratarlos salvo a aquellos pacientes que realizaron un tratamiento de prueba con inhibidores de la bomba de protones (IBP) y no experimentaron mejoría. (23)
No ha podido ser demostrado sobre bases científicas, el papel etiológico del Helicobacter pylori en los pacientes con dispepsia funcional o no ulcerosa, ni el alivio de los síntomas dispépticos después de erradicar la infección. (6)
La infección por Helicobacter pylori (HP) está presente en el 75-95% de los casos de úlcera duodenal y en el 60-80% de los casos de úlcera gástrica. La bacteria, se encuentra en 60% de las personas que tienen carcinomas gástricos. El linfoma gástrico MALT (mucosa-associated lymphoid tissue) es una proliferación de células B de crecimiento lento y evolución indolente, que permanece localizado por años y que se asocia a infección por Helicobacter pylori (HP) en más del 85% de los casos. Hoy se sabe que prácticamente todas las personas infectadas por el Helicobacter pylori (HP) desarrollan una gastritis crónica superficial (24).
Se dispone de estudios epidemiológicos que muestran que los pacientes con enfermedad esofágica por reflujo tienen similares tasas de incidencia de infección por Helicobacter pylori (HP) que los controles, incluso, hay reportes que señala (25). En otros se afirma categóricamente que la erradicación de la infección por Helicobacter Pylori no exacerba los síntomas derivados del reflujo en la enfermedad esofágica por reflujo (26).
I. III Justificación del estudio.
Helicobacter Pylori ha sido reconocido como importante patógeno del tracto digestivo superior. Se le considera causante de la gastritis crónica tipo B, así como un factor decisivo en el desarrollo de la úlcera péptica, sobre todo la duodenal, y en el linfoma gástrico de células B, que surge del tejido linfático asociado a la mucosa (Linfoma MALT). Se le reconoce así mismo su papel de cofactor, dentro de una etiología multifactorial, en el desarrollo del adenocarcinoma gástrico (ADC) de tipo intestinal. En efecto, el Helicobacter pylori (HP) ha sido clasificado por la OMS como factor carcinogénico probado - tipo I -. Esta relación con la neoplasia gástrica también es aceptada por parte del Instituto Nacional del Cáncer de EE.UU., considerándose así mismo a Helicobacter pylori (HP) asociado al desarrollo del cáncer gástrico (CG), si bien se precisan más estudios para confirmar definitivamente esta relación así como su posible mecanismo patogénico (18,19).
También existen datos que permiten sospechar la implicación de Helicobacter pylori (HP) en la patogenia de los linfomas gástricos B tipo MALT. Existen dos subtipos principales de Helicobacter pylori (HP). El tipo I posee el gen Cag A ("cytotoxin associated gene") expresando la proteína Cag A, así como la citotoxina vacuolizante (Vac A). El tipo II no las expresa al no poseer gen codificante. La expresión de la proteína Cag A constituye probablemente un factor de virulencia del germen; su producción se asocia con cepas ulcerogénicas y se correlaciona su expresión con la severidad de la inflamación mucosa. En el cáncer gástrico (CG) también es más frecuente la infección por microorganismos Cag A + Vac A +. (27)
Asociadas al desarrollo de MALTomas, se han encontrado aberraciones genéticas, en los genes supresores de tumores tipo adenocarcinoma gástrico (ADC). Se ha especulado que la respuesta inflamatoria a la infección sea probablemente la causante del daño del DNA.
Teniendo en cuenta que la evolución natural de la enfermedad avanza hacia lesiones pre malignas y el desarrollo de adenocarcinoma gástrico, nos hemos motivado a realizar esta investigación, que nos ayude a conocer el estado actual de estas alteraciones en la mucosa gástrica producidas por Helicobacter pylori en nuestro medio, para de esta forma realizar el diagnóstico precoz de lesiones con potencial maligno y la toma de decisiones oportunas, con relación a buscar soluciones definitivas a este problema de salud.
En Cuba no se ha estudiado suficientemente la prevalencia de la infección por Helicobacter pylori. Tampoco se ha profundizado lo suficiente en las alteraciones histológicas que es capaz de producir en la mucosa gástrica.
Recientemente se concluyó en nuestro servicio, un estudio relacionado con la ¨identificación de la infección por Helicobacter pylori en enfermedad ácido péptica¨, trabajo que constituyó la tesis de uno de los integrantes del equipo médico, para optar por el grado de máster en Enfermedades infecciosas, encontrándose que dos tercios de los pacientes a los que se le realizaron endoscopias estaban infectados por Helicobacter pylori (HP), relacionándose con la gastritis crónica y la úlcera péptica fundamentalmente, cifras alarmantes y que se corresponden con el aspecto epidemiológico conocido, que refleja la prevalencia de esta bacteria asociada a las enfermedades gastroduodenales más frecuentes.
Por todo lo anterior, y teniendo como base el estudio anteriormente referido, nos propusimos investigar en nuestros pacientes con síntomas dispépticos, las alteraciones a nivel del tejido, con vistas a desencadenar estrategias que modifiquen el curso natural de la infección, evitando la evolución hacia formas más complicadas o detectar precozmente cambios histológicos que sugieran una vigilancia estrecha o una conducta enérgica definitiva.
I. IV Problema científico.
¿Cuáles serán las alteraciones histológicas encontradas en pacientes con dispepsias y helicobacter pylori atendidos en el centro, conociendo que esta bacteria es considerada cancerígeno tipo I por la OMS?
I. V Resultados esperados.
Con este estudio podremos evaluar los cambios histológicos que ocurren en los pacientes aquejados con dispepsia, correlacionarlo con el cuadro clínico y hallazgos endoscópicos para prevenir a tiempo lesiones de tipo malignas gástricas.
II. OBJETIVOS
General
Determinar las alteraciones histológicas de la mucosa gástrica en pacientes con síntomas dispépticos y presencia de Helicobacter pylori.
Específicos
1. Determinar la prevalencia de la infección por Helicobacter pylori según edad y sexo, en los pacientes estudiados.
2. Identificar los síntomas dispépticos presentes en los pacientes con la bacteria.
3. Identificar los diagnósticos endoscópicos e histológicos encontrados en los pacientes estudiados según la presencia de Helicobacter pylori.
III. MARCO TEÓRICO.
La infección por Helicobacter pylori, es la enfermedad bacteriana crónica más prevalente en el ser humano con la excepción de las caries dentales. La relación de este microorganismo con la gastritis crónica y la úlcera péptica fue establecida por Warren y Marshall en 1983 (3,4) al aislar de la mucosa gástrica de pacientes una bacteria curvada, muy similar a las Campylobacterias, hoy en día conocida como Helicobacter pylori.
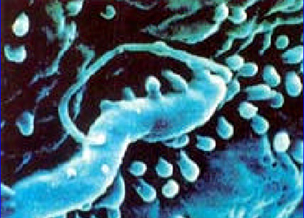
Los determinantes de patogenicidad juegan un papel importante en la infección por Helicobacter pylori. A diferencia de los factores de virulencia que son los atributos que tiene la bacteria para causar el daño a su huésped, los mecanismos de patogenia consisten en la forma en que se produce la lesión, de las células de la mucosa gástrica, así como la respuesta inflamatoria del huésped.
La ureasa es la enzima más representativa del Helicobacter pylori y tiene una función central en la supervivencia de la bacteria, pero también es responsable de un efecto patogénico, con el consiguiente daño de la mucosa gástrica. (28,29)
Esta enzima se localiza en el citoplasma y su producción es controlada por pH externo. La ureasa produce el ión amonio, que induce la apoptosis de las células gástrica, lo que conduce a una disminución de las funciones defensivas del epitelio además de influir en el proceso de reparación de la mucosa. Otro de los mecanismos a través de los cuales la ureasa puede producir daño, es por estimulación de los fagocitos mononucleares para que produzcan citocinas inflamatorias. (28)
Dentro de los factores de patogenicidad uno de extraordinaria relevancia es la citotoxina vacuolizante VacA, producida por aproximadamente el 65% de las cepas de Helicobacter pylori. (30) Su efecto mejor estudiado consiste en la formación de vacuolas en el citoplasma de las células, tanto in vitro como in vivo. Este efecto ejerce su acción sobre tres adenosinas trifosfatasas (ATPasas), localizadas en la membrana celular: La H+ ATPasa, el Na+K+ ATPasa y la H+K+ ATPasa. La penetración de la citotoxina en la célula eucariota parece ser un proceso lento, que tiene lugar directamente a través de la membrana citoplasmática. En el interior de la esta célula la toxina encuentra su blanco final: una ATPasa tipo V, que está presente en la formación de vesículas por la invaginación de la membrana. Estas vesículas continúan un proceso de maduración que ocurre en el aparto de Golgi y compartimentos endosomales. La toxina se une a estos compartimentos y no les permite formar complejos citoplasmáticos, por lo que las vesículas se fusionan unas con otras.
La actividad de la bomba de protones, presente en las membranas de las vesículas fusionadas, hace que se acumulen iones hidrógeno y disminuya el pH en el interior de las mismas, lo que promueve la difusión pasiva de sustancias básicas al interior de las vacuolas. Estas sustancias son protonadas y no pueden volver a salir de las vacuolas y atraen agua por ósmosis, lo que provoca el estallido de las vacuolas que las contienen. (31)
La VacA puede inducir múltiples efectos en las células, tanto in vivo como in vitro, entre ellos se pueden citar: el aumento del daño celular a través de sus numerosas acciones, entre las que se encuentra la formación de vacuolas en el citoplasma; el incremento de la secreción extracelular de hidrolasas ácidas; la reducción del potencial de degradación de los endosomas y lisosomas; así como daños en el cito esqueleto celular lo que juega un rol en la apoptosis a través del daño que produce en las mitocondrias; también, es capaz de interferir con los mecanismos de reconocimiento antigénico ya que en particular deprime la estimulación de las células T, CD4+. (27)
Otro factor estudiado es la proteína CagA que está codificada por el gen cagA cuya función se desconoce, aunque se sabe que tiene un poder inmunogénico fuerte y es considerada como un antígeno inmunodominante. Varios autores plantean que esta proteína participa en la configuración de la variedad antigénica de la bacteria, lo que le permite evadir la respuesta inmune del huésped, además de ser capaz de estimular la secreción de interleucina 8 (IL-8) y generar una respuesta humoral específica. La presencia del gen cagA, y por lo tanto, la producción de CagA se observa en el 100% de las cepas aisladas en individuos con cáncer gástrico, según algunos autores. (27)
En Cuba Gutiérrez B, Vidal T, Valmaña C y cols. (8) realizaron un estudio en tres centros hospitalarios de la Ciudad de la Habana. Este trabajo estudió la prevalencia de la infección por Helicobacter pylori en 117 pacientes dispépticos
y encontró el Helicobacter pylori en 83 (70,9%) pacientes. Además, se realizó la determinación de cagA a 35 biopsias, y se encontró que fue positiva la presencia de cagA en 31 (88,5%) pacientes.
El mundo se encuentra dividido en países desarrollados, muy ricos, y países subdesarrollados, muy pobres. La epidemiología del Helicobacter pylori (HP) se asemeja a la de muchas enfermedades infecciosas, y de por sí, hace más patentes los efectos nocivos de la ignorancia, la miseria, y las desigualdades flagrantes de nuestro mundo frente a la salud, la información y la educación. (32)
Estudios de prevalencia de la infección en poblaciones presumiblemente sanas muestran amplísimas variaciones entre las diferentes comunidades. En el Grupo I (países subdesarrollados) se aprecia el siguiente comportamiento: la prevalencia reportada en Nigeria fue 85%, en Argelia 79% y Costa de Marfil 73%. En el Grupo II (países desarrollados) las prevalencias encontradas son las siguientes: Estados Unidos 52%, Inglaterra 56,9%, Japón 50% y Francia 25%. (33,34) Estos datos indican, sin lugar a dudas, que la infección por esta bacteria ocupa uno de los primeros lugares, por su frecuencia, entre todas las infecciones bacterianas que afectan al género humano.
La prevalencia de la infección por esta bacteria, varía con el status socioeconómico de la población. Es muy alta en África, Asia y en muchas partes de América Central y del Sur, mientras es relativamente baja en el norte y oeste de Europa, Norteamérica y Australia. Los países subdesarrollados poseen tasas de prevalencia más altas que los países desarrollados. Los factores asociados con una alta prevalencia de la infección incluyen el hacinamiento en la vivienda, compartir las camas y la ausencia de agua corriente en el hogar. (35)
En los Estados Unidos y Europa Occidental los niños son infectados con escasa frecuencia. En contraste, el 60 a 70% de los niños de los países subdesarrollados muestran seropositividad a la bacteria a la edad de 10 años. La prevalencia de la infección por H. pylori en los adultos de cualquier edad en los países occidentales desarrollados, oscila entre el 20 y el 40% mientras que alcanza cifras del 60 al 80%, en los países del Tercer Mundo. Existen dos fases diferentes de adquisición de la infección: una rápida y variable según el status socioeconómico en la infancia y otra lenta durante la vida adulta. Estos datos indican, sin lugar a dudas, que la infección por esta bacteria ocupa el primer lugar, por su frecuencia, entre todas las infecciones bacterianas que afectan al género humano. (36)
En los últimos años se han descrito una amplia variedad de trastornos extra digestivos relacionados con la infección por Helicobacter pylori (HP) entre ellos figuran enfermedades de la piel, trastornos cardiovasculares, cerebro vasculares, enfermedades reumáticas, respiratorias, neurológicas, hematológicas, autoinmunes, Diabetes Mellitus (37), enfermedades pediátricas como el síndrome de muerte súbita infantil y retardo en el crecimiento, el linfoma tipo MALT extra gástrico e inclusive el cáncer colorrectal (38). También, se ha llamado la atención acerca de enfermedades de los órganos anexos al tubo digestivo, como son las enfermedades hepáticas y de vías biliares, que pudieran estar relacionadas con la infección por esta bacteria (38).
Al Helicobacter pylori (HP) se le ha intentado involucrar con una serie de enfermedades extra digestivas (rosácea, urticaria crónica idiopática, halitosis, cardiopatía isquémica, alopecia areata, diabetes mellitus, tiroiditis autoinmune, síndrome de Sjögren, síndrome de Raynaud, migraña, púrpura de Schönlein-Henoch, colelitiasis, encefalopatía hepática, etc.) pero no se ha demostrado mejoría en ninguna de ellas tras la erradicación de Helicobacter pylori (HP). Sí, ha habido numerosos reportes de mejoría evidente en púrpura trombocitopénica idiopática tras la erradicación de Helicobacter pylori (HP). La alta prevalencia de Helicobacter pylori (HP) en el mundo lo hace susceptible de ser relacionado a múltiples afecciones (38).
La relación entre la infección por Helicobacter pylori y la dispepsia es un problema que dista mucho de ser sencillo, Se ha sugerido que una explicación de los síntomas en los pacientes con dispepsia funcional e infección por Helicobacter pylori pudiera residir en la liberación de sustancias inflamatorias asociadas con la infección, lo que traería por consecuencia, una afectación de la función motora proximal del estómago; pero esto es objeto, también, de controversia. (39)
En estudio realizado en pacientes alcohólicos, en el Instituto Cubano de Gastroenterología (40), se encontró que en los pacientes alcohólicos dependientes la gastritis crónica se asociaba a la infección por Helicobacter pylori y no al consumo de alcohol per se; además puso de manifiesto que los síntomas dispépticos eran más frecuentemente encontrados en los pacientes infectados por Helicobacter pylori que en los no infectados, pero esto es una evidencia muy débil con respecto al establecimiento de una relación causal entre el microorganismo y los síntomas dispépticos.
Hay autores que no dudan en utilizar tratamiento de erradicación en la dispepsia no ulcerosa con Helicobacter pylori positivo. Las bases teóricas que justifican esta conducta incluyen los siguientes aspectos: los beneficios que se derivan de la erradicación incluyen la resolución de los síntomas, probablemente más efectiva que cuando se utiliza placebo; la reducción del riesgo de úlcera gastroduodenal y cáncer gástrico y la posibilidad de soslayar los efectos adversos que se han relacionado con la utilización a largo plazo de drogas inhibidoras de la bomba de protones. (39) Además, se ha señalado que cerca del 30% de los pacientes con Helicobacter pylori y dispepsia no ulcerosa pueden obtener alivio sintomático después de la erradicación de la infección.
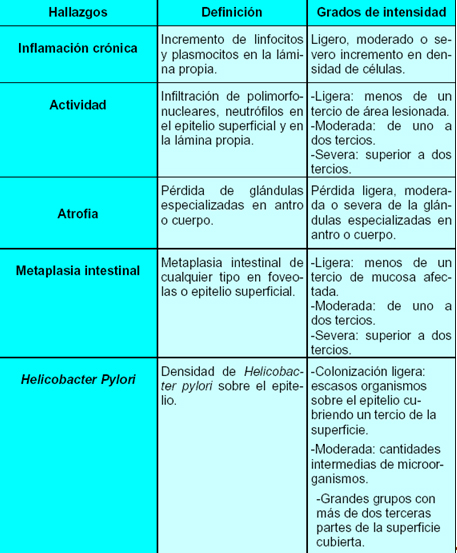
La mucosa gástrica tiene un alto poder de respuesta inflamatoria, a diferentes agentes lesivos, que pueden desencadenar una respuesta aguda, crónica o la combinación de ambas. Con relación a la gastritis crónica se plantea que su diagnóstico definitivo es mediante el estudio histopatológico. Existen desde 1970 varias clasificaciones y la más aceptada en la actualidad es la acordada por un grupo de gastroenterólogos y patólogos, principalmente europeos, en la ciudad de Sydney en Australia en 1990, en la cual se identifica como un aspecto importante la presencia o no en la mucosa gástrica del Helicobacter pylori. (41)
Aunque la clasificación de Sídney con sus cinco hallazgos o alteraciones histológicas, permite un diagnóstico organizado de la gastritis crónica, para mejor comprensión de los médicos que indican las biopsias, el diagnóstico histológico se realiza teniendo en cuenta la ubicación y extensión del infiltrado inflamatorio y el grado de pérdida de glándulas.
Definiciones y grados de intensidad de los hallazgos histológicos
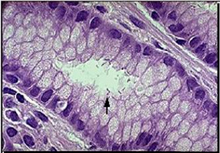
Gastritis crónica superficial
El infiltrado inflamatorio crónico está compuesto fundamentalmente por linfocitos y plasmocitos. Este infiltrado se sitúa en forma de banda en la porción más superficial de la mucosa y ocupa la lámina propia a nivel de las foveolas y los cuellos glandulares. La magnitud del infiltrado varía en intensidad para dejar indemne la capa glandular.
Gastritis crónica superficial. Imagen histológica con moderado infiltrado crónico de la mucosa antral,
(H-E x 100)
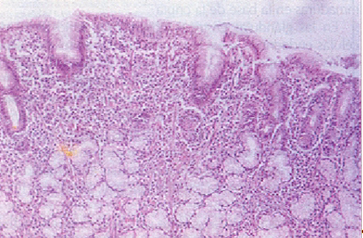
Gastritis crónica atrófica
La gastritis crónica atrófica se define histológicamente como la pérdida de glándulas o atrofia que puede variar en la cantidad de glándulas desaparecidas.
Se observa separación de unas y otras glándulas, con acúmulo de reticulina entre ellas, demostrada por coloraciones específicas. El infiltrado inflamatorio crónico a partir de linfocitos y plasmocitos que ocupan en profundidad los 2/3 partes o todo el grosor de la mucosa, en cantidad entre moderada y severa y ocupa los espacios interglandulares de la lámina propia donde estaban las glándulas que han desaparecido. En estos pacientes a pesar de clasificarse la gastritis como atrófica, la mayoría de las veces predomina el infiltrado inflamatorio sobre la pérdida de las glándulas.
La metaplasia intestinal aparece en un porcentaje alto de las biopsias y es más evidente al alcanzar mayor grado la atrofia de la mucosa. La metaplasia intestinal puede ser de tipo completo e incompleto; otro hallazgo histológico importante es la presencia de acúmulos linfoides que, en ocasiones, forman verdaderos folículos linfoides con centros germinales centrales .
Estas lesiones son más frecuentes en la mucosa antral (39), donde el número de bacterias observadas en los cortes histológicos es mayor, y su distribución es en parches donde existen áreas con gran cantidad de bacterias y otras con escasa o ninguna cantidad de microorganismos. Las bacterias no se observan en áreas de metaplasia intestinal. Para la tinción suele utilizarse la coloración de hematoxilina-eosina, aunque se han utilizado numerosas técnicas histológicas para la demostración de los microorganismos.
Gastritis crónica atrófica. Imagen histológica con marcado infiltrado crónico con moderada atrofia y glándulas con metaplasia intestinal. (H-E x 100)
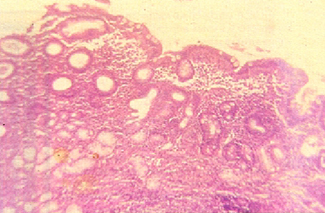
Gastritis crónica por Helicobacter pylori
La colonización por Helicobacter pylori en la mucosa gástrica es causa de más del 85% de los casos de esta enfermedad en el ser humano, se ha relacionado con la úlcera gastroduodenal, el adenocarcinoma y el linfoma gástrico de células B. Actualmente su papel en la dispepsia es objeto de controversias. (42)
La característica histológica fundamental de este tipo de gastritis es la presencia de polimorfonucleares neutrófilos, además de linfocitos y plasmocitos en la lámina propia, que constituyen un infiltrado mixto que varía en severidad desde leve con preservación de la arquitectura, hasta un infiltrado inflamatorio denso con diferentes grados de atrofia glandular. La presencia de los polimorfonucleares neutrófilos intraepiteliales en los orificios de salida de las glándulas y en ocasiones formando micro-abscesos, posibilitan el diagnóstico histológico de este tipo de gastritis crónica. Otra característica histológica que se observa con frecuencia es la presencia de folículos hiperplásicos. (43,44)
La presencia de agregados linfoides o folículos hiperplásicos, se encuentran tanto en la mucosa del cuerpo, como la del antro, siendo más frecuente esta última localización y su presencia es con mucho más frecuente en la gastritis crónica por Helicobacter que en otros tipos de gastritis crónica y se relaciona con la respuesta del sistema inmune de la mucosa y el posible origen de los maltomas de la mucosa gástrica. (45, 46)
Estas lesiones son más frecuentes en la mucosa antral donde el número de bacterias observadas en los cortes histológicos es mayor, y su distribución es en parches donde existen áreas con gran cantidad de bacterias y otras con escasa o ninguna cantidad de microorganismos. Las bacterias no se observan en áreas de metaplasia intestinal. Para la tinción suele utilizarse la coloración de hematoxilina-eosina, aunque se han utilizado numerosas técnicas histológicas para la demostración de los microorganismos. (47)
Gastritis crónica por Helicobacter pylori. Imagen histológica con pequeño micro-absceso en la lámina propia con probables Helicobacter pylori en dos glándulas (H-E x 200)
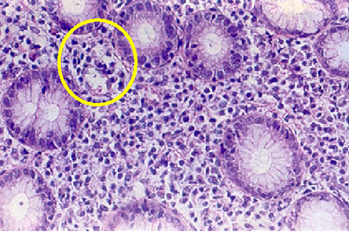
La cantidad de bacterias que se observan en los cortes histológicos, se relaciona, generalmente, con el mayor grado de lesión celular e infiltrado inflamatorio crónico. La mayoría de las alteraciones histológicas desaparecen o disminuyen cuando el microorganismo es erradicado como resultado del tratamiento o cuando los mismos adoptan formas cocoides.
Varios reportes de la década del 80 del pasado siglo, (48, 49, 50,51) reportaban en sujetos normales y en pacientes con dispepsia no ulcerosa, la presencia de Helicobacter pylori en la mucosa fúndica y de cuerpo normal. Llegándose a plantear que la bacteria vivía como un comensal en el fundus. Sin embargo, tanto en sujetos normales como en la dispepsia no ulcerosa se reporta la presencia del Helicobacter pylori en el antro acompañado de gastritis crónica superficial activa.
Imagen histológica con presencia de Helicobacter pylori en la mucosa gástrica. Coloración de Warthin-Starry (W-S x 1000)
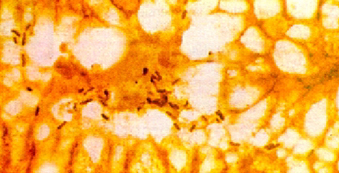
Hoy se acepta que prácticamente todas las personas infectadas por el Helicobacter pylori desarrollan una gastritis crónica superficial y si no se lleva a cabo un tratamiento que permita la erradicación de la infección, ésta se prolonga durante décadas, y en muchos casos durante toda la vida. (54)
En un estudio realizado en el Instituto de Gastroenterología, (55) de 520 biopsias de gastritis crónica antral se demostró la presencia de la bacteria en el 77% de los casos, siendo la frecuencia de la infección en los casos de úlcera duodenal del 95%, en la úlcera gástrica del 55% y en la gastritis crónica antral sin úlcera del 78%. Otro reporte de la misma institución (56) muestra 280 pacientes con infección por Helicobacter pylori, 180 de ellos con gastritis antral y úlcera duodenal y 100 con gastritis sin úlcera, se observó la presencia de folículos linfoides en el 37% y la actividad inflamatoria aguda en el 59% de los casos, siendo similar la presencia de folículos linfoides y el grado de colonización de las bacterias en ulcerosos y no ulcerosos. La gastritis crónica severa y la actividad inflamatoria aguda, fue mayor en la gastritis crónica antral con úlcera duodenal.
Los pacientes con gastritis crónica en los que el Helicobacter pylori no puede detectarse, es probable que hayan presentado con antelación una gastritis crónica asociada a la bacteria y se han librado de ella cuando se desarrolla una gastritis crónica atrófica el daño hístico es intenso y el medio ecológico propicio para la colonización bacteriana desaparece, al disminuir marcadamente la producción de ácido, etapa en la que suelen aparecer zonas de metaplasia intestinal en donde la bacteria carece de condiciones para subsistir tienen una gastritis autoinmune o una de las formas especiales de gastritis. (57)
La primera asociación de daño que se le atribuyó fue la gastritis crónica activa y de hecho todos los pacientes que albergan Helicobacter pylori (HP) tienen este hallazgo. Luego se asoció a úlcera péptica tanto gástrica como duodenal. Su asociación a úlcera gástrica es del orden del 70-75% de los casos y en úlcera duodenal es casi del 100%. Posteriormente se le relacionó con la aparición de linfoma MALT (LM) gástrico y probablemente con adenocarcinoma gástrico (58).
Histología y estadios de la gastritis por Helicobacter pylori

Se ha señalado que los individuos que portan el Helicobacter pylori se encuentran en mayor riesgo de desarrollar una enfermedad ulcerosa péptica y un adenocarcinoma gástrico no cardial, que aquellos que no portan el microorganismo, aunque el estado del portador es una condición que, a la luz de los conocimientos actuales, no es considerada necesaria ni tampoco suficiente para explicar cualquiera de estas dos enfermedades. Desde que se ha reconocido que la eliminación de la infección por Helicobacter pylori, con frecuencia, cambia la historia natural de la enfermedad ulcerosa péptica, los médicos se han venido preocupando, crecientemente, por su erradicación (59).
La asociación entre la ulcera duodenal (UD) y Helicobacter pylori, ha sido repetidamente confirmada en estudios provenientes de todo el mundo, aunque no está claro cómo se produce una úlcera duodenal (UD), si el Helicobacter pylori (HP) se localiza preferentemente en el antro gástrico. Se han postulado mecanismos gástricos, especialmente la demostrada hipergastrinemia e hiperpepsinogenemia tipo I inducida por Helicobacter pylori (HP), (60) que favorecerían la hipersecreción de ácido y la aparición de úlcera duodenal (UD). Sin embargo, el real efecto de Helicobacter pylori (HP) sobre la secreción de ácido gástrico es discutido. Mayor importancia parece tener los efectos sobre el duodeno. El 90% de los pacientes con úlcera duodenal (UD) tienen áreas de metaplasia gástrica en el bulbo duodenal, lo que probablemente corresponde a una respuesta inespecífica al daño, favorecida por hipersecreción de ácido. En el 50% de los pacientes con úlcera duodenal (UD), estas áreas de metaplasia están colonizadas por Helicobacter pylori (HP). (57) Una vez colonizado el duodeno, el Helicobacter pylori (HP) podría inducir úlcera mediante la inflamación o la liberación de toxinas.
El Helicobacter pylori solo se encuentra en aproximadamente el 80% de los pacientes con úlcera gástrica. Dos causas fundamentales explican este fenómeno, la primera radica en la importancia del papel etiológico desempeñado por las drogas antiinflamatorias no esteroideas en las úlceras gástricas y la segunda es que la mayoría de las úlceras gástricas asientan en una mucosa previamente afectada por una gastritis crónica, (61,62) que tiende a ser una pangastritis y que afecta el cuerpo gástrico, tanto como el antro.
Eventos fisiopatológicos que vinculan la infección por Helicobacter pylori con la úlcera duodenal
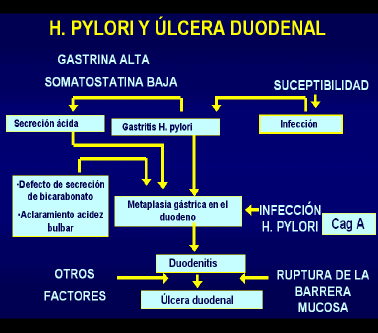
La atrofia gástrica y la metaplasia intestinal, son eventos que se desarrollan en estos pacientes como resultado de la persistencia de la infección bacteriana y se acentúan y extienden cada vez más. La gastritis atrófica y la metaplasia intestinal son un medio hostil para la colonización y la supervivencia de la bacteria.
La infección por Helicobacter pylori lleva a la gastritis crónica, que a menudo persiste de por vida, a menos que sea tratada con drogas antimicrobianas. Desde hace tiempo se ha reconocido que en la mayoría de los casos el carcinoma gástrico es el resultado final de un proceso pre-neoplásico prolongado, que atraviesa múltiples etapas y que es multifactorial, en el que las alteraciones celulares están correlacionadas con el microambiente gástrico anormal.
En el estómago normal no se encuentra tejido linfoide asociado a mucosa. La infección de larga duración por Helicobacter Pylori, sin embargo, produce un infiltrado linfocítico y la formación de folículos linfoides. La erradicación conduce a la regresión de estos cambios. Esto ha traído como consecuencia que se interrelacione la infección por Helicobacter pylori con la aparición de tejido MALT y su posterior transición a linfoma de células B de bajo y alto grado. (24, 63)
Lesión linfoepitelial típica, Hematoxilina y Eosina. 400X.
El diagnóstico histológico suele representar el diagnóstico definitivo de la mayor parte de patologías gástricas y de esta manera determina el tratamiento más efectivo. Con el uso de técnicas sencillas y de bajo costo podremos determinar en las biopsias gástricas, la tasa de infección por Helicobacter pylori (HP), grado inflamatorio de la mucosa, lesiones premalignas, ulceraciones y patología maligna (64). Además existen estudios que señalan la importancia de la toma de biopsias en las endoscopías, debido a la falta de correlación entre el diagnóstico endoscópico e histológico de la gastritis crónica y la normalidad de la mucosa. (65)
Histológicamente, en la mucosa gástrica normal, únicamente se observan de forma aislada, escasas células linfoides, por lo que cualquier incremento de ellas de forma organizada es indicativo de gastritis crónica. En la infección por Helicobacter pylori (HP) el infiltrado celular contiene efectores de la respuesta inmune que incluyen CD4+, CD8+, linfocitos T, linfocitos B, células plasmáticas, monocitos, células cebadas y eosinófilos. La infección aguda por Helicobacter pylori (HP) se caracterizada por cambios degenerativos marcados en la superficie epitelial, infiltración de leucocitos polimorfonucleares en las fositas gástricas y en el epitelio superficial e incluso absceso en las glándulas, el cuerpo y el antro se afectan de manera similar (64,65).
El conocimiento de la carcinogénesis gástrica, especialmente en relación con la infección por Helicobacter pylori, se ha incrementado grandemente en los últimos años, desde que en 1994 la Agencia Internacional del Cáncer, (66) reconociera que el microorganismo es carcinógeno del grupo I, rango de mayor peligrosidad otorgado a los agentes capaces de promover la carcinogénesis.
Aspectos fisiopatológicos fundamentales de la relación entre el Helicobacter pylori y el adenocarcinoma gástrico.
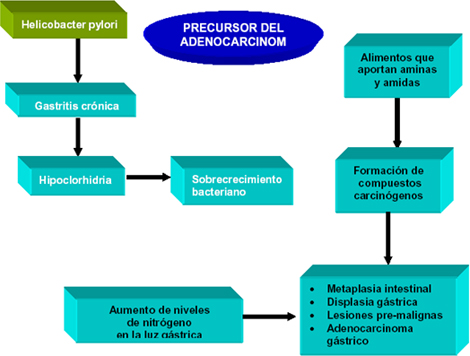
Si bien es difícil probar un efecto después de muchos años y en el momento del cáncer el Helicobacter pylori (HP) puede ser negativo, es evidente que datos epidemiológicos tienden a apoyar esto. Estudios experimentales con gerbos (“ratas del desierto”) han mostrado la secuencia del daño gástrico por el Helicobacter pylori (HP) con aparición de adenocarcinoma gástrico. (67) Hay autores que refieren un riesgo ocho veces mayor de las personas Helicobacter pylori (HP) (+) para hacer un cáncer gástrico en comparación con los Helicobacter pylori (HP) (-).Se han comprobado la existencia de dos grupos de cáncer gástrico en relación al Helicobacter pylori (HP): los cánceres “cardiales” y los “no cardiales”. Sólo en este último grupo hay relación con Helicobacter pylori (HP) (+). (68)
Autores japoneses han comunicado casos de desaparición de pólipos hiperplásicos después de erradicación de Helicobacter pylori (HP), (69) Si bien ellos no estarían relacionados al cáncer gástrico esto muestra posible participación de esta bacteria en otras lesiones proliferativas.
La epidemiología del cáncer gástrico y la de la infección por Helicobacter pylori son marcadamente similares. El cáncer gástrico de tipo intestinal es precedido por una cadena de cambios en el estómago que tienen lugar durante un largo período. Este modelo, avalado por un acúmulo de datos científicos fue propuesto por el Prof. Dr. Pelayo Correa, actualmente investigador del Centro Médico Universitario del estado de Luisiana, (70) plantea Según este modelo, que un estómago, inicialmente indemne, contrae una gastritis crónica superficial por el Helicobacter pylori. En un segundo escalón, la gastritis puede provocar un daño hístico mucho más severo y alcanzar el estadio de gastritis atrófica. En esta fase comenzarían a producirse cambios tales como la metaplasia intestinal y luego la displasia, lesiones que, típicamente, preceden al cáncer.
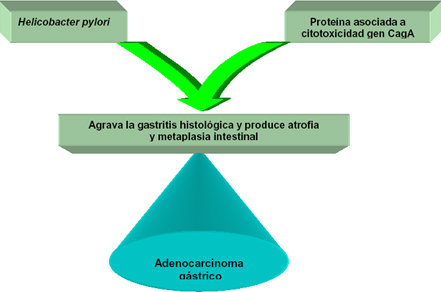
Un estudio por el grupo EUROGAST (71) en 17 poblaciones de 11 países europeos, Japón y los Estados Unidos de Norteamérica, encontró una estrecha relación entre las prevalencias de Helicobacter pylori y las del cáncer gástrico y estimó que el 10% de incremento en la prevalencia de la infección se asociaba con el 27% de aumento en la incidencia del cáncer gástrico.
Se ha detectado un incremento de la proliferación celular en la gastritis atrófica asociada al Helicobacter pylori, la metaplasia intestinal, la displasia y el cáncer gástrico. Estos efectos sobre la cinética celular del epitelio gástrico constituyen evidencias que sugieren una asociación entre la bacteria y el cáncer gástrico. (72)
En casos de Linfoma gástrico (LG) se ha detectado cáncer gástrico incipiente años después de haber sido tratado y erradicado el Helicobacter pylori (HP), (73) esto reafirma la idea que las alteraciones genéticas inducidas por la bacteria pueden persistir en el tiempo y mantener el riesgo de un adenocarcinoma. Este es otro hecho que hace necesario prolongar la vigilancia de los enfermos tratados exitosamente de Linfoma Gástrico.
Estudios epidemiológicos sugieren que pacientes con linfoma de mucosa asociada a tejido linfoide (MALT) de células B, de bajo grado, son más susceptibles de ser infectados por el Helicobacter pylori que los controles. (74)
Se realizó un estudio en 6 pacientes con evidencias histológicas y de genética molecular de padecer linfoma (MALT) a bajo grado de células B, que concomitantemente estaban infectados por Helicobacter pylori y se les administró terapia de erradicación. La bacteria fue exitosamente erradicada en los 6 pacientes. Después de biopsias repetidas 4 y 10 meses después de la erradicación 5 de los pacientes no mostraron evidencia alguna de linfoma. (75)
En un estudio más amplio, 33 pacientes con linfoma (MALT) a bajo grado de células B asociado a gastritis por Helicobacter pylori fueron tratados con terapia de erradicación. Esta bacteria fue erradicada en todos los pacientes. En la histología, 23 pacientes mostraron una regresión completa y 4 una regresión parcial del linfoma. Durante 1 año de seguimiento no ocurrieron recidivas del linfoma (MALT). El linfoma (MALT) a bajo grado de células B puede experimentar una regresión después de la erradicación del Helicobacter pylori. (76)
No disponemos, en el momento actual, de estudios epidemiológicos que pongan de relieve las tasas poblacionales de prevalencia de la infección por Helicobacter pylori en nuestro país. Pero, a pesar de los altos niveles de salud alcanzados por nuestra población como resultado de la obra del proceso revolucionario que tuvo lugar en Cuba, contamos con indicios limitados e indirectos que son sugestivos de una alta prevalencia de la infección por Helicobacter pylori en la población cubana.
Existen 2 estudios realizados en nuestro país que abordan el tema de la prevalencia de la infección en pacientes dispépticos. Uno de ellos fue realizado en La Habana, en el Instituto Cubano de Gastroenterología, en el año 2004, (55) donde se estudiaron 200 pacientes, la mayoría del sexo femenino y con un promedio de edad de 52 años. En pacientes con úlcera duodenal se encontró una prevalencia de la infección por Helicobacter pylori de 99.0%. En 22 pacientes con úlcera gástrica se encontró una prevalencia de 91.0%. La prevalencia de la infección encontrada en los pacientes con gastritis crónica fue 94.0 y el otro en Matanzas, en el Hospital Faustino Pérez, (77) el que se realizó un estudio analítico de cohorte prospectivo, donde el universo estuvo constituido por 150 pacientes, y se encontró una prevalencia de la infección por Helicobacter pylori de un 80%. Se apreció una fuerte asociación entre la infección por Helicobacter pylori y la úlcera duodenal, ya que el 100% de los pacientes con úlcera de esta localización eran portadores de la infección, como suele ocurrir en las áreas geográficas con alta prevalencia de la infección por Helicobacter pylori.
Un estudio de la prevalencia de esta bacteria, en pacientes dispépticos, nos permitiría arrojar un poco de luz sobre algunos aspectos epidemiológicos importantes relacionados con la infección por Helicobacter pylori en nuestra población y entorno geográfico.
IV. MATERIAL Y MÉTODO.
IV.I Diseño metodológico.
Tipo de Investigación.
Se realizó un estudio descriptivo, de tipo prospectivo, con el objetivo de determinar las alteraciones histológicas de la mucosa gástrica en pacientes dispépticos con Helicobacter Pylori, atendidos en el servicio de Gastroenterología, del Hospital Universitario “Comandante Manuel Fajardo”, durante el período comprendido desde el 1 de Mayo del 2009 hasta el 1 de Mayo del 2010.
Universo y muestra de estudio.
Constituido por 220 pacientes, que acudieron al Servicio de Gastroenterología, del Hospital Universitario “Comandante Manuel Fajardo”, aquejados por síntomas dispépticos, a los cuales se les realizó videoendoscopia del tracto digestivo superior, en el período de estudio y que dieron su consentimiento por escrito para participar en la investigación. (Anexo I).
El universo y la muestra coinciden, porque a todos los pacientes que asistieron en ese periodo, se les realizó la toma de muestra independientemente que tuvieran la presencia o no de la bacteria, y posteriormente se dividieron en dos grupos.
Criterios de inclusión.
1. Pacientes que dieron su consentimiento para participar.
2. Pacientes de 15 años y más de edad, con síntomas dispépticos que motivaron la realización de endoscopia.
Criterios de exclusión
1. Pacientes que se negaron a participar en la investigación.
2. Pacientes en los que la biopsia gástrica no fue útil para diagnóstico.
Criterios de salida del estudio
1. Pacientes que no cooperaron con la realización del proceder endoscópico.
Consideraciones éticas del estudio
El estudio estuvo justificado desde el punto de vista ético, ya que se realizó conforme a los principios establecidos en la declaración de Helsinki: (78)
1. Los pacientes incluidos podrán obtener un beneficio terapéutico para sus lesiones originadas por Helicobacter pylori en la mucosa digestiva, posterior a su participación.
2. El cuidado que recibirán los sujetos y las decisiones tomadas serán responsabilidad del equipo médico, debidamente calificado, que participará activamente en la investigación.
3. A los pacientes incluidos se les solicitará su consentimiento por escrito, luego de haber sido instruidos debidamente acerca de las características del estudio, sus objetivos, beneficios y riesgos posibles e informados sobre su derecho a participar sin exponerlos a limitaciones para su atención u otro tipo de represalia.
4. Se respetará la integridad de los pacientes dentro de la investigación, asegurando la confidencialidad de toda la información personal recogida durante esta.
5. Ningún investigador participante en el estudio utilizará formas coercitivas ni influirá sobre el paciente para obtener su participación en la investigación.
6. El lenguaje que se utilizará durante las entrevistas no será técnico, sino práctico y comprensible.
IV.II Procedimientos
Obtención de la información.
Todos los pacientes, previo al procedimiento, fueron informados para realizar ayuno de 8 horas antes del mismo, para evitar la presencia de alimentos y secreciones que imposibilitaran realizar una adecuada exploración del tractus digestivo superior. En el Departamento de Endoscopia, el médico ofreció una información sencilla y detallada del proceder, que incluyó la explicación de las posibles complicaciones y riesgos a que serian sometidos durante la prueba, con el fin de obtener su consentimiento. Después de haber obtenido el mismo, se les llenó una planilla encuesta confeccionada para esta investigación (Anexo 2) que recogía los datos generales, antes de comenzar el proceder y toda la información sobre los resultados posteriores del examen endoscópico e histológico.
Una vez recibido el paciente se le retiro la prótesis dental en caso que la usara, se aplicó lidocaína en spray al 10% como anestésico tópico en la orofaringe, se colocó la boquilla y se acostó en decúbito lateral izquierdo en la camilla, luego se procedió a realizar la videopanendoscopia con un equipo OLYMPUS GIF 240, se introdujo el equipo a través de la boca hasta llegar a visualizar la mucosa de la segunda porción del duodeno, de forma retrógrada se fue explorando el tracto digestivo superior de forma exhaustiva, el estómago (región antral, cuerpo y fundus), unión esofagogástrica y mucosa del esófago, donde se precisaron todas las características normales y patológicas de la mucosa, especialmente a nivel del estomago.
Durante el proceder se diagnosticó las lesiones encontradas en el trayecto explorado y se le realizó biopsia gástrica en cuatro cuadrantes a nivel del antro gástrico, una vez tomadas las muestras fueron depositadas en un frasco de cristal transparente, con formol al 10%, rotulados y dirigidas al Departamento de Anatomía Patológica del Hospital Universitario “Manuel Fajardo”, donde fueron procesadas y analizadas por el patólogo, utilizando la coloración con hematoxilina y eosina.
IV. III Procesamiento de la información y análisis estadístico.
Operacionalización de las variables
Se revisó la información, se procedió a corregir datos incompletos y posteriormente se confeccionó una base de datos en formato Microsoft Office Access para el procesamiento automatizado de la información.
Se empleó para el procesamiento de los datos el paquete estadístico SPSS 11.5 versión para Windows.
Se utilizaron totales, porcentajes y tasas de prevalencia, para resumir las variables cualitativas y cuantitativas discretizadas.
Se utilizó la determinación de Razón de tasas para encontrar la relación posible existente entre las variables síntomas, diagnostico endoscópico, diagnostico histológico y presencia de la bacteria.
Los resultados se presentan en tablas y gráficos.
V. RESULTADOS
Se presenta el resultado de un estudio realizado a un grupo de 220 pacientes atendidos en la consulta externa del Servicio de Gastroenterología, por manifestaciones dispépticas, con el objetivo de conocer las alteraciones histológicas de la mucosa gástrica, relacionadas con la infección por Helicobacter pylori (127 pacientes), el que fue diagnosticado en muestras de biopsias.
El grupo mostró rango de edades entre 18 y 87 años con promedio de 51 años.
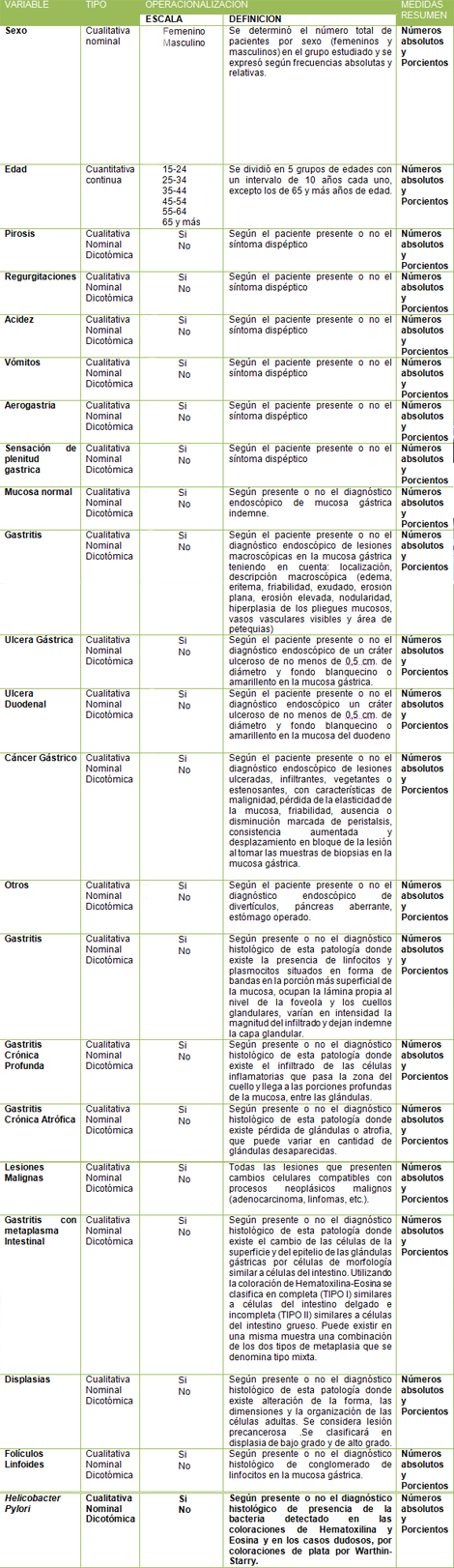
Grafico Nș 1: Prevalencia de infección por Helicobacter pylori diagnosticada por histología.
En el Gráfico 1, que muestra la prevalencia de Helicobacter pylori en los pacientes dispépticos atendidos en nuestra unidad, se observó una prevalencia general del 57,7%.
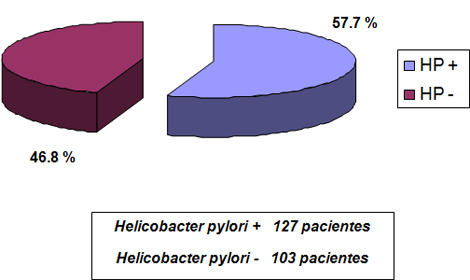
Al evaluar la distribución según grupos de edades y su relación con el Helicobacter pylori, lo que se muestra en la Tabla 1, se observó predominio del grupo de pacientes entre 45 y 64 años, mientras que en las edades más tempranas (los pacientes menores de 34) se presentó mayor prevalencia de pacientes con síntomas dispépticos infectados por la bacteria.
Tabla Nș 1: Prevalencia de Infección por Helicobacter pylori según edad.
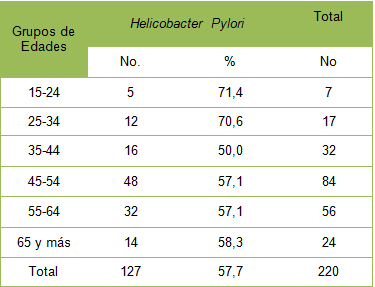
En la tabla 2, que relaciona la presencia de Helicobacter pylori según el sexo en pacientes dispépticos, encontramos mayor prevalencia en el grupo de las féminas, con un 69,1%, mientras los varones, que numéricamente representaron el grupo más nutrido, mostraron prevalencia del 48,8%.
Tabla Nș 2: Prevalencia de Infección por Helicobacter pylori, según sexo.
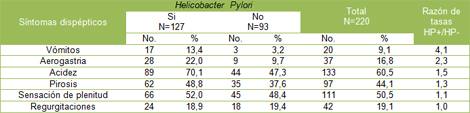
En cuanto a la distribución de los síntomas dispépticos en los pacientes con Helicobacter pylori (HP) positivo (Tabla 3), se observó predominio de la acidez en el 70,1% de los casos.
Tabla Nș 3: Principales síntomas dispépticos según presencia de Helicobacter pylori (HP)
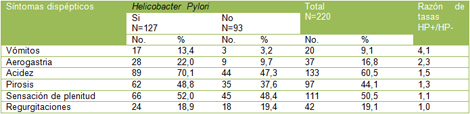
El resto de los síntomas referidos por los pacientes, resultaron la sensación de plenitud gástrica en más de la mitad de los casos (52,0%), la pirosis en el 48,8%, la aerogastria en el 22,0%, las regurgitaciones en el 18,9% y los vómitos en el 13,4% de los casos.
La Razón de tasas fue más significativa para los vómitos, resultando que este síntoma es 4.1 veces más frecuente en los pacientes Helicobacter pylori (HP) positivos.
Tabla Nș 4: Diagnósticos endoscópicos más frecuentes según presencia de Helicobacter pylori (HP)
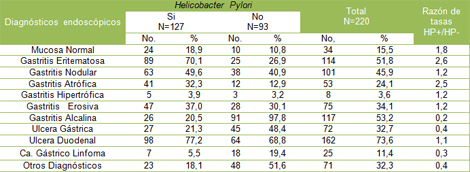
La ulcera duodenal, se asoció a Helicobacter pylori (HP) en un 77,2%, seguido de la gastritis eritematosa, que mostró prevalencia de la bacteria en el 70,1% (tabla 4).
Las gastritis nodular y erosiva, aportaron el 49,6% y 37,0% respectivamente. Existió una asociación entre ulcera gástrica y Helicobacter pylori (HP) en el 21,3% de los pacientes estudiados, mientras solo el 5,5% de los pacientes con cáncer gástrico/Linfoma MALT tuvieron la presencia de la bacteria en la mucosa gástrica.
Resultaron con mayor significación en la Razón de tasas la gastritis eritematosa y atrófica.
Tabla Nș 5: Diagnóstico histológico y presencia de Helicobacter pylori (HP).
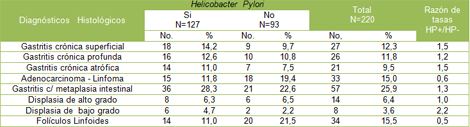
En la Tabla 5, que muestra los diagnósticos histológicos relacionados con la presencia o no de Helicobacter pylori (HP), se observa la mayor prevalencia de la bacteria asociada a la gastritis con metaplasia intestinal en el estómago.
En orden decreciente, se presentaron la gastritis crónica superficial, profunda y atrófica, con el 14,2%, 12,6% y 11,0% respectivamente. La presencia de folículos linfoides se vio asociada a Helicobacter pylori (HP) en similar frecuencia a la gastritis atrófica, mientras las lesiones malignas, que incluyeron los Adenocarcinomas y Linfomas, se relacionaron en el 11,8%. Otras alteraciones histológicas se asociaron en porcientos más bajos.
Con relación a la Razón de tasas en los diagnósticos histológicos, se observó mayor significación en la Displasia de bajo grado que fue 2.2 veces más frecuente en pacientes infectados, seguido de la Gastritis crónica atrófica y la superficial, que fueron 2.5 veces más frecuente en pacientes con Helicobacter pylori positivo.
VI. DISCUSIÓN
Las variaciones geográficas encontradas en la prevalencia de la infección por Helicobacter pylori entre unos países y otros, que ya han sido señaladas, (19) avalan la importancia de profundizar en el estudio de las alteraciones histológicas encontradas en la mucosa gástrica en los pacientes dispépticos y su relación con el Helicobacter pylori en nuestro medio, porque la extrapolación de resultados y conclusiones en estos trascendentales problemas puede conducir a errores de los que se derivarían, sin duda, consecuencias desastrosas para nuestros pacientes.
En el grupo que nosotros estudiamos (gráfico Nș 1), la prevalencia de la infección por Helicobacter pylori encontrada, fue de 57,7% similar a la reportada por unas investigaciones. (79) y diferentes a otras de otros grupos similares en nuestro país. (53, 54, 75) Las causas de esta discordancia en la tasa de prevalencia entre los mencionados estudios y el nuestro debemos buscarla en las diferencias de diseño de las investigaciones que nos sirven de referencia y la nuestra.
Dichas investigaciones adoptaron como criterio diagnóstico de la infección tanto la presencia del Helicobacter pylori en la histología, como su diagnóstico a través del test de ureasa. Cuantos más procedimientos diagnósticos se empleen en un mismo paciente para encontrar la presencia de la bacteria más probabilidades existen de detectarla y la prevalencia será entonces más alta. En nuestro estudio solamente contamos con la información de las muestras de mucosa gástrica y, por tanto, el diagnóstico de la infección se basa de manera exclusiva en el diagnóstico histológico.
Por otra parte, en nuestro grupo de estudio no fue posible emplear tinciones especiales como Warthin-Starry, Giemsa, u otra tinción especial. Ello hubiera ejercido un papel determinante en el incremento de la sensibilidad del método de diagnóstico histológico de la infección por Helicobacter pylori. Se usó la Hematoxilina-Eosina que es el método menos sensible de todos y que resulta particularmente útil cuando la densidad de la colonización bacteriana es alta. (80)
Este método es el que habitualmente se utiliza en nuestro Centro — y en numerosas Instituciones del mundo entero — por su bajo costo, facilidad con que se puede montar y utilidad en las identificaciones de las alteraciones histológicas de la mucosa gástrica. Aunque el método histológico de tinción con Hematoxilina-Eosina tiene menor sensibilidad para el diagnóstico del Helicobacter pylori, su empleo en la identificación del germen está muy difundido y se aún se utiliza en estos momentos. Estos resultados son indicadores de la trascendencia de realizar el método histológico con todos los requerimientos que conlleva y, a la vez, de la utilidad de complementar el diagnóstico de la infección por Helicobacter pylori con dos métodos diagnósticos cuando existe la posibilidad de hacerlo. (81)
En la tabla No 1 se observa la prevalencia encontrada en los diferentes grupos de edades seleccionados. Se encontró una mayor prevalencia en las edades más tempranas de la vida de 15 a 34 años, lo cual no coincide con otros estudios cubanos, como el del Dr. Carvajal, en el Instituto de Gastroenterología, donde la prevalencia fue aumentando con la edad y alcanzó el máximo en el grupo de edad entre 51 y 60 años con 50 (96%) pacientes positivos y en los grupos de edad más avanzada, se observó un discreto decrecimiento.(54). Sin embargo, en estudio realizado en Matanzas, en el Hospital Faustino Pérez, (75) mostró una mayor prevalencia en el grupo de menos edad que en el grupo intermedio, pero sí, una posterior disminución cuando la edad es ya muy avanzada en el grupo de 61 años o más.
La característica más llamativa de las curvas de prevalencia de la infección por Helicobacter pylori (HP) es el incremento de casos de infección que se producen con la edad. (82)
En países en vías de desarrollo gran parte de los niños (79% en algunos estudios) se encuentran ya infectados a los 10 años y la prevalencia continúa aumentando a lo largo de la vida, alcanzando en las personas adultas índices superiores a los de los países con alto nivel de desarrollo. (28) Igual distribución se observa en poblaciones de bajo nivel socioeconómico de países desarrollados. (83) En los países desarrollados la prevalencia de la infección es relativamente baja hasta los 35-40 años, observándose a partir de entonces y hasta casi los 60 años un ascenso importante. Luego se produce una leve pero persistente caída de esta en la población de más edad. (84)
La tabla Nș 2, que ilustra la prevalencia de Helicobacter pylori según sexo, muestra que no existió grandes diferencias entre ellos, aunque se observó un mayor un número de pacientes femeninos. Estos datos coinciden con lo reportado previamente, que la bacteria puede afectar a ambos grupos poblacionales. (85)
Al analizar la presencia de los síntomas dispépticos encontrados en los pacientes con H Pylori positivos, (tabla No 3) observamos que el mayor número de ellos presentaban acidez, seguidos de repletud gástrica y pirosis, mientras que los vómitos fue el síntoma que se reportó en menor número de pacientes. Esto coincide con lo señalado en otros estudios, (54) donde el síntoma clínico más frecuente presentado fue la acidez y al mismo tiempo, el de mayor positividad de la infección (97%). El síntoma menos frecuente detectado fue el vómito que lo padecieron solo 2 pacientes. (85)
Existen estudios donde se encuentra asociación de cepas específicas de Helicobacter pylori (HP) con sintomatología digestiva (dispepsia no ulcerosa), por ejemplo: la cepa Cag-A positivo. (86) Otros han comentado la posible existencia de un rol protector de Helicobacter pylori (HP) mediante la observación de aparición de enfermedad de reflujo gastroesofágico (RGE) luego de tratamiento erradicador de Helicobacter pylori (HP) y curación de la esofagitis por reflujo por la presencia de gastritis atrófica. (88)
A pesar de los avances en la investigación no está claro que tratar a pacientes con dispepsia no ulcerosa con tratamiento erradicador mejora la sintomatología y, por el contrario, se piensa que la depresión puede ser un factor determinante de dispepsia; ya sea originando alteraciones motoras del estómago o duodeno o ya sea incrementando la sensibilidad dolorosa a nivel de estos órganos al del aparato digestivo. (88)
La literatura confiere una prevalencia muy alta entre 90-100% del Helicobacter pylori en la úlcera duodenal. Nosotros encontramos una prevalencia de la infección bacteriana de 77,2% en este estudio (tabla No 4). Existen recientes reportes (89) de úlcera duodenal con Helicobacter pylori (-) y de la frecuencia creciente de ulceraciones duodenales no relacionadas con el mismo fenómeno, para cuya explicación se han invocado distintas causas, entre las que figura en un lugar importante, la disminución de las tasas poblacionales de prevalencia de la infección por Helicobacter pylori debido a un mejoramiento de las condiciones socioeconómicas y, consiguientemente, de la situación higiénico-sanitaria de la población. En la literatura internacional, (90, 91, 92) se reporta que el Helicobacter pylori está presente en el 50 -75% de los pacientes con úlcera gástrica y en el 95% de las úlceras duodenales. En nuestro estudio, se observó la úlcera gástrica, en un 21,3%. Otro estudio en nuestro país realizado en el 2004, en pacientes alcohólicos, (40) encontró que el 100% de los pacientes con úlcera gástrica padecían una infección por Helicobacter Pylori. (93)
Similares resultados, fueron obtenidos por Brizuela y cols (94) en 1999, quienes estudiaron la asociación de Helicobacter Pylori a úlcera duodenal (UD) mediante la prueba de la ureasa y en biopsia gástrica, en pacientes cubanos y observaron una correlación del 93,8%. En otro estudio, realizado en Santo Domingo, se detectó una Hp-seroprevalencia de 100% de los pacientes con úlcera duodenal, mientras que en los pacientes diagnosticados con úlcera gástrica fue de 92,8%. (95) Esto ha llevado a plantear que existe una relación causal entre ambas condiciones, lo que se ve apoyado por el efecto de la erradicación sobre la actividad y recidiva de la enfermedad ulcerosa. Sin embargo, la uniformidad de los pacientes con úlceras duodenales a este respecto contrasta significativamente con la ya señalada variabilidad en la prevalencia de infección por Helicobacter Pylori en población asintomática de diversas áreas geográficas y/o niveles socio-económicos y la falta de correlación entre la prevalencia de infección por la bacteria y la prevalencia de úlcera duodenal o gástrica en diversas poblaciones.
En nuestro estudio, la gastritis eritematosa, ocupó un segundo lugar, en relación con la presencia de Helicobacter Pylori, seguidas de las nodulares erosivas y atróficas.
La relación de Helicobacter pylori con las gastritis ha sido demostrada por varios autores. (28, 63) Desde el punto de vista endoscópico la gastritis constituye uno de los diagnósticos más frecuentes, a pesar de que está demostrado que existe una baja correlación entre los hallazgos macroscópicos y los histológicos.
En sentido estricto el término gastritis debería reservarse para designar las alteraciones microscópicas de la mucosa gástrica observadas en un estudio anatomopatológico, con este enfoque el concepto histológico de gastritis es amplio y engloba cualquier tipo de inflamación de la mucosa gástrica tanto aguda como crónica. Este concepto, aparentemente simple, es confuso cuando se emplea en la literatura médica porque se ha utilizado para describir las alteraciones microscópicas de la mucosa gástrica y también para referirse a sus alteraciones macroscópicas vistas endoscópicamente. (96)
El 5,5% de los pacientes estudiados en nuestra serie con cáncer gástrico (CG)/Linfoma MALT (LM) tuvieron la presencia de la bacteria en la mucosa gástrica.
Existen tres líneas de evidencia que sugieren asociación de cáncer gástrico e infección con Helicobacter pylori (HP). Primero, las poblaciones con riesgo incrementado de desarrollar cáncer gástrico, tienen una alta tasa de prevalencia de Helicobacter Pylori. Segundo, lesiones premalignas conocidas que están presentes antes del desarrollo de cáncer gástrico están también asociados con infección de Helicobacter pylori (HP) y tercero, en numerosos estudios epidemiológicos de cáncer gástrico han mostrado estar frecuentemente asociados con infección de Helicobacter pylori (HP). (20,97)
La infección precede en muchos años al desarrollo de la neoplasia, existiendo una correlación más significativa cuanto más antigua es aquella, así en las zonas de una mayor incidencia de cáncer gástrico (CG), la infección por Helicobacter pylori (HP) se contrae generalmente en la infancia. Es evidente que este, se desarrolla únicamente en una muy pequeña proporción de personas infectadas y que también afecta a personas sin anticuerpos frente a Helicobacter pylori (HP). Esto sugiere que se requiere además el concurso de otros factores genéticos o ambientales, por lo tanto se debe considerar que la infección por Helicobacter pylori (HP) no es suficiente, en todos los casos para la carcinogénesis gástrica. Deben existir otros factores implicados en la etiopatogenia del cáncer gástrico (CG) además de la infección por Helicobacter pylori (HP), siendo los factores dietéticos especialmente importantes. (61, 98, 99)
Pese a que un 30 a 40% de los habitantes en países desarrollados y más del 70% en países no desarrollados son Helicobacter pylori (HP) (+), sólo un muy pequeño grupo evoluciona a un Linfoma Malt (LM), la razón de esto no está muy clara aún pero demuestra el rol de otros factores que se investigan en la actualidad.
Los Linfomas Malt se ven de preferencia después de los 50 años, por igual en ambos sexos. Corresponden a un 7-8% de los linfomas no Hodgkin, representan sólo un 4% de los tumores gástricos y un 40% de los linfomas gástricos. Sus síntomas son muy inespecíficos y orientan a gastritis o dispepsia. (24)
La disminución en algunos países de la presencia de Helicobacter Pylori se ha asociado a una disminución de los cánceres gástricos, aunque habría un incremento de los cánceres “cardiales”. En nuestro país se ha observado una curva decreciente del cáncer gástrico en los últimos años pese a ello se mantiene como el cáncer más frecuente y por ello motivo de pesquisa permanente.
Al analizar, en nuestra casuística la asociación de la infección por Helicobacter pylori y el diagnóstico histológico presentado, observamos un predominio de la gastritis con metaplasia intestinal (28,3%), seguidos de las gastritis crónicas superficiales (14,2%) y profundas (12,6%).(Tabla Nș 5) Estos datos son compatibles con hechos científicamente demostrados, que consignan que la bacteria es la causante de más del 85.0% de los casos de gastritis crónica en el ser humano y, de hecho el factor causal más importante de gastritis crónica en el hombre. (98)
Existe una fuerte asociación entre la gastritis crónica y la infección por Helicobacter pylori. La existencia de un escaso porcentaje de pacientes con gastritis crónica en nuestro estudio puede relacionarse con diversas causas, entre las que figuran la distribución en parches de la bacteria, el empleo únicamente del diagnóstico histológico con tinción de Hematoxilina-Eosina para su detección y la posibilidad de que otros factores etiológicos, desempeñaran un papel importante, en el desarrollo de la gastritis.
Se sabe que prácticamente todas las personas infectadas por Helicobacter pylori desarrollan una gastritis crónica superficial. Si no se lleva a cabo un tratamiento que permita la erradicación de la infección, tanto ésta como la inflamación se prolongan durante décadas, y en muchos casos durante toda la vida. (100)
A pesar de lo ya señalado nuestros resultados coinciden con el estudio realizado por el profesor Carbajal, en el Instituto de Gastroenterología, en el año 2004, (53) donde de los 1009 pacientes estudiados, 125 tuvieron metaplasia intestinal y de ellos 69 (55,2%) tenían la infección por Helicobacter pylori y 884 sin metaplasia intestinal, de ellos 330 (37,3%) con la infección. Esta asociación se explica porque la colonización del microorganismo induce la metaplasia intestinal y sigue estando presente en la periferia de las zonas de metaplasia donde coloniza tejido gástrico no metaplásico.
La Gastritis crónica (GC) producida por Helicobacter Pylori se considera actualmente como precursora de la úlcera duodenal, se señalan algunas alteraciones histológicas que caracterizan la gastritis por Helicobacter Pylori, como respuesta del huésped a la presencia de la bacteria mediante la presencia de focos de neutrófilos, lo que produce una respuesta inflamatoria aguda focal sobre la respuesta inflamatoria crónica de la mucosa.(101) También la respuesta de tipo inmunológico de la mucosa, con la formación de verdaderos folículos linfoides se describen en la gastritis crónica antral por Helicobacter Pylori; se plantea que a mayor grado de lesión de la mucosa, es mayor la posibilidad de la presencia de Ulcera duodenal. (59)
En nuestro trabajo se ha investigado la presencia de Helicobacter Pylori en pacientes con gastritis crónica, y se observó que el 37,8% de ellos estaban infectados por el germen, resultados que difieren a los encontrados por González-Carbajal y otros, (40, 102,103) quienes reportaron en sus estudios, que el 96,2%, 97,5% y 94,8% respectivamente, de sus casos estudiados con gastritis crónica, presentaban Helicobacter Pylori. Otros estudios realizados en otras partes del mundo señalan que Helicobacter pylori (HP) constituye la causa primordial de gastritis crónica. (27)
Nuestro estudio recomienda, que deben realizarse más investigaciones con un diseño prospectivo que aborde con profundidad el problema de las alteraciones histológicas gástricas asociadas a la infección por Helicobacter pylori y su prevalencia en grupos determinados, como son los pacientes dispépticos, y en la población en nuestro país.
VII. CONCLUSIONES
1. La prevalencia de la infección por Helicobacter pylori en el grupo estudiado fue 57,7.
2. Hubo un predomino de la infección, en las edades más tempranas de la vida y en el sexo femenino.
3. La acidez predominó, como síntoma dispéptico, en los pacientes estudiados.
4. Existió una fuerte relación entre la infección por Helicobacter pylori y la úlcera duodenal, seguidas por las gastritis y el cáncer gástrico.
5. La metaplasia intestinal en el estómago, fue el diagnóstico histológico de mayor frecuencia en relación con la presencia de la bacteria.
VIII. RECOMENDACIONES
1. Educación sanitaria a la población para evitar la transmisión y propagación de la infección.
2. Realizar estudios amplios en población general y de riesgo para conocer la prevalencia de la infección en nuestro medio.
3. Implementar métodos de diagnostico no invasivos, que apoyen la recomendación anterior, para detectar la presencia del Helicobacter pylori y orientar métodos más selectivos que detecten alteraciones en la progresión a la malignidad.
ANEXO 1: Consentimiento informado
Alteraciones histológicas gástricas y Helicobacter Pylori en pacientes dispépticos, del Hospital Manuel Fajardo. Año 2009
Yo: ___________________________________
He leído la hoja de información que se me ha entregado.
He podido hacer pregunta sobre el estudio.
He recibido suficiente información sobre el mismo.
He hablado con: _________________________
Comprendo que mi participación es voluntaria y que puedo retirarme del estudio:
a) Cuando quiera
b) Sin tener que dar explicaciones
c) Sin que esto repercuta en mis cuidados médicos
Presto libremente mi conformidad para participar.
Firma del Participante: __________
Fecha: __________
Anexo 2: Planilla de Recolección de datos
Alteraciones histológicas gástricas y Helicobacter Pylori en pacientes dispépticos, del Hospital Manuel Fajardo. Año 2009
Nombre y Apellidos: ---------------------------------------------------------------------
Edad: -------------------------- Sexo: ------------------------------
Motivo de Indicación:
Diagnóstico Endoscópico:
Diagnóstico Histológico:
Presencia de Helicobacter pylori
Si -------------- No -------------
Fecha: ----------------------------
Nș de paciente: ----------------------
IX. BIBLIOGRAFÍA
1. López Espinosa JA. Hospital “Comandante Manuel Fajardo.” el más antiguo de los que funcionan actualmente en Cuba. Rev Cubana Med Gen Integr 2001;17(6):611-13
2. Salomon H. Uber das Spirillum des Saugetiermagens und sein Verhaltn zuden Belegzellen. Zentralbl Bakteriol 1896;19:433-42
3. Marshall BJ. Unidentified curved bacilin gastric epithelium in active chronic gastritis. Lancet 1983;1:1273-75
4. Marshall BJ y Warren JR. Unidentified curved bacilin in the stomach of patients with gastritis and peptic ulceration. Lancet 1994;1:1311-1315
5. Ricardo Latorre M. Gonzalo Gallo B.Helicobacter pylori: su importancia práctica en la gastroenterología.Rev. Med. Clin. Condes - 2008; 19(4) 323 - 329
6. Peek RM. The biological impact of Helicobacter pylori colonization. Semin Gastro intest Dis 2007 Jul;12(3):151-66
7. González-Carbajal M. Aspectos epidemiológicos de mayor relieve de la infección por Helicobacter pylori. En: González-Carbajal M. y cols. Helicobacter pylori ¿El tercer dogma? Autores Productores Asociados, S.L. Madrid, España. Capítulo V; 2003:83-112.
8. Gutiérrez B, Vidal T, Valmaña CE, Santiesteban N, González N, Leonard I, et al. Primer Informe sobre el Aislamiento de Helicobacter pylor asociado a enfermedades digestivas en Ciudad de La Habana. Vacci Monitor (Enero-Marzo) 2001, 26; Año 10: No 1.
9. Camargo MC, Yepez MC, Cerón C, Guerrero N, Bravo LE, Correa P, et al. Age at acquisition of Helicobacter pylori infection: Comparison of two areas with contrasting risk of gastric cancer. Helicobacter 2006 Jun; 9(3):262-70.
10. Tindberg G, Bengtsson C, Granath F, Blennow M, Nyrén O y Granstrom M. Helicobacter pylori infection in Swedish school children: lack of evidence of child-child transmission outside the family. Gastroenterology 2004;121:310-16.
11. Collins J.,Ali-Ibrahim A., Smoot D. Antibiotic therapy for Helicobacter. Med.Clin.N.A. 2006; 90:1125-1140.
12. Rautelin H y Kosunen TU. Helicobacter pylori infection in Finland. Ann Med 2007;36(2):82-8.
13. A R Magallán, J D Venegas Sandoval. Helicobacter pylori: agresor común de la mucosa gástrica. Med Int Mex 2009;25(4):295-9
14. David A, Peura MD. Bacteriology abd epidemiology of Helicobacter pylori infection. Upto Date. Version 11.2. CD-ROOM, 2008.
15. Vallejos C, Cerda O, Valenzuela M, Toledo A. Resistencia antimicrobiana en Helicobacter pylori: Aspectos Clinicos y Moleculares. Rev Med Chile 2006;131:1313-1320.
16. Valenzuela E, Jorge. Helicobacter pylori: 20 años después. Rev. méd. Chile, Nov 2007, vol.132, no.11, p.1339-1344. ISSN 0034-9887
17. Yakoob MY, Hussainy AS. Chronic Gastritis and Helicobacter pylori: A Histopathological Study of Gastric Mucosal Biopsies. J Coll Physicians Surg Pak. 2010 Nov;20(11):773-5.
18. Pandey R, Misra V, Misra S, Dwivedi M, Kumar A, Tiwari BK Helicobacter pylori and gastric cancer. Asian Pac J Cancer Prev. 2010;11(3):583-8.
19. Fock KM, Katelaris P, Sugano K, Ang TL, Hunt R, Talley NJ, Lam SK, Xiao SD, Tan HJ, Wu CY, Jung HC, Hoang BH, Kachintorn U, Goh KL, Chiba T, Rani AA. Second Asia-Pacific Consensus Guidelines for Helicobacter pylori infection. J Gastroenterol Hepatol. 2009 Oct;24(10):1587-600.
20. Suzuki H, Iwasaki E, Hibi T. Helicobacter pylori and gastric cancer. Gastric Cancer. 2009;12(2):79-87. Epub 2009 Jun 27.
21. Tanih NP, Okeleye BI, Ndip LM, Clarke AM, Naidoo N, Mkwetshana N, Green E, Ndip RN. Helicobacter pylori prevalence in dyspeptic patients in the Eastern Cape province - race and disease status. S Afr Med J. 2010 Nov 9;100(11):734-7.
22. Malfertheiner P, Megraud F, O’Morain C et al. Current conceps in the management of H pylori infection - The Maastricht III- Consensus Report. Gut 2007; 56:772-81
23. Monés J.,Gisbert J.P.,Bordas F et al. Conferencia española de Consenso.Indicaciones y métodos diagnósticos y tratamiento erradicador de Helicobacter pylori. Rev. Esp Enferm Dig 2005; 97: 348-374.
24. Zullo A, Hassan C, Andriani A, Cristofari F, Cardinale V, Spinelli GP, Tomao S, Morini S. Primary Low-grade and High-grade Gastric MALT-lymphoma Presentation: A Systematic Review. J Clin Gastroenterol. 2009 Sep 9.
25. Peitz U, Hackelsberger A, Gunther T y Malfertheiner P. The prevalence of Helicobacter pylori infection and the pattern of gastritis in Barrett´s esophagus. Dig Dis 2008;19:164-69
26. Moayyedi P, Bardham C, Young L, Dixon MF, Brown L y Axon At. Helicobacter pylori eradication does not exacerbate reflux symptoms in gastro esophageal reflux disease. Gastroenterology 2006;121:1120-26
27. Costa AC, Figueiredo C, Touati E. Pathogenesis of Helicobacter pylori infection. Helicobacter. 2009 Sep;14 Suppl 1:15-20.
28. Boixeda de MD, Martín de AC. Epidemiología de la infección por Helicobacter pylori. En: Boixeda de MD, Gisbert JP, Martín de AC. Infección por Helicobacter pylori. Dónde está el límite? Barcelona:Prodisa; 2007 p.75-91
29. Logan, Robert P H; Walker, Marjorie M. "Clinical review: ABC of the upper gastrointestinal tract. Epidemiology and diagnosis of Helicobacter pylori infection".Octubre 2007 BMJ 323:920–922.
30. Kidd M, Lastovica AJ, Atherton JC y Louw JA. Heterogeneity in the Helicobacter pylori vacA and cagA genes: association with gastroduodenal disease in South Africa? Gut 1999 Oct;45(4):499-502.
31. Blaser M J. Helicobacter pylori and related organisms. In: Principles and Practice of Infectious Diseases, 5TH ed. Churchill Livingstone, Inc 2000; 1305-12
32. Martín de Argila C, Boixeda de Miquel D y Gisbert JP. Epidemiología de la Infección por Helicobacter pylori. En Infección por Helicobacter pylori ¿Dónde está el límite? Prous Science, Barcelona – Philadelfia. Capítulo 5. 2006; 75-91.
33. Crespo A y Suh B. Helicobacter pylori infection: epidemiology pathofisiology, and therapy. Arch Pharm Res 2008; 24: 485-98
34. Suerbaum S y Michetti P. Helicobacter pylori infection. N Engl J Med 2008;347:1175-86.
35. Majka J, Rog T, Konturek PC, Konturek SJ, Bielanski W, Kowalsky M, et al. Influence of chronic Helicobacter pylori infection on ischemic cerebral stroke risk factors. Med Sci Monit. 2007 Dec;8(12):LE52-53
36. Roussos A, Philippou N y Gourgoulianis KI. Helicobacter pylori infection and respiratory diseases: a review. World J Gastroenterol. 2008 Jan;9(1):5-8
37. Maule S, Lombardo L, Rossi C, Crocella L, Masoero G, Della Monica P, et al. Helicobacter pylori infection and gastric function in primary autonomic neuropathy. Clin Auton Res. 2006 Jun;12(3):193-96
38. Campuzano-Maya G. Proof of an association between Helicobacter pylori and idiopathic thrombocytopenic purpura in Latin America. Helicobacter 2007; 12(3): 265-73.
39. Hungin AP, Hill C, Raghunath A. Systematic review: frequency and reasons for consultation for gastro-oesophageal reflux disease and dyspepsia. Aliment Pharmacol Ther. 2009 Aug 15;30(4):331-42.
40. González-Carbajal M, Ospina A, Borbolla E, y col. Influencia de la ingestión de bebidas alcohólicas y del Helicobacter pylori en la gastritis crónica de pacientes alcohólicos. Instituto Cubano de Gastroenterología. Ciudad de la Habana Cuba. 1999.
41. Misieewick J, Tytgat G, Goodwin C, et al. The Sydney System: A new classification of gastritis. Working Party report of the 4th world congresss of gastroenterology, Sydney 1990: 1-10.
42. Edmundo Aravena T. Helicobacter pylori y cáncer gástrico. Gastr Latinoam 2007; Vol 18, Nș 2: 129-132
43. Dixon MF. Helicobacter pylori and peptic ulceration. Histopathological aspects. J gastroent and Hepatol. 1991; 6: 125-30
44. Genta R, Hammer W y Graham DY. Gastric lymphoid follicles in Helicobacter pylori. Frequency, distribution and response to triple therapy. Human Path 2003; 24:577-83
45. Crahtree A. Immune and inflammatory responses to Helicobacter pylori infection. Scand. J. Gastroenterol. Suppl. 2006; 215: 3-10
46. Joachim H. L, Hadju C, Giancotti FR y Dorsett B. Lymphoid proliferations and lymphomas associated with gastric metaplasia, dysplasia and carcinoma. Human Pathology 2004 Jul; 30 (7) 833-42
47. Loffeld RJ y Stobberingh E. Presence of Helicobacter pylori in patients with non-ulcer dyspepsia revealing normal antral histological characteristics. Digestion 2005; 47: 29-34
48. Rollanson TP, Stone J y Rhodes JM. Spiral organism in endoscopic biopsies of the human stomach. J. Clinical Pathology 1984; 37: 23-26
49. León-Barba R, Spira WM y Ramírez-Ramos A Campylobacter pyloridis a complete misnomer (abstract) Gastroenterology; 1987; 92: 1501
50. Wyatt JI, Rathbone BJ y Heatley RV. Local inmune response to gastric Campylobacter in nonulcer dyspepsia. J clin Path 1986; 39:863-70
51. Peterson Wh, Lee E y Fredman M. Relationship between Campylobacter pylori and gastritis in healthy humans after administration of placebo or indomethacin. Gastroenterology 1988; 95:1185-97. Clin North Am 1993; 22: 73-88
52. Vakil N,Megraud F. Eradication therapy for Helicobacter Gastroenterology 2007; 133:985-1001.
53. González-Carbajal M, Rojas Zurita F, Grá Oramas B, Ávalos García R. de la infección por Helicobacter pylori en pacientes dispépticos. Rev Panam Infectol. 2004;6(4):8-14.
54. González-Carbajal M, Sevilla LF, Grá B. Alteraciones histológicas de la Mucosa gástrica y prevalencia del Helicobacter pylori en pacientes dispépticos. Revista Panamericana de Infectologia.. 2005: Vol 7; (1).
55. González-Carbajal M. y Concepción Izaguirre L. Helicobacter pylori, gastritis crónica y úlcera gastroduodenal. Cap VI. pag 113-129. En Helicobacter pylori ¿el tercer dogma? 2003. Edit. Autores y Productores Asociados A.P.A., S.L. Valle del Ebro, 1- 28669 Bobadilla del Monte (Madrid) España. I.S.B.N.: 84-932065-1-2
56. Vega-Ramos B. y col. Helicobacter pilori. Sus relaciones y controversias morfológicas. Rev. Gastroenterol Mex 2008, Vol. 65, (supl 2): 34-40
57. Nih Consensus Conference. Helicobacter pylori in peptic ulcer disease. JAMA 2004;272:65-69.
58. Moss S, Meyer-Wyss B, Renner EL, Merki HS, Gamboni G, Beglinger C. Influence of Helicobacter pylori, sex and age on serum gastrin and pepsinogen concentration in subjects without symptoms and patients with duodenal ulcers. Gut. 2008;34:752-6.
59. Tsimmerman IaS. Gastroduodenal diseases and Helicobacter pylori infection: overview] Klin Med (Mosk). 2009;87(5):9-15.
60. Gomollon F y Sicilia B. Helicobacter pylori: Strategies for treatment. Expert Opin Investig Drug 2001;10: 1231-41
61. Takenaka R., Okada H., Kato J., Makidono C., Hori S., Kawahara Y. y cols. Helicobacter pylori eradication reduced the incidence of gastric cáncer, especially of the intestinal type. Aliment Pharmacol Ther. 2007; 25, 805–812
62. Miranda R. Revisión histopatológica de las biopsias gástricas endoscópicas no neoplásicas: Periodo 1986-1987 en el hospital de apoyo No. 2 Cayetano Heredia.Tesis para optar al grado de especialista en patología y laboratorio clínico. Lima, Perú. Universidad Peruana Cayetano Heredia, 2008. 60 pp.
63. Silva E. Endoscopias digestivas altas y biopsias gástricas en el Hospital Nacional Cayetano Heredia y Clínica Médica Cayetano Heredia. Tesis para optar al grado de Médico cirujano. Lima, Perú. Universidad Peruana Cayetano Heredia, 2007. 58 pp
64. Correa P. Helicobacter pylori and gastric carcinogenesis. Am J Surg Pathol 2005; 19(Suppl 1): 35-43
65. Honda S, Fujioka T, Tokieda M, et al. Development of Helicobacter pylori-induced gastric carcinoma in mongolian gerbils. Cancer Research 2008; 58: 4255-59
66. Arfaoui D, Elloumi H, Ben Abdelaziz A.. Helicobacter pylori and gastric adenocarcinoma. Tunis Med. 2009 Apr;87(4):231-6
67. Ohkusa T, Takashimizu I,Fujiki K, et al. Dissapearence of hyperplastic polyps in the stomach after eradication of helicobacter pylori. Ann InterMed 2008; 129 (9): 712-715.
68. Correa P, Malcom G, Schmidt B, et al. Review article: Antioxidant micronutrients and gastric cancer. Aliment Pharmacol Ther 2004; 12(suppl 1): 73-82.
69. Eurogast Study Group. Epidemiology of, and risk factors for, Helicobacter pylori infection among 3194 asymptomatic sujects in 17 populations. Gut 199334:1672-6.
70. Sheu BS, Yang HB, Wang YL, et al. Pretreatment gastric histology is helpful to predict the symptomatic response after helicobacter pylori eradication in patient with non ulcer dyspepsia. Dig Dis Sci 2007; 46 (12): 2700-2707.
71. Morgner A, Miehlke S, Stolte M, et al. Development of early gastric ; 7: 248-53.).
72. Parsonnet J, Hansen S, Rodríguez L, et al. Helicobacter pylori infection in gastric lymphoma. N Engl J Med 2004; 330: 1267-1271.
73. Falcó G, Martinez A, Sanchez J, y col. Regresion del linfoma gastrico B MALT tras tratamiento erradicador para Helicobacter pylori. Rev Esp Enferm Dig 2007 91: 541-544.
74. Gretschel S, Hunerbein M, Foss HD, et al. Regression of high-grade B- cell lymphoma after eradication of Helicobacter pylori. Endoscopy 2001; 33 (9): 805-807.
75. Hernández A, Echenique AM, González-Carbajal M y Delgado A. Comportamiento de la Infección por Helicobacter pylori en pacientes dispépticos. Trabajo para optar por el título de especialista de primer grado en Gastroenterología. Hospital Universitario Comandante Faustino Pérez. Provincia de Matanzas, 2002
76. Valle J. Endoscopia digestiva alta, biopsia de mucosa gástrica y detección de Helicobacter pylori en el Hospital Arzobispo Loayza en el año 1996. Tesis para optar al grado de medico cirujano. Lima, Perú. Universidad Peruana Cayetano Heredia, 2008. 55 pp
77. Ramírez A, Watanabe J, Recavarren S, Cok J, Cevallos E, Hurtado O. Correlación entre el diagnóstico endoscópico e histológico en la gastritis crónica antral. Rev Gastroenterol Perú 2006; 6:171-177.
78. Declaración de Helsinki de la Asociación Médica Mundial. Principios éticos para las investigaciones médicas en seres humanos. Adoptada por la 18a Asamblea Médica Mundial Helsinki, Finlandia, Junio 1964 y enmendada por la 29a Asamblea Médica Mundial Tokio, Japón, Octubre 1975; 35a Asamblea Médica Mundial Venecia, Italia, Octubre 1983, 41a Asamblea Médica Mundial Hong Kong, Septiembre 1989, 48a Asamblea General Somerset West, Sudáfrica, Octubre 1996 y la 52a Asamblea General Edimburgo, Escocia, Octubre 2000.
79. Hill M. Helicobacter pylori: microbiology. Eur Cancer Prev 2006; 26 4-5.
80. Yamada T, Alpèrs DH, Owyang C, Powell D. W y Silverstin FE. Gastritis crónica por Helicobacter pylori. En: Manual de Gastroenterología 2000; Cap 34:356-57.
81. Chao González L y Bello Núñez M. Diagnóstico de la infección por Helicobacter pylori. En: González-Carbajal M y cols. Helicobacter pylori ¿el tercer dogma? Autores Productores Asociados, S.L. Madrid, España. 2003 Cap XI. 201-19.
82. Basso L, Clune J, Beattie S. Epidemiology of Helicobacter pylori infection. Rev Esp Enferm Dig 2007;78 (1):40.
83. Graham DY, Malaty HM, Evans DG, Evans DJ, Klein PD, Adam E. Epidemiology of Helicobacter pylori in a asymptomatic population in the United States. Effect of age,race and socio-economic status. Gastroenterol 2008;100:1495-501.
84. Mur Villacampa M, Gimeno Esteras E, Guerrero Navarro L, Cabeza Lamban F, Sainz Samitier R. Prevalencia del Helicobacter pylori en patología gástrica en Aragón. Rev Esp Enferm Dig 2008;82:311-6.
85. González-Carbajal M. Aspectos epidemiológicos de mayor relieve de la infección por Helicobacter pylori. En: González-Carbajal M y cols. Helicobacter pylori ¿el tercer dogma? Autores Productores Asociados, S.L. Madrid, España. 2003. Cap V: 83-112.
86. León R, Beredson R, Biber M. Reevaluación clínica, experimental y filosófica de la dispepsia. Diagnostico 2009; 39:266-269.
87. Talley N, Piper D, et al. Major life events stress and dyspepsia of unknown cause. Gut 2006; 27:127-134.
88. Hungin AP, Hill C, Raghunath A. Systematic review: frequency and reasons for consultation for gastro-oesophageal reflux disease and dyspepsia. Aliment Pharmacol Ther. 2009 Aug 15;30(4):331-42.
89. Freston JW. Helicobacter pylori negative peptic ulcers: frecuency and implications for management. J Gastroenterol 2009;35 (Suppl 12):29-32.
90. Aguilar C, Saavedra P, Mendoza G, Bussalleu R, Cok J, Martínez F, Aliaga E, Ortíz J, Cano R. Estudio de la prueba de la ureasa o test de aliento (TA) y correlación con biopsia gástrica para la detección de Helicobacter pylori (HP) en pacientes dispépticos del Hospital Nacional Cayetano Heredia – Lima. Rev. Gastroenterol. Perú 2007; 27: 172-176)
91. Hassal E. Peptic ulcer disease and current approaches to Helicobacter pylori. J Pediatr 2009;138:462-468.
92. Valmaseda T, Gisbert JP, Pajares JM. Geographic differences and the role of Cag A gene in gastroduodenal diseases associated with Helicobacter pylori infection. Rev Esp Enferm Dig 2008;93:471-480.
93. Ono S, Kato M, Asaka M. Gastric ulcer and Helicobacter pylori in the elderly population. Nippon Rinsho. 2010 Nov;68(11):1978-82.
94. Brizuela Quintanilla R, Fábregas Rodríguez C, Angulo Pérez O, Pérez Lorenzo M, García González E, Díaz García M. Helicobacter pylori y enfermedad ulcerosa. Rev Cubana Med Mil; 28(1):5-8.
95. Dra. Beatriz Gutiérrez, Dra. Teresita Vidal, Dr. Carlos Valmaña y Dra. Christine Camou Infección por Helicobacter pylori en Santo Domingo, República Dominicana. Rev Cubana Invest Biomed 2006;25(4) diagnosis in a population where Helicobacter pylori infection is frequent. Clin Infect Dis 2007; 25:1006-1012.
96. Konturek PC, Konturek SJ, Brzozowski T. Helicobacter pylori infection in gastric cancerogenesis. J Physiol Pharmacol. 2009 Sep;60(3):3-21.
97. Axon A. Helicobacter pylori What do we still need to know? J Clin Gastroenterol 2006; 40 (1): 15-19
98. Krejs GJ. Gastric cancer: epidemiology and risk factors. Dig Dis. 2010;28(4-5):600-3. Epub 2010 Nov 18.
99. Konturek PC, Konturek SJ, Brzozowski T. Helicobacter pylori infection in gastric cancerogenesis. J Physiol Pharmacol. 2009 Sep;60(3):3-21.
100. Medizinische Klinik II und Klinik für Palliativmedizin, Klinikum Aschaffenburg, Akad. Helicobacter pylori. Internist (Berl). 2009 Aug;50(8):979-86; quiz 987.
101. Grá Oramas B, Samada M, Hernández M, Segura N. ¿Es diferente la gastritis crónica antral por Helicobacter pylori en enfermos con y sin úlcera duodenal? VI congreso virtual de anatomia patológica. Cuba. Marzo del 2004.
102. Paniagua Estévez M, Grá Oramas B, González-Carbajal Pascual M, Pereiras Costa R, Piñol Jiménez F y Valdés Alonso L. Otras formas de gastritis crónica. Gastrum 1997; (142): 17-23