Las enfermedades cardiovasculares son la primera causa de muerte de nuestro país y a nivel mundial. Es por ello que nos decidimos a hacer esta revisión bibliográfica acerca de la insuficiencia coronaria, que dentro de las cardiopatías ocupa lugar de avanzada. Tratamos temas como la fisiopatología de esta enfermedad tan desvastadora, así como los factores que intervienen en la aparición de esta enfermedad. También los trastornos que trae asociado esta patología tales como la angina de pecho y el infarto del miocardio, entre los más frecuentes. Además exponemos los tratamientos tanto médicos como quirúrgicos mas novedosos que se utilizan en todo el mundo.
Objetivos
Generales
Exponer la fisiopatología de la insuficiencia coronaria.
Específicos
Identificar los factores que provocan la insuficiencia coronaria.
Exponer las manifestaciones de la insuficiencia coronaria.
Resumen
Las enfermedades cardiovasculares son la primera causa de muerte de nuestro país y a nivel mundial. Es por ello que nos decidimos a hacer esta revisión bibliográfica acerca de la insuficiencia coronaria, que dentro de las cardiopatías ocupa lugar de avanzada. Tratamos temas como la fisiopatología de esta enfermedad tan desbastadora, así como los factores que intervienen en la aparición de esta enfermedad. También los trastornos que trae asociado esta patología tales como la angina de pecho y el infarto del miocardio, entre los más frecuentes. Además exponemos los tratamientos tanto médicos como quirúrgicos mas novedosos que se utilizan en todo el mundo.
Material y Método
Hacemos una revisión bibliográfica acerca del síndrome de insuficiencia coronaria, su concepto, fisiopatogenia, agentes causales y predisponentes, así como las principales complicaciones. Para ello revisamos literatura actualizada, publicaciones de diferentes revistas médicas, y las estadísticas anuales relacionadas con dicho padecimiento en nuestro país.
INTRODUCCION
Las enfermedades cardiovasculares son la primera causa de muerte de nuestro país y a nivel mundial. La insuficiencia coronaria es el tipo más común de las enfermedades cardiovasculares, la cual durante el año 2003 llegó a cobrar 15013 1 vidas humanas en nuestro país. La causa más frecuente de insuficiencia coronaria es La Aterosclerosis y se ha demostrado la hipertensión arterial, los niveles elevados de colesterol y triglicéridos en la sangre, y el tabaquismo son los factores que con tribuyen al desarrollo de esta afección2. Siendo estos factores de riesgo prevenibles, es la razón por la cual nosotros como futuros profesionales de la salud nos hemos propuesto realizar esta revisión bibliográfica acerca de la INSUFICIENCIA CORONARIA, dentro de la cual abordaremos aspectos como su patogenia, complicaciones, diagnóstico y prevalencia. Con el objetivo de tratar de disminuir estas cifras abrumadoras.
Contenido
Insuficiencia coronaria
Concepto y epidemiología.
Hay insuficiencia coronaria cuando el flujo sanguíneo por los vasos coronarios se modifica en cantidad o calidad sin satisfacer las necesidades orgánicas; es decir; que existe una desproporción en el riego sanguíneo y las necesidades de sangre, y por ende, de oxigeno, por parte del miocardio.
La isquemia es una situación producida por la deprivación de oxígeno y la eliminación inadecuada de los metabolitos; desde un punto de vista práctico, la isquemia del miocardio se debe casi siempre a una disminución del flujo sanguíneo a través de las arterias coronarias.
Por este motivo, las manifestaciones clínicas y las consecuencias anatomopatológicas de la isquemia coronaria se denominan indistintamente cardiopatía isquémica o enfermedad coronaria. De igual forma, la reducción del flujo coronario es secundaria, en la mayoría de los casos, a lesiones aterosclerosas; ello explica que los términos cardiopatía coronaria y aterosclerosis coronaria, aunque no son sinónimos, se empleen como tales. Sin embargo, la embolia, el espasmo o la arteritis coronaria pueden ser otras causas de isquemia cuyos síntomas son, a menudo, indistinguibles de los producidos por la aterosclerosis.
La prevalencia de esta enfermedad varía ampliamente de unas áreas geográficas a otras; los datos del Seven Countries Study obtenidos del análisis de 12.770 varones en 18 comunidades de 7 países muestran que la tasa de mortalidad coronaria oscila entre 61 por 10.000 individuos y por 10 años en zonas rurales del Japón y 681 en el este de Finlandia, pasando por una tasa del 424 en los EE.UU. Aproximadamente un número similar de pacientes padece un infarto de miocardio no letal.
La mortalidad por cardiopatía isquémica en España en 1985, para los varones de 30-69 años, fue de 104 por 100.000, mientras que para las mujeres de la misma edad fue una cuarta parte. Estos datos indican una relativa baja frecuencia en comparación con los países del norte y centro de Europa o con EE.UU. Sin embargo, en estos países se ha observado un significativo descenso de la mortalidad en los últimos años. A pesar de ello, la enfermedad coronaria todavía constituye un grave problema sanitario y uno de los motivos de consulta más frecuentes en España.
Anatomía de la circulación coronaria
Vasos sanguíneos del corazón: Están representados por arteria y venas. Las arterias son dos (arterias coronarias) y nacen lateralmente de la aorta en su mismo comienzo a nivel de los senos valvulares. Estas se denominan arteria coronaria Izquierda y Derecha por su disposición. La arteria coronaria izquierda nace a nivel de la valva posterior izquierda, y luego de un corto trecho se subdivide en dos vasos o ramas: la rama descendente anterior que corre por el surco longitudinal anterior para alcanzar el ápice del corazón y la rama circunfleja que rodea la base de la aurícula izquierda, por el surco coronario, para alcanzar la superficie diafragmática del corazón. En su curso la rama descendente anterior envía ramificaciones más pequeñas al tabique interventricular y al miocardio ventricular adyacente. La rama circunfleja da ramificaciones que descienden sobre el margen obtuso hacia el ápice del corazón, y también envía ramas más pequeñas que irrigan el nacimiento de la aorta, la aurícula izquierda y la pared ventricular izquierda.
La arteria coronaria derecha se origina en el seno o valva anterior, pasa lateralmente por el surco ubicado entre el cono pulmonar y la aurícula derecha, corre luego por el surco coronario entorno a la base de la aurícula derecha, hasta alcanzar el surco longitudinal posterior. A este nivel se divide dando dos ramas, la arteria descendente posterior, y una rama más pequeña que se anastomosa junto al seno coronario con la rama circunfleja de la arteria coronaria izquierda.
Las venas coronarias son paralelas a las ramas de las arterias coronarias y traen de vuelta la sangre al atrio derecho a través del seno coronario.
Fisiología y fisiopatología de la circulación coronaria.
En el ser humano en reposo, el flujo sanguíneo coronario es en promedio de 225 ml/min., lo que supone a 0.7 a 0.8 mililitros por gramo de miocardio, o el 4-5% del gasto cardíaco total.4
El suministro de oxígeno del miocardio está regido por el flujo sanguíneo coronario y la capacidad del miocardio para extraer el oxígeno de la sangre que se le suministra. A diferencia de otros órganos, el corazón siempre extrae oxígeno de la sangre con una eficiencia casi máxima, incluso en situaciones de demanda mínima, de suerte que es imposible que un aumento de la extracción de oxígeno contrarreste las demandas del mismo.
Por otra parte, el flujo coronario puede aumentar varias veces en personas normales por vasodilatación de las arterias coronarias más importantes a nivel arteriolar, desencadenada por la liberación local de lactato, adenosina y otras sustancias vasoactivas a medida que aumentan las demandas de oxígeno del miocardio. La vasodilatación arterial coronaria es regulada por el endotelio coronario el cual libera sustancias vasodilatadoras, en especial Factor Liberador Derivado del Endotelio (endothelial-derived releasing factor EDRF), identificado químicamente hace poco como ácido nítrico.3
El corazón es un órgano aerobio que depende totalmente del aporte continuo de oxígeno para su funcionamiento; el metabolismo cardíaco debe producir fosfatos de alta energía continuamente, ya que en cada latido se consume hasta el 5% del total de ATP y creatincinasa (CK) almacenados en el miocardio. Puesto que la producción de estas sustancias por la glucólisis anaerobia es muy limitada, la circulación coronaria ha de suministrar constantemente el oxígeno y los sustratos necesarios.
La energía producida, y por tanto el oxígeno consumido por el miocardio, se destina en una mínima parte al mantenimiento de las funciones vitales de las células; en segundo lugar, a mantener el gradiente iónico indispensable para la actividad eléctrica y, por último, en mucha mayor proporción, a la actividad mecánica del miocardio.
En consecuencia, el consumo miocárdico de oxígeno (CM. O2) varía de forma constante y es proporcional al número de contracciones (frecuencia cardíaca), a la contractilidad miocárdica y a la tensión generada en la pared del ventrículo; ésta, a su vez, se halla determinada principalmente por la presión aórtica y el radio de la cavidad ventricular (ley de Laplace). Es lógico, pues, que la hipertensión arterial, la dilatación de las cavidades cardíacas y la taquicardia aumenten el CM. O2. El oxígeno llega al miocardio a través de las arterias coronarias en las cuales la sangre circula a favor del gradiente de presión que se establece entre la raíz de la aorta y el seno coronario (drenaje venoso coronario). El flujo coronario está limitado por dos tipos de factores: los factores mecánicos extrínsecos y las resistencias arteriales coronarias. La compresión que el miocardio circundante ejerce sobre las arterias intramiocárdicas durante la sístole reduce notablemente la circulación en aquéllas, sobre todo en el ventrículo izquierdo; en éste la circulación coronaria se produce casi exclusivamente en diástole y a favor de la presión diastólica aórtica (las situaciones que la reduzcan, como el shock cardiogénico o la insuficiencia aórtica, pueden causar isquemia). En segundo lugar, la presión diastólica intraventricular comprime el subendocardio y dificulta la irrigación de esta zona, susceptible siempre de presentar isquemia. En el individuo sano, las arterias coronarias epicárdicas apenas ofrecen resistencia al flujo y constituyen prácticamente vasos de conducción; las resistencias coronarias se hallan localizadas en las arteriolas intramiocárdicas, cuyo flujo se halla regulado, además de por los factores mecánicos antes mencionados, por el tono arterial, sobre el que influyen factores neurógenos, metabólicos y miógenos. Los primeros actúan a través del sistema nervioso vegetativo: los receptores betadrenérgicos y el parasimpático transmiten estímulos vasodilatadores, mientras que los receptores alfadrenérgicos provocan respuestas vasoconstrictoras. Sin embargo, la regulación del tono arterial es fundamentalmente metabólica a través de mediadores como la adenosina, que se libera en respuesta a un aumento del trabajo del miocardio o a la isquemia y determina una vasodilatación arterial y un aumento del flujo coronario. Así pues, los cambios en el tono simpático o parasimpático tienen menor importancia en la regulación de la circulación coronaria normal, que cuenta con la propiedad de equilibrar de manera constante las demandas y el aporte de oxígeno. Recientemente se ha destacado el papel del endotelio vascular en la regulación del flujo coronario; el endotelio normal libera sustancias vasoactivas, como la PGI2, el óxido nítrico y las endotelinas.
El óxido nítrico, que es un potente vasodilatador y antiagregante plaquetario, se libera en respuesta a múltiples sustancias, como la acetilcolina o la serotonina; igualmente, cuando aumenta la velocidad del flujo sanguíneo en respuesta a un aumento del consumo de oxígeno, el endotelio libera óxido nítrico, lo que favorece la vasodilatación coronaria y el aumento normal del flujo. Se ha demostrado disfunción endotelial coronaria en pacientes con aterosclerosis, incluso en las arterias que aparecen normales en la angiografía; esta disfunción parece guardar una relación directa con la presencia y la gravedad de los factores de riesgo coronario. Como consecuencia de la disfunción endotelial, estos pacientes muestran una respuesta vasoconstrictora durante el ejercicio o la administración de acetilcolina. La insuficiencia coronaria puede definirse como un desequilibrio entre la oferta coronaria y la demanda miocárdica de oxígeno. Las causas de insuficiencia coronaria son múltiples, pero todas ellas actúan a través de dos mecanismos, el aumento desproporcionado de las necesidades miocárdicas de oxígeno en presencia de un árbol coronario normal o una reducción del flujo sanguíneo por afectación de los vasos coronarios. La estenosis aórtica, la hipertensión arterial y la miocardiopatía hipertrófica pueden determinar un aumento considerable de la masa miocárdica, y en consecuencia del consumo de oxígeno, provocando insuficiencia coronaria incluso cuando las arterias coronarias son normales.
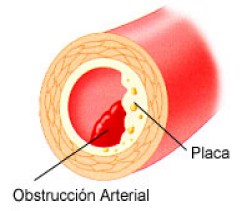
La frecuencia de la estenosis aórtica degenerativa o senil ha crecido en los últimos años con el envejecimiento de la población y debe tenerse en cuenta en el diagnóstico diferencial de la angina de pecho de los ancianos. De cualquier forma, el mecanismo más frecuente de isquemia es la reducción del flujo por una disminución u obstrucción de la luz arterial. Una estenosis puede reducir el área transversal del vaso hasta un 80% sin que disminuya el flujo sanguíneo a dicha zona, siempre que el paciente permanezca en reposo y las demandas de oxígeno por parte del miocardio no sean excesivas. Sin embargo, cuando los requerimientos de oxígeno aumentan, el flujo no puede hacerlo proporcionalmente a través de la estenosis y se produce una situación de déficit e isquemia. Cuando la reducción de la luz es mayor y el área resultante es inferior al 20%, el flujo arterial coronario en esta zona será insuficiente incluso en condiciones de reposo. La causa más frecuente de insuficiencia coronaria es la reducción del flujo sanguíneo por lesiones aterosclerosas de las grandes arterias epicárdicas coronarias. Con menor frecuencia, la disminución del flujo se debe al espasmo, que puede localizarse en una placa aterosclerosa o, incluso, en arterias angiográficamente normales. La trombosis coronaria es una causa común de oclusión total de la arteria, y aunque en ocasiones puede producirse en un vaso libre de lesiones, los trombos se injertan en general sobre placas aterosclerosas obstructivas. Otras causas menos frecuentes de isquemia coronaria son las embolias, la disección espontánea, la enfermedad de los pequeños vasos y la arteritis.
Cuando el flujo coronario se modifica en cantidad o calidad, producto determinados factores que serán expuestos posteriormente, sin satisfacer las necesidades orgánicas, existiendo una desproporción entre el riego sanguíneo y las necesidades de sangre, y por ende, de oxígeno, por parte del miocardio, estamos hablando de una insuficiencia coronaria.
Factores que provocan Insuficiencia coronaria
La insuficiencia coronaria es un trastorno fisiológico debido a un riego sanguíneo coronario inadecuado, que debe depender del flujo coronario, de un aumento del volumen de trabajo de corazón, de una disminución del contenido de oxigeno de la sangre o de una combinación de estos factores.
Estos factores que conducen a la insuficiencia coronaria pueden agruparse de la siguiente forma:
1. Obstáculos mecánicos al flujo coronario
- Arteriosclerosis
- Absceso ateromatoso
- Hematoma intraparietal
- Calcificación de la capa media con degeneración de la intima
- Factores Inflamatorios
- Sífilis
- Tuberculosis
- Fiebre reumática
- Tromboflebitis obliterante
- Embolia coronaria
- Grasosa
- Gaseosa
- Compresión coronaria
2. Disminución del contenido de oxigeno de la circulación coronaria, con flujo normal
- Anemias
- Intoxicación por CO
- Grandes alturas Ambientes pobres en oxigeno
3. Aumento de las demandas de oxigeno del miocardio
- Hipertensión arterial
- Hipoglicemia
- Embolia pulmonar
- Hipertrofias miocárdicas
De todos los factores antes mencionados la arteriosclerosis es el de más frecuente observación clínica.
Aterosclerosis
La aterosclerosis es una enfermedad generalizada que se caracteriza por la formación de placas de ateromas en la pared de las arterias de tamaño grande o intermedio. En el desarrollo de las placas de ateroma contribuyen los siguientes procesos: acumulación de macrófagos y linfocitos, proliferación de las células musculares lisas, formación y acumulación de colágeno, fibras elásticas y en general tejido fibroso, y, por último, depósito intracelular y extracelular de lípidos.
La formación de las placas ateromatosas se explica hoy por la denominada teoría de la respuesta a la lesión. Según ésta, la alteración en el patrón del flujo arterial en ciertos puntos del árbol arterial, como las bifurcaciones, puede provocar lesiones mínimas en el endotelio que, aunque no afectan su morfología, pueden alterar su permeabilidad o su capacidad para liberar sustancias antitrombóticas o vasoactivas. Esta lesión puede potenciarse por la presencia de hipercolesterolemia, hipertensión o sustancias irritantes como las derivadas el tabaco. La lesión provoca un aumento de la permeabilidad frente a los lípidos y la adherencia al endotelio de monocitos que emigran al subendotelio donde se transforman en macrófagos que acumulan lípidos en su interior y adquieren aspecto de células espumosas. Esta constituye la lesión inicial de la aterosclerosis, denominada estría grasa y puede observarse ya en la primera década de la vida. La lesión contiene además fibras musculares lisas con lípidos en su interior y linfocitos T. La liberación de ciertas sustancias tóxicas por los macrófagos puede producir una lesión más grave del endotelio, lo que favorece la adherencia plaquetaria; macrófagos y plaquetas liberan además factores de crecimiento, que promueven la proliferación y migración de las células musculares lisas desde la media y la formación de una lesión más avanzada que se denomina placa fibrosa.
La placa fibrosa es también una lesión excéntrica de la íntima que puede protruir hacia la luz del vaso y reducirla. Está cubierta por una capa fibrosa constituida por células musculares lisas y una matriz de colágeno. Por debajo, la composición de la placa es variable, con mayor o menor participación de lípidos, células musculares, macrófagos y un núcleo de material necrótico constituido por restos celulares, lípidos, cristales de colesterol y calcio. La cubierta de las placas con alto contenido lipídico tiene tendencia a fisurarse, denominándose entonces placa complicada, que facilita la adherencia plaquetaria y la trombosis. Dependiendo del grado de fisuración, la trombosis puede ocluir total o sólo parcialmente la luz del vaso; en este último caso, el trombo se organiza e incorpora a la placa, creciendo ésta y aumentando el grado de estenosis que produce.
Factores de riesgo.
Las investigaciones epidemiológicas sobre la aterosclerosis han sido muy numerosas durante los últimos 30 años y han demostrado que en los pacientes con enfermedad coronaria se presentan, con mayor frecuencia que en la población general, una serie de signos biológicos y hábitos adquiridos. Estos rasgos se denominan factores de riesgo coronario y su presencia en un individuo determinado aumenta la probabilidad de que éste padezca la enfermedad. Los más importantes, además de la edad y el sexo, son el tabaco, la hipertensión arterial y la dislipemia. La incidencia de cardiopatía isquémica aumenta con la edad, siendo máxima entre los 50 y los 65 años y excepcional antes de los 35. Afecta en mayor grado el sexo masculino, de manera que en el grupo de edad inferior a 45 años es 10 veces más frecuente en los varones que en las mujeres; entre los 45 y los 60 años, 2 veces más en los varones, y en edades superiores tiende a igualarse. La menopausia y el uso de anticonceptivos orales aumentan el riesgo de enfermedad coronaria; estos últimos, que tienden a elevar la presión arterial y las lipoproteínas séricas, han demostrado una fuerte interacción con otros factores de riesgo, en particular el tabaco.
Tabaco. Múltiples estudios epidemiológicos han demostrado claramente que el consumo de cigarrillos aumenta el riesgo de cáncer de pulmón, enfermedad vascular periférica, infarto de miocardio y muerte súbita. Dicho riesgo guarda relación con el número de cigarrillos, la precocidad del hábito y el tipo de tabaco, siendo inferior en los fumadores de pipa o cigarros. Cuando se abandona el hábito tabáquico, el riesgo de enfermedad coronaria decrece en un 50% durante el primer año y se aproxima al de los no fumadores al cabo de 2-10 años. Los mecanismos a través de los cuales el tabaco favorece la aterogénesis son la lesión del endotelio por el monóxido de carbono circulante. Otros efectos del humo del tabaco son el aumento del fibrinógeno, una reducción de la fibrinólisis, el aumento de la concentración plasmática de lípidos y el incremento de la agregación plaquetaria, provocada probablemente por un aumento de los niveles de catecolaminas circulantes.
Hipertensión arterial. Las cifras de presión arterial, tanto sistólicas como diastólicas, se correlacionan con la incidencia de enfermedad coronaria y de accidentes vasculares cerebrales.
El riesgo aumenta de forma continua a lo largo del rango de presiones, de forma que los individuos con hipertensión arterial límite o fronteriza tienen un riesgo algo superior al de los normotensos. Algunos estudios han mostrado una reducción en la incidencia de accidentes coronarios, enfermedad cerebrovascular e insuficiencia cardíaca con el tratamiento antihipertensivo. Este factor de riesgo al parecer actúa a través de una lesión de la pared arterial y favoreciendo su permeabilidad a los lípidos.
Hiperlipemia. La correlación entre el colesterol sérico y la incidencia de cardiopatía coronaria es evidente a partir de los estudios epidemiológicos y de ciertas investigaciones experimentales que demuestran la posibilidad de provocar aterosclerosis en algunas especies animales aumentando el contenido en grasa de la dieta. El valor predictivo del colesterol desaparece con la edad y es escaso con cifras inferiores a 220 mg/dL; no obstante, actualmente se recomienda la cifra de 200 mg/dL como límite superior de la normalidad. Por el contrario, existe una buena correlación entre el colesterol de las lipoproteínas de baja densidad (LDL) y la incidencia de coronariopatía, así como una relación inversa entre ésta y las lipoproteínas de alta densidad (HDL), relación que se mantiene de forma independiente de la edad. El nexo entre la hipertrigliceridemia y la enfermedad coronaria no parece totalmente establecido y los estudios muestran resultados dispares. En los estudios epidemiológicos se ha observado también una buena correlación entre la ingesta de colesterol en la dieta, los niveles de colesterol sérico y la prevalencia de enfermedad coronaria. La reducción de la proporción de grasas saturadas de la dieta parece, pues, aconsejable en los individuos con cifras de colesterol superiores a 220 mg/dL. Algunas enfermedades que cursan con una alteración de los lípidos se acompañan de una incidencia elevada de aterosclerosis, como sucede en la hipercolesterolemia familiar o, en menor grado, en el mixedema. Los tres factores citados, tabaco, hipertensión y dislipemia, contribuyen de forma independiente al riesgo de presentar enfermedad coronaria; el aumento moderado de dos o tres de estos factores supone un riesgo similar al de una hipercolesterolemia o una hipertensión arterial graves. En la práctica diaria son más frecuentes los aumentos moderados, y debe actuarse sobre ellos si se desea reducir la incidencia de infarto de miocardio y en general de enfermedad coronaria.
Predisposición familiar. La enfermedad se presenta con mayor frecuencia en ciertas familias, cuyos miembros son afectados incluso durante la juventud. Los factores genéticos y familiares pueden actuar a través de otros factores de riesgo: hiperlipemia familiar, diabetes, incidencia familiar de hipertensión arterial. No obstante, es posible que exista una predisposición hereditaria independiente de estos factores.
Diabetes. La incidencia de enfermedad coronaria y de vasculopatía periférica se halla elevada en los diabéticos y en los pacientes con una curva de glucemia (prueba de tolerancia a la glucosa) anormal. Así, en las mujeres la diabetes triplica la incidencia de cardiopatía coronaria e iguala el riesgo al de los varones no diabéticos. Esta enfermedad determina una elevación de los lípidos sanguíneos y una mayor concentración de glucosaminoglicanos en la íntima arterial. La hiperglucemia contribuye de forma independiente al riesgo y sus efectos se suman a los de los otros factores de riesgo, lo que obliga a corregirlos con energía en cualquier paciente diabético.
Obesidad. Aunque la asociación entre obesidad y enfermedad coronaria parece clara, especialmente antes de los 50 años de edad, se duda de que el exceso de peso constituya un factor de riesgo independiente. Probablemente, este aumento del riesgo se explique a través de otros factores, como la hipertensión y la dislipemia, que a menudo acompañan al exceso de peso. Todo ello no niega la importancia de corregir la obesidad en los pacientes coronarios.
Sedentarismo. Existen indicios de que el ejercicio físico moderado ejerce cierto efecto protector y se ha considerado que una vida sedentaria es un factor de riesgo coronario independiente. El ejercicio eleva las HDL, cuyos niveles se correlacionan de forma inversa con la incidencia de enfermedad coronaria. Los estudios son contradictorios, ya que el sedentarismo se asocia a la obesidad, la dislipemia y el tabaquismo, lo que impide conocer la contribución de cada uno de ellos al riesgo. De cualquier forma, el ejercicio moderado es una medida aconsejable en los pacientes coronarios y contribuye al mejor control de otros factores citados.
Patrón de conducta. Durante los últimos 10 años se ha especulado sobre la posibilidad de que los enfermos coronarios presenten ciertos rasgos de conducta particulares. FRIEDMAN y ROSEMAN denominaron patrón tipo A al de los individuos con mayores grados de hostilidad, agresividad, competitividad y sentido de urgencia del tiempo, y le atribuyeron la naturaleza de factor de riesgo coronario a esta forma de conducta; su importancia está en discusión.
Otros factores de riesgo. Además de los ya mencionados, se han descrito otros muchos factores cuya asociación con la enfermedad coronaria no se ha confirmado o es todavía motivo de discusión. Así, se ha señalado que la hiperuricemia, el consumo de azúcar refinado, alcohol y café, el estrés y la escasa dureza del agua aumentarían la probabilidad de padecer cardiopatía isquémica; su importancia es, en todo caso, relativa e incomparablemente menor que la del tabaco, la hipertensión y la dislipemia.
Espasmo coronario
Como ya se ha indicado, en condiciones normales las arterias coronarias epicárdicas apenas ofrecen resistencia al flujo sanguíneo. Sin embargo, estos vasos no son tubos rígidos, sino que cuentan con actividad espontánea y su tono varía por la influencia de estímulos nerviosos o farmacológicos. Estos cambios en el tono arterial son insuficientes para comprometer el flujo coronario, excepto cuando el calibre del vaso está reducido por lesiones aterosclerosas graves. En algunos pacientes, las arterias coronarias desarrollan espasmos que pueden reducir e incluso interrumpir de manera transitoria el aporte de sangre a una zona del miocardio. El espasmo es una disminución localizada del diámetro del vaso, diferente del aumento generalizado del tono arterial antes mencionado. Con frecuencia ocurre sobre una placa de ateroma, y sólo el 10% de los pacientes en quienes se sospecha angina de pecho vasospástica tienen coronarias angiográficamente normales. No se conoce con exactitud el mecanismo responsable del espasmo; se ha señalado que la aterosclerosis determinaría una reactividad especial de las arterias que facilitaría el espasmo. De igual forma se han sugerido mecanismos adrenérgicos y parasimpáticos, un aumento de la respuesta a la serotonina o la histamina y alteraciones de las prostaglandinas y del transporte de calcio en las células musculares de la pared vascular por cambios en la concentración de los iones hidrógeno; ninguna de estas teorías parece explicar todos los casos de espasmo coronario. Recientemente se ha demostrado que la inhalación de cocaína puede provocar espasmo coronario, isquemia e incluso necrosis miocárdica.
Trombosis coronaria
Con frecuencia, la íntima arterial presenta lesiones en la placa de ateroma que favorecen la formación de trombos; durante las primeras fases de la evolución de la placa –cuando su tamaño no es excesivo– no comprometen en exceso la luz arterial y no modifican el grado de isquemia preexistente; de esta forma, el trombo se incorpora y la placa crece sin que se traduzca en un cuadro clínico definido. No obstante, si la luz del vaso ya está reducida inicialmente, un trombo puede alterar el equilibrio, desencadenar la isquemia y, en consecuencia, agravar el cuadro clínico. Si la obstrucción que produce es total y no existe circulación colateral a la zona o ésta es insuficiente, sobrevendrá la necrosis del miocardio. Así pues, la trombosis coronaria es la causa de gran parte de los infartos de miocardio y de un número apreciable de casos de angina inestable. Disfunción endotelial. Síndrome X El endotelio desempeña un papel esencial en la regulación del tono arterial coronario. Diferentes situaciones clínicas, entre las que se incluyen la hipertensión y la hipercolesterolemia, pueden reducir la capacidad del endotelio para generar óxido nítrico y, en consecuencia, limitar la respuesta vasodilatadora de los vasos coronarios, tanto epicárdicos como prearteriolas. Se ha sugerido que este mecanismo puede ser responsable de la isquemia miocárdica en los pacientes con angina de pecho y arterias coronarias angiográficamente normales, el denominado síndrome X o angina microvascular. Idéntico mecanismo se ha invocado para explicar la isquemia miocárdica en pacientes posmenopáusicas con arterias coronarias normales y deficiencia de estrógenos.
Otras causas de isquemia miocárdica
En ocasiones, otras situaciones diferentes a la aterosclerosis o al espasmo pueden provocar isquemia y originar un cuadro clínico (angina, infarto de miocardio, muerte súbita) similar al de aquéllas. Estas causas poco frecuentes deben sospecharse en pacientes adolescentes o jóvenes, sin factores de riesgo coronario o con enfermedades generalizadas que afectan el sistema arterial. Las más frecuentes son las malformaciones congénitas de las arterias coronarias, la disección espontánea de éstas (suele ocurrir durante el embarazo), las vasculitis (poliarteritis nudosa, Wegener, Takayasu) y enfermedades metabólicas (amiloidosis). Consecuencias y manifestaciones clínicas de la isquemia miocárdica.
La isquemia provoca la liberación celular de sustancias como la serotonina, la histamina o la bradicinina y permite la acumulación de metabolitos ácidos y de potasio; se cree que alguna de estas sustancias estimula las terminaciones nerviosas y provoca el dolor característico de la isquemia miocárdica. La deprivación de oxígeno y nutrientes producida por la isquemia crónica determina una reducción de los fosfatos de alta energía y una disminución de la capacidad contráctil del miocardio (miocardio hibernado). Incluso una isquemia transitoria de unos minutos de duración puede causar un trastorno metabólico y una depresión de la contractilidad prolongados que no se recuperan hasta transcurrida una semana (miocardio “aturdido”). La isquemia altera igualmente las propiedades elásticas del miocardio originando una disfunción diastólica. Otra consecuencia de la isquemia es la alteración de las propiedades eléctricas de las células cardíacas, al reducir la energía necesaria para el funcionamiento de la bomba de sodio; esta alteración eléctrica provoca a menudo arritmias cardíacas que pueden ser letales. Por último, la disminución del flujo coronario puede ser tan profunda que determine la muerte celular o necrosis miocárdica. Así pues, el dolor coronario (angina de pecho), la insuficiencia cardíaca, las arritmias o la necrosis (infarto de miocardio) son consecuencias de la isquemia y constituyen las formas de presentación habituales de la cardiopatía coronaria. En un paciente determinado, la enfermedad puede comenzar con cualquiera de ellas, y es habitual que en su evolución estén presentes más de una. La angina de pecho es la forma inicial de presentación en aproximadamente el 45% de los pacientes, el infarto de miocardio en el 42% y la muerte súbita en el 13%.
Consecuencias de la Insuficiencia coronaria
La insuficiencia coronaria se expresa o manifiesta de diferentes formas, algunas de las cuales pueden coincidir o no en un mismo sujeto. Las mas habituales son:
1. Angina de pecho
2. Preinfarto
3. Infarto cardiaco
4. Insuficiencia ventricular izquierda
5. Insuficiencia cardiaca global
6. Trastornos de la conducción y el ritmo
7. Muerte súbita
Angina de pecho
La angina se define como el dolor, opresión o malestar, por lo general torácico, atribuible a la isquemia miocárdica transitoria. Es un concepto exclusivamente clínico y su diagnóstico se basa en las características y circunstancias que acompañan el dolor. El mecanismo que provoca la isquemia no siempre es el mismo; con frecuencia se trata de un aumento de las necesidades de oxígeno, provocado por los cambios en la presión arterial y la frecuencia cardíaca (ejercicio y emociones), en un paciente con lesiones aterosclerosas coronarias, mientras que en otras ocasiones el dolor sobreviene sin causa aparente, sugiriendo que se ha producido una reducción espontánea del aporte de oxígeno.
Diagnóstico. Como ya se ha mencionado, la angina es un concepto clínico y su diagnóstico se basa fundamentalmente en el interrogatorio del dolor. Cuando las características de éste sugieren su origen coronario, es necesario establecer el tipo de angina y, en consecuencia, la urgencia del tratamiento, así como las exploraciones indicadas para confirmar el diagnóstico. Las características que definen el dolor coronario son: el tipo, la localización, la irradiación, la duración, los factores desencadenantes y las circunstancias que lo alivian. En su forma habitual, los pacientes describen el dolor anginoso como una opresión, un peso o una sensación urente, localizado en la región retrosternal o en toda la cara anterior del tórax e irradiado hacia los brazos, el cuello o la mandíbula. Las excepciones a esta descripción son numerosas; en ocasiones se trata de una molestia indefinida que dificulta la respiración o bien se localiza exclusivamente en el cuello, la mandíbula, los brazos o incluso en las muñecas. Los episodios de angina suelen iniciarse de forma gradual, alcanzan pronto su máxima intensidad y desaparecen también de forma paulatina en 1-10 min. En la angina de esfuerzo clásica, los síntomas presentan una clara relación con el ejercicio, en especial si éste se realiza tras las comidas o en un ambiente frío; las emociones pueden asimismo desencadenar la crisis. El cese de la actividad que provocó el dolor, el reposo o la administración de nitroglicerina sublingual determinan rápidamente su desaparición, excepto en algunas formas de angina (prolongada) en las que puede durar más de 30 min. Un dolor de menos de 30 seg de duración o continuo durante todo el día rara vez es de origen coronario. La frecuencia con que la angina se presenta de forma atípica y el gran número de enfermedades que se manifiestan por dolor torácico exigen un diagnóstico diferencial cuidadoso y, a menudo, difícil. Los dolores punzantes, fugaces y localizados en el precordio suelen ser de origen psíquico. El dolor de la disección aórtica, del neumotórax y, en general, de los procesos que cursan con rotura o laceración de los tejidos comienza de forma brusca y su intensidad es máxima desde el principio. Las circunstancias y los síntomas que acompañan al dolor son muy útiles en el diagnóstico diferencial. La relación con la ingesta de alimentos o la mejoría con alcalinos orientarán hacia un problema digestivo; los cambios de intensidad con los movimientos de los miembros superiores o el cuello y con la respiración o la posición corporal sugieren una radiculitis cervical o una pericarditis, respectivamente. Por el contrario, el dolor anginoso suele acompañarse de una sensación de angustia y gravedad y, en ocasiones, de sudación y palpitaciones. La disnea durante el dolor no es frecuente, pero su aparición indica una afección coronaria grave y es un signo de mal pronóstico. La presencia de un dolor localizado en la parte superior del tronco durante el ejercicio obliga a pensar en la enfermedad coronaria como causa de aquél.
Clasificación. Las circunstancias en que aparece el dolor anginoso indican en líneas generales el mecanismo que lo provoca y, a su vez, el conocimiento de éste permite individualizar el tratamiento. Atendiendo a estos criterios, se han propuesto diferentes clasificaciones. La Sociedad Española de Cardiología distingue tres tipos de angina: angina de esfuerzo, de reposo y mixta.
La angina de esfuerzo es provocada por la actividad física o por otras situaciones que implican un aumento de la demanda miocárdica de oxígeno. Suele ser breve y desaparecer al interrumpir el ejercicio o con la administración de nitroglicerina. Se denomina inicial si su antigüedad es inferior a un mes, progresiva si ha empeorado durante el último mes en cuanto a frecuencia, intensidad, duración o nivel de esfuerzo en que aparece, y, finalmente, estable si sus características y la capacidad funcional del paciente no se han modificado en el último mes. La angina de reposo se produce de manera espontánea, sin relación aparente con los cambios en el consumo de oxígeno del miocardio; su duración es variable y en ocasiones los episodios son muy prolongados y el cuadro simula un infarto de miocardio. La angina variante, vasospástica o angina de Prinzmetal es una variedad de la angina de reposo, caracterizada por una elevación transitoria del segmento ST del ECG durante las crisis. La angina mixta es aquella en la que coexisten la angina de esfuerzo y la de reposo, sin un claro predominio de una de ellas.
La angina inicial, la progresiva y la de reposo son formas de evolución imprevisible y pronóstico variable, por lo que se agrupan bajo la denominación de angina inestable. Su tratamiento difiere en forma considerable del de la angina de esfuerzo estable, por lo que se estudian por separado.
Angina estable
Diagnóstico. El diagnóstico de la angina de esfuerzo estable se realiza por la relación entre el dolor coronario y el ejercicio. En general, el nivel de esfuerzo necesario para provocar la angina, o umbral de la angina, es constante durante largos períodos de tiempo, de forma que el paciente suele conocer de antemano qué actividades de su vida diaria la provocarán. En algunos casos, no obstante, el umbral puede variar a lo largo del día y presentarse el dolor con los primeros esfuerzos de la mañana, mientras que después se toleran ejercicios más vigorosos. Se admite que, en estos casos, los cambios en el tono arterial coronario modifican el grado de estenosis y, por tanto, la capacidad de esfuerzo. Según su gravedad y la limitación funcional que impone al paciente, la angina de esfuerzo se divide en cuatro grados siguiendo la clasificación de la Canadian Cardiovascular Society:
Grado I. La actividad física no causa dolor; éste aparece con los esfuerzos extenuantes, rápidos o prolongados.
Grado II. Limitación leve de la actividad física; el dolor aparece al caminar con paso normal dos o más travesías o subir más de un piso.
Grado III. Limitación importante de la capacidad funcional; el dolor se presenta al subir un piso o caminar con paso normal una travesía.
Grado IV. Incapacidad para llevar a cabo cualquier actividad física sin la aparición de angina; el dolor puede aparecer en reposo.
Exploración física. La exploración es con frecuencia normal, en especial una vez que ha pasado la crisis; una exploración cuidadosa permite descartar otras posibles causas de dolor torácico y detectar factores de riesgo coronario. Durante el acceso de angina el paciente puede aparecer pálido y con diaforesis. La frecuencia del pulso suele encontrarse aumentada, al igual que la presión arterial; la palpación del precordio puede revelar un doble impulso apical. La auscultación cardíaca puede ser normal, pero a menudo se ausculta un cuarto ruido y, con menor frecuencia, un soplo sistólico de insuficiencia mitral por disfunción transitoria del músculo papilar, un desdoblamiento paradójico del segundo ruido o un tercer ruido. La presencia de hipotensión arterial e insuficiencia cardíaca durante las crisis anginosas se ha señalado como signo de gravedad y con frecuencia se asocia a lesiones aterosclerosas coronarias graves e, incluso, afección del tronco principal de la coronaria izquierda, con isquemia de una amplia zona de miocardio. Todos estos signos remiten al desaparecer el dolor.
Electrocardiograma. Aproximadamente el 50% de los pacientes con angina crónica tienen un ECG normal durante el reposo y en ausencia de dolor; el resto puede mostrar los signos electrocardiográficos de un infarto de miocardio antiguo, una depresión del segmento ST o cambios isquémicos de la onda T. En algunos casos se añaden además signos de hipertrofia ventricular secundaria a hipertensión arterial, bloqueos de rama, etc. El registro del ECG durante la crisis de dolor es de gran utilidad; en estas circunstancias es frecuente la aparición de una depresión del segmento ST, cambios en el voltaje y polaridad de la onda T y, más rara vez, bloqueos de rama o trastornos del ritmo. Un ECG basal normal no permite descartar la enfermedad coronaria (un error frecuente en la práctica diaria); incluso durante las crisis anginosas el ECG puede permanecer sin cambios o presentar signos inespecíficos, si bien estos casos son poco frecuentes.
Ergometría. La prueba de esfuerzo estudia la respuesta clínica y electrocardiográfica a un ejercicio físico programado; constituye una prueba fundamental para el diagnóstico del paciente coronario y, además, proporciona datos sobre su pronóstico y capacidad funcional (véase Prueba de esfuerzo). La prueba de esfuerzo se considera positiva si provoca dolor o el segmento ST desciende al menos 1 mm (medido 0,08 seg después del punto J), adoptando una forma horizontal. La sensibilidad de esta técnica para diagnosticar enfermedad coronaria es del 60% y su especificidad del 90%. La prueba de esfuerzo se utilizó inicialmente con fines diagnósticos; así, está indicada en los siguientes casos:
a) pacientes con dolor anginoso típico y ECG de reposo normal;
b) presencia de dolores atípicos pero sospechosos de ser coronarios, y
c) pacientes con ECG anormal pero sin angina. En los últimos años se ha empleado para valorar la capacidad funcional de los enfermos y su pronóstico. En los pacientes con angina estable se consideran signos de mal pronóstico la aparición precoz (menos de 6 min) de angina o cambios del segmento ST, la depresión de éste superior a 2 mm, la incapacidad para realizar un esfuerzo superior a 5 METS y el descenso de la presión arterial durante el esfuerzo. También resulta extraordinariamente útil para evaluar la respuesta al tratamiento; por todo ello una prueba de esfuerzo es obligada en todo paciente coronario.
Estudios radioisotópicos. La prueba de esfuerzo convencional tiene una sensibilidad y una especificidad limitadas para el diagnóstico de insuficiencia coronaria; la utilización simultánea de la gammagrafía con talio-201 o isonitrilos mejora el valor diagnóstico de la prueba (véase Cardiología nuclear). Cuando el flujo coronario es normal, el radioisótopo se distribuye de forma uniforme; si, por el contrario, la perfusión está reducida en un área del miocardio, la gammagrafía muestra un defecto o “zona fría” que permite localizar la zona isquémica. La sensibilidad y la especificidad de la prueba de esfuerzo combinada con la gammagrafía con talio alcanzan el 80 y el 90%, respectivamente. Por su mayor coste debe reservarse para los casos en que la prueba de esfuerzo no es concluyente, es decir, pacientes con angina típica y prueba de esfuerzo normal y enfermos con alteraciones basales del ECG que impiden su interpretación [bloqueo de rama, síndrome de Wolff-Parkinson-White (WPW)]. La ventriculografía con 99mTc se utiliza para el análisis incruento de la función ventricular tras el infarto de miocardio o en cualquier otra situación en que se sospecha la presencia de disfunción ventricular. Además, la disminución de la fracción de eyección durante el ejercicio es también un signo útil en el diagnóstico del enfermo coronario.
Ecocardiografía (véase Ecocardiografía-Doppler). El ecocardiograma constituye un método sensible e incruento para el diagnóstico de los defectos segmentarios de la contractilidad y la evaluación global de la función ventricular. De esta forma, el ecocardiograma es fundamental en el diagnóstico y la evaluación de los pacientes con infarto de miocardio. Además, se está utilizando en combinación con la prueba de esfuerzo para el diagnóstico de la isquemia miocárdica (ecocardiografía de estrés). Para ello, se valoran las alteraciones segmentarias de la contracción ventricular que aparecen durante el ejercicio como consecuencia de la isquemia. Aproximadamente en el 80% de los casos se consiguen imágenes adecuadas para el diagnóstico; la sensibilidad de esta técnica la acumulación de metabolitos ácidos y de potasio; se cree para el diagnóstico de isquemia es del 75-90%. En los casos en que el paciente es incapaz de realizar un esfuerzo suficiente se utiliza el ecocardiograma en combinación con el dipiridamol, de forma similar a la descrita para el talio.
Cateterismo cardíaco. Coronariografía. Mediante la opacificación del ventrículo izquierdo y de las arterias coronarias, el cateterismo cardíaco permite el análisis de la función ventricular y el conocimiento del grado y la extensión de las lesiones coronarias (véase Métodos cruentos de exploración cardíaca). Así pues, las indicaciones principales de esta técnica son dos:
1. El diagnóstico de la enfermedad en pacientes con un cuadro clínico y exploraciones incruentas dudoso o contradictorio.
2. El diagnóstico de la localización de las estenosis coronarias en pacientes en los que está indicada la revascularización (los que no responden al tratamiento médico o tienen signos clínicos de mal pronóstico). En ocasiones puede utilizarse para evaluar el pronóstico de un paciente determinado; de cualquier forma es una exploración que entraña cierto riesgo, por lo que debe emplearse de forma selectiva y no indiscriminada. El grado de afectación coronaria observado durante la coronariografía en las diferentes series de angina estable publicadas varía ligeramente; en general, existe una proporción similar (25%) de pacientes con estenosis en una, dos o las tres arterias coronarias principales. El 5-10% muestra lesiones coronarias no obstructivas e incluso puede tener un árbol coronario angiográficamente normal. Existen algunas diferencias entre sexos; las mujeres tienen mayor prevalencia de coronarias normales, mientras que las lesiones del tronco común de la coronaria izquierda son 6 veces más frecuentes en los varones. La función ventricular es normal en la mayoría de los pacientes con angina estable y sin antecedentes de infarto de miocardio. Durante la angina provocada mediante estimulación auricular rápida con un marcapasos pueden evidenciarse alteraciones segmentarias de la motilidad que reflejan isquemia miocárdica.
Evolución y pronóstico.
El pronóstico de los pacientes con angina estable, y en general del enfermo coronario, depende del estado de la función ventricular y de la extensión de las lesiones coronarias. Aproximadamente un tercio de los pacientes con angina de esfuerzo de comienzo reciente quedan libres de síntomas de forma espontánea. En el estudio de Framingham, la mortalidad anual en la angina crónica estable fue del 4%. El sexo maculino, el antecedente de hipertensión y la presencia de arritmias se asocian a un mal pronóstico. Asimismo, la insuficiencia cardíaca ocasiona una elevada mortalidad, próxima al 12% anual. Otro factor de riesgo es la presencia de depresión del segmento ST en el ECG basal. Por último, los pacientes con pruebas de esfuerzo positivas a cargas bajas (5 METS) o a frecuencias cardíacas inferiores a 120 at/min tienen una mortalidad del 15-20% anual y constituyen un grupo de alto riesgo en el que son frecuentes las lesiones del tronco común de la coronaria izquierda. Los pacientes de estos grupos de mal pronóstico deben referirse para cateterismo cardíaco y revascularización coronaria. Como ya se ha mencionado, la coronariografía permite una evaluación más precisa del pronóstico. Los enfermos con lesiones en un solo vaso coronario y función ventricular normal tienen una mortalidad anual del 0,6%, que asciende al 3,5% si la función ventricular es anormal. Estas cifras son, respectivamente, del ,6 5,6% para los pacientes con afección de dos vasos, del 3,6 y 11% para los de tres y del 10 y 25% para los que presentan afección del tronco común de la coronaria izquierda.
Tratamiento.
1. Medidas generales. Aliviar el dolor anginoso, prevenir nuevas crisis e interrumpir el progreso de la aterosclerosis coronaria constituyen los tres objetivos principales del tratamiento de la angina estable. Como en todo paciente coronario, el primer paso debe ser el control de los factores de riesgo, fundamentalmente el de la hipertensión arterial, el abandono del tabaco y la modificación de la dieta, que consiste en reducir el aporte de grasas y moderar el consumo de café y alcohol. Además, deben corregirse, cuando existen, situaciones como la anemia o la hipoxemia, que favorecen la aparición de isquemia. La educación del paciente ocupa un lugar importante en esta enfermedad; es imprescindible informarle de su naturaleza e infundirle confianza, animándolo a desarrollar una vida normal; casi todos los pacientes con angina crónica pueden permanecer activos laboralmente, excepto los que desarrollan oficios especiales, como pilotos o conductores, o trabajos que requieren un esfuerzo físico muy intenso. El paciente debe conocer los esfuerzos y las situaciones que le provocan angina para evitarlos, así como la importancia de no realizar actividades físicas intensas tras las comidas, con tiempo frío o durante una situación de estrés. Por el contrario, se le debe recomendar que practique regularmente ejercicio, de acuerdo con su sintomatología; en general, caminar 4-6 km diarios es una medida prudente, pero algunos enfermos poco sintomáticos pueden realizar otros deportes como ciclismo o tenis, siempre no competitivos y sin que le causen estrés o les provoquen molestias. Los ejercicios isométricos deben desaconsejarse.
2. Tratamiento farmacológico. Tratamiento de las crisis anginosas. La nitroglicerina sublingual, en forma de comprimidos o aerosol, es el tratamiento de elección de las crisis anginosas y el paciente debe recibir instrucción para utilizarla de forma adecuada. Los nitritos reducen el consumo de oxígeno miocárdico al disminuir el retorno venoso y la poscarga. Al mismo tiempo causan vasodilatación coronaria, un mecanismo que puede ser importante cuando el espasmo desempeña un papel en la producción de la angina. La nitroglicerina debe administrarse tan pronto como aparezca el dolor e, incluso, utilizarse con carácter profiláctico si el paciente ha de realizar un esfuerzo que presumiblemente le ocasionará dolor. El comprimido se fracciona con los dientes y se deja debajo de la lengua, sin deglutir saliva durante unos instantes; cuando se toma por primera vez conviene hacerlo sentado o en decúbito, ya que algunos enfermos experimentan hipotensión y mareos con las dosis habituales (0,3-1 mg). El dolor suele aliviarse rápidamente, en 2-3 min, aunque en ocasiones es necesario administrar 2-3 comprimidos separados por un intervalo de 5 min. Si con estas medidas el dolor no cede, debe sospecharse la posibilidad de un infarto de miocardio. Los efectos más frecuentes tras la administración sublingual de nitratos son las cefaleas y la hipotensión.
Prevención de las crisis de angina. Cuando las crisis ocurren de forma muy aislada o guardan una relación muy estrecha con ciertos esfuerzos –por ejemplo, la angina que ocurre por las mañanas con el primer esfuerzo del día (angina de primo esfuerzo) – pueden controlarse fácilmente con nitratos de acción prolongada. Los preparados más útiles son los de mononitrato de isosorbide por vía oral y la nitroglicerina percutánea. Por el contrario, el dinitrato de isosorbide tiene una biodisponibilidad variable debido a un efecto de primer paso hepático. El principal problema que presentan estos fármacos es el desarrollo de tolerancia, en especial a dosis altas y con administración continuada durante las 24 h del día (parches de nitroglicerina).
En los pacientes con angina de esfuerzo moderada o grave (capacidad funcional grados II a IV), los bloqueadores betadrenérgicos son los fármacos de elección. Su efecto antianginoso se debe a la reducción del consumo de oxígeno provocada por la bradicardia y la disminución de la contractilidad que determinan. Además, los bloqueadores beta aumentan el flujo coronario al alargar la diástole, al mismo tiempo que reducen la taquicardia provocada por el ejercicio y controlan la presión arterial en los pacientes hipertensos. Todos los bloqueadores beta son eficaces en el tratamiento de la angina de esfuerzo, y su elección depende fundamentalmente de la experiencia; en algunos pacientes con asma bronquial o claudicación intermitente se utilizan preferentemente los cardioselectivos, aunque a dosis altas las diferencias entre los distintos tipos de bloqueadores betadrenérgicos se atenúan. Pueden combinarse con los nitratos de acción prolongada o con los antagonistas del calcio, en especial el nifedipino, en las formas rebeldes al tratamiento. Los bloqueadores beta pueden elevar los niveles plasmáticos de triglicéridos y reducir las HDL.
Aproximadamente el 20% de los pacientes con angina no responden a los bloqueadores beta; además, existen múltiples contraindicaciones pulmonares (asma, enfermedad pulmonar crónica), cardíacas (insuficiencia cardíaca, bradicardia), circulatorias (claudicación) y neurológicas (depresión), entre otras. En estos casos los antagonistas del calcio son una buena alternativa, especialmente el verapamilo, que comparte con los bloqueadores beta los efectos bradicardizante e inotrópico negativo. Se ha observado una mejoría clínica, tanto con este fármaco como con el diltiazem y el nifedipino, que se traduce en mayor capacidad de esfuerzo y menor consumo de nitroglicerina. Un estudio reciente ha demostrado que el ácido acetilsalicílico (AAS) a dosis bajas (75 mg/día) en pacientes con angina estable reduce la incidencia de muerte e infarto de miocardio. Parece, pues, razonable aconsejar su administración en estos enfermos.
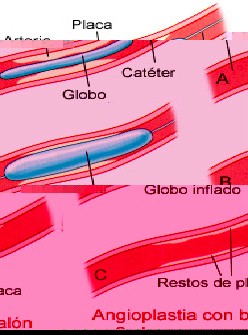
3. Angioplastia coronaria transluminal percutánea (véase Cateterismo terapéutico). En 1978 GRUNTZIG introdujo una nueva forma de tratamiento de la isquemia miocárdica consistente en dilatar la lesión aterosclerosa mediante un catéter con un balón en su extremo. Inicialmente se la consideró una alternativa al tratamiento quirúrgico y, por lo tanto, indicada sólo en los pacientes que no respondían al tratamiento farmacológico. Aunque en líneas generales este concepto continúa siendo válido, los buenos resultados que actualmente se obtienen han ampliado las indicaciones de la angioplastia coronaria. Está contraindicada en pacientes con lesiones difusas y distales o en las localizadas en el tronco común de la coronaria izquierda. En manos experimentadas, el porcentaje de éxitos sobrepasa el 90%, la mortalidad oscila entre el 0,2 y el 0,5%, y el 2,5% de los enfermos requieren revascularización quirúrgica de urgencia. La incidencia de infarto es del 1,5%. En el 30% de los casos se produce una reestenosis durante el primer año.
4. Tratamiento quirúrgico. En los pacientes en los que el tratamiento médico es ineficaz o en aquellos que consideran inaceptable la calidad de vida que éste les proporciona, la cirugía de revascularización mediante injerto venoso aortocoronario o con la arteria mamaria interna consigue a menudo eliminar las crisis anginosas. Así pues, la indicación fundamental de esta cirugía es la angina rebelde al tratamiento farmacológico. Además, se ha demostrado que la cirugía mejora la expectativa de vida en ciertos grupos de pacientes de alto riesgo, fundamentalmente aquellos con enfermedad del tronco común de la coronaria izquierda o afectación de los tres vasos coronarios y también los que presentan los signos clínicos y ergométricos de mal pronóstico antes mencionados. En la angina estable, la mortalidad operatoria oscila entre el 1 y el 3%, excepto para los enfermos con afectación del tronco común, en los que puede elevarse hasta el 10%; la máxima incidencia de infarto peroperatorio aceptable es del 10% y la oclusión de los injertos coronarios no debe sobrepasar el 20% durante el primer año.
Angina inestable
Algunos tipos de angina de pecho se consideran formas inestables de la enfermedad coronaria y su tratamiento difiere sensiblemente del de la angina crónica de esfuerzo. Bajo el término de angina inestable se incluyen los siguientes tipos:
a) angina inicial o de comienzo reciente (duración de los síntomas inferior a un mes)
b) angina de esfuerzo cuyas crisis dolorosas se hacen más frecuentes o de mayor duración, son rebeldes a la nitroglicerina o se presentan con esfuerzos cada vez de menor intensidad (angina progresiva)
c) angina de reposo. El término angina inestable ha desplazado a otras denominaciones, como insuficiencia coronaria aguda, síndrome preinfarto o síndrome intermedio, con las que se designaba hasta hace unos años a estas formas de angina. Indica una situación de evolución imprevisible, sin que ello implique necesariamente mal pronóstico.
Su prevalencia es difícil de establecer, ya que una de sus formas, la angina inicial, pasa con frecuencia inadvertida y no se diagnostica. No obstante, aproximadamente el 20-30%de los ingresos en una unidad coronaria están constituidospor angina inestable; una proporción similar de pacientes operados mediante injerto aortocoronario lo son por este diagnóstico. Desde el punto de vista de su fisiopatología, la angina inestable se interpreta como una fase evolutiva de la enfermedad coronaria. En este sentido, la coronariografía de dichos enfermos muestra con frecuencia lesiones de bordes irregulares e imágenes de trombos intracoronarios, lo que sugiere la existencia de placas ateromatosas complicadas (rotura de la íntima, hemorragias). En algunos pacientes se ha demostrado que el espasmo coronario constituye la causa de las crisis dolorosas; la angina vasospástica o de Prinzmetal constituye un tipo particular de angina y se trata más adelante.
Diagnóstico. Las características del dolor son similares a las de la angina estable y el diagnóstico se establece por los cambios en la frecuencia y en la duración de las crisis o en su falta de relación con el esfuerzo. Las crisis pueden presentarse varias veces al día o ser resistentes a la nitroglicerina, confiriendo un carácter de gravedad al cuadro. La exploración física puede ser normal en ausencia de dolor coronario, mientras que los hallazgos durante las crisis son similares a los descritos para la angina estable: tercero y cuarto ruidos, soplo sistólico de regurgitación mitral y alteraciones de la presión arterial, entre otros. Aunque un ECG normal no excluye el diagnóstico de angina inestable, la mayoría de los pacientes presentan alteraciones de la repolarización, en especial durante las crisis de dolor; en ellas es muy frecuente la depresión del segmento ST, el aplanamiento o la inversión de la onda T, la normalización de una onda T previamente negativa y, en ocasiones, la elevación del segmento ST. Como ya se ha mencionado, la combinación de dolor en reposo, supradesnivel del segmento ST durante las crisis y arritmias caracteriza la angina vasospástica, variante o de Prinzmetal. Aproximadamente en el 8-10% de los enfermos con angina inestable la gammagrafía con pirofosfato de tecnecio es positiva en ausencia de otros signos clínicos, electrocardiográficos o enzimáticos de infarto de miocardio. No obstante, este hallazgo suele interpretarse como sugestivo de una pequeña necrosis sin traducción clínica. La prueba de esfuerzo no está indicada hasta que el paciente se ha estabilizado y las crisis anginosas han desaparecido; en este momento es de gran utilidad para detectar a los pacientes con lesiones coronarias graves candidatos a revascularización miocárdica.
Coronariografía. La coronariografía está indicada en la mayoría de los pacientes con angina inestable. Una excepción la constituyen los enfermos con angina de esfuerzo inicial que se controla rápidamente con el tratamiento y no se acompaña de cambios en el ECG; estos pacientes suelen tener un pronóstico excelente, sobre todo si la prueba de esfuerzo posterior no muestra signos de isquemia grave. Si es posible, el estudio angiográfico debe efectuarse pasados los primeros días y una vez que el dolor se ha controlado; no obstante, si la medicación se muestra ineficaz en las primeras 24-48 h, hay que proceder a su realización. El patrón angiográfico de la angina inestable no difiere, en cuanto a gravedad y distribución de las lesiones, del de la angina estable. Alrededor de un tercio de los enfermos tienen lesiones de una sola arteria coronaria, y un número similar presenta afectación de dos o tres vasos; en el 10% de los casos las coronarias son angiográficamente normales, tratándose de pacientes con angina vasospástica o dolores no coronarios. La prevalencia de lesiones del tronco común de la coronaría izquierda se aproxima al 15%, y en la mayoría de estos casos existen además lesiones de dos o las tres arterias principales. A diferencia de lo que ocurre en los pacientes con angina de esfuerzo estable, las lesiones coronarias aparecenen la angiografía como excéntricas y de bordes irregulares, indicando la presencia de una placa ateromatosa complicada, es decir, con rotura y ulceración de la íntima, hemorragia y, a menudo, trombosis. Evolución y pronóstico. La angina inestable tiene un pronóstico algo peor que la angina crónica de esfuerzo; alrededor del 15-25% de los enfermos padecen un infarto de miocardio durante el año que sigue a la presentación de los síntomas, y el 8-20% fallece durante el mismo período. Además, un número sustancial de ellos requiere cirugía de revascularización para el control de dolor anginoso. El pronóstico durante la fase de hospitalización ha mejorado con la administración de AAS y heparina; la incidencia de muerte o reinfarto con este tratamiento es del 1-3%. Los factores que indican un pronóstico desfavorable son el antecedente de infarto previo, la ausencia de respuesta a la medicación, la recurrencia de las crisis, un ECG basal anormal y la depresión o la elevación del segmento ST durante el dolor, así como la presencia de lesiones en los tres vasos coronarios principales o en el tronco común de la coronaria izquierda. Una prueba de esfuerzo muy positiva una vez pasada la fase de inestabilidad tiene igual significado que en la angina estable.
Tratamiento. Debido a la elevada incidencia de infarto de miocardio y muerte súbita, los pacientes con angina inestable deben ingresarse con la máxima prioridad en la unidad coronaria. El reposo absoluto, la administración de ansiolíticosy el tratamiento de los factores desencadenantes o agravantes (fiebre, infecciones, insuficiencia cardíaca, hipertensión), si los hubiera, constituyen medidas comunes a los distintos tipos de angina inestable. Varios estudios han demostrado que la administración de AAS, a dosis de 325 mg 1-3 veces por día, reduce la incidencia de infarto y la mortalidad en los meses siguientes. Uno de dichos estudios, además, reveló que la heparina por vía intravenosa posee un efecto igualmente beneficioso sobre el pronóstico. Por el contrario, el tratamiento trombolítico no se ha mostrado eficaz.
Por ello, la pauta más aceptada en la actualidad incluye la administración de heparina y AAS. Si el paciente no recibía tratamiento previo, la elección del fármaco depende del tipo de angina; en la de esfuerzo progresiva o inicial se prefiere comenzar el tratamiento con bloqueadores betadrenérgicos y nitratos orales; por el contrario, si el dolor aparece en reposo se inicia con antagonistas del calcio. De cualquier forma, se han observado efectos beneficiosos de todos estos fármacos con independencia de las características del dolor. Las dosis deben aumentarse de modo progresivo y el tratamiento ajustarse según la respuesta; se pueden combinar antagonistas del calcio (en particular nifedipino) y bloqueadores beta si se alcanzan las dosis máximas tolerables de cualquiera de ellos sin conseguir el efecto deseado.
En los pacientes con angina previa que ya recibían tratamiento se aconseja mantener el mismo fármaco, aumentando la dosis si es posible o combinándolo con otro. Cuando las crisis anginosas son muy frecuentes (tres o más al día), prolongadas o se acompañan de cambios en el segmento ST se inicia simultáneamente la perfusión de nitroglicerina intravenosa y se mantiene hasta el control de los síntomas. Con estas medidas terapéuticas quedan asintomáticos entre el 70 y el 90% de los pacientes con angina inestable. En los casos en que el dolor persiste más de 48 h a pesar de un tratamiento médico correcto, debe practicarse una coronariografía de urgencia; en algunos pacientes la implantación de un balón de contrapulsación intraórtico permite controlar el dolor y realizar el estudio hemodinámico con menor riesgo. En estos pacientes están indicadas la cirugía o la angioplastia, según las lesiones coronarias que se encuentren. En los restantes enfermos, en los que el tratamiento farmacológico consigue controlar el dolor, debe practicarse una prueba de esfuerzo con el fin de evaluar el riesgo y seleccionar los que requieren coronariografía; algunos autores recomiendan practicar el estudio hemodinámico a todos los pacientes, incluso si se encuentran asintomáticos; no obstante, esta pauta más agresiva no se traduce en un mejor pronóstico.
Angina variante
En 1959 PRINZMETAL describió un tipo de angina caracterizada por crisis dolorosas en reposo y elevación del segmento ST durante éstas. En ocasiones, los episodios de angina se acompañan de arritmias, como extrasistolica, taquicardia ventricular o bloqueo auriculoventricular (AV), y pueden complicarse con un infarto de miocardio o muerte súbita. La angina variante representa aproximadamente el 5% de todos los ingresos por angina inestable. Aunque en la descripción inicial de PRINZMETAL los pacientes tenían aterosclerosis coronaria grave, el cuadro clínico puede presentarse tanto en pacientes con lesiones como en enfermos con arterias angiográficamente normales; en cualquier caso, el mecanismo responsable es un espasmo localizado en un segmento de la arteria coronaria; en alrededor el 25% de los casos existe el antecedente de migrañas o enfermedad de Raynaud. El dolor de la angina variante es similar al de la angina típica, excepto por su falta de relación con el esfuerzo y por la tendencia a presentarse durante el reposo nocturno. No obstante cuando el paciente tiene lesiones aterosclerosas obstructivas, puede mostrar una combinación de angina de reposo y esfuerzo. Es característica la gran variabilidad en la frecuencia y la intensidad de las crisis, que pueden alternar con largos períodos asintomáticos. La exploración física es normal en ausencia de dolor y muestra signos de disfunción ventricular o alteraciones del ritmo durante las crisis. El ECG suele ser normal, en especial en ausencia de obstrucciones coronarias fijas; durante las crisis aparece la elevación característica del segmento ST. En ocasiones, la monitorización continua del ECG muestra episodios de elevación o depresión del segmento ST sin dolor (isquemia silente, que puede observarse en otras formas de angina). La prueba de esfuerzo suele ser negativa cuando no existen lesiones obstructivas, aunque se ha comprobado la provocación del espasmo por el ejercicio.
La coronariografía está indicada en todos los pacientes en los que se sospecha una angina variante, con el objeto de descartar o confirmar la presencia de lesiones aterosclerosas. El 10-30% de los casos presentan una coronariografía normal, aproximadamente el 35% tienen afectación de un solo vaso coronario, y el 30%, lesiones de dos o las tres arterias principales. Los pacientes con espasmo coronario presentan una respuesta muy acentuada a la administración de ergonovina, que reproduce el cuadro clínico y electrocardiográfico de la angina variante; la prueba de la ergonovina está indicada en los pacientes con sospecha de angina variante en los que no ha podido registrarse un episodio típico con cambios electrocardiográficos y que muestran arterias normales en la coronariografía. Es una prueba potencialmente peligrosa que debe practicarse siempre en una unidad coronaria o en el laboratorio de hemodinámica; no debe realizarse cuando no se conoce el estado del árbol coronario o cuando existen lesiones obstructivas graves, debido a la posibilidad de provocar una isquemia rebelde al tratamiento. El pronóstico de estos pacientes depende fundamentalmente del estado del árbol coronario. Los enfermos con angina variante y lesiones obstructivas graves constituyen un grupo de alto riesgo, con una incidencia de infarto y muerte durante el primer año del 20 y 15%, respectivamente. En los restantes casos el pronóstico es benigno, con largos períodos de remisión.
Las crisis anginosas responden bien a los nitratos, tanto por vía sublingual como intravenosa. Los antagonistas del calcio son los fármacos de elección para la prevención de las crisis; los bloqueadores betadrenérgicos están contraindicados en los casos de angina vasospástica, en particular cuando no hay lesiones obstructivas fijas. De igual forma, la cirugía de revascularización y la angioplastia no están indicadas, excepto que existan lesiones aterosclerosas. Algunos autores han propuesto la plexectomía como alternativa para el tratamiento del espasmo coronario rebelde a los fármacos.
Infarto de miocardio
Con este término se designa la necrosis miocárdica aguda de origen isquémico, secundaria generalmente a la oclusión trombótica de una arteria coronaria. A pesar de algunas observaciones previas aisladas, se atribuye a HERRICK la primera descripción del cuadro clínico del infarto de miocardio. Durante muchos años fue un diagnóstico poco frecuente, pero tras la difusión de la electrocardiografía clínica pasó a considerarse una de las primeras causas de muerte en muchos países. Su incidencia varía ampliamente de unas comunidades a otras, oscilando entre el 0,8 y el 7,5 por 1.000 habitantes y por año; existe un claro predominio entre los varones y su mayor incidencia se presenta entre los 55 y los 65 años. El infarto de miocardio es, además, la manifestación inicial de la enfermedad en alrededor de la mitad de los pacientes coronarios. No sólo es una enfermedad frecuente, sino altamente letal, cuya mortalidad durante la fase aguda se ha estimado entre el 20 y el 50%.
Anatomía patológica. Miocardio. La lesión histológica fundamental en el infarto de miocardio es la necrosis isquémica, ausente en la angina de pecho debido a que, en ésta, por la menor duración e intensidad de la isquemia, no se llega a la muerte celular. Tras la necrosis se producen la eliminación del tejido necrótico y la organización y cicatrización del infarto.
Al principio, las lesiones son exclusivamente microscópicas y consisten en una ondulación de las fibras musculares; a las 6 h se observan edema, depósito de grasa en los miocitos y extravasación de hematíes; a las 24 h hay fragmentación e hialinización de las fibras musculares, con pérdida de la estriación normal y eosinofilia (necrosis por coagulación).
En los infartos en los que se produce la reperfusión miocárdica aparece un tipo de necrosis consistente en bandas eosinófilas transversales en las fibras musculares cardíacas lesionadas, producidas por la hipercontracción de las miofibrillas (necrosis en bandas de contracción). Simultáneamente se inicia una reacción inflamatoria con un infiltrado leucocitario que persiste 2-3 semanas. Al comienzo de la segunda semana la zona es invadida desde la periferia por capilares y tejido conjuntivo; la producción de colágeno convierte el tejido de granulación en una cicatriz fibrosa en el término de 6 a 8 semanas.
El infarto provoca cambios en la arquitectura del ventrículo que influyen en la función ventricular residual. Estos cambios se denominan remodelado ventricular e incluyen la expansión de la zona necrótica y la hipertrofia y dilatación de la zona normal. La expansión y el adelgazamiento del área necrótica se inician en las primeras horas y se deben al deslizamiento y realineación de los miocitos; el grado de expansión depende directamente del tamaño del infarto y, por ello, se observa con mayor frecuencia en los infartos transmurales extensos, especialmente los de localización anterior.
La expansión puede favorecer la rotura cardíaca y la formación de un aneurisma ventricular, una complicación que ocurre en el 8-20% de los infartos. El aumento de la tensión que se produce en la pared normal del ventrículo como consecuencia de la expansión, estimula la hipertrofia y dilatación del tejido sano, conduciendo al remodelado y a la disfunción ventricular.
El infarto puede abarcar todo el espesor de la pared, en cuyo caso se denomina transmural, o bien limitarse al tercio o a la mitad interna de ella, lo que se conoce como infarto subendocárdico o no transmural. La necrosis afecta, prácticamente en todos los casos, el ventrículo izquierdo, aunque puede extenderse al ventrículo derecho o a las aurículas; su tamaño oscila entre unos centímetros y el 50% o más de la masa ventricular.
Arterias coronarias. Las arterias coronarias presentan, en la mayoría de los casos (95%), lesiones ateromatosas obstructivas. En los infartos transmurales, la arteria que irriga la zona del infarto se encuentra ocluida con frecuencia por un trombo fresco, único, de unos 2-3 cm, adherido a una placa aterosclerosa, que casi siempre muestra lesiones agudas, como fisuración o rotura de la íntima y hemorragias.
Fisiopatología y etiología. La rotura de la placa es probablemente la circunstancia que desencadena el infarto, al exponer el colágeno subendotelial a la acción de las plaquetas y provocar su activación, la formación de agregados y la liberación de sustancias vasoactivas que, como el tromboxano, inducen espasmo y contribuyen a la oclusión del vaso. Todo ello, en definitiva, determina la formación de un trombo, que, como ya se ha mencionado, se halla presente en la mayoría de los pacientes. Así pues, aunque durante años se había discutido el papel de la trombosis en la génesis del infarto, sugiriéndose que el trombo sería consecuencia y no causa de la oclusión arterial, con la introducción del tratamiento trombolítico y la realización de coronariografías en la fase precoz del infarto esta teoría ya no puede sostenerse. En las horas y los días siguientes, el trombo sufre un proceso de lisis, de forma que la prevalencia de oclusión completa es del 50% a los 15 días y del 45% al mes.
En algunos pacientes se ha demostrado que el espasmo coronario puede causar infarto de miocardio; no obstante, esta circunstancia es, al parecer, rara y la administración intracoronaria de nitroglicerina durante las primeras horas sólo conduce a la reapertura de la arteria en un número muy limitado de casos. Finalmente, la disección aórtica o coronaria, una embolia, las anomalías congénitas de las arterias coronarias, su laceración por un traumatismo y la arteritis, entre otras causas, pueden reducir la perfusión hasta un nivel crítico, provocar isquemia y conducir a la necrosis miocárdica; no obstante, suelen ser mecanismos muy poco frecuentes. En los últimos años se han descrito con cierta frecuencia casos de infarto de miocardio por consumo de cocaína; esta droga provoca espasmo coronario y aumenta el consumo de oxígeno del miocardio.
Una vez producida la oclusión coronaria, la zona de miocardio irrigada por la arteria afecta queda isquémica; debido en parte a la presencia de colaterales que permiten cierto flujo de sangre, la necrosis no se establece de forma inmediata sino progresiva, desde el subendocardio hacia el epicardio. Experimentalmente, tras 40 min de oclusión, la necrosis alcanza alrededor del 35% del miocardio irrigado por ella; a las 3 h esta proporción es ya del 57%, y a las 6 h, del 75%. Por este motivo, las intervenciones terapéuticas destinadas a evitar o reducir la necrosis deben instaurarse durante las primeras 3-4 h de iniciados los síntomas. Además, pasado este período, el restablecimiento del flujo coronario puede producir una hemorragia en la zona infartada, cuya importancia funcional está en discusión. En resumen, la necrosis es un fenómeno dinámico y su extensión definitiva dependerá fundamentalmente de la masa ventricular irrigada por la arteria ocluida, de la existencia de colaterales, de la presencia de lesiones obstructivas en las arterias de las que parten dichas colaterales, de la posibilidad de una reperfusión miocárdica precoz por lisis espontánea o terapéutica del trombo y, en mucho menor grado, de las demandas de oxígeno del músculo isquémico. La repercusión del infarto sobre la situación hemodinámica del paciente es muy variable y depende de la extensión de la necrosis y del estado de la función ventricular previa al infarto. Aproximadamente el 80% de los enfermos muestran una elevación de la presión de llenado ventricular izquierda por encima del límite normal (12 mmHg); sin embargo, se ha demostrado que en estos pacientes la presión telediastólica ventricular óptima se sitúa alrededor de 18 mmHg, debido a los cambios en la distensibilidad ventricular. La respuesta del gasto cardíaco es, asimismo, variable y los pacientes sin signos de insuficiencia cardíaca suelen cursar con un índice cardíaco normal. De acuerdo con el grado de disfunción ventricular puede observarse activación del sistema simpático, y elevación del factor natriurético auricular, la angiotensina y la aldosterona en plasma.
Cuando el infarto se extiende al ventrículo derecho, la presión telediastólica en esta cavidad y, por consiguiente, la presión media de la aurícula derecha se elevan, llegando a igualar e incluso a superar a la presión pulmonar enclavada. El colapso y de la presión auricular se acentúa y, en los casos de infarto ventricular derecho masivo, se pierde la morfología habitual de la presión pulmonar ante la incapacidad del ventrículo para generar presión. La hipovolemia enmascara estos signos, que con frecuencia se ponen de manifiesto al forzar la administración de líquidos.
Diagnóstico.
Cuadro clínico. El dolor es el síntoma dominante en la mayoría de los casos; sus características son similares en cuanto a calidad, localización e irradiación al de la angina; no obstante, suele ser más intenso y prolongado, no responde a la nitroglicerina y se acompaña de manifestaciones vegetativas. De cualquier forma, la intensidad del dolor y en general la gravedad del cuadro son muy variables y no guardan relación con la extensión y la importancia de la necrosis. Aproximadamente en la mitad de los casos existe el antecedente de dolor anginoso en los días o semanas previos al infarto. Con frecuencia, estas molestias no se diagnostican correctamente y sólo a posteriori se catalogan de angina. El dolor no guarda relación con el esfuerzo y en más del 50% de los casos aparece cuando el paciente se halla en reposo, con frecuencia durante la noche y determina su despertar; es poco habitual que se presente tras un esfuerzo intenso o extenuante. La mayor incidencia de infarto ocurre durante la mañana, hacia las 9:00, y coincide con los cambios en la agregabilidad plaquetaria y en los niveles de cortisol que ocurren a estas horas.
El cuadro clínico se acompaña casi constantemente de sudación fría, debilidad, náuseas, vómitos, angustia y sensación de muerte inminente. Todo ello confiere al cuadro una sensación de gravedad que lo diferencia de la crisis anginosa.
Alrededor del 25% de los infartos de miocardio no se reconocen clínicamente; la mitad de ellos cursan de forma asintomática y el diagnóstico se realiza de forma retrospectiva al registrar un ECG; en el resto, el dolor es atípico o no está presente, pero pueden observarse otras manifestaciones clínicas debidas al síndrome vegetativo o a alguna de las complicaciones del infarto. Así, el dolor puede localizarse exclusivamente en los brazos o en el epigastrio; otras veces, por el contrario, los síntomas dominantes son las náuseas y los vómitos, que simulan un cuadro digestivo, o bien predominan la disnea, un síncope o un accidente vascular cerebral. La ausencia de dolor es más frecuente en los pacientes diabéticos y en los de edad avanzada.
La exploración física es muy variable; durante los episodios de dolor, el paciente se encuentra pálido, sudoroso e intranquilo. El pulso suele ser rápido, excepto si existe bradicardia (muy frecuente durante las primeras horas) o bloqueo AV. La hipotensión es también habitual mientras persisten el dolor y la bradicardia; cuando se prolonga, debe sospecharse la posibilidad de un shock cardiogénico. De cualquier forma, la presión puede ser normal e incluso detectarse hipertensión secundaria a una descarga adrenérgica. La palpación precordial puede mostrar un doble impulso apical por discinesia ventricular; en la auscultación casi siempre se detectan un cuarto ruido y la disminución en la intensidad de los ruidos cardíacos; con menor frecuencia se ausculta un soplo sistólico de regurgitación mitral. En presencia de insuficiencia cardíaca pueden aparecer un tercer ruido con cadencia de galope, un desdoblamiento paradójico del segundo ruido y estertores pulmonares. La afectación del ventrículo derecho se manifiesta por signos de fallo ventricular derecho, que incluyen ingurgitación yugular, hepatomegalia y reflujo hepatoyugular. Una exploración normal no descarta la existencia de un infarto de miocardio.
Electrocardiograma. Junto a la clínica y las determinaciones enzimáticas constituye un elemento fundamental para el diagnóstico del infarto agudo; además, permite analizar su evolución, localizar la necrosis y evaluar de forma aproximada su extensión. La génesis de los signos de isquemia, lesión y necrosis en el ECG se estudia detalladamente en Electrocardiografía.
Localización atípica del dolor, sólo en mandíbula, hombro, dolor abdominal simulando abdomen agudo .Náuseas y vómitos sin dolor, no infrecuente en los infartos de localización inferior. Angina de pecho clásica sin aumento en la duración o la intensidad del dolor. Insuficiencia cardíaca aguda. Accidente embólico: accidente vascular cerebral, embolia sistémica. Síncope por arritmias. Alteraciones psiquiátricas como manía o psicosis aguda.
La interrupción experimental del flujo coronario determina, casi de manera instantánea, cambios en el ECG que inicialmente se circunscriben a la onda T; ésta aumenta de tamaño y se vuelve simétrica, lo que en electrocardiografía se denomina fase de isquemia. Unos minutos más tarde, si persiste la interrupción del flujo coronario, el segmento ST se desplaza hacia arriba y adopta una forma convexa que caracteriza la denominada fase de lesión. Hasta este punto los cambios en el ECG son idénticos a los de la angina variante y, como en ella, reversibles si se restablece el flujo arterial. En caso contrario se inicia la necrosis celular, que se manifiesta eléctricamente por ondas Q de amplitud superior al 25% del complejo QRS o de duración mayor de 0,04 seg. En la mayoría de los pacientes, el primer ECG se registra un tiempo después del inicio de los síntomas y presenta, en las derivaciones que exploran directamente la zona del infarto, una combinación de los signos de isquemia y lesión. Con frecuencia aparecen ya ondas Q, que se hacen más evidentes en los trazados posteriores, al mismo tiempo que disminuye el voltaje de la onda R. En los días posteriores, el segmento ST desciende y puede llegar a normalizarse, mientras que la onda T se vuelve más negativa; con el tiempo, sin embargo, puede llegar a normalizarse. La onda Q, por el contrario, suele persistir definitivamente, excepto en una pequeña proporción de pacientes (6%) en los que el ECG llega a ser normal. Las derivaciones electrocardiográficas que presentan onda Q, elevación del segmento ST e inversión de la onda T orientan sobre la localización del infarto. Sin embargo, hay que señalar que no se ha observado una correlación estricta entre los resultados de la autopsia y los datos electrocardiográficos. La localización del infarto puede tener importancia pronóstica; se acepta que, en general, los infartos anteriores tienen peor pronóstico, ya que se complican más a menudo con shock cardiogénico, aneurismas ventriculares y trastornos graves de la conducción intraventricular. Las derivaciones alejadas u opuestas a la zona necrosada muestran cambios electrocardiográficos indirectos o en espejo (ondas R altas, depresión del segmento ST y ondas T positivas) que son de utilidad en el diagnóstico de algunos infartos de localización posterior. El diagnóstico electrocardiográfico de infarto puede ser difícil en presencia de algunos trastornos de la conducción como el bloqueo de rama izquierda. Cuando la necrosis no es transmural la onda Q suele faltar y el diagnóstico debe realizarse por los cambios de la repolarización (depresión del segmento ST) y, en ocasiones, por una disminución del voltaje de la onda R. En estos casos, las determinaciones enzimáticas, la historia clínica, el vectocardiograma y, eventualmente, los estudios isotópicos permiten el diagnóstico definitivo. Como ya se ha indicado, no existe una correlación estricta entre los hallazgos electrocardiográficos y anatomopatológicos, de forma que algunos infartos sin onda Q aparecen en la autopsia como transmurales; por este motivo, los términos infarto subendocárdico y no transmural en la actualidad tienden a sustituirse por el de infarto sin onda Q. Los signos electrocardiográficos de infarto de ventrículo derecho o de infarto auricular son más inespecíficos y a menudo el diagnóstico se basa exclusivamente en criterios clínicos; el primero suele dar elevación del segmento ST en la derivación V4R (quinto espacio intercostal y línea clavicular.
Exámenes de laboratorio. El infarto de miocardio ocasiona diversas alteraciones humorales, como leucocitosis y aumento de la velocidad de sedimentación globular (VSG). No obstante, desde el punto de vista diagnóstico, sólo tiene importancia el aumento en la actividad sérica de ciertas enzimas, liberadas al torrente circulatorio como consecuencia de la necrosis. En la práctica se determinan tres de ellas, la CK, la transaminasa glutámico-oxalacética (ASAT) y la láctico- deshidrogenasa (LDH). La velocidad con que se activan es diferente para cada una de ellas; la más precoz es la CK (6-8 h), intermedia la ASAT (8-12 h) y más tardía la LDH (24- 48 h). Los valores de las dos primeras se normalizan al cabo de 3-4 días, mientras que la LDH permanece elevada entre 8 y 14 días.
Es importante recordar que estas enzimas no son específicas del corazón, puesto que se encuentran en otros tejidos; por consiguiente, un valor anormal de cualquiera de ellas puede deberse a un proceso distinto al infarto. Así pues, para sustentar el diagnóstico de necrosis miocárdica se realizan determinaciones seriadas durante los primeros 3-4 días y se requiere que muestren la curva de ascenso y su normalización típica para cada una de ellas. La determinación de las isoenzimas de la CK y de la LDH facilita el diagnóstico y permite conocer si el aumento se debe específicamente a un infarto de miocardio, ya que las isoenzimas CK-MB y la LDH1 son casi exclusivas en el corazón. Además, la primera puede estar anormalmente elevada en algunos casos en que la actividad de la CK total es normal.
Los valores máximos de estas enzimas presentan una correlación discreta con la extensión de la necrosis y se han utilizado con fines pronósticos; no obstante, existen muchos factores diferentes que influyen en el grado de actividad enzimática, por lo que este parámetro sólo tiene un valor orientativo.
La determinación seriada de la CK o de su isoenzima MB, cada 2-4 h durante los primeros días, permite calcular el área de la curva de eliminación enzimática y estimar la magnitud del infarto con mayor precisión. De cualquier forma, es un parámetro de cálculo complejo y carece de utilidad práctica. En los últimos años se han desarrollado técnicas para la determinación de la mioglobina y la miosina; aunque todavía no se ha generalizado su uso, es posible que permitan un diagnóstico más precoz y tengan mayor especificidad que las enzimas clásicas.
Estudios radioisotópicos (véase Cardiología nuclear). El tejido necrótico del miocardio capta pirofosfato de tecnecio (99mTc) radiactivo, lo que permite detectar el infarto y estimar aproximadamente su extensión. La sensibilidad de esta técnica para detectar necrosis es del 85%, pero se reduce al 40% en los infartos sin onda Q. Las indicaciones de la gammagrafía con 99mTc se limitan a los casos en que el diagnóstico electrocardiográfico no es posible (bloqueo de rama izquierda, necrosis antigua). El talio-201, por el contrario, se distribuye en las zonas del miocardio con perfusión normal, de forma que las áreas de necrosis aparecen como zonas frías en la gammagrafía. En la práctica no se utiliza para el diagnóstico del infarto agudo.
Ecocardiografía. La ecocardiografía bidimensional constituye un método esencial para el diagnóstico del infarto de miocardio y sus complicaciones mecánicas, a la vez que permite una evaluación incruenta de la función cardíaca y del pronóstico.
Aproximadamente en el 80% de los pacientes se obtienen registros de buena calidad, y en el 90% de éstos pueden detectarse alteraciones de la motilidad ventricular que confirman el diagnóstico de infarto. Por ello, está indicada en los pacientes con un cuadro sugestivo de infarto en los que el ECG es normal o presenta anormalidades que dificultan su interpretación (bloqueo de rama, síndrome de WPW). También debe realizarse con urgencia ante la sospecha de una complicación mecánica del infarto. Finalmente, antes del alta, la ecocardiografía proporciona una información fidedigna sobre el estado funcional del ventrículo y, en consecuencia, permite valorar el pronóstico.
Cateterismo cardíaco. Coronariografía. La valoración hemodinámica del paciente con infarto agudo de miocardio puede realizarse en la actualidad fácilmente mediante catéteres flotantes con balón, dirigidos por el flujo sanguíneo.
Los catéteres pueden introducirse hasta la arteria pulmonar a la cabecera del enfermo sin equipo de rayos X y permiten la determinación de las presiones de las cavidades derechas, la presión pulmonar enclavada (equivalente a la presión telediastólica del ventrículo izquierdo) y el gasto cardíaco.
La monitorización hemodinámica está indicada cuando el infarto se complica con insuficiencia cardíaca, hipotensión, shock cardiogénico, taponamiento, rotura septal o del músculo papilar y, en general, cuando se requiere la administración de fármacos vasodilatadores o inotrópicos. Los hallazgos hemodinámicos tienen valor pronóstico, y el grado de disfunción ventricular se correlaciona con la mortalidad.
En la fase aguda del infarto, la coronariografía sólo está indicada en los pacientes con angina postinfarto rebelde al tratamiento farmacológico y en aquellos con complicaciones mecánicas graves en los que se considera el tratamiento quirúrgico o la angioplastia. Cuando se realiza en las primeras horas del cuadro agudo se observa la oclusión de la arteria que irriga la zona necrosada en aproximadamente el 85% de os pacientes; este porcentaje disminuye de manera progresiva en los días siguientes como consecuencia de la lisis espontánea del trombo. El 25% de los enfermos tienen lesiones aterosclerosas circunscritas a una sola arteria coronaria, el 33% a dos, y otro porcentaje similar muestra lesiones obstructivas en los tres vasos principales. Las lesiones del tronco común de la coronaria izquierda son raras (1-3%), al igual que una coronariografía estrictamente normal (3%).
Diagnóstico diferencial. Se plantea habitualmente con otros procesos que cursan con dolor torácico intenso, en particular el aneurisma disecante, la embolia pulmonar y la pericarditis aguda y, con menor frecuencia, el neumotórax o el enfisema mediastínico. En general, el ECG y las determinaciones enzimáticas seriadas permiten el diagnóstico con facilidad; sin embargo, debe tenerse presente que un ECG normal no descarta la existencia de infarto.
El dolor del aneurisma disecante suele ser agudo, terebrante, su intensidad es máxima desde el inicio y suele irradiarse hacia la espalda y el abdomen a medida que la disección avanza; el antecedente de hipertensión arterial grave o de enfermedad de Marfan, la asimetría en los pulsos arteriales y la auscultación de una insuficiencia aórtica son datos en favor de este diagnóstico. La embolia pulmonar masiva que a veces cursa con dolor torácico intenso suele producirse en pacientes en reposo prolongado, con traumatismos y operaciones abdominales recientes; se acompaña de taquipnea, cianosis, hipoxemia y signos electrocardiográficos de sobrecarga del ventrículo derecho. Por último, el dolor y los cambios eléctricos de la pericarditis suelen ser suficientemente claros para orientar el diagnóstico.
La pancreatitis aguda, la perforación de una úlcera gástrica o un episodio biliar agudo pueden plantear dificultades diagnósticas, que en general se resuelven con el estudio electrocardiográfico, ecocardiográfico o radiológico.
Complicaciones. El infarto de miocardio puede presentar una gran variedad de complicaciones, en particular durante los primeros días; su prevención y control constituyen los objetivos fundamentales del tratamiento durante la fase aguda.
Las complicaciones suelen dividirse en eléctricas y mecánicas y su frecuencia y gravedad son muy variables.
Complicaciones eléctricas. El 75-95% de los pacientes con infarto agudo de miocardio presentan alguna alteración del ritmo durante su estancia en la unidad coronaria; las más frecuentes son la extrasistolia ventricular, la bradicardia y la taquicardia sinusales. Prácticamente todos los pacientes presentan extrasístoles ventriculares durante las primeras 72 h de infarto, y en la mayoría de los casos son inocuas; el único peligro radica en su capacidad para provocar taquicardia y fibrilación ventriculares, arritmias que se presentan en alrededor del 10 y el 6%, respectivamente, y que son letales si no se instaura enseguida el tratamiento adecuado. Aunque se han señalado como signos de gravedad de las extrasístoles una frecuencia superior a 6/min, el acoplamiento corto (fenómeno de R sobre T) o su presentación en salvas, no parece existir una buena correlación entre estos criterios de alarma y la aparición de taquicardia o fibrilación ventriculares.
La bradicardia sinusal es muy frecuente durante las primeras horas, cuando la incidencia puede alcanzar el 30-40%; puede acompañarse de hipotensión y en ocasiones cede al suprimir el dolor. La taquicardia sinusal aparece en un tercio de los pacientes y se debe con frecuencia a la ansiedad, la persistencia del dolor o la insuficiencia cardíaca; se considera un signo oneroso cuando persiste pasadas las primeras horas.
Las extrasístoles auriculares son frecuentes y pueden constituir el único signo de infarto auricular; su único peligro radica en que pueden provocar flúter y fibrilación auriculares, los cuales, aunque benignos desde un punto de vista eléctrico, pueden deteriorar la situación clínica del paciente al reducir el gasto cardíaco.
Otro grupo importante de arritmias frecuentes en el infarto de miocardio está constituido por el bloqueo AV. En el infarto de localización inferior suele ser suprahisiano y transitorio y responde bien al tratamiento farmacológico. Por el contrario, en el infarto anterior traduce por lo general una afectación difusa del sistema intraventricular de conducción por la isquemia, es con frecuencia definitivo y entraña un mal pronóstico, incluso cuando se implanta un marcapasos. Los bloqueos de rama bifasciculares secundarios a un infarto agudo suelen traducir una necrosis extensa e indican mal pronóstico.
Complicaciones mecánicas. La insuficiencia cardíaca es la más frecuente entre las complicaciones mecánicas del infarto y se debe a la reducción de la masa contráctil del ventrículo izquierdo. Cuando la necrosis afecta más del 25% de ésta, aparecen los signos clínicos de fallo izquierdo; un infarto que afecte al 40% provocará shock cardiogénico. Así pues, las manifestaciones clínicas de fallo ventricular durante el infarto agudo de miocardio pueden limitarse a la auscultación de estertores pulmonares o de un tercer ruido o bien constituir el cuadro grave del shock cardiocirculatorio. La isquemia determina también una alteración de la distensibilidad ventricular, lo que provoca una elevación de la presión diastólica ventricular y favorece la aparición de los síntomas de congestión pulmonar. Otros factores, como la sobrecarga de volumen secundaria a otras complicaciones mecánicas o el desarrollo de un aneurisma ventricular, contribuyen a la aparición de insuficiencia cardíaca. Los signos de fallo ventricular derecho, como la ingurgitación yugular o el reflujo hepatoyugular, aparecen en una elevada proporción de casos de infarto inferior, indicando la afectación del ventrículo derecho.
La insuficiencia cardíaca es un signo de mal pronóstico, y el grado de fallo ventricular durante la fase aguda se correlaciona con la mortalidad. El shock cardiogénico constituye la forma más grave del fallo ventricular izquierdo y se diagnostica por la aparición de hipotensión (presión arterial sistólica inferior a 90 mmHg) junto a signos de hipoperfusión tisular (oliguria, obnubilación, piel fría y pálida), en ausencia de hipovolemia, dolor o una arritmia. Su mortalidad es superior al 80-90% a pesar de los nuevos fármacos adrenérgicos y de las medidas de soporte mecánico como el balón de contrapulsación intraórtico. La rotura del miocardio como consecuencia de la isquemia y la necrosis puede producirse en tres localizaciones distintas.
La rotura de la pared libre del ventrículo provoca la salida masiva de sangre al pericardio y un cuadro de taponamiento rápidamente letal a menos que pueda suturarse de inmediato; su traducción clínica suele consistir en una hipotensión profunda, con ausencia de pulsos, mientras el ECG permanece sin modificarse durante unos minutos (disociación electromecánica) y es responsable del 10% de los fallecimientos en la fase aguda. La rotura puede localizarse también en el tabique interventricular y originar una comunicación entre ambos ventrículos que se traduce clínicamente por un soplo sistólico con frémito, irradiado al borde esternal derecho, y por un cuadro de insuficiencia vi ventricular grave. Su incidencia es del 0,5% y tiene una elevada mortalidad. Por último, la necrosis de un músculo papilar ocasiona un cuadro de regurgitación mitral y edema agudo de pulmón; la isquemia de menor intensidad, en la que el músculo no alcanza a romperse, puede provocar distintos grados de insuficiencia mitral. Las roturas son complicaciones muy graves que requieren por lo general cateterismo cardíaco de urgencia y tratamiento quirúrgico. Alrededor del 10-20% de los pacientes desarrollan un aneurisma o dilatación circunscrita en la zona necrótica, que forman una bolsa no contráctil, de pared delgada, que se distiende durante la sístole y resta eficacia a la contracción ventricular. Por lo general se localizan en la pared anterior, se acompañan de trombosis mural y pueden provocar insuficiencia cardíaca. La aparición de un doble impulso apical y la persistencia de la elevación del segmento ST en el ECG son los signos clínicos que permiten sospechar el diagnóstico; el ecocardiograma, la ventriculografía isotópica y el cateterismo cardíaco confirmarán su presencia. Como ya se ha mencionado, el remodelado que sufre el ventrículo tras el infarto determina una dilatación progresiva, con disminución de la función ventricular; de esta forma, incluso en ausencia de nuevos episodios isquémicos puede aparecer tardíamente insuficiencia cardíaca.
Otras complicaciones. La tromboembolia pulmonar era una complicación frecuente del infarto cuando el reposo prolongado en cama constituía una medida terapéutica habitual; en la actualidad su aparición es rara. De igual forma, aunque con frecuencia (20-40%) se observan en los estudios ecocardiográficos trombos adheridos a la zona necrosada, las embolias sistémicas son raras y se detectan en la autopsia de, aproximadamente, el 10% de los pacientes fallecidos durante la fase aguda; los trombos pediculados, de gran tamaño y localizados en la cara inferior tienen mayor tendencia a desprenderse.
El 20% de los pacientes presentan en los primeros días del infarto un frote pericárdico acompañado de un dolor claramente relacionado con los movimientos respiratorios y que en general se distingue con facilidad del dolor coronario. En esta fase del infarto, la pericarditis es una complicación benigna que sólo en los pacientes tratados con anticoagulantes puede plantear problemas al provocar un hemopericardio.
Más tarde, a las 2-6 semanas del infarto, el 1-2% de los enfermos padecen una pericarditis, por lo general con derrame, acompañada de pleuritis o neumonitis, que recibe el nombre de síndrome de Dressler. Se trata de un proceso autoinmune que puede recurrir durante el primer año y requerir la administración de glucocorticoides e incluso la creación de una ventana pericárdica.
Pronóstico inmediato del infarto de miocardio. La mortalidad global del infarto de miocardio durante el primer mes del episodio agudo es del 30%; la mitad de estos fallecimientos se deben a trastornos del ritmo y se desencadenan en las primeras 2 h, generalmente antes de que el paciente haya recibido asistencia médica. Las muertes por arritmias son raras en la unidad coronaria; en estos pacientes ingresados, la insuficiencia cardíaca y las roturas constituyen las causas más frecuentes de mortalidad. Entre los pacientes ingresados la mortalidad es del 7-12% y depende fundamentalmente de la edad y de la gravedad del infarto. Son signos de mal pronóstico en esta fase del infarto la presencia de fallo izquierdo o shock, los bloqueos bifasciculares, los infartos anteriores de gran extensión, la taquicardia sinusal persistente, las arritmias ventriculares repetitivas rebeldes al tratamiento, la edad avanzada, el antecedente de infarto previo y la diabetes de difícil control.
Tratamiento del infarto agudo de miocardio. El tratamiento del infarto agudo está condicionado por varios factores, entre los cuales los más importantes son los siguientes:
1. El infarto es habitualmente un cuadro súbito e inesperado que cursa con un dolor intenso, que por sí mismo puede dar origen a arritmias, hipotensión y vegetatismo.
2. Más del 50% de los fallecimientos por infarto se desarrollanen las primeras 2 h y se deben a fibrilación ventricular.
3. En la mayoría de los casos la causa del infarto es la oclusión del vaso por un trombo, cuya lisis es posible espontánea o farmacológicamente.
4. La necrosis se establece en forma progresiva a lo largo de las primeras 4-6 h y ciertas intervenciones pueden reducir el área necrosada, en particular la reperfusión precoz.
5. La extensión de infarto es el principal determinante del pronóstico.
6. Durante los primeros días persiste el riesgo de complicaciones eléctricas y mecánicas graves.
En consecuencia, los objetivos del tratamiento en esta fase del infarto son:
a) suprimir el dolor;
b) prevenir las arritmias, en especial la fibrilación ventricular;
c) reducir el tamaño de la necrosis
d) prevenir y tratar las complicaciones mecánicas, sobre todo la insuficiencia cardíaca y el shock cardiogénico.
Una vez superada esta fase, la evaluación del pronóstico a largo plazo, la prevención de nuevos episodios isquémicos y la rehabilitación funcional, social y laboral del paciente constituyen nuevos objetivos.
1. Organización de los cuidados coronarios. Los pacientes con infarto suelen llegar al hospital una vez transcurridas las primeras 4-6 h; por este motivo, y con el fin de reducir la elevada mortalidad prehospitalaria, algunas ciudades han desarrollado programas de asistencia urgente que permiten desplazar hasta el mismo lugar en que se inician los síntomas una ambulancia con personal y material especializados. Pese a la eficacia demostrada de este sistema, su complejidad y elevado coste han impedido su generalización.
La introducción del tratamiento trombolítico con el objeto de recanalizar la arteria y reducir la necrosis, así como el corto intervalo de tiempo en que puede aplicarse, han vuelto a poner de manifiesto que el paciente debe ser atendido lo más rápidamente posible y trasladado a una unidad coronaria en las mejores condiciones posibles, es decir, una vez calmado el dolor y controladas las arritmias iniciales.
Dos estudios recientes han demostrado que es posible comenzar el tratamiento fibrinolítico antes del traslado cuando se dispone de ambulancias con personal entrenado y un equipo que permite realizar el diagnóstico de infarto con seguridad.
Aunque ello permite adelantar en casi una hora el tratamiento sin aumentar el riesgo de complicaciones, no ha podido demostrarse una reducción significativa de la mortalidad.
Por todo ello, el tratamiento trombolítico prehospitalario sólo se utiliza en ciertas ciudades que disponen de un sistema de urgencias adecuado.
El concepto de cuidados intensivos coronarios ha ido evolucionando de manera progresiva; en un principio, la unidad coronaria se limitaba al tratamiento del paro cardíaco; en una etapa posterior se intentó su profilaxis mediante el tratamiento de las arritmias premonitorias y el fallo de bomba; finalmente se ha llegado al concepto de reducción del tamaño de la necrosis. Aunque después de 2 décadas de su creación todavía se discuten su eficacia en la reducción de la mortalidad global y la conveniencia de ingresar a todos los pacientes con infarto no complicado, la dificultad para establecer en forma temprana durante su curso qué pacientes evolucionarán satisfactoriamente sin estos cuidados especiales aconseja su ingreso sistemático en estas unidades.
Aunque en menor grado, el riesgo de muerte por arritmias persiste pasados los primeros días de tratamiento en la unidad coronaria; para prevenir esta mortalidad, que puede representar el 30% de todos los fallecimientos por infarto que ocurren en el hospital, es conveniente mantener a los pacientes de mayor riesgo en unidades de cuidados intermedios, en las que sea posible monitorizar el ECG durante los primeros días de deambulación del paciente.
2. Tratamiento del infarto sin complicaciones. Cuidados generales. El reposo absoluto en cama se mantiene durante 48 h en el caso de pacientes sin complicaciones y se prolonga hasta la desaparición de aquéllas en el resto. Tan pronto como es posible se inicia la movilización progresiva, que comienza sentando al paciente en un sillón y continúa a los 5-6 días con la deambulación. En general es posible abandonar el hospital a los 7-12 días de iniciados los síntomas. Durante este tiempo debe procurarse el reposo mental y emocional, administrando sedantes en caso necesario. Aunque no se ha demostrado su eficacia en el enfermo sin insuficiencia cardíaca o enfermedad pulmonar, suele administrarse oxígeno a razón de 2-4 L/min durante las primeras 24 h. El primer día se recomienda una dieta blanda hipocalórica, pobre en sodio y repartida en 4 tomas. Con frecuencia existe estreñimiento, y es importante que el paciente no se esfuerce al defecar; si es necesario puede administrarse un laxante suave.
3. Tratamiento del dolor. El dolor del infarto agudo debe tratarse inmediatamente con cloruro o sulfato de morfina; la dosis inicial es de 2-3 mg por vía intravenosa, que puede repetirse cada 10 min hasta que desaparece el dolor o se alcanza la dosis máxima (10-15 mg cada 4-6 h). Por esta vía la acción máxima se consigue a los 10-15 min y los efectos colaterales más graves son la depresión respiratoria, la hipotensión y la bradicardia. Si inicialmente la frecuencia cardíaca es lenta, puede emplearse en su lugar meperidina a dosis fraccionadas de 20-30 mg hasta un total de 100 mg cada 4- 6 h. El efecto analgésico de estos fármacos se potencia con la administración de sedantes del tipo del diazepam, 5-10 mg3 veces al día.
4. Profilaxis de las complicaciones. Con el fin de prevenir la aparición de taquicardia y fibrilación ventriculares se ha aconsejado la administración de lidocaína por vía intravenosa en todos los pacientes con infarto durante las primeras 48 h; la utilidad de esta práctica está hoy en discusión y tiende a abandonarse. Por el contrario, cuando se atiende al paciente antes de su ingreso en el hospital y se prevé un traslado prolongado, puede administrarse lidocaína por vía intramuscular (deltoides) a dosis de 200-300 mg. La administración de anticoagulantes para prevenir las complicaciones tromboembólicas ha sido un tema muy discutido; en la actualidad se utilizan dosis bajas de heparina (25 mg cada 6-12 h) en todos los pacientes mientras permanecen en reposo absoluto, y se reservan las dosis completas para los pacientes con insuficiencia cardíaca grave, shock, insuficiencia venosa previa y en general con riesgo de embolias pulmonares. Algunos autores recomiendan asimismo administrar anticoagulantes en los pacientes con aneurismas ventriculares o infarto extenso de localización anterior, con el fin de reducir el riesgo de embolia sistémica.
5. Limitación del área de necrosis. Aunque son numerosos los fármacos y las intervenciones que, experimentalmente, reducen la extensión de la necrosis, sólo la fibrinólisis y los bloqueadores betadrenérgicos tienen importancia práctica. El mecanismo a través del cual actúan los trombolíticos en el infarto agudo de miocardio es la apertura de la arteria y, en consecuencia, la reducción del área necrótica. En efecto, se ha demostrado que tras la administración intravenosa de estreptocinasa se consigue la recanalización del 40% de las arterias coronarias responsables del infarto, siendo esta cifra algo superior para el activador tisular del plasminógeno (tPA, 65%). El tratamiento trombolítico reduce la necrosis miocárdica, valorada mediante determinaciones enzimáticas, entre un 10 y un 20%; como consecuencia de lo anterior, la función ventricular mejora y la mortalidad de la fase aguda se reduce en un 20-30%. El tratamiento es tanto más eficaz cuanto más precozmente se administra. De las diferentes pautas ensayadas, la administración de estreptocinasa a dosis de 1,5 millones de unidades en una hora y la pauta acelerada de tPA (100 mg en 60 min) son las más utilizadas en la actualidad.
Las principales complicaciones del tratamiento trombolítico son las hemorragias, especialmente la hemorragia cerebral, que puede presentarse en el 0,5-1,5% de los casos, dependiendo del fármaco y la dosis empleados. La tasa de hemorragias es algo mayor para el htPA, sobre todo a dosis superiores a 100 mg. Las hemorragias de otra localización aparecen en el 20% de los casos, aunque sólo son importantes en el 5% de ellos. A pesar de estas complicaciones, el efecto beneficioso de los trombolíticos en el infarto de miocardio es claro y la mortalidad hospitalaria del infarto se ha reducido actualmente al 7-9%. El tratamiento trombolítico está indicado en los pacientes de cualquier edad que acuden al hospital durante las primeras 4-6 h posteriores al infarto y que presentan una elevación del segmento ST en el ECG. Por el contrario, no ha podido comprobarse su eficacia cuando el ECG muestra depresión del segmento ST (infartos no transmurales o sin onda Q) o cuando es normal. Una vez transcurridas 6 h desde el comienzo de los síntomas, sólo se aconseja tratar a los pacientes en los que persisten el dolor y los signos electrocardiográficos de isquemia. Las contraindicaciones del tratamiento trombolítico se circunscriben fundamentalmente a los casos de diátesis hemorrágicas, antecedentes de hemorragia cerebral, intervenciones mayores recientes, úlcera gastroduodenal activa y retinopatía diabética, entre otras. La angioplastia coronaria se ha ensayado, con buenos resultados, como tratamiento alternativo a los trombolíticos en los pacientes que presentan contraindicaciones a éstos. Recientemente, se ha sugerido incluso que la angioplastia, en comparación con los trombolíticos, determina una mayor tasa de repermeabilización, menor grado de estenosis residual y de isquemia residual y, en un estudio, menor tasa de mortalidad y reinfarto. De cualquier forma, estos resultados deben confirmarse, y las dificultades de orden logístico y económico determinan que los trombolíticos sean el tratamiento de elección. Varios estudios han revelado que la realización de una angioplastia coronaria sistemática tras la trombólisis, con el fin de disminuir la estenosis arterial coronaria residual, no ofrece ventajas y se acompaña de un número mayor de complicaciones.
El International Study on Infarct Survival 2 (estudio ISIS 2) demostró de una manera definitiva que la administración de AAS dentro de las primeras horas del infarto reduce la mortalidad en un 20%; de esta forma, tan pronto se sospecha el diagnóstico de infarto, se recomienda administrar una dosis de al menos 160 mg de AAS. El papel de la heparina como tratamiento coadyuvante de la trombólisis es más discutible. Los resultados de los diferentes estudios que han abordado este problema son contradictorios, probablemente por las diferencias en las dosis y las vías de administración de la heparina. Además, su eficacia guarda relación con el fibrinolítico utilizado, siendo mayor cuanto más corta es la vida media de éste; así pues, hoy podría concluirse que la heparina es necesaria cuando se administra tPA, mientras que no se ha demostrado su utilidad con la estreptocinasa. La administración temprana de bloqueadores betadrenérgicos por vía intravenosa, seguida de mantenimiento por vía oral durante la hospitalización del paciente, reduce la mortalidad del infarto durante los primeros 7 días en un 15%; el efecto es máximo en los primeros 2 días, probablemente por la prevención de la rotura cardíaca y la fibrilación ventricular.
6. Tratamiento de las complicaciones.
Tratamiento de las arritmias. La corrección de los factores que condicionan o favorecen la aparición de las alteraciones del ritmo constituye el primer paso en el tratamiento de las arritmias en la fase aguda del infarto. De esta forma deben controlarse la hipoxemia o la hipopotasemia, si las hubiese, y suprimir el dolor. Los fármacos y las pautas son similares a los descritos en los apartados correspondientes. La angina de pecho que ocurre precozmente, durante el período de hospitalización del infarto, en particular si se acompaña de cambios eléctricos, es un signo de mal pronóstico y una indicación de coronariografía y revascularización.
Tratamiento de las complicaciones mecánicas. La insuficiencia cardíaca es una complicación grave, cuyo tratamiento adecuado exige contar con parámetros hemodinámicos y clínicos, por lo que constituye una indicación para la monitorización del gasto cardíaco y de la presión pulmonar. El tratamiento difiere sensiblemente de otros tipos de insuficiencia, sobre todo porque la digital se considera ineficaz e incluso contraindicada, excepto cuando existe fibrilación auricular. Los diuréticos y los vasodilatadores constituyen los fármacos de elección en las formas leves o moderadas, mientras que en los casos graves se añaden aminas simpaticomiméticas, como dopamina o dobutamina. El tratamiento del shock cardiogénico tiene como objetivo elevar la presión arterial y el gasto cardíaco a niveles que permitan una perfusión tisular adecuada, en particular en la circulación coronaria, cerebral y renal. El fármaco más utilizado es la dopamina, que a dosis bajas (2-5 mg/kg/min) tiene un efecto betadrenérgico, aumenta la contractilidad y al mismo tiempo produce vasodilatación renal por estimulación de los receptores dopaminérgicos; a dosis altas ejerce una acción vasoconstrictora. La dobutamina es menos taquicardizante, carece de efecto sobre la circulación renal y se utiliza en los pacientes con frecuencia cardíaca muy elevada. Cuando las aminas simpaticomiméticas consiguen elevar la presión arterial y persiste la congestión pulmonar (presión capilar elevada), puede añadirse un vasodilatador como el nitroprusiato sódico con el fin de disminuir la poscarga del ventrículo izquierdo. Si la respuesta inicial al tratamiento médico no es satisfactoria puede recurrirse a la asistencia circulatoria mecánica con el balón de contrapulsación intraórtica. Recientemente se ha sugerido que la apertura precoz de la arteria responsable del infarto mediante fibrinolíticos y angioplastia puede mejorar la función ventricular y el pronóstico. De cualquier forma, la mortalidad del shock continúa siendo muy elevada. La rotura de la pared libre del ventrículo es siempre una urgencia quirúrgica y sólo en contados casos es posible evitarla muerte inmediata; en los casos más favorables en que se forma un falso aneurisma (seudoaneurisma), el tratamiento quirúrgico proporciona mejores resultados. El tratamiento de la rotura del tabique interventricular tiene como objetivo controlar la insuficiencia cardíaca y estabilizar al paciente durante el mayor tiempo posible con el fin de retrasar la intervención quirúrgica unas semanas, cuando la mortalidad es menor; si ello no fuese posible debe intervenirse de urgencia. La rotura del músculo papilar es también una urgencia quirúrgica; hasta el momento de la intervención, la insuficiencia cardíaca y la congestión pulmonar deben aliviarse con vasodilatadores por vía intravenosa.
Morbilidad y mortalidad tardías. Pronóstico a largo plazo. En los pacientes que sobreviven a un infarto de miocardio persiste el riesgo de que se produzca un nuevo accidente coronario o la muerte de forma prematura. La mortalidad en los primeros 6 meses de convalecencia se sitúa alrededor del10% y se estabiliza posteriormente en el 3-4% anual. A los 5 años, del 20 al 35% de los supervivientes de un infarto han fallecido. En este mismo período, el 13% de los varones y el 39% de las mujeres han desarrollado un nuevo infarto. Existe cierta evidencia en la literatura de que el pronóstico postinfarto de miocardio ha mejorado en los últimos años. Así, en los pacientes tratados con trombolíticos la mortalidad a los 6 meses es del 3-4%. Los factores que determinan el pronóstico a largo plazo son fundamentalmente tres: el grado de disfunción ventricular residual, la gravedad de la afectación coronaria, expresada por el número de arterias con lesiones, y la presencia de arritmias ventriculares graves. Así, el pronóstico es excelente en los pacientes con fracción de eyección normal (³ 50%), que presentan una mortalidad a los 4 años del 4%. Por el contrario, los enfermos con fracción de eyección inferior al 30%, afectación de los tres vasos y arritmias ventriculares repetitivas constituyen un grupo de riesgo elevado. Mención especial merecen los infartos sin onda Q; aunque la mortalidad durante el período de hospitalización es inferior a la del infarto con onda Q, el pronóstico a largo plazo es más grave, por lo que se aconseja su evaluación precoz mediante ergometría y coronariografía. En diferentes series de la literatura la mortalidad en los primeros 2-3 años alcanzó el 31%, y la incidencia de reinfarto durante la hospitalización, el 15%, 3 veces más que la de los infartos con onda Q.
Tratamiento tras el alta hospitalaria. Prevención secundaria. Los objetivos del tratamiento una vez superada la fase aguda son interrumpir la progresión de la enfermedad coronaria, prevenir la muerte súbita y el reinfarto, controlar los síntomas, si los hubiese, y conseguir la rehabilitación funcional y laboral del paciente. Previamente al alta, el paciente debe recibir información sobre la necesidad de controlar los factores de riesgo, en particular el tabaquismo, la hipertensión arterial y la hipercolesterolemia. En este sentido, debe instruírsele sobre la importancia de abandonar el hábito tabáquico y de seguir una dieta baja en colesterol y sodio. Salvo contraindicaciones, los bloqueadores betadrenérgicos constituyen el tratamiento de elección en la hipertensión arterial de estos enfermos. Aunque los resultados con los antiagregantes no son concluyentes, se recomienda administrar AAS (100-200 mg/día) de forma crónica. Los anticoagulantes por vía oral se reservan para los pacientes con infartos extensos, aneurismas o evidencia de trombos intracavitarios en el ecocardiograma; el tratamiento se mantiene 6 meses. Los bloqueadores betadrenérgicos han demostrado un efecto favorable sobre el pronóstico, con una reducción de la mortalidad del 30%. Sin embargo, se ha puesto en duda la conveniencia de administrar de manera sistemática bloqueadores adrenérgicos a todos los pacientes que sobreviven a la fase aguda del infarto, ya que un porcentaje apreciable de ellos tiene un buen pronóstico. Por el contrario, parece razonable tratar de identificar a aquellos con riesgo de muerte o reinfarto, con el fin de individualizar el tratamiento. Como se ha mencionado en el apartado anterior, el cateterismo cardíaco permite conocer la probabilidad de desarrollar un nuevo accidente coronario grave mediante la coronariografía (número de arterias afectas) y la ventriculografía (fracción de eyección). Aunque en algunos centros se realiza de forma sistemática durante la segunda semana del infarto, previamente al alta, la práctica más extendida consiste en evaluar el riesgo a través de pruebas incruentas, en especial la ventriculografía isotópica y la prueba de esfuerzo. Se consideran enfermos de alto riesgo los que tienen una fracción de eyección inferior al 30%, los que presentan angina o depresión del segmento ST en los primeros estadios de la prueba de esfuerzo, aquellos en los que la depresión es superior a 0,2 mV y, en general, los enfermos que tienen una capacidad funcional muy limitada.
Un estudio reciente ha demostrado que el tratamiento con captopril reduce el remodelado ventricular y mejora la supervivencia; por ello se aconseja su administración en pacientes con infartos extensos o fallo cardíaco. El tratamiento de la angina tras el infarto no difiere del de otras formas de angina, aunque su aparición precoz es para muchos autores una indicación de cateterismo y cirugía o angioplastia, en especial si se acompaña de cambios en el segmento ST durante la crisis anginosa. No obstante, si éstas son recortadas, sin cambios eléctricos importantes, y se controlan bien con la medicación, la decisión puede retrasarse hasta la realización de la prueba de esfuerzo antes del alta. El tratamiento antiarrítmico sólo está indicado en presencia de arritmias ventriculares sintomáticas o potencialmente letales; la amiodarona y el sotalol parecen los fármacos de elección. Por el contrario, los antiarrítmicos tipo I pueden incrementar la mortalidad. El ejercicio físico moderado y progresivo es una parte importante de la rehabilitación del enfermo coronario; su intensidad debe prescribirse de forma individual, de acuerdo con la existencia de síntomas y los resultados de la prueba de esfuerzo. La gran mayoría de los enfermos pueden reanudar la actividad sexual unas 4 semanas después del infarto y alrededor del 60-75% de los pacientes pueden volver a su actividad laboral al cabo de 3 meses; constituyen una excepción los pacientes cuyo trabajo implica una actividad física extenuante o puede afectar la seguridad de otras personas (pilotos, conductores de autobuses) y, lógicamente, aquellos que padecen una disminución grave de su capacidad funcional por angina o insuficiencia cardíaca. La comprensión y la ayuda del médico constituyen factores importantes en la rehabilitación social y laboral del paciente, que a menudo tiende a la depresión una vez que abandona el hospital.
Otras formas de la enfermedad coronaria. Como ya se ha indicado, la cardiopatía coronaria puede adoptar diferentes formas clínicas, de las cuales la angina y el infarto de miocardio son las más frecuentes; en ocasiones, la enfermedad puede presentarse sin dolor, como en la insuficiencia mitral aguda por rotura de un músculo papilar, en algunos casos de arritmias graves, en la muerte súbita, en la denominada isquemia silente y en la miocardiopatía isquémica.
Isquemia silente
Algunos pacientes con aterosclerosis coronaria importante pueden presentar episodios de isquemia miocárdica que no se acompañan de angina; aunque la existencia de este fenómeno se conoce desde hace varias décadas, la posibilidad de diagnosticarlo mediante la electrocardiografía dinámica (Holter) o durante la monitorización en la unidad coronaria ha despertado recientemente mucho interés por su estudio. Se ha demostrado que alrededor del 75% de los pacientes con lesiones coronarias significativas muestran desplazamientos del segmento ST durante el día y que sólo un tercio de estos episodios se acompaña de dolor; estos cambios de la repolarización ventricular sin dolor anginoso asociado se han demostrado también en pacientes con angina variante, en los que se atribuye a espasmos coronarios transitorios. Por el contrario, las alteraciones del segmento ST en individuos sin enfermedad coronaria durante un registro electrocardiográfico de 24 h (Holter) son extremadamente raras si se utiliza un equipo adecuado. Hasta el momento se desconocen la importancia, el significado clínico y el valor pronóstico de la isquemia silente.
Miocardiopatía isquémica.
En ocasiones la aterosclerosis coronaria determina una grave afectación de la función ventricular que provoca síntomas y signos de insuficiencia cardíaca congestiva, a menudo sin dolor anginoso; estos pacientes se presentan con un cuadro clínico similar al de la miocardiopatía dilatada, y sólo la existencia de lesiones aterosclerosas en la coronariografía permite su diagnóstico diferencial. El ECG puede sugerir el diagnóstico cuando muestra signos electrocardiográficos de necrosis. El pronóstico es grave, es especial en el caso de pacientes que cursan con arritmias ventriculares malignas.
Conclusiones
Podemos concluir que la insuficiencia coronaria esta causada principalmente por una deficiencia del flujo coronario que puede estar dada por diferentes factores, donde encontramos que el principal es la arteriosclerosis. La insuficiencia coronaria trae aparejado otras complicaciones cardiacas como angina de pecho e infarto del miocardio el cual es la principal causa de muerte a nivel mundial y en nuestro país.
BIBLIOGRAFÍA ACOTADA
1. INFOMED. Estadísticas de Salud en Cuba. Anuario Estadístico 2003 – Mortalidad. MORTALIDAD POR ENFERMEDADES DEL CORAZÓN 1970, 1980, 2002 – 2003.
2. INFOMED. Texas Herat Institute. Leading With The Heart. Enfermedad Arterial Coronaria.
3. Cecil.tratado de medicina interna .tomo 1parte 7 enfermedades cardiovasculares
4. guyton-hall. Tratado de fifiologia medicca.tomo1.interamericana mac graw-hill.
BIBLIOGRAFÍA CONSULTADA
· Cecil Pusell le Fayette, 1994. Tratado de Medicina Interna, México.
· Cecil, Bennett yPlum, 1998. Tratado de Medicina Interna, Vol. 1.
· Departamento de Documentación de Prensa Latina, Cables sobre Insuficiencia Coronaria, 2003-2004.
Autores:
Roberto A. Díaz Ríos.
Deborah Rodríguez Verdecie.
Asesor:
Dr. Rodolfo Cusa.
ISCM-H. Facultad Dr. Salvador Allende.