El esófago de Barrett es una de las afecciones digestivas que más interés suscita en reuniones y congresos de la especialidad, a pesar de haber sido descrito hace 50 años por Norman Barrett. Se ha reconocido la predisposición al desarrollo del adenocarcinoma esofágico, por lo que se han utilizado métodos auxiliares en el diagnóstico endoscópico, algunos más antiguos como la cromoendoscopia con ácido acético, lugol y azul de metileno, mientras hoy día se pueden emplear otros más novedosos, todos con el fin de mejorar el diagnóstico y favorecer la vigilancia endoscópica.
Actualización en el diagnóstico del esófago de Barrett.
* Dra. Anniuska Gigato Diaz
** Dr. Rolando Martínez López
*** Dr. C. Raúl A. Brizuela Quintanilla
**** Dra. Lisset Díaz Díaz
* Especialista 1er grado en MGI y 1er grado en Gastroenterología. Profesor Asistente. Hospital Universitario Clínico Quirúrgico “Manuel Fajardo”. La Habana, Cuba.
** Especialista 1er grado en MGI y 2do grado en Gastroenterología. Profesor e Investigador Auxiliar. Centro Nacional de Cirugía de Mínimo Acceso. La Habana, Cuba.
*** Doctor en Ciencias Médicas. Especialista de 2do grado en Gastroenterología. Profesor e Investigador Titular. Centro Nacional de Cirugía de Mínimo Acceso. La Habana, Cuba.
**** Especialista 1er grado en MGI y 1er grado en Gastroenterología. Hospital Docente Clínico Quirúrgico Salvador Allende. La Habana, Cuba.
RESUMEN
El esófago de Barrett es una de las afecciones digestivas que más interés suscita en reuniones y congresos de la especialidad, a pesar de haber sido descrito hace 50 años por Norman Barrett. Se ha reconocido la predisposición al desarrollo del adenocarcinoma esofágico, por lo que se han utilizado métodos auxiliares en el diagnóstico endoscópico, algunos más antiguos como la cromoendoscopia con ácido acético, lugol y azul de metileno, mientras hoy día se pueden emplear otros más novedosos, todos con el fin de mejorar el diagnóstico y favorecer la vigilancia endoscópica.
Palabras Clave: Esófago de Barrett. Adenocarcinoma.
ABSTRACT:
Barrett's esophagus is a digestive trouble, to which is still paid a great deal of attention in meetings and conferences of the Gastroenterology speciality, in spite of having been described by Norman Barrett 50 years ago. The predisposition to the development of esophageal adenocarcinoma has been recognized, for what auxiliary methods have been used in the endoscopic diagnostic, some older ones as the cromoendoscopia with acetic acid, lugol and metylen blue, while nowadays other more novel ones can be used, all with the purpose of to improve the diagnosis and to favor the endoscopic surveillance.
Key words: Barrett´s esophagus. Adenocarcinoma
DEFINICIÓN ACTUAL
El Esófago de Barrett (EB) se define como la presencia de mucosa columnar con metaplasia intestinal en el esófago distal, incluida la mucosa que tapiza el esfínter esofágico inferior, por lo que se ha convertido en un criterio anatomopatológico más que endoscópico, ya que sólo sería posible identificar la metaplasia intestinal mediante histología. (1, 2,3)
FISIOPATOLOGÍA
Inicialmente se postuló un origen congénito, actualmente se acepta como una condición adquirida, en la que una injuria intensa y sostenida sobre el epitelio del esófago distal, generalmente debida al reflujo gastroesofágico (RGE), provoca el reemplazo del epitelio plano pluriestratificado normal por un epitelio columnar metaplásico, más resistente al ácido. El origen de este nuevo epitelio serían células pluripotenciales ubicadas en la capa basal o germinativa del epitelio esofágico. (4)
La acción del ácido sobre la metaplasia produce proliferación, diferenciación celular y cambios genéticos, tratando de mantener la supervivencia celular. Es un proceso en tres fases; la primera consiste en una predisposición genética y racial (blanco, masculino) con una prolongada exposición, oculta o con expresión clínica al reflujo gastroesofágico (RGE) y una transformación a un nuevo fenotipo celular, la segunda fase es la formación de nuevas matrices de fenotipo que desarrollarán segmentos cortos o largos y la tercera fase, la progresión hacia displasia y cáncer. (5,6)
Estudios recientes con el "Bilitec 2000", con el que se puede detectar la presencia de bilirrubina como marcador del reflujo biliar, se ha observado un aumento en la exposición del esófago distal al reflujo biliar en los pacientes con esófago de Barrett. Estos componentes, inducirían un proceso metaplásico que cambia el fenotipo de las células pluripotenciales del epitelio escamoso, hacia un fenotipo mucosecretor y que también podría estar implicado en los mecanismos que conducen al desarrollo del adenocarcinoma del esófago. En este sentido, los ácidos biliares dihidroxilados (desoxicólico y quenodesoxicólico), pueden activar la transcripción de la ciclooxigenasa-2 (COX-2) en líneas celulares de adenocarcinoma, ya que las prostaglandinas inhiben la apoptosis, disminuyen la inmunidad e incrementan la capacidad de invasión de las células malignas. (7)
EPIDEMIOLOGIA.
La prevalencia del Esófago de Barrett (EB) en poblaciones adultas de EE.UU. es de 0,4% a 1,3%, aunque recientes reportes sugieren una prevalencia mayor. (8,9)
Se ha encontrado Esófago de Barrett (EB) en el 8 al 20% de los pacientes sometidos a endoscopia por síntomas de reflujo gastroesofágico y en menos del 1% de pacientes no seleccionados a quienes se les practica una endoscopia alta. El promedio de edad de estos pacientes es de 55 años (2, 5, 10,11) y la relación hombre-mujer de 5:1 (10,11). La prevalencia aumenta hasta alcanzar una meseta entre la séptima y la novena década de la vida, (12) es poco frecuente en niños y muy raro antes de los 5 años.
Los pacientes portadores de Esófago de Barrett (EB) con alto riesgo para desarrollar un adenocarcinoma se consideran; blancos, masculinos, mayores de 50 años, obesos, con síntomas de reflujo gastroesofágico (ERGE) de larga fecha, historia de tabaquismo, alcohol y antecedentes de cáncer familiar (2,13) Se estima que la progresión del Esófago de Barrett (EB) al adenocarcinoma en pacientes con reflujo gastroesofágico (ERGE) es aproximadamente de 0.5% por año. (11, 14,15)
DIAGNÓSTICO CLÍNICO
No existe una sintomatología propia del esófago de Barrett, los pacientes tienen generalmente una historia larga de reflujo gastroesofágico (RGE), con presencia de pirosis y episodios nocturnos de regurgitación, aunque ni la frecuencia ni la severidad de la pirosis predicen la presencia de metaplasma, (16) sin embargo, existe un porcentaje de ellos que se encuentran asintomáticos en el momento del diagnóstico y entre el 5.6 % y 25 % de los pacientes tienen metaplasia sin pirosis previa. (17, 18)
La exploración para detectar el esófago de Barrett continúa siendo polémica, debido a la falta de impacto documentado acerca de la mortalidad por adenocarcinoma esofágico. El gran número de pacientes que no presentan síntomas de reflujo, pero que tienen esófago de Barrett, plantea un desafío para el diagnóstico. (3)
DIAGNÓSTICO ENDOSCÓPICO
Los desafíos en la exploración para detectar el Esófago de Barrett (EB) incluyen, la incapacidad de pronosticar quién tiene Esófago de Barrett (EB) antes de la endoscopia, la falta de criterios basados en la evidencia, el carácter invasivo y el gasto de la endoscopia y la creciente documentación de un subgrupo de pacientes con Esófago de Barrett (EB), que no presentan síntomas de reflujo. (3)
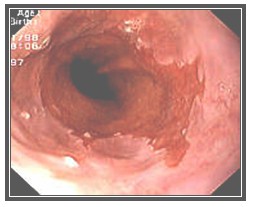
El epitelio de Barrett se reconoce durante la endoscopia por el color rosa salmón y aterciopelado, en contraste con el color blanco nacarado de la mucosa escamosa normal del esófago, a nivel de la unión esófago-gástrica (UEG) (Foto). Puede adoptar varias configuraciones: en islotes o parches de mucosa dentro del esófago, por encima de la unión esófago-gástrica, en lengüetas o extensiones digitiformes, o encontrarse en una unión esófago-gástrica (UEG) de aspecto irregular o prominente, incluso normal. (19) Puede clasificarse endoscópicamente como:
Esófago de Barrett (EB) de segmento corto (menor de tres centímetros)
Esófago de Barrett (EB) segmento largo (mayor de tres centímetros)
Esófago de Barrett (EB) ultracorto (menor de dos centímetros)
Recientemente un grupo de investigadores, dedicados al estudio del Esófago de Barrett (EB), presentaron los criterios de un consenso basado en la evidencia sobre el diagnóstico endoscópico de esta enfermedad, que han sido llamados “Criterios de Praga” y nos reportan la extensión máxima (M) y circunferencial (C) del Esófago de Barrett (EB) sospechado por endoscopia. Este sistema identifica las señales de la unión escamoso-columnar, la unión gastroesofágica, la dimensión del revestimiento columnar circunferencial y la extensión más proximal de la mucosa columnar excluyendo los islotes, para determinar la longitud del esófago de Barrett. (3, 20)
La endoscopía de vigilancia continúa siendo polémica, debido a la falta de pruebas aleatorias que confirmen su valor. El análisis crítico de la literatura sugiere que la vigilancia endoscópica sí ofrece una ventaja para la supervivencia. Se han publicado múltiples estudios retrospectivos, todos los cuales indican que las estadísticas de supervivencia aumentan si se detectan los cánceres mediante vigilancia endoscópica. El grado de la displasia determina el intervalo de vigilancia apropiado. Cualquier grado de displasia, determinado mediante la histología, debe ser confirmado por un patólogo experto. (3)
DIAGNÓSTICO HISTOLÓGICO
Se basa en la identificación de epitelio columnar especializado con células caliciformes. La metaplasia intestinal puede ser clasificada en tipo I, II y III. En la tipo I o completa, las células caliciformes producen mucina ácida, en la tipo II o incompleta la células metaplásicas están constituidas por células caliciformes inmaduras que producen sialomucinas ácidas y en la de tipo III, producen sulfomucinas. Diversos estudios señalan, que la metaplasia completa incrementa poco el riesgo de carcinoma, mientras que la tipo III es considerada como una lesión con riesgo elevado de transformación neoplásica. (21,22)
El estudio histológico es el “gold standard” y no ha sido superada para el diagnóstico de la metaplasia columnar, la displasia y el adenocarcinoma. (23) La detección de displasia, constituye el único marcador de riesgo de malignización en pacientes con Esófago de Barrett (EB), no siendo reconocible endoscópicamente, por lo que es necesario realizar biopsias sistemáticas de la mucosa metaplásica, obtenidas cada 2 cm. en los 4 cuadrantes por encima de la unión esófago-gástrica (UEG). (23,24) La clasificación de displasia que se utiliza en la actualidad, es la misma que para cualquier epitelio: negativa, indefinida, de bajo y de alto grado (24,25).
Negativo para D/NI
Se aplica para las muestras que tengan epitelio columnar metaplásico con cambios regenerativos, que incluyen alteraciones citológicas como atipia celular, pero con preservación de la arquitectura glandular.
Indefinido para D/NI
La arquitectura glandular está intacta o tiene leves cambios, cambios citológicos más intensos que los regenerativos y generalmente se asocian con ulceración o erosión del epitelio. Puede originarse por la mala preservación del tejido o deficiente técnica histológica.
Positivo para D/NI
Este debe ser clasificado en bajo (NIBG) o alto grado (NIAG), utilizando para ello dos criterios: alteraciones citológicas (cambios nucleares) y características de arquitectura (forma y crecimiento de las glándulas).
D/NI de bajo grado
Los cambios incluyen núcleos agrandados, hipercromáticos con contornos nucleares irregulares, leve estratificación con preservación de la polaridad, disminución en el número de células caliciformes. El epitelio neoplásico muestra una abrupta transición con el epitelio no neoplásico. Las alteraciones en la arquitectura se caracterizan por la presencia de criptas de contornos irregulares, con bifurcación de algunas de las glándulas.
D/NI de alto grado
Los cambios citológicos incluyen aumento en la estratificación, marcada atipia, pleomorfismo, con pérdida de la polaridad, abundantes mitosis atípicas, múltiples nucléolos e importante disminución de células caliciformes y moco. Los cambios arquitecturales incluyen glándulas con un patrón de crecimiento velloso, criptas bifurcadas con papilas y puentes intraglandulares. (28,29)
En un futuro cercano, el uso de marcadores biológicos de proliferación celular y detección de alteraciones en oncogenes y genes supresores de tumor, en áreas de mucosa metaplásica, constituirán herramientas de detección precoz de adenocarcinoma esofágico.
CAPSULA ENDOSCÓPICA
La cápsula endoscópica esofágica es una nueva técnica que tiene el potencial para proporcionar un diagnóstico no invasivo del posible Esófago de Barrett (EB). A los primeros estudios de pequeñas muestras de pacientes que mostraban alta sensibilidad, les han seguido conjuntos de datos en forma de resúmenes que documentan una sensibilidad considerablemente menor, aunque resulta interesante, esta técnica no se recomienda en estos momentos en el marco de la exploración. Se prevé que el costo de la cápsula y su precisión serán barreras para reducir su utilidad en la detección de esta afección. (30, 31)
MÉTODOS ENDOSCÓPICOS AUXILIARES EN EL DIAGNOSTICO DEL ESÓFAGO DE BARRETT
Cromoendoscopia convencional
Se conoce como cromoendoscopia al conjunto de técnicas de tinción de la superficie mucosa del tracto gastrointestinal y que se aplica a través de procedimientos endoscópicos, las que permiten visualizar detalles, realzar o delimitar lesiones ya detectadas y facilitar el diagnóstico de algunas que pasan inadvertidas con las técnicas convencionales. De esta forma se ayudan a delimitar áreas de inflamación, metaplasia, displasia o cáncer, lo cual facilita la toma de biopsias dirigidas. Son técnicas sencillas, baratas, rápidas y prácticamente exentas de efectos adversos.
Los colorantes se clasifican en base a su interacción con la mucosa gastrointestinal: (32, 33, 34,35)
- De absorción (vitales): penetran en la célula por medio de difusión o absorción a través de la membrana celular. Azul de metileno, azul de toluidina y lugol.
- Reactivos: interaccionan con determinadas sustancias en la célula produciendo cambios de color característicos. Rojo Congo y rojo fenol.
- De contraste: no son absorbibles, se depositan entre las elevaciones y depresiones de la mucosa produciendo un realce de su topografía. Índigo carmín.
- De tatuaje: Se inyectan a nivel de la submucosa proporcionando una marca permanente. Tinta china.
En el esófago, los más empleados son:
Azul de metileno, que es captado por las células absortivas del epitelio intestinal, de utilidad en el diagnóstico y seguimiento del Esófago de Barrett (EB), facilitando la detección de metaplasma intestinal, lo que permite la toma de biopsias dirigidas.
Azul de toluidina, es un colorante metacromático con gran afinidad por los ácidos nucleicos, lo que lo hace útil para delimitar zonas con displasia o cáncer, dadas la elevada actividad mitótica de estos tejidos.
Solución de lugol, que tiñe el glucógeno de las células escamosas no queratinizadas del esófago. Las lesiones inflamatorias, displasias y el carcinoma, tienen menor contenido de glucógeno y dan lugar a zonas no coloreadas, que las diferencian del epitelio normal.
Índigo carmín, un colorante de contraste, que permite visualizar con detalles el epitelio intestinal, específicamente cuando se utiliza endoscopia de alta resolución o magnificación. Permite detectar lesiones diminutas, planas o deprimidas, que no son visibles con la endoscopia convencional y aunque se ha utilizado más frecuentemente en lesiones de estómago y colon, se puede emplear en el esófago.
Tinta china, resulta un colorante de inyección submucosa (tatuaje), se utiliza para marcar base de pólipos y diferentes lesiones para la localización por el cirujano, se ha utilizado en el Esófago de Barrett (EB) para marcar el límite entre el epitelio metaplásico y la mucosa del esófago normal.
MAGNIFICACIÓN
Las últimas series de endoscopios han logrado no solo gran amplificación de x2.5 a x150, sino también una alta resolución que aporta imágenes más nítidas y que unido a las tinciones, resalta aún más las formas. Hay un nuevo aditamento (endocitoscopio) que se introduce por el conducto de operaciones del endoscopio estándar y que permite aumentos de 450 a 1225 veces y da un campo de visión de 120 mm x 120 mm y requiere tinción con azul de metileno, para estudiar la superficie mucosa. (36)
La utilización de magnificación endoscópica (ME) hace posible identificar el patrón velloso, relacionado con la presencia de metaplasia intestinal especializada, que representa áreas de displasia o carcinoma incipiente, lo que incrementa su detección y permite el tratamiento. En la ME se reconocen cuatro patrones diferentes de Esófago de Barrett: I- Redondo, II- Reticular, III- Velloso y IV- Ramificado o cerebroide, los más frecuentemente asociados a displasia o carcinoma son el III y IV. (3)
INDUCCIÓN DE FLUORESCENCIA
Mediante dosis bajas (10-20mg kg/peso) de ácido 5 aminolevulínico, fotosensibilizador utilizado en terapia fotodinámica, y un haz de luz roja, las zonas displásicas pueden ser fluoresceína-negativas y guiar el sitio de la toma de biopsia.
(37 38,39)
AUTOFLUORESCENCIA
Los tejidos expuestos a la luz con longitud de onda corta, ultravioleta o azul, algunas substancias biológicas, fluoróforos son estimulados y emiten una luz a lo que se llama autofluorescencia (AF) y se ha demostrado que los tejidos neoplásicos y no neoplásicos tienen una autofluorescencia diferente. Se ha desarrollado, en base a esta cualidad, una técnica endoscópica para la vigilancia del Esófago de Barrett (EB), donde en la imagen vista con autofluorescencia, el epitelio escamoso y el Esófago de Barrett (EB) no displásico tienen color verde, en cambio el Esófago de Barrett (EB) que tiene displasia o cáncer es de color azul/púrpura. Algunos islotes de tejido escamoso dentro del Esófago de Barrett (EB) tienen color rosado. (36, 40,41)
ESPECTROSCOPIA CON LUZ INFRARROJA (LASER)
El principio físico es que cada epitelio emite un espectro diferente de acuerdo a la calidad del tejido, de tal manera que se conoce el espectro normal para el epitelio escamoso, el metaplásico de tipo intestinal, displasia y cáncer. El procedimiento consiste en introducir una sonda de fibra óptica por el canal del trabajo del endoscopio, la cual emite un haz de luz que estimula al tejido para la producción de un espectro que es recogido por el mismo instrumento y se plasma en una gráfica en un monitor alterno al del endoscopio, en tiempo real, la ventaja es también la guía de la toma de la biopsia y la identificación de sitios displásicos y neoplásicos. (40)
ENDOMICROSCOPIA LASER CONFOCAL
Es la tecnología más avanzada para el estudio de la mucosa a nivel celular y subcelular. Se integra un microscopio confocal en la punta de endoscopio cercano al convencional aunque tiene dos guías de luz, un conducto de instilación extra para materiales de contraste y dos botones adicionales para el control del plano de profundidad de la imagen. El láser que se usa es el de argón. Antes de introducir el endoscopio se instilan 5 ml de fluoresceína al 10%. Se elige el sitio de estudio y se hace contactar la punta del endoscopio con la mucosa de forma gentil y los botones del control se elige el plano focal y se guardan imágenes desde la superficie hasta la profundidad de la mucosa, obteniéndose imágenes de gran calidad, con los bordes precisos de las células, con capilares con eritrocitos, los núcleos vacíos por las propiedades de la fluoresceína, el moco de las células caliciformes y otros detalles no vistos anteriormente por un endoscopio. Consiste en la combinación del principio de histología in vivo con la videoendoscopia, estudiando todo el espesor de la mucosa, aunque actualmente se encamina hacia su perfeccionamiento desde el punto de vista diagnóstico y técnico. (36)
IMAGEN DE BANDA ESTRECHA (NBI)
A través de este método se obtiene una imagen endoscópica por la conjunción de tres colores: rojo, verde y azul, este es el que tiene menor penetración por lo que para resaltar la vascularidad, se dio predominio al azul con reducción de los otros dos por medio de filtros. La nueva imagen impresiona algo más, pero con ayuda de la amplificación, los detalles y la vascularización son mucho más evidentes y no se requiere tinción (36)
CROMOENDOSCOPIA VIRTUAL COMPUTARIZADA (FICE) / IMAGEN DE BANDA OPTIMA (OBI)
Recientemente ha sido desarrollado, un nuevo sistema tecnológico en endoscopia, basado en el uso espectral de la luz, que toma una imagen endoscópica ordinaria del videoprocesador, la procesa y usando longitudes de ondas seleccionadas de la luz blanca, obtiene una imagen que realza y magnifica las características de la mucosa, lo que permite la identificación de cambios morfológicos en el tejido sin el empleo de colorantes. Este sistema ha recibido varias denominaciones: Cromoendoscopia virtual computarizada (CVC), Fuji Intelligent Color Enhancement (FICE), Sistema de “Realce Inteligente del Color”, ”Tecnología de estimación espectral” y más recientemente “Optimal band imaging system (OBI) (42)
TOMOGRAFÍA ÓPTICA COHERENTE
Sigue el principio del ultrasonido y es capaz de identificar, además de epitelio metaplásico, la localización de lesiones submucosas y estadificarlas adecuadamente, el equipo es portátil y se emplea una sonda que se introduce a través del canal de trabajo del endoscopio. (39)
ECOENDOSCOPIA
Combina la endoscopia con la ultrasonografía y consiste en la aplicación de un transductor ecográfico en la pared esofágica, a nivel de la zona de epitelio columnar, lo que permite evaluar sus características, áreas de engrosamientos que pudieran corresponder a zonas de displasia y cáncer, incluso puede detallar la presencia de adenopatías en las cercanías del esófago. Esta técnica se podría usar para determinar opciones terapéuticas en pacientes con displasia de alto grado. (32)
BIOMARCADORES DE ALTERNATIVA
Los marcadores tumorales y/o genéticos son aquéllas sustancias biológicas, sintetizadas y liberadas por células malignas ó producidas por el huésped en respuesta a la presencia de tejidos neoplásicos y sustancias relacionadas con alteraciones genéticas (oncogenes). (43) En la actualidad se recomienda la utilización del p53 (gen supresor ó antioncogén y regulador del ciclo celular) y el Ki67 (marcador de proliferación celular). La detección de mutación o disminución del gen supresor de tumores p53 está asociada con la presencia de neoplasia, como en el cáncer asociado con esófago de Barrett. Estos pacientes pueden tener los anticuerpos contra p53, los que sirven de marcadores de la enfermedad, pero su sensibilidad es baja. (44)
BIBLIOGRAFÍA
1. BOYCE H.W. Jr. What are the defining indices of the esophagogastric junction andthe defining criteria for columnar lined esophagus (LE)? In: The esophageal mucosa. Eds. R.Giuli, G.N.J Tytgat, T.R. De Meester, J.P.Galmiche. Elsevier, Amsterdam, 2006(775-780).
2. Mitsuyo Yoshizawa, Hiroyuki Osawa, Hironori Yamamoto, Kiichi Satoh, Hidetoshi Nakano,Mamiko Tsukui and Kentaro Sugano. Newly developed optimal band imaging system for the diagnosis of early gastric cancer. Digestive Endoscopy 2008;20:194–197
3. Wang Kk, Sampliner RE. Updated Guidelines 2008 for the Diagnosis, Surveillance and Therapy of Barrett’s Esophagus. Am J Gastroenterol 2008;103:788–797
4. Trakál E, Butti ALL, Ortiz GA, et al. Precancerous and non-precancerous Barrett´s esophagus. Gastroenterology 2007;112:A670
5. Triadafilopoulos G. Acid and bile reflux in Barrett´s esophagus: a tale of two evils. Gastroenterology 2001;121:1502-6
6. Triadafilopoulos G. The acid conundrum. en: Modlin I. GERD then and now. Yale University School of Medicine, 2003;96-98.
7. Miller BA, Kolonel LN, Bernstein L, et al. Racial/Ethnic patterns of cancer in the United States 1998-1992. National Cáncer Institute Bethesda, Maryland 2006; NIH Pub.No. 96-4104.
8. Parquet RA, Saenz RF. Esófago de Barrett. Actualización del tratamiento endoscópico. Acta Gastroenterol Latinoam Diciembre 2007;37(4):250-258
9. Sharma VK, Wang KK, Overholt BF, et al. Balloon-based, circumferential, endoscopic radiofrequency ablation of Barrett’s esophagus: 1-year follow-up of 100 patients. Gastrointest Endosc 2007;65:185-195.
10. Chandrasoma PT, Der R, Dalton P, et al. Distribution and significance of epithelial types in columnar-lined esophagus. Am J Surg Pathol 2001;25:1188-93.
11. Vicari J, Falk GW, Richter JE. Helicobacter pylori and acid peptic disorders of the esophagus. Is it conceivable?. Am J Gastroenterol 1997; 92: 1097-1102
12. Helicobacter pylori and Esophageal Cancer Risk: A Meta-analysis Cancer Prevention Research 2008 1: 329-338.
13. Lagergren J, Bergström R, Lindgren A et al. Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma. N Eng J Med 2006;340:825-31.
14. Hazell SL, Carrick J, Lee A. Campylobacter pylori can infect the oesophagus when gastric tissue is present (abstract). Gastroenterology 1998; 94: A178.
15. Shaheen NJ, Crosby MA, Bozymski E•M, Sandler RS. Is there publication bias in the reporting of cancer risk in Barrett´s esophagus? Gastroenterology 2007;119:333-8.
16. Vakil N, van Zanten SV, Kahrilas P, Dent J, Jones R; Global Consensus Group. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence based consensus. Am J Gastroenterol 2006;101:1900-20.
17. Phillips RW, Wong RK. Barrett´s esophagus. Natural history, incidence, etiology, and complications (review). Gastroenterol Clin North Am 1991; 20: 791-816.
18. Gerson LB, Shetler K, Triadafilopoulos G. Prevalence of Barrett´s esophagus in asintomatic individuals. Gastroenterology 2002;123:461-7.
19. Van Blankenstein M, Looman CWN, Hop WC, et al. The incidence of adenocarcinoma and squamous cell carcinoma of the esophagus: Barrett’s esophagus makes a difference. Am J Gastro 2005;100:766–74.
20. Sharma P, Armstrong D, Bergman J, et al. The development and validation of an endoscopic grading system for Barrett’s esophagus–The Prague C and M criteria. Gastroenterology 2006; 130: A121
21. Genta RM. Assessing the regression of Barrett Esophagus. Don´t Try It al home. Avd Anat Pathol 2006; 13 (3): 127-130.
22. Odze RD. Diagnosis and grading of dysplasia in Barrett´s oesophagus. J Clin Pathol 2006; 59: 1029-1038.
23. Spechler SJ. The Barrett’s dilema. en: Modlin I. GERD then and now. Yale University School of Medicine, 2003;110-15.
24. Sharma P, Dent J, Armstrong D, et al. The development and validation of an endoscopic grading system for Barrett’s esophagus: the Prague C & M criteria. Gastroenterology 2006;131:1392–99.
25. Sharma P, McQuaid KR, Dent J, et al. A critical review of the diagnosis and management of Barrett’s esophagus: the AGA Chicago workshop. Gastroenterology 2004;127:310–30
26. Vakil N, van Zanten SV, Kahrilas P, Dent J, Jones R, and Global Consensus Group. The Montreal Definition and Classification of Esophageal Reflux Disease: a Global Evidence-Based Consensus. Am J Gastroenterol, 2006;101:1900-1920.
27. Sharma P, Dent J, Armstrong D, Bergman JJ, Gossner L, Hoshihara Y, Jankowski JA, Junghard O, Lundell L, Tytgat GN, Vieth M. The development and validation of an endoscopic grading system for Barrett’s Esophagus: the Prague C & M criteria. Gastroenterology 2006;131:1392-1399
28. Odze RD. Diagnosis and grading of dysplasia in Barrett´s oesophagus. J Clin Pathol 2006; 59: 1029-1038.
29. Montgomery E, Bronner MP, Goldlum JR et al. Reproducibility of the diagnosis of dysplasia in Barrett´s esophagus (BE). A reaffirmation. Hum Pathol 2001; 32: 368-78.
30. Sharma P, Rastojg A, EsquivelR, et al. Accuracy of wireless capsule endoscopy for the detection of Barrett’s esophagus. Gastroenterology. 2006;130(4 (Suppl 2)):A262 (S1812).
31. Lin O, Schembre DB, KM, et al. Blinded comparison of esophageal capsule endoscopy versus conventional endoscopy for diagnosis of Barrett’s esophagus in patients with chronic gastroesophageal reflux. Gastrointest Endosc 2007;65(4):577–83
32. Jankowski J, Barr H. Improving surveillance for Barrett’s oesophagus. BMJ. 2006;322:1512.
33. Hanna S, Rastogi A,Weston AP, et al. Detection of Barrett’s esophagus after endoscopic healing for erosive esophagitis. Am J Gastro 2006;101:1416–20.
34. Fountoulakis A, Zafirellis K, Dolan K, et al. Effect of surveillance of Barrett’s oesophagus on the clinical outcome of oesophageal cancer. Br J Surg 2004;91:997–1003.
35. Marín R, Gil V, Castellano M, Álvarez C, Belda O. Revisión clínica de la aplicación clínica de los colorantes en cromoendoscopia digestiva y su formulación magistral. Farm Hosp. 2006;30:112-119.
36. De la Torre,A. Métodos de diagnóstico y tratamiento endoscópico del esófago de Barrett.Rev Gastroenterol Mex, Vol. 72, Supl. 2,2007
37. Nestor Landoni. Adelantos en el manejo Endoscópico del esófago de Barrett. Relato por invitación ante el Encuentro Nacional de Gastroenterología y Endoscopía Digestiva (ENGED), Córdoba, Argentina, 2005.
38. Lim CH, Rotimi O,Dexter SPL, et al. Randomized crossover study that used methylene blue or random 4-quadrant biopsy for the diagnosis of dysplasia in Barrett’s esophagus. Gastrointest Endosc 2006;64(2):195–99.
39. Horwhat JD, Maydonovitch CL, Ramos F, et al. A randomized comparison of methylene blue-directed biopsy versus conventional four-quadrant biopsy for the detection of intestinal metaplasia and dysplasia in patienst with long-segment Barrett’s esophagus. Am J Gastroenterol 2007;102(10)
40. Kara MA, Peters FP, Fockens P, et al. Endoscopic videoautofluorescence imaging followed by narrowband imaging for detecting early neoplasia in Barrett’s esophagus. Gastrointest Endosc 2006;64(2):176–85.
41. Falk GW, Skacel M, Gramlich TL, et al. Fluorescence in situ hybridization of cytologic specimens from Barrett’s esophagus: a pilot feasibility study. Gastrointest Endosc 2004;60(1):280–84.
42. Anagnostopoulos GD, Yao K, Kaye P, et al. Novel endoscopic observation in Barrett’s oesophagus using high resolution magnification endoscopy and narrow band imaging. Aliment Pharmacol Therap 2007;26(3):501–07.
43. Ross AS, Noffisinger A, Waxman I. Narrow band imaging directed EMR for Barrett’s esophagus with high grade dysplasia. Gastrointest Endosc 2007;65(1):166–69.
44. Sharma P, Bansal A, Mathur S, et al. The utility of a novel narrow band imaging endoscopy system in patients with Barrett’s esophagus. Gastrointest Endosc 2006;64(2):167–75.