El término de síndrome coronario agudo (SCA) engloba las manifestaciones clínicas de un proceso fisiopatológico progresivo.
La rotura de una placa de ateroma previamente existente en un vaso coronario, desencadena los procesos de agregación plaquetaria y cascada de la coagulación, que provocarán distintos grados de obstrucción al flujo coronario y éstos determinarán angor inestable, Infarto Agudo de Miocardio (IAM) no Q (subendocárdico) o IAM (transmural).
INTRODUCCIÓN
El término de síndrome coronario agudo (SCA) engloba las manifestaciones clínicas de un proceso fisiopatológico progresivo.
La rotura de una placa de ateroma previamente existente en un vaso coronario, desencadena los procesos de agregación plaquetaria y cascada de la coagulación, que provocarán distintos grados de obstrucción al flujo coronario y éstos determinarán angor inestable, Infarto Agudo de Miocardio (IAM) no Q (subendocárdico) o IAM (transmural).
Se denomina síndrome coronario agudo sin elevación de segmento ST (SCASEST) a angor inestable e IAM no Q.
Se engloba como ANGOR INESTABLE al angor de reposo, angor de primo comienzo, angor prolongado (más de 30 minutos), angor progresivo (cada vez con menor esfuerzo y más duradero), angor postinfarto (en el primer mes postinfarto) y ANGOR VASOESPÁSTICO O PRINZMETAL.
EVALUACIÓN
Es de suma importancia el diferenciar en el menor tiempo posible si el dolor al que nos enfrentamos es debido a un SCA o es debido a otras causas de dolor torácico, incluyendo el angor estable que no constituye una urgencia vital.
- .Se recomienda que en un plazo menor de 10 minutos se haya realizado una anamnesis dirigida para averiguar las características del dolor y los factores de riesgo cardiovascular, un ECG de 12 derivaciones y una exploración física con toma de constantes vitales.
- .La determinación de analítica, Rx tórax y enzimas miocárdicas son de gran importancia pero nunca retrasarán el diagnóstico y actuación inicial de un SCA.
- .Igualmente es de importancia averiguar posibles contraindicaciones a tratamiento fibrinolítico. Los factores de riesgo coronario rápidamente identificables en la urgencia son hipertensión arterial, diabetes mellitus, hipercolesterolemia, obesidad, tabaquismo, antecedentes previos de patología cardiovascular en el enfermo o en su familia directa y estados de hipercoagulabilidad.
- .La clínica de presentación habitual consiste en dolor centrotorácico opresivo, que se puede irradiar a mandíbula, cuello, región interescapular y cara cubital de miembros superiores (sobre todo al izquierdo), de comienzo progresivo (tanto en esfuerzo como en reposo) y duración mayor de 1 minuto. La clínica que nos puede ayudar a diferenciar entre angor e IAM consiste en que en el IAM la duración es mayor de 30 minutos, no cede con nitroglicerina sublingual ni reposo, suele comenzar en reposo durante la noche. Se acompaña de sudoración profusa, náuseas y vómitos, (Cortejo Vegetativo), aunque en ocasiones angor e IAM son indistinguibles clínicamente.
- .Los hallazgos electrocardiográficos evolutivos en más de 2 derivaciones consecutivas son: – Lesión subepicárdica con ascenso de segmento ST mayor de 1 mm en IAM y angor Prinzmetal. – Lesión subendocárdica con descenso de segmento ST en angor. – Isquemia subepicárdica con inversión de onda T en angor e IAM. – Necrosis con onda Q mayor de 40 mseg y voltaje mayor de 25% de onda R siguiente. La presencia de bloqueo de rama izquierda (BRIHH) de nueva aparición equivale a ascenso de segmento ST.
- .La exploración física y constantes vitales determinarán la repercusión hemodinámica y presencia de complicaciones como arritmias, alteraciones mecánicas o insuficiencia cardíaca. Las enzimas cardíacas nos permiten diferenciar entre angor e IAM; comienzan a elevarse en el IAM a partir de las 4-6 horas aproximadamente desde la necrosis miocárdica (por orden cronológico mioglobina, CPK, troponina I, LDH, GOT).
Es de importancia estratificar el riesgo de muerte en el SCASEST para pronóstico y tratamiento. Se clasifica como Bajo riesgo el angor inestable sin elevación enzimática, con ECG normal y/o sin dolor en reposo. Medio riesgo cuando existe leve elevación enzimática, alteración ECG y/o comienzo de dolor en reposo resuelto con nitroglicerina o manteniendo reposo. Alto riesgo cuando existe elevación enzimática, alteración ECG, dolor en reposo persistente y/o alteración hemodinámica.
TRATAMIENTO
El tratamiento y manejo de un SCA diagnosticado en urgencias, habitualmente se realiza en UCI o unidad coronaria, donde el enfermo debe estar monitorizado y dispondremos de desfibrilador rápidamente.
Mientras esperamos el traslado, en urgencias se mantendrá monitorizado al enfermo, se comenzará tratamiento y se valorará lo antes posible qué paciente se puede beneficiar de tratamiento trombolítico o antiagregante IIb/IIIa.
1) TRATAMIENTO INICIAL:
– Reposo absoluto en cama.
– Dieta absoluta durante las 12 primeras horas.
– O2 con gafas nasales a 2 lpm durante las 2-3 primeras horas de SCA no complicado. Si existe congestión pulmonar o saturación de O2 menor de 90% se mantendrá a mayor flujo y durante el tiempo necesario.
– Aspirina, inicialmente 200-300 mg/día y después 100-200 mg/día. Es el antiagregante de elección, aunque si existe intolerancia se puede usar Clopidogrel inicialmente 300 mg/día como dosis de carga y después 75 mg/día, Ticlopidina 250 mg/día o Triflusal 300 mg/8 h.
– Nitroglicerina sublingual 2 pulsos (0.8 mg) si TAS mayor de 100 mmHg. Si no mejora, mantiene TAS mayor de 100 mmHg y no existe afectación de ventrículo derecho usaremos Nitroglicerina iv en bomba (50 mg de nitroglicerina en 500 cc G5%) empezando por 5 ml/h y subiendo cada 5 minutos 5 ml/h hasta ceder dolor o TAS menor de 100 mmHg. – Cloruro mórfico 1/2 ampolla (5 mg) cada 5 minutos hasta 2-3 ampollas sc o iv, ayuda a controlar el dolor y la ansiedad.
Indicaciones de trombolisis:
- Ascenso de segmento ST mayor de 0.1 mV en 2 derivaciones consecutivas o BRIHH de reciente aparición con dolor compatible.
- Evolución menor de 24 horas, sabiendo que el mayor beneficio se obtiene en las 6 horas primeras con escaso beneficio a partir de 12 horas de evolución.
- No existir contraindicaciones absolutas: hemorragia activa (excepto menstruación), sospecha de rotura cardíaca, disección aórtica, antecedente de ictus hemorrágico, cirugía o traumatismo craneal hace menos de 2 meses, neoplasia intracraneal conocida, ictus no hemorrágico hace menos de 6 meses, traumatismo importante o cirugía mayor o litotricia hace menos de 14 días, hemorragia digestiva o urológica hace menos de 14 días y embarazo.
- Valorar contraindicaciones relativas: Enfermedad sistémica grave, alteración de coagulación conocida, HTA no controlada (mayor de 180/110 mmHg), cirugía menor hace menos de 7 días, fotocoagulación retiniana con láser reciente y pericarditis.
- Valorar traslado para ACTP primaria si existen contraindicaciones de trombolisis. Indicaciones de antiagregación IIb/IIIa: – SCASEST de medio y alto riesgo.
2) TRATAMIENTO POSTERIOR:
Ø Anticoagulación: Heparina de bajo peso molecular (Enoxaparina 1 mg/Kg/12 h sc o Dalteparina 120U/Kg/12 h sc) durante 1 semana aproximadamente o Heparina sódica, 5000U en bolo iv seguido de perfusión de 1000 U/h según control TTPA durante 2 días. El uso prolongado de heparinas aumenta riesgo de sangrado sin aumentar beneficio.
Ø Betabloqueo en IAM si no existen contraindicaciones, en las primeras 12 horas, con Atenolol, 5 mg iv en 5 minutos y si no aparecen efectos indeseables se seguirá a los 15 minutos con 50 mg/12 h vo o Metoprolol, 5 mg iv en 2 minutos y seguir a los 15 minutos con 50 mg/6 h vo x 2 días y después 100 mg/12 h vo.
Ø Fibrinolisis si procede con fibrinolíticos según pautas propuestas por fabricante y anticoagulación previa con heparina sódica iv o enoxaparina 30 mg en bolo iv.
Ø Antiagregación IIb/IIIa si procede con Eptifibatide o Tirofibán según pauta propuesta por fabricante y anticoagulación.
Ø Clopidogrel a dosis indicadas, en SCASEST de medio y alto riesgo asociado a aspirina, como antiagregación plaquetaria durante 1-9 meses.
Ø IECAs en las primeras 24 horas, comenzando con Captopril 6,25-50 mg/8 h según permita la tensión arterial. Se administrará en todos los casos si no existe hipotensión ni contraindicaciones (clase IIa) y en presencia de insuficiencia cardíaca congestiva o fracción de eyección de ventrículo izquierdo menor de 40% (clase I). Una vez estable y llegada a la dosis máxima tolerada se podrá usar IECA de vida media más larga para mantenimiento.
Ø Estatinas a dosis suficiente para mantener colesterol LDL menor de 100 mg/dl. – Ansiolíticos, en ocasiones útiles como tratamiento precoz tras el manejo inicial.
ANEXOS A SCA.
Hospitales de toda España evalúan cómo se trata a los pacientes con síndrome coronario agudo
Cada año se diagnostican unos 130.000 casos de síndrome coronario agudo (SCA), cuyo tratamiento podría variar entre comunidades autónomas e incluso entre centros de una misma zona.
Madrid, 14 de junio de 2005.-
Medio centenar de hospitales comprobarán por primera vez si los enfermos españoles que han sufrido un infarto agudo de miocardio o una angina inestable están recibiendo el tratamiento que recomiendan las guías terapéuticas nacionales e internaciones. El estudio MÁSCARA (Manejo del Síndrome Coronario Agudo. Registro actualizado), que antes de que finalice el verano tiene previsto incluir 11.000 enfermos, mostrará si un paciente con la misma enfermedad cardiaca es tratado de manera distinta dependiendo de la comunidad autónoma e, incluso, del hospital. Esta investigación, realizada por la Red de Investigación Cardiovascular del Fondo de Investigaciones Sanitarias y la Sección de Cardiopatía Isquémica de la Sociedad Española de Cardiología, cuenta con la colaboración de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias y el apoyo del laboratorio Bristol-Myers Squibb.
El registro MÁSCARA persigue un doble objetivo: analizar hasta qué punto las guías de práctica clínica se aplican y cuándo se aplican. Desde el año 2002, los expertos disponen de unas pautas estandarizadas para el tratamiento de estos enfermos a través de las guías terapéuticas de la Sociedad Española de Cardiología. "La idea", dice el doctor Ignacio Ferreira, cardiólogo del Hospital Vall D´Hebron de Barcelona y uno de los coordinadores del estudio, "es comprobar en qué medida hay una adecuación a las guías en las diferentes regiones y hospitales, cogiendo una muestra aleatoria de 52 hospitales de los tres niveles asistenciales".
Finalidad descriptiva y analítica
Otro de los investigadores principales del estudio, el doctor Héctor Bueno, cardiólogo del Hospital General Universitario Gregorio Marañón de Madrid, aclara que el MÁSCARA representa un avance respecto a otros registros anteriores que analizaban la atención que recibían los pacientes con cardiopatía isquémica, al no limitarse a la descripción de la situación (qué se hace y cómo se hace) de estos enfermos, y añadir una finalidad evaluadora de los tratamientos (hasta qué punto se siguen las recomendaciones de las sociedades científicas y si lo que se recomienda es tan eficaz en la vida real como en los ensayos clínicos). "El número de pacientes constituye un hito entre los estudios de cardiopatía isquémica realizados en España. Será el registro con más enfermos coronarios agudos que se haya hecho nunca en nuestro país", destaca este experto.
El MÁSCARA supone una continuidad respecto a trabajos previos, como los estudios PRIAMHO I (1995) y PRIAMHO II (2000), TRIANA (2002) y el DESCARTES (2002).
"Por eso, ahora con los resultados del MÁSCARA", señala el doctor Bueno, "tendremos no sólo una fotografía de la situación con fecha 2005, sino que podremos observar la evolución del grado de mejoría que han ido experimentando estos pacientes a lo largo de los años a medida que se han ido incorporando nuevas estrategias terapéuticas. Servirá además para determinar la efectividad de intervenciones y tratamientos aconsejados en las guías por su eficacia demostrada en condiciones ideales, es decir, en los ensayos clínicos. El MÁSCARA nos dirá si también son efectivas en la práctica del día a día, donde la información disponible es mucho menor".
Los enfermos incluidos en este estudio presentan síndrome coronario agudo (SCA), que comprende, el infarto agudo de miocardio y la angina inestable, caracterizada por provocar episodios intermitentes de falta de riego a las células del corazón y que aparece cuando el paciente está en reposo o haciendo un ejercicio suave. Por tanto, estos pacientes son enfermos de alto riesgo, con alta prevalencia de colesterol elevado, hipertensión arterial, tabaquismo y diabetes y con antecedentes cardiovasculares. En el estudio, estos enfermos tendrán un seguimiento de seis meses una vez sean dados de alta en el hospital. "De ese modo", indica el doctor Ferreira, "podemos saber si han tenido que ser hospitalizados de nuevo y, en ese caso, si ha sido por una angina, un infarto o si ha sido por otra causa. Es la única manera de conocer con precisión los verdaderos beneficios de las intervenciones realizadas en el hospital".
El afán por tener un buen control de calidad será, según el doctor Ferreira, un estímulo para identificar aquellas intervenciones que son beneficiosas y que no se realizan y lo contrario: terapias que no funcionan y que sin embargo siguen aplicándose.
Diferencias por hospitales y comunidades autónomas
Los médicos sospechan que puede haber diferencias en el tratamiento por comunidades autónomas, aunque admiten que será difícil saber si hay no sólo determinantes geográficos sino también sociológicos o políticos. En cualquier caso, coinciden en destacar que un mismo paciente con idéntico síndrome tiene probabilidades de ser tratado de forma distinta según ingrese en un hospital de una comunidad autónoma o de otra; e incluso en dos hospitales dentro de una misma comunidad autónoma. "En un análisis preliminar del estudio Descartes ya advertimos esas diferencias, pero la muestra era reducida. En ese sentido, el volumen del MÁSCARA permitirá hacer análisis más precisos", comenta el doctor Bueno.
SCA
Desde el año 2001, el síndrome coronario agudo (SCA) comprende todos los procesos isquémicos agudos del corazón (déficit del flujo coronario), que pueden provocar de repente un problema grave: bien por sufrir una angina inestable (algo menos grave) o bien por sufrir un infarto de miocardio (más grave).
SÍNTOMAS FUNDAMENTALES DEL I.A.M.
SÍNTOMAS
- 1)Dolor toracico precordial o retroesternal
Es el príncipe de los dolores torácicos, no tanto por su frecuencia como por su gravedad.
Típicamente nos encontraremos a un varón a partir de la 6ª década de la vida.pálido, sudoroso, inmóvil, inclinado sobre su almohada, con mirada perdida, brazos y manos recogidos sobre el pecho, respirando superficialmente, habla parca y con “sensación de muerte inminente”.
Es un dolor:
- Opresivo ("... como si tuviera una losa en el pecho...”,"como si me retorciesen el corazón...")
- Nociceptivo.
- Central.
- Referido.
- Suele irradiarse a pars interna de brazos (no exclusivamente el "izquierdo"), cuello, mandíbula, epigastrio (en la mayoría de dolores cardiacos referidos a epigastrio son por Síndrome Coronario Agudo de localización infero-posterior) y espalda (en este tipo de irradiación: pensar siempre en ANEURISMA DISECANTE DE AORTA, sobre todo si refiere el paciente, que el dolor aumenta con la inspiración).

(Zonas más Frecuentes de Dolor por IAM).
Hay que tener muy presente, que existen INJURIAS CARDIACAS SILENTES , es decir, aquellas en que el paciente NO refiere DOLOR, y sólo están presentes los síntomas vegetativos acompañantes: Sudoración profusa, nauseas, vómitos (el dolor no mejora tras la expulsión de contenido gástrico). Desestabilización hemodinámica (mala perfusión acra, cianosis, hipotensión arterial, Pulsioximetría menor de 80% de saturación de O2... etc.)
Este Tipo de INJURIA SILENTE es muy frecuente en Ancianos, Diabéticos y en ambos, por lo que es fundamental tener estos datos en cuenta.
Dolor torácico es muy intenso (Es similar al de la angina de pecho, pero más prolongado, y no responde a la nitroglicerina bajo la lengua.)
- 2) Dificultad para respirar. (Disnea)
- 3) Mareo. Es el único síntoma en un 10 %.
- 4) Síncope. Acompañado de intensa diaforesis (sudoración profusa y fría).
- 5) Antecedentes de angina inestable: ataques frecuentes de ANGINA DE PECHO no ligados a actividad física.
En la inmensa mayoría de los casos se dan todos estos síntomas asociados. (Clínica Típica)
Un infarto es un área de tejido que ha muerto (necrosis) por falta total del oxígeno que precisa (Desbalance Oferta/Demanda de O2).
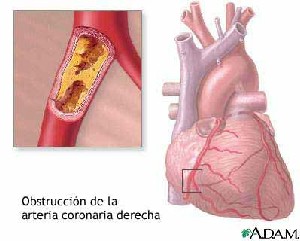
El miocardio, o músculo del corazón, puede sufrir un infarto cuando existe una enfermedad coronaria avanzada.
La corona de vasos sanguíneos que llevan oxígeno y nutrientes al propio músculo cardíaco (vasos "coronarios") puede desarrollar placas de ateroma, lo que compromete en mayor o menor grado el flujo de oxígeno y nutrientes al propio corazón, con efectos que varían desde una angina de pecho (cuando la interrupción del flujo de sangre al corazón es temporal) a un infarto de miocardio (cuando es permanente e irreversible).
La presencia en un vaso dado de arteriosclerosis hace que en dicho vaso existan estrechamientos y que en ellos se desarrolle más fácilmente un trombo: un coágulo de plaquetas, proteínas de la coagulación y desechos celulares que acaba taponando en mayor o menor medida, el vaso sanguíneo. Cuando este trombo se fragmenta, suelta al torrente sanguíneo un trozo más pequeño del mismo que se denomina Embolia.
Una embolia es un trombo que ha viajado por la sangre hasta llegar a un vaso pequeño donde se enclava como un émbolo. Trombosis y embolia son, pues, términos equiparables.
Un infarto de miocardio es una urgencia médica por definición.
Las demoras en su Tratamiento son un error grave que se cobra miles de vidas cada año.
-La simple Inspección del paciente "casi" nos da el diagnostico:
"Paciente inmóvil, muy pálido, con brazos sobre el pecho, respiración dificultosa y que no cesa de decir: me muero..."
-La auscultación puede resultar difícil, sobre todo en pacientes ancianos, en los que los ruidos pulmonares añadidos (crepitantes, estertores...) dificultan la audición de ruidos cardíacos; cuando pueden oírse, casi siempre se ausculta un 3º ó 4º ruido (S3, S4 o ritmo de galope). [Ver Clasificación de Killip].
-El Pulso periférico resulta difícil de palpar; es filiforme, diacrótico, saltón y,- en muchas ocasiones-, se manifiesta el llamado "Efecto Cardio-esfigmico". (Este efecto No es patognomónico de la Fibrilación Auricular)
-ELECTROCARDIOGRAMA. Puede resultar el diagnostico Definitivo (aunque no siempre es así). [Ver capitulo "Técnica de Electrocardiograma"]
Si una persona sufre síntomas compatibles con un infarto de miocardio, se le hará un ECG inmediatamente, incluso en la ambulancia que le traslade. Si éste fuese negativo pero con clínica sugestiva se volverá a realizar EKG de superficie con 12 derivaciones a las 2-4 horas. (Hasta ello, siempre se mantendrá monitorizado, al menos con 3 electrodos).
De hecho, estará unido a un monitor de ECG durante todo el tiempo que esté en el Hospital, al menos si se ingresa en la sala dedicada a los enfermos graves del corazón o unidad coronaria.
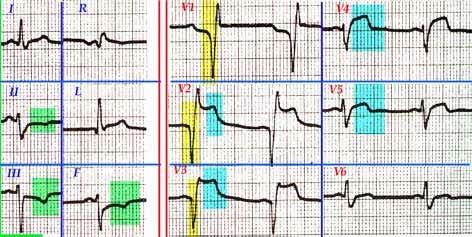
FIGURA (Nótese la lesión subendocardica en derivaciones inferiores (D2-D3-vF) y onda QS con lesión subepicardica en derivaciones anteriores y septum. Corresponde, básicamente, a un INFARTO AGUDO de MIOCARDIO ANTERO-SEPTO-INFERIOR EXTENSO, con RS a 75 cx´aprox. Hipertrofia biventricular discreta. Ensanchamiento de QRS.)(Posible enfermedad de "2 vasos").
| DIAGNOSTICO TOPOGRÁFICO DEL INFARTO DE MIOCARDIO | |
| LOCALIZACIÓN | DERIVACIONES INDICATIVAS (Onda Q y/o desnivel ST) |
| Pared Anterior | |
| - Septal | V1 -V2. |
| - Anteroseptal | V1 a V4 |
| - Anterior | V3 -V4. |
| - Anterolateral | D1- aVL- V3 a V6. |
| - Anterior Extenso | D1, V1 a V6 |
| Apical | D2-D3-aVF. V3-V4. |
| Pared Inferior | |
| - Inferior | D2-D3-Avf |
| - Inferolateral | D2-D3-aVF-aVL, V5-V6 |
| - Inferoposterior | D2-D3-aVF- V7-V8 (Imagen especular) |
| Pared Posterior | |
| - Posterior | V7-V8 (Imagen especular de “R” altas en V1-V2) |
| - Posterolateral | D1-aVL- V6-V7-V8 |
- Análisis Sanguíneo. Incluyen la determinación de algunos enzimas que aumentan en la sangre cuando se daña el músculo cardíaco.
|
| Aparición (horas) | Máximo (horas) | Normalización (días) |
| CK total | 6-15 | 24 | 1-4 |
| CK-MB | 3-15 | 12-24 | 1-3 |
| LDH | 12-24 | 36-72 | 7-14 |
| GOT | 6-8 | 18-24 | 4-5 |
La Proteína C reactiva es la más temprana en aparecer, aunque de los menos especificas.
- Estudios isotópicos y/o cateterismo cardiaco (coronariografía). Resonancia Magnética Nuclear helicoidal. Gated-Spect. Se plantean cuando ya ha pasado la fase aguda. (Ver Iconografía II en esa misma monografía)
En cualquier caso, el paciente estará sometido a observación durante varios días, y se le permitirá aumentar gradualmente su actividad. (Rehabilitación Cardíaca)
El tiempo de ingreso en el Hospital es muy variable, pero generalmente está entre 10 y 14 días en IAM No Complicados.
HABILIDADES
ELECTROCARDIOGRAFÍA
Lo primero es comprobar que la calibración del electrocardiógrafo es correcta: velocidad del papel a 25 mm/seg. Y que la aguja marque una deflexión de 10 mm al emitir 1 mV (los aparatos más modernos se calibran automáticamente).
Comprobar que se han colocado los electrodos correctamente: los de las extremidades están bien colocados si se cumple que la medida de la altura del QRS de la derivación II es igual a la suma de las derivaciones I + III, y también cuando la suma de las derivaciones aVL + a AR + AFV es igual a cero. La colocación correcta de los electrodos precordiales es muy importante para estandarizar la valoración de las ondas e intervalos. Hay que dudar de la correcta colocación de los electrodos ante imágenes no coherentes con la clínica del paciente o con ECG previos.
Confirmar que el contacto de los electrodos con la piel es adecuado: la interpretación electrocardiográfica comienza con la obtención de un ECG libre de artefactos. Es importante limpiar eficazmente la piel y en su caso rasurar y si es preciso cambiar el electrodo. Si la línea isoeléctrica no es “limpia”, pensar en interferencias electromagnéticas cercanas (relojes, radio, teléfonos, etc.) o bien en mal contacto del electrodo con la piel, sin olvidar los temblores involuntarios o movimientos que puede presentar el propio paciente.
Recomendaciones generales:
La lectura del ECG debe realizarse siempre con un determinado orden y con una sistemática correcta para no ignorar aspectos importantes del ECG.
Recordar siempre a la hora de dicha interpretación: edad, sexo, raza, actividad física y, sobre todo, el cuadro clínico del paciente; y NUNCA pensar que un ECG NORMAL descarta patología cardiaca.
Preguntas ineludibles a responder ante un ECG:
- ¿Hay complejos QRS?
- ¿Los complejos QRS son anchos o estrechos?
- ¿Frecuencia ventricular?
- ¿Ritmo es regular o irregular?
- ¿Existen ondas P?
- ¿Todos los complejos QRS van precedidos de onda P?
- ¿Todas las ondas P van seguidas de un complejo QRS, con PR constante o no?
- ¿Artefactos?
Valoración inicial del ECG:
Frecuencia, normal (50-100 lat/min) o taquicardia (>100) o bradicardia (<50). Los rangos normales en niños son diferentes (neonato: 110-150, 2 años de edad: 85-125, 4 años de edad 75-115, 6 años 60-100). Cálculo rápido, dividir 300 entre el número de cuadrados grandes que hay entre in intervalo RR. En caso de arritmias (ejemplo en fibrilación auricular), se cuentan los QRS existentes en 10 segundos (5 cuadros grandes=20 cuadritos=1 segundo) y se multiplica por 6.
Ritmo, sinusal (normal: P + en II y aVF y – en aVR con PR>0,12) o de otro tipo (fibrilación, fluter, taquicardia auriculares y ritmo nodal o idioventricular; los 5 son patológicos).
Eje eléctrico, normal (<30º a >100º) o alterado. Se utiliza la positividad o negatividad de las derivaciones I y aVF
Onda P (existencia o ausencia) y segmento PR (normal 0,12-0,20 seg. [1 mm = 0.04 seg. = 1 cuadrito del registro])
Complejo QRS anchura (normal < 0,10 seg.), voltaje (altura), morfología (normal o anormal) y presencia de ondas Q de infarto (> 1mm de anchura o superior a 1/3 de la onda R, a excepción de aVR)
Segmento ST normal (isoeléctrico en todas las derivaciones) o alterado (elevado o descendido)
La onda T es positiva en I, II y de V3 a V6, negativa en aVR y variable en III, aVL, aVF, V1 y V2
En personas jóvenes la repolarización precoz (ST elevado con punto J, que con el ejercicio suele volverse isoeléctrico) no debe confundirse con isquemia.
Técnica
Colocar al paciente en decúbito supino en la camilla con el tórax desnudo, sin reloj ni otros aparatos que puedan producir interferencias (teléfono móvil).
Colocar los electrodos de registro de los miembros. Este contacto se facilita limpiando la zona y rasurando si es preciso; en el caso de que se trate de placas metálicas, aplicar pasta conductora o un algodón impregnado de alcohol entre placa y piel.
Conectar los cables a los electrodos: brazo derecho: color rojo; brazo izquierdo: color amarillo; pierna derecha: color negro, pierna izquierda: color verde. De este modo obtenemos las derivaciones bipolares (I, II, III) y las monopolares (aVR, aVL, aVF).
Colocar los electrodos adhesivos de registro en la cara anterior del tórax: V1: en cuarto espacio intercostal derecho, línea paraesternal derecha; V2: en cuarto espacio intercostal izquierdo, línea paraesternal izquierda; V3: entre V2 y V4; V4: en quinto espacio intercostal izquierdo, línea medioclavicular; V5: en quinto espacio intercostal izquierdo, línea axilar anterior; V6: quinto espacio intercostal izquierdo, línea media axilar.
Calibrar la sensibilidad del registro teniendo en cuenta que 1 milivoltio corresponda a 10 mm de altura (dos cuadros grandes en el papel). Además confirmar que la velocidad del registro sea de 25 mm/seg.
Poner en marcha el electrocardiograma para obtener el registro.
Cada registro debe incluir como mínimo 6 complejos QRS. Realizar una tira más larga (30 complejos) en la derivación II ó V6 para valorar alteraciones del ritmo si las hubiera. Los electrocardiógrafos pueden registrar una o más derivaciones según el número de canales de registro de los que disponga.
Dr. José M. Maroto, Cardiólogo, Unidad de Rehabilitación Cardiaca. Hospital Ramón y Cajal (Madrid)
El electrocardiograma, al igual que la radiología o las determinaciones analíticas en sangre y orina constituyen, junto a la historia clínica y la exploración física, herramientas básicas de la práctica clínica diaria en Cardiología.

ELECTROCARDIÓGRAFO
ELECTRODOS
TÉCNICA DE VÍA ENDOVENOSA
- Localizar una vena adecuada. Intentar evitar usar el dorso de la mano y la fosa antecubital.
- Aplicar el torniquete en el brazo y volver a comprobar la vena elegida.
- Colocarse los guantes.
- Limpiar la piel y dejar secar.
- Sacar la vía intravenosa de su envoltorio.
- Decirle al paciente que va a notar un pinchazo,
- Inmovilizar la vena estirando la piel e insertar la vía intravenosa en un ángulo aproximado de 30 grados.
- Si se ve retorno de sangre, avanzar unos 2 mm la vía intravenosa (aguja y cánula).
- Mantener fija la aguja y avanzar la cánula en la vena.
- Retirar el torniquete.
- Presionar la vena a la altura de la punta de la cánula, retirar la aguja y colocar el tapón en la cánula.
- Colocar la aguja en el recipiente para material biocontaminado.
- Colocar esparadrapo para fijar la cánula.
- Aplicar suero en la cánula.
- Es conveniente aflojar el torniquete tras dos minutos y permitir que recircule la sangre antes de volver a aplicarlo.
Si se atraviesa una válvula venosa durante la inserción de la vía, el paciente notará repentinamente dolor. En ese caso, interrumpir el procedimiento.
- Es preciso conocer la anatomía topográfica de la zona de donde insertemos la vía: tener en cuenta la situación de la arteria braquial (flexura del codo) y de las ramas sensitivas del nervio radial (cara dorso-radial del antebrazo y muñeca).
- Existen varios métodos para aumentar la accesibilidad a las venas al colocar una vía intravenosa, aparte de la aplicación del torniquete:
- Abrir y cerrar consecutivamente el puño (la musculatura dirige la sangre hacia las venas).
- Colocar el antebrazo por debajo del nivel del corazón (aumenta la presión venosa).
- Puede golpearse suavemente las venas, aunque puede producir dolor y resultar en la formación de hematomas en pacientes con venas frágiles (ej. pacientes trombocitopénicos).
El empleo de calor mediante gasas empapadas calientes o sumergiendo el antebrazo en un recipiente con agua caliente durante 10 minutos, produce venodilatación.
La aplicación de EMLA disminuye el dolor y puede facilitar la inserción de la vía.
Dr. José M. Arribas, Médico de Familia.
CATEGORÍAS DE I.A.M.
Si el área de infarto es pequeña y no compromete al sistema bioeléctrico que controla los latidos del corazón, las probabilidades de sobrevivir a un infarto son altas.
Sin embargo, una de cada tres personas que sufren un infarto muere antes de poder recibir atención médica (muerte súbita por Fibrilación Ventricular).
Hace muy pocos años, las estadísticas eran aún peores (un fallecimiento precoz por cada dos infartos).
| CLASIFICACIÓN KILLIP DE INFARTO AGUDO DE MIOCARDIO | ||||
| | TIPO I | TIPO II | TIPO III | TIPO IV |
| DEFINICIÓN | Sin alteraciones pulmonares. Sin S3 | Con alteraciones Pulmonares en < 50% De Campos Pulmonares. (Crepitantes y/o estertores). Presencia de S3. | Con alteraciones Pulmonares en > 50% de campos Pulmonares. Presencia de S3 y Edema Pulmonar | Shock |
| INGRESO EN UNIDADES CORONARIAS. % | 30-40 % | 30-50 % | 5-10 % | 10% |
| MORTALIDAD % | 8 % | 10-30 % | 44% | 80-100 % |
En 1.967, Killip y cols. Realizaron esta estratificación del Infarto Agudo de Miocardio, tras el seguimiento de 250 pacientes durante 3 meses. En la actualidad, es la más aceptada en países anglosajones (incluida España).
| Clasificación de IAM basada en EKG de Presentación y Correlación Angiografica | ||||
| Categorías | Topografía de la Obstrucción | E.K.G. | Mortalidad a los 30 días | Mortalidad al 1º año |
| Arteria Anterior Descendente Proximal | Proximal a la 1ª Arteria septal | Elevación ST de V1 a V6 y D1-aVL. Con HBAI y/o BRD. | 19,6% | 25,6 % |
| Arteria descendente anterior Media | Distal a la 1ª septal. | ST V1 a V4 y D1-aVL. | 9,2 % | 12,4 % |
| Arteria descendente anterior Distal ó Diagonal | Distal a Diagonal | ST V1 a V4 ó D1.aVL con V5-V6 | 6,8 % | 8,4% |
| Inferior moderado o grande (Posterior, lateral de Ventrículo Derecho) | Arteria coronaria Derecha ó Circunfleja | ST e D2-D3-aVF y algunas de a) V1-V3R-V4R. b) V5-V6. c) R>SV1-V2 | 6,4 % | 8,4 % |
| Inferior Estricto | Rama de la Circunfleja | ST en D2-D3-aVF | 4,5 % | 6,7 % |
Tomado de River NT et al. 1.990
La mejora de estas expectativas está ligada a los avances en resucitación cardiopulmonar, RCP (Soporte Vital Avanzado), en pruebas diagnósticas especiales, y en atención urgente, incluyendo ambulancias 'medicalizadas' y unidades coronarias. En la actualidad, se tienen como ciertos los datos de que el 20-30% de los IAM mueren en el ámbito extrahospitalario.
Debido a la frecuencia de muerte súbita, las técnicas de resucitación cardiopulmonar deben aplicarse cuanto antes a cualquier persona que esté sufriendo un ataque al corazón. La mayoría de los que estén vivos 2 horas después de un ataque sobrevivirán.
Sin embargo, existen algunas COMPLICACIONES posibles:
-Disrritmia cardíaca
Existe un sistema bioeléctrico que controla los latidos del corazón. Nódulo Sinusal; Nódulo Auriculo-Ventricular- Haz de Hiss (con sus bifurcaciones en Rama izquierda,-que a su vez se dicotomiza en Haz anterior y Haz posterior), Rama Derecha) y Fibras de Purkinje.
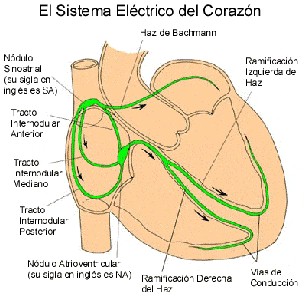
Si se daña en el infarto, pueden aparecer arritmias muy graves, como la llamada fibrilación ventricular (la mas grave y...más frecuente), en la que los ventrículos se contraen de forma rápida, descoordinada e ineficaz como una "bolsa de gusanos", y a efectos de bombeo de sangre, el corazón no funciona y se produce una Parada Cardíaca.
Si se daña en el infarto, pueden aparecer arritmias muy graves, como la llamada fibrilación ventricular (la mas grave y...más frecuente), en la que los ventrículos se contraen de forma rápida, descoordinada e ineficaz como una "bolsa de gusanos", y a efectos de bombeo de sangre, el corazón no funciona y se produce una Parada Cardíaca.
Fibrilación ventricular
La arritmia más grave es la fibrilación ventricular, que son latidos irregulares no controlados. En lugar de tener una sola pulsación a destiempo de los ventrículos, es posible que varios impulsos se originen al mismo tiempo en diferentes lugares (taquicardia irregular polimorfica), todos ellos estimulando al corazón a latir. Por consecuencia, se producen latidos mucho más rápidos y desordenados que pueden alcanzar los 300 latidos por minuto. A causa de estos latidos caóticos, el corazón bombea muy poca sangre al cerebro y al resto del organismo, y es posible que la persona pierda conciencia (Síncope). Es necesario obtener asistencia médica inmediatamente. Si es posible iniciar medidas de reanimación cardiopulmonar (RCP) o administrar descargas eléctricas (Desfibrilador Eléctrico con sincronía o desincronizado) para restablecer el ritmo normal del corazón, de esta forma, es posible que el corazón no sufra un daño muy grave.
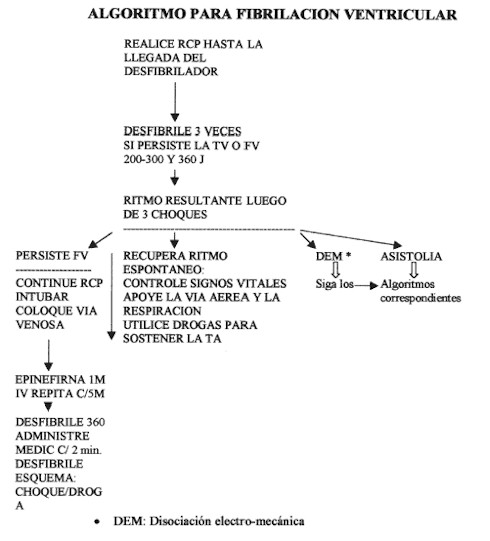
El tratamiento es el de una verdadera urgencia médica e incluye:
· Desfibrilación eléctrica inmediata (no sincronizada), con dosis variable de 200-200-360 julios en "bucles", para seguir con 360 julios si no recupera.
· Mantenimiento de la permeabilidad de las vías aéreas y administración de oxígeno al 100 % generalmente mediante intubación endotraqueal.
· Masaje cardíaco externo.
· Uso de vasopresores (adrenalina 0,02 mg/Kg en bolo).
· Corrección de la acidosis
· Realización de R.C.P. en caso de Fibrilación Ventricular.
1. Golpe Precordial.
2. ABC Primaria – Desfibrilar 200 – 200 – 360 J (Equivalente Bifásico 120 – 200 J)
3. ABC Secundaria
4. VASOPRESINA 40 UI IV DOSIS ÚNICA (Clase 2b)
ADRENALINA = 1 mg / 3 – 5 min IV (Clase Indeterminada)
5. RCP durante 1 minuto.
6. Desfibrilar 360 – 360 – 360 J (Equivalente Bifásico 200 J)
7. Repetir ciclos FÁRMACO – RCP – DESCARGA
8. A partir del 3º ciclo considerar Antiarrítmicos:
TRANGOREX® (Amiodarona) amp. 150 mg / 3 ml (Clase 2b)
1º- Bolo IV 5 mg / kg = 2 amp. + 10 – 20 ml SG5% en 3 – 5 min
2º- Bolo IV 1 amp + 20 ml SG5% en 3 – 5 min.
3º- Perfusión 2 amp. + 250 ml SG5% / 8 h (30 ml / h).
LINCAÍNA® (Lidocaina) 50 ml al 50% (50 mg / ml) (Clase Indeterminada)
Bolo IV 1,5 ml / 5 min (Máximo 3 dosis).
Perfusión 40 ml + 250 ml SG5% a 30 ml / h.
SULMETÍN® (Sulfato de Mg) amp 10 ml al 15% (1500 mg) Clase 2b).
Indicación: TV Polimorfa o Hipomagnesemia
Bolo IV 1 – 2 gr. + 10 ml SG5%
Perfusión 4 amp + 250 ml SG5% a 30 ml / h.
CO3Hna 1 mEq / kg.
a. PCR prolongada (Clase 2b).
b. Hiperpotasemia (Clase 1).
c. Acidosis sensible a bicarbonato (Clase 2a).
d. Intoxicación por Antidepresivos Tricíclicos
(Clase 2a): NO para la Hipercapnia.
e. Intoxicación por AAS (Clase 2a): Para alcalinizar la orina.
9. Si recupera circulación espontánea, soporte vital y tratamiento etiológico.
3Hna 1 mEq / kg...
Se cree que la fibrilación ventricular ocasiona aproximadamente 220.000 muertes anuales por ataques cardíacos. Las personas que sufren de alguna enfermedad cardiovascular o que tienen antecedentes de injurias cardíacas tienen el mayor riesgo de padecer fibrilación ventricular.
IMAGEN ELECTROCARDIOGRÁFICA DE FIBRILACIÓN VENTRICULAR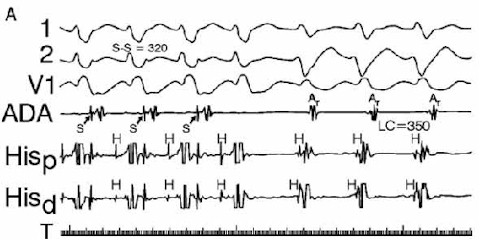
En otras personas, pueden aparecer arritmias lentas, es decir, el latido es demasiado lento para que el corazón funcione normalmente (Bradicardias). Esto puede requerir la implantación temporal o definitiva de un marcapasos artificial.
La actividad eléctrica sin pulso incluye:
· Disociación electromecánica
· Pseudo disociación electromecánica
· Ritmo idioventricular
· Ritmo bradisistólico
· Ritmo idioventricular postdesfibrilación
Manejo:
· Continuar con Reanimación Cardiopulmonar
-Intubar
-Obtener Vía Endovenosa
· Considerar las posibles causas:
Hipovolemia >> Administrar líquidos
Hipoxia >> Ventilación
Taponamiento Cardiaco >> Pericardiocentésis
Neumotórax Hipertensivo >> Descompresión por punción
Hipotermia
Embolia Pulmonar Masivo >> Cirugía, Trombolíticos
Sobredosis Medicamentosa
Digital, Betabloqueantes,
· Bloqueantes Calcicos, Triciclicos >> Bicarbonato de sodio
· Acidosis >> Bicarbonato de sodio
· Hiperkalemia >> Bicarbonato de sodio
· IAM Masivo >> Hemodinamia
Tratamiento
· Epinefrina: 1 mg v/ev, repetir cada 3-5’ Si NO da resultado, considerar otros regimenes: Mediano: EPINEFRINA 2-5 mg v/ev cada 3-5’
Progresivo: EPINEFRINA 1 mg. 3 mg. 5 mg v/ev con intervalos cada 3’
Alto: EPINEFRINA 0,1 mg/Kg v/ev cada 3-5’ Si hay Bradicardia: Atropina. 1 mg v/ev., repetir cada 3-5’ hasta un total de 0,04 mg/Kg Bicarbonato de sodio: 1 m Eq/Kg v/ev
1. Si tiene HIPERKALEMIA previamente diagnosticada.
2. Si tiene ACIDOSIS previamente diagnosticada.
3. Sobredosis con TRICICLICOS.
4. Para ALCALINIZAR la orina por sobredosis de medicamentos.
5. Cuando estando intubado, el PARO es prolongado o luego de recuperarse de un paro prolongado.
- Insuficiencia cardíaca
Cuando el área de infarto es extensa, el resto del corazón puede ser insuficiente para realizar el trabajo de bombeo.
- Asistolia
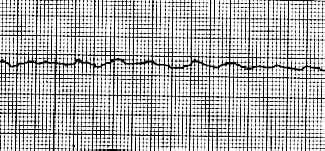
Asistolia con mínimo temblor de la línea isoeléctrica (diferenciarlo de fibrilación ventricular de onda fina. Trazado "agónico")
Considerar las posibles CAUSAS:
· Hipoxia
· Hiperkalemia
· Hipokalemia
· Acidosis preexistente
· Sobredosis de drogas
· Hipotermia
Tratamiento:
Marcapasos transitorio Epinefrina: 1 mg v/ev, repetir cada 3-5’ Si NO da resultado, se puede usar los siguientes. Regímenes: Mediano: 2-5 mg v/ev cada 3-5’.
Progresivo: 1 mg., 3 mg., 5 mg. v/ev con intervalos cada 3’.
Alto: 0,1 /Kg v/ev cada 3-5’ Atropina: 1 mg v/ev, repetir cada 3-5’ hasta un total de 0,04 mg/Kg Bicarbonato de sodio: Dosis: 1 m Eq/Kg v/ev Considerarlo cuando se halla:
Acidosis previamente diagnosticada
Sobredosis por tricíclicos
Sobredosis medicamentosa
Paro prolongado
Recuperación de un paro prolongado Si el paciente persiste en ASISTOLIA u otros RITMOS AGONIZANTES, luego de ser intubado exitosamente y de ser administrados los medicamentos antes descriptos y no se encuentran causas reversibles, un médico puede considerar la suspensión de las maniobras de resucitación.
-Muerte
En una de cada cuatro personas que sufren muerte súbita, no existían síntomas previos de cardiopatía.
Con mucho, la causa más frecuente de muerte súbita por infarto es la arritmia cardiaca (fibrilación ventricular).
ESCALAS T.I.M.I.
PREDICTORES DE MORTALIDAD EN INFARTO AGUDO DE MIOCARDIO EN LOS 30 DÍAS DEL EVENTO. (ESCALA T.I.M.I.)
| VALORACIÓN | PUNTUACIÓN |
| EDAD HASTA 64 AÑOS | 2 PUNTOS |
| EDAD 64-74 AÑOS. | 3 PUNTOS |
| FRECUENCIA CARDIACA > 100 cx´ | 2 PUNTOS |
| KILLIP II-IV | 2 PUNTOS |
| IAM ANTERIOR O BCRI | 1 PUNTO |
| DM. HTA. Y/O ANGOR PREVIO | 1 PUNTO |
| PESO < 67 KGRS Y TIEMPO > 4 HORAS | 1 PUNTO POR CADA UNO DE ELLOS. |
ESCALA DE RIESGO DE MUERTE Y REINFARTO EN LOS 14 DÍAS SIGUIENTES A SCASEST (T.I.M.I.).
| EDAD > 65 AÑOS |
| 3 Ó MAS FACTORES DE RIESGO CORONARIO |
| MAS DE 2 EPISODIOS DE ANGINA EN MENOS DE 24 HORAS |
| TRATAMIENTO CON ASPIRINA DURANTE AL MENOS 7 DÍAS. |
| ESTENOSIS CORONARIA DE > 50% |
| CAMBIOS DEL SEGMENTO ST. |
| ELEVACIÓN SIGNIFICATIVA DE MARCADORES ENZIMÁTICOS CARDIACOS |
SOPORTE VITAL AVANZADO.

TRATAMIENTO
1 Pedir ayuda y buscar atención médica inmediata.
2 No intentar conducir uno mismo hasta un Hospital.
3 Aplicar Soporte Vital Básico ó Soporte Vital Avanzado (si se dispone del mismo).
- +Oxígeno. Puede ser la primera medida en el Hospital o la propia ambulancia.
- +Analgésicos: Comenzar por analgésicos periféricos. Si el dolor torácico persiste y es insoportable, se administra Cloruro Mórfico al 1% diluido en 10 cc. De SSF. O medicamentos similares para aliviarlo. Si la Tensión arterial sistólica es menor de 90 mm de Hg se utiliza Meperidina.
- Antiagragantes Plaquetarios: Ácido Acetil Salicílico en dosis de 250-375 mgrs. Por vía oral.
- Fibrinolíticos: Heparinas de Bajo Peso Molecular, por ejemplo Enoxaparina 40 mgrs vía IV en bolo ó vía SC si no se tiene práctica. Valorar contraindicaciones Absolutas.
- +Trombolíticos. Son medicamentos para disolver el coágulo (Trombo) que impide que fluya la sangre. Se ponen sustancias como la estreptoquinasa o un "activador del plasminógeno tisular", bien en la vena, o bien directamente en el coágulo por medio de un catéter. Actualmente se emplean Anti-agregantes Plaquetarios, son los glucopeptidos IIb/ III a.
- +Nitratos. Los derivados de la nitroglicerina actúan disminuyendo el trabajo del corazón y por tanto sus necesidades de oxígeno. En la angina de pecho se toman en pastillas debajo de la lengua o también en spray. También pueden tomarse en pastillas de acción prolongada o ponerse en parches de liberación lenta sobre la piel. En la fase aguda de un ataque al corazón, suelen usarse por vía venosa. No deben utilizarse en casos de Shock.
- +Betabloqueantes. Actúan bloqueando muchos efectos de la adrenalina en el cuerpo, en particular el efecto estimulante sobre el corazón. El resultado es que el corazón late más despacio y con menos fuerza, y por tanto necesita menos oxígeno. También disminuyen la tensión arterial. Precaución si el paciente esta en Bradicardia y/o en Hipotensión Arterial.
- +Digital. Los medicamentos derivados de la digital, como la digoxina, actúan estimulando al corazón para que bombee más sangre. Esto interesa sobre todo si el ataque al corazón produce insuficiencia cardíaca.
- +Calcio-antagonistas o el bloqueantes de los canales del calcio impiden la entrada de calcio en las células del miocardio. Esto disminuye la tendencia de las arterias coronarias a estrecharse y además disminuye el trabajo del corazón y por tanto sus necesidades de oxígeno. También disminuyen la tensión arterial. Tener mismas precauciones que con B-Bloqueantes.
(No suelen usarse en la fase aguda de un ataque al corazón, aunque sí inmediatamente después).
TRATAMIENTO DE INFARTO AGUDO DE MIOCARDIO
TRATAMIENTO INVASIVO
Cuando los medicamentos no pueden despejar las arterias obstruidas, una arteria coronaria significativamente estrechada podría necesitar tratamiento adicional para reducir el riesgo de un ataque cardíaco. Existen dos tratamientos principales:
- Las intervenciones transcatéter
- La cirugía de bypass coronario.
Ambos tratamientos han demostrado ser eficaces en pacientes cuidadosamente seleccionados. La elección dependerá de factores tales como el grado de obstrucción, cuántas arterias han sido afectadas, el lugar donde se encuentra la obstrucción y la cantidad de músculo cardíaco que podría verse afectado, y de los factores individuales del paciente, tales como la edad y el estado general de salud.
INTERVENCIONES TRANSCATÉTER
La angioplastia, que abre las arterias estrechadas, es un procedimiento realizado por cardiólogos intervencionistas, utilizando un tubo largo y delgado denominado «catéter» que lleva un pequeño globo (o balón) en la punta, el cual inflan en el lugar de la obstrucción de la arteria para comprimir la placa contra la pared arterial. La angioplastia también se denomina angioplastia coronaria transluminal percutánea (ACTP).
El procedimiento consiste en introducir un alambre delgado (el catéter guía) en una arteria de la pierna, dirigiéndolo a la zona estrechada de la arteria coronaria. El catéter con el globo pasa por encima de este catéter guía y se ubica en el lugar de la obstrucción, donde se infla el globo. Después del tratamiento, se retiran el catéter guía y el catéter con el globo. La estancia en el hospital y el tiempo de recuperación con este procedimiento son menores que con un bypass. Pero aproximadamente el 35 % de los pacientes corre el riesgo de sufrir obstrucciones adicionales en la zona tratada (lo que se denomina «reestenosis»). La reestenosis normalmente se produce dentro de los seis meses siguientes a la realización del procedimiento.
La angioplastia con balón se complementa con la colocación de un stent. El stent es una malla metálica de forma tubular que se implanta en la zona de la arteria obstruida por placa. El stent, montado sobre un catéter que tiene un globo en la punta, se introduce por la arteria y se ubica en el lugar de la obstrucción. A continuación, se infla el globo, lo cual hace que el stent se abra. Luego se retira el catéter con el globo desinflado, dejando el stent en su lugar. La incidencia de reestenosis con este procedimiento es normalmente de entre un 15 y un 20 por ciento.
Como la reestenosis es un problema que presenta el procedimiento de colocación de stent, los médicos han estado tratando de encontrar maneras de mantener abiertas las arterias en las que se han colocado stents. Algunos stents más modernos están recubiertos de medicamentos que reducen la posibilidad de que la arteria se cierre nuevamente. Estos se denominan «stents recubiertos» o «stents liberadores de fármacos». En otro procedimiento de colocación de stent denominado braquiterapia, se aplica una dosis baja de radiación directamente al stent. Se cree que la radiación puede reducir el tejido que obstruye el stent y evitar que vuelva a crecer.
STENT
La aterectomía puede ser una opción para ciertos pacientes que no pueden someterse a la angioplastia con balón. El procedimiento consiste en usar un catéter con un eje rotatorio con cuchillas, que gira a alta velocidad, para cortar la placa de las paredes arteriales.
En la ablación láser se utiliza un catéter que tiene un haz de fibra óptica o metal en la punta. El láser utiliza la luz para «quemar» la placa y abrir el vaso lo suficiente como para permitir la introducción de un globo que pueda dilatarlo aún más.
La revascularización transmiocárdica percutánea (RTMP) es un procedimiento realizado por un cardiólogo en un laboratorio de cateterización cardíaca. Tras la administración de anestesia local, el cardiólogo introduce un catéter en una arteria de la pierna que conduce al corazón. A continuación se introduce por el catéter un láser que se utiliza para abrir pequeños orificios en el músculo cardíaco. Estos orificios se convierten en canales que permiten el paso de la sangre a las zonas del corazón donde existe una deficiencia de oxígeno. Los investigadores creen que el procedimiento puede estimular la formación de nuevos vasos sanguíneos, reduciendo el dolor de la angina de pecho. La RTMP se utiliza actualmente en pacientes que no responden a otros tratamientos, tales como los medicamentos, la angioplastia y la cirugía de bypass coronario.
CIRUGÍA
La cirugía de by-pass coronario consiste en derivar el flujo sanguíneo alrededor de uno o más vasos sanguíneos obstruidos. Para hacerlo, el cirujano corta una sección de una vena del muslo (denominada «vena safena») o utiliza una arteria de la parte superior de la pared torácica (denominada «arteria mamaria interna»). A veces puede utilizarse una arteria de otra parte del cuerpo. Este vaso sanguíneo extirpado quirúrgicamente se denomina «injerto». El injerto puede cortarse en secciones, las cuales se utilizan para derivar el flujo sanguíneo alrededor de las arterias coronarias obstruidas. Tras realizar una incisión en el tórax, el cirujano conecta un injerto a puntos que se encuentran por encima y por debajo de la obstrucción a fin de restablecer el flujo sanguíneo.
El bypass coronario mínimamente invasivo es una técnica de bypass menos invasiva. La incisión es más pequeña y el procedimiento puede realizarse mientras el corazón late. Esto reduce el riesgo de sufrir complicaciones. El procedimiento puede reducir el tiempo de recuperación del paciente, lo cual a su vez disminuye el costo. Esta operación sólo se realiza en aquellos pacientes cuyas obstrucciones pueden sortearse a través de esta pequeña incisión y cuyo riesgo de sufrir complicaciones es bajo.
La revascularización transmiocárdica con láser (RTML) consiste en el uso de un láser para crear pequeños canales en la cavidad inferior izquierda del corazón (el ventrículo izquierdo), a fin de aumentar el flujo de sangre dentro del corazón. Los cirujanos realizan una incisión en el lado izquierdo del tórax. Mientras el corazón late, los cirujanos emplean el láser para crear entre 20 y 40 pequeños canales (de un milímetro de ancho) en el ventrículo izquierdo, a través del músculo cardíaco donde existe una deficiencia de oxígeno. Estos canales constituyen una nueva ruta para llevar sangre al músculo cardíaco, lo cual puede reducir el dolor de la angina de pecho. La RTML se considera generalmente menos invasiva que los procedimientos de corazón abierto. Sólo requiere una pequeña incisión y los pacientes generalmente no necesitan una transfusión de sangre. Y como el procedimiento se realiza mientras el corazón late, no es necesario utilizar una máquina de circulación extracorpórea. Aunque el procedimiento ha sido aprobado por la Administración de Drogas y Alimentos de los Estados Unidos, la RTML sólo se utiliza en pacientes que no responden a otros tratamientos, tales como los medicamentos, la angioplastia o la cirugía de bypass coronario.
(Tratamiento percutáneo de lesiones coronarias con trombos)
La finalidad primordial de cualquier procedimiento de revascularización en un evento isquémico agudo, es mejorar el flujo a nivel micro vascular. Durante la Angioplastia en lesiones con trombos, la manipulación del catéter determina diferentes grados de embolizacion. Esta ultima puede conducir a diferentes grados de obstrucción micro vascular (no re flow) o puede no ser visible angiograficamente a pesar de una significativa reducción del flujo microvascular.
La Angioplastia de lesiones tromboticas incrementa las dificultades del intervencionismo al aumentar el riesgo de eventos mayores (cierre abrupto, muerte, infarto agudo, cirugía coronaria). Los tratamientos trombolíticos y anti coagulante no han probado ser eficaces en prevenir los eventos embolicos producidos durante el procedimiento de Angioplastia.
La terapéutica anti plaquetaria con inhibidores de los receptores II B- III A (abciximab, eptifibatide, tirofiban) han demostrado mejorar el pronostico en la Angioplastia en los síndromes coronarios agudos reduciendo la incidencia de infarto agudo de miocardio relacionado al procedimiento. El beneficio de la medicación Anti II B-III A no se ha probado en las angioplastias con trombosis angiográfica excepto en comunicaciones con evidencias anecdóticas que apoyan el uso de esta medicación en dicho tipo de lesiones. Un meta análisis reciente de 6 grandes Trials no solo confirmo que las lesiones con trombos son grandes predictoras de aumento de la tasa de eventos mayores intra hospitalarios y a los 6 meses sino también que el uso de esta medicación Anti II B- III A no tiene impacto en dichos eventos mayores cuando la angioplastia se realiza en casos con evidente carga de trombos angiográficos.4. Un sub análisis angiografico del Prism Plus demostró que la presencia de trombos angiográficos a pesar del tratamiento con Tirofiban fueron predictores de mortalidad a los 30 días. Un sub análisis reciente del Rapport Trial mostró que la presencia de trombos angiográficos fue también predictor de flujo Timi < 3 a pesar del uso de Abciximab.
No es sorprendente que los inhibidores plaquetarios II B- III A tengan limitaciones en mejorar el flujo micro vascular cuando el lecho vascular ha sido taponado con relativamente grandes émbolos ricos en fibrina. En estas circunstancias parece razonable concebir que una estrategia de extracción de trombo antes de la intervención de la placa pudiera ayudar a disminuir o minimizar los fenómenos embolicos. Hasta el momento actual pocos Devices de trombectomia han sido utilizados para la intervención coronaria aunque la mayoría de ellos tiene limitaciones desde que la manipulación de estos catéteres puede ocasionar también embolizacion distal mientras se trata de realizar la trombectomia.
El catéter de extracción Transluminal TEC fue el primer Device realizado con ese propósito, es decir fraccionar y aspirar el trombo, este Device de alto perfil y poca flexibilidad tuvo indicaciones muy limitadas por causar con alta frecuencia disecciones y también embolias dístales, otra limitación era la incompatibilidad del catéter TEC con catéteres guías de 8 French o menores.7. El sistema de trombectomia reolitico Angiojet ha sido desarrollado para el sistema vascular periférico y para lesiones puntuales seleccionadas coronarias. Recientemente la clínica Mayo presento su experiencia con este Device en 72 pacientes de alto riesgo. Todos ellos tenían evidencia angiográfica de trombo y un puente venoso estuvo involucrado en el 45% de los casos. La mayoría de los pacientes se presentaron como síndrome coronario agudo o infarto agudo de miocardio (87%) y 8% por shock cardiogénico, Antes del procedimiento un flujo Timi 0/1 estuvo presente en el 60% de los casos y un Timi 3 post procedimiento se observo en el 79% de los pacientes. A nivel intra hospitalario los resultados demostraron que un paciente falleció, el 3% sufrió un infarto Q y el 5% un infarto no Q. La sobre vida a un año libre de eventos mayores fue de 65 % reflejando la naturaleza muy enferma de la población. Los resultados de esta experiencia de este único centro son comparables a los resultados del veGASI I Dicho estudio en 90 pacientes de alto riesgo con isquemia aguda o infarto (57% de puentes venosos, 7% shock cardiogénico) y evidencia angiográfica de trombos fueron tratados también con este Device.
El veGASI II trial randomizo 349 pacientes al azar a Angiojet o uroquinasa intra coronaria. La incidencia de eventos mayores a 30 días fue de 23.2% en el grupo de Angiojet y 41.8% en el grupo uroquinasa. Las conclusiones de los investigadores del veGASI es que la trombectomia reolitica es un Device efectivo y puede ser aplicado exitosamente en el tratamiento de lesiones tromboticas mas aun que ahora un catéter nuevo de bajo perfil probablemente mejorara su maniobrabilidad y podría disminuir la probabilidad de embolizacion distal. En una editorial reciente Andreus j. Carter y Kenton Gregory dicen que el Angiojet esta bien probado para el tratamiento de las oclusiones tromboticas de los Graft en territorio vascular periférico y en los vasos nativos, pero sin embargo tiene aplicación limitada debido a su perfil y a la alta probabilidad de bradiarritmia también con consecuencias hemodinámicas adversas. El X-SIZER es un catéter con diámetro en el extremo 1.5 mm, 2.0 y 2.3 mm que extrae Debris tromboticos fraccionando con una cuchilla helicoidal rotante (2100 rpm) mientras aspira el material desde la lesión a un frasco al vacío. Este Device a diferencia del TEC es compatible con Wires 0.014 y catéteres guías según el diámetro distal del Device que va de entre 6 y 8 French. Kwok y colaboradores reportaron un análisis angiografico retrospectivo de la aplicación clínica del X-SIZER para el tratamiento de 14 lesiones tromboticas no calcificadas como parte de un estudio multicéntrico clínico fase I que involucraba una población de 85 pacientes.
En el PCR (curso de Paris de revascularización) se presento el resultado de la fase I del X-TRACT TRIAL. El Trial involucro el tratamiento a 31 pacientes con By Pass venosos severamente enfermos y 19 pacientes con trombos en arteria Nativas. 14. Usando definiciones stándard la tasa de eventos mayores para la fase I fue 6%, para los pacientes tratados con X-SIZER vs. 2 a 4 veces mayor con los tratamientos tradicionales. Coxs y el grupo del hospital Marañon de Madrid han demostrado buenos resultados clínicos y un número incrementado de blush score 3 con el uso del X-SIZER antes de la implantación del Stent.
Todos estos datos anecdóticos deben ser apoyados en su eficacia clínica o deben ser documentados por trials multicéntricos randomizados que comparen el X-SIZER con angioplastia con Balón empleando Stents y protección embolica como así también terapéutica farmacológica (inhibidores de la glucoproteina II B- III A). Probablemente una terapia asociada mecánica y farmacológica probara ser más eficaz que simplemente aspirar el trombo.
MARCADORES BIOQUÍMICOS DE INFARTO MIOCÁRDICO AGUDO POSTOPERATORIO EN LA CIRUGÍA CARDÍACA
Resumen El infarto del miocardio agudo postoperatorio es uno de los determinantes de la morbimortalidad postoperatoria en la cirugía cardíaca y es relativamente frecuente. Como consecuencia del mismo proceder quirúrgico los criterios clínicos, electrocardiográficos y enzimáticos clásicos pierden eficacia, por lo cual no pueden ser aplicados de la manera acostumbrada. Se revisan los marcadores bioquímicos para esta complicación, sus valores y criterios de aplicación en este grupo poblacional particular. DeCS: INFARTO DEL MIOCARDIO/diagnóstico; COMPLICACIONES POSTOPERATORIAS/mortalidad; CIRUGÍA TORÁCICA/complicaciones; MARCADORES BIOLÓGICOS; INDICADORES MORBIMORTALIDAD; REVASCULARIZACION MIOCÁRDICA. Uno de los principales determinantes de la morbimortalidad postoperatoria en la cirugía cardíaca es el infarto del miocardio agudo (IMAPO). Su prevalencia es del 9,4 % en la cirugía cardiovascular en general y del 16,9 % en la revascularización miocárdica con puentes con los criterios diagnósticos de IMAPO que se utilizan en nuestro servicio.
1 Los criterios clínicos y electrocardiográficos diagnósticos clásicos de IMA pierden eficacia al ser aplicados a un paciente que ha sido sometido a una operación cardíaca. El dolor precordial puede faltar o ser modificado a causa de la analgesia y a causas osteomusculares secundarias a los traumatismos de origen quirúrgico.
En este tipo de cirugía, los cambios electrocardiográficos (ECG) peri operatorios no son indicativos de que un daño isquémico sea reversible o no. Los cambios de ST-T no son signos confiables de IMAPO. El único signo electrocardiográfico específico, la aparición de nuevas ondas Q patológicas, es tardío o puede faltar, la mayoría de los IMAPO son infartos no Q. Otro elemento a tener en cuenta es que el uso de estas nuevas ondas Q ha sido cuestionado como patrón “oro” en el diagnóstico de IMAPO al aparecer hasta en un cuarto de los casos de cirugía coronaria sin que exista necrosis miocárdica.
2 Los criterios diagnósticos bioquímicos no son ajenos a las interferencias que produce el acto quirúrgico. En circunstancias normales, los marcadores enzimáticos para el diagnóstico del IMA no constituyen un gran problema. En el contexto de la cirugía cardíaca y especialmente en la de revascularización miocárdica, su interpretación es mucho más difícil, ya que además del daño miocárdico que puede ser producido por un proceso isquémico per. se, existen daño miocárdico y no miocárdico secundarios a la manipulación quirúrgica. El mero hecho de ser sometido a una circulación extracorpórea produce un aumento de los marcadores bioquímicos cardíacos a la media hora de la reperfusión.
3 Durante la cirugía de revascularización miocárdica hay liberación de marcadores miocárdicos. Esta liberación tiene un significado funcional, estrechamente relacionado con el tiempo de isquemia y refleja la demora en la recuperación de la función ventricular izquierda y del metabolismo oxidativo, o sea demuestran daño miocárdico que puede ser reversible.
4 Muchos de los marcadores bioquímicos propuestos para detectar el daño miocárdico también son liberados por otras estructuras, como el músculo esquelético. Esta carencia de especificidad limita su uso en este contexto.
Enzimas Creatincinasa (CK) No es específica del miocardio, también la libera el músculo esquelético. Se utilizan la mensuración de la CK total, la de CK-MB y el porcentaje CK-MB/CK. Son de uso común.
La eficacia diagnóstica puede ser interferida por factores diversos: macrocinasas, adenilatocinasa, la izo enzima CK-MM y la cirugía que conlleve escisión muscular. La medición por cromatografía de columna es superior a la realizada por inmunoinhibición, inmunoprecipitación o electroforesis.
En la cirugía cardíaca, para evitar las interferencias ya descritas se utilizan valores de referencia de actividad catalítica de CK superiores a 600 – 700 UI/L a las 24 h post intervención, y de CK-MB de 133 y 45 UI/L a las 15 y 34 h.
5,6 La cuantificación de la concentración de masa de CK-MB por métodos inmunológicos no se afecta por interferencias y es más eficiente para el diagnóstico de IMAPO. En el valor de referencia diagnóstica no infartados el pico de esta concentración de masa se halla a las 6,4 h y se normaliza a las 22 h de la operación.
7,9 En los infartados, el pico máximo está sobre las 16 a 19,1 h y se normaliza 62,4 h después de la intervención, aunque ya a las 6 h de la cirugía el aumento puede ser de utilidad diagnóstica.
8, 10,11 Estos picos tienen sus limitaciones en el significado, por lo que es más seguro el patrón mostrado en mediciones seriadas.
9 Una manera de aumentar la especificidad de esta enzima es el índice de CK-MB masa sobre la actividad de la CK. El límite superior puede considerarse en el 3,3 %, aunque en dependencia de las técnicas usadas puede llegar al 10 %. El aumento de la CK-MB masa no predice mortalidad.
12 Proteínas no enzimáticas Mioglobina Es menos utilizada por ser más inespecífica. En pacientes no infartados tiene un pico máximo entre 1 y 4 h después del declampaje aórtico. En los infartados, el máximo de concentración se ubica entre las 6 y 12 h siguientes al declampaje aórtico y persiste la elevación en las primeras 24 h. En ambos casos, a las 48 h hay una normalización de las cifras.5 Existen pruebas comerciales cualitativas.
Troponinas Las troponinas están presentes en el miocardio y el músculo esquelético. Es un complejo de proteínas formado por 3 subunidades que regulan el proceso contráctil del músculo estriado: la troponina C que liga el Ca++, la troponina I (TnI) que regula la interacción actina-miosina inhibiéndola y la troponina T (TnT) que la liga a la tropomiosina. Las isoformas T e I tienen diferente estructura proteica y son específicas del corazón. Ambas han mostrado alta especificidad y sensibilidad para el diagnóstico de IMA.9 En la cirugía cardíaca sus concentraciones se relacionan con el tiempo de pinzamiento aórtico.
La TnT es una proteína del complejo tropomiosina. En cirugía cardíaca se toman como valores diagnósticos de IMAPO concentraciones superiores a los 3 - 4 µg/L (3 ng/mL).5, 13 En pacientes no infartados hay un pico sobre las 48 h.7 En casos con IMAPO, el pico máximo ocurre a las 18,6 h después de la intervención y al cuarto o quinto día hay otro pico. El aumento del primer día parece corresponder básicamente a la liberación de TnT citoplasmática y no estructuralmente ligada y que puede liberarse al plasma incluso cuando hay cambios mínimos y reversibles en los miocitos. Cifras altas en días posteriores corresponden a liberación de TnT que forma parte de los complejos de tropomiosina que aparecen circulantes solo cuando hay daño severo e irreversible de las células miocárdicas.5 La troponina T predice mortalidad. Permanece elevada hasta por 2 semanas.12 En el mercado existen pruebas cualitativas que también son efectivas en pacientes quirúrgicos.
En pacientes sometidos a trasplantes cardíacos, la liberación de TnT no se relaciona con el tiempo de isquemia quirúrgica ni las funciones renal o hepática de los casos. Es muy variable entre individuos y las cifras son similares a las que se ven en casos de IMA de poca extensión con ondas Q. En casos que presentan rechazo severo al trasplante ocurre un aumento significativo de la TnT hasta 13 días antes de su detección histológica.
14,15 La TnI es otra proteína del complejo tropomiosina. Aunque tiene isoformas tanto en miocardio como en el músculo esquelético, estas tienen diferencias estructurales que permiten diferenciarlas por métodos bioquímicos. En pacientes no infartados hay un pico a las 12 h de operados.
7,10 En los infartos el pico máximo es más tardío, sobre las 24 h, 10 aunque ya a las 6 h la cuantía del aumento permite discriminar un evento isquémico significativo.8 Los valores de referencia diagnóstica para IMAPO se sitúan en cifras de 3,1 a 19 µg/L, con sensibilidad de 90 a 100 % y especificidad de 93 a 100 %.
En cirugía cardíaca valores de troponina I > 40 ng/mL se asocian a anormalidades de motilidad de la pared ventricular y aparición de Q en el ECG. Valores > 60 ng/mL tienen fuerte asociación a eventos isquémicos cardíacos, arritmias, tiempo de ventilación y estadía. La correlación de la troponina I con estos eventos es mayor que la de la CK-MB.18 En pacientes infartados se mantiene elevada por 5-7 días. Es un discriminador de IMAPO similar o superior a la TnT. La TnI junto con el porcentaje CK-MB/CK son los únicos marcadores bioquímicos de IMAPO que no se modifican en pacientes donde se realiza autotransfusión de sangre derramada.19 Ácidos grasos unidos a proteínas (FABP) De uso poco frecuente. Es el marcador bioquímico de IMA que aumenta más rápidamente, 4 h antes que la mioglobina y las CK o CK-MB.3 Al igual que la mioglobina no es específico del músculo cardíaco, se encuentra también en el músculo esquelético. Alcanza mayor especificidad cuando se utiliza en forma de relación con la mioglobina (Mioglobina/FABP en plasma). En el músculo cardíaco humano normal esta relación es de 4,5 y en el músculo esquelético varía de 21 a 73. Después de una cirugía cardiaca esta relación puede aumentar a un promedio de 32,1.20
RESUMEN DE TRATAMIENTO
- Al abordar un paciente con IAM en el Hospital debe contemplarse tres Objetivos principales:
- Lograr la recuperación del paciente lo antes posible.
- Limitar la extensión necrótica de miocardio. Mejorar el desequilibrio Oferta/Demanda de O2 a los tejidos.
- Evitar y manejar las Complicaciones post-infarto.
MEDIDAS GENERALES
Monitorización
El principal método de monitorización es el examen físico del paciente siempre que se considere necesario y fueren las veces que fueren. El aspecto clínico y su asociación con la Monitorización Electrocardiográfica continua junto con las variaciones del dolor en relación al estado del segmento ST son fundamentales. (Estos procesos se realizan ya en la Ambulancia Medicalizada).
En El Hospital, se deriva por definición, a la Unidad Coronaria. Allí debe permanecer, al menos durante 3 días, en un IAM no complicado. Este tiempo se prorrogará si existe algún tipo de complicación o si persisten alguno de los síntomas /signos.
En La Unidad Coronaria permanecerá Monitorizado tanto Electrocardiográfica mente como de todas las constantes vitales. Se realizaran venoclisis para sistema de Perfusión y se le realizará Gasometría Arterial para valoración de Presión de Oxigeno, de Dióxido de carbono, pH, Bicarbonatos, Exceso de Base y Electrolitos.
Si existiese un gran deterioro Hemodinamico, se realizará cateterismo de SWAN-GANZ sobre todo cuando hay fallo cardíaco, shock, o deterioro progresivo del paciente.
DESCRIPCIÓN del CATÉTER DE SWAN-GANZ
Recientemente ha irrumpido en el mercado un tipo de catéter más sofisticado, también bastante más costoso, que permite la medición continua -cada minuto- y automática del gasto cardiaco, índice cardiaco y saturación venosa central o mixta Sus características físicas son distintas y precisas, actualmente, de la conexión a un monitor-traductor propio. Es mucho más cómodo de usar y requiere menor manipulación del sistema por lo que también es más beneficioso para el paciente, ya que se reduce el riesgo de contaminación. Será objeto de un estudio posterior que se identificará con el nombre de "Catéter de Swan-Ganz modificado".
Hoy por hoy, y dado el coste de este equipo, los más usados son los catéteres de Swan-Ganz convencionales. Hay varios modelos en el mercado con ligeras variaciones. El más utilizado en nuestro servicio es el 7F de los laboratorios Edwards y sobre él se basará la descripción.
Es un catéter radiopaco de 110 cm. de longitud que consta de:
*Una luz proximal (color azul) que tiene su salida a 30 cm. del extremo del catéter. Tras colocarse el Swan-Ganz debe quedar ubicada en aurícula derecha. Por ella captamos la presión de esta cavidad y, además, es por ella por donde introducimos el suero frío para medir el gasto cardiaco.
Puede usarse para administrar medicación, si bien no es aconsejable para evitar su manipulación.
*Una luz distal (color amarillo) que vierte en el extremo del catéter. Su ubicación correcta es en una gran ramificación de la arteria pulmonar. Por ella recibimos la presión arterial pulmonar y la presión capilar pulmonar.
No debe usarse para la administración de medicación, y la extracción de sangre a su través solo debe realizarse por indicación específica.
*Sistema de inflación del balón. En su extremo externo presenta una válvula que permite bloquear la entrada o salida de aire. Tiene una jeringa de 1,5 cm. incorporada. A unos 2 cm. del final del catéter se encuentra el balón el cual, al hincharse, posibilita el enclavamiento y, con ello, la medición de la presión capilar pulmonar.
Se introducirá por su través únicamente aire o CO2, nunca líquidos. La cantidad máxima para el modelo 7F es de 1,5 cm. si bien no se llegará a esta cifra si con menor cantidad conseguimos que enclave. El desinflado debe ser pasivo.
*Cable del termistor. En su extremo externo presenta una conexión que le permite adaptarse a un monitor para el registro térmico continuo y para el cálculo del gasto cardiaco. A 4 cm. del final del catéter presenta un sensor de temperatura (termistor).
Si fuese necesario se realizará ANGIOPLASTIA CORONARIA´TRANSLUMINAL PERCUTANEA (ACTP) y hasta BY-PASS, cuando la recanalización arterial no ha sido satisfactoria con medios farmacológicos. En Casos de alteraciones de Ritmo, sobre todo bradicardias, se implantará Marcapasos definitivo subcutáneo.
Reposo
Éste debe ser Absoluto durante las primeras 48 horas de un IAM no complicado. Se alargará si existen o se presentan Complicaciones de cualquier tipo.
Mientras esté en Reposo Absoluto, se administrarán Heparinas de Bajo Peso Molecular para evitar Trombosis Venosas Profundas y Trombo-embolismo Pulmonar Agudo.
Al 3º-4º día el paciente podrá sentarse en la cama y comer sentado en la misma.
A partir del 4º día puede pasar a Planta Hospitalaria y se le permitirá deambular por la habitación y realizar labores de aseo personal.
Al 8º día se le permite ducharse y andar por el pasillo.
Entre el 10º-14º día puede ser dado de Alta Hospitalaria si no hubo ninguna complicación. Antes se le realizará una Prueba de Esfuerzo Submáxima con actividad equivalente a 5 Mets de O2.
Oxigenación
Damos por hecho que siempre existe una cierta hipoxemia, por lo que se aplicara mascarilla nasal a 2-3 litros de O2 por minuto. Durante 48-74 horas.
Dieta
Será Absoluta durante las primeras 12 horas (por si fuese necesario realizar procedimientos invasivos)
A partir de entonces se pasara Dieta Liquida.
Al 2º día se dará dieta blanda sólida, hiposodica e hipocalórica. Se añadirán laxantes para evitar maniobras de Vasalva que aumente la presión intratorácica, con la posible aparición de disrritmias e incluso rotura cardíaca, por el esfuerzo.
Sedación
En el tratamiento se añadirán Benzodiacepinas, para evitar la ansiedad y consecuente descarga de catecolaminas con aumento de necesidades de O2.
Analgesia
Disminuye la ansiedad, secreción catecolaminica y demandas metabólicas. En IAM extenso se utiliza Cloruro Mórfico al 1% en perfusión continua o a dosis de 3-8 mgrs IV cada 15-30 minutos.
Lidocaína Profiláctica
Es un tema controvertido. La Asociación Americana del Corazón (AHA) sólo la prescribe en estos casos:
- Extrasístoles ventriculares con criterios de Low de II a IV.
- Taquicardia o Fibrilación Ventricular que requirieron cardioversión eléctrica.
- Pacientes menores de 70 años con bajo riesgo de Toxicidad.
De utilizarse, se emplea 1 mgrs/Kg de peso en bolo inicial y se repite cada 5-8 minutos en tres o cuatro ocasiones.
Rehabilitación Física
Una vez estabilizado el paciente, cuanto antes se realice mucho más efectiva la recuperación.
Cambios en el estilo de vida
Aunque el IAM puede ser provocado por el ejercicio físico, esto no significa que el paciente deba dejar de hacer ejercicio, sino que debe seguir un programa de ejercicios aprobado por el médico.
Deben controlarse los factores de riesgo de IAM (típicamente la aterosclerosis), entre ellos:
- la hipertensión arterial,
- el consumo de cigarrillos,
- los niveles elevados de colesterol
- el exceso de peso.
Si el paciente come una dieta sana, no fuma, limita su consumo de alcohol y evita el estrés, podrá vivir más cómodamente y sufrir ataques de angina y/o IAM con menor frecuencia.
Nitratos
Marcas comúnmente usadas en los Estados Unidos: IMDUR (mononitrato de isosorbida), ISMO (mononitrato de isosorbida), Isordil (dinitrato de isosorbida), Monoket (mononitrato de isosorbida), Nitro-Dur (nitroglicerina), Nitrolingual (nitroglicerina), Nitrostat (nitroglicerina) y Sorbitrate (dinitrato de isosorbida).
Marcas comúnmente usadas en Canadá: Apo-ISDN (dinitrato de isosorbida), Coronex (dinitrato de isosorbida), IMDUR (mononitrato de isosorbida), ISMO (mononitrato de isosorbida), Isordil (dinitrato de isosorbida) y Nitrostat (nitroglicerina).
Los nitratos son vasodilatadores. Los vasodilatadores ensanchan (dilatan) los vasos sanguíneos, lo cual mejora el flujo sanguíneo y permite un mayor suministro de sangre rica en oxígeno al músculo cardíaco. Los nitratos además relajan las venas. Si regresa al corazón una menor cantidad de sangre proveniente de los brazos y las piernas, se reduce el esfuerzo del corazón.
Betabloqueantes
(Bloqueantes betaadrenérgicos)
Marcas comúnmente usadas en los Estados Unidos: Betapace (sotalol), Blocadren (timolol), Brevibloc (esmolol), Cartrol (carteolol), Coreg (carvedilol), Corgard (nadolol), Inderal (propranolol), Inderal-LA (propranolol), Kerlone (betaxolol), Levatol (penbutolol), Lopressor (metoprolol), Normodyne (labetalol), Sectral (acebutolol), Tenormin (atenolol), Toprol-XL (metoprolol), Trandate (labetalol), Visken (pindolol) y Zebeta (bisoprolol).
Marcas comúnmente usadas en Canadá: Apo-Atenolol (atenolol), Apo-Metoprolol (metoprolol), Apo-Propranolol (propranolol), Apo-Timol (timolol), Betaloc (metoprolol), Blocadren (timolol), Corgard (nadolol), Inderal (propranolol), Lopressor (metoprolol), Monitan (acebutolol), Novo-Atenol (atenolol), Novometoprol (metoprolol), Novo-Pindol (pindolol), Novo-Timol (timolol), Sectral (acebutolol), Sotacor (sotalol), Tenormin (atenolol), Trandate (labetalol), Trasicor (oxprenolol) y Visken (pindolol).
· Los betabloqueantes «bloquean» los efectos de la adrenalina en los receptores beta del organismo. Esto retarda los impulsos nerviosos que pasan por el corazón. Por consiguiente, el corazón no tiene que esforzarse tanto porque necesita menos sangre y oxígeno. Los betabloqueantes también bloquean los impulsos que pueden provocar una arritmia.
· El organismo tiene dos principales receptores beta: beta-1 y beta-2.
· Algunos betabloqueantes son selectivos, es decir que bloquean más a los receptores beta-1 que a los receptores beta-2. Los receptores beta-1 controlan la frecuencia y la fuerza del latido cardiaco.
· Los betabloqueantes no selectivos bloquean tanto los receptores beta-1 como los beta-2. Los receptores beta-2 controlan la función de los músculos lisos (los músculos que controlan las funciones del organismo pero que la persona misma no puede controlar en forma voluntaria).
Bloqueantes cálcicos
Marcas comúnmente usadas en los Estados Unidos: Adalat (nifedipina), Calan (verapamilo), Cardene (nicardipina), Cardizem (diltiazem), Cardizem CD (diltiazem), Cardizem SR (diltiazem), Cartia (diltiazem), Covera-HS (verapamilo), Dilacor XR (diltiazem), Diltia XT (diltiazem), DynaCirc (isradipina), Isoptin (verapamilo), Lotrel (amlodipine), Nimotop (nimodipina), Norvasc (amlodipina), Plendil (felodipina), Procardia (nifedipina), Procardia XL (nifedipina), Sular (nisoldipina), Tiamate (diltiazem), Tiazac (diltiazem), Vascor (bepridil) y Verelan (verapamilo).
Marcas comúnmente usadas en Canadá: Adalat (nifedipina), Apo-Diltiaz (diltiazem), Apo-Nifed (nifedipina), Apo-Verap (verapamilo), Cardene (nicardipina), Cardizem (diltiazem), Cardizem SR (diltiazem), Isoptin (verapamilo), Nimotop (nimodipina), Novo-Diltazem (diltiazem), Novo-Nifedin (nifedipina), Novo-Veramil (verapamilo), Nu-Diltiaz (diltiazem), Nu-Nifed (nifedipina), Nu-Verap (verapamilo), Plendil (felodipina), Renedil (felodipina), Sibelium (flunaricina), Syn-Diltiazem (diltiazem) y Verelan (verapamilo).
Los bloqueantes cálcicos reducen el paso del calcio al músculo cardíaco y a las paredes de los vasos sanguíneos. Esto relaja los vasos. Los vasos relajados permiten que la sangre fluya más fácilmente, reduciéndose así la presión arterial.
REVISIONES POST-I.A.M.
| PATOLOGÍA | 1ª REVISIÓN | PRUEBAS EN 1ª REVISIÓN | REVISIONES SUCESIVAS | PRUEBAS A REALIZAR |
| ANGINA ESTABLE | 1 AÑO | ERGOMETRIA Y ANALÍTICA | ANUALES | LAS MISMAS. |
| KILLIP I | 6º MES | ERGOMETRIA. ANALÍTICA. ECOCARDIOGRAMA | NO | NO, SALVO CLÍNICA |
| KILLIP II-III | 6º MES | IGUAL | 1 AÑO | ERGOMETRIA Y ANALÍTICA. |
| CIRUGÍA | 6º MES | IGUAL | CADA 2 AÑOS | ERGOMETRIA. ANALÍTICA. |
| VALVULO PATIAS GRAVES | 6º MES | ANALÍTICA. ECO CARDIOGRAFÍA | ANUAL | ECO CARDIOGRAFÍA. |
REVISIONES DE CARDIOPATÍAS EN CONSULTAS EXTRAHOSPITALARIAS
ICONOGRAFÍA
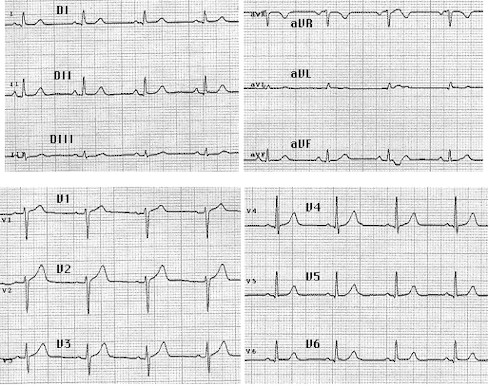
ELECTROCARDIOGRAMA NORMAL
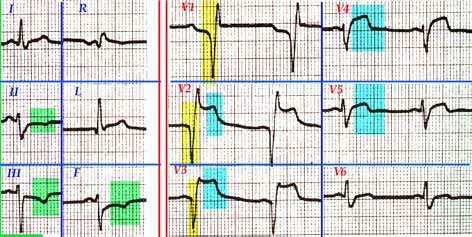
ELECTROCARDIOGRAMA CON IAM ANTERO-SEPTO-INFERIOR
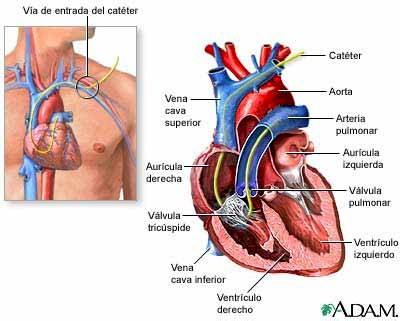
CATÉTER DE SWAN-GANZ
ARTERIA CORONARIA ATEROMATOSA (Corte Sagital)
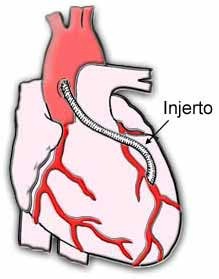
ESQUEMA DE BY-PASS CORONARIO
REALIZACIÓN DE BY-PASS (INTRAOPERATORIO).
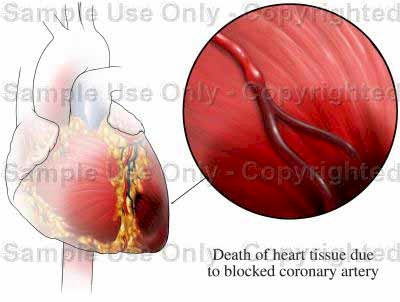
OBSTRUCCIÓN CORONARIA
MÉTODOS DIAGNÓSTICOS DE ALTERACIONES CARDIACAS EN IMÁGENES
(Instituto del Corazón de Texas. USA)
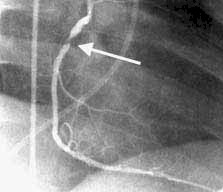
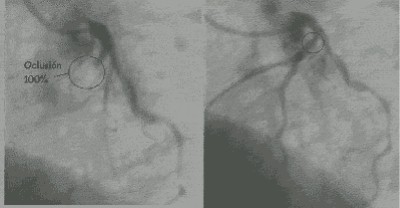
ARTERIOGRAFÍA CORONARIA
ECOCARDIOGRAFÍA ISOTÓPICA
RESONANCIA MAGNÉTICA DE CORAZÓN
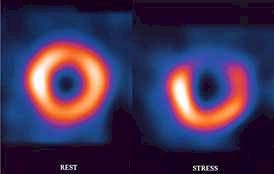
SPECT CARDIACO
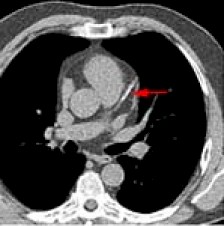
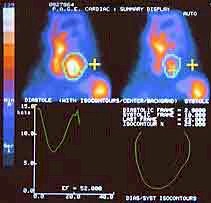
VENTRICULOGRAFÍA ISOTÓPICA
BIBLIOGRAFIA
Svedjeholm R, Dahlin L, Lundberg C, Szabo Z, Kagedal B, Nylander E et al. Are electrocardiography Q-wave criteria reliable for diagnosis of perioperative myocardial infarction after coronary surgery?. Eur J Cardiothorac Surg 998; 13(6):655-61.
Fransen E, Maessen J, Hermens W, Glatz J. Demonstration of ischemia-reperfusion injury separate from postoperative infarction in coronary cartery bypass graft patients. Ann Thorac Surg 1998; 65(1):48-53.
Koh T, Hooper J, Kemp M, Ferdinand F, Gibson D, Pepper J. Intraoperative release of troponin T in coronary venous and arterial blood and its relation to recovery of left ventricular function and oxidative metabolism following coronary artery surgery. Heart 1998; 80:341-8.
Ordóñez J, Guindo J, Ferrer G. Utilidad de los marcadores bioquímicos en la detección del daño miocárdico asociado al infarto peri operatorio y al rechazo del transplante cardiaco. Rev Esp Cardiol 1995; 2:77-84.
Greaves S, Rutherford J, Aranki S, Cohn L, Couper G, Adams D et al. Current incidence and determinants of perioperative myocardial infarction in coronary artery surgery. Am Herat J 1996; 132(3):572-8.
Bonnefory E, Filley S, Kirkorian G, Guidollet J, Roriz R, Robin J et al. Troponin I, troponin T, or creatine kinase-MB to detect perioperative myocardial damage after coronary artery bypass surgery. Chest 1998; 114(2):482-6.
Jacquet L, Noirhomme P, El Khoury G, Goenen M, Philippe M, Col J et al. Coronary bypass surgery. Eur J Cardiothorac Surg 1998,13(4):378-84.
Galiña M. In search of reliable marker of tissue injury during heart surgery. Heart 1998; 80:317-8.
Alyanakian M, Dehoux M, Chatel D, Seguret C, Desmonts JM, Durand G et al. Cardiac troponin I in diagnosis of perioperative myocardial infarction after cardiac surgery. J Cardiothorac Vasc Anesth 1998; 12(13):288-94.
Jain U, Laflamme C, Aggarwal A, Ramsay J, Comunale M, Ghoshal S et al. Electrocardiographic and hemodynamic changes and their association with myocardial infarction during coronary artery bypass surgery. A multicenter study. Multicenter study of preoperative ischemia (McSPI) research group. Anesthesiology 1997; 86(3):576-91.
van Domburg R, Cobbaert C, Kimman G, Zerback R, Simoons M. Long-term prognostic value of serial troponin T bedside tests in patients with acute coronary syndromes. Am J Cardiol 2000; 86(6):623-7.
Simeone F, Biagioli B, Dolci A, Favilli R, Totaro P, Marullo A et al. The diagnostic and prognostic value of cardiac Troponin T in bypass surgery. J Cardiovasc Surg (Torino) 1999; 40(2):211-6.
Hosein-Nia M. Mascaró J, Mckenna W, Murdy A, Holt D. Troponin T as non invasive marker of cardiac allograft rejection. Lancet 1993; 341:838.
Zimmerman R, Baki S, Dengler T, Ring G, Remppis A, Langer R et al. Troponin T release after heart transplantation. Br Heart J 1993; 69:395-8.
Gensini G, Fusi C, Conti A, Calamai G, Montesi G, Galanti G et al. Cardiac troponin I and Q-wave perioperative myocardial infarction after coronary artery bypass surgery. Crit Care Med 1998 26(12):1936-7.
Benoit MO, Paris M, Silleran J, Fiemeyer A, Moati N. Cardiac Troponin I: its contribution to the diagnosis of perioperative myocardial infarction and various complications of cardiac surgery. Crit Care Med 2001,29:1880-1886.
Greenson N, Macoviak J, Krishnaswamy P, Morrisey R, James C, Clopton P et al. Usefulness of cardiac troponin I in patients undergoing open-heart surgery. Am Heart J 2001; 141(3):447-55.
De Paul’s R, Colagrande L, Seddio F, Piciche M, Penta de Peppo A, Bassano C et al. Levels of troponin I and cardiac enzymes after reinfusion of shed blood in coronary operations. Ann Thorac Surg 1998; 65(6):1617-20.
Van Nieuwenhoven F, Kleine A, Wodzig W, Hermens W, Kragten H, Laessen J et al. Discrimination between myocardial and skeletal muscle injury by assessment of the plasma ratio of myoglobin over fatty acid binding protein. Circulation 1995; 92(10):2848-54.
Sedgwick ML, Watson J, Dalziel K, Carrington DJ, Cobbe SM.
Efficacy of out of hospital defibrillation by ambulance technicians using automated external defibrillators.
The Heartstart Scotland Project. Resuscitation. 1992; 24:73-87.
Herlitz J, Bang A, Axelsson A, Graves JR, Lindqvist J.
Experience with the use of automated external defibrillators in out of hospital cardiac arrest.
Resuscitation. 1998; 37:3-7.
Eisenberg MS. Is it time for over-the-counter defibrillators? JAMA. 2000; 284:1435-1438.
Balady GJ, Chaitman B, Foster C, Froelicher E, Gordon N, Van Camp S.
Automated external defibrillators in health/fitness facilities: supplement to the AHA/ACSM
Recommendations for Cardiovascular Screening, Staffing, and Emergency Policies at Health/Fitness Facilities. Circulation. 2002; 105:1147-1150.
Larsen MP, Eisenberg MS, Cummins RO, Hallstrom AP.
Predicting survival from out-of hospital cardiac arrest: a graphic model. Ann Emerg Med. 1993; 22:1652-1658.
Swor RA, Jackson RE, Cynar M, et al.
Bystander CPR, ventricular fibrillation, and survival in witnessed, unmonitored out-of-hospital cardiac arrest. Ann Emerg Med. 1995; 25:780-784.
American Heart Association - Fighting Heart Disease and Stroke. 2000 Heart and Stroke Statistical Update. p.5 American Heart Association - Fighting Heart Disease and Stroke. Cardiovascular Disease Statistics American Heart Association - Fighting Heart Disease and Stroke. 2000 Heart and Stroke Statistical Update. p.11 American Heart Association - Fighting Heart Disease and Stroke. 2000 Heart and Stroke Statistical Update. pp. 20 - 25 . The Task Force on the management of acute myocardial infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with ST segment elevation. Eur Heart J., 2003; 24: 28-66. López Bescós, L., et al.: Guías de actuación clínica de la Sociedad Española de Cardiología en la angina inestable/infarto sin elevación ST. Rev Esp Cardiol, 2000; 53: 838-850. López Bescós, L., et al.: Actualización (2002) de las guías de práctica clínica de la Sociedad Española de Cardiología en angina inestable/infarto sin elevación del segmento ST. Rev Esp Cardiol, 2002; 55: 631-642. Théroux, P.:Angina inestable. En: Manual Hurst, El corazón 9.ª edición, 2000; 161-168. Wayne Alexander, R.: Diagnóstico y tratamiento de los pacientes con infarto agudo de miocardio. En: Manual Hurst El corazón 9.ª edición, 2000; 169-226. Perales Rodríguez de Viguri,N.: Síndrome coronario agudo. En: Guía de recomendaciones en medicina de urgencias, 2003; 1-19. López-Reina Torrijos, P.; Rodríguez Alonso, M.: Síndromes coronarios agudos. En: Manual de protocolos y actuación en urgencias, 2001; 81-88. Ortigosa Aso, F. J.; Silva Melchor, L.: Cardiopatía isquémica. En: Normas de actuación en urgencias, 2000; 160-166. Marino, P. L.:Tratamiento precoz del infarto de miocardio agudo. En: El libro de la UCI 2.ª edición, 2000; 325-342.