Se realizó un estudio prospectivo longitudinal, analítico, estudio de corte en el periodo de tiempo correspondiente a Mayo del
Alternativa terapéutica en los pacientes con sepsis y riesgo de evolucionar a shock séptico en el Hospital “General Docente Pedro Betancourt “Jovellanos Mayo del 2008-Diciembre del 2010
Dr. José Ramón Cuba Lores. MSC en Urgencias y Emergencias Médicas. Especialista de Primer grado en Medicina Interna – Medicina Intensiva.
Dr. Reynaldo Elías Sierra. Especialista de primer grado en Cardiología. Especialista de segundo grado en Medicina Intensiva
Dunia Odanis García Meriño. Enfermera Intensivista.
RESUMEN
Se realizó un estudio prospectivo longitudinal, analítico, estudio de corte en el periodo de tiempo correspondiente a Mayo del 2008 a Diciembre del 2010, en el Hospital General Docente Pedro Betancourt del municipio Jovellanos, Provincia Matanzas. Nuestro universo de trabajo estuvo constituido por los pacientes con sepsis y riesgo de evolucionar al shock séptico que acudieron al cuerpo de guardia o que se encontraban hospitalizados en dicho Hospital. La muestra estuvo compuesta por 100 pacientes, los que se enmarcaron en nuestro universo de trabajo. De acuerdo a la discusión y análisis de los resultados en la tabla I, según sexo y edad, existió un predominio del sexo masculino y, respecto a los grupos etarios, fueron los pacientes entre de 70-80 años.
En la tabla II, de acuerdo a los factores relacionados con las características del agente invasor, predominaron los pacientes de la tercera edad. En la tabla III, el servicio que más aportó fue el servicio de Medicina Interna
En la tabla IV, de acuerdo a la localización de la sepsis, el mayor porcentaje fue para las sepsis respiratorias. En la tabla V, de acuerdo a la precocidad del tratamiento protocolizado, se demostró que en la primeras 6 horas fueron valorados el mayor porcentaje de pacientes.
De acuerdo a la aparición de las complicaciones, fueron más frecuentes antes de la aplicación del protocolo (así lo demuestra la tabla VI). En la tabla VII, la mortalidad fue mayor en los procedentes de la sala de medicina y cuerpo de guardia y por último los atendidos después de las 24 horas fueron los que evolucionaron fatalmente. De esta forma lo observamos en la tabla VIII.
Palabras Clave: sepsis, sepsis grave, shock séptico
Introducción
Si bien es cierto que en la Medicina no existen temas que no sean de interés, hemos considerado conveniente tratar un problema que universalmente enfrentamos los médicos, no importando a que especialidad nos dediquemos: nos referimos a la sepsis, tema apasionante y en constante renovación, dado a que con la misma celeridad con que descubrimos nuevos antimicrobianos, también las bacterias elaboran nuevos mecanismos de defensa que le conceden resistencia a éstos.
La práctica médica está experimentando numerosos cambios a los que debe adaptarse cualquier profesional del ámbito sanitario. Un breve análisis del índice de esta sección nos indica que se están implantando conceptos y modalidades que harán nuestra actividad muy diferente de la que era habitual durante el siglo que estamos abandonando. La época actual se ha venido a llamar "era de la revolución informática", por lo mucho que los recursos de esta índole están invadiendo todas las actividades humanas, incluidos los ámbitos de nuestra profesión. A diferencia de las épocas anteriores en las que dominaba la medicina terapéutica o sanadora, actualmente se hace cada vez mayor énfasis en los aspectos médicos de tipo epidemiológico y preventivo. (1, 2, 3, 4,5)
Están surgiendo numerosas modalidades sanitarias apenas conocidas en el siglo anterior, tales como la cirugía ambulatoria o la hospitalización a domicilio. Por otro lado, un gran capítulo considerado antaño como medicina casi heroica, la trasplantología, se ha consolidado como algo normal. Se está haciendo énfasis sobre calidad de vida y, en consecuencia, sobre el tratamiento del dolor y los cuidados paliativos. Cada vez adquieren mayor importancia numerosas vertientes de la bioética, así como la intervención de la justicia en relación a la práctica médica. La insuficiencia de recursos obliga a su utilización racional, lo cual ha generado los nuevos modelos de gestión sanitaria y la creciente intervención de factores económicos en nuestra práctica. Por otro lado, parece conveniente que las actuaciones médicas se fundamenten en datos objetivos, lo cual ha generado un interesante aunque aún debatido movimiento de "medicina basada en la evidencia". La actividad asistencial no puede estar de espaldas de los progresos que se obtienen con la investigación, tanto básica como clínica. (6, 7, 8, 9, 10, 11,12)
El incremento a la sepsis grave y al shock séptico en el mundo se ha convertido en un grave problema de salud. Actualmente son definidos como una entidad clínica desde 1992 a partir de las definiciones del American College of Chest Physicians Society of Critical Care Medicine y modificados en la Conferencia Internacional para la definición de sepsis del 2001, ambos son un importante problema de salud en el mundo entero donde por ejemplo solamente en Estados Unidos se detectan 750.000 nuevos casos por año y es la principal causa de muerte no cardiaca en la unidad de cuidados críticos y la tercera causa de muerte en la población general. Pese a los marcados esfuerzos en el cuidado estos pacientes, la tasa de mortalidad oscila entre un 28 – 50%, el costo total y la estadía hospitalaria aumentó. (13,14)
Pronovost señaló que la mayor oportunidad de mejorar el pronóstico de nuestros pacientes en los próximos 25 años no va a venir probablemente del descubrimiento de nuevas terapias, sino del usó más efectivo de las ya existentes.
A lo largo de los últimos 40 años, la prevalecía de muerte debida a sepsis en los países occidentales se ha multiplicado por diez. En la actualidad, en EE.UU. se producen 400.000 casos de sepsis anuales, que ocasionan alrededor de 200.000 shock sépticos y 100.000 muertes. En Europa se registran entre 400.000-500.000 casos anuales, por lo que la incidencia de bacteriemias se sitúa entre 5 y 30 episodios por cada 1.000 ingresos y la mortalidad directamente relacionada se aproxima al 20% de los casos. En las unidades de cuidados intensivos aproximadamente el 40% de los pacientes desarrollarán sepsis con una mortalidad cercana al 50% frente al 16% de los pacientes sin sepsis. (15)
Durante las dos últimas décadas, el aumento de las manipulaciones instrumentales (genitourinarias, respiratorias, cateterismos), la administración de perfusiones endovenosas, las intervenciones quirúrgicas cada vez más agresivas (prótesis, injertos intravasculares, trasplantes), la mayor supervivencia de los pacientes que padecen inmunosupresión por edad avanzada, enfermedad de base o tratamiento, ha llevado a un aumento progresivo de la incidencia de bacteriemias, principalmente a expensas de las de origen intrahospitalario. (1, 2, 16,17)
Nuestro país(Cuba), no está exento de este incremento, debido a que nuestra población al igual que la de nivel mundial se encuentra en un envejecimiento, dado a los logros alcanzados en cuanto a salud se refiere por nuestra revolución y su lucha encarecida por aumentar la expectativa de vida. Esto con lleva a que al aumentar la edad existen mayores posibilidades de presentar factores de riesgos asociados al envejecimiento. Por ejemplo tenemos que en el Hospital ¨Calixto García¨ en el período comprendido de 2002 a 2004 hubo un incremento de pacientes con sepsis que requirieron de ingresos en salas de cuidados intensivos con un aumento total de 30% con relación a años anteriores. (18)
La provincia de Matanzas con el incremento de la salas de cuidados intensivos municipales ha tenido en los últimos años una mayor tasa de pacientes atendidos con sepsis severas, pero con un menor porcentaje de fallecimiento por esta enfermedad. Esto se debe a que se está haciendo un mejor diagnóstico y llevando una atención adecuada y precisa. Nuestra población perteneciente al municipio de Jovellanos no está exenta. Esto se demuestra dado a que en los últimos 2 años presentamos en nuestro servicio una alta prevalencia de esta enfermedad con un total de 100 pacientes atendidos en UCI, con un 38% de fallecidos, lo que era mayor en años anteriores entre un 50 – 55%, así lo demuestran los datos estadísticos.
La prevención de la sepsis severa y el shock séptico es posible actuando sobre diferentes factores de riesgo que pudieran modificarse y otros ser controlados para prevenir el desarrollo de éstas, en el paciente séptico. En esta entidad las características de la mortalidad son muy variadas pero se pueden dividir en dos grandes grupos, las derivadas del grado de respuesta del individuo frente a las noxas específicas y los determinados por las distintas comorbilidades existentes previamente a la infección y las derivadas de la terapéutica. Ambas actúan en conjunto y brindan una marcada heterogeneidad de pacientes con distintos factores pronósticos. (4, 7, 19,20)
En cada sociedad existen comunidades, grupos de individuos familiares o individuos que presentan más posibilidades que otros de sufrir en un futuro enfermedades, accidentes, muertes prematuras, se dice que son individuos o colectivos especialmente vulnerables. A medida que se incrementan los conocimientos sobre los diferentes procesos la conciencia científica demuestra cada uno de ellos que, en primer lugar las enfermedades no se presentan aleatoriamente y segundo que muy a menudo esa "vulnerabilidad" tiene sus razones. Esta se debe a la presencia de cierto número de características de tipo genético, ambiental, biológicas, psicosociales, que actuando individualmente o entre sí desencadenan la presencia de un proceso. Surge entonces el término de "riesgo" que implica la presencia de una característica o factor (o de varios) que aumenta la probabilidad de consecuencias adversas. En este sentido el riesgo constituye una medida de probabilidad estadística de que en un futuro se produzca un acontecimiento por lo general no deseado. (8, 21, 22,23)
Un factor de riesgo es cualquier característica o circunstancia detectable de una persona o grupo de personas que se sabe asociada con un aumento en la probabilidad de padecer, desarrollar o estar especialmente expuesto a un proceso mórbido. Estos factores de riesgo [biológicos, ambientales, de comportamiento, socioculturales, económicos] pueden sumarse los unos a los otros y aumentar el efecto aislado de cada uno de ellos produciendo un fenómeno de interacción. (21, 24,25)
Teniendo en cuenta la esencia de lo planteado anterior, surge la necesidad de establecer una alternativa terapéutica para el tratamiento precoz de los pacientes con sepsis y riesgo a evolucionar al shock séptico, desde su primera valoración en cuerpo de guardia, en sala o en sala de cuidados intensivos del Hospital Pedro Betancourt en Jovellanos, servicio de reciente comienzo con cinco años de trabajo, pero que no escapa de esta entidad, ni de las complicaciones a que esta puede evolucionar.
Por lo que el problema científico que se determina en esta investigación es:
¿Cómo contribuir a la búsqueda de estrategias para disminuir las complicaciones y el desenlace fatal de los pacientes con sepsis y riesgo de evolucionar al shock séptico?
Objeto de estudio
Pacientes con sepsis y riesgo a evolucionar al shock séptico.
Campo de acción
Estrategias para disminuir las complicaciones y el desenlace fatal de los pacientes con sepsis y riesgo de evolucionar al shock séptico. En el Hospital General Docente ¨ Pedro Betancourt ¨ del municipio de Jovellanos.
Lograr una elevada supervivencia de los pacientes que sufren de esta entidad es una cuestión importante con relación a este tema, por lo que se plantean las siguientes preguntas científicas:
1. ¿Cuáles son los fundamentos teóricos que sustentan la posibilidad de lograr una elevada supervivencia después de padecer de una sepsis, con el tratamiento precoz?
2. ¿Cuál es el estado actual de las diversas complicaciones y desenlace fatal de los pacientes que sufren de sepsis en el Hospital de Jovellanos?
3. ¿Qué acciones deben integrarse en el tratamiento precoz de esta entidad en el cuerpo de guardia, en sala y en la unidad de cuidados intensivos que contribuyan a disminuir las complicaciones y el desenlace fatal de los pacientes con sepsis y riesgo de evolucionar al shock séptico en el hospital de Jovellanos?
4. ¿Cómo comprobar la efectividad obtenida con las acciones tomadas en la disminución de las complicaciones y desenlace fatal de los pacientes después de padecer de una sepsis en el Hospital de Jovellanos?
Dándole respuesta a estas interrogantes se trazan las tareas investigativas que aparecen a continuación:
1. Sistematización de los fundamentos teóricos sobre el tratamiento precoz, para tratar de lograr una elevada supervivencia después de padecer de una sepsis.
2. Diagnóstico actual de las diversas complicaciones que presentan los pacientes que sufren de esta enfermedad, en el Hospital Docente General ¨ Pedro Betancourt ¨ del municipio de Jovellanos.
3. Diseño de alternativas terapéuticas, en el tratamiento precoz que permitan contribuir a la disminución de las complicaciones y el desenlace fatal de los pacientes con sepsis y riesgo de evolucionar al shock séptico, en el Hospital Docente General ¨Pedro Betancourt ¨ del municipio de Jovellanos.
4. Validación de las alternativas terapéuticas que permitan contribuir a la disminución de las complicaciones y el desenlace fatal de los pacientes con sepsis y riesgo de evolucionar al shock séptico, en el Hospital Docente General ¨ Pedro Betancourt ¨ del municipio de Jovellanos.
Marco conceptual
Previamente a la conferencia de consenso de 1991, un problema habitual en la práctica clínica era la falta de precisión a la hora de definir conceptos como: bacteriemia, septicemia, sepsis, sepsis grave, shock séptico. Es importante clasificar estos términos para poder establecer un diagnóstico precoz y según el estadio evolutivo del síndrome.
Los microorganismos alcanzan el sistema circulatorio generalmente a partir de un foco infeccioso; sin embargo, en algunas ocasiones, pueden proceder de la propia flora endógena, sin infección previa, o bien ser inoculados directamente en el torrente sanguíneo desde el exterior, a partir de transfusiones sanguíneas, soluciones intravenosas contaminadas, en adictos a drogas por vía parenteral, entre otros.
Existen varios factores que determinan o favorecen la aparición de bacteriemia y Sepsis como:
Características propias del agente invasor: algunos microorganismos, a partir del foco de infección, dan lugar con facilidad a invasión sanguínea. Este es el caso de Salmonella typhi que no suele ocasionar infecciones locales sin bacteriemia, Brucella spp, Neisseria meningitidis, etc. La existencia de estructuras bacterianas de naturaleza proteica o polisacárida que se encuentran fuera de la membrana externa, los pili o fimbrias (Escherichia coli), así como el ácido teicoico (Staphylococcus aureus) o lipoteicoico (Streptococcus pyogenes) y el aliñe (Staphylococcus epidermidis) son muy importantes para la adherencia y fijación de los microorganismos a las superficies mucosas. La endotoxina o lipopolisacárido de la membrana externa de los bacilos gramnegativos es un importante inductor de la respuesta inflamatoria. El lípido A, que forma parte de la región central de la membrana externa, es el responsable de las alteraciones hemodinámicas, pirógenas e inflamatorias asociadas a la actividad endotóxica. Las exotoxinas TSST-1, enterotoxina B y enterotoxina C1 de Staphylococcus aureus pueden causar el llamado shock tóxico, al igual que algunas cepas de S. pyogenes productoras de exotoxina pirógena A y B.
Factores relativos al paciente que pueden predisponer a la bacteriemia: los pacientes ancianos, los que padecen cirrosis hepática, diabetes, neoplasias, hemopatías graves, sida, los portadores de catéteres urinarios o intravasculares, que están sometidos a ventilación mecánica, tratamiento inmunosupresor con corticoides o citostáticos o nutrición parenteral prolongada, tienen un riesgo aumentado de padecer bacteriemia y shock séptico. En algunos casos la puerta de entrada de la infección puede no ser identificable. Esta circunstancia se observa en más de un 25% de los casos de sepsis nosocomial y con menor frecuencia en los casos de inicio comunitario. El paso de bacterias o sustancias liberadas por ellas a través de la pared del tubo digestivo anatómicamente intacta (translocación bacteriana) se cree que es la causa de un número importante de sepsis de origen desconocido.
El shock séptico, pese a estar producido por una gran variedad de microorganismos, es bastante estereotipado, sugiriendo que son más importantes los mecanismos de respuesta del huésped que el tipo de agente infeccioso. La activación del sistema de proteínas de fase aguda contribuye a la aparición de los síntomas de la sepsis y el shock séptico, como fiebre, hipotensión y trastornos de la coagulación.
En la primera fase se liberan citocinas (glucoproteínas de bajo peso molecular que actúan como transmisoras de información) para estimular las defensas del huésped. Entre las citocinas destacan el factor de necrosis tumoral alfa (TNF-alfa y la interleucina 1 beta (IL-1-beta), que presentan efectos sinérgicos (fiebre, taquicardia, taquipnea, mialgias, escalofríos, somnolencia). Otras, como la IL-6 e IL-8, actúan de forma sinérgica con el TNF-alfa o potencian las respuestas celulares, como el interferón gamma (IFN-gamma) o el factor activador de las plaquetas.
Además de esta respuesta inflamatoria a las sepsis, se inicia simultáneamente una respuesta antiinflamatoria para limitar el efecto lesivo de la sepsis en los distintos órganos de la economía. Las citocinas poseen un mecanismo de retrocontrol con citocinas antiinflamatorias como la IL-4, IL-10, IL-11 y IL-13, que atenuarán la reacción en cascada y disminuirán los niveles de TNF-alfa e IL-1-beta
En una segunda fase, estos mediadores producen sus efectos a través de la activación de sistemas plasmáticos (coagulación, fibrinólisis, complemento y quininas), conjuntos de proteínas que se activan de forma secuencial y que circulan por el torrente sanguíneo en forma inactiva. La IL-1-beta genera fosfolipasas, las cuales, a su vez, producen liberación de metabolitos del ácido araquidónico (tromboxano A2, prostaciclina, prostaglandina E2 y leucotrienos) a partir de los fosfolípidos de la membrana. Esto induce la formación de prostaglandinas, sobre todo PGE2, que actúan sobre el centro termorregulador hipotalámico. La IL-1-beta y el TNF-alfa también actúan sobre las células musculares, induciendo la producción de PGE2, que acelera el catabolismo proteico muscular e induce lesión muscular directa.
La consecuencia es una lesión endotelial generalizada con aumento de la permeabilidad capilar, agregación plaquetaria en la microcirculación, causando isquemia que puede evolucionar a daño por reperfusión, activación de la coagulación y deterioro de la vía inhibitoria de la proteína C-proteína S y vasodilatación muy marcada.
La activación de la coagulación es muy precoz desde el inicio de la sepsis, debido al TNF-alfa y la IL1-beta, a través de la generación de factor tisular (vía extrínseca) y en mucho menor grado de activación del factor XII (vía intrínseca). Esto conduce a la coagulación intravascular diseminada (CID) con trombosis intraluminal y consumo de factores de la fase plasmática y del anticoagulante fisiológico AT-III. La función alterada de las proteínas C y S, con poder anticoagulante, potencia los efectos procoagulantes, a lo que se une el déficit de AT-III, empeorando la coagulación intravascular diseminada (CID). Paralelamente se produce una inhibición de la fibrinolisis por inactivadores del activador tipo 1 del plasminógeno (PAI-1), lo que favorece la persistencia de los trombos intravasculares.
Todos estos mecanismos conducen a una lesión vascular generalizada por alteración endotelial, que es la alteración fundamental en la sepsis grave y el shock séptico.
En una fase avanzada puede aparecer una depresión miocárdica, caracterizada primero por la incapacidad para mantener un gasto cardíaco elevado. Posteriormente aumenta el volumen telediastólico y disminuye la fracción de eyección, aunque el volumen sistólico se mantiene gracias a la dilatación ventricular. El gasto cardíaco puede estar elevado, pero no lo suficiente para mantener una perfusión adecuada en los tejidos, debido a la excesiva vasodilatación. A pesar de esta depresión miocárdica, la hipotensión profunda del shock séptico es debida fundamentalmente a la vasodilatación, incluso en fases muy avanzadas.
La evolución del paciente dependerá tanto del estímulo que ha desencadenado la infección como de la respuesta del organismo a la infección. Si predomina el efecto inflamatorio (SRIS) se progresa a la disfunción orgánica (SDMO), se mantiene el shock séptico o se camina a la apoptosis (muerte celular programada). Si predomina el efecto antiinflamatorio (CARS) se produce una inmunodepresión con anergia y aumento de sensibilidad a nuevas infecciones. La homeostasis alterada en la sepsis grave se recupera mejor cuando el síndrome de respuesta inflamatoria sistémica (SIRS) y el CARS están equilibrados.
Existe un continuum de gravedad creciente desde la infección, a través de la bacteriemia y la sepsis, hasta el síndrome de alteración multiorgánica y el shock séptico. La clínica de la sepsis aguda grave es similar a la que se produce al inyectar TNF en voluntarios: fiebre, escalofríos, taquicardia, taquipnea, mialgias, cefalea y confusión. Tras la inyección de una toxina bacteriana se observa un rápido ascenso en el TNF circulante, que alcanza un pico a los 90 minutos y se elimina de la circulación antes de las 3 horas.
La fiebre es frecuente pero no constante, y el 10% de los pacientes con sepsis presentan hipotermia, en particulares recién nacidos, ancianos, alcohólicos y urémicos. El 20% de las sepsis por bacilos gramnegativos cursan con hipotermia, por lo que una temperatura rectal inferior a 36,5 ºC puede ser un indicador de sepsis. Las mialgias que acompañan los cuadros febriles infecciosos se deben a un aumento del tono muscular a través de los nervios somáticos y a lesión directa muscular. Son frecuentes en el tercio proximal de los muslos.
En la piel pueden observarse lesiones de hipoperfusión, como lividez, y de diátesis hemorrágica, como petequias y equimosis. La taquipnea, característica de la primera fase de la bacteriemia, produce una alcalosis respiratoria, que si persiste la sepsis puede evolucionar a acidosis metabólica, la hipoxemia que suele ser moderada al inicio y puede agravarse rápidamente si aparece un pulmón de shock o síndrome del distrés respiratorio del adulto. Las alteraciones mentales por hipoperfusión cerebral suelen manifestarse por signos de encefalopatía, con agitación, confusión y obnubilación progresivas.
El diagnóstico de la bacteriemia, síndrome de respuesta inflamatoria sistémica (SIRS), sepsis, sepsis grave y shock séptico debe basarse en los síntomas y signos clínicos y en los datos de laboratorios (bioquímicos, hematológicos y microbiológicos).
Habitualmente se comprueba leucopenia con desviación a la izquierda y eosinopenia y, tras pocas horas, leucocitosis con neutrofilia y desviación a la izquierda. La neutrofilia >10.000 suele ser signo de bacteriemia.
Las alteraciones en la coagulación acostumbran a ser precoces y preceden en ocasiones al shock séptico, con trombocitopenia e hiperfibrinogenemia. Rápidamente el consumo de factores de la fase plasmática evoluciona a la coagulación intravascular diseminada (CID) franca, con trombocitopenia grave, descenso del fibrinógeno y aparición de D-dímeros.
Los grandes progresos en el tratamiento etiológico de las sepsis no se han acompañado de avances paralelos en el tratamiento fisiopatológico, que ayudaría a frenar la respuesta inflamatoria sistémica a la infección. Los esteroides inhiben la síntesis de citocinas por los monocitos, y administrados en animales simultáneamente con el microorganismo los protegen contra el shock séptico, y se emplearon como la primera opción. En un metaanálisis reciente de nueve estudios controlados realizados en la década de los setenta con glucocorticoides a dosis altas (30 mg/kg de 6-metil prednisolona o equivalentes) en la sepsis grave y shock séptico, las diferencias en mortalidad (35% sin y 39% con glucocorticoides) no eran estadísticamente significativas. Excluyendo un estudio discordante, los glucocorticoides a estas dosis podían aumentar la mortalidad.
Más recientemente se han propuesto las dosis de corticoides denominadas de "estrés" (1 mg/kg/día de prednisona vía intravenosa en perfusión continua o su equivalente en hidrocortisona), basándose en una respuesta insuficiente a los esteroides en el shock séptico por el estrés. Mantenidas hasta retirar las aminas, se continúan a la mitad de la dosis 6 días más, con buenos resultados iniciales, que deberán confirmarse.
Los anticuerpos contra la endotoxina tanto policlonales (de donantes humanos inmunizados), como monoclonales (ingeniería genética), humanos o murinos, no han sido eficaces e incluso pueden aumentar la mortalidad en sepsis por grampositivos. Los antagonistas del óxido nítrico pueden mejorar la situación de hipotensión a costa de efectos secundarios tanto o más graves.
Posteriormente se han intentado encontrar fármacos antiinflamatorios no esteroideos efectivos en esta situación clínica. Entre ellos: el antagonista de los receptores de la IL-1 (IL-1ra), antibradiquininas (CP0127), anti-PAF (BN 52021), anti-TNF, receptor soluble del TNF (P80 y P55), antiprostaglandinas (ibuprofeno). Todos ellos han sido hasta el presente infructuosos, incluso algunos han aumentado la mortalidad. Un metaanálisis realizado en 1997 de 21 ensayos clínicos con medicamentos antiinflamatorios no esteroideos no encontró beneficios significativos en estos tratamientos (mortalidad 39% sin y 36% con estos fármacos).
A pesar de estos resultados desalentadores, se están estudiando nuevas generaciones de fármacos antiinflamatorios. Entre ellos anticuerpos que actúen en el receptor de la endotoxina CD14, fármacos que bloqueen las vías de conducción de la señal de la respuesta inflamatoria en las células como los inhibidores de la proteincinasa y los inhibidores de la formación de trombina: proteína C, inhibidor del factor tisular y antitrombina III (AT-III). La AT-III, antiproteasa sérica inhibidora de la coagulación, posee una acción antiinflamatoria per se en las sepsis graves.
El objetivo final del tratamiento etiológico debe ser la eliminación de los microorganismos responsables del cuadro clínico; por tanto, se basará en la administración de antibióticos y en la actuación médica o quirúrgica sobre el foco de sepsis. En algunos casos la existencia de colecciones purulentas o abscesos no drenados puede causar bacteriemias persistentes. La liberación de una obstrucción, especialmente en los tractos urinario o biliar, contribuye en gran medida a resolver la infección. El material protésico intravascular colonizado pueden ser causa de bacteriemia continua. En la mayoría de ocasiones únicamente su retirada permite la resolución del cuadro clínico.
Cuando todavía no se dispone de información sobre el microorganismo causal y su sensibilidad a los antimicrobianos, la antibioticoterapia inicial debe ser empírica. En su elección deberán considerarse una serie de factores como: el tipo de microorganismos que pueden ser la causa de la infección según el origen de la sepsis, la concentración que alcanza el antibiótico en ese foco, el porcentaje de resistencias intra o extrahospitalarias de los microorganismos posiblemente implicados o el estado inmunitario del paciente. Debido a la gravedad de la situación clínica los antibióticos deben alcanzar concentraciones máximas en sangre lo más precozmente posible, por lo que deben administrarse agentes bactericidas, a dosis altas, por vía intravenosa y, siempre que sea posible, combinaciones sinérgicas. La eficacia del tratamiento antimicrobiano de la sepsis se relaciona directamente con la precocidad de su instauración y con su actividad sobre el/los microorganismo/s causales. Sin embargo, una vez instaurado el shock séptico, los antibióticos apenas mejoran el cuadro tóxico durante las primeras 24 h, debido a la liberación masiva de mediadores. En pacientes graves la administración de antibióticos bactericidas puede desencadenar una lisis bacteriana y una reacción del tipo Jarisch-Herxheimer, caracterizada por escalofríos, taquipnea, fiebre, dolor de cabeza, mialgias y vasodilatación periférica.
La antibioticoterapia empírica de elección en las sepsis de origen urinario es un aminoglucósido, una cefalosporina de segunda o tercera generación o una quinolona, ya que suelen estar implicados los bacilos gramnegativos; sin embargo, cuando el paciente ha sido sometido a instrumentación de la vía urinaria o es portador de sonda vesical, deberá considerarse al Enterococcus spp como uno de los posibles agentes causales, incluyéndolo en la cobertura antibiótica. En las sepsis de origen abdominal debidas a bacilos gramnegativos asociados a anaerobios está indicada una cefalosporina de tercera generación y metronidazol, piperacilina-tazobactam, amoxicilina-ácido clavulánico y gentamicina o imipenem. Cuando el foco de origen de la sepsis es una neumonía extrahospitalaria el tratamiento será cefotaxima o ceftriaxona y eritromicina. En las neumonías intrahospitalarias de los pacientes con enfermedad de base grave o inmunosupresión el tratamiento será ceftazidima con amikacina y eritromicina o imipenem y eritromicina. Las infecciones de piel, catéteres, prótesis del sistema nervioso central (SNC) y osteomielitis requieren la elección de antibióticos eficaces frente a Staphylococcus spp y bacilos gramnegativos, como la asociación de un aminoglucósido a cloxacilina, clindamicina o vancomicina.
Los regímenes antibióticos empíricos deben ser modificados de forma apropiada una vez que se conocen los resultados de la sensibilidad del/los microorganismo/s implicados. Uno de los aspectos más importantes del tratamiento de estos pacientes reside en la expansión de volumen y la administración de fármacos vasoactivos e inotrópicos. La disminución de la volemia es constante en esta situación, debido al aumento de la permeabilidad capilar (edema), secuestro de líquido en las zonas inflamadas (tercer espacio), hinchazón celular (lesión intracelular) y aumento de la capacitancia arterial y venosa (vasodilatación y disminución de la volemia efectiva). El aporte de líquidos es importante para conseguir un gasto cardíaco elevado, necesario dada la vasodilatación intensa de estos pacientes y su estado hiperdinámico. Muchos pacientes precisan entre 4-6 litros de cristaloides. La acidosis debida a glucólisis anaerobia y formación de ácido láctico es frecuente y se corregirá con bicarbonato sódico i.v. si es grave, evitando la alcalosis que produciría una dificultad de entrega de oxígeno a los tejidos.
Se considera que la presión arterial sistólica debe ser superior a 90 mm Hg y la diuresis mayor de 0,5 mL/kg/h. Para ello la presión venosa central (PVC) se debe mantener entre 12-15 cm H2O y la presión capilar pulmonar (PCP) entre 12-15 mm Hg Por debajo de estas cifras puede existir hipovolemia, y por encima de ellas la sobrecarga de fluidos podría provocar un edema pulmonar. La función cardiaca es óptima con una presión capilar pulmonar de 18 mm Hg, pero se recomienda no pasar de 12-15. Una reposición precoz y decidida, pero con precaución, no se asocia a una mayor frecuencia de síndrome de distrés respiratorio del adulto, mientras que una reposición de líquidos tardía puede abocar al shock refractario. La velocidad de infusión oscilará entre 250-500 ml cada 15 minutos, con control de las presiones de llenado (presión venosa central (PVC) y presión capilar pulmonar (PCP)).
Los líquidos administrados pueden ser coloides o cristaloides, sin que se hayan demostrado ventajas con alguno de ellos. En casos de hipoalbuminemia inferior a 2 g/dL, la administración excesiva de cristaloides puede favorecer un descenso de presión oncótica y la aparición de edema, por lo que se administrará seroalbúmina. El suero de Ringer lactato está desaconsejado, ya que en estos casos la metabolización hepática del lactato a bicarbonato está enlentecida y puede agravar la acidosis láctica. Los concentrados de hematíes sólo se emplean cuando el transporte de oxígeno pueda estar limitado por un hematocrito bajo o en casos de hipovolemia por anemia aguda. Se mantendrá también un gasto cardíaco elevado y una presión de oxígeno arterial normal. Se aconseja un hematocrito por encima del 24%, para mantener un aporte adecuado de oxígeno a los tejidos (mantener hematocrito superior a 0,24 L/L, índice cardíaco superior a 3,5 L/min y PaO2 superior a 90 mmHg). La acidosis grave hace que las aminas no actúen, por lo que se empleará bicarbonato sódico si el pH es inferior a 7,10.
Una vez corregido el déficit de volumen y la acidosis, si no ha mejorado la situación hemodinámica (presión arterial sistólica inferior a 90 mm Hg y oliguria) se instaurará soporte con fármacos vasoactivos. Hay que recordar que con TA inferior a 80 mm Hg es difícil que el riñón mantenga el filtrado glomerular. Los diuréticos, por otra parte, pueden agravar la hipovolemia relativa de estos pacientes. La noradrenalina a dosis de 0,5-2 microgramos/kg/min es la de elección en el shock séptico, ya que aumenta las resistencias vasculares sistémicas y la presión arterial. En algunos casos se pueden precisar dosis más altas de noradrenalina, aunque con control hemodinámico estricto, alcanzando en ocasiones dosis de hasta 5 microgramos/kg/min. En los casos con depresión miocárdica puede ser útil la dobutamina a dosis entre 2-30 microgramos/kg/min, o la dopexamina a dosis entre 2-4 microgramos/kg/min. La dopamina a dosis bajas (2-3 microgramos/kg/min), por su efecto vasodilatador renal, se utiliza para ayudar a mantener una diuresis aceptable
La mortalidad aumenta a medida que progresa la sepsis. En las bacteriemias no complicadas es inferior al 5%, en las sepsis del 15-20% y en las sepsis graves del 25-30%. La mortalidad del shock séptico es del 50-60% y asciende al 75% en el shock refractario. En el síndrome de distress respiratorio del adulto (SDRA) la mortalidad es del 60-80%. Si hay criterios de síndrome de disfunción multiorgánica, la mortalidad es de alrededor del 50% si fallan dos órganos y del 85% si fallan tres órganos. La utilización de índices de valoración de gravedad, que cuantifican las alteraciones clínicas y bioquímicas, como el APACHE-II (Acute Physiology and Chronic Health Evaluation), puede ayudar a determinar la gravedad y el pronóstico de estos pacientes. Dado que una vez instaurado el shock es difícil reducir la mortalidad, los esfuerzos deben dirigirse a interrumpir la evolución de la sepsis cuanto antes. Rivers planteó algunos buscan excusas académicas para no cambiar nada y mantener el status quo, en vez de cambiar sus prácticas para mejorar sus resultados y demasiado a menudo, los escrúpulos científicos y la espera del ensaño clínico perfecto suponen una excusa conveniente para quedarse de brazos cruzados, en vez de tener esa actitud, pongamos manos a la obra con las herramientas con que disponemos hoy.
Conclusiones del capítulo
El objetivo de la terapéutica precoz en los pacientes con sepsis y riesgo a evolucionar al shock séptico, radica en la necesidad de eliminar el progreso de la sepsis, dado a que a medida que progresa la sepsis la mortalidad de los pacientes aumenta. Por lo que hemos visto en el desarrollo de este capítulo, existen muchos factores que favorecen la aparición de un shock séptico en un paciente con una sepsis, por tanto se puede ver que es muy importante actuar sobre estos desde el inicio que se sospeche de una sepsis, es decir desde que el paciente se valorado en el cuerpo de guardia o en sala antes de que sea trasladado a las salas de cuidados intensivos.
CONTROL SEMÁNTICO O GLOSARIO
Bacteriemia. Es la presencia de bacterias viables en la sangre; la presencia de virus, hongos o parásitos recibe el nombre de viremia, funguemia y parasitemia, respectivamente. Esta invasión transitoria del torrente sanguíneo es generalmente asintomática y no tiene consecuencias, excepto cuando estos microorganismos se implantan en órganos distantes de su puerta de entrada, como es el caso de la endocarditis favorecida por lesiones previas del endotelio de las válvulas cardíacas.
Síndrome de respuesta inflamatoria sistémica (SRIS). Es una reacción inflamatoria generalizada que puede ser de causa infecciosa, pero que también puede darse en otros procesos como: pancreatitis, isquemia, grandes quemados, hemorragias, enfermedades autoinmunes o politraumatismos. El Síndrome de respuesta inflamatoria sistémica (SRIS) se manifiesta (pero no limitado) con dos o más de los siguientes signos: a) temperatura central superior a 38 ºC o inferior a 36 ºC; b) frecuencia cardiaca superior a 90 latidos/min; c) frecuencia respiratoria superior a 20 respiraciones/min o PaCO2 inferior a 32 mm Hg (inferior a 4,3 kPa), y d) recuento leucocitario con más de 12 x 109/L o menos de 4 x 109/L, o fórmula con más del 10% de formas jóvenes.
Septicemia. Es un término ambiguo que se ha venido utilizando en el pasado para designar la bacteriemia o la sepsis. Debido a esta confusión, se recomienda evitar su uso en el futuro.
Sepsis. SRIS debido a una infección. Requiere la presencia de dos o más criterios de Síndrome de respuesta inflamatoria sistémica (SRIS) y deberse a infección, taquipnea, taquicardia, hipertermia o hipotermia.
Sepsis grave. Sepsis que cursa con alteración de la perfusión orgánica y uno o más de los siguientes
signos: acidosis láctica (superior a 2 mmol/L), oliguria (inferior a 30 mL/h) o alteraciones mentales agudas (agitación, confusión, obnubilación). Este cuadro se denominaba en el pasado "síndrome séptico" o "sepsis con afección de algún órgano".
Shock séptico. Es la sepsis que cursa con hipotensión, a pesar de una correcta expansión de volumen y con trastornos de la perfusión orgánica. Los pacientes que reciben fármacos inotrópicos o aminas presoras pueden no estar hipotensos, pero continúan presentando alteraciones en la perfusión de algún órgano. La expresión "shock séptico refractario" se emplea para designar el shock que dura más de 1 h y no responde a la restitución de líquidos o a las aminas vasoactivas, aunque no implica irreversibilidad.
Síndrome de disfunción multiorgánica secundario a sepsis (SDMO). Afección de diferentes órganos en un paciente agudo grave, en el que la homeostasis sólo puede mantenerse mediante intervención médica. Se trata de un patrón de signos y síntomas progresivos, que conduce a la insuficiencia orgánica.
La respuesta clínica a una amplia variedad de agresiones graves que limita y antagoniza el efecto inflamatorio recibe el nombre de síndrome de respuesta antiinflamatoria compensatoria (CARS). Se caracteriza por una disminución en la capacidad de los monocitos de producir citocinas inflamatorias (TNF-alfa o IL-6) y reducción a menos del 30% de la expresión del antígeno leucocitario humano HLADR en la superficie de los monocitos.
OBJETIVOS.
A) Objetivo general.
Elaborar alternativas terapéuticas precoces, que permitan disminuir las complicaciones y el desenlace fatal en los pacientes con sepsis y riesgo a evolucionar al shock séptico.
B) Objetivos específicos
1. Determinar las edades y sexo más frecuentes en que se presentaron pacientes con sepsis.
2. Identificar los factores predisponentes que más frecuentes se asocian a estas entidades.
3. Determinar la procedencia por servicios, así como localización de la sepsis primaría de los pacientes que llegan a nuestra sala portadores de sepsis.
4. Comprobar la precocidad en el tratamiento y evolución.
5. Mostrar las complicaciones más frecuentes, así como el porcentaje de fallecidos.
DISEÑO METODOLÓGICO
Se realizó un estudio prospectivo, longitudinal, analítico, estudio de cohorte, en el período de tiempo correspondiente a Mayo del 2008 a Diciembre de 20010, en el Hospital General Docente ¨Pedro Betancourt¨ del Municipio Jovellanos.
Universo de trabajo.
Nuestro universo de trabajo estuvo constituido por los pacientes con sepsis y riesgo a evolucionar al shock séptico que acudieron al cuerpo de guardia o que se encontraban hospitalizado en dicho hospital, en el período de tiempo referido anteriormente.
Muestra:
Nuestra muestra estuvo compuesta por 100 pacientes los que se enmarcaron en nuestro universo de trabajo.
Criterios de inclusión y exclusión:
Criterios de inclusión
Pacientes con sepsis y riesgo a evolucionar al shock séptico
Criterios de exclusión
Edad pediátrica
Pacientes con sepsis neurológicas y sepsis puerperal
SIDA
Pacientes con enfermedades malignas en estadios avanzados
Se utilizan durante el desarrollo de la investigación diferentes métodos del nivel teórico y empírico. Estos métodos se emplean en todas las etapas del proceso investigativo, favoreciendo al perfeccionamiento de los resultados y el buen desarrollo de la investigación.
Métodos empíricos:
Observación. (Enfermería)
Encuestas. (Pacientes y familiares)
Permiten la recopilación de información sobre el problema científico objeto de investigación. Se empleó la observación de la evolución clínica de los pacientes desde el mismo momento de su examen, haciendo hincapié en los síntomas y signos que se sumaban a los iníciales, para lo cual se contó con la ayuda eficaz del personal de enfermería.
Se practicó la encuesta a cada paciente, así como a los familiares de estos con el objetivo de conocer los factores predisponentes que tuvieran para poder enmarcar nuestra conducta a la compensación de ser posible de estos.
Métodos teóricos:
Analítico-sintético: Utilizado en el análisis de la evolución que alcanzaron los pacientes con sepsis, después de la terapéutica precoz empleada.
Inducción-deducción, porque se infiere que se parte de las ventajas que brindan la terapéutica precoz, para disminuir las complicaciones de los pacientes con sepsis y riesgo a evolucionar al shock séptico.
Contribución a la teoría:
Los resultados constituyen, un material metodológico importante para el trabajo del médico que se encuentre en cuerpo de guardia o en salas, en dirección a prevenir y a eliminar las complicaciones o desenlace fatal de los pacientes con sepsis y riesgo a evolucionar al shock séptico.
Significación práctica:
Se expresa en las alternativas terapéuticas propuestas con una concepción problémica. Concretadas en los aportes teóricos de la tesis.
La importancia y la actualidad del trabajo realizado radica en que las alternativas terapéuticas propuestas en el tratamiento precoz de los pacientes con sepsis y riesgo de evolucionar al shock séptico, reúne los requisitos de pertenencia, porque ofrece un resultado concreto que desde el punto de vista científico contribuye a desarrollar nuevas estrategias para erradicar las complicaciones de estos pacientes.
Aspectos particulares de la investigación.
Se recogió la información de todos los pacientes con sepsis y riesgo de evolucionar al shock séptico en el Hospital de Jovellanos, para lo cual se revisaron las Historias Clínicas individuales de cada paciente, para almacenar la información se utilizó una planilla confeccionada por el autor de la investigación (ANEXO I), donde además se reflejó el seguimiento clínico, la evolución clínica, complicaciones, así como su evaluación final.
Definición de variable y operacionalización.
1. Edad en años. Se recogieron los datos en intervalos de edades: 15 –25, 26 – 36, 37 – 47, 48 – 58, 59 – 69, 70 – 80
2. Sexo. Según género femenino y masculino.
3. Factores predisponentes
• Características propias del agente invasor
• Pacientes ancianos
• Cirrosis hepática
• Diabetes
• Neoplasias
• Hemopatías graves
• Sida
• Portadores de catéteres urinarios o intravasculares
• Pacientes sometidos a ventilación mecánica
• Tratamiento inmunosupresor con corticoides o citostáticos
• Nutrición parenteral prolongada
4- Según procedencia
• Cuerpo de guardia
• Salas medicina, cirugía, ginecoobstetricia
5- Localización de la sepsis primaria
• Sistema respiratorio
• Sistema renal
• Sistema ginecológico
• Sistema digestivo
6- Precocidad en el tratamiento
• Primera 6 hora (C/G)
• Primeras 24 horas (sala)
• Después de 24 horas
7- Proyecto de intervención en nuestro hospital en el tratamiento del paciente con sepsis y riesgo a evolucionar al shock séptico.
Medidas a tomar después de realizar el diagnóstico de sepsis, que incluyen las principales intervenciones consideradas claves para reducir la mortalidad de estos pacientes.
Primeras 6 horas:
• Reposo en posición de 30 - 45º, según estado del paciente.
• Vía oral suspendida, sonda de Levine si fuera necesario.
• Oxígeno terapia. Si < 90%, relación PaO2 / FiO2 no > 280.
• Sonda vesical y diuresis horaria. Monitoreo cardiovascular permanente.
• El tratamiento debe comenzarse donde se haga el diagnóstico.
• Accesos vasculares (canulación de dos vías periféricas para la extracción de complementarios, hemocultivos y administración inmediata de líquidos y antibióticos de amplio espectro.
• Canalizar vena profunda para medir presión venosa central (PVC).
• Tratamiento. Inicio precoz del tratamiento antibiótico en las 2 primeras horas si el paciente es atendido en urgencias y en la 1 hora si es atendido en la UTI y no procede de urgencias.
• Fluidoterapia: se administra de 20 a 40 ml/Kg de cristaloide 2/3 y 1/3 de
• Coloide, (entre 250 y 500 ml cada 15 minutos, para un total de 2000 ml en una hora).
• En presencia de hipotensión y lactato elevado mayor de 2 mmol/l (canalizar vena profunda, medir presión venosa central (PVC) y mantener en 12 y 15 cm de agua, diuresis horaria > de 0,5 ml/kg/h y saturación de oxígeno > de 95%).
• Si tensión arterial media (TAM) < de 85 mmHg y TAS < 90 mmHg a pesar de la administración de líquidos correctamente sugerimos vasopresores más inotropos (uso de norepinefrina de 0,01 – 5,0 µg/kg/min, (dosis/ valorar 0,52 µg/kg/min), dopamina de 1 – 20 µg/kg/min (dosis/ valorar 15 µg/kg/min), uso de esteroides a razón de 1 mg/kg/día.
Primeras 24 horas:
Mantener las mismas medidas que se aplicaron en las primeras 6 horas y adicionar:
1. Control estricto hemodinámica (tensión arterial media (TAM), diuresis y saturación de oxígeno)
2. Mantener la glicemia por encima del límite inferior de la normalidad y por debajo de 8,3 mmol/l (con valores que oscilen entre 4,4 – 6,1 mmol/l). Comenzar tratamiento con insulina simple a dosis prehipoglicemiante (insulinoterapia intensiva).
3. Tratar la hipoalbuminemia inferior a 2,0 g/dl.
4. Tratamiento de las complicaciones que puedan aparecer.
Estas medidas deben ser aplicadas siguiendo el proyecto de intervención descritos para el tratamiento por el autor en el Hospital de Jovellanos.
Después de 24 horas:
Fueron atendidos estos pacientes haciendo un compendio de las dos etapas descritas con anterioridad y siempre los mismos tuvieron un mal pronóstico demostrado en el trabajo.
Complicaciones
1. Cardiorrespiratorias
2. Renales
3. Hematológica
4. ácido- básicas e hidroelectrolíticas
5. Fallo multiorgánico
6. Fallecidos
Fallecidos según procedencia
1. Cuerpo de guardia
2. Salas medicina, cirugía, ginecoobstetricia
Evolución
1. Favorable
2. Fatal
Procedimientos empleados en la recolección de los datos.
Tipos de instrumentos empleados:
• Historia clínicas
• Planilla confeccionada por el autor (Anexo I)
Los métodos empleados como la historia clínica, se empleo en la recopilación de datos guardados en este documento legal, como el tiempo transcurrido en el comienzo de la sepsis, tiempo de aplicación de la terapéutica adecuada, la evolución final, etc. La planilla confeccionada por el autor recoge informaciones precisas a través de preguntas objetivas y valoraciones de las manifestaciones clínicas de las sepsis, así como las evaluaciones finales alcanzadas por el paciente durante el tratamiento y su rehabilitación.
Los datos obtenidos fueron automatizados; confeccionándose una base de datos en el programa SPSS versión 10.0. Posteriormente se realizó el análisis de la información teniendo en cuenta, las medidas de resúmenes para las variables cuantitativas (Frecuencia Absoluta, Frecuencia Relativa) y cualitativa (Media, Moda).Los resultados fueron presentados en una PC Pentium III con ambiente XP, los textos se procesaron en Word XP y las tablas y gráficos en EXCEL XP.
Consideraciones éticas de la investigación:
En nuestro trabajo se tuvieron presente las consideraciones éticas, al recolectarse y manipularse la información, se creó una planilla en la que se recogió el consentimiento del paciente o del familiar en caso de estar de acuerdo en formar parte de la investigación e informándole en que consistía dicha investigación. Además se crearon archivos y carpetas con seguridad, teniendo sólo accesos a estos las personas vinculadas con la investigación, siempre se pidió el consentimiento de los jefes de salas de procedencias.
Análisis y Discusión
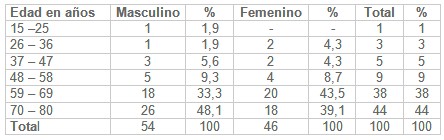
De acuerdo a la distribución de pacientes con sepsis y riesgo de evolucionar al shock séptico, según edad y sexo, como se muestra en la tabla I. En el intervalo de edad de 15 a 25 años se constató un paciente del sexo masculino y ninguno del sexo femenino, en el intervalo de 26 a 36 años hubo un paciente del sexo masculino y 2 del sexo femenino, de 37 a 47 años se tuvo 3 pacientes del sexo masculino y 2 del sexo femenino, en el siguiente intervalo de edad, de 48 a 58 años se presentaron 5 pacientes en el sexo masculino y 4 en el femenino, de 59 a 69 años contamos con 18 masculinos y 20 femeninos y en el último intervalo el de 70 a 80 años se presentaron 26 pacientes del sexo masculinos y 18 femeninos. Se pudo observar que de un total de 100 pacientes atendidos existió un predominio del sexo masculino con 54 pacientes (54%), solamente del sexo femenino fueron 46 pacientes (46%), esto demuestra que no existe prácticamente interés en la distribución, lo que puede deberse a que en nuestra UTI no existe predilección por el sexo.
Siendo los grupos etarios más afectados para el sexo masculino el de 70 a 80 años con un total de 26 pacientes (48,1%), seguido de los grupos de 59 a 69 años con 18 pacientes (33,3%). Con relación al sexo femenino el grupo de edades más afectadas fue el de 59 a 69 años con 20 pacientes (43,5%). Señalar que los pacientes más afectados se encontraron en edades comprendidas entre 59 y 80 años, los que está dado por diversos factores predisponentes descritos en el trabajo.
En el estudio se comportaron estas variables muy similares a algunos estudios internacionales realizados, (23, 26, 27, 28, 30, 31) por ejemplo en el Hospital ¨Gregorio Marañón ¨ de Madrid, en el que los pacientes de edad avanzada (65 años o más) constituyeron más del 12% de la población y fueron el 65% de los pacientes con sepsis.
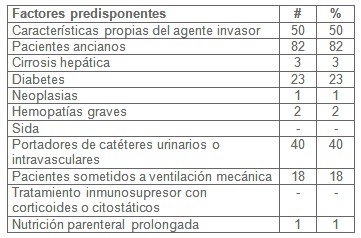
La distribución de pacientes con sepsis y riesgo de evolucionar al shock séptico según factores predisponentes, como se muestra en los resultados reflejados en la tabla II, con factores relacionados con las características propias del agentes invasor se presentaron 50 pacientes, pacientes ancianos presentamos 82, con cirrosis hepáticas asociadas presentamos 3, con diabetes mellitas tuvimos 23 pacientes, con neoplasias 1 pacientes, con hemopatías graves 2 pacientes, con SIDA ningún paciente, portadores de catéteres intravasculares y urinarios 40 pacientes, con tratamiento con inmunosupresor o citostático ningún paciente y con nutrición parenteral prolongada 1 paciente. De un total de 100 pacientes atendidos predominaron los pacientes correspondientes a la tercera edad con un total de 82 pacientes (82%), siguiendo en orden de frecuencia las características propias del agente invasor con 50 pacientes (50%) y por último los portadores de catéter urinarios o intravasculares para un 40% de 40 pacientes atendidos
Al comparar el estudio y resultados obtenidos con otros trabajos de la literatura mundial (5, 28, 32, 33, 34, 35, 36,37) se observó que existía relación con los mismos, donde ellos definieron que la sepsis es una enfermedad del anciano y que la mortalidad aumenta con la aparición de diferentes factores predisponentes como son comorbilidades, disfunción de órganos, focos de infección y características del agente invasor. Así se demostró con el trabajo de Coll y colaboradores que lleva por título ¨Influencia de la edad sobre la incidencia y el pronóstico de la sepsis¨.
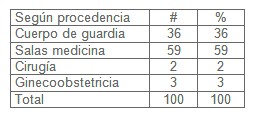
Según la tabla III, en cuanto a procedencia, se obtuvo del cuerpo de guardia 36 pacientes, de salas de medicina 59 pacientes, de cirugía 2 pacientes y de ginecoobstetricia 3 pacientes. Como se puede observar de un total de 100 pacientes la distribución fue de la siguiente forma: el servicio de la sala de medicina interna aportó 59 paciente (59%) seguidos por los atendidos en cuerpo de guardia con 36 pacientes (36%). Las unidades quirúrgicas fueron las que menos casos aportaron.
Los trabajos revisados (24, 32,38, 39, 40, 41). Por ejemplo los autores Gao Col. con título ¨ Manos a la obra ¨: reducir la mortalidad en la sepsis, donde incluyeron 101 pacientes médicos 55% y quirúrgicos un 45% con sepsis graves. Más del 50% son procedentes de la sala con un 89% y de urgencias médicas solo un 11%, esto nos demuestra que existe coincidencia con el trabajo.
Definiendo la localización de la sepsis primaria de acuerdo a la distribución de pacientes con sepsis y riesgo de evolucionar al shock séptico como se muestra en la tabla IV, se localizaron 58 pacientes con sepsis primaria en el sistema respiratorio, 28 pacientes con sepsis en el sistema renal, en el sistema ginecológico se presentaron 8 pacientes y en el sistema digestivo se tuvieron 6 pacientes. Se puede observar que en la muestra hubo un predominio de pacientes con sepsis respiratorias con 58 pacientes (58%), seguido por las sepsis del sistema renal con 28 pacientes (28)
Aquí se revisaron trabajos (14, 34, 40, 42, 43, 44,45) que coinciden plenamente con el trabajo, como el de Krotgen y Col. donde los focos más frecuentes de infección o de sepsis por orden de aparición se comportaron de la siguiente forma: tórax 50% y el abdomen para un 22%, predominando los pacientes médicos sobre los quirúrgicos.
Al analizar los datos correspondientes, tabla V se pudo apreciar de acuerdo a la precocidad del tratamiento protocolizado y a las medidas empleadas en las primeras 6 horas se atendieron 40 pacientes, en las primeras 24 horas 34 pacientes y después de las 24 horas 26 pacientes. Se demostró que en las primeras 6 horas fueron valorados y atendidos 40 pacientes para un 40%, seguido por las primeras 24 horas con un total de 34 pacientes (34%).
Demostrado por estudios realizados de autores, que la implantación de un conjunto de medidas presentan un impacto en la atención de un paciente con sepsis. Así es definido por TRZECIAK y colaboradores en el trabajo que lleva por título ¨ Impacto de la implantación en un servicio de urgencia de un protocolo de resucitación para la sepsis ¨. (32, 45, 46, 47, 48, 49,50)
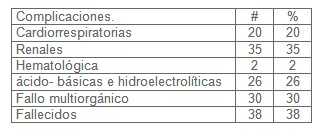
Según la aparición de complicaciones en la distribución de pacientes con sepsis y riesgo de evolucionar al shock séptico como se plasma en la tabla VI. Existieron 20 pacientes con complicaciones cardiorrespiratorias, renales 35 pacientes, hematológicas 2, complicaciones acido-básicas e hidroelectrolíticas 26 pacientes, fallo multiorgánico 30 pacientes y fallecidos 38 pacientes. Se puede observar en esta serie que predominaron por orden de aparición 38 pacientes fallecidos (38%), seguidos del fracaso renal agudo con 35 paciente (35%), fallo multiorgánico con 30 pacientes (30%) y por último las complicaciones ácido-básicas e hidroelectrolíticas con 26 pacientes (26%). Destacar que las mayorías de las complicaciones se presentaron ante el establecimiento del protocolo para el manejo de estos pacientes en los diferentes servicios de nuestro hospital.
Fueron revisados trabajos que coincidieron con el nuestro. El estudio que lleva por título ¨ISSILEM¨ 2006, revisión de las guías de práctica clínica para las sepsis graves y el estudio Prowess, donde las complicaciones más frecuentes fueron: mortalidad 41% fracaso renal agudo 41%, disfunción de 3 órganos 35%, acidosis metabólicas 36% y pacientes que desarrollaron shock séptico un 34%.(51, 52, 53, 54,55)
En la tabla VII, donde se plasma la distribución de pacientes con sepsis con riesgo de evolucionar al shock séptico según fallecidos y procedencias, la mortalidad en cuerpo de guardia fue de 10 pacientes, sala de medicina fue de 26 paciente, cirugía 1 paciente y ginecoobstetricia 1 paciente. En nuestra serie los pacientes procedentes de las salas de medicinas fueron los que más alta incidencias de fallecidos presentaron con 26 paciente (68,4%) de un total de 38 defunciones, seguida por 10 pacientes procedentes del cuerpo de guardia para el 26,3% y los pacientes quirúrgicos fueron los que menos aportaron con 2 pacientes para el 5,3%.
En la bibliografía internacional (40, 54, 56, 57, 58, 59,60) se constata que la gran mayoría de los autores no lo distribuyen de esta forma sino en: procedentes de emergencias, salas y quirúrgicas, pudiendo valorar los resultados obtenidos con los de los trabajos revisados por los autores Gao y Col. con título ¨ Manos a la obra ¨: reducir la mortalidad en la sepsis, donde incluyeron 110 pacientes médicos 58% y quirúrgicos un 42% con sepsis graves. Más del 54% son procedentes de la sala con un 90% y de urgencias médicas sólo un 10%, esto nos demuestra que existe coincidencia con el trabajo.
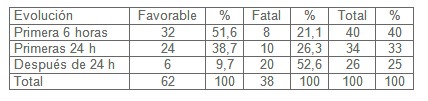
En la tabla VIII, en la que se encuentran los resultados, según la distribución de pacientes con sepsis y riesgo a evolucionar al shock séptico de acuerdo a la evolución alcanzada. Los pacientes atendidos en las primeras 6 horas evolucionaron 32 favorablemente y 8 fatalmente, los atendidos en las primeras 24 horas evolucionaron favorablemente 24 pacientes y 10 fatales, los atendidos después de las 24 horas 6 pacientes evolucionaron favorablemente y 20 fatales. Se puede constatar que los pacientes que se sometieron a tratamiento en las primeras 6 horas de un total de 40 pacientes 32 presentaron una evolución favorable (51,6%) y de forma fatal evolucionaron 8 pacientes (21,1%), en las primeras 24 horas de un total de 34 pacientes, 10 pacientes evolucionaron de forma fatal (26,3%) y 24 pacientes de forma favorable (38,7%).
Los pacientes atendidos después de las 24 horas sumaron un cómputo de 26 pacientes dentro de los cuales 20 pacientes con evolución fatal (52,6%) y 6 pacientes evolucionaron favorablemente para un (9,7%); vale aclarar nuevamente que las mayorías de estos pacientes que tuvieron una mala evolución, no fueron atendidos en las primeras 6 horas o antes de establecerse el protocolo expuesto en el trabajo.
Se revisaron trabajos donde coinciden con estas evoluciones después de crear un plan de medidas que no fueron cumplidas en aquellos pacientes con una evolución tórpida, así lo demuestran los estudios de River Shapiro y colaboradores con el protocolo Must (multiple urgent sepsis therapies) (45, 61, 62, 63, 64,65)
Tabla I: Distribución de pacientes con sepsis y riesgo de evolucionar al shock séptico según edad y sexo. Hospital General Docente ¨Pedro Betancourt¨ del Municipio Jovellanos. Mayo de 2008 - Diciembre de 2010.
Fuente: Historia Clínicas. Dpto. Archivo y Estadística
Tabla II: Distribución de pacientes con sepsis y riesgo de evolucionar al shock séptico, factores predisponentes. Hospital General Docente ¨Pedro Betancourt¨ del Municipio Jovellanos. Mayo de 2008 - Diciembre de 2010.
Fuente: Historia Clínicas. Dpto. Archivo y Estadística
Tabla III: Distribución de pacientes con sepsis y riesgo de evolucionar al shock séptico según procedencia. Hospital General Docente ¨Pedro Betancourt¨ del Municipio Jovellanos. Mayo de 2008 - Diciembre de 2010.
Fuente: Historia Clínicas. Dpto. Archivo y Estadística
Tabla IV: Distribución de pacientes con sepsis y riesgo de evolucionar al shock séptico según localización de la sepsis primaria. Hospital General Docente ¨Pedro Betancourt¨ del Municipio Jovellanos. Mayo de 2008 - Diciembre de 2010.

Fuente: Historia Clínicas. Dpto. Archivo y Estadística
Tabla V: Distribución de pacientes con sepsis y riesgo de evolucionar al shock séptico según precocidad en el tratamiento. Hospital General Docente ¨Pedro Betancourt¨ del Municipio Jovellanos. Mayo de 2008 - Diciembre de 20010.

Fuente: Historia Clínicas. Dpto. Archivo y Estadística
Tabla VI: Distribución de pacientes con sepsis y riesgo de evolucionar al shock séptico según complicaciones. Hospital General Docente ¨Pedro Betancourt¨ del Municipio Jovellanos. Mayo de 2008 - Diciembre de 2010.
Fuente: Historia Clínicas. Dpto. Archivo y Estadística
Tabla VII: Distribución de pacientes con sepsis y riesgo de evolucionar al shock séptico según fallecidos. Hospital General Docente ¨Pedro Betancourt¨ del Municipio Jovellanos. Mayo de 2008 - Diciembre de 2010.

Fuente: Historia Clínicas. Dpto. Archivo y Estadística
Tabla VIII: Distribución de pacientes con sepsis y riesgo de Evolucionar al shock séptico según evolución. Hospital General Docente ¨Pedro Betancourt¨ del Municipio Jovellanos. Mayo de 2008 - Diciembre de 2010.
Fuente: Historia Clínicas. Dpto. Archivo y Estadística
Conclusiones
• La búsqueda de alternativas terapéuticas para evitar que los pacientes con sepsis y riesgo de evolucionar al shock séptico evolucionen de manera no deseada, es una tarea de todo médico sea cual fuera su especialidad. Dado a que con el aumento de la expectativa de vida al nacer nuestra población ha envejecido y con esto los riesgos de sepsis son mucho mayores.
• El comportamiento de las variables que determinan el estado actual de la población atendida en nuestro centro, con sepsis y riesgo a evolucionar al shock séptico. Se comportan de manera similar al comportamiento mundial.
• El proyecto de intervención en el Hospital General Docente ¨Pedro Betancourt¨ descrito por el autor de este trabajo, con sus propuestas terapéuticas, resultó práctico y eficaz en el tratamiento de esta entidad, disminuyendo en gran medida las complicaciones de los pacientes sépticos.
• Los resultados satisfactorios obtenidos durante el tratamiento, sobre todo en los pacientes que fueron atendidos precozmente ante las 6 horas, confirman que con este proyecto de atención se puede mejorar la calidad de vida de los pacientes afectados.
Recomendaciones
Poner en marcha en el Hospital General Docente ¨Pedro Betancourt¨ el proyecto de intervención elaborado para el manejo del paciente con sepsis y riesgo de evolucionar al shock séptico.
Anexo I
PLANILLA DE RECOLECCIÓN DE DATOS:
Nombres y Apellidos: _____________________________________
HCl. __________ Edad:_______ Raza:____ Sexo:_____
Profesión: _____________. # C.I: _________________
Dirección: ____________________________.
Factores predisponentes:
____ Características propias del agente invasor
____ Pacientes ancianos
____ Cirrosis hepática
____ Diabetes
____ Neoplasias
____ Hemopatías graves
____ Sida
____ Portadores de catéteres urinarios o intravasculares
____ Pacientes sometidos a ventilación mecánica
____ Tratamiento inmunosupresor con corticoides o citostáticos
____ Nutrición parenteral prolongada
Según procedencia
_____ Cuerpo de guardia
_____ Salas medicina
_____ Cirugía
_____ Ginecoobstetricia
Localización de la sepsis primaria
_______ Sistema respiratorio
_______ Sistema renal
_______ Sistema ginecológico
_______ Sistema digestivo
Precocidad en el tratamiento
______ Primeras 6 horas
______ Primeras 24 horas
______ Después de 24 horas
Complicaciones
_____ Cardiorrespiratorias
_____ Renales
_____ Hematológica
_____ Ácido-básicas e hidroelectrolíticas
_____ Fallo multiorgánico
_____ Fallecidos
Fallecidos según procedencia
______ Cuerpo de guardia
______ Salas medicina
______ Cirugía
______ Ginecoobstetricia
Evolución
______ Favorable
______ Fatal
Anexo II
Proyecto de intervención en nuestro hospital para el tratamiento del paciente con sepsis graves y riesgo de evolucionar al shock séptico.
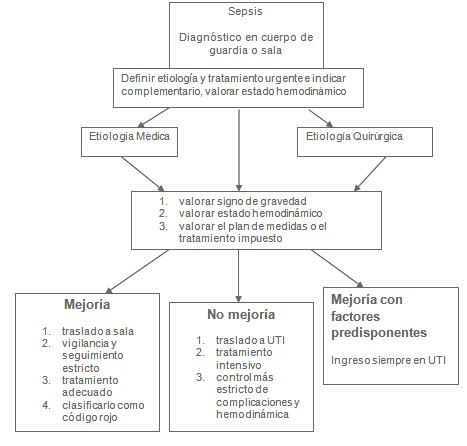
Diagnóstico de la sepsis en cuerpo de guardia o sala.
1. Definir etiología
2. Signos clínicos de alarma: taquipnea, taquicardia, hipertermia, hipotermia, llene capilar lento, confusión mental, frecuencia cardiaca no deseada, tensión arterial media menor de 70 mmHg, signos de deshidratación, diuresis menor de 0,5 ml/ Kg/ h.
Indicar complementarios de urgencias
Hemocultivo, Hemograma, Leucograma, Cituria, Coagulograma, Glicemia, Creatinina, Gasometría, Ionograma y Rayos X de Tórax.
3. Tratamiento urgente
Fluidoterapia: se administra de 20 a 40 ml/Kg de cristaloide 2/3 y 1/3 de coloide, entre 250 y 500 ml cada 15 minutos, para un total de 2000 ml en una hora.
Antibióticoterapia empírica precoz según localización (se sugiere cefalosporinas de tercera generación combinadas con aminoglucósidos, macrólidos, quinolonas y metronidazol), sí es en cuerpo de guardia en la primeras 2 horas, si es atendido en la UTI y no procede de urgencias en la primera hora.
4. Valoración de la hemodinámica, a través de medición de diuresis (más de 0,5ml/Kg/h), tensión arterial media (TAM) y estado de hidratación (abordaje venosos profundo y medir presión venosa central (PVC) entre 12 y 15 cm de agua, saturación de oxígeno mayor de 95%).
Etiología Médica.
Tratamiento adecuado a los signos de localización de la sepsis
Etiología quirúrgica
Tratamiento quirúrgico adecuado.
Valorar signos de gravedad.
. Taquicardia, taquipnea
. Oliguria, < 0,5 ml/kg/h.
. Alteraciones mentales agudas.
. Hipotensión.
. Llene capilar lento (< 2 segundos).
. Gradiente térmico.
. Cianosis.
. Hipotermia (temperatura < 36ºC), Hipertermia (temperatura > 38 ºC).
Valoración del estado hemodinámico.
TA sistólica > 90 mmHg y tensión arterial media (TAM) > 85 mmHg, diuresis > 0,5 ml/Kg/h, frecuencia respiratoria > 20, frecuencia cardiaca > 90 y llene capilar > 2 segundos.
Presión venosa central (PVC) entre 12 y 15 cm de agua. Taquicardia, cianosis, hipotensión, polipnea, confusión mental e hipotermia o hipertermia.
Relación PaO2 / FiO2 no superior a 280 (en ausencia de enfermedad pulmonar o cardiovascular).
Presencia o no de acidosis láctica.
Oliguria (diuresis < 0,5 ml/kg/h).
Valorar el plan de medidas o el tratamiento impuesto.
Primeras 6 horas:
Reposo en posición de 30 - 45º, según estado del paciente.
Vía oral suspendida, sonda de levyn si fuera necesario.
Oxígeno terapia. Si < 90%, relación PaO2 / FiO2 no > 280.
Sonda vesical y diuresis horaria. Monitoreo cardiovascular permanente.
El tratamiento debe comenzarse donde se haga el diagnóstico.
Accesos vasculares (canulación de dos vías periféricas para la extracción de complementarios, hemocultivos y administración inmediata de líquidos y antibióticos de amplio espectro.
Canalizar vena profunda para medir presión venosa central (PVC).
Tratamiento. Inicio precoz del tratamiento antibiótico en las 2 primeras horas si el paciente es atendido en urgencias y en la 1 hora si es atendido en la UTI y no procede de urgencias.
Fluidoterapia: se administra de 20 a 40 ml/Kg de cristaloide 2/3 y 1/3 de
Coloide, (entre 250 y 500 ml cada 15 minutos, para un total de 2000 ml en una hora).
En presencia de hipotensión y lactato elevado mayor de 2 mmol/l (canalizar vena profunda, medir presión venosa central (PVC) y mantener en 12 y 15 cm de agua, diuresis horaria > de 0,5 ml/kg/h y saturación de oxígeno > de 95%).
Si tensión arterial media (TAM) < de 85 mmHg y TAS < 90 mmHg a pesar de la administración de líquidos correctamente sugerimos vasopresores más inotropos (uso de norepinefrina de 0,01 – 5,0 µg/kg/min, (dosis/ valorar 0,52 µg/kg/min), dopamina de 1 – 20 µg/kg/min (dosis/ valorar 15 µg/kg/min), uso de esteroides a razón de 1 mg/kg/día.
Primeras 24 horas:
Mantener las mismas medidas que se aplicaron en las primeras 6 horas y adicionar:
1. Control estricto hemodinámico (tensión arterial media (TAM), diuresis y saturación de oxígeno)
2. Mantener la glicemia por encima del límite inferior de la normalidad y por debajo de 8,3 mmol/l (con valores que oscilen entre 4,4 – 6,1 mmol/l). Comenzar tratamiento con insulina simple a dosis prehipoglicemiante (insulinoterapia intensiva).
3. Tratar la hipoalbuminemia inferior a 2,0 g/dl.
4. Tratamiento de las complicaciones que puedan aparecer.
Estas medidas deben ser aplicadas siguiendo el proyecto de intervención descritos para el tratamiento por el autor en el Hospital de Jovellanos.
Después de 24 horas:
Fueron atendidos estos pacientes haciendo un compendio de las dos etapas descritas con anterioridad y siempre los mismos tuvieron un mal pronóstico demostrado en el trabajo.
Proceder según evolución y factores de riesgos
Mejoría
1. traslado a sala
2. vigilancia y seguimiento estricto
3. tratamiento adecuado
4. clasificarlo como código rojo.
No mejoría
1. traslado a UTI
2. tratamiento intensivo
3. control más estricto de complicaciones y hemodinámica
Mejoría con factores predisponentes
1. Ingreso siempre en UTI.
Anexo III
Planilla de consentimiento e información al paciente o familiares
Nombre y apellidos:
Edad:
Solicitamos su consentimiento para incluirlo en un estudio que se realiza en nuestro centro con relación a los pacientes que sufren o padecen de sepsis y riesgo de evolucionar al shock séptico. En el proyecto de intervención en nuestro medio para el tratamiento de estos pacientes.
Firma del paciente de estar de acuerdo: ____________________
Firma del familiar de estar de acuerdo: _____________________
Firma del jefe de sala: __________________________
Bibliografía
1. Alberti C, Brun-Buisson C, Goodman SV, Guidici D, Granton J, Moreno R, Smithies M, Thomas O, Artigas A, Le Gall JR; European Sepsis Group. Influence of systemic inflammatory response syndrome and sepsis on outcome of critically ill infected patients. Am J Respir Crit Care Med 2003; 168: 77-8
2. Annane D, Bellissant E, Bollaert PE,Briegel J, Keh D, Kupfer Y, Corticosteroids for severe sepsis and septic shock: a systematic review and meta-analysis, BMJ 2004; 329; 480-488.
3. Bergogne-Berezin E, Towner KJ. Acinetobacter spp as nosocomial pathogens: microbiological, clinical and epidemiological features. Clin Microbiol Rev 1996; 9:148-165.
4. Bernaldo de Quirós JCL, Moreno S, Muñoz P, Rodríguez-Créixems M, Catalán P, Bouza E. Antigen detection in the rapid diagnosis of severe extrapharyngeal infections caused by group A Streptococcus. Infect Dis Clin Pract 1992; 1:372-376.
5. Bernaldo de Quirós JCL, Rodríguez-Créixems M, Cosín J, Cercenado E, Wihelmi I, Bouza E. Bacteriemia por estreptococo betahemolítico grupo A. Med Clin (Barc) 1987; 88:9-12.
6. Betriu C, Sánchez A, Gómez M, Cruceyra A, Picazo JJ. Antibiotic susceptibility of group A streptococci: a 6 year follow-up study. Antimicrob Agents Chemother 1993; 37:1717-1719.
7. Bodey GP, Bolívar R, Fainstein V, Jadeja L. Infections caused by Pseudomonas aeruginosa. Rev Infect Dis 1983; 5:279-313.
8. Bollaert PE, Charpentier C, Levy B, Debouverie M, Audibert G, Larcan A. Reversal of late septic shock with supraphysiologic doses of hydrocortisone. Crit Care Med 1998; 26:645-650.
9. Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Chest 1992; 101:1644-1655.
10. Bone RC, Grodzin CJ, Balk RA. Sepsis: a new hypothesis for pathogenesis of the disease process. Chest 1997; 112:235-243.
11. Brun-Buisson C, Doyon F, Carlet J, Dellamonica P, Gouin F, Lepoutre A, Mercier JC, Offenstadt G, Regnier B. Incidence, risk factors, and outcome of severe sepsis and septic shock in adults. A multicenter prospective study in intensive care units. French ICU Group for Severe Sepsis. JAMA 1995; 274: 968-974.
12. Brun-Buisson C, Meshaka P, Pinton P, Vallet B; EPISEPSIS Study Group. EPISEPSIS: a reappraisal of the epidemiology and outcome of severe sepsis in French intensive care units. Intensive Care Med 2004; 30: 580-588.
13. Chaowagul W, White NJ, Dance DAB, Fainstein V. Melioidosis: A major cause of community-acquired septicemia in northeastern Thailand. J Infect Dis 1989; 159:890-899.
14. Cohen J, Cristofaro P, Carlet J, Opal S. New method of classifying infections in critically ill patients. Crit Care Med 2004; 32: 1510-1526.
15. Colten H, Rosen FS. Complement deficiencies. Annu Rev Immunol 1992; 10:809-834.
16. Criado García O, Rodríguez de Córdoba S. Sistema del complemento, sus receptores y proteínas reguladoras. Medicine 1997; 7:2229-2235.
17. De Miguel-Yanes JM, Andueza-Lillo JA, González-Ramallo VJ, Pastor L, Muñoz J. Failure tu implement evidence-based clinical guidelines mor sepsis at the ED. Am J Emerg Med 2006; 24: 553-559.
18. Dr. Ruibal Antonio. Sepsis severa en unidades de cuidados intensivos. Hospital Calixto Garcia. Editorial pueblo y educación. Pág 21-23, 2000.
19. Dellinger RP, Carlet JM, Masur H, et al Surviving Sepsis: Campaing Guidelines for management of severe sepsis and septic shock. Crit Care med.2004; 32: 858-873.
20. Dellinger RP, Carlet JM, Masur H, Gerlach H, Calandra T, Cohen J, Gea -Banacloche J, Keh D, Marshall JC, Parker MM, Ramsay G, Zimmerman JL, Vincent JL, Levy MM, Surviving Sepsis Campaign, Gudelines the management of the severe sepsis and septic shock. Crit Care Med 2004, 32: 858-873 Intensive Care Med 2004, 30: 536-555.
21. Departament de Sanitat i Seguretat Social. Recomanacions per a la prevenció de la infecció als centres sanitaris, 2.a ed. Generalitat de Catalunya, Barcelona, 1991.
22. Destarac LA, Ely EW Sepsis in older patients: An emerging concern in critical care. Adv sepsis 2002: 2: 15-22
23. Dhainaut JF, Laterre PF, et al. Drotrecogin alfa (activated) in the treatment of severe sepsis patients and septic shock, N Eng J Med
24. Dodds Aw, Sim Rb. Complement. A practical approach. IRL Press, 1997.
25. Dunzer MW, Mayr AJ, Ulmer H et al. Arginine Vasopressin in advanced vasodilatory shock: a prospective, randomized, controlled study. Circulation 2003; 107: 2313-19.
26. Finfer S, Bellomo R, Lipman J, French C, Dobb G, Myburgh J and ANZICS Clinical Trials Group Sepsis Investigators. Adult-population incidence of severe sepsis in Australian and New Zealand intensive care units. Intensive Care Med 2004; 30: 589-596.
27. Gao F, Melody T, Daniels DF, Giles S, Fox S. The impact of compliance with 6-hour and 24-hour sepsis bundles on hospital mortality in patients with severe sepsis: a prospective observational study. Crit Care 2005; 9: 764-770
28. Garner JS, Jarvis WR, Emori TG, Horan TC, Hughes JM. CDC definitions for nosocomial infections, 1988. Am J Infect Control 1988; 16: 128-140.
29. GRADE Working Group. Grading quality of evidence and strength of recommendations. BMJ 2004; 328: 1490-1497.
30. Harbeck Rj, Giclas Pc. Diagnostic immunology laboratory manual. Nueva York, Raven Press, 1991.
31. Harrison LH, Ali A, Dwyer DM, Libonati JP, Reeves MW, Elliot JA, et al.
32. Hollenberg SM, Ahrens TS, Annane D, Astiz ME, Chalfin DB, Dasta JF, Heard SO, Martin C, Napolitano LM, Susla GM, Totaro R, Vincent JL, Zanotti-Cavazzoni S. Practice parameters for hemodynamic support of sepsis in adult patients: 2004 update. Crit Care Med 2004; 32: 1928-1948.
33. Hollenberg SM, Ahrens TS, Annane D, et al Practica parameters for hemodynamic support of sepsis in adult patients, 2004 update Crit Care Med 2004; 32: 0928-48.
34. Horan TC, Gaynes RP, Martone WJ, Jarvis WR, Emori TG. CDC definitions of nosocomial surgical site infections, 1992: A modification of CDC definitions of surgical wound infections. Infect Control Hosp Epidemiol 1992; 13:606-608.
35. Kortgen A, Niederprum P, Bauer M. Implementation of an evidence-based “standard operating procedure” and outcome in septic shock. Crit Care Med 2006; 34: 943-949.
36. Kortgen A, Niederprum P, Bauer M.. Implementation of an evidence-based“standard operating procedure” and outcome in septic shock. Crit Care Med 2006; 34: 943-949.
37. Law SKA, Reid KBM. Complement. Londres, IRL Press, 1996.
38. Levi M, Cate HT, Poll T, Deventer SJH. Pathogenesis of disseminated intravascular coagulation in sepsis. JAMA 1993; 270:975-979.
39. Levy MM, Fink MP, Marshall JC, Abraham E, Angus D, Cook D, Cohen J, Opal SM, Vincent JL, Ramsay G; International Sepsis Definitions Conference. 2001 SCCM/ ESICM/ ACCP/ ATS/ SIS International Sepsis Definitions Conference. Intensive Care Med 2003; 29: 530-538.
40. Levy MM, Macias WL, Vincent JL, Russell JA, Silva E, Trzaskoma B, Williams MD. Early changes in organ function predict eventual survival in severe sepsis. Crit Care Med 2005; 33: 2194-2201.
41. Lizzewski M, Farries T, Lublin I, Rooney I, Atkinson J. Control of the Complement System. Adv Immunol 1996; 61:201-257.
42. Makrides S. Therapeutic Inhibition of the Complement System. Pharmacol Rev 1998; 50:59-87.
43. Mallolas J, Gatell JM, Miró JM, Marco F, Bisbe J, Jiménez De Anta MT et al. Analysis of prognosis factors in 274 consecutive episodes of Pseudomonas aeruginosa bacteremia. En: Homma JY, Tanimoto H, Holder IA, Hoiby N, Doring G, eds. Pseudomonas aeruginosa in human diseases. Antibiot Chemother 1991; 44:106-114.
44. Marx J. Rosen´s Emergency Medicine: Concepts and Clinical Practice. 5th ed St. Louis Mo.: Mosby; 2002: 1957
45. Mayhall CG, ed. Hospital epidemiology and infection control. Baltimore, Williams and Wilkins, 1996.
46. Morgan Bp. Complement. Clinical aspects and relevance to disease. Nueva York, Academic Press, 1990.
47. Moss M, Martin GS. A global perspective on the epidemiology of sepsis. Intensive Care Med 2004; 30: 527-529.
48. Muñoz P, Coque T, Rodríguez-Créixems M, Bernaldo de Quirós JCL, Moreno S, Bouza E. Group B Streptococcus: A cause of urinary tract infection in nonpregnant adults. Clin Infect Dis 1992; 14:492-496.
49. Muñoz P, Llancaqueo A, Rodríguez-Créixems M, Peláez T, Martín L, Bouza E. Group B Streptococcus bacteremia in nonpregnant adults. Arch Intern Med 1997; 157:213-216.
50. Padkin A, Goldfrad C, Brady AR, Young D, Black N, Rowan K. Epidemiology of severe sepsis occurring in the first 24 hours in intensive care units in England, Wales and Northern Ireland. Crit Care Med 2003; 31: 2332-2338.
51. Palencia E. Epidemiología de la sepsis REMI 2004: 4 (7): C 1b
52. Palencia E. Epidemiología de la sepsis REMI 2004: 4 (7); 1b
53. Palencia E. Tratamiento del enfermo con sepsis grave REMI: 2005:5 (3): C3
54. Pichichero ME. Cephalosporins are superior to penicillin for treatment of streptococcal tonsillopharyngitis: is the difference worth it? Pediatr Infect Dis J 1993; 12:268-274.
55. Porcel-Pérez Jm, ed. El sistema del complemento: de la inmunología a la clínica. Rev Clin Esp 1996; 196 (monografía 1).
56. Pronovost PJ, Nolan T, Zeger S, Miller M, Rubin H. How can clinicians measure safety and quality in acute care?. Lancet 2004; 363: 1061-1067.
57. Rakel P, ed Conn´s Current Therapy 2005 57th ed Philadelphia, Pa WB Saunders 2005:71
58. Relapsing invasive group B streptococcal infection in adults. Ann Intern Med 1995; 123:421-427.
59. Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, Peterson E, Tomlanovich M, Early goal-directed therapy in the treatment of severe sepsis and septic shock, N Eng J Med 2001; 345; 1368-1377.
60. Rivers EP. Early Goal-Directed Therapy in severe sepsis and septic shock. Converting science to reality. Chest 2006; 129: 217-218.
61. Rolston KV, Boded GP. Pseudomonas aeruginosa infection in cancer patients. Cancer Invest 1992; 10:43-59.
62. Rosselló J, Trilla A. Epidemiología de las infecciones nosocomiales. Todo Hospital 1995; 114:21-28.
63. Rother K, Till Go, Hänsch Gm. The complement system. Nueva York, Springer, 1997.
64. Rudis MI, Basha MA, Zarowitz BJ. Is it time to reposition vasopressors and inotropes in sepsis? Crit Care Med 1996; 24:525-537.
65. Shapiro NI, Howell MD, Talmor D, Lahey D, Ngo L, Buras J, Wolfe RE, Weiss JW, Lisbon A. Implementation and outcomes of the multiple urgent sepsis therapies (MUST) protocol. Crit Care Med 2006; 34: 1025-1032.
66. Shoemaker WC, Appel PL, Kram HB, Waxman K, Lee TS. Prospective trial of supranormal values of survivors as therapeutic goals in high-risk surgical patients. Chest 2005; 94: 1176-1186.
67. Silva E, de Almeida M, Beltrami AC, et al. Brazilian sepsis epidemiologic study (BASES study). Crit Care 2004, 8: R251-R260.
68. Sprung CL, Sakr Y, Vincent JL, Le Gall JR, Reinhart K, Ranieri VM, Gerlach H, Fielden J, Groba CB, Payen D. An evaluation of systemic inflammatory response syndrome signs in the Sepsis Occurrence in Acutely Ill Patients (SOAP study). Intensive Care Med 2006; 32: 421-427.
69. Stevens DL, Tanner MH, Winship J. Severe group A streptococcal infections associated with a toxic shock-like syndrome and scarlet fever toxin A. N Engl J Med 1989; 321:1-6.
70. Surviving Sepsis Campaign. http://www.survivingsepsis.org
71. Surviving Sepsis Campaign: Position Paper
72. Torrabadella de Reynoso P, Salgado Remigio A. Nuevos tratamientos de la sepsis grave. Una encrucijada científica, económica y ética. Med Clin (Barc) 1999; 113:18-19.
73. Torrabadella de Reynoso P, Salgado Remigio A. Óxido nítrico y sus inhibidores en la sepsis y el shock séptico. Med Intensiva 1993; 17: 477-484.
74. Trilla A, Vaqué J, Sallés M, Jiménez de Anta MT, Asenjo MA. Prevention and control of nosocomial infections in Spain. Infect Control Hosp Epidemiol 1996; 17:617-622.
75. Trilla A. Epidemiology of nosocomial infections in adult intensive care units. Intensive Care Med 1994; 20 (S3):1-5.
76. Trzeciak S, Dellinger RP, Abate NL, Cowan RM, Stauss M, Kilgannon JH, Zanotti S, Parrillo JE.Translating research to clinical practice. A 1-year experience with implementing early goal-directed therapy for septic shock in the emergency department. Chest 2006; 129: 225-232.
77. Van den Berghe G, Wilmer A, Hermans G, Meersseman W, Wouters PJ, Milants I, Van Wijngaerden E, Bobbaers H, Bouillon R, Intensive Insulin therapy in the medical ICU, N Engl J Med 2006, 354-461.
78. Vaqué J, Rosselló J, Trilla A, Monge V, García-Caballero J, Arribas JL et al. Nosocomial infections in Spain: Results of four nationwide serial prevalence surveys (EPINE Project, 1990-1993). Infect Control Hosp Epidemiol 1996; 17:293-297.
79. Verger G. Infección quirúrgica. En: Verger G, ed. Enfermedades infecciosas. Barcelona, Doyma, 1989; 603-607.
80. Verger G. Septicemias y bacteriemias. En: Verger G, ed. Enfermedades infecciosas. Barcelona, Doyma, 1989; 77-83.
81. Vila J, Marcos A, Marco F, Abdalla S, Vergara Y, Reig R et al. In vitro antimicrobial production of beta-lactamases, aminoglycosides-modifying enzymes, and chloramphenicol acetyltransferase by and susceptibility of clinical isolates of Acinetobacter baumannii. Antimicrob Agents Chemother 1993; 37:138-141.
82. Vila J. Mechanisms of antimicrobial resistance in Acinetobacter baumannii. Rev Med Microbiol 1998; 9:87-97.
83. Vincent JL, Sakr Y, Sprung CL, Ranieri VM, Reinhart K, Gerlach H, Moreno R, Carlet J, Le Gall JR, Payen D; Sepsis Occurrence in Acutely Ill Patients Investigators. Sepsis in European intensive care units: results of the SOAP study. Crit Care Med 2006; 34: 344-353.
84. Vivanco F, Casado Mt. Déficit congénitos del complemento y enfermedades reumáticas. Angioedema hereditario. Tratado de Reumatologia. Madrid, Ed. Arán, 1998.
85. Volanakis JE, Frank MM. The Human Complement System in Health and Disease. Nueva York, Marcel Dekker, 1998
86. Weinstein MP. Current blood culture methods and systems: clinical concepts, technology, and interpretation of results. CID 1996; 23:406.
87. Wenzel RP, ed. Prevention and control of nosocomial infections, 3.a ed. Baltimore, Williams and Wilkins, 1997.
88. Wheeler AP, Bernard GR. Treating patients with severe sepsis. N Engl J Med 1999; 340:207-214.
89. Williams MD, Braun LA, Cooper LM, Johnston J, Weiss RV, Qualy RL, Linde-Zwirble W. Hospitalized patients with severe sepsis: analysis of incidence, mortality, and associated costs of care. Crit Care 2004; 8: 291-298.
90. Zeni F, Freeman B, Natanson C. Antiinflammatory therapies to treat sepsis and septic shock: a reassessment. Crit Care Med 1997; 25:1095-1100.