El paciente oncológico está más expuesto a padecer enfermedades infectocontagiosas, relacionadas y favorecidas por la enfermedad de base y con el tipo de tratamiento quimioterápico al que está expuesto. La neutropenia es una situación frecuente en este tipo de pacientes y se relaciona en forma directa con el riesgo de infección. Se sabe que aproximadamente el 80% de los pacientes con un recuento absoluto de neutrófilos menor a 500/mm3 padecerá un episodio febril y que quienes tengan menos de 100/mm3 tendrán mayor riesgo de cursar infecciones graves (el 20% de los que exhiben menos de 100 polimorfonucleares/mm3 presentará bacteriemia).
Actualización en el tratamiento de neutropenia febril en pacientes pediátricos oncológicos
Oría, Maite (1); Clemente, Damián Andrés (2),
1- Residencia de Clínica del Niño de Quilmes
2- Médico Pediatra de planta de Clínica del Niño de Quilmes
Buenos Aires, Argentina.
Introducción
El paciente oncológico está más expuesto a padecer enfermedades infectocontagiosas, relacionadas y favorecidas por la enfermedad de base y con el tipo de tratamiento quimioterápico al que está expuesto. La neutropenia es una situación frecuente en este tipo de pacientes y se relaciona en forma directa con el riesgo de infección. Se sabe que:
Aproximadamente el 80% de los pacientes con un recuento absoluto de neutrófilos menor a 500/mm3 padecerá un episodio febril y que quienes tengan menos de 100/mm3 tendrán mayor riesgo de cursar infecciones graves (el 20% de los que exhiben menos de 100 polimorfonucleares/mm3 presentará bacteriemia)1.
Cuando un paciente oncohematológico tiene menos de 500 neutrófilos por mm3 en sangre periférica o se detecta una caída brusca del conteo (mayor al 50% del valor) en la última semana, y presenta un pico febril mayor a 38,5ºC o dos mayores a 38,1ºC en el lapso de 24 horas, debe considerárselo un neutropénico febril (2).
Los pacientes neutropénicos febriles, deben ser considerados como una urgencia infectológica; por lo tanto, deben ser rápidamente evaluados para el inicio del tratamiento médico correspondiente (1). Las enfermedades infecciosas son una causa importante de morbilidad y mortalidad en el paciente oncológico. Los factores que contribuyen en distinta medida a incrementar el riesgo del paciente oncológico de adquirir una infección son muy numerosos, entre ellos (2):
_ Neutropenia
_ Disrupción de las barreras cutáneo-mucosas
– punciones digitales
– punciones venosas
– aspirado de médula ósea
– inserción de accesos venosos permanentes
_ Esplenectomía y asplenia funcional
_ Corticoides y otros fármacos linfotóxicos
_ Trasplante de progenitores hematopoyéticos
_ Inmunodeficiencia asociada con la neoplasia primaria
_ Enfermedad en etapa avanzada
_ Neoplasia hematológica refractaria
_ Malnutrición (2)
Etiología
El paciente oncológico es un individuo que tiene mayor riesgo de infección por estar expuesto a múltiples variables como: la enfermedad de base, el tipo de terapéutica a la que es sometido, su estado nutricional, los procedimientos invasivos, internaciones frecuentes y prolongadas, la posibilidad de colonización con gérmenes del área hospitalaria multirresistentes, el uso de profilaxis antibiótica y tratamientos empíricos o por la combinación de estos factores. Las infecciones bacterianas se presentan durante los estadios más tempranos de la neutropenia (1).
Los patógenos que infectan a los pacientes con neutropenia febril han variado en su frecuencia con el transcurso del tiempo. En las últimas dos décadas se produjo una disminución progresiva en la frecuencia de las infecciones por bacilos gramnegativos y a un aumento de las causadas por cocos grampositivos y hongos. Este fenómeno se ha observado en todo el mundo, incluido nuestro país (3).
En solo el 30-40% de los casos puede documentarse foco clínico o cultivos positivos. En el 25% de los pacientes la única evidencia de infección es la documentación de bacteriemia. En el 80% de las infecciones identificadas, el agente proviene de la flora endógena del paciente (4) (Tabla 1) (1).
Tabla 1: Neutropenia y fiebre. Agentes etiológicos frecuentes.
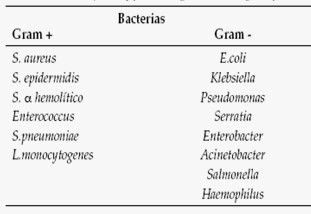
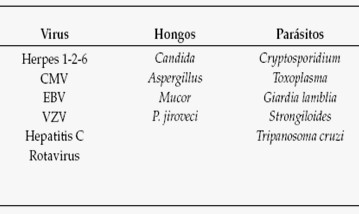
CMV: citomegalovirus. EBV: Epstein Barr virus. VZV: varicela zóster virus. PNJ: Pneumocystis jiroveci.
Categorización del paciente
Los estudios en el área pediátrica han demostrado que, desde el punto de vista clínico y de los exámenes complementarios, existen factores que permiten predecir el riesgo que puede tener un infante de tener una evolución complicada. Los principales factores de riesgo que se deben considerar al ingreso del paciente con diagnóstico de neutropenia febril y que indican un mal pronóstico (5), son los enumerados en la tabla 2 (2):
Tabla 2. Factores de alto riesgo en niños con neutropenia y fiebre 
En estudios multicéntricos efectuados en Argentina se ha validado un puntaje de riesgo de mortalidad con gran sensibilidad y especificidad, con los siguientes aspectos:
a) estadio de la enfermedad de base, 3 puntos,
b) enfermedad asociada, 2 puntos, y
c) bacteriemia, 1 punto.
Los niños que presentan un puntaje mayor de 4 deben catalogarse como de alto riesgo.
Santolaya (5) y col. elaboraron una escala de riesgo para identificar los pacientes que tienen bajo riesgo de presentar una infección bacteriana invasiva y de este modo generar protocolos de manejo menos agresivos que los tradicionales. En sus estudios secuenciales, su grupo halló cinco parámetros que permitían clasificar un paciente como de bajo o alto riesgo: PCR sérica mayor a 90 mg/L, presencia de hipotensión, conteo de plaquetas menor a 50.000/mm3, intervalo menor a 7 días después del último ciclo de quimioterapia y tener leucemia como tipo de cáncer (5).
Un niño era considerado de alto riesgo para infección bacteriana invasiva si tenía dos o más factores de riesgo o si presentaba una PCR mayor de 90, hipotensión o recaída de leucemia como único factor (5).
Un niño era considerado de bajo riesgo si no tenía factores de riesgo o si tenía, como únicos factores, un conteo de plaquetas menor o igual a 50.000/mm3 o haber recibido quimioterapia en los últimos 7 días (5).
Otra regla para predicción de bajo riesgo en pacientes oncológicos pediátricos fue diseñada por Klaassen (5) y col. Este grupo propone que los pacientes con fiebre y neutropenia que presenten un conteo inicial de monocitos mayor o igual a 0,1 x 109/L, sin enfermedades asociadas ni radiografía de tórax anormal, pueden considerarse para una terapia inicial menos agresiva. No hay una regla de predicción de riesgo aceptada en forma universal (5).
Tratamiento
Debido a que la progresión de la infección en los pacientes con neutropenia puede ser rápida, y que inicialmente es difícil diferenciar a los pacientes infectados de los que no, la terapéutica antibiótica debe iniciarse rápidamente en todo paciente con neutropenia febril, así como también en los pacientes neutropénicos afebriles pero que presentan otros signos de infección (4).
Los pacientes neutropénicos febriles deben recibir tratamiento antibiótico de amplio espectro, de baja toxicidad y bajo costo, que debe administrarse rápidamente. En este tipo de pacientes se han ensayado diferentes esquemas antibióticos. La combinación más utilizada es la de un betalactámico y un aminoglucósido. Antes de instituir el tratamiento se debe categorizar al paciente de acuerdo a su riesgo y valorar la situación epidemiológica del lugar donde se encuentra internado (3).
Esquemas propuestos:
• Tratamiento inicial por vía oral:
No es una recomendación en el episodio de neutropenia febril, es una modalidad posible utilizada en algunos centros de alta complejidad, con estructura y seguimiento adecuados.
• Tratamiento ambulatorio:
Se podrá plantear luego de una adecuada categorización y evaluación del paciente.
• Tratamiento hospitalario de inicio y luego ambulatorio:
De acuerdo con la categorización del paciente, foco de infección detectado, documentación microbiológica y evolución del paciente dentro de las 48 horas de iniciado el tratamiento (1).
El tratamiento antibiótico empírico con cambio a la vía oral es seguro y eficaz. Se han propuesto distintos esquemas.
• Vía oral:
- Ciprofloxacina (25-30 mg/kg/día, cada 12 horas)
- Cefixime (4 mg/kg/dosis, cada 12 horas)
- Ciprofloxacina más amoxicilina o amoxicilina/ácido clavulánico
• Vía parenteral:
- Cefalosporina (ceftriaxona: 100 mg/kg/día cada 24 horas) más aminoglucósido (amikacina: 15 mg/kg/día cada 24 horas)
- Monoterapia: cefalosporina de cuarta generación, carbapenémico (1).
Como esquemas antibióticos alternativos:
a. Un esquema que incluya un aminoglucósido y una penicilina antipseudomonas:
Tiene la ventaja de potenciar sinérgicamente su acción sobre gramnegativos y menor riesgo de resistencia; como desventaja, no cubre Staphylococcus aureus meticilinorresistentes (SAMR) y tiene un posible efecto nefrotóxico.
b. Un doble esquema que incluya un aminoglucósido y una cefalosporina de tercera generación: Con igual acción que el anterior.
c. Monoterapia que incluya un antibiótico de amplio espectro como ceftazidima, cefepima, imipenem o meropenem:
Esquema con baja toxicidad y amplio espectro, pero de poca eficacia sobre Staphylococcus aureus meticilinorresistentes (SAMR). En algunos trabajos se ha mencionado el uso de ceftazidima, pero no está recomendada como monoterapia en los pacientes neutropénicos febriles de alto riesgo (1).
A continuación se presenta tabla con los antimicrobianos más utilizados (Tabla 3) (3):
Tabla 3. Dosis, vía e intervalos de administración de los antimicrobianos más frecuentemente utilizados en en niños con neutropenia y fiebre.
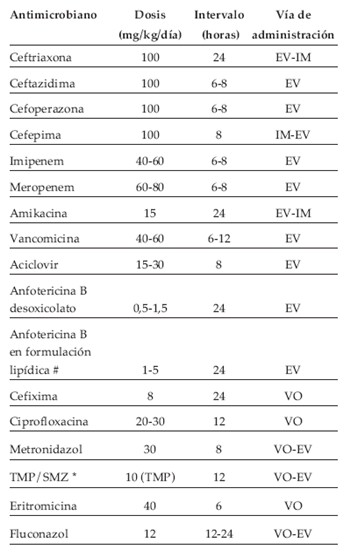
Se consideran aquí tres esquemas de tratamiento antibiótico endovenoso con similar eficacia, teniendo en cuenta que alguno puede ser más apropiado que otro en ciertos pacientes y ciertas instituciones (6).
1. Monoterapia:
Una cefalosporina de tercera (ceftazidima) o cuarta (cefepime) generación, o un carbapenem (imipenem o meropenem) pueden ser utilizados con éxito, aunque debe recordarse que la aparición de B-lactamasas de espectro extendido han reducido la utilidad de la ceftazidima como monoterapia (4). Cefepime, imipenem y meropenem, a diferencia de ceftazidima, tienen excelente actividad contra Estreptococo viridans y neumococo. Vancomicina demostró ser requerida con menor frecuencia en monoterapias con cefepime que con ceftazidima.
Un estudio prospectivo doble ciego realizado por Vandercam (6) y col. de 411 pacientes con enfermedad oncológica, demostró que la tasa de respuesta fue mayor en pacientes neutropénicos febriles tratados con meropenem, que en aquellos tratados con ceftazidima (6). La piperacilina-tazobactam también es efectiva como monoterapia, pero no ha sido extensamente estudiada frente a los otros antibióticos. El agregado de otros antibióticos puede ser necesario en el curso de la enfermedad (4). Las quinolonas, como ciprofloxacina, también fueron evaluadas como monoterapia en estudios limitados arrojando resultados favorables como los efectuados por Johnson y col.7 y Winston y col. 8; y desfavorables como los efectuados por Meunier y col. 9, por lo que no son recomendadas de rutina como monoterapia endovenosa (6).
2. Terapia combinada sin vancomicina:
Un aminoglucósido (gentamicina, tobramicina o amikacina) más:
- una penicilina antipseudomónica (ticarcilina-clavulánico o piperacilina-tazobactam),
- o cefalosporina con espectro antipseudomona (ceftazidima o cefepime),
- o carbapenem (imipenem o meropenem).
Las ventajas de la terapia combinada son: los potenciales efectos sinérgicos contra algunos bacilos Gram negativos y las pocas cepas que desarrollan resistencia durante el tratamiento. Las desventajas son: la falta de actividad de algunas combinaciones sobre Gram positivos, la ototoxicidad y nefrotoxicidad, y la hipokalemia (4).
Estudios limitados del Grupo Cooperativo Internacional de Terapia Antimicrobiana (10) y los realizados por Rubinstein y col. (11), demostraron que una dosis diaria de aminoglucósido más ceftriaxona, es tan efectivo como múltiples dosis en el día de estas mismas drogas, y tan efectivo como la monoterapia con ceftazidima, pero la información no es suficiente para establecerlo como tratamiento de rutina (6).
3. Terapia con vancomicina más 1 o 2 drogas:
Debido a la emergencia de gérmenes resistentes asociados con el uso excesivo de vancomicina, su uso debe estar limitado a las indicaciones específicas (4). En aquellas instituciones donde las bacterias Gram positivas comúnmente causan infecciones graves, vancomicina debería incorporarse en el esquema inicial en algunos pacientes de alto riesgo, para discontinuarse 24 a 48 horas después si no se identifica infección (6).
Las infecciones por Gram positivos son frecuentemente indolentes, pero algunas son sólo sensibles a vancomicina y en ocasiones pueden ser serias y provocar la muerte en 24 horas si no se tratan rápidamente (4).
La terapéutica inicial con vancomicina debe ser considerada en:
1. Sospecha clínica de infección severa asociada a catéter (bacteriemia, celulitis)
2. Colonización conocida con Estreptococo pneumoniae o Estafilococo aureus resistente
3. Hemocultivos positivos para Gram positivos antes de la sensibilidad e identificación
4. Hipotensión u otra evidencia de compromiso hemodinámico (4)
La combinación de vancomicina con ceftazidima ha sido utilizada en forma extensa en el pasado; el posible riesgo de resistencia bacteriana a ceftazidima justificaría la recomendación de asociar preferentemente vancomicina con cefepime o carbapenémicos (6).
Evaluación del régimen antibiótico en la primera semana
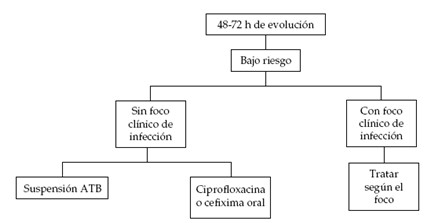
Una vez instalado el plan terapéutico, el paciente es revalorado clínicamente y microbiológicamente dentro de las 48 a 72 horas, ante la necesidad de modificar o ampliar el esquema inicial (1).
Si después de iniciado el tratamiento el paciente se torna afebril en los primeros 3 a 5 días, el conteo de neutrófilos es mayor de de 500 células/mm3 por dos días consecutivos, la evolución es favorable y se considera un paciente de bajo riesgo según los criterios expuestos anteriormente, se pueden suspender los medicamentos endovenosos y continuar con terapia oral (5).
Si alguna de estas tres condiciones no se cumple, el paciente debe continuar con antibióticos endovenosos (5).
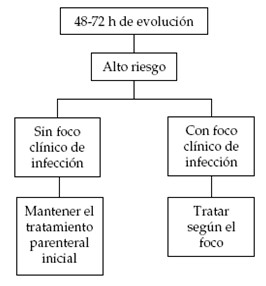
Algoritmo 1. Manejo a las 48-72 horas de ingresado el paciente con neutropenia febril de bajo riesgo (1).
Algoritmo 2. Manejo a las 48-72 horas de ingresado el paciente con neutropenia febril de alto riesgo (1).
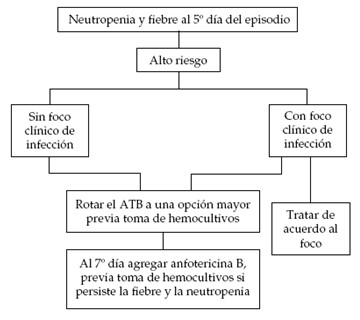
Si después de 3 a 5 días el paciente persiste febril, tenemos tres opciones:
1) En un paciente clínicamente estable, sin organismos identificados, podríamos sospechar una causa no bacteriana de infección o una respuesta lenta al tratamiento. Algunas infecciones, por ejemplo, por Estreptococo viridans, pueden asociarse con fiebre por más de 3 a 5 días a pesar de una terapia adecuada. El esquema antibiótico puede continuar igual, especialmente si anticipamos mejoría pronta en el conteo de neutrófilos. La vancomicina se puede suspender si no hay evidencia que soporte su uso.
2) Si el paciente tiene una enfermedad clínicamente progresiva, las posibilidades incluyen una infección no bacteriana seria, resistencia bacteriana a los antibióticos actuales o falla de los antibióticos para alcanzar su sitio de acción (absceso). En estos casos, se debe considerar añadir antimicrobianos apropiados o cambiar a diferentes medicamentos.
3) La tercera opción por considerar es la adición de terapia antimicótica. Hasta un tercio de los pacientes con neutropenia febril que no responden a la terapia antibiótica después de una semana, tienen una infección por hongos, en la mayoría de casos por especies de Candida o Aspergillus. Se han descripto cuatro factores de riesgo independientemente asociados con infección micótica invasiva: neutropenia prolongada (mayor a 30 días), terapia prolongada con esteroides, trasplante alogénico de médula ósea y recaída de malignidad (5). Si persiste febril y neutropénico entre 5 y 7 días sin documentación microbiológica, realizar nuevos cultivos y agregar al esquema desoxicolato de anfotericina B; se indicará a una dosis de 0,25 mg/kg/día y se aumentará progresivamente según la gravedad del cuadro hasta llegar a una dosis de 0,75-1,5 mg/kg/día de acuerdo a la existencia o no de foco fúngico confirmado. La dosis total diaria no debe exceder los 50 mg/día (1).
Algoritmo 3. Evolución posterior de los pacientes con neutropenia y fiebre de alto riesgo (1).
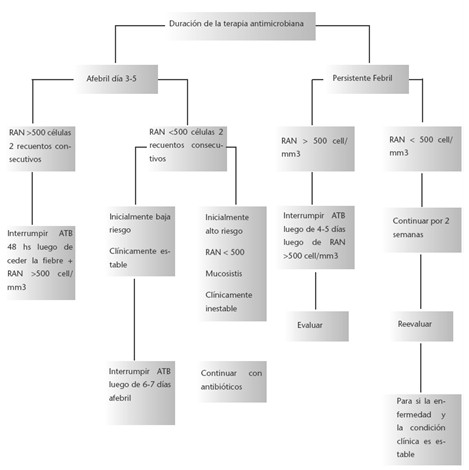
Duración del tratamiento
El momento de inicio de la terapéutica antibiótica suele ser claro pero existe mucha controversia con respecto a su finalización. Desde hace más de diez años existen varios trabajos publicados que evalúan el tiempo óptimo del tratamiento endovenoso hasta la resolución de la neutropenia (1).
El factor más importante que determina una interrupción exitosa de los antibióticos es el recuento de neutrófilos (6).
Si no se identifica infección luego de tres días de tratamiento, si el recuento de neutrófilos es mayor a 500/mm3 por dos días consecutivos, y si el paciente se encuentra afebril por 48 horas, el antibiótico puede ser suspendido. Si el paciente está afebril pero permanece con neutropenia, la conducta está menos definida. Algunos sugieren continuar con antibióticos hasta la resolución de la neutropenia, pero esta conducta aumenta el riesgo de toxicidad y superinfección por hongos o bacterias resistentes (6,12,13).
Los pacientes neutropénicos en buen estado general, de bajo riesgo, sin evidencia de infección, ni foco, es razonable discontinuar los antibióticos luego de 5 a 7 días de encontrarse afebriles y con evidencia de recuperación hematológica. Si la suspensión de antibióticos se realiza durante la neutropenia, el paciente debe ser estrictamente monitorizado y reiniciar los antibióticos endovenosos ante fiebre o cualquier signo de infección (6).
Se debe considerar continuar con los antibióticos durante todo el periodo de neutropenia en los pacientes con: neutropenia profunda (menor a 100 neutrófilos/mm3), mucositis, o signos vitales inestables. En los pacientes con neutropenia prolongada, en los cuales no se espera recuperación, se puede suspender el tratamiento luego de dos semanas, si no se ha identificado sitio de infección (6).
La duración de la anfotericina varía. Si se identifica la infección, debe cumplirse el curso de la misma según el agente y la extensión. Si no pudo documentarse la infección, la neutropenia está resuelta, el paciente está clínicamente estable, y la tomografía axial computada (TAC) sin lesiones, la anfotericina puede suspenderse. Para pacientes con neutropenia prolongada y clínicamente estables, se sugiere que luego de dos semanas de anfotericina, si no hay evidencias clínicas ni en imágenes, ésta puede suspenderse. En los pacientes inestables o de alto riesgo, se debe continuar antibióticos más anfotericina durante la neutropenia (4,14,15).
Para pacientes que permanecen febriles luego de la recuperación de la neutropenia a pesar de haber recibido tratamiento con antibióticos de amplio espectro, la reevaluación debe ser orientada a una infección fúngica, (especialmente candidiasis crónica sistémica, aspergilosis, histoplasmosis, y trichosporonosis), por micobacterias, o viral. Los antibióticos pueden suspenderse 4 a 5 días luego de la recuperación (recuento mayor a 500 neutrófilos/mm3) y sin lesiones identificadas (4).
Los estudios por imágenes (ecografía, TAC, RMN) pueden ser útiles para la detección de infecciones sistémicas (esplénica, hepática, renal) y éstas pueden hacerse aparentes o aumentar a medida que el recuento de neutrófilos aumenta (4).
Algoritmo 4. Duración del tratamiento antimicrobiano (4).
Uso de drogas antivirales
Sólo están indicadas cuando existe evidencia clínica o de laboratorio de infección viral. Si hay lesiones en piel o mucosas debidas a herpes simplex (HVS) o varicela zoster, aunque no sean la causa de la fiebre, está indicado el tratamiento con aciclovir. De esta manera se evita la presencia de puertas de entrada para sobreinfecciones bacterianas o fúngicas (6). El tratamiento de las formas graves es con aciclovir endovenoso, en dosis de 10 mg/kg cada 8 horas por 14 a 21 días. Ante la presencia de herpes simplex (HVS) resistente a aciclovir se indicará foscarnet 180 mg/kg en tres dosis, pero otros expertos proponen el uso de cidofovir. En pacientes de bajo riesgo puede utilizarse aciclovir por vía oral o fanciclovir. En herpes zóster se utilizan dosis de 800 mg, cinco veces por día, por 5 a 7 días (1).
Las infecciones por citomegalovirus (CMV) son poco frecuentes, pero si existieran deberían tratarse con ganciclovir (10 mg/kg/día EV, por 14 a 21 días) o foscarnet (6).
La exposición de un paciente inmunocomprometido susceptible al virus de la varicela es indicación de la infusión de inmunoglobulina específica dentro de las 72 horas, con una eficacia esperable del 50-60% o puede utilizarse profilácticamente aciclovir entre 5 y 7 días del contacto con el caso índice, 40-80 mg/kg/día por 5 a 7 días. Este grupo de pacientes serán considerados de riesgo hasta 28 días del contacto. Si aparecen lesiones cutáneas se debe administrar aciclovir endovenoso, que disminuiría la progresión de las lesiones y previene la diseminación, reduciendo el riesgo de encefalitis o neumonía (1,16,17).
Los virus sincitial respiratorio (VSR), influenza A y B, parainfluenza y adenovirus pueden producir una enfermedad grave. En estos casos, la ribavirina es indicación para el virus sincitial respiratorio (VSR), la amantadina 8 mg/kg/día o rimantadina 5 mg/kg/día para influenza A, o los nuevos fármacos inhibidores de la neuraminidasa: oseltamivir y zanamivir (1).
NUEVAS MODALIDADES DE TRATAMIENTO
En los últimos años hubo avances significativos en el tratamiento ambulatorio de los niños con neutropenia febril. El alta precoz del enfermo es beneficiosa para el niño pues evita el hospitalismo y la posibilidad de infección intrahospitalaria. Es más confortable para el paciente y disminuye los costos de salud (3).
Diferentes estudios han comunicado diversas modalidades terapéuticas. Los tratamientos acortados o secuenciales con el niño hospitalizado y el tratamiento exclusivamente ambulatorio fueron los más ensayados en la población pediátrica (3).
Actualmente, en los pacientes de bajo riesgo correctamente caracterizados pueden realizarse tratamientos por vía oral luego de un curso breve de tratamiento endovenoso. Los antibióticos ensayados en niños, son cefixime, ciprofloxacina y, recientemente, acetilcefuroxima (3).
Diversos autores en todo el mundo han ensayado modalidades terapéuticas nuevas, como el tratamiento secuencial o los tratamientos acortados o domiciliarios (3).
En el año 2001, en el St. Jude Children´s Research Hospital, en Memphis, Estados Unidos, se realizó un estudio durante 53 meses evaluando 433 episodios de neutropenia febril en 308 pacientes. De los mismos, 200 episodios (en 156 pacientes) fueron elegidos en forma aleatoria para ser tratados por vía oral o continuar en forma endovenosa (18).
La respuesta que se obtuvo al tratamiento fue segura. La tasa observada de bacteriemia fue del 1% entre los episodios asignados al tratamiento oral, y de 0,5% en el grupo de estudio como un todo (18).
Con respecto a los fracasos de dicho tratamiento, como se esperaba, la tasa fue más alta en niños con neutropenia severa que en aquellos sin ella (18).
Considerando alternativas para el manejo convencional de neutropenia febril en un gran espectro de niños oncológicos, se cree que el inicio del tratamiento por vía parenteral es prudente. Se ha llegado a la conclusión de que pacientes que no muestren crecimiento bacteriano en sus cultivos luego de 48 horas, y que no tienen factores de riesgo específicos para bacteriemia, pueden rotarse a antibióticos orales sin aumentar significativamente el riesgo de infecciones severas, comparado con pacientes que completan su tratamiento parenteral. En conclusión, cefixime oral es similar que continuar antibióticos endovenosos en el tratamiento empírico de neutropenia febril en niños con enfermedades oncológicas (18,19,20).
Estos descubrimientos coinciden con los resultados de un estudio canadiense piloto efectuado por Lau y col (21)., en donde el hecho de rotar el tratamiento a cefixime oral fue un éxito para 20 (87%) de 23 pacientes pediátricos oncológicos, quienes permanecieron afebriles luego de recibir por 72 horas tratamiento endovenoso. Tres de los pacientes estudiados tuvieron fiebre recurrente, dos de ellos respondieron a la reanudación del tratamiento parenteral, y en el tercero de ellos se cree que la fiebre fue causada por una recaída de la leucemia (18).
En el año 2000, en el Hospital de Pediatría Prof. Dr. Juan P. Garrahan, en Buenos Aires, Argentina, se publicó un estudio que fue llevado a cabo desde mayo de 1997 a marzo de 1998, sobre 154 episodios de neutropenia febril en 128 niños de bajo riesgo de un promedio de edad de 62 meses. Los criterios de inclusión fueron los siguientes: fiebre (mayor a 38ºC), neutropenia (recuento de neutrófilos menor a 500/mm3), características de bajo riesgo y conformidad por parte de los padres (22).
Luego de iniciar el tratamiento parenteral por tres días con ceftriaxona (100 mg/kg/día cada 12 horas) y amikacina (15 mg/kg/día cada 24 horas), todos los pacientes se dividieron en 2 grupos: grupo A (n=74) recibió cefixime oral (8 mg/kg/día) por 4 días; grupo B (n=80) recibió ceftriaxona y amikacina por 4 días más hasta completar 7 días totales (22).
Se arribó a la conclusión de que en niños de bajo riesgo, la eficacia de cefixime oral dado por 4 días luego de 72 horas de ceftriaxona y amikacina endovenosos, es similar a recibir por vía parenteral 7 días de ceftriaxona más amikacina (22).
En el año 2000, en el Children´s Medical Center of Dallas, en Texas, Estados Unidos, se estudió la viabilidad de ciprofloxacina oral para el manejo del paciente no hospitalizado con neutropenia febril en niños oncológicos (23).
En este estudio los pacientes debían reunir ciertas características, a saber: edad de 1 a 21 años, recuento de neutrófilos mayor a 100/mm3, más de 7 días del inicio de la última sesión de quimioterapia y padres confiables (23).
Los pacientes recibieron ceftazidima (50 mg/kg/día cada 24 horas) y fueron observados de 2 a 23 horas. Si clínicamente se encontraban estables, comenzaban tratamiento con ciprofloxacina oral (20 mg/kg/día cada 12 horas, dosis máxima 500 mg), y eran enviados a sus hogares con pautas de alarma (mal estado general, fiebre, etc.). El tratamiento con ciprofloxacina continuaba hasta que el niño estuviera 24 horas afebril, tuviera hemocultivos negativos y evidenciara signos de recuperación de la médula ósea.
Los resultados evidenciaron que ciprofloxacina es un antibiótico oral que podría ser eficaz en el tratamiento empírico de neutropenia febril en pacientes pediátricos oncológicos de bajo riesgo. Es una quinolona con actividad contra muchas bacterias Gram negativas, incluidas enterobacterias, pseudomona aeruginosa y algunos Gram positivos. Se absorbe rápidamente por vía oral y tiene buena distribución por todos los compartimientos del cuerpo (23). Sin embargo, no hay experiencia suficiente todavía para recomendarlo como estrategia inicial en niños (24).
Intervenciones adicionales
El uso de inmunomoduladores como los factores estimulantes de colonias (G-CSF y GM-CSF) son ciertamente beneficiosos para un subgrupo de pacientes, pero probablemente son sobreutilizados clínicamente. Pueden acortar la duración de la neutropenia y acelerar la recuperación aunque con variable efecto en la incidencia e impacto de la infección y sin ningún efecto demostrado en la duración de la fiebre, y mortalidad relacionada a infección (2).
La Sociedad Americana de Enfermedades Infecciosas y la Sociedad Americana de Oncología Clínica no recomienda para pacientes neutropénicos con fiebre inexplicada el uso rutinario de factores estimulantes de colonias, aunque se debe considerar su uso en ciertas condiciones tales como en pacientes en los que se espera un empeoramiento de su cuadro clínico y se predice un período largo para la recuperación de la neutropenia. Estas condiciones incluyen neumonías, episodios de hipotensión, celulitis severa o sinusitis, infección fúngica sistémica y disfunción multiorgánica secundaria a sepsis (2).
La bacteriemia que se desarrolla en pacientes con cáncer y neutropenia a partir de la colonización de catéteres endovenosos, puede frecuentemente ser tratada sin la remoción del catéter. Sin embargo, en ciertas infecciones bacterianas, como Bacillus spp, o fúngicas, como Candida species, es necesario remover el catéter. Igualmente, los catéteres deben ser removidos en pacientes con infección del túnel, sea por bacterias, micobacterias u hongos (2).
Conclusión
El tratamiento por vía oral para pacientes con neutropenia febril de bajo riesgo es seguro y económico. Esta estrategia podría adoptarse como terapéutica estandarizada en el futuro (22).
Podrían mencionarse varios beneficios que se obtienen cuando niños neutropénicos febriles de bajo riesgo, cuidadosamente seleccionados, rotan al tratamiento antibiótico oral:
- exposición reducida a patógenos nosocomiales
- reducción del estrés atribuible a la hospitalización
- reincorporación temprana a sus actividades normales
- reducción de los costos del cuidado de la salud (22)
El manejo de los pacientes pediátricos oncológicos con neutropenia febril requiere de su clasificación en alto o bajo riesgo de adquirir infecciones bacterianas invasoras, con el fin de implementar estrategias selectivas de tratamiento (22).
Todos los pacientes pediátricos que presentan episodios de neutropenia febril deben ser ingresados al hospital por al menos 24 horas (25,26). Durante este lapso se efectuará su evaluación clínica y de laboratorio con el objeto de clasificar el riesgo de este episodio y precisar el (los) posible(s) foco(s).
Los pacientes de alto riesgo deben continuar internados hasta su recuperación. Los de bajo riesgo pueden ser manejados en forma ambulatoria. La elección de la terapia antimicrobiana inicial y los criterios para su ajuste deberán basarse en el hallazgo o no de focos infecciosos y en los patrones epidemiológicos e institucionales de susceptibilidad (24).
La reevaluación de ambos grupos debe ser periódica, y la respuesta terapéutica será clasificada como favorable o desfavorable según criterios clínicos y parámetros de laboratorio preestablecidos (27).
El manejo ambulatorio no se puede considerar una estrategia universal, sino que deberá limitarse a pacientes con bajo riesgo de desarrollar una infección bacteriana invasora. Además debe asegurarse que los pacientes puedan acceder al hospital en cualquier momento y sin restricción horaria, de modo de garantizar su oportuna atención las veces que fuera necesaria (24).
Bibliografía
1. Comité Nacional de Infectología Pediátrica. Consenso sobre el cuidado del paciente oncológico neutropénico febril. Actualización 2008-2009, Archivos Argentinos de Pediatría, SAP, Buenos Aires, 2010.
2. Dufort y Alvarez, Gustavo. Guía para el tratamiento del paciente con neutropenia febril, Archivos Pediátricos Uruguayos, 2009.
3. Paganini Hugo. Enfoque clínico y tratamiento de los niños con neutropenia y fiebre, Archivos Argentinos de Pediatría, Buenos Aires, 2007.
4. Intramed. Neutropenia y fiebre, Libros virtuales intramed, www.intramed.net.
5. Lopez Pio, Lopez Eduardo. Neutropenia febril en pediatría, Asociación Colombiana de Pediatría, 2008.
6. Hughes Walter T., Armstrong Donald, Bodey Gerald P., Bow Eric J., Brown Arthur E., Calandra Thierry, Feld Ronald, Pizzo Philip A., Rolston Kenneth V. I., Shenep Jerry L., and Young Lowell S. 2002 Guidelines for the Use of Antimicrobial Agents in Neutropenic Patients with Cancer, Clinical Infectious Diseases 2002.
7. Johnson PRE, Liu Yin JA, Tooth JA. High dose intravenous ciprofloxacin in febrile neutropenic patients, J Antimicrob Chemother, 1990.
8. Winston DJ, Lazarus HM, Beveridge RA, et al. Randomized, doubleblind multicenter trail comparing clinafloxacin with imipenem as empirical monotherapy for febrile granulocytopenic patients, Clinical Infectious Diseases, 2001.
9. Meunier F, Zinner SH, Gaya H, et al. Prospective randomized evaluation of ciprofloxacin versus piperacillin plus amikacin for empiric antibiotic therapy of febrile granulocytopenic cancer patients with lymphomas and solid tumor, European Organization for Research on Treatment of Cancer International Antimicrobial Therapy Cooperative Group, Antimicrob Agents Chemother, 1991.
10. International Antimicrobial Therapy Cooperative Group of the European Organization for Research and Treatment of Cancer. Efficacy and toxicity of single daily doses of amikacin and ceftriaxone versus multiple daily doses of amikacin and ceftazidime for infection in patients with cancer and granulocytopenia, Ann Intern Med, 1993.
11. Rubinstein E, Lode H, Grassi C. Ceftazidime monotherapy vs. ceftriaxone/tobramycin for serious hospital-acquired gram-negative infections, Antibiotic Study Group, Clinical Infectious Diseases, 1995.
12. Hughes WT, Armstrong D, Bodey GP, et al. 1997 guidelines for the use of antimicrobial agents in neutropenic patients with cancer, Clinical Infectious Diseases, 1997.
13. Aditya G, Patricia F, Jerry S. Optimum management of pediatric pa¬tients with fever and neutropenia, The Indian Journal of Pediatrics, 2004.
14. Santhosh-Kumar CR, Ajarim DSS, Harakati MS, et al. Ceftazidime and amikacin as empiric treatment of febrile episodes in neutropenic patients in Saudi Arabia, J Infect, 1992.
15. Heussel CP, Hauczor HU, Heussel G, et al. Early detection of pneumonia in febrile neutropenic patients: use of thin-section CT, AJR Am J Roentgenol, 1997.
16. Guidelines for preventing opportunistic infections among hematopoietic stem cell transplant recipients. MMWR, 2000.
17. Sandherr M, Einsele H, Hebart H, et al. Antiviral prophylaxis in patients with haematological malignancies and solid tumours, Guidelines of the infectious diseases working party (AGIHO) of the German society for Hematology and Oncology (DGHO), Ann Oncol, 2006.
18. Shenep J. L., Flynn P. M., Baker D. K., Hetherington S. V., Hudson M. M., Hughes W. T., Patrick C. C., Roberson P. K., Sandlund J. T., Santana V. M., Sixbey J. W., and Slobod K. S. Oral Cefixime Is Similar to Continued Intravenous Antibiotics in the Empirical Treatment of Febrile Neutropenic Children with Cancer, Clinical Infectious Diseases 2001.
19. Freifeld A, Marchigiani D, Walsh T, et al. A double-blind comparison of empirical oral and intravenous antibiotic therapy for low-risk febrile patients with neutropenia during cancer chemotherapy, N Engl J Med, 1999.
20. Kern WV, Cometta A, De Bock R, et al. Oral versus intravenous empirical antimicrobial therapy for fever in patients with granulocytopenia who are receiving cancer chemotherapy, N Engl J Med, 1999.
21. Lau RC, Doyle JJ, Freedman MH, King SM, Richardson SE. Early discharge of pediatric febrile neutropenic cancer patients by substitution of oral for intravenous antibiotics, Pediatr Hematol Oncol, 1994.
22. Paganini Hugo R., Sarkis Claudia M., De Martino Mónica G., Zubizarreta Pedro A., Casimir Lidia, Fernández Cristina, Armada Ariel A., Rodriguez-Brieshcke María T., Debbag Roberto. Oral Administration of Cefixime to Lower Risk Febril Neutropenic Children with Cancer, American Cancer Society, 2000.
23. Aquino Victor M., Herrera Larry, Sandler Eric S., Buchanan George R. Feasibility of Oral Ciprofloxacin for the Outpatient Management of Febrile Neutropenia in Selected Children with Cancer, American Cancer Society, 2000.
24. Santolaya María Elena, Rabagliati Ricardo, Bidart Teresa, Payá Ernesto, Guzmán Ana M., Morales Ricardo, Braun Stephanie, Bronfman Lucía, Ferrés Marcela, Flores Claudio, García Patricia, Letelier Luz M., Puga Bárbara, Salgado Carmen, Thompson Luis, Tordecilla Juan y Zubieta Marcela. Consenso Manejo racional del paciente con cáncer, neutropenia y fiebre, Revista Chilena de Infectología, 2005.
25. Santolaya M E, Álvarez A M, Avilés C L, et al. Early hospital discharge followed by outpatient management versus continued hospitalization of children with cancer, fever, and neutropenia at low risk for invasive bacterial infection, J Clin Oncol, 2004.
26. Paganini H, Gómez S, Ruvinsky S, et al. Outpatient, sequential, parenteral-oral antibiotic therapy for lower risk febrile neutropenia in children with malignant diseases, Cancer, 2003.
27. Santolaya María Elena, Ávarez Ana M., Avilés Carmen L., Becker Ana, Cofré José, Payá Ernesto, Rodriguez Jaime, Salgado Carmen, Silva Pamela, Tordecilla Juan, Varas Mónica, Villarroel Milena, Viviani Tamara y Zubieta Marcela. Tratamiento selectivo de los episodios de neutropenia febril en niños con cáncer. Comité de Infectología, Programa Infantil Nacional de Drogas Antineoplásicas (PINDA), Revista Chilena de Infectología, 2004.