Las implicaciones de la infección por Helicobacter pylori en la Enfermedad por reflujo gastroesofágico constituye un tema controversial. Se realizó un estudio descriptivo, prospectivo, con el objetivo de evaluar la posible relación entre la Enfermedad por reflujo y el Helicobacter. La muestra se constituyó por 193 pacientes con síntomas de reflujo, a los que se realizó videoendoscopia con biopsia, test de ureasa y manometría esofágica. La prevalencia de la infección fue del 84% y más frecuente entre 45 y 64 años. Predominaron los síntomas típicos y las esofagitis leves, mientras la prevalencia aumentó con el grado de esofagitis. Fueron significativos la hipotonía del esfínter esofágico inferior y los trastornos motores ligeros del cuerpo esofágico relacionados con la bacteria, no así las relajaciones transitorias del esfínter. La infección por Helicobacter pylori favorece la incompetencia del esfínter esofágico inferior y probablemente juega un rol significativo en el daño de la mucosa.
Enfermedad por reflujo gastroesofágico y Helicobacter pylori en pacientes atendidos en el centro de cirugía endoscópica.
Autores:
Dr. Rolando Martínez López. Especialista de primer grado en MGI y segundo grado en Gastroenterología
Dra. Vivianne Anido Escobar. Especialista de segundo grado en Gastroenterología
Dr. C. Raúl Antonio Brizuela Quintanilla. Especialista de segundo en Gastroenterología. Doctor en Ciencias Médicas
Dra. Anniuska Gigato Díaz. Especialista de primer grado en MGI y primer grado en Gastroenterología
Dr. Jorge Luis García-Menocal Hernández. Especialista de 1er grado en Gastroenterología
Dra. Maricela Morera Pérez. Especialista de primer grado en MGI y primer grado en Bioestadística
Institución:
Centro Nacional de Cirugía de Mínimo Acceso. La Habana, Cuba. 2011
RESUMEN
Las implicaciones de la infección por Helicobacter pylori en la Enfermedad por reflujo gastroesofágico constituye un tema controversial. Se realizó un estudio descriptivo, prospectivo, con el objetivo de evaluar la posible relación entre la Enfermedad por reflujo y el Helicobacter. La muestra se constituyó por 193 pacientes con síntomas de reflujo, a los que se realizó videoendoscopia con biopsia, test de ureasa y manometría esofágica. La prevalencia de la infección fue del 84% y más frecuente entre 45 y 64 años. Predominaron los síntomas típicos y las esofagitis leves, mientras la prevalencia aumentó con el grado de esofagitis. Fueron significativos la hipotonía del esfínter esofágico inferior y los trastornos motores ligeros del cuerpo esofágico relacionados con la bacteria, no así las relajaciones transitorias del esfínter. La infección por Helicobacter pylori favorece la incompetencia del esfínter esofágico inferior y probablemente juega un rol significativo en el daño de la mucosa.
Antecedentes del tema
La enfermedad por reflujo gastroesofágico (ERGE) puede definirse como la presencia de síntomas crónicos o daño de la mucosa, producido por el reflujo anormal de contenido gástrico dentro del esófago (1). Es la enfermedad esofágica más frecuente y la condición clínica más común del aparato digestivo (2).
La enfermedad por reflujo gastroesofágico es un importante problema de salud pública. Sus síntomas son comunes en un estimado del 10-40% de los adultos en los Estados Unidos, lo que significa un detrimento importante en su calidad de vida (3). Esto cobra aún más importancia por el conocimiento de que los síntomas crónicos de reflujo son un factor de riesgo independiente para el desarrollo de adenocarcinoma esofágico, que ha tenido un rápido aumento de su incidencia, más que cualquier otro tipo de tumor sólido en el mundo occidental, y con pobre pronóstico, a menos que se diagnostique en etapas precoces de la enfermedad (4) (5).
Las causas que provocan el reflujo son muchas, de las cuales se conoce que una de las principales razones de que el ácido llegue al esófago, es por la motilidad anormal del esfínter esofágico inferior (EEI) (6). La causa de esta disfunción no es bien conocida, pero se ha invocado recientemente que la carditis provocada por una colonización del estómago por el Helicobacter pylori (HP), planteada por la fuerte asociación de ambos, pudiera estar involucrada en dicha incompetencia (7).
En 1983, Warren y Marshall reportaron resultados de observaciones, que databan de unos 4 años antes, sobre la presencia en tejido gástrico de bacilos curvos de forma espiral y cubiertos con una vaina (8). Constataron además, que dichas bacterias se encontraban solamente en las muestras hísticas con signos de inflamación. Estos hallazgos dejaron perplejos a muchos investigadores, entre otras razones, porque era admitido que las bacterias eran destruidas en el medio ácido del estómago antes de que pudieran colonizar la mucosa gástrica y establecerse allí (9).
Estos investigadores confrontaron dificultades para lograr el crecimiento de estas bacterias “desconocidas”, en realidad redescubiertas, en cultivos. En Abril de 1982, ambos autores habían intentado el cultivo de muestras de más de 30 pacientes, en todos los casos sin éxito. Pero en ocasión de Semana Santa y de manera accidental, los platos de cultivo quedaron conservados durante más de 5 días, en vez de los usuales 2 días. Al quinto día brotaron las colonias. Las denominaron Campylobacter, ya que tenían cierta semejanza con el género Campylobacter, que había sido encontrado en el tracto gastrointestinal. No transcurrió mucho tiempo antes de que se advirtiera que estas bacterias no pertenecían, realmente a ese género. De este modo, un nuevo género, Helicobacter, fue creado (10). Los hallazgos de Warren y Marshall fueron confirmados por gran número de investigadores de muchos países y, finalmente, el microorganismo fue denominado Helicobacter pylori. Se reconoció, asimismo, que existía una fuerte asociación entre la bacteria y la gastritis crónica superficial.
En realidad, la existencia de bacterias espiriladas en el estómago de animales y seres humanos era conocida desde la segunda mitad del siglo pasado; dentro de los reportes principales figuran el de Bizzozero en 1893, seguido de Salomon en 1896 (11). Ambos autores encontraron estos microorganismos en perros, gatos y ratones. Posteriormente, en 1906, Krienitz describió microorganismos semejantes en el jugo gástrico de pacientes con cáncer gástrico. Estos hallazgos fueron vistos con cierto escepticismo pues las muestras fueron obtenidas post mortem y la contaminación podía haber sido responsable de la presencia de los microorganismos. Mientras tanto, Luger en 1921, llamó la atención de la ausencia de microorganismos en individuos saludables. Por varios años, continuaron produciéndose, aunque esporádicamente, reportes semejantes, hasta que en 1938 Doenges y St. Louis reportaron la identificación de espiroquetas en el 43% de 242 estómagos humanos estudiados.
A pesar de que los trabajos mencionados señalaban la presencia de organismos espirilados en la mucosa gástrica la hipótesis de la participación de los mismos en cualquier enfermedad gástrica humana tenía escasa aceptación, principalmente, por la creencia, devenida en dogma, de que el estómago era un órgano totalmente estéril debido al ácido.
En 1975 se producen los elegantes trabajos de Steer y Colin Jones quienes encontraron en material de biopsias obtenidas de pacientes con úlcera gástrica, organismos espirilados situados profundamente en la capa de moco en contacto con el epitelio gástrico y proporcionaron, suplementariamente, imágenes de microscopía electrónica bastante consistentes. Estos investigadores propusieron, incluso, la brillante hipótesis de que las bacterias podían disminuir la resistencia de la mucosa como factor predisponente a la formación de una úlcera (12).
Durante más de 100 años los investigadores han realizado esfuerzos colosales para develar las causas de la enfermedad ulcerosa péptica. Casi todos se han concentrado en la acidez gástrica. Sin embargo, excepcionalmente, algunos han examinado la posibilidad de un origen infeccioso. De este modo, la “hipótesis bacteriana” con respecto a la patogenia de la enfermedad ulcerosa puede considerarse articulada en fecha tan temprana como 1875. Algunos investigadores, entre los que figura Kussmaul, en 1868 aconsejaron el uso de sales de bismuto, producto dotado de acción bactericida, para tratar las úlceras. Estos investigadores trabajaron a la sombra de un dogma que afirmaba que en el ácido clorhídrico y la acción colinérgica del nervio vago, que estimula su secreción por las células parietales del estómago descansaba el centro de la patogenia de la enfermedad ulcerosa péptica. Esta creencia constituyó la opinión prevaleciente hasta fecha muy reciente.
Moynihan en 1907 expresó el pensamiento médico ortodoxo cuando se refirió a: “la digestión de la mucosa duodenal por el jugo gástrico hiperácido”. Desde entonces generaciones enteras de médicos fueron educadas en la creencia de que el estrés, ciertos tipos de alimentos y algunos irritantes de la mucosa gástrica como el café, las bebidas alcohólicas y el cigarro estimulaban la secreción de ácido por parte de las células parietales del estómago, y así, una vez resquebrajada la resistencia ofrecida por los factores defensivos de la mucosa gástrica, el resultado era la formación de una lesión ulcerosa.
De esta forma, fueron ampliamente manejados conceptos tales como “La enfermedad ulcerosa se extiende durante toda la vida del enfermo”, y también “El paciente ulceroso hoy es ulceroso siempre”. Conceptos, desde luego avalados por la experiencia de largos años de trabajo de clínicos eminentes, a los que, por cierto, no les faltaba razón, si tenemos en cuenta que una gran parte de estos pacientes ulcerosos padecían una infección por Helicobacter pylori, y al no emplearse antibiótico terapia de erradicación, la misma se perpetuaba durante toda o casi toda la vida. No obstante, un hecho bien establecido, y que mantiene su vigencia, es la relación entre la existencia de úlcera y la secreción clorhidropéptica. Esta observación fue hecha por el científico alemán K. Schwartz, quien en 1910 formuló una afirmación que ha resistido la prueba del tiempo: “Sin ácido no hay úlcera”.
Actualmente sabemos que aunque la acidez gástrica es necesaria para la formación de úlceras, no es suficiente para explicar su ocurrencia. De hecho muchos pacientes con cantidades normales de ácido y otros con altos niveles de producción ácida, nunca desarrollan una úlcera.
John Lykoudis (1910-80), médico griego, en 1950 concluyó que la enfermedad ulcerosa péptica y la gastritis, tenían una causa infecciosa y diseñó un tratamiento antibiótico que administró a cientos de pacientes. Convencido de la validez de su método, apeló a las más altas autoridades de Grecia, incluyendo el Primer Ministro y el Ministro de Salud, pero todo fue inútil. Como éste existen, sin lugar a dudas, otros casos que no están tan bien documentados. Un notable médico español de la primera mitad del pasado siglo fue prácticamente excomulgado por la Academia, al esbozar su hipótesis infecciosa con relación a la patogenia de la úlcera péptica (Prof. Dr. J. M. Pajares: Simposium. La Úlcera Gastroduodenal en los Albores del Siglo XXI. Congreso Cubano de Gastroenterología. Gastro 97. Palacio de las Convenciones. Ciudad de La Habana).
Como consecuencia de los aspectos mencionados, puede asumirse que con relación a la bacteria y sus implicaciones en las enfermedades del tracto digestivo superior, se erigió durante largos, años un auténtico monumento a la “miopía científica”. Tanto es así, que Warren y Marshall declararon una vez, que el hecho de que clínicos y patólogos expertos no tuvieran conocimiento de dicho microorganismo —fácilmente identificable en el microscopio— permanecería, por siempre, como un enigmático misterio (13).
El Helicobacter pylori es una bacteria ligeramente curva, con 4 o 6 flagelos envainados en sus polos, Gram negativa, su tamaño oscila de 0.5 a 1.0 um de ancho y de 2.5 a 4.0 um de longitud. Es movible y microaerofílico.
La bacteria presenta una fuerte capacidad de producción de ureasa y su medio natural es la mucosa gástrica o las áreas donde se ha producido metaplasia gástrica. La bacteria crece en medios de cultivo enriquecidos y en condiciones generalmente alcalinas a una temperatura entre 33 y 40° C (14). Su genoma es circular y su secuencia fue completada por Tomb y cols. en 1997. Dicho genoma tiene 1, 667,867 pares de bases, un tercio de las cuales tiene aún funciones desconocidas (15).
El entorno ecológico del estómago presenta un formidable desafío a la colonización bacteriana. Constantemente recubierto y protegido por una fluida capa mucosa, el epitelio gástrico posee un poderoso escudo que lo defiende de cualquier agente lesivo intraluminal. Potentes ondas peristálticas impiden el estancamiento y, por lo tanto, la acción de los agentes invasores es, necesariamente, de muy corta duración. La secreción ácida normal del estómago genera un jugo gástrico con un pH de 1-2, lo que representa quizás, uno de los obstáculos más fuertes a cualquier agente patógeno potencial. Pero el Helicobacter pylori ha demostrado, en la práctica, estar dotado de atributos que le permiten, de manera inimitable, vencer todas estas dificultades; prueba irrefutable de ello es su inmensa diseminación en el mundo entero, con las más altas tasas de prevalencia por una infección bacteriana en el momento actual, alrededor del 50% en todo el planeta.
Entre los rasgos que lo distinguen están su motilidad y los flagelos envainados que posee. Penetra en la capa mucosa y la horada hasta alcanzar el epitelio gástrico; su propia configuración helicoidal le confiere facilidad para el movimiento. Las cepas bacterianas que carecen de motilidad no están aptas para la colonización
Estudios microbiológicos recientes señalan que la mayoría de los mamíferos portan en sus estómagos organismos similares, pero no idénticos al Helicobacter pylori. Estos microorganismos son altamente diversos y generalmente son específicos de su hospedero. De forma similar, se ha reconocido que el Helicobacter pylori coloniza, únicamente, primates y especialmente a los humanos. Por lo tanto, el hombre es el reservorio natural del Helicobacter pylori y la transmisión de la infección se produce de persona a persona. (16)
A pesar de los esfuerzos que se han llevado a cabo, hoy en día no se conoce con exactitud cómo el Helicobacter pylori se transmite de una persona a otra. Es decir, la ruta de la infección continúa siendo un enigma que no se ha esclarecido completamente (17). Mientras la mayoría de las evidencias epidemiológicas indican que la transmisión se produce de persona a persona, la manera en que esto ocurre no ha podido ser precisada (18) (19). Aunque la infección vertical durante el embarazo y el parto es una vía de transmisión poco probable, la infección horizontal a través de la lactancia materna, puede ocurrir (20).
No obstante los mecanismos de adaptación de que está dotado, el microorganismo es sensible a altos niveles de ácido, por lo que se presume que coloniza el estómago en períodos en que éste se mantiene hipoclorhídrico. Esto puede ocurrir durante una infección por enterovirus, o puede ser causado por una nutrición deficitaria en la infancia (21). Durante los primeros días de vida los bebés tienen escasa acidez gástrica y esta situación puede proporcionarles una oportunidad ideal, para que la infección tenga lugar. Existen evidencias crecientes de que la mayoría de la infecciones por Helicobacter pylori ocurren durante la infancia temprana, antes de que una barrera ácida efectiva contra la colonización se desarrolle; o tal vez, más adelante en la infancia, quizás durante una infección viral entérica.
Hasta la fecha existen escasos datos epidemiológicos que apoyen las transmisión oral-oral (17). Los trabajadores estomatológicos tienen similar prevalencia de infección por Helicobacter pylori que la población general (22). La mayoría de las parejas casadas muestran poca concordancia con respecto a la infección y cuando ambos están infectados, muchas veces, no es por la misma cepa bacteriana (23 - 24). Por otra parte, los pacientes infectados y tratados con éxito no suelen reinfectarse por su cónyuge, cuando éste no ha sido tratado (25). Estos hechos pueden estar en relación con la escasa cantidad de microorganismos que están presentes en la boca. El DNA de la bacteria ha sido encontrado, frecuentemente, tanto en la saliva como en la placa dental (26) (27), pero muy raramente ha sido cultivado de la boca (28) (29). El Helicobacter pylori se ha obtenido de la saliva antes de presentarse vómitos en 19% de los pacientes y después del vómito en el 50% de ellos (17). Por tanto, no conocemos aún hasta qué punto los microorganismos que están presentes, típicamente, en baja cantidad en la boca en comparación con los que están en el vómito, son una fuente de transmisión, pero es poco probable que la diseminación por vía oral-oral sea una ruta importante de transmisión (30) sino, más bien, una forma excepcional cuando, por ejemplo, la madre premastica la comida para su hijo.
La infección por Helicobacter pylori es crónica, transmisible y se caracteriza típicamente por el hecho de que las manifestaciones clínicas de la enfermedad están precedidas por un largo período asintomático. Esta infección, al igual que la provocada por el Streptococcus mutans, que causa las caries dentales, son probablemente las infecciones crónicas bacterianas más frecuentes en el ser humano. Se adquiere típicamente en la infancia y resulta persistentemente transmisible (31).
La prevalencia de la infección por Helicobacter pylori varía con el status socioeconómico de la población. Es muy alta en África, Asia y muchas partes de América Central y del Sur, mientras es relativamente baja en el Norte y Oeste de Europa, Norteamérica y Australia (32). Los países subdesarrollados poseen tasas de prevalencia más altas que los países desarrollados (33).
La infección se adquiere temprano en la vida; a la edad de 10 años más del 50% de los niños de todo el mundo están infectados (34). El factor de riesgo más importante para la adquisición de esta infección bacteriana, parece ser el bajo status socioeconómico de la familia del niño. Cuando se realiza una encuesta pormenorizada, se encuentra que la frecuencia de la infección, en un individuo en particular, está vinculada con el nivel socioeconómico que tuvo durante su infancia y no con su situación actual (35). Los factores asociados con una alta prevalencia de la infección incluyen el hacinamiento en la vivienda, compartir las camas y la ausencia de agua corriente en el hogar (31) (36) (37).
La prevalencia de la infección por Helicobacter pylori en los adultos de cualquier edad en los países occidentales desarrollados oscila entre el 20 y el 40% y alcanza cifras del 60 al 80% en los países del Tercer Mundo (7). Estos datos indican, sin lugar a dudas, que la infección por esta bacteria ocupa uno de los primeros lugares, por su frecuencia, entre todas las infecciones bacterianas que afectan al género humano.
En Cuba son escasos los estudios realizados sobre prevalencia de la infección por Helicobacter pylori en población sana. En un estudio prospectivo de prevalencia, realizado por la Dra. Beatriz Gutiérrez y colaboradores, en el que participaron 121 pacientes adultos, que acudieron a los Servicios de Endoscopia de tres instituciones de Ciudad de La Habana (Instituto Nacional de Oncología y Radiobiología, Instituto Cubano de Gastroenterología y el Centro de Cirugía Endoscópica del Hospital Calixto García), desde Julio de 1999 hasta Agosto del 2000 y cuyos métodos diagnósticos fueron el cultivo microbiológico, el test de ureasa y el estudio histológico con coloración de Giemsa y Gram, la prevalencia de la infección por Helicobacter pylori en pacientes con diagnóstico endoscópico de úlcera gástrica fue de 90.4%, mientras en los pacientes con úlcera duodenal fue del 100% (38).
En un estudio realizado en el Instituto de Gastroenterología (39), hubo una prevalencia global de 90%, mientras en otro realizado en Matanzas (40), la prevalencia fue del 80%.
El Helicobacter pylori se reconoce como un importante factor en el desarrollo de gastritis, úlcera péptica, linfoma tipo MALT y carcinoma gástrico (41-42-43-(44), pero se conoce menos su asociación con la enfermedad esofágica. Los reportes demuestran rangos de prevalencia de la infección por esta bacteria en pacientes con enfermedad esofágica, que varían del 16 al 88% (45). La discordancia puede ser debida a la prevalencia variable según el área, entre otros factores (46), pero el principal señalamiento que se le hace a estos estudios, es su diseño retrospectivo (47) (48).
La presencia de helicobacter pylori justificaría el daño a la mucosa esofágica a través de mecanismos que incluyen: el aumento de la secreción ácida del estómago, el enlentecimiento del vaciamiento gástrico, el aumento de las relajaciones transitorias del esfínter esofágico inferior (RTEEI), la producción de citotoxinas lesivas y la carditis (49-50-51). Desde el punto de vista clínico, está a favor del vínculo, el hecho de que los pacientes portadores de enfermedad por reflujo, mejoran su sintomatología después de un esquema de tratamiento específico para la bacteria en algunas series (52) (53) (54). Al contrario de esto, algunos autores plantean un rol « defensivo » de la bacteria, que evita el daño esofágico, ya que una gastritis severa disminuye la producción de ácido.
Se ha comprobado la actividad modulatoria de la gastrina en el esfínter esofágico inferior (EEI), cuyos niveles séricos están aumentados en pacientes con presencia de Helicobacter pylori, y además el ión amonio producido por la bacteria, funciona como un neutralizador del jugo gástrico (6) (49) (55) (56) (57).
Los defensores de este punto de vista plantean, que la enfermedad por reflujo «empeora» una vez tratado el Helicobacter pylori (HP). Esta contradicción hace que algunos autores cuestionen su papel en la enfermedad por reflujo gastroesofágico y en caso de su asociación, sea necesaria más información para determinar si dicha asociación es casual o no.
Justificación del estudio
La experiencia que hemos alcanzado en el Centro Nacional de Cirugía de Mínimo Acceso, desde su fundación en 1993, con la ejecución de los procedimientos básicos laparoscópicos y a partir de 1995 con la introducción en el país de técnicas consideradas como cirugía laparoscópica de avanzada, ha permitió dirigir nuestras investigaciones a aspectos controversiales, que pueden modificar conductas habituales, favoreciendo la implementación de algoritmos de tratamiento, con relación a la elección de terapia conservadora o quirúrgica.
Determinar la validez de la hipótesis que sustentamos, se puede lograr teniendo en consideración el gran volumen de pacientes que estudiamos y la importante experiencia alcanzada en nuestro centro, realizando un estudio prospectivo que permitirá llegar a conclusiones de alta evidencia, para dar un verdadero aporte científico, en lo que respecta a la fisiopatología de la enfermedad por reflujo gastroesofágico (ERGE), de manera que podamos identificar, la posible asociación entre la presencia de infección por Helicobacter pylori y esta enfermedad, lo que podría ser tomado en cuenta para la solución terapéutica.
El soporte práctico de este trabajo se llevó a cabo por un equipo de gastroenterólogos y enfermeras especializadas, con un estricto sentido de los principios éticos y científicos. El proyecto estuvo íntimamente relacionado con las diferentes líneas de investigación del Centro, que incluye tanto el diagnóstico certero de las afecciones digestivas desde el punto de vista clínico, endoscópico y manométrico, como lo referente al desarrollo de los procederes laparoscópicos básicos y de avanzada, que incluye el adiestramiento continuado en técnicas complejas, lo que permite incrementar el conocimiento de nuestros especialistas, con el enfoque multidisciplinario, interdisciplinario y transdisciplinario que se lleva a cabo en la institución, con el objetivo de elevar el nivel científico-técnico del personal y su competencia profesional e investigativa.
La infección por helicobacter pylori está considerada como condición o agente causal de lesiones en el organismo humano, capaz de evolucionar incluso al cáncer en el tracto digestivo superior y existen criterios contradictorios con relación al manejo de esta infección en la enfermedad por reflujo gastroesofágico (ERGE).
MARCO TEÓRICO.
La acidez y la pirosis son síntomas comunes que afectan entre el 21y el 44% de la población adulta. La Esofagitis o enfermedad esofágica por reflujo, sin embargo, es menos común y afecta solamente alrededor del 2% de los adultos (58).
La enfermedad esofágica por reflujo es un trastorno común caracterizado por la exposición anormal de la mucosa esofágica al contenido gástrico ácido. Esto puede causar síntomas, daño de la mucosa o ambos fenómenos simultáneamente, con una severidad variable.
La necesidad de esclarecer los conceptos y el marco teórico práctico de la enfermedad, ha determinado que se elaboren consensos internacionales, donde los expertos tratan de llegar a opiniones unánimes sobre la enfermedad, en aras de su mejor manejo. Hasta ahora, el consenso global de mayor aceptación y que define la enfermedad, es el Consenso de Montreal del año 2006, desarrollado por un Grupo Internacional de expertos y que ofrece un arma útil en la práctica clínica, permitiendo un mejor diagnóstico y abordaje terapéutico de la Enfermedad por reflujo gastroesofágico. El Consenso global, basado en la evidencia, esclarece diferencias en la terminología, prevalencia y manifestaciones en diferentes países, lo que simplifica el manejo, las investigaciones y establece estudios para la generalización, asistencia a pacientes, médicos y a agencias regulatorias.
La clasificación del Consenso de Montreal, desde el punto de vista sintomático, contempla dos grupos (Fig.1): el primero de ellos se refiere a los Síndromes esofágicos, que incluye los Síndromes sintomáticos (Síndrome típico de reflujo y Síndrome de dolor torácico) y los Síndromes con daño esofágico (que engloba la Esofagitis por reflujo, la estenosis péptica, el Esófago de Barrett y el adenocarcinoma). En el segundo grupo se encuentran los Síndromes extraesofágicos, subdivididos en Asociaciones establecidas (Síndrome tos-Reflujo, Síndrome Laringitis-Reflujo, Síndrome Asma-Reflujo y Síndrome Erosiones dentales-Reflujo) y Asociaciones propuestas (Faringitis, Sinusitis, Fibrosis pulmonar idiopática y Otitis recurrente media). (59)
Figura 1. Síndromes que constituyen la enfermedad por reflujo gastroesofágico (ERGE) según consenso de Montreal del 2006.
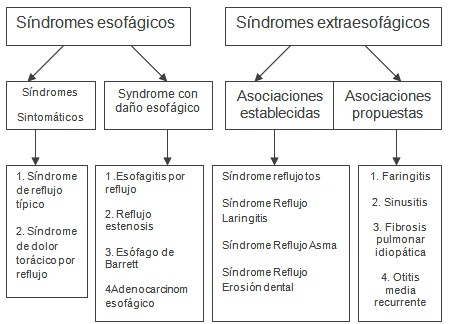
Las manifestaciones clínicas de la Enfermedad por reflujo gastroesofágico son muy diversas, tanto por las características del cuadro clínico (síntomas, lesiones y complicaciones), como por la forma de presentación (típica, atípica). Cursa con síntomas en la mayoría de los pacientes, pero no en todos; es decir, existe una forma asintomática en la que hay lesiones esofágicas e incluso puede aparecer con una complicación, cuyo paradigma es el Esófago de Barrett. Se estima que en menos de la mitad de los pacientes con Enfermedad por reflujo, la mucosa esofágica muestra cambios inflamatorios (esofagitis) visibles con la endoscopia, en un amplio espectro que se extiende desde lesiones de esofagitis leves hasta ulceración, estenosis y metaplasia (esófago de Barrett). La relación entre la presencia e intensidad de la sintomatología y la existencia de lesiones esofágicas es muy imperfecta. Por otra parte, la enfermedad por reflujo gastroesofágico (ERGE) puede manifestarse de forma atípica (manifestaciones supra o extraesofágicas), presentándose con un síndrome clínico que por sus características no parece tener origen en el esófago (laringitis, faringitis, asma, etc.).
La Enfermedad por reflujo se sospecha ante un síndrome clínico compatible. Pirosis y regurgitación son los síntomas capitales (síntomas típicos), aunque inespecíficos. Disfagia y odinofagia son síntomas de alarma que sugieren estenosis péptica o esofagitis grave, al tiempo que obligan a descartar lesiones malignas del esófago. La sospecha diagnóstica es más difícil cuando se manifiesta de manera atípica. El diagnóstico de Enfermedad por reflujo gastroesofágico es formal cuando existen datos objetivos de la enfermedad; son la esofagitis (en ausencia de otras causas de ésta) y/o la evidencia de reflujo gastroesofágico patológico, lo que convierte a la endoscopia y a la pHmetría esofágica, en las mejores pruebas diagnósticas cuando resultan positivas; en cambio, su negatividad no excluye el diagnóstico de la enfermedad. También es aceptable el diagnóstico de Enfermedad por reflujo gastroesofágico ante un síndrome clínico típico (pirosis, regurgitación) que remite con el tratamiento antisecretor (60).
PATOGENIA DE LA ENFERMEDAD POR REFLUJO GASTROESOFÁGICO (ERGE).
Las teorías sobre la patogenia de la enfermedad por reflujo gastroesofágico (ERGE) han evolucionado históricamente desde aquellas que lo relacionaban con factores puramente anatómicos, como la hernia de hiato, hasta las teorías más recientes que señalan la disfunción del esfínter esofágico inferior (EEI) como la causa fundamental del reflujo patológico.
Actualmente el conocimiento más exhaustivo de la fisiopatología de la enfermedad por reflujo gastroesofágico (ERGE), derivado de la introducción de los estudios funcionales (manometría esofágica y pHmetría), permite afirmar que su patogenia es multifactorial, aceptándose que la enfermedad por reflujo gastroesofágico (ERGE) sería el resultado del desequilibrio entre factores defensivos y factores agresivos al nivel de la mucosa esofágica (45).
Así, la barrera anti-reflujo con sus diferentes componentes, el aclaramiento esofágico que permite la normalización del pH intraesofágico merced al peristaltismo primario y la resistencia de la mucosa esofágica actuarían como factores defensivos, mientras el ácido refluido desde el estómago y, en menor medida, la pepsina y las sales biliares actuarían como factores agresivos y mediadores principales de la lesión tisular (6).
La ruptura del equilibrio entre factores defensivos y factores agresivos se produciría fundamentalmente por la disfunción de la barrera anti-reflujo y en menor medida por el compromiso del aclaramiento esofágico.
El paso del contenido ácido y de la pepsina del estómago al esófago es el factor clave en el desarrollo de la enfermedad por reflujo gastroesofágico (ERGE). En condiciones normales la barrera anti-reflujo limita este paso y su disfunción lo facilita. El contacto del material refluido desde el estómago con la mucosa esofágica ocasiona los síntomas y las lesiones histopatológicas características de esta enfermedad (60).
Principales mecanismos responsables de la disfunción de la barrera anti-reflujo (55).
Hipotonía del esfínter esofágico inferior (EEI)
En personas sanas el esfínter esofágico inferior (EEI) presenta un tono basal muestran variaciones a lo largo del día y son modificables en función de incrementos puntuales de la presión intra-abdominal, de la ingesta de determinados alimentos y de la toma de fármacos, fundamentalmente.
La hipotonía esfinteriana que desencadena reflujo patológico puede ser:
• Severa: En este grupo existiría una buena correlación entre la presión del esfínter esofágico inferior (EEI) y la severidad de la esofagitis.
• Hipotonía moderada, con valores presivos basales ligeramente superiores produce reflujo por estrés ante aumentos transitorios de la presión intra-abdominal, coincidentes con descensos de la presión esfinteriana bajo el influjo de fármacos, tabaco o de algunos alimentos.
Relajaciones transitorias inadecuadas del esfínter esofágico inferior (EEI)
Son descensos bruscos y de gran duración (>10 s) de la presión esfinteriana, descensos no relacionados con la deglución y que por lo tanto no se acompañan, en el registro de manometría, de una secuencia peristáltica. El aumento de la frecuencia y/o de la duración de estas relajaciones transitorias del esfínter esofágico inferior (RTEEI) serían responsables del 60-90% de los episodios de reflujo patológico y conllevarían habitualmente una enfermedad por reflujo gastroesofágico (ERGE) leve.
Hernia de hiato
La hernia de hiato (HH), definida como desplazamiento de la unión esófago-gástrica por encima del hiato esofágico del diafragma y que incluye una porción mayor o menor del estómago, ha sido implicada en la patogenia de la enfermedad por reflujo gastroesofágico (ERGE). Su importancia relativa ha variado con el tiempo, pasando de ser el factor patogénico casi único en épocas anteriores a la introducción de los estudios funcionales del tubo digestivo, a permanecer en el olvido cuando la manometría esofágica permitió conocer la importancia de la hipotonía del esfínter esofágico inferior (EEI) en el reflujo patológico. Más recientemente, la hernia hiatal ha vuelto a recobrar relevancia en la patogenia de la enfermedad por reflujo gastroesofágico (ERGE).
La hernia de hiato (HH) favorece el desarrollo de la enfermedad por reflujo gastroesofágico (ERGE) a través de los siguientes mecanismos:
• Pérdida del soporte extrínseco del diafragma crural sobre el esfínter esofágico inferior (EEI).
• Interacción con un esfínter esofágico inferior (EEI) hipotónico, intensificando el grado de incompetencia de la barrera anti-reflujo y aumentando la frecuencia de relajaciones transitorias del esfínter esofágico inferior (RTEEI).
• Dificultando el aclaramiento esofágico mediante el desarrollo del fenómeno del re-reflujo, por el cual, el contenido ácido retenido en la hernia tras un episodio de reflujo volvería nuevamente al esófago tras una relajación transitoria del esfínter esofágico inferior (EEI).
Finalmente, la disfunción del aclaramiento esofágico, relacionada fundamentalmente con trastornos del peristaltismo esofágico y, en menor medida, con la reducción de la secreción salivar y el fenómeno de re-reflujo que condiciona la hernia de hiato cuando está presente, puede contribuir al desarrollo de la enfermedad por reflujo gastroesofágico (ERGE). Además, no podemos dejar de mencionar el papel que la sensibilidad visceral esofágica, aumentada en determinados individuos, juega en la aparición de síntomas de reflujo, incluso en pacientes con tiempo de exposición al ácido normal.
Desde el punto de vista primario, la Enfermedad por reflujo es un trastorno asociado con la incompetencia del esfínter esofágico inferior. El espectro de alteraciones del esfínter esofágico bajo se extiende desde una relajación transitoria inapropiada, hasta una presión basal baja persistente (61) (62). La acidez en el esófago es el factor clave en la patogénesis y se ha reportado que la secreción ácida gástrica es igual en pacientes con Esofagitis por reflujo que en los controles (63). De cualquier manera, los pacientes con una secreción ácida muy elevada se encuentran en riesgo de desarrollar Esofagitis por reflujo (64), y la hipersecreción ácida gástrica se ha encontrado en pacientes con enfermedad esofágica por reflujo refractaria (65).
La complicaciones más importantes de la enfermedad esofágica por reflujo son la Esofagitis erosiva, la estenosis esofágica y el esófago de Barrett, todas ellas son el resultado del daño infligido por el jugo gástrico a la mucosa esofágica (66) (67).
El esófago de Barrett se define como la presencia de epitelio especializado columnar metaplasia de tejido gástrico o intestinal por encima de la unión gastroesofágica. Para confirmar este diagnóstico es preciso realizar una biopsia del tejido sospechoso para su estudio histológico (68). El desarrollo de esófago de Barrett es una de las más graves complicaciones de la enfermedad esofágica por reflujo, debido a la predisposición que conlleva al desarrollo de un adenocarcinoma. Según las evidencias más recientes, el adenocarcinoma en el esófago de Barrett solamente ocurre cuando previamente se producen cambios displásicos (68) (69) (70).
Múltiples clasificaciones de la Enfermedad por reflujo gastroesofágica basadas en criterios endoscópicos existen, la de Los Ángeles es la más aplicada hoy día (48). En síntesis, todas estratifican la gravedad en función de que no exista esofagitis evidente desde el punto de vista endoscópico (enfermedad por reflujo gastroesofágico (ERGE) no erosiva), la esofagitis sea leve (erosiones en la porción distal poco extensas), moderada (erosiones más extensas en sentido longitudinal y/o circunferencial) y grave (presencia de complicaciones).
No obstante, esta categorización no tiene gran valor para decidir el tratamiento inicial, ya que la ausencia de esofagitis no se corresponde con que los síntomas sean más leves o se alivien con más facilidad.
De hecho, la Enfermedad por reflujo no erosiva debe ser tratada inicialmente igual que la que muestra esofagitis. La presencia de esófago de Barrett, coexista o no esofagitis, es un elemento diferencial que categoriza a los pacientes por la necesidad de seguimiento endoscópico con biopsias seriadas, dado el riesgo de malignización (71) (72).
La existencia de estenosis esofágica de aspecto péptico se considera como una complicación de la Enfermedad por reflujo gastroesofágica. De igual forma, la existencia de un Esófago de Barrett se asocia fuertemente con el reflujo, y estos pacientes, en su mayoría asintomáticos, tienen un importante factor de riesgo para el desarrollo de un adenocarcinoma, como se ha mencionado. El diagnóstico y tratamiento de la enfermedad cobra para ellos especial importancia, ya que se evita la progresión del daño histológico y se permite la posterior recuperación de la mucosa por técnicas endoscópicas (73). Cuando en la endoscopia no se comprueba daño de la mucosa distal del esófago, en paciente con síntomas de reflujo gastroesofágico, no podemos conceptuarlo como tal a no ser que se realice una pHmetría con resultados anormales.
El estudio anatomopatológico de la mucosa del esófago es vital en los casos sintomáticos, donde se observe endoscópicamente una Esofagitis distal grado A, ya que los cambios en la endoscopia no son tan definitivos como en los demás grados y se prestan a interpretación personal del endoscopista. También en los demás grados la corroboración del diagnóstico endoscópico con la histología, sobre todo en el Esófago de Barrett, es un elemento clave en la evaluación de extensión del daño y descarta la existencia de displasia o un proceso anarcoproliferativo, lo que cambia la conducta ante la enfermedad (67) (74).
A partir de 1997 comenzaron a difundirse reportes sobre la aparición o el empeoramiento de enfermedad esofágica por reflujo, en pacientes en los que se había erradicado el Helicobacter pylori, producto del tratamiento de una úlcera duodenal (75).
Inicialmente, no existían datos claros que revelaran que los pacientes con reflujo o enfermedad por reflujo, estaban más frecuentemente infectados por Helicobacter pylori, que los controles tanto en adultos como en niños (76).
Un estudio realizado en Japón, encontró una incidencia significativamente baja de infección por Helicobacter, en pacientes con esofagitis por reflujo con respecto a los controles (77). Este hallazgo fue apoyado por otros estudios (78). Estos datos, sugieren la hipótesis de que la infección por Helicobacter pylori puede proteger contra la enfermedad esofágica por reflujo, y lo que es más importante, contra el adenocarcinoma de la unión gastroesofágica. Desde ese momento los cánceres de esta zona fueron reconocidos como una posible complicación de la enfermedad esofágica por reflujo (79) (80) (81).
Hubo reportes iniciales que señalaron que la esofagitis por reflujo podía desarrollarse en sujetos sanos y en pacientes con úlcera duodenal después de un tratamiento exitoso de erradicación de la infección por Helicobacter pylori (82) (83). Como la enfermedad esofágica por reflujo es un trastorno común, estos hallazgos llevados a cabo en estudios a pequeña escala podían ser fruto de coincidencias fortuitas en los grupos de pacientes estudiados. No obstante, no transcurrió mucho tiempo sin que se conocieran los resultados de un estudio controlado más amplio, que puso en evidencia que alrededor de una cuarta parte de los pacientes con úlcera duodenal en los que se erradicó la infección por Helicobacter pylori desarrollaron una enfermedad esofágica por reflujo, documentada endoscópicamente, en un intervalo de tres años de seguimiento después de la curación. En estos pacientes la frecuencia de enfermedad esofágica por reflujo fue el doble de la observada en los pacientes que permanecían infectados (84). Estos hallazgos intrigaron a muchos investigadores (85), lo que condujo a la realización de gran número de estudios con resultados discordantes.
La prevalencia tanto de infección por Helicobacter pylori como de enfermedad esofágica por reflujo se incrementa con la edad. Se dispone de estudios epidemiológicos que muestran que los pacientes con enfermedad esofágica por reflujo tienen similares tasas de incidencia de infección por Helicobacter pylori que los controles, incluso, hay estudios que señalan que una alta proporción de pacientes con esófago de Barrett están infectados por Helicobacter pylori (86). En otros se afirma categóricamente que la erradicación de la infección por Helicobacter pylori no exacerba los síntomas derivados del reflujo en la enfermedad esofágica por reflujo (87).
Los reportes de algunos investigadores de que los pacientes con enfermedad esofágica por reflujo tienen una baja incidencia de infección por Helicobacter pylori y por lo tanto, que la infección no ocasiona esofagitis de reflujo, sino que por el contrario confiere de cierta manera protección contra la enfermedad esofágica por reflujo, tienen su explicación fisiopatológica. Los mecanismos implicados en esta aparente discordancia son complejos, pero giran alrededor de un eje constituido por el hecho que los individuos que desarrollan una infección por Helicobacter pylori que cursa con una pangastritis, con atrofia glandular del cuerpo gástrico, donde se encuentran las células productoras de ácido, con la consiguiente hipoclorhidria, dispondrían como consecuencia de estos eventos, de un escudo protector contra la enfermedad esofágica por reflujo (88).
Mientras tanto, aquellos con una gastritis predominantemente antral, como ocurre en los pacientes que desarrollan una úlcera duodenal, y que tienen una producción muy elevada de ácido, serían proclives a desarrollar una enfermedad esofágica por reflujo. Recientes evidencias han vinculado a la infección por Helicobacter pylori con el desarrollo de inflamación en el área correspondiente al cardias gástrico y hay información disponible que muestra que la carditis es un hallazgo frecuente en los pacientes con enfermedad esofágica por reflujo, por lo que se ha postulado que esta inflamación en el cardias puede comprometer la suficiencia del esfínter esofágico inferior y debilitar su capacidad antirreflujo.
La incidencia del adenocarcinoma del cardias, al igual que el adenocarcinoma esofágico, se ha incrementado en los últimos años. No obstante, en el momento actual la relación entre enfermedad esofágica por reflujo, inflamación de la mucosa del cardias, metaplasia intestinal y carcinoma del cardias no está suficientemente esclarecida. La metaplasia intestinal puede ser el resultado de una gastritis atrófica multifocal, vinculada a la infección por Helicobacter pylori, pero también la infección por Helicobacter pylori pudiera conducir a una enfermedad esofágica por reflujo y al desarrollo de un esófago de Barrett, displasia y cáncer de esófago. Como quiera que sea, en la compleja patogénesis de la enfermedad ulcerosa genuina, el Helicobacter pylori es un factor causal importante pero no suficiente. La erradicación de la infección cicatriza la úlcera activa, y a largo plazo, conduce a una drástica reducción de la recurrencia y las complicaciones de la enfermedad ulcerosa. Algunos pacientes permanecen sintomáticos incluso sin recidiva de la úlcera, y en este tipo de pacientes, puede tener alguna relevancia el hecho de que puede originarse una enfermedad esofágica por reflujo o exacerbarse si ya existía. Pero no debe perderse de vista que la curación de la enfermedad ulcerosa asociada al Helicobacter pylori mejora la calidad de vida del paciente y posiblemente sus expectativas de vida. Los hipotéticos efectos negativos del tratamiento de erradicación del Helicobacter pylori son todavía objeto de vivas controversias (89) (90).
En el futuro tiene importancia crucial diseñar y llevar a cabo estudios que permitan confirmar si la infección por Helicobacter pylori protege contra la enfermedad esofágica por reflujo, el esófago de Barrett y el adenocarcinoma del cardias gástrico y del esófago, y si la respuesta es afirmativa, resultaría interesante dilucidar hasta qué punto es capaz de hacerlo. No está todavía claro por qué se desarrolla metaplasia intestinal en esta región y cuál es el papel que pudiera tener el Helicobacter pylori en el desarrollo de la enfermedad, si esta se relaciona con la existencia de una enfermedad por reflujo, como en el caso del esófago de Barrett o puede ser inducida por la presencia de la bacteria (49) (91).
La manometría esofágica es la prueba diagnóstica que mide las presiones intraluminales en el esófago y la coordinación de la actividad en la musculatura del mismo. A través de esta se diagnostican algunos de los elementos conocidos en la fisiopatología de la enfermedad por reflujo gastroesofágico (ERGE), como son la presencia de Hernia hiatal, hipotonía del esfínter esofágico inferior (EEI) y la presencia de relajaciones transitorias del mismo (92) (93).
Se consideran como Relajaciones Transitorias del Esfínter Esofágico Inferior la caída brusca de la presión de reposo del esfínter a niveles cercanos a la presión intragástrica, sin ser precedidos por deglución voluntaria o no del paciente (94). McNally y colaboradores fueron los primeros en 1964, en describir las relajaciones del esfínter esofágico inferior no inducidas por la deglución, como un mecanismo de la digestión, que permite la expulsión de los gases de la cámara gástrica por vía oral (95), pero no fue hasta 1980 que este fenómeno y su relación con el reflujo gastroesofágico fue descrito en detalle (96).
La mayoría de los sujetos normales presentan episodios de reflujo durante las relajaciones transitorias, relacionado con estímulos conocidos como es la distensión gástrica. Lo anterior no es una sorpresa si sabemos que las relajaciones transitorias del esfínter esofágico inferior son el mecanismo normal, por el cual el gas es expulsado del estómago durante la digestión (97). Sin embargo, en sujetos normales esto es casi totalmente suprimido en posición supina (98) (99) (100). Otro estímulo conocido para dichas relajaciones es la intubación faríngea, ya que la misma se asocia con la fase faríngea de la deglución (101).
El sueño profundo, la anestesia aunque sea ligera y el frío también actúan sobre las relajaciones transitorias del esfínter esofágico inferior, pero disminuyendo su incidencia, por lo que un sujeto acostado o dormido, en circunstancias normales, no debería tener estas relajaciones (102) (103) (104). Se presume que la vía eferente de este mecanismo está mediada por el vago, con la acción de neurotransmisores (94).
Existe consenso sobre la mayor incidencia de reflujos durante las relajaciones del esfínter inferior del esófago en pacientes afectados por la Enfermedad por reflujo gastroesofágico, comparados con sujetos normales (97) (105). Se han reportado frecuencias de 3 a 8 /hora de relajaciones transitorias del esfínter esofágico inferior (RTEEI) en sujetos con esta afección y de 2 a 6 /hora en sujetos normales. Por lo tanto si el organismo utiliza las relajaciones transitoria como un mecanismo de control sobre la distensión gástrica, inhibiendo su presencia en momentos en que pueden razonablemente causar daño sobre la mucosa esofágica, o inclusive provocar episodios de broncoaspiración, el fallo de este mecanismo de control se puede asociar fuertemente con la presencia de reflujo patológico (106).
La presencia de Hernia hiatal e hipotonía del esfínter esofágico inferior (EEI) tienen una buena solución a través de la vía quirúrgica, sobre todo por técnicas de mínimo acceso, independientemente de si existen o no relajaciones transitorias. Pero si el único elemento identificado en la manometría del esófago, como causante de la Enfermedad por reflujo gastroesofágico, es la presencia de dichas relajaciones transitorias, sería de utilidad saber si existe relación sobre esta circunstancia y la presencia de Helicobacter pylori y si la erradicación de la bacteria modifica este patrón, por lo que constituiría el tratamiento de elección para estos pacientes. De demostrarse lo contrario, podríamos proponer cambiar el criterio actual de cirugía, luego del fracaso en el tratamiento médico de la enfermedad por reflujo gastroesofágico (ERGE), ya que estos pacientes se derivarían directamente a esta modalidad y no tendrían que mantenerse meses, con largos y costosos tratamientos médicos, antes de decidir el tratamiento quirúrgico.
En la actualidad, la Asociación Americana de Gastroenterología ha propuesto que las indicaciones clásicas de la manometría esofágica con respecto a la enfermedad por reflujo gastroesofágico (ERGE) fueran modificadas y se considerara la prueba para evaluación preoperatoria de la función peristáltica esofágica, previa a cirugía antirreflujo y por supuesto, como soporte a la pHmetría (59). Sin embargo, consideramos que el papel de este examen va más allá de estas indicaciones, ya que en la manometría consideramos en relación con la enfermedad por reflujo gastroesofágico (ERGE), muchos elementos de gran importancia para comprender la fisiopatología de esta enfermedad, entre los que mencionamos (107):
Esfínter esofágico inferior (EEI) (Evalúa su competencia al identificar la presencia de relajaciones transitorias del esfínter esofágico inferior (RTEEI), la presión media de reposo, su simetría y longitud)
Presencia de Hernia hiatal
Motilidad del cuerpo esofágico
Entonces nos plantearíamos una interrogante, ¿Cuál es el primer mecanismo que permite al ácido llegar al esófago? El orden del suceso no está bien precisado, pero parece plausible plantear que hay un primer episodio, que provoca a su vez un aumento de las relajaciones transitorias del esfínter esofágico inferior (RTEEI), lo que facilita que el contenido llegue al esófago y siga el orden de eventos para que se produzca la enfermedad por reflujo gastroesofágico (ERGE).
Lo que ocurre en la génesis de este primer paso, en el que se desencadena el aumento de las relajaciones transitorias del esfínter esofágico inferior (RTEEI), parece ser un evento multicausal, donde juegan su papel agentes externos como la dieta, agentes tóxicos conocidos, el aumento del peso, etc., pero hay otro agente que no se puede perder de vista y aunque no hay estudios concluyentes y más bien los resultados son controversiales, el Helicobacter pylori - que está bien relacionado con la patología gástrica- se invoca con fuerza como se había relacionado anteriormente.
Para resumir las opiniones contrarias, desde el punto de vista de la fisiopatología, podemos agregar que a favor de la implicación del Helicobacter pylori (HP) en el daño provocado en la enfermedad por reflujo gastroesofágico (ERGE) se encuentra:
El aumento de la secreción de ácido
La disminución del vaciamiento gástrico
El aumento de las relajaciones transitorias del esfínter esofágico inferior (RTEEI)
La producción de citotoxinas lesivas
Carditis
Mientras en contra de esta implicación se recoge:
La atrofia de la mucosa fúndica
Aumento de la gastrina, que aumentaría el tono del esfínter esofágico inferior (EEI)
El ión amonio que producido en gran cantidad neutraliza el ácido
Estos son los hechos aceptados en la actualidad, pero aun en ellos hay cuestiones que no están claras. Por ejemplo, ¿qué importancia podría tener en pacientes a partir de determinada edad, que la erradicación de la bacteria pudiera provocar un nuevo aumento de la secreción ácida, cuando por su edad es posible esperar en ellos cierto grado de atrofia gástrica, que no vamos a mejorar, independientemente del tratamiento antimicrobiano? ¿Es la carditis una prolongación del proceso inflamatorio de todos el estómago, producto del Helicobacter pylori o es una consecuencia de la presencia de ácido en el esófago? ¿Esta carditis es un factor desencadenante de las relajaciones transitorias del esfínter esofágico inferior (EEI), por lo que resolviendo la primera, se resuelve la segunda?
Estas son sólo algunas de las interrogantes más evidentes que se desprenden del problema, por lo que se necesitan más investigaciones para darles respuestas.
OBJETIVOS:
GENERAL:
Determinar la relación entre la Enfermedad por reflujo gastroesofágico y la infección por Helicobacter pylori.
ESPECÍFICOS:
1. Describir la relación entre la edad del paciente y la existencia de infección por Helicobacter pylori.
2. Identificar la posible asociación entre la presencia del Helicobacter pylori con:
Síntomas de reflujo gastroesofágico.
Grados de Esofagitis diagnosticada por endoscopia.
3. Describir la posible correlación entre el Helicobacter pylori y los resultados de la manometría referidos a:
Presión del esfínter esofágico inferior.
Presencia de relajaciones transitorias del esfínter esofágico inferior.
Trastornos motores del cuerpo esofágico.
MATERIAL Y MÉTODO.
Diseño Metodológico.
Tipo de Investigación:
Se realizó un estudio descriptivo, prospectivo, con el objetivo de evaluar la posible relación existente entre la Enfermedad por reflujo gastroesofágico y la infección por Helicobacter pylori, en pacientes atendidos en el Departamento de Gastroenterología del Centro Nacional de Cirugía de Mínimo Acceso, en el período comprendido de enero del 2007 a enero del 2010.
Universo de estudio:
Estuvo constituido por 716 pacientes atendidos en el Servicio de Gastroenterología del Centro Nacional de Cirugía de Mínimo Acceso, provenientes de consulta externa o remitidos desde otra institución durante el período referido, los que se realizaron videopanendoscopia por presentar síntomas de Enfermedad por reflujo gastroesofágico.
Muestra:
Estuvo constituida por 193 pacientes que cumplieron con los criterios que se citan a continuación:
Criterios de elegibilidad:
- Pacientes con sintomatología típica de reflujo gastroesofágico, disfagia de causa no orgánica y/o dolor torácico de causa no cardiaca, que se realizaron videoendoscopia superior y Manometría Esofágica en nuestra institución, cumpliendo en esta última con los siguientes criterios de indicación:
• En la disfagia de causa no orgánica
• En el dolor torácico no cardiogénico
• Como estudio previo a la Cirugía anti reflujo
- Pacientes con 15 años y más.
- Consentimiento informado de participación del paciente en la investigación. (Anexo 1)
- Pacientes sin Sangramiento Digestivo Alto, de cualquier causa.
- Pacientes sin Neoplasia digestiva diagnosticada.
- Pacientes sin Acalasia.
Todos los pacientes incluidos en la muestra completaron la dinámica prevista para la investigación, por lo que no hubo salida de casos del estudio después de obtener el resultado de la manometría.
Consideraciones éticas del estudio
El estudio está justificado desde el punto de vista ético, ya que se realizó conforme a los principios establecidos en la declaración de Helsinki: (108)
1. Los pacientes incluidos obtienen beneficio de los estudios que se realizan, conociendo que forman parte de los establecidos y seguidos internacionalmente en la enfermedad por reflujo gastroesofágico (ERGE).
2. El cuidado que recibieron los sujetos y las decisiones tomadas fueron responsabilidad del equipo médico, debidamente calificado, que participó activamente en la investigación.
3. A los pacientes incluidos se les solicitó su consentimiento por escrito, luego de haber sido instruidos debidamente acerca de las características del estudio, sus objetivos, beneficios y riesgos posibles e informados sobre su derecho a participar sin exponerlos a limitaciones para su atención u otro tipo de represalia.
4. Se respetó la integridad de los pacientes dentro de la investigación, asegurando la confidencialidad de toda la información personal recogida durante esta.
5. Ningún investigador participante en el estudio utilizó formas coercitivas ni influyó sobre el paciente, para obtener su participación en la investigación.
6. El lenguaje que se utilizó durante las entrevistas no fue técnico, sino práctico y comprensible.
Una vez aplicados los criterios expuestos anteriormente, se procedió al estudio de los pacientes, los cuales conformaran la muestra de esta investigación.
Procedimiento.
Dinámica de Trabajo
Se incluyeron todos los pacientes que acudieron al Departamento de Gastroenterología del Centro Nacional de Cirugía de Mínimo Acceso, para realizarse una videopanendoscopia diagnóstica bajo indicación facultativa, por presentar síntomas de reflujo gastroesofágico (Síndromes esofágicos de Enfermedad por reflujo).
Previa explicación del proceder a realizar y después de aplicar anestesia orofaríngea con spray de Xylocaina, se colocó al paciente en decúbito lateral izquierdo, se insertó la boquilla entre ambas arcadas y realizó la exploración endoscópica por parte del personal médico especialista del departamento, auxiliado por dos enfermeras entrenadas, una de ellas para asistir al paciente y la otra para instrumentar al médico. El estudio se llevó a cabo utilizando un videoendoscopio Olympus GIF-260, realizando exhaustiva exploración del esófago y la unión esófago-gástrica, además del resto de la mucosa hasta la segunda porción del duodeno.
Durante la videoendoscopia, se tomó muestra de tejido gástrico de antro y cardias, para realizar Test de Ureasa (con reactivo Urepyl, de fabricación nacional y patentado en el Instituto Nacional de Gastroenterología) y se obtuvieron también muestras para diagnóstico del Helicobacter pylori en tejido, empleando la técnica de hematoxilina-eosina, además de la realización de biopsias del esófago distal, por encima de la unión esófago-gástrica, para precisar o confirmar la existencia de afección esofágica. Después de concluido el estudio, se entregó informe por escrito de los resultados de la exploración endoscópica, especificando la presencia de esofagitis distal y su gradación según la clasificación endoscópica de Los Ángeles, así como la presencia de Hernia hiatal y la sospecha de incompetencia del esfínter esofágico inferior.
A todos los pacientes con algún grado de esofagitis, se les explicó la necesidad de realizar Manometría esofágica en nuestro propio centro, como parte del estudio de su enfermedad, comentándole que de aceptar este segundo estudio, estaba en condiciones para participar en una investigación, la que sin otras implicaciones, solo utilizaría los resultados de la endoscopia, las pruebas realizadas durante esta y el estudio manométrico, para llegar a conclusiones relacionadas con la Enfermedad por reflujo gastroesofágico.
La manometría esofágica, en los pacientes con criterio de indicación y que consintieron en realizársela para participar en el estudio, se realizó por el sistema pneumohidráulico de perfusión de capilares, programa Polygraph 98, actualizado en el 2001.
Se detalló enfáticamente la presencia de relajaciones transitorias del esfínter esofágico inferior (RTEEI), mientras secundariamente se detallaron otros resultados para precisar la competencia del esfínter esofágico inferior (EEI) (presión basal, simetría, relajación en respuesta a la deglución provocada), las características de la motilidad en el cuerpo esofágico, datos que serían los utilizados para la investigación, mientras se incluyó el esfínter esofágico superior (EES) para completar el estudio. Se consideraron los siguientes valores para estos parámetros:
Esfínter esofágico inferior (EEI)
• Hipotónico: < 14,3 mmHg
• Normotónico: 14,3 a 34,5 mmHg
• Hipertónico: > 34,5 mmHg
• Índice de relajaciones del esfínter esofágico inferior (EEI): superior a 90% se considera normal
Cuerpo del esófago
• Trastorno motor ligero: Hasta un 60% de peristalsis normal
• Trastorno motor moderado: Entre 60 y 40% de peristalsis normal
• Trastorno motor severo: Menos de un 40% de peristalsis normal.
Finalmente y después de obtener los resultados de la endoscopia, test de ureasa, estudio histológico y manometría, quedaron conformados dos grupos de pacientes con enfermedad por reflujo gastroesofágico (ERGE), uno con Helicobacter pylori positivo y otro que incluyó los pacientes que no estaban infectados.
Procesamiento de la información y análisis estadísticos.
Descripción de las variables:
1. Edad: se dividirá en 6 grupos de edades, con intervalo de 10 años cada uno, excepto los de 65 y más años de edad.
2. Síntomas típicos de reflujo gastroesofágico (RGE): se tendrán en cuenta como síntomas típicos la pirosis y las regurgitaciones.
3. Otros síntomas de reflujo gastroesofágico (RGE): incluye el dolor torácico de origen con cardiaco y la disfagia como síntoma de alarma.
4. Esofagitis según clasificación endoscópica de Los Ángeles: se clasificará en 5 grados, en dependencia de las lesiones encontradas, como se expone a continuación:
• A: Una o más rupturas de la mucosa, en un cuadrante, cada uno no mayor de 5 mm.
• B: Al menos una ruptura de la mucosa, mayor de 5 cm de largo, confinada a un cuadrante, pero no continua entre el borde superior de esas rupturas.
• C: Al menos un rompimiento de la mucosa continuo, entre los ápices de dos o más bordes superiores de los desgarros, pero que incluye menos del 75% de la circunferencia
• D: Al menos un rompimiento de la mucosa, que involucra al menos 75% de la circunferencia del esófago.
• E: Esófago de Barrett.
5. Diagnóstico de Helicobacter Pylori por Test de ureasa: para este examen se emplea el reactivo Urepyl, depositando una gota de este en un vial que contiene un fragmento de tejido gástrico, tomado con pinza de biopsia a través del canal de trabajo del endoscopio. El resultado se define como positivo, cuando cambia el color amarillo claro del reactivo, al ponerse en contacto con la urea que produce la bacteria, tomando un color rojo fucha. Es negativo cuando no se produce cambio de coloración.
6. Diagnóstico de Helicobacter Pylori por biopsia de antro y cardias: se obtuvieron muestras de tejido gástrico del antro y el cardias con pinza de biopsia, durante la videoendoscopia, las que serán colocadas sobre papel de filtro y depositadas por separado y debidamente rotuladas, en frascos con formol al 70%. Se incluyeron en parafina y se realizó tinción con hematoxilina – eosina para el diagnóstico de Helicobacter pylori en tejido y en los casos dudosos, mediante coloración de plata Warthin-Starry. Se informó como positivo cuando se detectó la bacteria y negativo en caso contrario. La presencia de la bacteria en solo una de las muestras de tejido, independientemente del lugar de la toma, se consideró positivo.
La presencia del Helicobacter pylori, al menos en uno de los estudios (test de ureasa o biopsias), se consideró finalmente como infección del paciente por la mencionada bacteria.
7. Relajaciones transitorias del esfínter esofágico inferior en la manometría esofágica: se definió en el estudio manométrico la presencia o no de relajaciones transitorias del esfínter esofágico inferior (EEI) y se informó como presente en caso de existencia de las mismas o ausente en el caso contrario.
8. Presión basal del esfínter esofágico inferior (EEI): se definió en el estudio manométrico la presión basal del esfínter esofágico inferior (EEI), que en dependencia de las presiones registradas, se clasificó en:
Normotónico: Cuando la presión registrada en el esfínter esofágico inferior (EEI) se encontró entre 14.3 -34.5 mmHg.
Hipotónico: Cuando la presión registrada en el esfínter esofágico inferior (EEI) se encontró por debajo de 14.3 mmHg.
Hipertónico: Cuando la presión registrada en el esfínter esofágico inferior (EEI) se encontró por encima de 34.5 mmHg.
9. Motilidad del cuerpo esofágico: Se definió en el estudio manométrico el porcentaje de ondas normales y anormales, lo que posteriormente se informó como:
Peristalsis normal: más de 90% de ondas peristálticas normales
Trastorno motor ligero: más de 60% de ondas peristálticas normales
Trastorno motor moderado: entre 40 y 60% de ondas peristálticas normales
Trastorno motor severo: menos de 40% de ondas peristálticas normales
Tratamiento de los datos registrados.
Los datos se recogieron en una planilla confeccionada al efecto (Anexo 2), que incluyó los datos generales del paciente, el número asignado en la investigación, datos clínicos en relación con la enfermedad de base, resultados de los estudios: endoscopia, biopsia, test de ureasa y manometría.
Cada planilla se completó por el investigador principal, quien fue el encargado de velar por el llenado adecuado de los acápites y su conservación.
Posteriormente los datos fueron vertidos a una base de datos en formato Microsoft Office Excel, la que luego se utilizó para hacer los reportes necesarios para el final de la investigación.
La información recolectada fue llevada a una hoja de datos de Microsoft Office Excel y luego utilizada la misma por el programa estadístico SPSS 11.5.1 para Windows para confeccionar las tablas, obtener las frecuencias absolutas y relativas (porcentajes), así como realizar gráficos, que en conjunto ayudaron a interpretar de manera más adecuada los resultados obtenidos durante la investigación.
Con el programa SPSS también se realizaron pruebas de asociación estadística entre las variables del estudio y la presencia de la infección por Helicobacter Pylori. La asociación estadística univariada se consideró estadísticamente significativa cuando el valor de la p en el estadígrafo Chi Cuadrado estuviera por debajo de 0.05 (95% de confiabilidad).
Para dar salida a los objetivos propuestos se utilizaron los siguientes tratamientos:
- Para las variables de grupos etarios y sexos se realizó análisis de frecuencias absolutas, relativas y porcentajes, representándose en tablas y gráficos.
- Para la variable diagnósticos endoscópicos se realizó análisis de frecuencias absolutas, relativas y porcentajes, representándose en tablas y gráficos.
- Se utilizó la determinación de Razón de tasas para encontrar la relación posible existente entre variable síntomas y variable presencia de la bacteria.
RESULTADOS.
Al analizar los resultados de la posible relación existente entre la Enfermedad por reflujo gastro-esofágico y la infección por Helicobacter pylori, en el grupo de pacientes a los que se les realizó manometría esofágica, estuvo integrado por 193 pacientes, 130 pertenecientes al sexo femeninos, que representan el 67% del total y 63 del sexo masculinos, para el 33% (Gráfico 1), con rango de edad de 8 a 72 años y media de 47 años.
Gráfico Nº 1: Distribución de los pacientes con enfermedad por reflujo gastroesofágico (ERGE) según sexo.
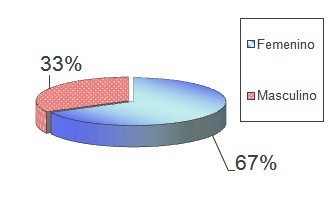
Fuente: Base de datos de la investigación
En la tabla 1 se muestra que mas de las ¾ partes de los pacientes con enfermedad por reflujo gastroesofágico (ERGE) (84.5%) presentan infección por Helicobacter pylori, con mayor prevalencia en los grupos de edades entre 45 y 64 años. Los pacientes en las edades por debajo de los 25 años, mostraron la prevalencia más baja del grupo estudiado.
Tabla Nº 1: Distribución de los pacientes con enfermedad por reflujo gastroesofágico (ERGE) según edad y presencia de infección por Helicobacter Pylori.
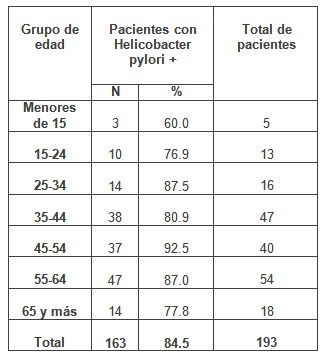
Fuente: Base de datos de la investigación
Al analizar los síntomas que motivaron el estudio y su posible relación con la infección por Helicobacter pylori, lo que se muestra en la tabla 2, se observa la presencia de síntomas típicos (pirosis y regurgitación) en el 73.6% de los pacientes que conformaron la muestra de la investigación, la disfagia fue el síntoma referido en el 19.2% de los casos, mientras el dolor torácico de origen no cardiaco, se presentó en el 13.5% de los casos.
Tabla Nº 2: Distribución de pacientes estudiados según síntomas que motivaron la indicación de manometría y su relación con el Helicobacter Pylori.
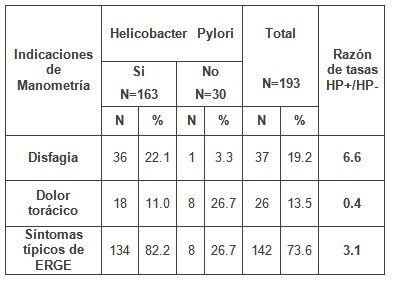
Fuente: Base de datos de la investigación
Cuando se analiza la Razón de tasas Helicobacter pylori (HP)+/Helicobacter pylori (HP)-, en relación con la posible relación existente entre los síntomas que motivaron la indicación de este estudio y la presencia de la bacteria, se obtuvo que es la disfagia aproximadamente 6 veces más frecuente en los pacientes con helicobacter que en los que no lo tienen, algo similar sucede con los síntomas típicos de reflujo gastroesofágico, en que estos son tres veces más frecuentes en los que tienen la infección. En el caso del dolor torácico no sucede lo mismo, pues la tasa es mayor en los que no tienen helicobacter pylori a razón de 0.4, o sea, la mayoría de los pacientes con dolor torácico de origen no cardiaco, no estaban infectados.
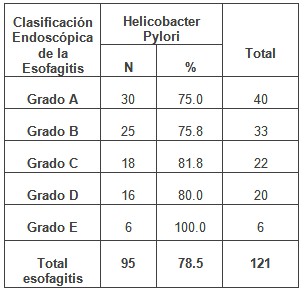
Tabla Nº 3: Distribución de pacientes estudiados según la clasificación endoscópica de esofagitis y su relación con el Helicobacter Pylori.
Fuente: Base de datos de la investigación
Al distribuir los 121 pacientes según los grados de esofagitis por la clasificación de Los Ángeles, lo que se muestra en la tabla 3, se observa que predominaron los grados más leves (A y B) de la clasificación, mientras el porcentaje de pacientes con Helicobacter pylori se eleva a medida que aumenta el grado de afección esofágica hasta el grado E, en el que el 100% de los pacientes se asocian a la presencia de la mencionada bacteria.
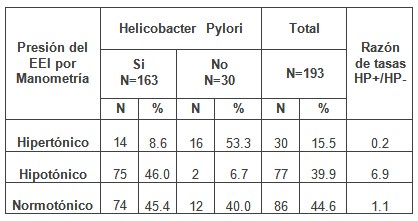
Cuando se relacionan las presiones del esfínter esofágico inferior (EEI) en los pacientes con enfermedad por reflujo gastroesofágico (ERGE) y la presencia o no de infección por helicobacter (tabla 4), se observa que predominaron los esfínteres normotónicos, sin embargo, la hipotonía fue 6.9 veces más frecuente en los pacientes con esta infección, no mostrando tasas de significación, la asociación de la bacteria en los casos con presiones del esfínter normal o alta.
Tabla Nº 4: Distribución de pacientes con enfermedad por reflujo gastroesofágico (ERGE) según presión del esfínter esofágico inferior (EEI) y su relación con Helicobacter pylori.
Fuente: Base de datos de la investigación
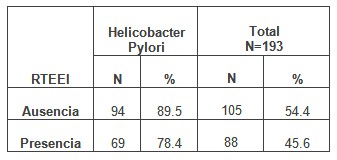
En el caso de las relajaciones transitorias del esfínter esofágico inferior (EEI), que se muestra en la tabla 5, se puede observar que en más de la mitad de los casos (54.4%) no fueron evidentes, mientras la presencia de dichas relajaciones es ligeramente mayor en los pacientes que no presentan la infección por Helicobacter Pylori.
Tabla Nº 5: Distribución de pacientes estudiados según relajaciones transitorias del esfínter esofágico inferior (RTEEI) y Helicobacter pylori
p= 0.054
Fuente: Base de datos de la investigación
No existe una asociación estadísticamente significativa entre las variables relajaciones transitorias del esfínter esofágico inferior (RTEEI) y la infección por Helicobacter pylori en nuestros pacientes.
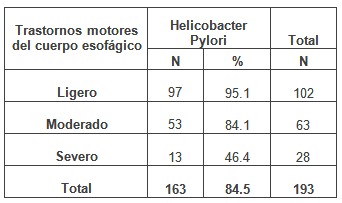
En la tabla 6 se relacionan los trastornos motores del cuerpo esofágico con la presencia del Helicobacter pylori, observándose una asociación estadísticamente significativa entre las alteraciones motoras de este órgano y la presencia de dicha infección bacteriana.
Tabla Nº 6: Distribución de pacientes estudiados según la presencia de Trastornos motores del cuerpo esofágico y su relación con el Helicobacter pylori.
p= 0.000
Fuente: Base de datos de la investigación
Predominaron los trastornos motores ligeros y moderados en más de la mitad de los casos con la infección (165 pacientes), pero no resultó de igual forma en el trastorno severo, que es ligeramente más frecuente en los casos con Helicobacter pylori negativo.
DISCUSIÓN.
Actualmente la enfermedad por reflujo gastroesofágico alcanza proporciones epidémicas y es considerada como la afección gastrointestinal alta más frecuente en el mundo occidental, mientras el impacto de sus síntomas repercute en la calidad de vida de manera importante, en los ámbitos social, laboral y psicológico de los pacientes (45) (49) 109) (110) (111).
Las aristas que imbrican a la Enfermedad por reflujo gastroesofágico y el Helicobacter pylori, aspectos teóricos que abordamos en este trabajo, resultan un tema sumamente atractivo y son justamente las controversias que han establecido los investigadores, lo que mantiene el tema en actualidad (7) (49) (38) (107) (112).
La enfermedad por reflujo gastroesofágico (ERGE) es una enfermedad que puede presentarse en cualquier etapa de la vida, pero tiene un alza entre los 40 y los 60 años. Nuestros resultados apoyan estas aseveraciones, pues la mayor prevalencia de nuestra serie de pacientes correspondió a los grupos entre 45 y 65 años de edad.
En edades extremas de la vida, el estudio de la Enfermedad por reflujo tiene consideraciones diferentes.
En los menores de un año, se presenta el conocido reflujo fisiológico, que tras la maduración de los esfínteres, tiende a resolverse espontáneamente después del año de nacido. Durante este periodo, las orientaciones higiénico dietéticas, unidas a la terapia farmacológica, suelen paliar el problemas sin grandes implicaciones; sin embargo, puede resultar necesario el estudio en caso que los síntomas sean pertinaces y comprometan el desarrollo pondoestatural. En estos niños pueden existir anomalías congénitas, como es el caso de grandes hernias hiatales y pueden evolucionar haciendo complicaciones como es la broncoaspiración del material refluido.
En este grupo el diagnóstico puede ser confirmado por la pHmetría esofágica, después de esta edad se hace complejo el proceder, hasta que los niños no son mayores y capaces de cooperar con los estudios. En las personas muy ancianas o en pacientes con severo deterioro de su estado físico, es cuestionable la utilidad de la manometría esofágica, ya que por lo general este grupo no tiene criterio de cirugía y resulta suficiente el diagnóstico clínico, radiológico y endoscópico, para instaurar un tratamiento que mejore la calidad de vida (107) (113) (114) (115).
Aunque el sexo no la contemplamos dentro de los objetivos de nuestra investigación, por no considerárselo necesario en relación con la infección por Helicobacter pylori, exponemos la distribución en un gráfico como información complementaria. Al respecto comentamos que en el grupo de pacientes estudiados por enfermedad por reflujo gastroesofágico (ERGE), se presentó una prevalencia del sexo femenino, el que representó el 67% del total de los casos.
Según estudios revisados (116), no existe predilección por género en esta enfermedad aunque se plantea que es más común en hombres, con relación 2:1 – 3:1 para la Esofagitis y en el Esófago de Barrett, que en la evolución natural de la enfermedad, constituye el eslabón más alto de la clasificación de los Ángeles, la relación hombre – mujer es 10:1, lo que difiere de nuestros resultados, sin embargo este reporte coincide con nosotros, en la edad de presentación por encima de los 40 años.
En un estudio rumano recientemente publicado (80), se muestran cifras similares a las nuestras, en el que la edad promedio de los pacientes fue de 51 años y predominaron las mujeres con el 63.4%, en una serie de 112 casos estudiados por enfermedad por reflujo gastroesofágico (ERGE) y Helicobacter pylori.
En los países occidentales desarrollados, la prevalencia de la infección en los adultos oscila entre el 20 y el 40%, pero alcanza cifras hasta del 80% en las naciones del Tercer Mundo, ocupando uno de los primeros lugares, por su frecuencia, entre todas las infecciones bacterianas que afectan al humano.
La infección, desde el punto de vista de su prevalencia y adquisición se divide en 2 grandes grupos. El primero constituido por los países donde la mayoría de los niños se infectan durante la infancia y en los cuales la infección crónica persiste durante la edad adulta. Mientras el otro, está configurado por aquellos países en los cuales solo una minoría de los niños que viven actualmente están infectados, pero la prevalencia aumenta con la edad durante la etapa adulta, en los que interviene el denominado efecto de cohorte o generacional, que suele encontrarse en poblaciones en las que se ha modificado de modo importante las condiciones socioeconómicas en las últimas décadas.
La prevalencia de la infección por Helicobacter pylori en nuestro grupo de pacientes con Enfermedad por reflujo fue del 84.5%, lo que representan las ¾ partes y constituye una cifra elevada. No nos referimos a prevalencia en población sana. En un estudio realizado hace algunos años en Navarra, España, el Dr. Sanz de Villalobos y col. (117) relacionaron el reflujo gastroesofágico y el Helicobacter pylori, describiendo que la prevalencia de la infección por este microorganismo era muy superior en los pacientes con enfermedad por reflujo gastroesofágico (ERGE) (60%), al comparar con los pacientes sanos (que entonces se estimaba en un 5% a 10% de la población); sin embargo varios estudios han estimado que la prevalencia de la mencionada bacteria en pacientes con enfermedad por reflujo gastroesofágico (ERGE) oscila entre el 25% y el 74,5% y en los trabajos con población control no existen diferencias significativas en cuanto a la proporción de infectados entre pacientes con Esofagitis y pacientes con endoscopia normal (118) (119) (120) (121) (122) (123).
Si no existen diferencias en la prevalencia de helicobacter entre pacientes con enfermedad por reflujo gastroesofágico (ERGE) y población general, nuestras estadísticas se comparan con la de los países en vías de desarrollo, clasificados en el primer grupo y donde la infección se adquiere desde la infancia, como sucede en Nigeria con el 85% de prevalencia en población general, en Argelia con 79% y en Costa de Marfil con 73%, contrario a los países desarrollados, que se ubican en el segundo grupo, como es el caso de Estados Unidos con 52%, Inglaterra con 56,9%, Japón con 50% y Francia con el 25% de prevalencia (124).
A pesar de que en nuestro estudio la prevalencia es elevada, comparándose con la existente en países africanos, que muestran malas condiciones socioeconómicas, cuando se desglosa por grupos de edades, llama la atención que la prevalencia tiende a ser más baja en los grupos más jóvenes, comportamiento que se acerca al segundo grupo, no obstante para este comportamiento no tenemos explicación, si conocemos que en materia de salud, nuestro país exhibe resultados similares al de países desarrollados, no obstante esto puede estar en relación con la mayor incidencia de la bacteria en nuestra área geográfica, como fue reconocido en el Consenso de Montreal del 2006 (107) (124).
Con relación a los síntomas presentados por los pacientes y que fueron incluidos en nuestra serie, observamos que las manifestaciones típicas de reflujo gastroesofágico y la disfagia predominaron de forma significativa en los pacientes con Helicobacter pylori, no así el dolor torácico que fue muy escasamente referido por los pacientes infectados. Al comparar nuestros resultados con otros estudios, encontramos que la mayoría de las series, incluyendo grandes meta-análisis, no evidencian asociación entre la presencia del Helicobacter pylori y los síntomas de reflujo gastroesofágico (80) (125) (126) (127) (128) (129) (130).
No obstante a la mayoría de los resultados, en la literatura revisada encontramos un estudio reciente que relaciona la presencia de la bacteria con un incrementos de los síntomas provocados por reflujo gastroesofágico, la detección de marcadores inflamatorios y factores de patogenicidad de la bacteria, como es la proteína CagA, que está codificada por el gen CagA y se observa en el 60 – 70% de los aislamientos de cepas de Helicobacter pylori, asociada con la mayor severidad de la Enfermedad por reflujo (131). Mientras otro reporte de finales de la década de los 90, asevera también en sus resultados, el rol de la mencionada bacteria en su asociación con los síntomas típicos y severidad de la enfermedad por reflujo gastroesofágico (ERGE) (132).
En una publicación realizada en Aliment Pharmacol Ther del 2001 (133), el Dr. Dent del Royal Adelaida Hospital en Australia, presentó un estudio con 86 pacientes portadores de úlcera gástrica y duodenal infectados por Helicobacter pylori, de ellos el 31% tenían además una Enfermedad por reflujo gastroesofágico; después de 1 a 3 de tratamiento erradicador, en la mitad de los pacientes persistían los síntomas de reflujo, mientras que en los pacientes que no tenían enfermedad por reflujo gastroesofágico (ERGE), al mismo tiempo de la erradicación, el 6% de los casos desarrollaron síntomas de reflujo, lo que evidencia incluso en un mismo trabajo el comportamiento controversial entre la infección por la bacteria y los síntomas de reflujo.
Cuando se analiza la distribución de pacientes según el grado de severidad de la esofagitis por la clasificación de Los Ángeles, se observa que predominaron los grados más leves de la enfermedad (grado A y B), mientras nos llama la atención, que la prevalencia del Helicobacter aumenta en la muestra en relación proporcional al grado de afección esofágica desde el punto de vista endoscópico, lo que coincide con los resultados anteriores, en el que los síntomas principales de la enfermedad por reflujo gastroesofágico (ERGE) concuerdan con la mayor prevalencia de la infección, aunque no siempre las presencia y severidad de los síntomas de reflujo, se corresponden con daño esofágico.
En este sentido cabe interpretar, que en nuestros casos se debe cumplir el aspecto fisiopatológico que apoya el daño del esófago y que se explica por el aumento de la secreción de ácido y la disminución del vaciamiento gástrico, que implica un mayor volumen y calidad del contenido gástrico dañino al esófago, el aumento de las relajaciones transitorias del esfínter esofágico inferior (RTEEI), que favorece los episodios de reflujo, la producción de citotoxinas lesivas y la Carditis que provoca la infección por la bacteria.
Para nuestros pacientes, la infección por Helicobacter influye favoreciendo el desarrollo de la enfermedad por reflujo, ya que las formas más graves de esofagitis, coinciden con las prevalencias más altas de la bacteria, hecho que comparten otros autores al analizar sus resultados, en el que incluso se plantea factores genéticos que sugieren un posible mecanismo de influencia del Helicobacter pylori en la patogenia de la enfermedad por reflujo gastroesofágico (ERGE) (129) (134) (135) (136) (137).
Mientras tanto, otro grupo mayor de reportes apoyan el papel protector del Helicobacter pylori en la Enfermedad por reflujo gastroesofágico, aludiendo la atrofia de la mucosa fúndica, con la consiguiente disminución en la producción de ácido clorhídrico y pepsina, que participan como factores agresivos a la mucosa esofágica, el aumento de la gastrina, que por su mecanismo de acción aumenta el tono del esfínter esofágico inferior (EEI) y refuerza la barrera antirreflujo, además de la producción de grandes cantidades del ión amonio por parte de la bacteria que ayuda a neutralizar el ácido contenido en el estómago (138) (139) (140) (141) (142).
La infección por Helicobacter pylori y su papel en el desarrollo de esófago de Barrett (que corresponde con la Esofagitis grado E, de la clasificación de Los Ángeles), no ha sido determinada en forma clara, esta interrogante es aún mayor cuando se consideran otros factores asociados a la infección, como lo es la presencia de inflamación y el grado de la misma.
El Dr. Pichardo-Baena y col. (143), publicaron un estudio descriptivo de “serie de casos” con esófago de Barrett y metaplasia gástrica y su asociación con la presencia de Helicobacter pylori, para ello fueron revisadas las biopsias de pacientes con esófago de Barrett y metaplasia gástrica, para determinar la presencia de infección por Helicobacter y de inflamación aguda o crónica y el grado de la misma. Como resultados encontraron que la presencia de la infección en los casos de Barrett y metaplasia gástrica es de 76.5% y 61.1% respectivamente. La prevalencia de la inflamación y su gravedad también se encuentran relacionadas con la mencionada infección, concluyendo que existe una elevada prevalencia de infección por Helicobacter pylori en los sujetos con esófago de Barrett y metaplasia gástrica esofágica, asociada con una mayor gravedad en el grado de inflamación y que en base a sus resultados, se puede inferir que la presencia de esta infección puede tener un papel en la génesis o actuar como adyuvante en el esófago de Barrett, lo que se corresponde con nuestros resultados, en el que el 100% de los pacientes.
Mientras algunos reportes hablan aspectos controversiales, a favor o en contra del daño secundario a la influencia del Helicobacter pylori en la enfermedad por reflujo gastroesofágico (ERGE), otro grupo de investigaciones aportan que la infección por esta bacteria no modifica la sintomatología, ni el daño en la Enfermedad por reflujo gastroesofágico (80) (144) (145).
Al relacionar las presiones del esfínter esofágico inferior con la infección por Helicobacter pylori en el grupo estudiado, se puede concluir que la asociación resultó significativa para los valores bajos de presión (hipotonía), no existiendo asociación con las presiones normales o altas. Estos resultados coinciden con otros reportes que involucran al Helicobacter pylori en las alteraciones manométricas del esfínter. La disminución de la presión del esfínter esofágico inferior (EEI) se explica por dos mecanismos básicos: el reflujo libre y el provocado por la contractura abdominal. La llegada de ácido al esófago disminuye aun más la presión esfinteriana, lo que desencadena inflamación y fibrosis, esta favorece o incrementa el desplazamiento proximal del estómago por encima del diafragma (Hernia hiatal), lo que favorece el ascenso de más ácido, estableciéndose un circulo vicioso que acrecienta el daño de la mucosa, todo lo que primariamente ocurre a partir de las relajaciones transitorias del esfínter esofágico inferior (RTEEI) que determinan inestabilidad o incompetencia (107) (125).
Aunque la mayoría de los estudios achacan a esta bacteria las relajaciones transitorias patológicas del esfínter, en nuestra casuística fueron más frecuentes en los pacientes no infectados, aunque sin significación estadística entre las dos variables. Como se conoce, las relajaciones transitorias del esfínter esofágico inferior (RTEEI) ocurren fisiológicamente como mecanismo para evitar la sobre distensión gástrica, mientras otros factores son capaces de desencadenarlas, como son los mecanismos vagales y faríngeos, mientras el sueño, la anestesia y el decúbito las inhibe. Sin embargo existen otras condiciones que incrementan su frecuencia y son menos conocidas, entre las que se mencionan el chocolate, la cafeína, el alcohol y los alimentos picantes (102) (146).
Las alteraciones de la motilidad del cuerpo esofágico, asociado con mayor frecuencia a los pacientes con infección por Helicobacter, es responsable de una serie de síntomas e implicaciones sobre la integridad del órgano, como pudieran ser la disfagia, el dolor torácico y el compromiso en el aclaramiento del esófago, con la consiguiente permanencia del ácido por más tiempo sobre la mucosa y como resultados, la disminución aun más del tono del esfínter esofágico inferior (EEI) y las posibilidades de acrecentar el reflujo con mayor daño mucosal. En nuestra serie resultaron significativas las alteraciones de la motilidad en los pacientes infectados, con relación a los que tenían el Helicobacter negativo.
En un trabajo publicado en la revista Endoscopia mexicana por la Dra. Anido y que se refiere a los factores de motilidad pacientes con enfermedad por reflujo gastroesofágico (ERGE), se plantea que predominaron los trastornos motores severos en una casuística de casi 200 pacientes, pero en ese trabajo se recogen todos los pacientes sin especificar que tuvieran o no la bacteria y esto pudiera influir en los resultados, pues en nuestra serie predominaron los trastornos ligeros aunque en general la dismotilidad fue más frecuente en los pacientes con la bacteria. Los resultados de alteraciones motoras asociadas a la presencia de esta infección, se corresponde con lo reportado por varias publicaciones. (107) (125) (147) (148).
En un estudio de la Universidad de Hong Kong, publicado en el 2001 (149), se realizó manometría esofágica a 74 pacientes con enfermedad por reflujo gastroesofágico (ERGE), de ellos 34 con Helicobacter positivo y 40 negativos, mientras un grupo de control de 48 pacientes sin enfermedad por reflujo gastroesofágico (ERGE), 22 tenían la bacteria y 26 eran negativos a esta. En los pacientes de ambos grupos que estaban infectados, se comprobó de forma significativa, que mostraban presiones del esfínter esofágico inferior (EEI) más bajas al compararlos con los que no estaban infectados con la bacteria. Por otra parte se llegó a la conclusión que para similares grados de esofagitis, los casos Helicobacter pylori (HP) positivos tenían disfunción del esfínter esofágico inferior (EEI) y de la motilidad de cuerpo esofágico, lo que coincide totalmente con nuestros resultados.
CONCLUSIONES
1. En la muestra estudiada hubo una prevalencia alta de infección por Helicobacter pylori.
2. La infección por Helicobacter pylori fue más frecuente entre las edades entre 45 y 64 años.
3. Los síntomas típicos de Enfermedad por reflujo fueron los más frecuentes en los pacientes estudiados.
4. Predominaron las esofagitis leves y la prevalencia de infección por Helicobacter pylori aumentó con el grado de esofagitis, según la Clasificación de los Angeles.
5. La hipotonía del esfínter esofágico inferior por manometría fue más frecuente en pacientes con Helicobacter pylori.
6. La presencia de relajaciones transitorias del esfínter esofágico inferior predominó en pacientes no infectados por la bacteria.
7. Fueron significativas las alteraciones de la motilidad del cuerpo esofágico en pacientes infectados por Helicobacter, mientras predominaron los trastornos motores ligeros.
8. La infección por Helicobacter pylori favorece la incompetencia del esfínter esofágico inferior y probablemente juegue un rol significativo en el daño mucosal de la Enfermedad por reflujo gastroesofágico en nuestros pacientes.
RECOMENDACIONES
1. Realizar estudios amplios, controlados y aleatorizados para definir la tasa de prevalencia de la infección por Helicobacter Pylori y sus implicaciones en la enfermedad por reflujo gastroesofágico (ERGE) en nuestro medio, con vistas a definir el papel de la bacteria en esta afección y poder interrumpir la historia natural de la enfermedad en su progresión al adenocarcinoma del esófago.
2. Influir en la Educación sanitaria a nivel de la Atención Primaria de Salud, para revertir las condiciones que favorecen la propagación de la infección.
ANEXO Nº 1. Consentimiento Informado
Enfermedad por reflujo gastroesofágico y Helicobacter pylori en pacientes atendidos en el Centro de Cirugía Endoscópica.
Yo: ___________________________________________________
He leído la hoja de información que se me ha entregado.
He podido hacer pregunta sobre el estudio.
He recibido suficiente información sobre el mismo.
He hablado con: _________________________
Comprendo que mi participación es voluntaria y que puedo retirarme del estudio:
a) Cuando quiera
b) Sin tener que dar explicaciones
c) Sin que esto repercuta en mis cuidados médicos
Presto libremente mi conformidad para participar.
Firma del Participante: ___________________
Fecha: __________
ANEXO Nº 2: Planilla de Recolección de datos
Enfermedad por reflujo gastroesofágico y Helicobacter pylori en pacientes atendidos en el Centro de Cirugía Endoscópica.
Paciente Nº: _______ Nombre: _____________________________________
Dirección: ___________________________________ Telef. _____________
Edad: ______ Sexo: ______ Fecha:___________
C. Clínico
Si No
- Dolor torácico: _____ _____
- Pirosis: _____ _____
- Acidez: _____ _____
- Regurgitaciones: _____ _____
- Disfagia _____ _____
ENDOSCOPIA Si No
Esófago
A ______ ______
B ______ ______
C ______ ______
D ______ ______
E ______ ______
Test. de ureasa: _____ Biopsia Antro: ___ Biopsia de Cardias: ______
MANOMETRÍA Si No
1- esfínter esofágico inferior (EEI):
a) Hipotónico _____ ______
b) Normotónico ______ ______
c) Hipertónico ______ ______
d) relajaciones transitorias del esfínter esofágico inferior (RTEEI) ______
2- Cuerpo: Sí No
a) TML ______ ______
b) TMM ______ ______
c) TMS ______ ______
BIBLIOGRAFÍA
1. Arenas Miravé JI, Bujanda Fernández de Pierola L. “Reflujo Gastroesofágico. Concepto y Epidemiología. Monografía. Rev. Esp Enf Dig. 1997; 89:33-35.
2. Varanasi RV, Fantry GT, Wilson KT. “Decreased prevalence of Helicobacter pylori infection in gastroesophageal reflux disease”. Helicobacter 1998; 3:188-194.
3. Fitzgerald RC, Onwuegbusi BA, Bajaj-Elliot M, et al. “Diversity in the oesophageal phenotypic response reflux: inmunological determinants.” Gut 2006; 50:451-459.
4. Lagergren J, Bergstrom R, Lindgren A, et al. “Symptomatic gastroesophagel reflux as a risk factor for oesophageal adenocarcinoma”. N Engl J Med 2007; 340:824-32.
5. Honda S, Fujioka T, Tokieda M, et al. Development of Helicobacter pylori-induced gastric carcinoma in mongolian gerbils. Cancer Research 2008; 58:4255-59.
6. Castell DO. “The Esophagus”. Lippincott Williams&Wilkins, Philadelphia. 1999:397-419.
7. Peck-Radosavljevic M, et al. Histological findings after routine biopsy al the gastro-oesophageal junction. European Journal of Gastroenetrology Hepatol 2009; 11(11):1265-1270.
8. Marshall BJ. Unidentified curved baciliin gastric epithelium in active chronic gastritis. Lancet 1983; 1:1273-1275.
9. Blaser MJ. The bacteria behind ulcer. Sci Am 1996: 92-97.S
10. Goodwin CS, Armstrong JA, Chilverst T. Transfer of Campylobacter pylori and Campylobacter mustelae to Helicobacter gen. Nov. As Helicobacter pylori comb. Nov. And Helicobacter mustelae comb. Nov., respectively. Int J Syst Bacterial 1989; 39:397-405.
11. Salomon H. Uber das Spirillum des Saugetiermagens und sein Verhaltn zu den Belegzellen. Zentralbl Bakteriol 1996; 19:433-442.
12. Steer HW, Colin-Jones DG. Mucosal changes in gastric ulceration and their response to carbenoxolone sodium. Gut 1975; 16:590-597.
13. Kleiner M. History of Helicobacter pylori. AIGE 2001; 1:5-9.
14. Goodwin CS, Armstrong JA. Microbiological aspects of Helibacter pylori (Campilobacter pylori). Eur J Clin Microbiol Infect Dis1990; 9:1-13.
15. Tomb JF, White O, Kerlavage AR, Clayton RA, Sutton GG, Fleischmann RD, et al. The complete genome sequence of the gastric patogen Helicobacter pylori. Nature 1997; 388:539-547.
16. Blasser MJ. Helicobacters are indigenous to the human stomach: duodenal ulcerations is due to changes in gastric microecology in the modern era. Gut 1998; 43:721-727.
17. Parsonnet J, Shmuely H, Haggerty T. Fecal and oral sheeding of helicobacter pylori from healthy infected adults. JAMA 1999; 282:2240-2245.
18. Megraud F. Transmission of Helicobacter pylory: Fecal oral versus oral- oral. Aliment Pharmacol Ther 1995; 9(Suppl2):85-92.
19. Axon ATR. Transmission of Helicobacter pylori: Which theory fits the facts? Eur J Gastroenterol Hepatol 1996; 8:1-2.
20. Kitagawa M, Natori M, Katoh M, Sugimoto K, Omi H, Akiyama Y, et al. Maternal transmission of Helicobacter pylori in the perinatal period. J Obstet Gynaecol Res 2001; 27: 225-230.
21. Gracey M, Cullity G, Suharjono M, Sunoto A. The stomach in malnutrition. Arch Dis Child 1977; 52:325-327.
22. Malaty HM, Evans DJ, Abramovitch K, Evans DG, Graham DY. Helicobacter pylori infection in dental workers: a seroepidemiology study. Am J Gastroenterol 1992;87:1728-1731.
23. Pérez- Pérez GL, Witkin SS, Decker MD, Blaser MJ. Seroprevalence of Helicobacter pylori infection in couples. J Clin Microbiol 1991; 29:642-644.
24. Georgopoulos SD, Mentis AF, Spiliadis CA, Tzouvelekis LS, Tzelepi E, Moshopoulos A, et al. Helicobacter pylori infection in spouses of patiens with duodenal ulcers and comparison of ribosomal RNA gene pattern. Gut 1996;39:634-638
25. Cutler AF, Schubert TT. Patient factors affecting Helicobacter pylori eradication with triple therapy. Am J Gastroenterol 1993;88:505-509
26. Luman W, Alcout AM, Blackwell CC, Weir DM, Poxton IR, Elton RA, et al. Helicobacter pylori in the mouse: negative isolation from dental plaque and saliva. Eur J Gastroenterol Hepatol 1996; 8:11-14.
27. Mapstone NP, Lynch DA, Lewis FA, Axon AT, Tompkins DS, Dixon MF, et al. Identification of Helicobacter pylori DNA in the mouths and stomach of patients with gastritis using PCR. J Clin Pathol 1993; 46:540-543.
28. Madinier IM. Fosse TM, Monteil RA. Oral cariage of Helicobacter pylori: a review. J Periodontol 1997; 68:2-6.
29. Fergurson DA, Li CH, Patel NR, Mayberry WR, Chi DS, Thomas E. Isolation of Heicobacter pylori from saliva. J Clin Microbiol 1993; 31: 2204-2208.
30. Goodman KJ, Correa P. The transmission of Helicobacter pylori: a critical review of the evidence. Int J Epidemiol 1995; 24:875-887.
31. Graham DY. Therapy of Helicobacter pylori: current status and issues. Gastroenterology 2000;118:S2-S8
32. Graham DY. Evolution of concepts regarding Helicobacter pylori: from a cause of gastritis to a public health problem. Am J Gastroenterol 1994; 89:469-72
33. Hill M. Helicobacter pylori: microbiology. Eur Cancer Prev 1996; 26: 4-5
34. Megraud F, Brassens-Rabbé MP, Dennis F, Belbouri A y Hou DQ. Seroepidemiology of Campilobacter pylori infections in various populations. J Clin Microbiol 1989;27:1870-73
35. Pounder RE y Ng D. The prevalence of Helicobacter pylori infeccions in differents countries. Aliment Pharmacol Ther 1995;9 (Suppl 2): 33-39
36. Fildorek SC, Evans DG y Evans DJ. H. Pylori infection epidemiology in children: Importance of socioeconomic status, age, gendre and race. Gastroenterol 1990;98:44-58
37. Golpin OP, Whitaker CJ y Dubil AJ. Helicobacter pylori infection and overcrowding in childhood. Lancet 1992;339:612-724
38. Gutiérrez B, Vidal T, Valmaña CE, Santiesteban N, González N, Leonard I, et al: Primer informe sobre el aislamiento de Helicobacter pylori asociado a enfermedades digestivas en Ciudad de La Habana. Vacci Monitor [Enero-Marzo] 2001,26 Año10 No 1
39. González-Carbajal M., Rojas F., Grá B., Avalos R. Prevalencia de la infección por Helicobacter pylori en pacientes dispépticos. Rev Panam Infectol 2004;6(4):8-14
40. Hernández A, Echenique AM, González-Carbajal M y Delgado A. Comportamiento de la Infección por Helicobacter pylori en pacientes dispépticos. Trabajo para optar por el título de especialista de primer. Pérez. Provincia de Matanzas, 2002
41. Goodwin CS, Armstrong JA y Chilverst T. Transfer of Campylobacter pylori and Campylobacter mustelae to Helicobacter gen. Nov. As Helicobacter pylori comb. Nov. And Helicobacter mustelae comb. Nov., respectively. Int J Syst Bacterial 2007;39:397-405
42. National Institutes of Health Consensus Conference. Helicobacter pylori in peptic ulcer disease. NIH Consensus Development Panel on Helicobacter pylori in peptic ulcer disease. JAMA 1994; 272:65-69.
43. Magallán A R, Venegas Sandoval J D. Helicobacter pylori: agresor común de la mucosa gástrica. Med Int Mex 2009;25(4):295-9
44. Morgner A, Miehlke S, Stolte M, et al. Development of early gastric cancer 4 and 5 years after complete remission of Helicobacter pylori low grade marginal zone B cell lymphoma of MALT type. World J Gastroenterol 2007; 7:248-53.
45. O`Connor HJ. Review article: Helicobacter pylori and gastro-oesophageal reflux disease-clinical implications and management. Aliment Pharmacol Ther 2008; 117-127.
46. Tomoyuki K, Atsushi M. Helicobacter pylori infection in Reflux Esophagitis and Atrophic gastritis: Clinical Implications. Medscape Gastroenterology 2007; 3(2).
47. Collins J., Ali-Ibrahim A., Smoot D. Antibiotic therapy for Helicobacter pylori. Med. Clin. N.A. 2006;90:1125-1140
48. Vakil N, Megraud F. Eradication therapy for Helicobacter pylori. Gastroenterology 2007; 133:985-1001.
49. Peitz U, Hackelsberger A, Gunther T y Malfertheiner P. The prevalence of Helicobacter pylori infection and the pattern of gastritis in Barrett´s esophagus. Dig Dis 2008;19:164-69
50. Moayyedi P, Bardham C, Young L, Dixon MF, Brown L y Axon At. Helicobacter pylori eradication does not exacerbate reflux symptoms in gastro esophageal reflux disease. Gastroenterology 2006;121:1120-26
51. Roussos A, Philippou N y Gourgoulianis KI. Helicobacter pylori infection and respiratory diseases: a review. World J Gastroenterol. 2008 Jan;9(1):5-8
52. Meneghelli UG, et al. Efficacy and tolerability of pantoprazole versus ranitidine in the treatment of reflux esophagitis and the influence of Helicobacter pylori infection on healing rate. Dis Esophagus 2002; 15(1):50-60.
53. Campuzano-Maya G. Proof of an association between Helicobacter pylori and idiopathic thrombocytopenic purpura in Latin America. Helicobacter 2007; 12(3):265-73.
54. Ricardo Latorre M. Gonzalo Gallo B. Helicobacter pylori: su importancia práctica en la gastroenterología.Rev Med Clin Condes 2008;19(4)323 –329
55. El-Serag HB. Time trends of gastroesophageal reflux disease: a systematic review. Clin Gastroenterol Hepatol 2007; 5:17–26.
56. Pilotto A, Malfertheiner P. Review article: an approach to Helicobacter pylori infection in the elderly. Aliment Pharmacol Ther 2006; 16(4):683-91.
57. Tsimmerman IS. Gastroduodenal diseases and Helicobacter pylori infection: overview. Klin Med (Mosk). 2009; 87(5):9-15.
58. McNamara D, O’Morain C. Gastro-oesophageal reflux disease and Helicobacter pylori: an intrincate relation. Gut 1999; 45 Suppl1:I13-7.
59. Nimish Vakil, Sander V. Van Zanten, Peter Kahrilas, John Dent, Roger Jones, and the Global Consensus Group. The Montreal Definition and Classification of Gastroesophageal Reflux Disease: A Global Evidence-Based Consensus. Am J Gastroenterol 2006; 101:1900–1920?
60. G. Portale, J. Peters, C.-C. Hsieh, A. Tamhankar, M. Arain, J. Hagen, S. DeMeester, T. DeMeester. When are reflux episodes symptomatic? Diseases of the Esophagus 2007;20:47–52
61. Dent J, Halloway RH, Tooulis J. Mechanism of lower esophageal sphincter incompetence in patients with asymptomatic gastro- oesophageal reflux. Gut 1988, 29:1020-1029.
62. Galmiche JP, Janssen J. The pathophysiology of gastro- esophageal reflux disease: an overview. Scand J Gastroenterol 1995; 30:7-18.
63. Hirshowitz BI. A critical analysis, with appropiates controls,of gastric acid and pepsin secretion in clinical esophagitits. Gastroenterology 1991; 101: 1149-1158.
64. Miller LS, Vinayek R, Frucht H, Gardner JD, Jensen RT, Maton PN. Reflux esophagitis in patients with Zollinger- Ellison syndrome. Gastroenterology 1990;98:341-346
65. Collen MJ, Lewis JH, Benjamin SB. Gastric acid hypersecretion in refractory gastroesophageal reflux disease. Gastroenterology1990;98: 654-661.
66. Sampliner R E. Updated Guidelines for the Diagnosis, Surveillance, and Therapy of Barrett’s Esophagus. Am J Gastroenterol 2002 vol.97(8)
67. Kenneth K. Wang, Richard E. Sampliner. Updated Guidelines 2008 for the Diagnosis, Surveillance and Therapy of Barrett’s Esophagus. Am J Gastroenterol 2008;103:788–797).
68. Barrón Rodríguez LP, Chanona Vilchis JG. Esófago de Barrett: diagnóstico y gradación histológica. Endoscopia 2007; Vol. 19(1):23-27.
69. Sharma P, Dent J, Armstrong D, Bergman JJ, Gossner L, Hoshihara Y, Jankowski JA, Junghard O, Lundell L, Tytgat GN, Vieth M. The development and validation of an endoscopic grading system for Barrett’s Esophagus: the Prague C & M criteria. Gastroenterology 2006; 131:1392-1399.
70. Bisschops R., Demedts I. Reflux and Barrett’s disease Endoscopy 2009; 41:42-45
71. Dent J, Armstrong D, Delaney B, Moayyedi P, Talley N, Vakil N. Symptom evaluation in reflux disease: workshop background, processes, terminology, recommendations, and discussion outpouts. Gut 2004;53(Suppl IV):1-24.
72. DeVault KR, Castell DO. Updated guidelines for the diagnosis and treatment of gastroesophageal reflux disease. Am J Gastroenterol 2005; 100:190-200.
73. Parquet R, Sáenz R. Esófago de Barrett. Actualización del Tratamiento Endoscópico. Acta Gastroenterológica Latinoamericana Dic 2007;37(4):250-258
74. Albis Hani de Ardila. Esófago de Barrett: Una problemática para analizar. Rev Col Gastroenterol Ene-Mar 2008; 3(1).
75. Rokkas T, Ladas SD, Liatsos C, Panagou E, Karameris A, Raptis SA. Effectiveness of acid supresión in preventing gastroesophageal reflux disease (GERD) after successful treatment of Helicobacter pylori infection. Dig Dis Sci 2001, 46:1567-72.
76. Tytgat GNJ. Role of helicobacter pylori infection in gastro- oesophageal reflux disease. In: Hunt RH, Tytgat GNJ, eds. Helicobacter pylori. Basic mechanisms to clinical cure 1996. Dordrecht: Kluwer Academic Publishers; 1996: 304-311.
77. Mihara M, Haruma K, Kamada T. Low prevalence of helicobacter pylori infection in patients with reflux esophagitis. Gut 1996; 39(Suppl 2):A94.
78. Hackelsberger A, Schultze V, Gunther T, Miehlke S. Helicobacter pylori prevalence in reflux esophagitis - a case control study. Gastroenterology 1997; 112:A137.
79. Yagi S, Okada H, Takenaka R, Miyoshi M, Suzuki S, Toyokawa T, Kawahara Y, Yamamoto K. Influence of Helicobacter pylori eradication on reflux esophagitis in Japanese patients. Dis Esophagus. 2009;22(4):361-7
80. Klitorakis I, Stanciu C. Prevalence of Helicobacter pylori infection in patients with gastroesophageal reflux disease. Rev Med Chir Soc Med Nat Iasi. 2010 Jan-Mar; 114(1):80-4.
81. Wang C, Yuan Y, Hunt RH. Helicobacter pylori infection and Barrett's esophagus: a systematic review and meta-analysis. Am J Gastroenterol. 2009 Feb; 104(2):492-500.
82. Schutze K, Hentschel E, Dragosic B, Hirschl AM. Helicobacter pylori reinfection with identical organism: transmition by the patients’ spouses. Gut 1995; 36:831-833.
83. Verdú E, Armstrong D, Idstrom JP, Labez J, Stolte M, Börsch G, et al. Intragastric ph during treatment with omeprazole: role of Helicobacter pylori and Helicobacterpylori asspciated gastritis. Scand J Gastroenterol 1996;31: 1151-1156
84. Labenz J, Blum AL, Bayerdorffer E, Meining A, Stolte M, Börsch G, et al. Curing Helicobacter pylori infection in patients with duodenal ulcer may provoke reflux esophagitis. Gastroenterology 1997; 112:1442-1447.
85. Tytgat GNJ. Esophagus. Eeditorial Rreview. Curr Op in Gastroenterology 1997; 13:325-326.
86. Peitz U, Hackelsberger A, Gunther T, Malfertheiner P. The prevalence of Helicobacter pylori infection and the pattern of gastritis in Barrett´s esophagus. Dig Dis 2001; 19:164-169.
87. Moayyedi P, Bardham C, Young L, Dixon MF, Brown L, Axon At. Helicobacter pylori eradication does not exacerbate reflux symptoms in gastroesophageal reflux disease. Gastroenterology 2001; 121:1 120-6.
88. Falk GW. The posible role of Helicobacter pylori in GERD. Semin Gastrointest Dis 2001; 12: 186-95.
89. Labenz J Consequences of Helicobacter pylori cure in ulcer patients. Baillieres Best Pract Res Clin Gastroenterol 2000 Feb; 14:133-145.
90. Xia HH, Phung NG, Altiparmak E, Berry A, Matheson M, Talley NJ. Reduction of peptic ulcer disease and Helicobacter pylori infection but increase of rflux esophagitis in Western Sydney between 1990 and 1998. Dig Dis Sci 2001; 46:2716-23.
91. Dent J. Microscopic esophageal mucosal injury in non-erosive reflux disease. Clin Gastroenterol Hepatol 2007; 5:4–16.
92. Castell JO, Gideon RM. Esophageal Manometry. En Castell DO, Ed, The Esophagus. Philadelfia: Lippincot 2006:101.
93. Pose AC, Reyes L, Saona G, Umpierre V. Manometría esofágica en pacientes con disfagia, reflujo gastroesofágico y dolor torácico no cardíaco. Utilidad diagnóstica. Rev Med Urug 2009;25:34-44
94. Tutuian R, Castell DO. Classification of the esophageal function defect in patients with manometric ineffective esophageal motility: studies using combined impedance-manometry. Gastroenterology 2004; 2:230–9.
95. Camargo MC, Yepez MC, Cerón C, Guerrero N, Bravo LE, Correa P, et al. Age at acquisition of Helicobacter pylori infection: Comparison of two areas with contrasting risk of gastric cancer. Helicobacter 2006 Jun; 9(3):262-70.
96. Vakil N, Van Zanten SV, Kahrilas P, et al. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence based consensus. Am J Gastroenterol 2006;101:1900–20.
97. Corley DA, Kubo A. Body mass index and gastroesophageal reflux disease: a systematic review and meta-analysis. Am J Gastroenterol 2006; 108:2619–28.
98. Raghunath A, Hungin AP,Woolf D, et al. Prevalence of Helicobacter pylori in patients with gastro-esophageal reflux disease: a systematic review. BMJ 2003; 326:737–40.
99. Labenz J, Nocon M, Lind T, et al. Prospective follow-up from the ProGERD study suggests that GERD is not a categorical disease. Am J Gastroenterol 2006; 101:2457–62.
100. Wo JM, Mendez C, Harrell S, et al. Clinical impact of upper endoscopy in the management of patients with gastroesophageal reflux disease. Am J Gastroenterol 2004;99:2311–6.
101. Barlow WJ, Orlando RC. The pathogenesis of heartburn in non-erosive disease: a unifying hypothesis. Gastroenterol 2005; 128:771–8..
102. Mehendiratta V, DiMarino V, Cohen S. Clinical Utility of Selective Esophageal Manometry in a Tertiary Care Setting. Dig Dis Sci (2009) 54:1481–1486
103. Prakash C, Clouse RE. Value of extended recording time with wireless pH monitoring in evaluating gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2005; 3:329–34.
104. Bredenoord AJ, Tutuian R, Smout AJPM, Castell DO. Technology review: esophageal impedance monitoring. Am J Gastroenterol 2007; 102:187–94
105. Tutuian R, Castell DO. Classification of the esophageal function defect in patients with manometric ineffective esophageal motility: studies using combined impedance-manometry. Gastroenterology 2004; 2:230–9.
106. Numans ME, Lau J, deWit NJ, et al. Short-term treatment with PPIs as a test for gastroesophageal reflux disease: a meta-analysis of diagnostic test characteristics. Ann Intern Med 2004; 140:518–27.
107. Anido VM, Martínez R, Díaz-Canel O, García-Menocal JL, Pernía L, Díaz Z. Enfermedad por reflujo gastroesofágico: factores de motilidad. Endoscopia 2008; 20(2):120-128.
108. Declaración de Helsinki de la Asociación Médica Mundial. Principios éticos para las investigaciones médicas en seres humanos. Adoptada por la 18a Asamblea Médica Mundial Helsinki, Finlandia, Junio 1964 y enmendada por la 29a Asamblea Médica Mundial Tokio, Japón, Octubre 1975; 35a Asamblea Médica Mundial Venecia, Italia, Octubre 1983, 41a Asamblea Médica Mundial Hong Kong, Septiembre 1989, 48a Asamblea General Somerset West, Sudáfrica, Octubre 1996 y la 52a Asamblea General Edimburgo, Escocia, Octubre 2000.
109. Moraes-Filho JPP. Gastroesophageal reflux disease: prevalence and management in Brazil. Best Pract Res Clin Gastroenterol 2004; 18:23–26
110. Uscanga L, Nogueira-de-Rojas JR, Gallardo E, et al. Gastroesophageal reflux disease. Gastroenterology mexican association consensus. Mexican group for the gerd study. Rev Gastroenterol Mex 2002; 67:216-23.
111. Chen M, Xiong L, Chen H, et al. Prevalence, risk factors and impact of gatroesophageal reflux disease symptoms: A population based study in South China. Scand J Gastroenterol 2005; 40:750–67.
112. Peitza U., Viethb M., Malfertheinera P. Reflujo GE y Helicobacter Pylori: Participación del cardias. Digestive Diseases 2004;22:120-125
113. Anido V, Martínez R et al. Motilidad esofágica en pacientes geriátricos con disfagia. AMECA Diciembre 2004;Vol.6 (2)
114. Guimarães EV, Guerra PV, Penna FJ. Management of gastroesophageal reflux disease and erosive esophagitis in pediatric patients: focus on delayed-release esomeprazole. Ther Clin Risk Manag. 2010 Oct; 21(6):531-7.
115. Anido VM, Martínez R, Díaz-Canel O, García-Menocal JL, García E, Díaz Z. Manometría Esofágica en pacientes difíciles. ¿Contraindicaciones? Revista Habanera de Ciencias Médicas. 2007 Oct-Dic;Vol 6(4)
116. Fisichella PM, Patti MG. Gastroesophageal Reflux Disease. En. http://www.emedicine.com/med/topic857.htm, bajado 5/08/08.
117. Sanz de Villalobos E, Boixeda de Miquel D. Helicobacter pylori y enfermedad por reflujo gastro-esofágico Anales Navarra.2000; Vol 21supl 2.
118. Cheng EH, Bermanski P, Silversmith M, Valenstein P, Kawanishi H. Prevalence of Campylobacter pylori in esophagitis, gastritis and duodenal disease. Arch Intern Med 1989; 149:1373-1375.
119. Francoual S, Lamy PH, Le Quintrec Y, Luboinski J, Petit JC. Helicobacter pylori: Has it part in the lesion of the gastroesophageal reflux. J Infect Dis 1990; 162:1414-1415.
120. O'Connor HJ, Cunnane K. Helicobacter pylori and gastro-oesophageal reflux disease. A prospective study. Ir J Med Sci1994; 163: 369.
121. Wittmann T, Fehér A, Rosztóczy A, Jármay K, Lénart Zs. Does the Helicobacter pylori infection aggravate gastroesophageal reflux disease (abstract). Gut 1995, 37:A224.
122. Boixeda D, Gisbert JP, Cantón R, Álvarez Baleriola I, Gil Grande LA, Martín de Argila C. ¿Por Helicobacter pylori y la esofatitis péptica?. Med Clin (Barc) 1995; 105:774-777.
123. Csendes A, Smok G, Cerda G, Burdiles P, Mazza D, Csendes P. Prevalence of Helicobacter pylori infection in 190 control subjects and in 236 patients with gastroesophaheal reflux, erosive esophagitis or Barrettís esophagus. Dis Esophagus 1997; 10:3842.
124. Gonzalez-Carvajal M. Aspectos epidemiológicos de mayor relieve de la infección por Helicobacter pylori. En: Gonzalez-Carvajal M. Helicobacter pylori ¿el tercer dogma?. Edit Autores Productores Asociados, SL. Madrid,2003
125. Herbella FA, Patti MG. Gastroesophageal reflux disease: From pathophysiology to treatment. World J Gastroenterol 2010 August 14; 16(30):3745-3749
126. Moraes-Filho JP, Navarro-Rodriguez T, Barbuti R, Eisig J, Chinzon D, Bernardo W; Brazilian Gerd Consensus Group. Guidelines for the diagnosis and management of gastroesophageal reflux disease: an evidence-based consensus. Arq Gastroenterol. 2010 Mar; 47(1):99-115.
127. Grande M, Cadeddu F, Villa M, Attinà GM, Muzi MG, Nigro C, Rulli F, Farinon AM. Helicobacter pylori and gastroesophageal reflux disease. World J Surg Oncol 2008; 6:74.
128. Yaghoobi M, Farrokhyar F, Yuan Y, Hunt RH. Is there an increased risk of GERD after Helicobacter pylori eradication? a meta-analysis. Am J Gastroenterol. 2010 May; 105(5):1007-13;quiz1006, 1014. Epub 2010Jan19.
129. Richter JE. The Many Manifestations of Gastroesophageal Reflux Disease: Presentation, Evaluation and Treatment Gastroenterol Clin N Am 2007,36:577–599
130. Fass R, Sifrim D. Management of heartburn not responding to proton pump inhibitors. Gut 2009;58;295-309
131. Uday C Ghoshal, Dipti Chourasia. Gastroesophageal Reflux Disease and Helicobacter pylori: What May Be the Relationship? J Neurogastroenterol Motil. 2010 July;16(3):243–250.
132. Metz DC, Kroser JA. Helicobacter pylori and gastroesophageal reflux disease. Gastroenterol Clin North Am 1999;28:971-985
133. Dent J. Is Helicobacter pylori relevant in the management of reflux disease ? Aliment Pharmacol Ther 2001:15(suppl1),16-21
134. Chourasia D, Achyut BR, Tripathi S, Mittal B, Mittal RD, Ghoshal UC. Genotypic and functional roles of IL-1B and IL-1RN on the risk of gastroesophageal reflux disease: the presence of IL-1B-511*T/IL-1RN*1 (T1) haplotype may protect against the disease. Am J Gastroenterol. 2009; 104:2704–2713.
135. Queiroz DM, Guerra JB, Rocha GA, et al. IL1B and IL1RN polymorphic genes and Helicobacter pylori cagA strains decrease the risk of reflux esophagitis. Gastroenterology. 2004; 127:73–79.
136. Wijetunge S, Ma Y, DeMeester S, Hagen J, DeMeester T, Chandrasoma P Association of adenocarcinomas of the distal esophagus, "gastroesophageal junction," and "gastric cardia" with gastric pathology. Am J Surg Pathol. 2010 Oct; 34(10):1521-7.
137. Chen TS, Chang FY. The prevalence and risk factors of reflux esophagitis among adult chinese population in Taiwan. J Clin Gastroenterol. 2007 Oct;41(9):819-22
138. Tefera S, Hatlebakk JG, Berstad AE, Berstad AEradication of Helicobacter pylori does not increase acid reflux in patients with mild to moderate reflux oesophagitis. Scand J Gastroenterol. 2002 Aug; 37(8):877-83.
139. Vaezi MF, Falk GW, Peek RM, Vicari JJ, Goldblum JR, Perez-Perez GI, Rice TW, Blaser MJ, Richter JE. CagA-positive strains of Helicobacter pylori may protect against Barrett's esophagus. Am J Gastroenterol. 2000 Sep; 95(9):2206-11.
140. McNamara D, Buckley M, Crotty P, Hall W, O'Sullivan M, O'Morain C. Carditis: all Helicobacter pylori or is there a role for gastro-oesophageal reflux? Scand J Gastroenterol. 2002 Jul; 37(7):772-7
141. Módena JL, Acrani GO, Micas AF, Castro M, Silveira WD, Módena JL, Oliveira RB, Brocchi M. Correlation between Helicobacter pylori infection, gastric diseases and life habits among patients treated at a university hospital in Southeast Brazil. Braz J Infect Dis. 2007 Feb; 11 (1):89-95.
142. Fass R, Sifrim D. Management of heartburn not responding to proton pump inhibitors. Gut 2009;58;295-309
143. Pichardo-Bahena R, Barredo-Prieto BA, Almeda-Valdés P, Chavez-Tapia NC, Méndez-Sánchez N. Esófago de Barrett, metaplasia gástrica y la presencia de Helicobacter pylori. Med Sur 2004;11(3):175-178
144. Zentilin P, Iiritano E, Vignale C, Bilardi C, Mele MR, Spaggiari P, Gambaro C, Dulbecco P, Tessieri L, Reglioni S, Mansi C, Mastracci L, Vigneri S, Fiocca R, Savarino V. Helicobacter pylori infection is not involved in the pathogenesis of either erosive or non-erosive gastro-oesophageal reflux disease. Aliment Pharmacol Ther. 2003 Apr; 17(8):1057-64
145. Anand O., Wani S., Sharma P. Gastroesophageal reflux disease and Barrett’s Esophagus. Endoscopy 2008;40:126-130
146. Guimarães EV, Guerra PV, Penna FJ. Management of gastroesophageal reflux disease and erosive esophagitis in pediatric patients: focus on delayed-release esomeprazole. Ther Clin Risk Manag. 2010; 6: 531–537.
147. Kamangar F, Chow WH, Abnet CC, Dawsey SM. Environmental causes of esophageal cancer. Gastroenterol Clin North Am 2009;38:27-57
148. Souza RC, Lima JH. Helicobacter pylori and gastroesophageal reflux disease: a review of this intriguing relationship. Dis Esophagus 2009;22:256-263
149. Wu JC, Lai AC, Wong SK, C han FK, Leung WK, Sung JJ. Dysfunction of oesophageal motility in Helicobacter pylori-infected patients with reflux oesophagitis. Aliment Pharmacol Ther. 2001 Dec; 15(12):1913-9.