En la actualidad la obesidad representa un problema de salud pública, cuyo manejo basado en cambios en el estilo de vida del paciente parecen no ser suficientes. Sin embargo, el arsenal farmacológico para el tratamiento de la misma aun es deficiente e incapaz de adaptarse a la creciente problemática que afecta a millones de individuos en el mundo. Ante tal situación el Sistema de endocannabinoides ha surgido como una posible diana para la farmacoterapia antiobesidad, y a pesar de que actualmente es objeto de intensa investigación, se han logrado caracterizar varios de sus componentes entre ellos: los ligandos endógenos, los receptores CB tipo 1 y 2, y su respectivas maquinarias enzimáticas biosintéticas y degradativas.
Sistema endocannabinoide. Una nueva diana antiobesidad
Univ. Juan Salazar V. La Universidad del Zulia. Escuela de Medicina.
RESUMEN
En la actualidad la obesidad representa un problema de salud pública, cuyo manejo basado en cambios en el estilo de vida del paciente parecen no ser suficientes. Sin embargo, el arsenal farmacológico para el tratamiento de la misma aun es deficiente e incapaz de adaptarse a la creciente problemática que afecta a millones de individuos en el mundo. Ante tal situación el Sistema de endocannabinoides ha surgido como una posible diana para la farmacoterapia antiobesidad, y a pesar de que actualmente es objeto de intensa investigación, se han logrado caracterizar varios de sus componentes entre ellos: los ligandos endógenos, los receptores CB tipo 1 y 2, y su respectivas maquinarias enzimáticas biosintéticas y degradativas.
Estos compuestos, similares a los derivados de la planta Cannabis sativa, son capaces de activar numerosas vías de señalización intracelular principalmente acopladas a proteína G. Su participación en la regulación del apetito y homeostasis energética es ejercida a través de los receptores CB1, por mecanismos centrales a nivel del hipotálamo y sistema límbico, así como también mecanismos periféricos en órganos relacionados a las funciones metabólicas como: tejido adiposo, hígado, músculo esquelético, entre otros. Este conjunto de acciones son el objetivo en el diseño de nuevos medicamentos para el control de la obesidad, ya que ésta cursa con la hiperactividad del sistema. Rimonabant es la primera droga basada en esta premisa, cuyo bloqueo de los receptores CB1 no solo ha demostrado disminuir el peso corporal, sino además mejorar el perfil de factores de riesgo cardiovasculares presentes en el paciente obeso.
Palabras Clave: Obesidad, Endocannabinoides, Rimonabant.
ABSTRACT
Today obesity is a public health problem, whose management based on changes in the patient's lifestyle seem not to be enough. However, the drug arsenal for the treatment of it is still poor and unable to adapt to the growing problem that affects millions of individuals worldwide. In this situation the endocannabinoid system has emerged as a potential target for antiobesity drug therapy, and although currently its subject matter of intense research, have been characterized various components including: the endogenous ligands, CB receptors type 1 and 2, and their respective biosynthetic and degradative enzyme machinery.
These compounds similar to those derived from the plant Cannabis sativa are able to activate numerous intracellular signaling pathways coupled to G protein mainly those which involvement in the regulation of appetite and energy homeostasis is exerted through CB1 receptors by central mechanisms at the hypothalamus and limbic system, as well as peripheral mechanisms in organs related to metabolic functions such as adipose tissue, liver, muscle skeletal, among others. These actions are targeted in the design of new drugs to control obesity, because it presents hyperactivity of the system. Rimonabant is the first drug based on this premise, which CB1 receptor blockade has not only shown to decrease body weight, but also raise the profile of cardiovascular risk factors present in the obese patient.
Keywords: Obesity, Endocannabinoids, Rimonabant.
INTRODUCCIÓN
La obesidad actualmente representa un problema de salud pública que afecta a numerosos países a nivel mundial, por lo cual algunos la catalogan como una verdadera pandemia que en conjunto con las complicaciones que acarrea continuara su implacable progresión en la población global (1). De hecho, cálculos de la Organización Mundial de la Salud (OMS) indican que en el 2005 existían aproximadamente 1600 millones de adultos con sobrepeso, y al menos 400 millones eran obesos; según las estimaciones la cifra se elevara a 2300 millones y 700 millones, respectivamente para el año 2015 (2).
Uno de los aspectos más llamativos es la alta prevalencia y crecimiento de esta enfermedad en países en vías de desarrollo, donde el desafío es doble al enfrentar de igual manera los problemas de desnutrición (3)
La obesidad es probablemente la alteración metabólico – nutricional más antigua de la humanidad, que consiste básicamente en el desbalance entre la cantidad de energía que se ingiere y la cantidad que se emplea para satisfacer las necesidades metabólicas (4). Es decir, existe un desequilibrio entre la entrada de energía, la cual es mayor al gasto calórico resultando en un balance energético positivo y el consecuente acumulo excesivo de grasa corporal. Este trastorno constituye un factor de riesgo para múltiples patologías como: dislipidemias, diabetes mellitus tipo 2, hipertensión arterial, artropatía degenerativa, entre otros (5).
Es importante saber diferenciar el sobrepeso de la obesidad, términos usados comúnmente como sinónimos, pero que denotan cierta distinción ya que el sobrepeso se refiere al exceso de peso corporal en relación a la talla; mientras que la obesidad involucra un exceso de adiposidad o grasa corporal (3,4). Estas alteraciones tienen un origen multifactorial que va desde causas medio ambientales hasta factores genéticos (4).
A pesar del gran reto que representa esta condición, el arsenal terapéutico contra la misma aun es limitado. Probablemente debido a las numerosas interrogantes que todavía existen en relación a la regulación neuroendocrina del peso corporal, campo ampliamente investigado en la actualidad y que ha develado muchos de los mecanismos neurohumorales ejercidos por el organismo para defender los depósitos energéticos (7)
De esta manera, se han diseñado múltiples fármacos que puedan contribuir a un mejor manejo del balance energético, llevando a cabo acciones tanto a nivel central como periférico. Uno de los más resaltantes debido a sus prometedores resultados en pruebas clínicas es el que involucra la manipulación del sistema de endocannabinoides, que gracias a sus variados mecanismos simultáneos en órganos de importancia vital en la producción de obesidad, en el futuro cercano puede convertirse en el blanco principal del tratamiento de la misma (8).
Cannabinoides. Origen.
Los cannabinoides son compuestos químicos presentes en la planta Cannabis sativa, una de las primeras plantas cultivadas por el hombre y cuyo empleo se remonta a 4000 años a.C. en China para la realización de textiles y cuerdas a partir de su fibra. Sus usos con fines terapéuticos se describen para el año 2600 a.C. por el emperador chino Huang Ti contra dolores abdominales, menstruales y articulares (9,10)
La planta de la marihuana, como también se le conoce, contiene más de 400 sustancias presentes en la resina secretada por sus hojas y frutos, de las cuales aproximadamente 60 son cannabinoides. Estos cannabinoides naturales, también llamados fitocannabinoides son compuestos químicos de naturaleza lipídica derivados de los terpenoides, cuya estructura química carboxílica presenta 3 anillos: benceno, tetrahidropirano central y un anillo ciclohexil monoinsaturado (11,13). Los fitocannabinoides varían según la variedad de la planta, siendo los más abundantes el canabicromeno, canabigerol, canabidiol, canabinol y el delta – tetra – hidro – canabinol (Δ9-THC) (14)
En 1964, Mechoulam y Gaoni, descubrieron que el compuesto psicoactivo más abundante y potente de la marihuana es el Δ9-THC. El cual presenta una rápida absorción, distribución y efecto gracias a su naturaleza hidrofóbica y/o altamente soluble en lípidos (9,11,12,15). Pero el estudio de su fisiología no se inicia hasta 1988 cuando Devane y col. descubrieron uno de sus receptores en el cerebro de ratas (16).
No obstante, en la actualidad son numerosos los efectos relacionados a los cannabinoides; en las plantas se cree que actúan como protectores ante insectos y en los animales las principales acciones van dirigidas al sistema cardiovascular como vasodilatadores generando hipotensión; sobre el sistema inmunitario como depresores de la función inmune a dosis muy elevadas; y sobre el sistema nervioso central (SNC) disminuyendo la movilidad, la temperatura, así como también propiedades analgésicas, antiinflamatorias antineoplásicas y efectos cognitivos (11,14,17)
Cannabinoides de Origen Endógeno o Sistema de Endocannabinoides,
Actualmente la definición de cannabinoide abarca, en sentido más amplio, a todos aquellos compuestos que con estructura química similar a los fitocannabinoides tienen la capacidad de ejercer efectos semejantes debido a que poseen receptores en común (14).
A partir del descubrimiento del primer receptor en el ser humano, se pensó que en el organismo podrían existir compuestos endógenos capaces de llevar a cabo los mismos efectos que los cannabinoides de origen exógeno. Pero no fue hasta 1992 cuando Devane y cols. descubrieron la N – etanolamida del ácido araquidónico (o N – Araquidonil – Etanolamida) como el primer “Endocanabinoide” (EC). A este compuesto se le denomino “Anandamida” (AEA), del sánscrito ananda, que quiere decir “dicha o bienestar interior” (9,11).
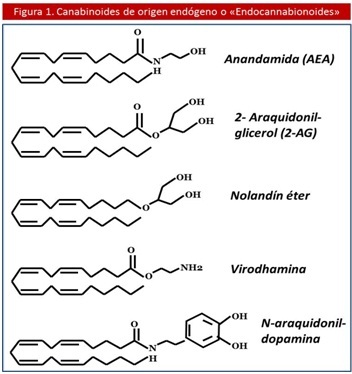
Además de la Anandamida (AEA), se han descrito otros endocannabinoides como: el 2 – Araquidonil – Glicerol (2 – AG), el éter del 2 – Araquidonil Glicerol (éter de Noladín), el O – Araquidonil – Etanolamina (virhodamina) y la N – Araquidonil – Dopamina (NADA). La Anandamida (AEA) y el 2 – AG fueron los 2 primeros en descubrirse y los más ampliamente estudiados. La principal diferencia a nivel estructural de los fitocannabinoides con los endocannabinoides es que estos últimos derivan de ácidos grasos poliinsaturados (14,18,19) (Ver Figura 1).
Por su parte, existen otros compuesto de origen lipídico que pertenecen al grupo de las N – aciletanolamidas como: (oleiletanolamida, palmitiletanolamida, homo – gamma linoleiletanolamida y docosatetraeiletanolamida), que poseen un precursor y una maquinaria enzimática de síntesis y degradación igual a la Anandamida (AEA), pero que no se unen a los receptores para cannabinoides; por lo tanto no son considerados Endocanabinoides (EC), a pesar de que juegan cierto papel de importancia junto a estos en las funciones homeostáticas (18,20).
Los Endocanabinoides (EC) se han encontrado en el sistema nervioso central (SNC), (corteza cerebral, cuerpo estriado, tálamo, hipocampo, puente, cerebelo, medula espinal); plasma y tejido periférico. Sin embargo, recientemente se ha cuestionado la relevancia del éter de noladín debido a que sus concentraciones son muy bajas a nivel cerebral como para activar los receptores (11, 21, 22).
En síntesis, se denomina Sistema de Endocanabinoides (SEC) al conjunto de ligandos endógenos, receptores y enzimas biosintéticas y degradativas de estos (12,23). Cabe destacar que este sistema tiene un alto grado de conservación evolutiva, indicativo de su importante papel en el sistema nervioso (24,25)
Activación del Sistema de Endocannabinoides: Síntesis, Liberación, Recaptación y Degradación.
Los Endocanabinoides (EC) mejor caracterizados hoy en día son la Anandamida (AEA) y el 2 – AG, sus vías anabólicas y catabólicas aún son ampliamente investigadas, pero se sabe que son derivados de ácidos grasos provenientes del remodelado de las membranas celulares.
Una particularidad de estas sustancias es que a diferencia de los neurotransmisores comunes, debido a su naturaleza lipídica estos no se almacenan en vesículas sinápticas, sino que son sintetizados y liberados “a demanda” o “a necesidad” directamente de los fosfolípidos de membrana, motivo por el cual son considerados “neurotransmisores no clásicos” o incluso moléculas con comportamiento hormonal en lugar de neurotransmisores (10,23,26-29).
Por ende, cambios en la síntesis de los Endocanabinoides (EC) desencadenan modificaciones inmediatas en su señalización, ya que estos poseen un nivel basal que puede alterarse ante ciertos estímulos fisiológicos tales como: la despolarización de la membrana y las concentraciones intracelulares de Ca2+. Y estímulos patológicos, tales como el estrés; modulando de esta manera su síntesis y liberación (11,30).
En relación a la AEA o N – Araquidonil – Etanolamida, esta se forma a partir de la ruptura de un precursor fosfolipídico llamado N-araquidonil-fosfatidil-etanolamina (NAPE), el cual es sintetizado por la enzima N-acetiltransferasa, la cual es dependiente de AMPc. y Ca2+ siendo la encargada de catalizar la transferencia del ácido araquidónico de la fosfatidilcolina al grupo cabeza de la fosfatidiletanolamida. Esto constituye el primer paso en el proceso de síntesis (9,2).
Posteriormente, el N-araquidonil-fosfatidil-etanolamina (NAPE) se hidroliza por acción de una fosfolipasa tipo D (el segundo paso) formando la Anandamida (AEA). Esta enzima se encuentra principalmente en cerebro, riñones y testículos. Y su actividad es regulada por despolarización, activación de receptores ionotrópicos de glutamato tipo N-Metil-D-Aspartato (NMDA), receptores nicotínicos (31) receptores metabotrópicos de neurotransmisores como: dopamina, acetilcolina y glutamato (32). En el 2004, Okamoto y cols reportaron haber clonado la enzima (33).
Asimismo, el 2 – AG tiene un precursor fosfolipídico de membrana, pero su síntesis es diferente ya que se trata de un monoglicérido, estando su formación muy ligada al metabolismo de triacilglicéridos. Los estudios bioquímicos han revelado que existen 2 posibles vías para la formación de este compuesto, la más importante se inicia cuando el fosfatidilinositol de la membrana celular es hidrolizado por la Fosfolipasa C (PLC) generando diacilglicerol (DAG), este a su vez es diana de otra enzima llamada diacilglicerol lipasa responsable de la formación del 2 – AG. Esta vía es dependiente de Ca2+ y su regulación no está asociada a la síntesis o liberación de Anandamida (AEA). (21,34)
De igual forma se ha descrito otra vía en la cual actúa la enzima fosfolipasa A1 (PLA1) sobre el fosfatidilinositol proveniente de la membrana celular, generando un lisofosfolípido, que luego es blanco de la lisofosfolipasa C que lo hidroliza a 2 – AG. (34,35)
Cabe destacar que el proceso de síntesis del endocannabinoide se lleva a cabo en terminales postsinápticos; una vez sintetizados estos pueden actuar en la propia célula donde se originaron, o ser liberado a la hendidura sináptica para que actúen en la terminal presináptica (señalización retrograda), o ejerzan acciones en otros tipos celulares a distancia como autocoides u hormonas. La albúmina y las lipocalinas son proteínas que pueden contribuir al proceso de transporte o difusión. (18,21,30) (Ver Figura 2).
Por su parte, el cese de la señal generada por los Endocanabinoides (EC) liberados de la terminal postsináptica se lleva a cabo en 2 pasos: inicialmente hay una recaptación o transporte a la célula donde se sintetizó y luego hay una subsecuente degradación enzimática. Estos procesos son los responsables del control específico de sus niveles en los tejidos. (36,37)
En primer lugar, la recaptación de la Anandamida (AEA) se lleva a cabo por un transportador que aún no ha sido clonado, sin embargo se sabe que es saturable y dependiente de la temperatura. (34) Además posee una amplia distribución a nivel cerebral. (38) Se han descubierto compuestos que inhiben este transportador y por lo tanto actúan como potenciadores de la señalización de los Endocanabinoides (EC), algunos son: AM404, VDM11, OMDM-1, OMDM-2, UCM707. Aún se encuentran en estudios preclínicos ya que podrían tener un potencial uso clínico en el futuro. (18) Por otra parte, muchos estudios sugieren que el transportador para Anandamida (AEA), es el mismo utilizado por el 2 – AG. (39, 40)
En el segundo paso, la degradación del endocanabinoide se puede llevar a cabo por hidrólisis y/o por oxidación. (41) El primer sistema enzimático lo constituye la hidrolasa de amidas de ácidos grasos (FAAH) que actúa principalmente sobre la Anandamida (AEA) y tiene una mínima acción sobre el 2 – AG.42 Y la otra enzima degradativa es la monoacilglicerol lipasa (MAGL) que actúa exclusivamente sobre este último compuesto. (43,44)
Ambas enzimas son hidrolasas de serina, pero la FAAH tiene una amplia distribución especialmente en cerebro y corazón. Mientras que la MAGL se ha determinado en neuronas cerebrales específicas. (45)
Asimismo, evidencia reciente sugiere que las ciclooxigenasas (COX – 1 y 2) son capaces de degradar los Endocanabinoides (EC) generando compuesto que aún pueden ser activos metabólicamente. (41,46) (Ver Figura 3).
Los Receptores Cannabinoides.
Para llevar a cabo sus efectos los cannabinoides deben unirse y activar receptores de membrana específicos, actualmente se han identificado y clonado 2 tipos de receptores: los receptores CB1 y CB2. Ambos son metabotrópicos y pertenecen a la superfamilia de receptores acoplados a proteína G, específicamente al tipo Gi/o (inhibe la síntesis de AMPc.) caracterizados por tener 7 dominios transmembrana. (11,18)
En 1990 Matsuda, descubrió el receptor CB1 (RCB1) en el cerebro de ratas por medio de técnicas de ADN recombinante, (47) se trata de una proteína transmembrana de 476 aminoácidos que por estudios autorradiográficos se ha localizado tanto en sistema nervioso central (SNC) como en tejidos periféricos. (9)
A nivel de sistema nervioso central (SNC), su distribución es heterogénea hallándose principalmente en corteza cerebral, hipocampo, núcleo caudado-putamen, substancia nigra pars reticulata, globo pálido y cerebelo. Y en menor densidad, se encuentra en hipotálamo, tronco encefálico, células gliales, médula espinal y también en el sistema nervioso periférico. (11,23,34) Al parecer no existe correlación directa entre la densidad de receptores y su funcionalidad, ya que en regiones donde ejercen una función importante, la cantidad de receptores es relativamente baja. Tal es el caso del hipotálamo donde actúan de forma clave en la modulación de la ingesta de alimentos y en aspectos relacionados al metabolismo energético. (17,48)
En cuanto a su distribución en órganos periféricos, hoy en día se sabe que estos receptores se expresan en tejidos metabólicos de relevancia como: el adiposo, el hígado, el músculo esquelético, el páncreas endocrino,…49 – 52 Y otros órganos que presentan RCB1 son: glándulas salivales, corazón, bazo, leucocitos, y zonas de los aparatos reproductor (testículos), urinario y gastrointestinal. (14,23)
Cabe destacar que el RCB1 es el más abundante de los acoplados a proteína G en el cerebro de mamíferos, y que al ser presináptico actúa en la modulación de algunos neurotransmisores como: GABA, glutamato, serotonina, dopamina, (16) Por lo tanto, es el encargado de regular los efectos psicoafectivos (centrales) de los cannabinoides. (53)
Por su parte, el receptor CB2 (RCB2) fue aislado por primera vez en 1993 por Munro y col. está formado por 360 aminoácidos. Ha sido localizado principalmente en células del sistema inmunológico: leucocitos, macrófagos, linfocitos T y B, bazo, amígdalas, nódulos linfáticos, timo, medula ósea,…(14,54)
De igual forma, en corazón (55) y a nivel de sistema nervioso central (SNC) en células de la microglia56 en mínima cantidad. Por lo tanto su papel está limitado a la modulación de la respuesta inmunológica a través de la liberación de citocinas. (14,57)
La homología existente entre ambos receptores es de aproximadamente 44 - 48%. (23,34,54) Otros receptores propuestos recientemente incluyen al GPR55, el cual comparte 13.5% de homología con RCB1 y 14.4% con RCB2, aún se discute su pertenencia al sistema endocanabinoide, ya que su mecanismo intracelular es diferente al de los receptores clásicos. 57
Asimismo el receptor activado por proliferadores de peroxisomas de tipo alpha (PPAR-alfa), y el canal de tipo 1 de potenciales transitorios del receptor vaniloide (TRVP1) son blanco de los endocannabinoides pero especialmente de las aciletanolamidas: oleiletanolamida y palmitiletanolamida. (58) El TRVP1 pertenece a una familia de canales catiónicos sensibles a pH, calor,… siendo sensible incluso a la Anandamida (AEA). (18) Pero no es sensible al 2 – AG y otros cannabinoides sintéticos, por esto no han sido considerados miembros del sistema. (59,60) (Ver Figura 4).
Mecanismos de Señalización de los Endocannabinoides.
Desde 2001 se sabe que los Endocanabinoides (EC) actúan como mensajeros “retrógrados” de las sinapsis nerviosas, hecho que marco un nuevo concepto en la señalización de moléculas difusibles moduladoras de la actividad sináptica. (61 – 63)
Posterior al proceso de síntesis en la neurona postsináptica, los EC se unen a su receptor ubicado en la membrana celular presináptica. Esta unión puede desencadenar la activación de varios sistemas de transducción de señal: (Ver Figura 4).
1. Inhibición en la producción de AMPc.: esta fue la primera vía de transducción de señal caracterizada para los RCB1, (64,65) mediada a través de proteína G inhibidora (Gi/o) capaz de bloquear la acción de la adenilatociclasa (AC) tanto en tejido neural como periférico,(54) modulando por lo tanto la actividad de la Proteincinasa A (PKA). (66)
2. Estimulación en la producción de AMPc: recientemente ha sido reportado que en ciertas células in vitro los ligandos de los receptores CB1 son capaces de activar la AC y aumentar los niveles de AMPc. intracelular, esto sugiere el posible acoplamiento a proteína G estimuladora (Gs). (67,68) Otros investigadores piensan que dicho efecto puede ser mediado por el dímero beta-gamma de la proteína Gi/o. (69)
3. Modulación de canales iónicos: se ha demostrado que los Endocanabinoides (EC) inhiben canales de calcio dependientes de voltaje tipo N/P/Q/L (predominantemente los localizados en las neuronas presinápticas), así como también activan canales de potasio rectificadores de entrada. (11,67,70) Todo este mecanismo conlleva a un estado de menor producción de potenciales de acción (hiperpolarización) de la neurona presináptica y a una disminución en la liberación de neurotransmisores tanto excitatorios (glutamato) como inhibitorios (GABA), debido a la menor disposición de iones de calcio. (21,54,71)
4. Activación de vías pro-mitogénicas (MAPK): la activación de los receptores acoplados a proteína G son capaces de regular la proliferación, diferenciación y muerte celular mediante la estimulación de cascadas enzimáticas tipo MAPK.71 Los Endocanabinoides (EC) modulan tales vías tanto en células in vitro como in vivo, y a pesar de que no se sabe el mecanismo preciso se ha descubierto que varía de acuerdo al grupo celular. (72,73) Posiblemente al inhibirse la AC y la PKA se activen cascadas como la de la proteína ERK1/2 y la PI3K/Akt. (66,74,75)
5. Activación de otras proteínas: se ha descubierto que luego de la activación de los RCB1 por sus respectivos ligandos en ciertos grupos celulares, se desencadenan vías de transducción de señal que promueven el aumento del Ca2+ intracelular. Posiblemente a través del dímero beta-gamma de la proteína Gi/o, capaz de estimular la acción de la Fosfolipasa C (PLC). (76,77) Por su parte, Lauckner y cols. demostraron que este incremento se generaba al activar proteína Gq/11 en células tipo HEK que expresaban RCB1. (78)
Además de las proteínas G, otras proteínas acopladas a los RCB1 son las beta-arrestinas, hasta ahora son pocos los datos disponibles en cuanto a su mecanismo de acción, pero parecen jugar un papel importante en la desensibilización e internalización de estos receptores. Sin embargo, aún falta mucho por esclarecer en las vías independientes de proteína G. (71,79,80)
Por otro lado, Stella ha reportado que los Endocanabinoides (EC) no solo se transmiten de una terminal sináptica a otra, sino que pueden actuar de forma autocrina y paracrina en varios sitios donde se sintetizan, como: células gliales, adipocitos, hepatocitos,… (81)
Esta amplia gama de mecanismos inter e intracelulares refleja la gran complejidad y versatilidad de los Endocanabinoides (EC) en el espectro de efectos fisiológicos que median en el hombre y su importancia como posibles objetivos terapéuticos en diversos trastornos.
Rol de los Endocannabinoides en el Balance Energético.
Desde hace siglos se relacionan los cannabinoides con la inducción del apetito, los primeros estudios en animales mostraban resultados contradictorios ya que dependían de varios factores como la dosis y la vía de administración del compuesto. De esta manera, ante dosis bajas se evidenciaba un aumento en la ingesta de alimentos (efecto orexígeno) pero cuando se elevaban las dosis hasta 10mg/kg, el efecto era hipofágico debido al predominio de las acciones de tipo sedante de las drogas. (17,18)
En 1970 Tart refirió que los individuos intoxicados con marihuana sufrían la apreciación de nuevas cualidades en los alimentos. (82) Posteriormente numerosos investigadores continuaron los estudios en humanos, aportando datos que sugieren que tales compuestos efectivamente producen un aumento en el peso corporal de los sujetos investigados, un incremento en la frecuencia de la ingesta de comida y del valor incentivo o hedónico hacia cierto tipo de alimentos, especialmente los dulces. (83,84)
Por lo tanto, en la actualidad la vinculación Sistema de Endocanabinoides (SEC) - regulación del apetito y balance energético está ampliamente documentada, estableciéndose tanto mecanismos centrales como periféricos en tal modulación. (85) (Ver Figura 5).
1. Mecanismos Centrales. El Sistema de Endocanabinoides (SEC) cerebral regula la ingesta de comida en dos niveles: Hipotálamo y Sistema Límbico. Siendo los más importantes en la modulación, tal como se evidencia por la alta densidad de RCB1 en el sistema nervioso central (SNC). (86)
• A nivel hipotalámico: es ampliamente conocido que el hipotálamo juega un papel clave en la integración de los diversos componentes bioquímicos y conductuales involucrados en la alimentación. Siendo los neurotransmisores implicados: la Hormona Alfa-Estimulante de Melanocitos (alfa-MSH) y el Transcripto relacionado con Cocaína y Anfetaminas (CART) como señalizadores anorexígenos (inductores de saciedad). Mientras que el Neuropéptido Y (NPY), la orexina y la Proteína relacionada con Agouti (AgRP) actúan como la contraparte orexígena (inductora del apetito). (87)
Los Endocanabinoides (EC) entran en este último grupo ya que la administración central (incluso intrahipotalámica) de Anandamida (AEA) y 2 – AG produce hiperfagia en roedores, este efecto es bloqueado ante la administración de un antagonista selectivo de los RCB1. (88,89) Asimismo el ayuno de aproximadamente 24 horas, conlleva a un incremento en los niveles de 2 – AG, para potenciar el apetito, y ante la ingesta de alimentos los niveles descienden nuevamente. (23)
Si el ayuno se prolonga durante varios días (aproximadamente 12 días), el Sistema de Endocanabinoides (SEC) se activa de forma “tónica”, con la finalidad de reducir la motivación para la búsqueda de alimentos con el objetivo de disminuir el gasto energético. (90)
Estas acciones de los Endocanabinoides (EC) y los diversos péptidos orexígenos, parecen regulados por la leptina, hormona sintetizada en el tejido adiposo que participa como un mediador hipotalámico esencial en el apetito. La cual inhibe la síntesis de Endocanabinoides (EC) en el hipotálamo de ratas normales. Mientras que en ratas genéticamente obesas se encuentran niveles elevados de todos los compuestos (Anandamida (AEA), 2 – AG y leptina). (23,91,92)
• A nivel del Sistema Límbico: el sistema mesolímbico dopaminérgico está conformado por varias estructuras entre ellas: el Área Tegmental Ventral (ATV), el Núcleo Accumbens (NAc), y la Corteza Frontal Medial (CFM). Este es influenciado por el Sistema de Endocanabinoides (SEC) evidenciado por la inhibición de la conducta motivacional hacia los alimentos, después de la administración de un antagonista de los receptores en animales de experimentación (21).
En síntesis, el Sistema de Endocanabinoides (SEC) forma parte del sistema de recompensa cerebral y tiene gran importancia en el origen de la conducta adictiva en general. Algunos hallazgos experimentales han sido: que durante el ayuno los niveles de Anandamida (AEA) y 2 – AG aumentan en el cerebro límbico, y que la administración de 2 – AG directamente en el NAc. produce una respuesta hiperfágica. (23 30)
Asimismo los cannabinoides parecen favorecer los ingesta de alimentos más apetitosos para el individuo (93) y la Anandamida (AEA) amplía la respuesta hedónica y motivacional a los dulces en la corteza cerebral, específicamente en el NAc. (94)
2. Mecanismos Periféricos. Existen evidencias experimentales que apoyan el papel que juega el Sistema de Endocanabinoides (SEC) en la regulación periférica del metabolismo energético. La presencia de RCB1 en órganos relacionados a esta función como: tejido adiposo,(95) hígado,(50) neuronas del tracto gastrointestinal,(96) músculo esquelético (97) y páncreas. (52) Además, al administrar bloqueadores de los RCB1 inicialmente se inhiben el consumo de alimentos, pero este efecto se atenúa gradualmente, mientras que la pérdida de peso corporal se mantiene incluso después del cese de las propiedades anorexígenas. (90) Otro hallazgo de interés, es la presencia de este efecto anorexígeno a pesar de que algunos de estos compuestos son incapaces de atravesar la barrera hematoencefálica
.
• A nivel de Tejido Adiposo: Pagano y cols. han descubierto que el tejido adiposo no solo posee RCB1, sino que también es rico en las enzimas que participan en la síntesis y degradación de los Endocanabinoides (EC), y que los niveles de estos compuestos son similares a los encontrados en el cerebro. (98) Asimismo se ha descubierto que en animales obesos existe una sobreexpresión de RCB1 en sus adipocitos. (99) Mientras que en cultivos de adipocitos tratados con agonistas cannabinoides se evidencia la activación de la lipoproteinlipasa, (49) y otras enzimas inductoras de lipogénesis; así como también hay una disminución en la expresión de la adiponectina (hormona que favorece la oxidación de ácidos grasos y la esterificación de triacilglicéridos) (100). La mayoría de estos efectos son explicados a nivel bioquímico por la inhibición de la PKA en este tejido por parte de los Endocanabinoides (EC). (101,102)
También se favorece la captación de glucosa en células grasas, y los Endocanabinoides (EC) son capaces de activar receptores nucleares tipo PPAR-γ, favorecedores de adipogénesis. (103) En caso contrario, en aquellos cultivos de adipocitos tratados de forma crónica con bloqueadores de los RCB1, presentan una reducción de la masa adiposa debido a un incremento en la tasa oxidativa por inducción de enzimas implicadas en la β-oxidación. (104)
• A nivel Hepático: Tras una dieta alta en grasas, el número de RCB1 en tejido hepático se eleva, al igual que los niveles de Anandamida (AEA); esto origina una mayor expresión de ciertos factores de transcripción como el SRBEP-1c y sus respectivas dianas los genes de la Acetil CoA – Carboxilasa-1 y la Sintetasa de Ácidos Grasos. Por lo tanto, se incrementa la síntesis de ácidos grasos, los niveles plasmáticos de triacilglicéridos (TAG), el peso corporal, y contribuye a la aparición de esteatosis hepática e insulinorresistencia. (50,105)
Por su parte, al administrar antagonistas de RCB1 la esteatosis hepática en ratas parece disminuir. (106)
• A nivel de Tracto Gastrointestinal: posterior a un ayuno de 24 horas, los niveles de Anandamida (AEA) aumentan a nivel intestinal, tras su síntesis en este tejido. Se ha planteado que esto constituye una señal orexigénica, ya que al destruir las neuronas aferentes periféricas con capsaicina se atenúan los efectos hiperfágicos de la Anandamida (AEA) y anoréxicos del Rimonabant. (23)
Adicional a esto, ante la activación CB1 se estimula la secreción de ghrelina en las células de la mucosa gástrica incrementado de esta manera el apetito. (107)
• A nivel de Músculo Esquelético: Liu y cols. han reportado la sobreexpresión de RCB1 en células musculares de ratones obesos. Cuando estos ratones con fenotipo ob/ob fueron tratados con un antagonista, se incrementó la captación de glucosa en el músculo esquelético aislado. (99)
Matías y cols. han demostrado la disminución en la captación de glucosa por el músculo así como su oxidación, y el descenso en el gasto energético tras la estimulación CB1. (101)
• A nivel Pancreático: Todos los estudios a este nivel se han realizado en ratones, los hallazgos indican que los RCB1 se presentan en las células alfa productoras de glucagón, mientras que en las células beta se encuentran los RCB2; ambos influyen en la regulación de la secreción de insulina. (108) Por otro lado, Nakata y cols. han demostrado que los agonistas CB1 inhiben la secreción insulínica, y la presencia únicamente de RCB1. (109)
Rol en el Tratamiento de la Obesidad. Manipulación del sistema.
La meta primordial en el tratamiento contra la obesidad es mejorar la calidad de vida del paciente mediante la disminución de su peso corporal mantenida a largo plazo. (110) Si este descenso es de 5 – 10% mejorará de igual forma el perfil cardiovascular del individuo, y sus respectivos factores de riesgo: presión arterial, colesterol total, glicemia, TAG, entre otros… Es bien conocido que el primer en paso en el tratamiento lo constituyen los cambios en el estilo de vida, es decir dieta, actividad física constante y terapia conductual. (7) Sin embargo, los resultados en ocasiones son poco efectivos a mediano y largo plazo, lo que hace necesario el uso de farmacoterapia. (111)
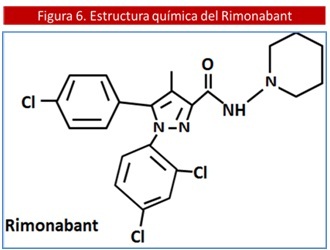
Ante la sobreactividad del Sistema de Endocanabinoides (SEC) en la obesidad, demostrado por estudios tanto en animales como en humanos,(85,111) la meta en los últimos años ha sido el diseño y utilización de un compuesto que actúe como un bloqueador de los RCB1 con la finalidad de atenuar su señalización. El de mayor difusión a nivel mundial ha sido el Rimonabant (SR141716), el cual afecta la expresión constitutiva de estos receptores, actuando por lo tanto como un agonista inverso. (18,112) Este fármaco, a nivel químico conocido como: (N-piperino-5-(4-clorofenyl)-1-(2,4-diclorofenil)-4-metilpyrazole-3-carboxamida), tiene una afinidad 1000 veces mayor por los RCB1 que por los RCB2. Y es capaz de participar en la regulación energética así como también en la modulación del hábito tabáquico a nivel del sistema nervioso central (SNC). (91) (Ver Figura 6)
Una vez descubierto el compuesto, y superadas las fases iniciales de evaluación, Sanofi-Aventis desarrollo un programa conformado por 4 ensayos clínicos con el fin de comprobar la seguridad y eficacia de Rimonabant como un posible tratamiento para la obesidad, además de su efecto farmacológico en la dislipidemia, diabetes mellitus y tabaquismo. (113) Estos ensayos clínicos fueron: RIO – Europe (114), RIO – North America, (115) RIO – Lipids116 y RIO – Diabetes,(117) en los cuales el número de participantes superó los 6000 individuos, y cuyos criterios de inclusión fueron la presencia de obesidad o sobrepeso junto con factores de riesgo asociados, en los 2 primeros ensayos. Mientras que en RIO – Lipids los pacientes obesos o con sobrepeso sufrían dislipidemias y en RIO – Diabetes los individuos presentaban esta enfermedad.
Los resultados de este programa multinacional, arrojaron una disminución significativa del peso corporal en aquellos pacientes tratados con 20mg/día de Rimonabant. Especialmente una reducción de la obesidad abdominal, (30) conjuntamente con la estabilización de los parámetros metabólicos como: descenso de los TAG, de la glicemia en ayuno, de los niveles de insulina y de HbA1c. Asimismo, se elevaron los niveles de HDL-c y adiponectina; comparado con el grupo tratado con placebo. (114,116-118) Estos hallazgos demuestran la eficacia de este fármaco no solo en el control del peso corporal sino también en la mejoría del perfil de factores de riesgo con los que cursa el paciente obeso.
Con respecto a sus efectos adversos, los más comunes fueron: cefalea, náuseas, mareos, diarrea; principalmente en pacientes tratados con 20mg/día del fármaco. (1169 Sin embargo, las reacciones adversas más severas son las de índole psiquiátrica caracterizadas por: depresión mayor, ideación suicida, ansiedad y trastornos del sueño. (119) Razón por la cual la Agencia Estadounidense para la Evaluación de los Fármacos y Alimentos (FDA) rechazó su uso al encontrar una incidencia de hasta 26% de estos trastornos en los ensayos clínicos. (18)
Por su parte en la Unión Europea, sí se autorizó su comercialización en junio de 2006 pero ante los hallazgos clínicos adversos, la Agencia Europea de Medicamentos (EMEA) lo retiró del mercado en octubre de 2008. (120) Probablemente los efectos secundarios psiquiátricos se deben al mecanismo de acción del Rimonabant, que al actuar como un agonista inverso afecta por ende la expresión constitutiva del receptor. Una alternativa propuesta ante este problema es la utilización de antagonistas neutrales capaces de mantener la mejoría metabólica sin efectos indeseados. (18) Otra alternativa es el empleo de agonistas parciales, de los cuales se ha reportado una menor incidencia de efectos adversos sin comprometer la eficacia clínica de la droga. (121). Un prototipo de estos compuesto está actualmente en las primeras fases de investigación, se trata de un ligando del receptor 5-HT6 conocido como E-6837 el cual constituye el futuro en el tratamiento antiobesidad. (122)
CONCLUSIÓN
Ante el creciente avance de la obesidad a nivel mundial debido a los inadecuados hábitos alimenticios de la población entre otras numerosas causas, que conllevan al desequilibro en el balance energético, se hace menester el tratamiento farmacológico para el control de esta enfermedad que compromete a varios aparatos y sistemas del cuerpo humano y que está asociada especialmente a patologías de origen cardiovascular.
Si bien la base del manejo del paciente con obesidad lo constituyen los cambios en el estilo de vida, no siempre éstos muestran resultados factibles a mediano y largo plazo. Siendo pertinente la administración de medicamentos que mantengan el descenso del peso corporal por tiempo prolongado. Desafortunadamente, son pocos los compuestos existentes actualmente capaces de ejercer este efecto, pero en los últimos años se han destinado esfuerzos hacia la búsqueda y diseño de nuevas terapias.
Tanto se ha investigado al respecto, que se ha relacionado y demostrado experimentalmente la actuación de los cannabinoides como sustancia inductoras del apetito, efecto que se conocía desde tiempos remotos, pero que ante el incremento en la utilización de éstos con fines recreativos, se hizo necesario evaluar las numerosas acciones que llevan a cabo en los individuos consumidores, además de sus posibles implicaciones terapéuticas.
Los hallazgos de que tales compuestos pueden ser sintetizados en el organismo, y que conforman un verdadero sistema (Sistema Endocannabinoide) capaz de participar en la regulación del apetito y de la homeostasis energética, ha llevado a los investigadores a considerarlo un objetivo promisorio en la creación de un fármaco antiobesidad. La comprensión en sus mecanismos de acción ha hecho posible el descubrimiento de su hiperactividad en los pacientes obesos, así como también el diseño de compuestos con propiedades bloqueadores de sus receptores tanto a nivel central como periférico, que hasta la fecha parecen mostrar resultados positivos y alentadores, no solo en la reducción del peso corporal sino también en la mejoría de los factores de riesgo cardiovascular propios del paciente con exceso de grasa abdominal y obesidad.
FIGURAS
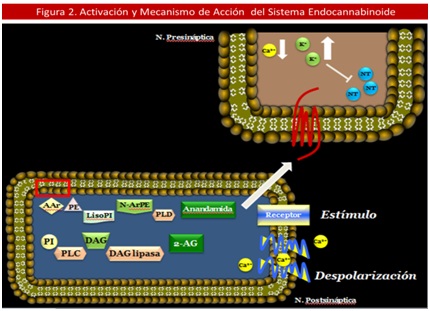
Diversos estímulos pueden conllevar a un incremento del calcio (Ca2+) intracelular en la neurona postsináptica, que desencadena la activación del sistema generando Anandamida y el 2-AG. Estos compuesto ejercen su acción en la neurona presináptica, aumentado los niveles de K+ y disminuyendo los de Ca2+ y AMPc intracelular, inhibiendo la liberación de los neurotransmisores. 2– AG = 2 – Araquidonilglicerol, N – ArPE = N – Araquidonil Fosfatidil Etanolamina, AAr = Acido Araquidónico, PE = Fosfatidil-Etanolamina, PLD = Fosfolipasa D, PI = Fosfatidil Inositol, PLC = Fosfolipasa C, DAG = Diacilglicerol lipasa, NT = Neurotransmisor.
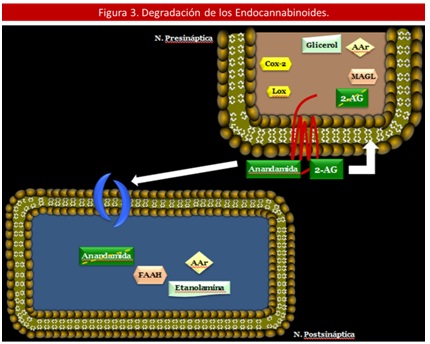
2– AG = 2 – Araquidonilglicerol, AAr = Acido Araquidónico, FAAH = Hidrolasa de Amidas de Ácidos Grasos, MAGL = Monoacilglicerol Lipasa, Cox – 2 = Ciclooxigenasa – 2, Lox=Lipooxigenasa.
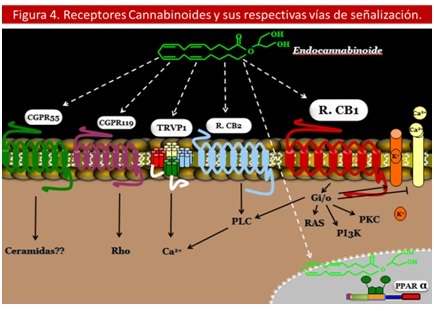
R. CB1-2 = Receptor Cannabinoide tipo 1-2, TRVP1 = canal de potenciales transitorios del receptor vaniloide, PPARα = Receptor activado por proliferadores de peroxisomas de tipo alpha, PKC = Proteín Cinasa C, PI3K = Fosfatidil Inositol 3-Kinasa.
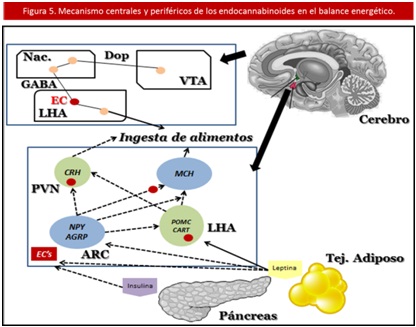
Los círculos rojos representan receptores Cannabinoides, las flechas continuas vías activadoras y las flechas punteadas vías inhibitorias. Dop = Vías Dopaminérgicas, GABA = Vías Gabaérgicas, VTA = Área Tegmental Ventral, Nac = Núcleo Acuminado, LHA = Núcleo Lateral Hipotalámico, PVN = Núcleo Paraventricular, ARC = Núcleo Arcuato, MCH = Hormona Concentradora de Melanina, CRH = Hormona Liberadora de Corticotropina, NPY = NeuropéptidoY, AGRP = Proteína relacionada con el Agouti, POMC = Proopiomelanocortina, CART = Transcrito regulado por anfetaminas y cocaína.
Referencias Bibliográficas.
1. Ogden CL, Carroll MD, y cols. 2006 Prevalence of overweight and obesity in the United States, 1999–2004. JAMA 295:1549–1555.
2. http://www.who.int/mediacentre/factsheets/fs311/es/index.html. Nota descriptiva N°311. Septiembre de 2006.
3. Sánchez-Castillo CP, Pichardo-Ontiveros E, López-R P. Epidemiología de la obesidad. Gac Méd Méx 2004. Vol.140, Suplemento No. 2.
4. Daza CH. La obesidad: un desorden metabólico de alto riesgo para la salud. Colomb Med 2002; 33: 72-80.
5. Cruz EC, Marín Patón M. Epidemiología de la obesidad. Trastornos del comportamiento alimentario en el niño. Primera Ed. 2001.
6. Wasan KM, Looije NA. Emerging Pharmacological Approaches to the Treatment of Obesity. J Pharm Pharmaceut Sci. 2005. 8 (2):259-271.
7. Díaz M. Presente y futuro del tratamiento farmacológico de la obesidad. Rev Argent Cardiol. 2005; 73:137-144.
8. Foster-Schubert KE, Cummings DE. Emerging Therapeutic Strategies for Obesity. Endocrine Reviews 27(7):779–793.
9. Netzahualcoyotzi-Piedra C, y cols. La marihuana y el sistema endocanabinoide: De sus efectos recreativos a la terapéutica. Rev Biomed 2009; 20:128-153.
10. Di Marzo V, Bifulco M, De Petrocellis. The endocannabinoid system and its therapeutic exploitation. Nature Reviews Drug Discovery 2004; 3: 771-84.
11. Rodríguez U, Carrillo E, Soto E. Cannabinoides: Neurobiología y usos médicos. Elementos. 2005; 60: 3-9.
12. Valenzuela Montero A. Obesidad y Sistema Endocannabinoide. Obesidad. 2007. Vol. 18, Num. 3: 7-10.
13. Howlett AC, Breivogel CS, y cols. Cannabinoid physiology and pharmacology: 30 years of progress. Neuropharmacology. 2004; 47 Suppl 1: 345-58.
14. Grotenhermen F. Los cannabinoides y el sistema endocannabinoide. Cannabinoids 2006; 1(1):10-14.
15. Mechoulam R, Devane WA, Glaser R. Cannabinoid geometry and biological activity in marijuana/Cannabinoids. Neurobiology and Neurophysiology. 1992. p. 1-34.
16. Devane WA, y cols.Determination and characterization of a cannabinoid receptor in rat brain. Mol Pharmacol 1988; 34: 605-13.
17. Pagotto U, y cols. The emerging role of the endocannabinoid system in endocrine regulation and energy balance. Endocr Rev 2006; 27 (1): 73-100.
18. Bermúdez Silva FJ, y cols. El sistema endocannabinoide, homeostasis energética y obesidad: ¿el final o un nuevo comienzo? Revista Española de Obesidad. 2009. Vol. 7, Núm. 6. (342-359).
19. Mechoulam R, y cols. Identification of an endogenous 2-monoglyceride, present in canine gut, that binds to cannabinoid receptors. Biochem Pharmacol 1995; 50:83-90.
20. Rodríguez de Fonseca F. Sistema endocannabinoide y control de la ingesta. Rev Med Univ Navarra. 2004. Vol 48, Nš 2, 18-23.
21. Rodríguez de Fonseca F, y cols. The Endocannabinoid System: Physiology and Pharmacology. Alcohol & Alcoholism. 2005. Vol. 40, No. 1, pp. 2–14.
22. Oka, S., y cols. Ether-linked analogue of 2-arachidonoylglycerol (noladin ether) was not detected in the brains of various mammalian species. Journal of Neurochemistry (2003) 85, 1374–1381.
23. Zieher LM, Guelman LR. El sistema de los endocannabinoides y su rol en el control de la ingesta alimentaria. Psicofarmacología. 2005. 5:33.
24. De Petrocellis L, y cols. Finding of the endocannabinoid signalling system in Hydra, a very primitive organism: possible role in the feeding response. Neuroscience 1999; 92:377-387.
25. Soderstrom K, Leid M, Moore F, Murray T. Behavioral, pharmacological, and molecular characterization of an amphibian cannabinoid receptor. J Neurochem 2000;
75:413-423.
26. Alger BE. Endocannabinoids: getting the message across. Proc Natl Acad Sci US A 2004; 101: 8512-13.
27. Di Marzo V, y cols.. Leptin-regulated endocannabinoids are involved in maintaining food intake. Nature 2001; 410: 822-25.
28. Pagotto U, Vicennati V, Pasquali R. The endocannabinoid system and the treatment of obesity. Ann Med. 2005; 37: 270-5.
29. Piomelli D. The molecular logic of endocannabinoid signalling. Nat Rev Neurosci 2003; 4:873–884.
30. Feliciano JE, Mendivil CO, Sierra ID. Sistema Endocannabinoide: Modificando los factores de riesgo cardiovascular. Rev Fac Med Univ Nac Colomb 2006 Vol. 54 No. 4.
31. Stella, N. Piomelli, D. Receptor-dependent formation of endogenous cannabinoids in cortical neurons. European Journal of Pharmacology (2001) 425, 189–196.
32. Kim, J., Isokawa, M., Ledent, C. Alger, B. E. Activation of muscarinic acetylcholine receptors enhances the release of endogenous cannabinoids in the hippocampus. Journal of Neuroscience (2002) 22, 10182–10191.
33. Okamoto, Y., y cols. Molecular characterization of a phospholipase D generating anandamide and its congeners. Journal of Biological Chemistry (2004) 279, 5298–5305.
34. Kano M, y cols. Endocannabinoid-Mediated Control of Synaptic Transmission. Physiol Rev 2009. 89: 309–380.
35. Sugiura T, y cols. 2-Arachidonoylglycerol: a possible endogenous cannabinoid receptor ligand in brain. Biochem Biophys Res Commun, 1995. 215: 89–97.
36. Fowler CJ, Jacobsson SO. Cellular transport of anandamide, 2-arachidonoylglycerol and palmitoylethanolamide–targets for drug development? Prostaglandins Leukot Essent Fatty Acids, 2002. 66: 193–200.
37. McFarland MJ, Barker EL. Anandamide transport. Pharmacol Ther, 2004.104: 117–135.
38. Giuffrida, A., Beltramo, M. Piomelli, D. Mechanisms of endocannabinoid inactivation: biochemistry and pharmacology. Journal of Pharmacology and Experimental Therapeutics. (2001) 298, 7–14.
39. Beltramo M, Piomelli D. Carrier-mediated transport and enzymatic hydrolysis of the endogenous cannabinoid 2-arachidonylglycerol. Neuroreport, 2000.11: 1231–1235.
40. Bisogno T, y cols. The uptake by cells of 2-arachidonoylglycerol, an endogenous agonist of cannabinoid receptors. Eur J Biochem, 2001.268: 1982–1989.
41. Vandevoorde S, Lambert DM. The multiple pathways of endocannabinoid metabolism: a zoom out. Chem Biodivers, 2007. 4: 1858–1881.
42. Cravatt, B. F., y cols. Molecular characterization of an enzyme that degrades neuromodulatory fatty-acid amides. Nature. (1996) 384, 83–87.
43. Dinh TP, y cols. Brain monoglyceride lipase participating in endocannabinoid inactivation. Proc Natl Acad Sci USA, 2002. 99:10819–10824.
44. Dinh TP, Kathuria S, Piomelli D. RNA interference suggests a primary role for monoacylglycerol lipase in the degradation of the endocannabinoid 2 - arachidonoylglycerol. Mol Pharmaco, 2004. 66: 1260–1264.
45. Gulyas, A. I., y cols. Segregation of two endocannabinoid-hydrolyzing enzymes into pre- and postsynaptic compartments in the rat hippocampus, cerebellum and amygdala. European Journal of Neuroscience (2004) 20, 441–458.
46. Fowler C. The contribution of cyclooxygenase-2 to endocannabinoid metabolism and action. Br J Pharmacol 2007; 152(5): 594-601.
47. Matsuda LA, y cols. Structure of a cannabinoid receptor and functional expression of the cloned cDNA. Nature 1990; 346:561-4.
48. Marsicano G, Lutz B. Neuromodulatory functions of the endocannabinoid system. J Endocrinol Invest 2006; 29 (3 Suppl): 27-46.
49. Cota D, y cols. The endogenous cannabinoid system affects energy balance via central orexigenic drive and peripheral lipogenesis. J Clin Invest 2003; 112 (3): 423-31.
50. Osei-Hyiaman D, y cols. Endocannabinoid activation at hepatic CB1 receptors stimulates fatty acid synthesis and contributes to diet induced obesity. J Clin Invest 2005; 115 (5): 1298-305.
51. Cavuoto P, y cols. The expression of receptors for endocannabinoids in human and rodent skeletal muscle. Biochem Biophys Res Commun 2007; 364 (1): 105-10.
52. Juan-Picó P, y cols. Cannabinoid receptors regulate Ca(2+) signals and insulin secretion in pancreatic beta-cell. Cell Calcium 2006; 39 (2): 155-62.
53. Ishac EJ, y cols. Inhibition of exocytotic noradrenaline release by presynaptic cannabinoid CB1 receptors on peripheral sympathetic nerves. Br J Pharmacol 1996; 118:2023-28.
54. Howlett AC, y cols. International Union of Pharmacology. XXVII. Classification of Cannabinoid Receptors. Pharmacological Reviews 2002; 54(Suppl 2): 161-202.
55. Lepicier P, Bouchard JF, Lagneux C, Lamontagne D. Endocannabinoids protect the rat isolated heart against ischaemia. Br J Pharmacol 2003; 139:805-15.
56. Núñez E, Benito C, y cols. Glial expression of cannabinoid CB2 receptors and fatty acid amide hydrolase are beta amyloid-linked events in Down’s syndrome. Neurosci 2008; 151:104-10.
57. Lunn, CA. A novel cannabinoid peripheral cannabinoid receptor-selective inverse agonist blocks leukocyte recruitment in vivo. J Pharmacol Exp Ther 2006; 316:780-8.
58. Henstridge C, Balenga N, y cols. The GPR55 ligand L-alpha-lysophosphatidylinositol promotes RhoA-dependent Ca2+ signaling and NFAT activation. FASEB J 2009; 23 (1): 183-93.
59. Lo Verme J, y cols. The nuclear receptor peroxisome proliferator-activated receptor-alpha mediates the antiinflammatory actions of palmitoylethanolamide. Mol Pharmacol 2005; 67(1): 15-9.
60. Zygmunt PM, y cols. Vanilloid receptors on sensory nerves mediate the vasodilator action of anandamide. Nature 1999; 400: 452–457.
61. Maejima T, Hashimoto K, Yoshida T, Aiba A, Kano M. Presynaptic inhibition caused by retrograde signal from metabotropic glutamate to cannabinoid receptors. Neuron 2001; 31: 463–475.
62. Ohno-Shosaku T, Maejima T, Kano M. Endogenous cannabinoids mediate retrograde signals from depolarized postsynaptic neurons to presynaptic terminals. Neuron 2001; 29: 729–738.
63. Wilson RI, Nicoll RA. Endogenous cannabinoids mediate retrograde signalling at hippocampal synapses. Nature 2001; 410: 588–592.
64. Howlett AC & Fleming RM. Cannabinoid inhibition of adenylate cyclase. Pharmacology of the response in neuroblastoma cell membranes. Molecular Pharmacology 1984. 26 532–538.
65. Howlett AC. Cannabinoid inhibition of adenylate cyclase. Biochemistry of the response in neuroblastoma cell membranes. Molecular Pharmacology 1985. 27 429–436.
66. Howlett AC. Cannabinoid receptor signalling. Handbook of Experimental Pharmacology 2005.168 53–79.
67. Glass M & Felder C. Concurrent stimulation of cannabinoid CB1and dopamine D2 receptors augments cAMP accumulation in striatal neurons: evidence for a Gs linkage to the CB1 receptor. Journal of Neuroscience 1997. 17 5327–5333.
68. Kearn CS, y cols. Concurrent stimulation of cannabinoid CB1 and dopamine D2 receptors enhances heterodimer formation: a mechanism for receptor cross-talk? Molecular Pharmacology 2005. 67 1697–1704.
69. Rhee MH, y cols. Cannabinoid receptor activation differentially regulates the various adenylyl cyclase isozymes. Journal of Neurochemistry 1998. 71 1525–1534.
70. Turu G & Hunyady L. Signal transduction of the CB1 cannabinoid receptor. Journal of Molecular Endocrinology (2010) 44, 75–85.
71. Ameri A. The effects of cannabinoids on the brain. Progress in neurobiology (1999) 58; 315-348.
72. Demuth DG & Molleman A. Cannabinoid signalling. Life Sci. 2006 2; 78(6):549-63.
73. Moranta D. y cols. Acute, chronic and withdrawal effects of the cannabinoid receptor agonist WIN55212-2 on the sequential activation of MAPK/Raf-MEK-ERK signaling in the rat cerebral frontal cortex: short-term regulation by intrinsic and extrinsic pathways. J Neurosci Res. 2007 15; 85(3):656-67.
74. Davis MI, Ronesi J & Lovinger DM. A predominant role for inhibition of the adenylate cyclase/protein kinase A pathway in ERK activation by cannabinoid receptor 1 in N1E–115 neuroblastoma cells. Journal of Biological Chemistry 2003. 278 48973–48980.
75. Galve-Roperh I, y cols. Mechanism of extracellular signal-regulated kinase activation by the CB(1) cannabinoid receptor. Molecular Pharmacology 2002. 62 1385–1392.
76. Sugiura T, y cols. 2-Arachidonoylglycerol, a putative endogenous cannabinoid receptor ligand, induces rapid, transient elevation of intracellular free Ca2C in neuroblastoma! glioma hybrid NG108-15 cells. Biochemical and Biophysical Research Communications 1996. 229 58–64.
77. Sugiura T, Kodaka T, y cols. Is the cannabinoid CB1 receptor a 2-arachidonoylglycerol receptor? Structural requirements for triggering a Ca2C transient in NG108-15 cells. Journal of Biochemistry 1997. 122 890–895.
78. Lauckner JE, Hille B & Mackie K. The cannabinoid agonist WIN55,212-2 increases intracellular calcium via CB1 receptor coupling to Gq/11 G proteins. PNAS 2005. 102 19144–19149.
79. Jin W, y cols. Distinct domains of the CB1 cannabinoid receptor mediate desensitization and internalization. Journal of Neuroscience 1999. 19 3773–3780.
80. Breivogel CS, y cols. Sensitivity to delta9-tetrahydrocannabinol is selectively enhanced in beta-arrestin2 K/K mice. Behavioural Pharmacology 2008. 19 298–307.
81. Stella N. Cannabinoid signaling in glial cells. Glia 2004. 48:267–277.
82. Tart C. Marijuana intoxication: Common experiences. Nature, 1970, Vol. 226. 701-704.
83. Abel EL. Effects of marihuana on the solution of anagrams, memory and appetite. Nature 1971 28; 231-260.
84. Foltin RW, Brady JV Behavioral analysis of marijuana effects on food intake in humans. Pharmacol Biochem Behav.1986 25(3):577-82.
85. Matias I y Di Marzo V. Endocannabinoids and the control of energy balance. Trends Endocrinol Metabol (2007) 18 27–37.
86. Engeli S, y cols. Activation of the peripheral endocannabinoid system in human obesity. Diabetes. 2005; 54: 2838-43.
87. Mendivil CO, Sierra ID. Avances en obesidad. Rev Fac Med Univ Nac Colomb 2004; 52(4): 270-286.
88. Jamshidi N, Taylor DA. Anandamide administration into the ventromedial hypothalamus stimulates appetite in rats. Br J Pharmacol. 2001; 134: 1151-1154.
89. Kirkham TC, Williams CM, Fezza F, Di Marzo V. Endocannabinoid levels in rat limbic forebrain and hypothalamus in relation to fasting, feeding and satiation: stimulation of eating by 2-arachidonoyl glycerol. Br J Pharmacol. 2002; 136: 550-7.
90. Fride E, Bregman T, Kirkham TC. Endocannabinoids and food intake: newborn suckling and appetite regulation in adulthood. Exp Biol Med (Maywood). 2005 230(4):225-34.
91. López-Jaramillo P, y cols. El sistema endocanabinoide y su relación con la obesidad abdominal y el síndrome metabólico: implicaciones terapéuticas. Rev. Col Cardiol. 2005. Vol. 12 No. 3 113-121.
92. García Barreno P. Gordos y Flacos. Rev.R.Acad.Cienc.Exact.Fís.Nat. 2007. Vol. 101, Nš. 2, pp 361-387.
93. Arnone, M, et al. Selective inhibition of sucrose and ethanol intake by SR 141716, an antagonist of central cannabinoid (CB1) receptors. Psychopharmacol. 1997. 132:104-106.
94. Mahler SV, Smith KS, Berridge KC. Endocannabinoid hedonic hotspot for sensory pleasure: anandamide in nucleus accumbens shell enhances 'liking' of a sweet reward. Neuropsychopharmacology 2007. 32 (11): 2267–78.
95. Despres JP. The endocannabinoid system: a new target for the regulation of energy balance and metabolism. Critical Pathways in Cardiology 2007 6 46–50.
96. Croci T, y cols. In vitro functional evidence of neuronal cannabinoid CB1 receptors in human ileum. British Journal of Pharmacology 1998. 125 1393–1395.
97. Liu YL, Connoley IP, Wilson CA & Stock MJ. Effects of the cannabinoid CB1 receptor antagonist SR141716 on oxygen consumption and soleus muscle glucose uptake in Lep(ob)/Lep(ob) mice. International Journal of Obesity 2005. 29 183–187.
98. Pagano C, y cols. The endogenous cannabinoid system stimulates glucose uptake in human fat cells via phosphatidylinositol 3-kinase and calciumdependent mechanisms. Journal of Clinical Endocrinology and Metabolism 2007. 92 4810–4819.
99. Bensaid M, y cols. The cannabinoid CB1 receptor antagonist SR141716 increases Acrp30 mRNA expression in adipose tissue of obese fa/fa rats and in cultured adipocyte cells. Mol Pharmacol 2003; 63: 904-914.
100. Matias I, y cols. Regulation, function, and dysregulation of endocannabinoids in models of adipose and beta-pancreatic cells and in obesity and hyperglycemia. Journal of Clinical Endocrinology and Metabolism 2006. 91 3171–3180.
101. Matias I, Cristino L, Di Marzo V. Endocannabinoids: some like it fat (and sweet too). J Neuroendocrinol. 2008; 20 Suppl 1:100-9.
102. Kola B, y cols. Cannabinoids and ghrelin have both central and peripheral metabolic and cardiac effects via AMP-activated protein kinase. Journal of Biological Chemistry 2005. 280 25196–25201.
103. Pagano C, Rossato M, Vettor R. Endocannabinoids, adipose tissue and lipid metabolism. J Neuroendocrinol. 2008. 20 Suppl 1:124-9.
104. Jbilo O, y cols. The CB1 receptor antagonist rimonabant reverses the diet-induced obesity phenotype through the regulation of lipolysis and energy balance. FASEB Journal 2005 19 1567–1569.
105. Jesudason D & Wittert G. Endocannabinoid system in food intake and metabolic regulation. Current Opinion in Lipidology 2008. 19 344–348.
106. Gary-Bobo M, y cols. Rimonabant reduces obesity-associated hepatic steatosis and features of metabolic syndrome in obese Zucker fa/fa rats. Hepatology 2007. 46 122–129.
107. Zbucki RL, Sawicki B, et al. Cannabinoids enhance gastric X/A-like cells activity. Folia Histochem Cytobiol. 2008; 46(2):219-24.
108. R. Nogueiras, y cols. The Endocannabinoid System and the Control of Glucose Homeostasis. J Neuroendocrinol. 2008. 20 Suppl 1:147-151.
109. Nakata M, Yada T. Cannabinoids inhibit insulin secretion and cytosolic Ca2+ oscillation in islet beta-cells via CB1 receptors. Regul Pept (2008) 145:49–53.
110. Joyal SV. A perspective on the current strategies for the treatment of obesity. Curr Drug Targets CNS Neurol Disord. 2004; 3:341-56.
111. Gutt S. Tratamiento farmacológico de la obesidad. Abordaje farmacológico. Rev. Hosp. Ital. B Aires. 2009; Vol. 29. Nš 1. 10-16.
112. Makriyannis A, Mechoulam R, Piomelli D. Therapeutic opportunities through modulation of the endocannabinoid system. Neuropharmacology (2005) 48 1068-1071.
113. Rinaldi-Carmona M, y cols. SR141716A, a potent and selective antagonist of the brain cannabinoid receptor. FEBS Letters 1994. 350 240–244.
114. Van Gaal LF, y cols. Effects of the cannabinoid-1 receptor blocker rimonabant on weight reduction and cardiovascular risk factors in overweight patients: 1-year experience from the RIO-Europe study. Lancet 2005. 365 1389–1397.
115. Pi-Sunyer FX, y cols. Effect of rimonabant, a cannabinoid-1 receptor blocker, on weight and cardiometabolic risk factors in overweight or obese patients: RIO-North America: a randomized controlled trial. Journal of the American Medical Association 2006. 295 761–775.
116. Despres JP, Golay A & Sjostrom L. Effects of rimonabant on metabolic risk factors in overweight patients with dyslipidemia. New England Journal of Medicine 2005. 353 2121–2134.
117. Scheen AJ, y cols. Efficacy and tolerability of rimonabant in overweight or obese
patients with type 2 diabetes: a randomised controlled study. Lancet 2006. 368 1660–1672.
118. Scheen AJ. Effects of rimonabant in patients with type 2 diabetes mellitus. Results of the RIO DIABETES trial. Paper presented at American Diabetes Association, San Diego, CA, 2005.
119. Nissen SE, y cols. Effect of rimonabant on progression of atherosclerosis in patients with abdominal obesity and coronary artery disease: the STRADIVARIUS randomized controlled trial. Journal of the American Medical Association 2008. 299 1547–1560.
120. Butler H & Korbonits M. Cannabinoids for clinicians: the rise and fall of the cannabinoid Antagonists. European Journal of Endocrinology (2009) 161 655–662.
121. Ohlsen R, Pilowsky L. The place of partial agonism in psychiatry: recent developments. J Psychopharmacol 2005; 19 (4): 408-13.
122. Fisas A, y cols. Chronic 5-HT6 receptor modulation by E-6837 induces hypophagia and sustained weight loss in diet-induced obese rats. British Journal of Pharmacology 2006. 148 973–983.