La hipertermia maligna (HM) es una rara enfermedad metabólica muscular que generalmente se desencadena ante la exposición de ciertas drogas usadas en la anestesia general en personas susceptibles. Específicamente los agentes más implicados son: los anestésicos volátiles y el relajante muscular despolarizante succinilcolina. Estas drogas pueden inducir un incremento descontrolado del metabolismo muscular, superando las capacidades del cuerpo de suplir las necesidades de oxígeno, remover el dióxido de carbono y regular la temperatura muscular, pudiendo ocasionar eventualmente el colapso circulatorio y llevar a la muerte si no se trata rápidamente. La hipertermia maligna (HM) es una enfermedad heredada en forma autosómica dominante.
Caso clínico. ¿Un caso de hipertermia maligna?
Mariana Cecilia Musciatti. Servicio de Anestesiología y Terapia Intensiva. Sanatorio Santa Fe – Ciudad de Santa Fe
PALABRAS CLAVE:
ESPAÑOL: hipertermia maligna - relajantes musculares despolarizantes – succinilcolina – anestésicos inhalatorios halogenados – halotano – enflurano - isoflurano - desflurano – sevoflurano - síndrome neuroléptico maligno - neurolépticos - haloperidol - flufenazina – perfenazina - trifluperazina -cloropromacina - tioridazina – miopatía - dantrolene sódico - gen receptor de la rinodrina (RyR1) - rigidez muscular - radbomiólisis
INGLÉS: malignant hyperthermia - depolarizing muscle relaxant succinylcholine - volatile anesthetic agents - halothane – enflurane - isoflurane - sevoflurane - desflurane - neuroleptic malignant syndrome - neuroleptic agents – haloperidol – fluofenazine – perfenazin - chlorpromazine – trifluperazin – tioridazin - dantrolene sodium - myopathy - ryanodine receptor gene (RYR1) - rigid muscles - rhabdomyolysis
RESÚMENES EN CASTELLANO Y EN INGLÉS:
RESUMEN:
La hipertermia maligna (HM) es una rara enfermedad metabólica muscular que generalmente se desencadena ante la exposición de ciertas drogas usadas en la anestesia general en personas susceptibles. Específicamente los agentes más implicados son: los anestésicos volátiles y el relajante muscular despolarizante succinilcolina. Estas drogas pueden inducir un incremento descontrolado del metabolismo muscular, superando las capacidades del cuerpo de suplir las necesidades de oxígeno, remover el dióxido de carbono y regular la temperatura muscular, pudiendo ocasionar eventualmente el colapso circulatorio y llevar a la muerte si no se trata rápidamente. La hipertermia maligna (HM) es una enfermedad heredada en forma autosómica dominante.
El defecto más típico es una mutación localizada en el cromosoma 19 que involucra al receptor de la rinodrina. La hipertermia maligna (HM) es usualmente revelada durante la anestesia, o cuando algún familiar ya ha padecido esos síntomas. No es fácil arribar a su diagnóstico. Cuando es descubierto durante un procedimiento, el tratamiento con dantrolene sódico es instaurado; el uso de dantrolene además de la interrupción de la anestesia en pacientes susceptibles reduce la mortalidad de dicho trastorno. Es muy importante tener en cuenta dicha patología así como sus diagnósticos diferenciales durante la Anestesia General y en la UTI (Unidad de terapia intensiva), así como eventualmente en Unidades de Emergencias Médicas.
REVIEW:
Malignant hyperthermia (MH) is a rare metabolic disease of muscle that is usually triggered by exposure to certain drugs used for general anesthesia in susceptible individuals. Particularly, the volatile anesthetic agents and the despolarizing muscle relaxant succinylcholine. These drugs can induce a drastic and uncontrolled increase in skeletal muscle metabolism, which overwhelms the body's capacity to supply oxygen, remove carbon dioxide, and regulate body temperature, eventually leading to circulatory collapse and even death if not treated quickly. Malignant hyperthermia's inheritance is autosomal dominant.
The most typical defect is located on the long arm of the nineteenth chromosome, involving the ryanodine receptor. Malignant hyperthermia (MH) is usually revealed by anesthesia, or when a family member develops the symptoms. There is no simple, straightforward test to diagnose the condition. When Malignant hyperthermia (MH) develops during a procedure, treatment with dantrolene sodium is usually initiated; dantrolene and the avoidance of anesthesia in susceptible people have markedly reduced the mortality from this condition.It is very importan to take into account this disease as well as its differential diagnosis during general anesthesia and in intensive care unit and eventually in unit of medical emergencies
HIPERTERMIA MALIGNA:
PRESENTACIÓN DE UN CASO:
PACIENTE:
Sexo: MASCULINO
Edad: 43 AÑOS
Antecedentes Patológicos:
Diabetes mellitus tipo II, medicado con Metformina (850 mg/día).
Neumonía grave hace aprox. 3 años que requirió asistencia respiratoria mecánica (ARM) prolongada, complicada con estenosis traqueal, por lo cual requirió múltiples intervenciones quirúrgicas para colocación de stent traqueal.
Motivo de ingreso: intervención quirúrgica programada para recolocación de stent traqueal.
Intervención:
Ingresa a quirófano el 16/03 a las 12:00 hs para recolocación de stent traqueal.
Se realiza anestesia general balanceada con sevofluorano + remifentanilo. Previa Inducción con fentanilo-propofol y relajación muscular con succinilcolina-vecuronio.
Evolución durante la intervención: Hemodinámicamente estable, temperatura normal, normocápnico, sin complicaciones intraoperatorias.
Al finalizar la cirugía: el paciente es trasladado a Unidad de Terapia Intensiva (UTI), extubado, lúcido, vigil, saturación 93% (aire ambiente) y en buenas condiciones hemodinámicas.
Evolución:
A 6 hs del post-operatorio comienza con alteración del estado de conciencia, deterioro del sensorio y excitación psicomotriz, para lo cual se medica con haloperidol y midazolan vía intravenosa; 2 horas más tarde agrega hipertermia persistente (40-41°) que no responde a los antipiréticos ni medios físicos. Además presenta alteración de la mecánica respiratoria con abundantes secreciones.
SV:
Tensión arterial (TA): 135/75 mmHg
Frecuencia cardiaca (FC): 98 latidos por minuto
Frecuencia respiratoria (FR): 24 respiraciones por minuto
Saturación (SAT): 93% (Fio2 50%)
DIURESIS: conservada
Conducta inicial:
Se pancultiva, y comienza tratamiento antibiótico (ATB) con vancomicina + imipenen.
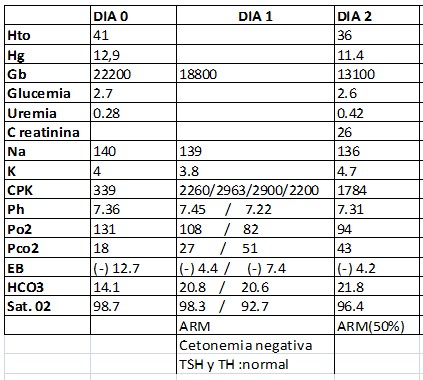
Laboratorio:
Hematocrito (Hto): 41%
Hemoglobina (Hg): 12,9 gr/dl
Leucocitos (Gb): 22.200/mm3
Glucemia: 2,71 mg/dl Uremia: 0,28 mg/dl
CPK: 339 U/ml
Ionograma: Na+:140 mEq/l K+:4 mEq/l
Equilibrio ácido-base (EAB):
PH: 7,24
PO2: 131 mmHg
PCO2: 18,1 mmHg
Exceso de bases (EB):-12,7
HCO3: 14 mEq/l
Saturación: 98.7%
Electrocardiograma (ECG): ritmo sinusal. Eje 45°. Taquicardia sinusal.
Rx Tórax: Mala técnica. Sin evidencia de infiltrados pulmonares.
A las 20 horas: continúa con igual signo sintomatología.
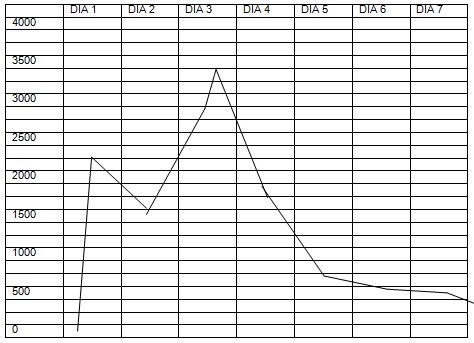
Se recibe CPK en aumento (2260).
Ante ausencia de evidencia clara de otra etiología que justifique el cuadro, se sospecha una probable de hipertermia maligna.
A las 24 horas: comienza tratamiento (día 1) con dosis de carga de dantrolene a 2mg/kg y mantenimiento a 2mg/kg c/8 horas.
Evoluciona hipertenso, taquicárdico y empeorando la mecánica respiratoria con rales bilaterales en ambos pulmones. Se interpreta el cuadro como edema agudo de pulmón, se realiza tratamiento sintomático y horas más tarde se coloca en asistencia respiratoria mecánica (ARM) con mejoría del cuadro.
Electrocardiograma (ECG): Ritmo sinusal. Taquicardia sinusal. Sin trastornos ST-T.
Rx Tórax: Sin evidencia de infiltrados pulmonares. Redistribución de flujo
Día 2: estable hemodinámicamente. Continúa mantenimiento. T° (38-38₅°↓) CPK: 1784↓
Día 3: Persiste hipertérmico con aumento de curva térmica (39-39₅°↑) y aumento de CPK (2935↑). Por sospecha de recidiva se realiza nueva carga de dantrolene a 2mg/kg.
Evoluciona con disminución curva térmica (37₅-38₂↓). CPK (3500↑).
Hemocultivos: 1/1 + Klebsiella oxytoca sensible a ciprofloxacina, cefalosporinas de primera generación y gentamicina.
Urocultivo: negativo.
Ecocardiograma: Tamaño cavidades normales. Función VI normal. Sin evidencia de vegetaciones.
Día 4: estable hemodinámicamente. Temperatura en descenso (37₃-37₅°↓). CPK: 1983↓. Presenta episodio de disminución de la saturación de oxígeno, empeoramiento de la mecánica respiratoria, roncus, sibilancias y rales bilaterales. Se interpreta cuadro como probable bronco aspiración vs edema agudo de pulmón. Se inician medidas de tratamiento de insuficiencia respiratoria con buena evolución. Se realiza nueva carga de dantrolene a 2mg/kg. y continua con mantenimiento.
Nuevo episodio de aumento de la t° (38.7 °C)
Día 5: Estable. T° (<38°). CPK en descenso (900↓).
Se cambia stent traqueal. Se coloca montgomery.
Se disminuye mantenimiento de dandrolene 1mg/kg c/8hs. Se disminuyen sedantes y analgésicos para destete.
Día 6: Estable. Temperatura normal (36.7°C). Lúcido, vigil, OTE, Moviliza 4 miembros. CPK continúa en descenso (585↓). Se disminuye la dosis de dantrolene a 0.5 mk/kg durante 8 hs y se suspende la infusión. Continúa la diminución de sedantes y analgésicos.
Día 7: Estable. Mantiene igual temperatura. Se retira de asistencia respiratoria mecánica (ARM). CPK (565↓)
Día 10: Pasa sala general. CPK (278). Se informa mioglobinuria negativa.
LABORATORIO:
CURVA DE CPK:
¿Qué es la hipertermia maligna?
La hipertermia maligna es una enfermedad fármaco-genética caracterizada por un síndrome hipermetabólico muscular desencadenado por una alteración en la regulación del calcio.
Se da en pacientes genéticamente susceptibles y se desencadena tras la exposición a ciertos agentes, fundamentalmente algunos anestésicos. Se hereda por un desorden autosómico dominante.
Su prevalencia e incidencia exacta es desconocida, es difícil de establecer debido a que muchos casos cursan con manifestaciones medias no conocidas y además el rasgo heredado tiene penetrancia reducida y expresividad variable, pero se estima que promedia 1 de cada 250.000 anestesias generales y 1 de cada 62.000 anestesias con Succinilcolina o Halogenados, siendo mayor en niños.
El trastorno genético más conocido es una mutación del gen que codifica el receptor ritodrínico (RYR1), ubicado en el cromosoma 19, de carácter autosómico dominante, que produce defectos en los canales receptores de rianodina (La rianodina es un alcaloide con propiedades insecticidas que permitió caracterizar dichos canales y que por ello que llevan el nombre de receptores para rianodina) que se encuentra en la membrana del retículo sarcoplásmico, provocando dicha alteración en el metabolismo del calcio. También se han descripto mutaciones de otros genes.
Los fármacos principalmente implicados son los anestésicos volátiles halogenados (halotano, enflurano, isoflurano, desflurano, sevoflurano) y relajantes musculares despolarizantes como la succinilcolina. El calcio juega un importante papel en la contracción muscular.
Cuando el potencial de acción se propaga a través de la membrana de cada fibra muscular, (sarcolema) lo hace hasta el interior de las mismas llegando hasta el retículo endoplasmático, que en el músculo se llama retículo sarcoplásmico, dispuesto a manera de un sistema de túbulos situados a lo largo de las fibras musculares esqueléticas que facilitan dicha transmisión del potencial de acción al interior de la fibra muscular. La fibra muscular se compone de miofibrillas que a su vez poseen filamentos gruesos: miosina y finos: actina, cuyo deslizamiento entre sí genera el proceso de contracción.
La unión entre ambos se encuentra impedida por unas proteínas que controlan dicho proceso, lo que resulta en mantener el músculo relajado hasta que media la contracción. Dichas proteínas se llaman Troponina y Tropomiosina y forman un complejo que bloquen en apariencia físicamente el sitio de interacción entre los filamentos y que sufren un cambio conformacional al unirse al calcio liberado del retículo sarcoplásmico durante la estimulación neuromuscular, lo cual lleva a que se descubra el mismo facilitando el deslizamiento filamentoso. Para que cese dicha contracción, lógicamente es necesario que el calcio sea removido, proceso en el cuál interviene el retículo sarcoplásmico a través de su recaptación. Este proceso está mediado por una bomba, continuamente activa, que se localiza en las paredes del retículo sarcoplásmico, bajo la cual existe un canal de liberación del calcio que es el que conocemos como receptor de rianodina. La bomba extrae el calcio del sarcoplasma que rodea los filamentos, de vuelta a las cavidades del retículo sarcoplásmico. Una mutación en el receptor de rianodina puede, por tanto, alterar su funcionalidad, con lo que la relajación muscular no tiene lugar y en consecuencia se mantiene la contracción muscular.
Se la ha relacionado con enfermedades musculares como miopatía multimininuclear (multi -minicore) y la miopatía centronuclear (central core).
Manifestaciones Clínicas:
Las mismas se producen debido a la contractura muscular sostenida y rabdomiolisis:
• Contracturas o rigidez muscular: uno de los síntomas más característicos, se da en el 80% de los casos
• Espasmo maseterino: signo importante ya que es uno de los primeros en aparecer y se pone de manifiesto al no poder abrirse bien la boca del paciente para intubarlo.
• Taquicardia
• Presión arterial inestable
• Hipertermia*
• Taquipnea
• Sudoración
• Cianosis periférica
• Arritmias
• Hiperpotasemia
• Aumento de la CPK
• Mioglobinuria
• Acidosis metabólica
* El inicio de la hipertermia es variable, siendo a veces tardío y se pueden alcanzar temperaturas de hasta 40-43ş, como consecuencia aparece la sudoración y rubefacción a nivel de cráneo, cuello y tórax superior.
Complicaciones:
• Insuficiencia renal: puede ser una complicación a causa de hipoperfusión renal (IRA prerrenal) o por lesión tubular de la mioglobinuria (IRA renal).
• ICC (insuficiencia cardíaca congestiva)
• CID (coagulación intravascular diseminada)
• Síndrome compartimental
• Mortalidad aún con tratamiento: 7-10%
Formas de presentación clínica:
• Formas de aparición rápida: con contractura muscular. con hipertermia progresiva. asociado al uso de succinilcolina, en general en su forma mayor.
• Formas de aparición tardía: generalmente durante la anestesia o posterior con o sin contracturas musculares. con hipertermia progresiva. asociado al uso de agentes inhalatorios. pueden tener la forma mayor o menor.
Los pacientes susceptibles podrían haber tolerado una anestesia previa.
Evolución del cuadro:
• Crisis mayor: Corresponde la clínica clásica, anteriormente detallada.
• Crisis menor o abortiva: Son aquellas que se autolimitan, detienen su evolución, o lo hacen en una forma solapada, atípica, con la sintomatología incompleta siendo su diagnostico por descarte o casual. Debe tratarse igual porque puede tener evolución fatal.
Se puede dar en el preoperatorio, en pacientes portadores de stress, intraquirúrgico, por agentes gatillo, postoperatorio, pacientes susceptibles sin recaudos en cuanto dolor, stress y temperatura ambiente. La CPK en postquirúrgica hace un pico entre las 6 y 10 hs, y desciende luego de las 24 horas.
Si las mediciones muestran una meseta o aumento sostenido sospechar hipertermia maligna (HM).
¿Cómo se diagnostica?
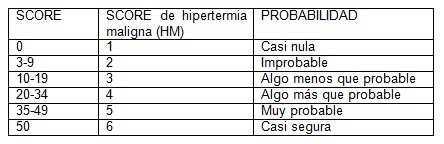
El diagnóstico es de gran dificultad. Hay escalas clínicas graduadas que se han utilizado para ayudar a determinar con que probabilidad un episodio sospechoso de hipertermia maligna (HM) puede ser verdadero.*
Aunque se han propuesto varias pruebas, el gold standard es el test de contracción con cafeína y halotano que se realiza con una pequeña porción de músculo estriado.
Para llevar a cabo esta prueba, se toman 2 gramos de tejido muscular, usualmente tomando una biopsia del vasto lateral después de la administración de un anestésico local o epidural que no induzca la hipertermia maligna.
Se toman 6 muestras, de las cuales 3 deben ser sometida a cafeína, en un período no mayor a 5 horas a dosis progresivas(de 0,5 mM a 32 mM) y 3 al halotano (3%), se registra la respuesta de tensión del músculo y se considera positiva si alguna de las 6 muestras es positiva, llamándose positiva cuando al agregar 2 mM de cafeína, presenta una tensión por encima de 0,2 gr. o en la prueba de halotano por encima de 0,7 gr. Existen 2 protocolos uno norteamericano y otro europeo, el protocolo norteamericano es el mencionado anteriormente; el europeo se diferencia de este por utilizar dosis diferentes de halotano y que solamente acepta como positivos aquellos que desarrollan alteración tanto en la prueba de cafeína como con el halotano; aquellos que son solo positivos a una, se les llama equívocos.
La sensibilidad de la prueba es de 97% y la especificidad del 88% en el protocolo americano, siendo en el europeo la sensibilidad del 99% y la especificidad del 94%. La desventaja de este método es lo invasivo y costoso que resulta.
También se ha utilizado la pesquisa genética, demostrando las alteraciones conocidas, sobre todo para detectar la isoforma alterada RyR1.
INDICADORES CLÍNICOS:
PROCESO – INDICADOR - PUNTOS
Rigidez:
Rigidez muscular generalizada en ausencia de temblor debido a hipotermia durante o inmediatamente después de la emergencia de la anestesia general inhalatoria. 15
Espasmo de masetero a continuación de la administración de succinilcolina. 15
Ruptura muscular
CPK > 20000 UI luego de succinilcolina. 15
CPK > 10000 UI después de anestésicos sin succinilcolina. 15
Orina color cola en período perioperatorio. 10
Mioglobina en orina > 60 ug/l. 5
Mioglobina en suero > 170 ug/l. 5
K* en sangre, plasma, > 6 meq/l (en ausencia de fallo renal). 3
Acidosis respiratoria
PetCo2 > 55 con ventilación asistida. 15
PCO2 >60 con ventilación asistida. 15
PetCo2 > 60 con espontánea. 15
PCO2 > 65 con espontánea. 15
Hipercapnia inapropiada. 15
Taquipnea. 10
Aumento de temperatura
Rápido aumento inapropiado de la temperatura. 15
Incremento inapropiado de la temperatura en el perioperatorio >38.8şC. 10
Cardiovascular
Taquicardia sinusal inadecuada. 3
Taquicardia ventricular o Fibrilación ventricular. 3
Historia Familiar
Historia familiar positiva a hipertermia maligna (HM) en parientes de primer grado. 15
Historia familiar positiva a hipertermia maligna (HM) en parientes no en primer grado. 15
Otros indicadores que no son parte de proceso único
Exceso de base arterial < de 8 meq/l. 10
Ph < 7,25 arterial. 10
Rápida reversión de los signos en la hipertermia maligna (HM) de acidosis respiratoria y/o metabólica con Dandrolene vía intravenosa. 5
Historia familiar positiva de hipertermia maligna (HM) junto con otro indicador del paciente, distinta CPK elevada en reposo. 10
CPK elevada en pacientes con historia familiar de hipertermia maligna (HM). 10
¿Cómo debo tratarla?
PEDIR AYUDA!!!
TRATAMIENTO ESPECÍFICO:
• Discontinuar en forma inmediata los anestésicos, principalmente los más implicados antes mencionados.
• Cambiar bolsas y corrugados.
• Oxigenar al paciente con FiO2 al 100% a alto flujo.
Administrar Dantrolene sódico URGENTE a dosis de 2 mg/kg inicial en bolo con incrementos cada 5 minutos hasta una dosis total de 10 mg/kg. El goteo se hará continuo a 1-2 mg/kg cada 8 hs, con un destete progresivo de 1mg/kg cada 12 horas y luego 1 mg/kg cada 24 horas. *
MEDIDAS DE SOSTÉN: Hemodinámico, equilibrio ácido-base (EAB), Arritmias, trastornos hidroelectrolíticos:
• Monitoreo constante
• Cuidados en UCI.
• Corregir la acidosis, si fuera necesario, con bicarbonato según el equilibrio ácido-base (EAB). Si no hay acidosis administrar 1-2 mg/kg de Bicarbonato.
• Disminuir la temperatura del paciente con medidas físicas ((lavado de cavidades, líquidos vía intravenosa fríos, enfriamiento de la superficie corporal, sin producir hipotermia)
• Hiperpotasemia: glucosa e insulina (10 unidades de insulina regular en 50 cc de glucosa al 50% adecuándolo con el nivel de potasio o 0,15 u/kg de insulina regular por 1cc/kg de glucosa al 50%)
• La hipercalemia que pone en peligro la vida se puede tratar con la administración de calcio(2,5 mg/kg de cloruro de calcio)
• Asegurar una diuresis mayor de 2 ml/kg/hora mediante fluidoterapia parenteral enérgica y/o administrando manitol o furosemida si es necesario.
*Cada frasco de Dantroleno contiene 20 mg de Dantroleno y 3 gramos de manitol.
Cada frasco debe ser mezclado con 60 ml de agua estéril sin agente bacteriostático.
El dantroleno es un relajante muscular de acción rápida que impide la liberación de iones de Ca +desde el retículo sarcoplásmico, revirtiendo de esta manera los efectos de su exceso en el sarcoplasma.
La intervención del dantroleno como tratamiento ha permitido que la mortalidad baje más de un 70% en los países desarrollados.
Signos de tratamiento efectivo: en 30 minutos aparece:
• Cese de la contractura y disminución del tono muscular
• Descenso de la ETCO2
• Descenso de la Temperatura
• Descenso de la frecuencia cardiaca (FC)
• Recuperación de la conciencia.
• Los valores de CPK pueden tardar varios días en alcanzar los valores normales y persisten los dolores musculares.
¿Existe forma de prevenirla?
I) DETECCIÓN DE PACIENTES SUSCEPTIBLES:
1)- Historia clínica: MUY IMPORTANTE!
Debo determinar los pacientes de riesgo a través de los datos recaudados en la anamnesis.
Son pacientes de riesgo:
• Pacientes que han sobrevivido a una crisis o que tienen una biopsia muscular positiva.
• Familiares de primer grado con una biopsia muscular positiva.
• Miembros de una familia que presentan anomalías musculares.
• Miembros de una familia sospechosa con valores de CPK elevados.
2)- CPK:
No debe ser usada como único método diagnóstico.
Se encuentra elevada en el 80% de sujetos susceptibles o sus familiares.
Si la CPK es normal, no tiene valor predictivo y son necesarios estudios de contractura.
Un paciente con antecedentes familiares de hipertermia maligna (HM) y CPK elevada tiene diagnóstico certero de “susceptible”
3)- Biopsia muscular para estudios de contractura.
Prueba de contracción de cafeína y halotano.
II) PROFILAXIS ANTE REINTERVENCIONES QUIRÚRGICAS EN ESTOS PACIENTES:
Algunos autores recomiendan el uso profiláctico del dantroleno pre, peri y pos operatorio, independientemente del método anestésico que se emplee, pero hoy día la mayoría no lo recomiendan más y la consideran una medida en desuso, argumentando que solo basta con evitar los fármacos desencadenantes y que además no es aconsejable su uso profiláctico ya que puede provocar cuadros de debilidad tanto en pacientes susceptibles como no.
La conducta más implementada consiste en:
• Desconectar los vaporizadores y limpiar el aparato de anestesia, lavarlo con 10 ml/min de oxígeno durante 29 minutos.
• Tener preparado el carro de hipertermia maligna (HM) en quirófano (mantas y sueros refrigerados, dantrolene).
• Utilizar fármacos no desencadenantes (propofol, barbitúricos, etomidato, ketamina, benzodiazepinas, opioides, anestésicos
Locales, relajantes musculares no despolarizantes).
III) Aconsejar a los familiares a cerca de la posibilidad de portar la anomalía y recomendar los estudios pertinentes.
¿CUALES SON SUS DIAGNÓSTICOS DIFERENCIALES?
- Hipertiroidismo.
- Feocromocitoma.
- Sepsis
- Síndrome Neuroléptico Maligno.
- Cetoacidosis diabética.
SÍNDROME NEUROLÉPTICO MALIGNO
Infrecuente (0.4-2.4%).Predomina en varón 2/1. El 80% son menores de 40 años.
Carácter idiosincrático y potencialmente fatal (tasa de mortalidad del 10%).
Se desencadena en pacientes tratados con neurolépticos como: haloperidol, flufenazina, perfenazina, cloropromacina, trifluperazina o tioridazina. No existe relación clara entre el desarrollo del síndrome, el tipo de neuroléptico empleado, su dosis o el tiempo de administración. Está causado por el bloqueo de los receptores de dopamina en hipotálamo y en ganglios basales.
La aparición de los síntomas se da (66%) en la primera semana de tratamiento.
Los signos clínicos fundamentales son la hipertermia y la rigidez muscular.
Otros hallazgos comunes son las alteraciones vegetativas: taquipnea, taquicardia, diaforesis, palidez cutánea, incontinencia de esfínteres, hipo e hipertensión, siendo más frecuente la hipertensión. El nivel de conciencia varía desde el estado de alerta con obnubilación y mutismo hasta el estupor y coma.
EXISTEN DIFERENCIAS ENTRE EL SÍNDROME NEUROLÉPTICO MALIGNO Y LA HIPERTERMIA MALIGNA (HM):
- En la hipertermia maligna (HM) existe una alteración muscular evidente, en el síndrome neuroléptico maligno no.
- La hipertermia maligna (HM) es un trastorno genético.
- La hipertermia maligna (HM) se asocia al uso de agentes anestésicos y el síndrome neuroléptico maligno a neurolépticos.
- La hipertermia maligna (HM) se desarrolla en minutos (aunque no siempre) y el síndrome neuroléptico maligno tiene un curso más lento y los síntomas centrales más evidentes.
IMPORTANTE: los pacientes con síndrome neuroléptico maligno no son propensos a la hipertermia maligna (HM).
Tratamiento del síndrome neuroléptico maligno:
El Dantroleno o bromocriptina (agonista de los receptores de dopamina).
Bibliografía:
Miller Anestesia – Miller Ronald D. - 7° edición, año 2010 – Elsevier.
Tratado de Anestesia y Reanimación Luis Miguel Torres Morera – 2007 - ARAN EDICIONES S.A.
Anestesia Secretos – James Duke – 2011 – Elsevier.
Anestesia Intravenosa – Alberto Vanegas Saaverdra – 2009 – Panamericana.
Goodman & Gilman – Las bases farmacológicas de la Terapéutica – 11° edición – Laurance L. Bruton, John S. Lazo y Keith L. Parker - Mc Graw Hill.
Case of fulminant-malignant hyperthermia occurring on sixth sevoflurane anesthesia]. Sugiyama K, Toya A, Shimomatsu K, Saitoh Y, Manabe Y, Kohjitani A. Masui. 2011 Jun;60(6):703-5. Japanese
Malignant hyperthermia: pharmacology of triggering. Hopkins PM. Br J Anaesth. 2011 Jul;107(1):48-56. Epub 2011 May 30. Review
Annual meeting of the European Malignant Hyperthermia Group. Glauber V. Harefuah. 2011 Mar;150(3):281-2. Hebrew
Malignant hyperpyrexia: an anaesthetic hazard. Jaffe EC, Wedley JR. Br Dent J. 1972 Dec 19;133(12):538-41
Malignant hyperthermia. Rawls GH. J Natl Med Assoc. 1972 Nov;64(6):520-1
Malignant hyperthermia in anaesthesia. Isaacs H. S Afr Med J. 1972 Sep 16;46(37):1321
Tratado de fisiología médica Guyton – Hall - 10° edición - Mc Graw Hill.