En el presente estudio se exponen los factores de riesgo que han influido en el rápido incremento de la prevalencia de las enfermedades no transmisibles en el Departamento del Meta, Colombia: dieta no balanceada, diabetes, alcoholismo, tabaquismo, pesticidas, etc. Se expone el proceso bioquímico a partir de la deficiencia vitamínica B y demás factores, por su acción mitocondrial hasta generar la Inflamación Crónica, de donde habrá de surgir el estrés oxidativo causante de la disfunción endotelial, con liberación de los factores epigenéticos. Este mecanismo bioquímico se abre aflorando las distintas enfermedades, entre ellas: ansiedad, estrés, depresión, psicosis, hipertensión arterial, etc.
Factores de riesgo y enfermedades no transmisibles
Dr. Jaime Altamar Ríos. Especialista exjefe del Servicio de ORL del hospital Departamental de Villavicencio, Colombia.
RESUMEN
En el presente estudio se exponen los factores de riesgo que han influido en el rápido incremento de la prevalencia de las enfermedades no transmisibles en el Departamento del Meta, Colombia: dieta no balanceada, diabetes, alcoholismo, tabaquismo, pesticidas, etc. Se expone el proceso bioquímico a partir de la deficiencia vitamínica B y demás factores, por su acción mitocondrial hasta generar la Inflamación Crónica, de donde habrá de surgir el estrés oxidativo causante de la disfunción endotelial, con liberación de los factores epigenéticos. Este mecanismo bioquímico se abre aflorando las distintas enfermedades, entre ellas: ansiedad, estrés, depresión, psicosis, hipertensión arterial, etc.
Se propone la enzima lisozima, como ‘factor supresor’, que activaría el gen p53 o ‘supresor tumoral’ para frenar el ‘gen promotor’, motor del cáncer. La lisozima electropositiva juega papel importante en la protección del organismo frente a estas enfermedades y actúa inactivando el papilomavirus electronegativo, además de que es un potente antioxidante. El papilomavirus ADN, por su parte, es un virus desnudo que no es posible propagar en cultivo, por tal, no es factible elaborar vacuna contra él.
SUMMARY
In this paper we present the risk factors that they’ve produced a rapid increase of the standard measure of the untransmittable diseases in Meta Department, Colombia: insufficient nourishment with hypovitaminosis B, diabetes mellitus, alcoholism, tobacco addiction, etc. We present a biochemistry mechanism from the vitaminic deficiency and other factors that act in the mitochondry to produce a chronic inflammation. This inflammation will create the oxidative stress with endothelial disfunction that liberates the epigenetic factors. In addition to, we show the biochemistry mechanism of several pathologies, between these we have: anxiety, stress, depression, psychosis, cancer, etc.
Equally, we propose the lysozyme enzyme as a ‘suppressor factor’. This actived the p53 gen or ‘tumoral suppressor gen’ to brake the ‘promotor gen’, the cancer motor. The electro-positive lysozyme is playing an important paper in the protection of the human organism in front to these diseases, inactive the electronegative papillomavirus and it acts as a strong antioxidant. On the other hand the AND papillomavirus is a uncovered virus and it isn’t possible to propagate in culture, wherefore it isn’t feasible to elaborate a vaccine against to it.
Palabras clave: Factor epigenético, inflamación crónica, estrés oxidativo, disfunción endotelial, supresor tumoral, lisozima.
INTRODUCCIÓN
Hace ya cerca de cuarenta años cuando iniciamos nuestras observaciones sobre la creciente prevalencia, en Villavicencio, Colombia, de las malformaciones congénitas (MC) y otras patologías, aparentemente no asociadas. Sobre ellas se realizó un estudio epidemiológico de 1985 a 1995, en el departamento del Meta. Se analizaron 360 pacientes con malformaciones congénitas y familiares de tres generaciones que vivían en las mismas condiciones de vida. Algunos de estos últimos mostraban hipovitaminosis B, enfermedades cardiovasculares, malignas y autoinmunes. La dieta era básicamente hidrocarbonada y rica en grasas, pobre en verduras, frutas y proteínas. Alto consumo de alcohol y tabaco. Algunos eran diabéticos u obesos, así como la exposición a los agroquímicos. Como quiera que la dieta no balanceada, el alcohol y el tabaco siempre han estado presentes en la vida del colombiano, ello nos explicaba la existencia de una tasa media de malformaciones congénitas de 15-25x100.000 habitantes. Viendo que este aumento en la prevalencia de dichas enfermedades coincidía con el inicio del uso intensivo de los herbicidas, ello nos indujo a aceptar que estas patologías y estos pesticidas debían estar estrechamente vinculados, por lo que hubo el incremento. A los pacientes y a sus familiares se les practicaron los exámenes de rutina, glicemia, colinesterasa, serología VDRL, etc.
Como señalamos en nuestro estudio ya publicado (3), el 61% de los pacientes procedía de áreas rurales sometidas a intensa fumigación aérea con Paraquat y Glifosato, en promedio ocho veces al año, y durante esos diez años la tasa por cien mil habitantes se duplicó, pasando de 97 pacientes, en 1985 a 189, en 1995.. El 80 % de las familias fue clasificado dentro del rango social bajo y el 15% como clase media y sólo un 5% de clase social alto. La patología más común fue la hendidura del labio y del paladar con el 30%. El consumo intenso de alcohol y tabaco osciló entre el 80 y 70% respectivamente, pero no se encontró consumo de drogas psicoactivas. El estudio genético sólo fue positivo en tres pacientes con síndrome de Down. Las patologías congéneres en los familiares fueron: autoinmunes 38%, cardiovasculares 34%, malignas 31%, congénitas 15%, (no existen parámetros estadísticos en la literatura mundial). El 40% de las madres se encontraba entre los 33 y 45 años y el 5% por debajo de los 17 años. Por todo lo anterior, deducimos que en nuestro medio podemos señalar la existencia de factores ambientales de riesgo: 1- Dieta no balanceada, hidrocarbonada y rica en grasas saturadas, con déficit de vitaminas del complejo B, 2- Diabetes mellitus, 3- Alcohol, 4- Tabaco, 5- Herbicidas, etc.
Es nuestra intención, en este estudio, intentar explicar el mecanismo cómo estos elementos etiológicos se convierten en ‘factores de riesgo’ de las enfermedades no transmisibles.
ETIOLOGÍA
Dado el estrecho vínculo existente entre las malformaciones congénitas, cardiovasculares, malignas, autoinmunes, etc y el estado nutricional, la diabetes y otros factores, hemos juzgado prudente involucrar estas patologías dentro del marco de las llamadas enfermedades no transmisibles o degenerativas, por lo que tendrían, en consecuencia, un origen multifactorial. De ahí que, a pesar de la enorme preocupación que estas patologías han despertado, siempre ha existido un gran desconcierto en cuanto a la aclaración de la etiología, no existiendo una base científica en qué sustentar dicha apreciación, tal vez por la disímil naturaleza de los posibles factores involucrados.
Por ello nos esforzamos en encontrar una explicación que permita vincular esos diferentes factores entre sí. Partimos entonces del que consideramos más importante, el nutricional para la generación de la energía a partir de los carbohidratos. Para ello apelamos a la concepción bioquímica de la Biología molecular. En consecuencia, teniendo en cuenta el déficit nutricional de las vitaminas del complejo B y algunos minerales, en calidad de mediadores enzimáticos, en la desintegración metabólica de la glucosa hasta llegar a la formación de sustancias biológicamente activas, altamente tóxicas, como son los radicales libres (RL) o factores epigenéticos y otros mediadores tóxicos causantes de las diversas patologías no transmisibles. Ello parece ir aclarándonos los mecanismos etiológicos de esas patologías: congénitas, diabetes-2, cáncer, cardiovasculares, autoinmunes, Párkinson, Alzheimer, depresión, esquizofrenia, trastorno bipolar, etc.
¿Qué son y cómo se forman los radicales libres?
Los radicales libres (RL) son átomos que poseen un electrón célibe o no apareado en su órbita externa. Normalmente los electrones se encuentran por parejas en cada órbita del átomo y constituyen dos corpúsculos cargados eléctricamente que rotan sobre su propio eje, en sentido contrario, generando así, un campo magnético. Pero, por tener cargas opuestas, ello induce a la anulación de dichos campos magnéticos recíprocos; fenómeno éste que imprime a los átomos la estabilidad de que carecen aquellos átomos con un solo electrón. Estos átomos con un electrón célibe presentan una gran inestabilidad, moviéndose como locos en busca de su pareja, por lo que son muy oxidantes.
Ahora bien, en las reacciones de oxidación el oxígeno (O2) que ingresa a la célula recibe de la glucosa dos electrones para formar energía y los residuos de agua y dióxido de carbono (CO2), siendo los dos últimos eliminados por la célula. Este proceso metabólico se efectúa en las mitocondrias, consideradas las centrales eléctricas de la célula. Pero esta reacción bivalente, con la transferencia de dos electrones, no ocurre siempre así. Existe una pequeña cantidad del oxígeno (O2) (un 2-5%) que ingresa a la célula, que no reacciona con la glucosa, de una manera bivalente sino monovalente, esto es, que la glucosa traspasa al oxígeno (O2) un solo electrón. De esta manera, ese escaso oxígeno (O2), al recibir un electrón de la glucosa se convierte en el radical libre (RL) anión superóxido (O2-), muy reactivo (1,2). Pero este anión superóxido es rápidamente degradado por acción de la enzima superóxido dismutasa, para dar lugar, de esa forma, al peróxido de hidrógeno o agua oxigenada (H2O2), de una menor capacidad oxidante, que por acción de las otras enzimas antioxidantes intrínsecas, glutatión peroxidasa y la catalasa, se va a convertir en agua, perdiendo así sus efectos deletéreos. Esto indica que el organismo normalmente produce una pequeña cantidad de radicales libres (RL): anión superóxido y el peróxido de hidrógeno.
Pero los mecanismos enzimáticos defensivos naturales o intrínsecos (superóxido dismutasa, glutatión peroxidasa y catalasa) disminuyen con la edad. Es ésta producción ‘endógena’ de radicales libres (RL) la encargada del proceso de envejecimiento normal que se observa a partir del comienzo de la cuarta década con lento deterioro de la función endotelial. Ello quiere decir que esos radicales libres (RL) producidos, de manera endógena, en el curso fisiológico de la cadena respiratoria mitocondrial, requieren, para mantener sus niveles normalmente bajos, el suministro de una dieta balanceada con vitaminas del complejo B y algunos minerales. Estos minerales y vitaminas B actúan en calidad de coenzimas o activadores de las enzimas encargadas de la transferencia de H, la descarboxilación y la acetilación en el curso de la desintegración de la glucosa para generar la energía.
Sin embargo, existe también un mecanismo ‘exógeno’ de producción de radicales libres (RL). Son muchos los factores externos o ambientales o que dependen del estilo de vida, que inducen la liberación en exceso de radicales libres (RL), hasta sobrepasar las capacidades defensivas naturales, ocasionando daño progresivo de diversas estructuras biológicas de las membranas celulares en su acción oxidativa. A estos radicales libres (RL) se les denomina también ‘agentes contaminantes’ porque son muy reactivos, capaces de oxidar indiscriminadamente dichas estructuras biológicas (3), dañándolas.
Entre esos factores, los más comunes en capacidad de producir un exceso de radicales libres (RL), están: la dieta no balanceada, el alcohol y el tabaco, factores estos que siempre han existido en nuestro medio colombiano. Pero en las últimas décadas se observa un notable incremento de las enfermedades degenerativas, en particular la diabetes (que a su vez es factor de riesgo), enfermedades cardiovasculares, respiratorias crónicas, cáncer, autoinmunes, congénitas, etc. (Fig. 1) Todo ello como consecuencia de la perversión de los hábitos dietéticos, la contaminación industrial, etc, surgidos del desarrollo económico y tecnológico operado en el mundo. Y a partir de la séptima década del siglo pasado se suma otro factor, el de los herbicidas, de uso indiscriminado en la agricultura y el narcocultivo, con la cocaína y otros a bordo, productos químicos (hidrocarburos aromáticos policíclicos, nitrosaminas, nitritos, etc), metales pesados (mercurio, arsénico, cianuro, etc), contaminación electromagnética, etc (Fig. 1). De ahí que debamos aceptar que las enfermedades no transmisibles o degenerativas tengan una causa multifactorial.
Todos estos factores ambientales de riesgo, a excepción del electromagnético, siendo el más importante el nutricional, tienen su centro de acción a nivel de la mitocondria y, por distintas vías, conducen a un punto de convergencia constituido por una variable reducción en la generación de energía vital (adenosíntrifosfato, ATP) (3), lo que debilitará el sistema inmunitario mediante un complejo proceso metabólico reaccional de la glucosa y el oxígeno (O2).
La deficiente generación energética determina una alteración de la bomba de Na/KATPasa energeticodependiente. En ese momento se rompe el equilibrio funcional del tejido lesionado para producirse un edema intra y extracelular, a partir del cual se desarrolla una intrincada cascada de reacciones que constituyen la Inflamación crónica inespecífica (3), generadora de los radicales libres (RL). Este evento transcurrido hasta aquí es lo que se denomina ‘estrés oxidativo’ que precede al desarrollo de la disfunción endotelial y, por lo tanto, de las enfermedades no transmisibles o metabólicas. El incremento del estrés oxidativo con su impacto sobre la función endotelial tiene un carácter reversible inicialmente. Como vemos, éstas pueden dispararse por la acción de los diversos factores ambientales asociados con el metabolismo mitocondrial de la respiración celular (3-5), como se ha señalado
De ese proceso inflamatorio crónico se generan los radicales libres (RL) de origen exógeno: el anión superóxido y el peróxido de hidrógeno, que aumentan considerablemente debido a la disminución de las enzimas antioxidantes naturales o intrínsecas: superóxido dismutasa, glutatión peroxidasa y catalasa. Estos radicales libres (RL) en exceso mencionados, reaccionan entre sí, a través de la reacción de Haber Weis y Fenton, para dar origen al radical libre más agresivo, el radical hidroxilo (OH-), contra el cual el organismo sólo cuenta con una enzima defensiva natural, la lisozima, pero la síntesis de ésta suele reducirse por la acción de los factores de riesgo señalados, por lo que se requiere acudir a los antioxidantes de origen externo: vitamina A, C, E, cisteína, albúmina, etc.
Liberación de Radicales libres o factores epigenéticos.
1- Dieta no balanceada.
Todos esos factores de riesgo señalados y muchos más, alteran el proceso de degradación de la glucosa, con baja producción de moléculas macroérgicas de ATP. Para formar energía la célula utiliza los mecanismos aerobio y anaerobio. Una molécula gramo de glucosa produce, por ambos sistemas, 38 mol. de ATP. Dos de estas 38 moléculas se elaboran por glicólisis anaeróbica, en el citoplasma celular, en ausencia de oxígeno (O2), y 36 por vía oxidativa en la mitocondria. Por glicólisis se comprende el desdoblamiento de la glucosa en el citoplasma, en dos moléculas de ácido pirúvico de tres carbonos a través de diez reacciones, en ausencia de oxígeno, en las que se liberan dos moléculas de ATP por vía anaerobia.
Ahora bien, si el organismo, en caso de un ejercicio intenso o de diabetes no controlada o del marcado consumo de tabaco, necesita mucha energía con urgencia, ésta puede obtenerse de fuentes anaerobias, por cuanto la vía oxidativa resulta muy lenta. Por esta razón, el organismo debe acudir al glucógeno para, por glucogenólisis, contar con glucosa disponible para obtener energía por vía anaerobia, como veremos más adelante, obteniendo así escasa energía por molécula con un gran desperdicio de glucosa y formación de ácido láctico, con pérdida de peso del paciente. Los dos ácidos pirúvico formados ingresan a la mitocondria, donde por acción de las enzimas activadas por la coenzima-A o ácido pantoténico, la nicotinamida y la tiamina o B1 van a formar dos metabolitos terminales de acetil-CoA y la liberación de ocho átomos de hidrógeno y 2 de dióxido de carbono (CO2).
De cada metabolito terminal acetil-CoA derivado de los dos ácidos pirúvicos se va a desarrollar, en la mitocondria, la fase aeróbica, en la que se realizan todas las reacciones de oxidación hasta degradar dicho metabolito terminal formando 36 mol de ATP y los residuos de agua y dióxido de carbono (CO2), (2 Ciclos del ácido cítrico o del ácido tricarboxílico, más conocido como ciclo de Krebs y la fosforilación oxidativa) (Fig. 2). Proceso éste que se lleva a cabo mediante una secuencia sucesiva y coordinada de reacciones y pasos de electrones catalizados por diversas enzimas encargadas de la transferencia de hidrógeno, la descarboxilación y la acetilación, enzimas esas activadas por Nicotinamida, Vit. B1, B2, B12, Coenzima-A o ácido pantoténico y minerales: hierro, magnesio, selenio, etc. La acetil-CoA reacciona, de igual manera, con la colina para formar acetilcolina (Fig. 2), neurotransmisor parasimpático que actúa como mediador químico activando las células cerebrales.
De esa manera, ella juega un papel fundamental en la propagación del impulso nervioso de las terminaciones parasimpáticas al órgano efector vascular de todo el organismo, en particular, determinadas regiones del cerebro por su importancia funcional, tal el caso de la corteza órbito-frontal, como centro de toma de decisiones y el hipocampo que regula las emociones y la memoria. Allí actúa, asociado al glutamato, en la función de la memoria, la preservación cognitiva y del razonamiento, y con la serotonina protege al cerebro de los efectos de la ansiedad y el estrés. Esta acetilcolina es regulada por la enzima colinesterasa. De ahí que la reducción energética de moléculas de ATP, causada por cualquiera de los factores ambientales señalados, disminuye la síntesis de la acetilcolina, con predisposición, entre otras, a una tendencia a la hipertensión arterial, al mal de Alzheimer, la ansiedad, la depresión, la psicosis y el conjunto de enfermedades no transmisibles.
Por esta razón, un déficit de las vitaminas del complejo B y algunos minerales va a determinar una alteración en la cadena de catabolización de la glucosa, disminuyendo la generación de la Acetil-CoA y, por lo tanto, de la acetilcolina, así como el neurotransmisor glutamato, cuya deficiencia de ambos es de mucha importancia en la génesis de la enfermedad de Alzheimer (la memoria y las decisiones). Igualmente, da lugar a una depleción energética de ATP y liberación de especies intermedias de oxígeno (O2), muy reactivas, los radicales libres (RL) y otros factores. Este bajo rendimiento de la cadena respiratoria mitocondrial de ATP deteriora la bomba de Na/K, energeticodependiente.
Normalmente, cuando sobreviene un estímulo nervioso la membrana celular se despolariza, permitiendo una marcada difusión de Na al interior de la célula, por lo que se invierte el potencial de membrana, pasando de -85 a +140mv. Para recuperar su potencial de reposo, esto es, de -85mv o de repolarización en el interior, la célula requiere energía para accionar la bomba de Na/KATPasa y expulsar el Na por transporte activo. Pero si la energía disponible no es suficiente, la bomba no posee la capacidad para expulsar todo el Na, permaneciendo un remanente intracelularmente un tiempo más prolongado (despolarización celular prolongada), lo que se acompaña de una ganancia osmótica de agua, con aumento isoosmótico de este líquido, con el respectivo edema intracelular y salida de K (2,3).
Seguidamente llega un nuevo estímulo con una difusión de Na al interior de la célula insuficiente como para invertir el potencial de membrana debido a la existencia de rezagos de Na, por lo que éste se retiene en el espacio intercelular dando lugar a edema extracelular. Aquí se rompe el equilibrio funcional del tejido. Este fenómeno es el punto de partida de la Inflamación Crónica Inespecífica con liberación de radicales libres (RL) y otros elementos (3-6). Este proceso es lo que constituye el estrés oxidativo, que con sus radicales libres (RL) o factores epigenéticos y otros mediadores van a impactar sobre la función endotelial, determinando la disfunción del endotelio, con discretos dolores articulares.
Esta parece ser la primera manifestación clínica de las enfermedades autoinmunes (7). Muchos agentes tóxicos causan lesión celular interfiriendo sustratos o enzimas de la cadena respiratoria celular o sea el C. de Krebs y la fosforilación oxidativa a nivel de la membrana interna y matriz mitocondrial. Generalmente este edema inicial pasa inadvertido. Debemos tener presente que para que exista una absorción adecuada de los micronutrientes, entre ellos las vit del complejo B y minerales, se requiere una normal estructura microvascular de la vellosidad duodenal. Pero en condiciones patológicas de la cadena respiratoria de larga data o de enfermedades diarreicas recurrentes en la infancia, parte de las vellosidades puede sufrir una necrosis por microinfartos con disminución de la capacidad de absorción.
Estas reacciones del ciclo del ácido tricarboxílico (Fig. 2), catalizadas por diversas enzimas (2), activadas por dichas vitaminas, están encargadas de la:
1- Transferencia de hidrógeno
A- Deshidrogenación:
a- Nicotinamida: Nicotín-adenín-dinucleótido (NAD) a nivel del: Ácido isocítrico, Ácido acetoglutárico y Ácido málico.
b- Vitamina B2: Flavin-adenín-dinucleótido (FAD) a nivel del Ácido succínico
B- Fosforilación oxidativa: Citocromooxidasas (Vit. B12).
2- Descarboxilación: Vit. B1 (Cocarboxilasa o tiamina), a nivel del:
Ácido oxalosuccínico
Ácido acetoglutárico
3- Acetilación: Coenzima-A o ácido pantoténico (Co-ASH) a nivel del
Ácido oxalacético
Ácido acetoglutárico
Ácido succinilCo-A.
De esta manera, un déficit nutricional de esas vitaminas del complejo B, determina una alteración en la cadena de catabolización en el C. de Krebs con depleción energética de ATP y eliminación proporcional de especies intermedias de oxígeno (O2), muy reactivas.
2- Diabetes mellitus
La diabetes es un trastorno patológico que actúa, a la vez, como causa (factor de riesgo) y efecto de las enfermedades no transmisibles. Su incidencia ha estado marcadamente influida por la modernidad consumista, que ha introducido en la sociedad una perversión en los hábitos alimenticios con un desbordado consumo de carbohidratos, grasas, etc. La consecuencia de esa perversión ha sido el creciente incremento de la diabetes-1, al igual que las demás enfermedades no transmisibles. En la diabetes-1 se presenta una depleción en la generación de moléculas energéticas de ATP, con la consiguiente falla de la bomba de Na/K-ATPasa y el subsecuente edema intra y extracelular. Pero este proceso ocurre por un mecanismo diferente a la deficiencia nutricional. Normalmente, para que se lleve a cabo el proceso degradativo oxidativo de la glucosa hasta llegar a la formación de ATP, se requiere que ella se encuentre dentro de la célula, más concretamente, en la mitocondria. Pero en la diabetes no sucede así, porque una parte variable de la glucosa se encuentra fuera de la célula, en el plasma, por existir una deficiencia de la insulina que ayuda al transporte de la glucosa al interior de la célula. Y esta glucosa que está por fuera, en el plasma, no se metaboliza, por lo que no da lugar a energía, presentándose, en consecuencia, un déficit de la misma, continuando así el proceso señalado.
Alcohol
En el curso del alcoholismo crónico, además de la acción tóxica propia del alcohol, que no vamos a discutir aquí, se opera un proceso metabólico semejante al ocurrido en la alimentación no balanceada con déficit de vit. del complejo B. Pero, en este caso, ello ocurre como consecuencia de una deficiente absorción y biodisponibilidad de los micronutrientes, secundaria al edema de la mucosa intestinal, en particular la duodenal, producida por la permanente irritación alcohólica, como lo señaló Green (8), en 1983. Debemos tener en cuenta que esta manifestación inflamatoria se presenta sobre todo en los consumidores del ‘trago corto’: ron, aguardiente, whisky, etc. La baja generación de ATP conduce a la Inflamación Crónica Inespecífica y a ello hay que sumarle la acción tóxica propia del alcohol. Desde hace ya cuatro décadas se empezó a incriminar al alcohol como factor teratógeno y cancerígeno (9-12).
Nicotina
Sin tener en cuenta las múltiples sustancias tóxicas que se eliminan con el humo del tabaco, la nicotina tal vez sea la más importante, determinando una gran actividad vasopresora simpática con notable aumento del metabolismo basal, pudiendo alcanzar hasta un 10% (13). Y ello sucede a consecuencia del bloqueo a la recaptación de la norepinefrina en el botón presináptico para su posterior reciclaje (5,6,13,14). Ello lleva a que esta hormona permanezca en la hendidura sináptica un tiempo más prolongado activando los receptores simpáticos postsinápticos. Esta estimulación prolongada va a determinar un mayor consumo de energía, sin su reemplazo correspondiente, llevando a un agotamiento de las reservas de ATP y la consecuente falla en la bomba de Na/KATPasa y edema intra y extracelular para dar inicio a la Inflamación Crónica Inespecífica con liberación de radicales libres (RL) y otros (1).
Por otro lado, como quiera que esta más activa estimulación se acompaña de un mayor consumo de energía, esto es, una mayor desintegración de ATP sin su reemplazo correspondiente, ello lleva a un aumento de AMPc que activa la fosforilasa para liberar glucosa del glucógeno. Ello tiene el propósito de mantener disponible la fuente de energía, de que están necesitadas las células, pero a través de la glicólisis anaeróbica (1,2), por cuanto la vía oxidativa es muy lenta, como ya se señaló, con pobre producción de ATP y desperdicio de dicha glucosa. Esto determina una acumulación de ácido láctico y fosfatos inorgánicos; de esa manera se reduce el pH intracelular, con acidez, que ocasiona aglutinación de la cromatina y su condensación por debajo de la membrana nuclear (2). Este fenómeno se observa igualmente en la diabetes no controlada. La nicotina es, además, adictiva y es tal vez el factor cancerígeno más importante en el mundo y produce más muertes que las armas.
A parte de la nicotina, debemos señalar igualmente, la presencia en el tabaco de hidrocarburos aromáticos policíclicos que se acumulan en los bronquios, determinando carcinoma específico en las vías respiratorias. La pérdida de funcionalidad alveolar por la fibrosis consecutiva al estrés oxidativo y a la disfunción endotelial conduce a la enfermedad pulmonar obstructiva crónica (EPOC).Finalmente, la cocaína, la heroína y la marihuana tienen un sistema de acción parecida, pero con mucha mayor intensidad.
5- Pesticidas
Entre estos compuestos, muy usados en el campo de la agricultura, están los herbicidas, ellos son los encargados de controlar las malas hierbas. Son aparentemente inofensivos, propiamente no ocasionan lesión aguda en el organismo, ni se absorben por la piel, como sucede con los insecticidas, se absorben por las mucosas respiratorias y digestivas, dando lugar a patologías crónicas, no atribuibles a ellos. Pero para permitir una acción más efectiva en la productividad, por recursos tecnológicos se logra que penetren la cutícula de las hojas, de los frutos que se consumen y la piel. Con la lluvia son arrastrados a las fuentes de agua que surte a la población y los animales domésticos o no. Todos estos venenos tienen su centro de acción en la respiración oxidativa, esto es, en la mitocondria celular (1-3,14,15). Entre los productos más conocidos y de mayor empleo está el paraquat, el glifosato, el tebutiurón, etc. El primero compite con la Nicotinamida, en forma de NAD (nicotin-adenín-dinucleótido) desplazándola del C. de Krebs en sus tres niveles (á. isocítrico, á. acetoglutárico y á. málico) (Fig. 2) para formar paraquat-piridinil (14), con lo que se cambia el mensaje del Ciclo, reduciéndose la liberación de ATP, siguiendo el proceso que ya conocemos, con formación de radicales libres (RL).
Según Williams y cols. (16), el Glifosato, por su parte, inhibe algunos aminoácidos esenciales como es el caso del triptófano y la fenilalanina, al tiempo que bloquea la biosíntesis de la tirosina, inactivando, en consecuencia, la enzima Lisozima, cuya importante función en la defensa contra el cáncer exógeno y su acción antioxidante, veremos más adelante. El glifosato, además, desplaza en el ciclo tricarboxílico la vitamina B2, en forma de FAD (flavin-adenín-dinucleótido) a nivel del ácido succínico y abre los canales del Ca en la membrana celular, acción que también ejerce el Tebutiurón, aumentando el Ca citosólico su acción catabólica para dar curso a la Inflamación Crónica Inespecífica con liberación de radicales libres (RL) (14), etc. El Tebutiurón también desplaza la Nicotinamida del C. de Krebs al igual que lo hace el Paraquat.
6- Radiación
Las radiaciones, a diferencia de los demás factores ambientales, no determinan una depleción de las moléculas de ATP, por lo que no generan el estrés oxidativo ni la disfunción endotelial, generadores de los radicales libres (RL); pero las incluimos aquí, como factores ambientales de riesgo dada su importancia. Las radiaciones ionizantes, sea ultravioleta o solar, electromagnética o X o la gamma o nuclear, tienen un mecanismo diferente para generar radicales libres. Ellas sólo dan lugar al radical hidroxilo (OH-). Lo originan directamente, sin requerir del desarrollo de un proceso inflamatorio, por radiolisis del agua tisular. El sitio de lesión, ocasionado por la acción del radical hidroxilo, en término general, depende del tipo de radiación. Los UVB ocasionan cáncer cutáneo porque ellos no rebasan ese plano. En profundidad le siguen los RX y luego los R. gamma, pudiendo acumularse en tejidos profundos y en la médula ósea, por lo que ambos están involucrados en las leucemias (1).
Existen muchos otros factores de riesgo como los colorantes anilínicos, los preservantes alimenticios, medicamentos, los metales pesados como mercurio, arsénico, cianuro, etc.
Radicales libres o factores epigenéticos.
Hasta aquí hemos considerado el curso de un proceso bioquímico, del cual se liberan los mal llamados ‘radicales libres’, de origen exógeno o ambiental, sin un significado etimológicamente representativo. Por esta razón, desde hace algún tiempo viene utilizándose un nombre más consecuente con su etimología, los llamados factores epigenéticos. Y ello es así, porque constituyen un conjunto de señales bioquímicas que corresponden a la epigénesis, actuando a modo de interruptores, activando o apagando la función de los genes. Estos factores, de origen exógeno o medioambiental, son múltiples, como ya se indicó.
¿Pero, de qué manera se va a trasladar toda esta influencia ambiental, esto es, la calidad de vida, al ADN? Ello se consigue pasando una señal química al ácido nucleico, lo que va a determinar un cambio en su comportamiento. De todos esos factores de riesgo, el más importante, como ya se ha señalado, es el relacionado con la nutrición. No todos los organismos responden de igual manera frente a la presencia genética al desarrollar determinadas enfermedades, no, ello depende del uso que hagamos del ambiente que nos rodea, esto es, de la epigénesis.
PATOGENIA
No obstante existir múltiples factores de riesgo, podemos constatar que la naturaleza de la agresión siempre es la misma, a excepción de la radiación electromagnética. Y ella no es otra que la depleción energética de ATP que ocasionan dichos factores, depleción que genera el estrés oxidativo con ruptura del equilibrio funcional del tejido para inducir una disfunción endotelial, dando lugar a una cadena de reacciones que constituyen la Inflamación Crónica Inespecífica (Fig. 1). Esta se inicia de manera insidiosa, a menudo asintomática (1), pero observable en las enfermedades autoinmunes asociada a leves dolores articulares. Estos cambios, como en todo proceso inflamatorio, alteran la permeabilidad vascular, acompañándose de marginación, adhesión, transmigración celular a través del endotelio y migración quimiotáctica.
En el proceso de adhesión al endotelio, la transmigración y la quimiotaxis, intervienen las moléculas adhesivas selectinas, la familia de las inmunoglobulinas e integrinas, así como los factores quimiotácticos y algunas citoquinas fibrogénicas (1). Esas alteraciones en la permeabilidad vascular con entrada de fluidos, solutos y células al área de la lesión, por la acción quimiotáctica, lleva a la producción de perturbaciones metabólicas que van a determinar modificaciones estructurales irreversibles en el tejido lesionado con cambios funcionales en el mismo, llegándose a la formación de tejido fibroso.
Este trastorno de la permeabilidad vascular, con salida de líquido plasmático, solutos y células al espacio extravascular da lugar a una infiltración de estos elementos, con edema en los tejidos. Ello es notorio básicamente en la piel grasosa, el rostro (cara abotagada con las bolsas infraorbitarias), el cuero cabelludo, con su brillo reluciente dado por las grasas sanguíneas que lo inducen hacia la calvicie, indicativo todo ello, de la existencia de una disfunción endotelial de base. Este proceso, por lo tanto, es complejo debido a la gran cantidad de elementos involucrados. Esto es, según va apareciendo el edema extra e intracelular y extravascular, con ruptura del equilibrio funcional del tejido afectado, se produce una serie de reacciones llamada Inflamación Crónica Inespecífica (3).
En el desarrollo de estos mecanismos participan dos tipos de células: a- Inmunitarias (linfocitos); b- Inflamatorias (neutrófilos, eosinófilos, fibroblastos, macrófagos, monocitos, plaquetas y endoteliales) (17). En el curso de estas reacciones de la Inflamación Crónica Inespecífica se eliminan varias sustancias interrelacionadas: radicales libres (RL) o factores epigenéticos (FE) (18), PAF (factor de activación plaquetaria) (18), citoquinas recombinantes o fibrogénicas: TNF, IFN-y e interleucinas que coordinan las células inmunitarias e inflamatorias y determinan proliferación, diferenciación y quimiotaxis de las mismas; PDGF (factor de crecimiento derivado de las plaquetas) que juega papel importante en las enfermedades cardiovasculares y malignas (1), factores de crecimiento de los fibroblastos (FGF), epidérmico (EGE), factor-B transformador del crecimiento (TGF-B), prostaglandinas, endotelina y tromboxano (estos dos últimos son hipertensores). Recordemos que las citoquinas recombinantes, liberadas por los macrófagos, deprimen la liberación de la serotonina reduciendo, de esa manera, la actividad del hipocampo, región que regula las emociones y la memoria, induciendo a la ansiedad al estrés y a la depresión.
Al romperse el equilibrio funcional del tejido afectado con edema intra y extracelular se suceden dos fenómenos simultáneos: 1- Aparecen en el lugar afectado los macrófagos (1,3). Estos liberan factores epigenéticos (FE), PAF (factor de activación plaquetaria), Interleucina-1 (IL-1), TNF, IFN-y, los factores de crecimiento, etc. 2- La depleción de las moléculas de ATP lleva también a un exceso del ión glutamato extracelular, por cuanto este necesita energía para su ingreso al citoplasma celular. Este ión glutamato es activado por el aminoácido glicina, para ampliar los canales del calcio con entrada pasiva de gran cantidad de este catión al interior de la célula, desarrollándose así todo el proceso catabólico que se describe adelante. Este es el otro mecanismo por el cual actúa el herbicida Tebutiurón, y el Glifosato ejerce su alcance patológico.
La Interleucina-1 (IL-1), por su parte, actúa en tres esferas: 1- Estimula la proliferación, quimiotactismo e infiltración de los linfocitos T, que, a su vez, generan Interleucina-2-13, que participan en los fenómenos de adhesión al endotelio. Algunas de ellas estimulan la maduración de los linfocitos B hasta convertirlos en células plasmáticas generadoras de inmunoglobulinas (factores de adhesión al endotelio) y, además, la proliferación, maduración y quimiotactismo de los eosinófilos. Estos liberan factores tóxicos: proteína básica mayor, proteínas catiónicas y neurotoxina, indispensables para la acción “homicida”, tanto de los eosinófilos como de los linfocitos citotóxicos y asesinos. Esta es la razón de dicha infiltración observada en la histología de la Parotiditis recidivante y el síndrome de Sjögren (7). 2- Potencializa el ingreso del calcio al citoplasma celular (3). 3- Estimula el hipotálamo anterior responsable del aumento de la temperatura en la inflamación al liberar prostaglandina E (14).
Reacciones catabólicas.
Parece que la primera lesión ocasionada por los FE, en particular, el radical OH-, sea un trastorno profundo en la funcionalidad de la membrana celular con pérdida de su permeabilidad selectiva, por aumento de la misma (1). Este fenómeno determina una afluencia masiva de calcio desde el espacio extracelular, la mitocondria y el retículo endoplasmático, con incremento de la concentración del calcio citosólico que se comporta con una actividad tóxica al activar las enzimas catabólicas. Ello lleva a la pérdida de la homeostasis iónica y osmótica y otras funciones de la membrana.
Las enzimas catabólicas activadas por el calcio son: proteinkinasa, endonucleasa, proteasa, fosfolipasa, etc (14). Con ello se agrava la Inflamación Crónica Inespecífica. La proteinkinasa activada crea poros en la membrana celular al contraer las moléculas proteicas alojadas en su espesor, con mayor entrada de calcio. La endonucleasa ocasiona una fragmentación de la cromatina nuclear ya aglutinada y condensada debajo de la membrana nuclear a consecuencia del bajo pH por el mayor consumo de ATP existente en el tabaquismo o la diabetes desbordada. Tal vez sea esta la explicación de la existencia de las células LE observadas en ocasiones enfermedades autoinmunes (las derivadas del tabaquismo y diabetes). La proteasa activada fragmenta los filamentos citoesqueléticos que conectan la membrana plasmática con el interior de la célula, presentando desprendimiento y desorganización de la misma.
De igual manera, la fosfolipasa activada degrada los fosfolípidos de la membrana celular con liberación del ácido araquidónico. Dos enzimas participan en la desintegración de este ácido: la lipooxigenasa, liberadora de leucotrienos, y la ciclooxigenasa que da lugar a los endoperóxidos: prostaglandinas, prostaciclina y tromboxano, así como PAF (factor de activación plaquetaria), con lesión del endotelio, ocasionando disfunción endotelial y liberación de gran cantidad de factores epigenéticos (FE) que van a activar más fosfolipasa por vía retrógrada. Este impacto sobre el endotelio afecta su funcionalidad con aumento de la presión arterial.
Estos factores epigenéticos (FE) liberados en exceso, inhiben la vía de la prostaciclina (vasodilatador y antiagregante plaquetario) para desviarla hacia la formación de tromboxano. Este es un potente vasoconstrictor y agregante plaquetario con cierre del esfínter precapilar (14) y el consecuente aumento de la presión arterial, favorecida por la menor síntesis de óxido nítrico (NO) por el endotelio, reducción favorecida por el aumento del Ca citosólico en la célula endotelial. Por su parte, el tromboxano activa la liberación de endotelina por las células endoteliales, otro potente vasoconstrictor, así como PDGF (factor de crecimiento derivado de las plaquetas), multiplicador de las células musculares lisas de las arterias (1), con engrosamiento de la pared arterial y la consecuente reducción de su luz con disminución de la irrigación sanguínea y tendencia al infarto (19).
De ahí que la reducción de los protectores del endotelio, como la prostaciclina y el NO, y el impacto que sobre el endotelio ejercen tanto el PAF (factor de activación plaquetaria), como el tromboxano, la endotelina y el PDGF en la disfunción endotelial crónica, juegan papel fundamental en las enfermedades cardiovasculares (20), con sus implicaciones: hipertensión, trombosis, infarto, hemorragias, etc.
Ello nos lleva a considerar que, una recurrente injuria endotelial ejercida por los diferentes factores de riesgo, conduce a una hiperplasia de la íntima arterial sobre un fondo inflamatorio crónico, lo que lleva a una formación ateromatosa. Los monocitos circulantes se activan para adherirse al endotelio e ingresar a la íntima, captando lipoproteínas de baja densidad extracelulares, que al ser oxidadas por los factores epigenéticos (FE), se convierten en células espumosas aglutinadas en forma de placas de ateroma, con incremento de la reducción de la luz arterial. Seguidamente, aparecen factores de crecimiento derivado de las plaquetas que hacen proliferar las células musculares lisas. Su progresivo desarrollo conduce a una arterio-ateroesclerosis, sumado ello a los cambios estructurales y funcionales ocurridos en el tejido lesionado con formación de fibrosis. Todo ello como consecuencia del proceso inflamatorio, con trastorno en la permeabilidad vascular, en que los factores epigenéticos (FE) ocasionan lesión de peroxidación de las células proteicas, como la elastina, el colágeno, el ácido hialurónico, etc, con alteración de sus propiedades biofísicas y bioquímicas (6).
Factores epigenéticos y enfermedad.
Los factores epigenéticos (FE) son átomos célibes de una gran reactividad que los hace muy oxidantes, capaces de dañar, de manera indiscriminada, estructuras biológicas de las células por reacción en cadena de peroxidación. Cuando los sistemas enzimáticos defensivos son desbordados por una mayor producción de factores epigenéticos (FE), determinada por factores exógenos, se va a generar, especialmente el radical hidroxilo (HO-), contra el cual no existe ningún mecanismo natural o enzimático de defensa, salvo la lisozima y los antioxidantes externos, como ya se indicó, además de poseer una muy alta actividad oxidativa que se abre como un amplio abanico con múltiples enfermedades, descritas bajo diversos nombres:
1- Estos elementos van acumulando lentamente lesiones en los sistemas biológicos celulares (1): proteínas, fosfolípidos de la membrana celular, ácidos nucleicos (ADN) (17), lipoproteínas de baja densidad o colesterol (5), mitocondrias, etc. Promueven, además, enlaces cruzados mediados por grupos sulfhidrilos de algunos aminoácidos. Por acción de la proliferación de los fibroblastos consecutiva a la actividad de los factores de crecimiento (mitógenos) y citoquinas fibrogénicas producidas por los macrófagos se va instaurando fibrosis, esclerosis, angiogénesis y células musculares lisas, como se observa en la arterioesclerosis y las enfermedades autoinmunes. De los 360 pacientes, que vivían en las mismas condiciones de vida se encontró que el 38% presentaba alguna manifestación de enfermedad autoinmune (3).
2- Los factores epigenéticos (FE), en particular el OH-, atacan los ácidos grasos poliinsaturados fosfolípidos a nivel de los dobles enlaces carbono-carbono. Los ácidos grasos insaturados lesionados se convierten en factores epigenéticos (FE) con súbita restauración de sus dobles enlaces para formar un radical peroxi-ROO en presencia de oxígeno (O2) (2). De esa manera se forma una reacción en cadena, la lipoperoxidación (2), que termina cuando encuentra moléculas frenadoras. En el curso de estas reacciones se eliminan productos de degradación como los malondialdehídos que aumentan con la edad y que sirven para medir el daño por peroxidación lipídica (4,5). Este proceso determina una desorganización estructural, así la membrana pierde su textura y sus funciones de información y la permeabilidad selectiva con entrada de calcio para activar las enzimas catabólicas. Esta es la razón del punteado radioopaco observado a la sialografía en la Parotiditis recidivante y el síndrome de Sjögren cuando el medio de contraste ingresa a presión al acini (21). Además, esta lesión va demarcando un mayor envejecimiento.
3- Los factores epigenéticos (FE) oxidan las lipoproteínas de baja densidad (LDL) (5) infiltradas en la membrana celular y entre las células endoteliales, sufriendo precipitación con tendencia a formar placas de ateroma en las arterias escleróticas (5,22), como ya explicamos.
4- Los factores epigenéticos (FE) inhiben las enzimas con grupos sulfhidrilos (1,3), como la lisozima. Por ello ella desempeña el papel de molécula barrendera, al igual que las vitaminas A, C, E, cisteína, glutatión, albúmina, etc (1,3). La lisozima es básica en la activación del gen p53 o gen supresor (reportado por David Lane, en 1979) (23), para convertirlo en antioncogén o gen supresor tumoral (3).
5- El FE, por su parte, puede lesionar el DNA de una célula somática por mutación puntual para determinar una lesión maligna (3,24).
En este último caso, debemos señalar que para el control normal de la proliferación de las células se distinguen dos tipos de genes:
A- Los genes promotores o protooncogenes, encargados de promover la proliferación de las células activadas por la enzima DNA-polimerasa (1,3) y, en caso patológico, también por los factores de crecimiento.
B- El gen supresor, al que Lane acuñó el nombre de gen p53 (25-28) o regulador de dicha proliferación, activado, como lo presumimos, por la enzima lisozima (3), para que ordene la síntesis de una proteína que inhiba el gen promotor. Del equilibrio accional de estos dos tipos de genes surge una normal multiplicación celular. Los primeros son mejor conocidos desde cuando los nobel Arthur Kolberng y Severo Ochoa, en la década del cincuenta del siglo pasado, sintetizaron el DNA y descubrieron la DNA-polimerasa, enzima capaz de propiciar su replicación. Mientras los segundos apenas si se sospechan.
La lisozima, por su parte, es una enzima básica de carga eléctrica positiva (29) constituida por una cadena polipeptídica de 129 aminoácidos, ocho de los cuales son moléculas de cisteína que por acción del factor epigenético anión superóxido forman cuatro puentes disulfuro de cistina que le dan consistencia a la molécula enzimática y la mantienen plegada. Aquí los FE actúan favorablemente. Para su síntesis la lisozima requiere ATP, para lo cual son indispensables las vitaminas del complejo B. Aproximadamente el 40% de la cadena polipeptídica tiene forma de segmentos alfa-helicoidales o secundaria, que dibuja una hendidura a un lado de la molécula y que constituye el sitio activo de la enzima. Su estructura secundaria es mantenida por enlaces de H entre un grupo amida situado en cierta posición y un grupo carboxilo (CO) situado por arriba o por debajo. El OH- rompe esos enlaces para formar agua perdiendo la molécula su estructura secundaria con inhibición de la enzima.
De esa manera, como antioxidante, la lisozima cumple la función de proteger al organismo de las enfermedades no transmisibles, en particular, el cáncer endógeno o celular, dependiente de los factores epigenéticos (FE) y, además, por su actividad electropositiva protege del cáncer de origen exógeno o viral, determinado por el papilomavirus ADN, electronegativo. Una tercera función importante parece ejercer dicha enzima: activar la acción supresora del gen p53 para inducirlo a ordenar al ribosoma a generar la proteína supresora.
Normalmente el organismo sintetiza ampliamente esta enzima por casi todos los órganos. Sin embargo, su síntesis disminuye por la acción de los mismos factores generadores de las enfermedades no transmisibles, que ya hemos indicado. Al disminuir su síntesis, se reduce o deja de activarse el gen supresor o gen p53.
La lisozima actúa entonces, como regulador o ‘freno’ de la replicación del DNA o sea, como control de la multiplicación celular. Para ingresar a la célula ella debe despolimerizar el mucopolisacárido que constituye los receptores existentes en la membrana. De allí es captada por receptores proteicos del citoplasma, que por fosforilación transducen sus órdenes reguladores sucesivamente hasta el gen p53 del DNA del cromosoma 17 del núcleo de una célula somática (1,3,29). Así se activa este gen convirtiéndose en gen p53 salvaje, conocido como antioncogén o supresor tumoral. Este lleva la orden de controlar la replicación del DNA o sea de la multiplicación celular determinada por la DNA-polimerasa. Al disminuir la lisozima, sea por deficiente síntesis de ATP, por cualquier causa, como la hipovitaminosis B o por acción inhibidora de los factores epigenéticos (OH-), se salta el freno con predominio del protooncogén activado por la DNA-polimerasa y los factores de crecimiento (3). En este caso puede suceder:
a- Dada la mayor actividad de la DNA-polimerasa y los factores de crecimiento, por la falta o disminución del ‘freno’ se va a generar una proliferación de células bien diferenciadas, normales, es decir, una hiperplasia del tejido afectado con características y producción de matriz intercelular (mucopolisacáridos) normales. Ello es debido a que el mRNA conserva la información del código genético. De esa manera se produciría un tumor benigno (3).
b- Si en lugar de este fenómeno o sobre él se opera una mutación puntual del protooncogén por acción del OH- (Fig. 3) producido en exceso durante la Inflamación Crónica Inespecífica o por acción de las radiaciones ionizantes, este protooncogén se va a convertir en oncogén con deleción parcial de una base complementaria, el código genético se altera inmediatamente y el mRNA, con su mensaje genético alterado va estimular el ribosoma para que codifique una proteína intercelular anómala, la oncoproteína. La proliferación celular va a ser irregular, sin un patrón, descontrolada; las mitosis más rápidas y las células muy indiferenciadas o anaplásicas en la medida en que el proceso es más agresivo, activados, a su vez, por los factores de crecimiento (mitógenos) y citoquinas fibrogénicas, determinantes de angiogénesis y fibrosis, es el tumor maligno (1,3).
c- La tercera forma es una mezcla de las dos anteriores. La lesión comienza en forma de tumor benigno y si en el transcurso de un tiempo variable el protooncogén sufre una mutación puntual para convertirse en tumor maligno, ya descrito, como sucede en la malignización del tumor mixto de parótida, el bocio, el papiloma laríngeo, etc. Sin embargo, el tumor benigno no necesariamente sufre malignización.
El tumor maligno producido por esta vía es lo que se denomina oncogénesis endógena o celular (c-onc), a diferencia de la exógena o viral (v-onc) que ocurre cuando al protooncogén se integra por mutagénesis insercional un virus oncógeno DNA de carga eléctrica negativa, como el papilomavirus (HPV) (29), con mutación puntual de dicho gen del fibroblasto. Cuando el virus oncógeno no se integra al DNA nuclear, da lugar a la Papilomatosis laríngea juvenil u otra lesión, permaneciendo latente en el soma del núcleo recibiendo el nombre de episoma, sin determinar malignidad, aunque puede sufrirla en cualquier momento favorable.
No obstante, para que se efectúe esa integración del virus al DNA se requiere que exista una predisposición dada por una deficiencia inmunológica a partir de la ICI, con un bajo nivel de lisozima, porque ella con su carga eléctrica positiva inhibe extracelular o citoplasmáticamente al virus oncógeno electronegativo impidiéndole ingresar a la célula o integrarse al DNA nuclear. Por tal razón, dicha enzima constituye el verdadero “guardián del genoma”. Así se explica por qué los agentes cancerígenos parecen selectivos al afectar a unas personas y no a otras.
El virus del papiloma es un virus oncógeno DNA desnudo que no puede ser propagado por cultivo. De ahí la imposibilidad de la elaboración de una vacuna, además de que ésta no supliría la insuficiencia inmunitaria, con disminución de las secreciones serosas (entre ellas la saliva), que contienen la lisozima. Por ello la sequedad de las mucosas es uno de sus síntomas manifiestos. El virus, por su parte, no se localiza en el citoplasma de la célula huésped, sino en el núcleo. Y, a diferencia de los virus citocidas (RNA), que llevan a la muerte celular, la infección por este virus tumoral ADN conduce hacia la coexistencia simbiótica del virus con la célula, lo que determina un cambio profundo de las propiedades de las células infectadas. La célula presenta, en consecuencia, un incremento en su metabolismo y la multiplicación.
Aquí nos asalta una pregunta: ¿Por qué el papilomavirus ataca determinadas zonas específicas, como el área cutánea, el cuello del útero y las cuerdas vocales, predominantemente?
Sencillamente, porque son áreas cubiertas por un epitelio estratificado, a donde no llega la sangre, como tal, que es donde se encuentran los factores epigenéticos (FE), sino una especie de trasudado. Por esta razón, es muy baja la incidencia del cáncer en esos lugares disparado por los factores epigenéticos (FE). En cambio, estas son zonas expuestas al ambiente externo a donde llega un factor procedente del exterior, el papilomavirus, que no circula en la sangre. Por otro lado, para garantizar la efectividad de esta vacuna, se requiere una estricta observación de por lo menos 30 años.
En nuestro estudio (3), las enfermedades malignas estuvieron presentes en un 31% de los familiares que convivían con los 360 pacientes con malformaciones congénitas. 15 pacientes con Papilomatosis laríngea tratados con dieta balanceada, complejo B y lisozima (29) se recuperaron.
6- Los factores epigenéticos (FE) pueden igualmente determinar una mutación de un gen cromosómico de una célula germinal, sea el espermatozoides o el óvulo (3,22) (Fig. 3). Ello da lugar a anomalías de carácter genético preconcepcional. Esta mutación es, en general, de tipo puntual (30), ocasionada por la acción oxidante del HO- sobre el enlace de hidrógeno que une las bases de las dos tripletas de un gen del DNA con deleción parcial. Se afecta una sola base complementaria, en la que se sustituye una base por otra, por ej. T por A. Esta mutación altera, en consecuencia, la información del código genético del gen al dificultar la transcripción en el DNA correspondiente con su mensaje genético y la generación de dismorfosis en la descendencia (1). Ello sucede así porque al llevarse a cabo la concepción ya lleva el error que se desarrolla en la blastogénesis durante el periodo de organogénesis o de diferenciación y migración celular que ocurre durante el primer trimestre del embarazo.
Las anomalías postconcepcionales o embrionarias, son aquellas que se producen por exposición de la gestante a algún factor teratógeno durante el período de organogénesis en el primer trimestre de gestación. Las causas son diversas y las clasificamos en dos grupos: A- Metabólicas y B- Inflamatorias.
7- Las mitocondrias también comparten el edema intracelular en el proceso de la Inflamación Crónica Inespecífica. La persistencia de la acción inflamatoria va a determinar una lesión permanente de peroxidación de los FE sobre la misma mitocondria a nivel de las crestas y matriz donde se realizan las reacciones del ciclo de Krebs y la fosforilación oxidativa. De esa forma, la mitocondria pierde su capacidad degradativa de la glucosa, por lo que esta aumenta en el plasma, dando lugar a la Diabetes-2, insulino-resistente que aparece en la vida adulta al fundirse la central eléctrica, la mitocondria. Ahora, no se trata propiamente de una resistencia a la insulina, sino que se han fundido los fusibles donde se metaboliza la glucosa para producir la energía.
FACTORES DE RIESGO
1. Déficit de vitaminas del complejo B
2. Diabetes
3. Alcohol
4. Tabaco
5. Cocaína
6. Herbicidas†
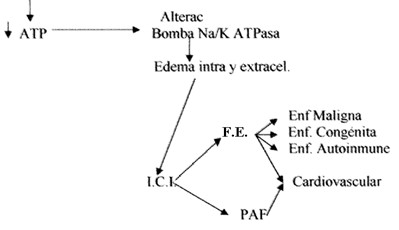
Figura 1.†
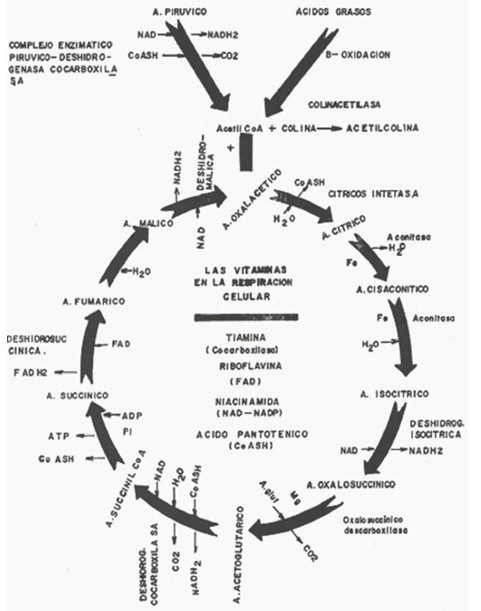
Figura 2.†
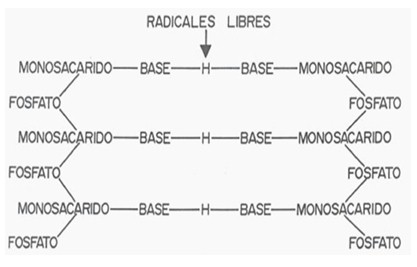
Figura 3.
BIBLIOGRAFÍA
1- Cotran, R.S. et al. –Patología Estructural y Funcional. 5™. Ed. Mc-Graw-Hill Interamericana, Madrid, 1997.
2- Guyton, A.C. et al. –Tratado de Fisiología. 9™. Ed. Mc-Graw-Hull Interamericana, México, 1997.
3-Altamar, J. –Herbicidas y Malf. Congén. en el Meta, Colombia. Actividad Patogénica de los radicales libres (RL). Orinoquia, Villavicencio, Colombia, 2002; 6: 5-35
4- Villa Pérez, M. –radicales libres (RL) de oxígeno (O2) y la Enfermedad. Conferencia en la VI Reunión del Grupo Español RL. Cádiz,
5- Jiménez, S. –Antioxidantes y radicales libres (RL) en el Tabaquismo. Solo-Mujeres. Buenos Aires; 2003.
6- Southern, P.A. and Powis, G. –Medicine. II. Involvement in Human Disease. Mayo Clinic.Proc.1994; 63: 390-404.
7- Altamar, J. –El Síndrome de Sjögren, una manifestación de deficiencia del complejo B. Anales ORL-Iber-Amer: 1985; 12: 443-457.
8- Green, P.H.R. –Alcohol Nutrition and Malabsort. Cl.Gastroen.N.A. 1983; 12: 563-574.
9- Lemoyne, P. et al. –Les enfants de parens alcoholiques. Anomalies observes. Quest. Med. 1968; 21 : 476-482.
10- Jones, K.L. –Pattrerns of malformation in offspring of chronic alcoholic mother. Lancet. 1973; 1:1267-1271.
11- Palmer, R.H. et al. –Congenital malformation on offspring of a chronic alcoholic mother.Pediatrics, 1974; 53:490-494.
12- Falcón, G. Et al. –Síndrome alcohólico fetal. Rev.Esp.Ped. 1980; 36: 35-42.
13- Ruiz, M. Et al. –Efectos tóxicos del tabaco. Rev.Toxicol. I.Canarias. 2004; 21:47-71.
14- Goodman y Gillman, L.S. –Bases Farmacologicas de la Terapéutica. 8™. Ed. Edit. Panamericana, México, 1991.
15- De Ross, A. J. et al. –Cancer incidente among Glyphosate-Exposed Pesticida Applicators in the Agricultural Health Study. Enviromental Health Perspective, 2005; 113: 4957.
16- Ramírez D, W.F. et al. –Efectos del Glifosato con énfasis en organismos acuáticos. (Revisión de Literatura). Orinoquia, Villavicencio, Colombia, 2004; 7:70-100
17- Martins, M.A. et al –Interaction between inflammation and systemic haematologic Effect of PAF- acether in the rat. L.Pharmacol. 1989; 36: 333-360
18- Hilliguin, P. et al.-Correlation. Between PAF-acether and tumor necrosis factor in rheumat Arthritis. Influen. Of parenter-corticoter. Scands. J. Rheumat. 1995; 24: 169-173.
19- Hollan, S. –FR in health and diseases. Haematologia. Budapest, 1995; 26: 177.
20- Alloati, G. Et al. –Role of PAF in oxygen radical.induced cardiac dysfunction. J. Pharmacol.Exp.Ther. 1994; 269: 766-771.
21- Altamar, J. –La Parotiditis recidivante. Su etiopatogenia y tratamiento. Anales ORL. Iber-Amer. 1994; 21: 391-402.
22- Hallivell, B. –Current review. Free reactive oxygen species human disease, a critical evaluation with special Reference to atherosclerosis. B. Exp. Path. 1995; 70:737-771.
23- Lane, D.P. and Crawford, l.V. –SV40 T antigen is bound to a host protein in V40 transformed cells. Nature (1979); 278: 262-263.
24- Richard, J. –Fumar. Cigarrillo. Reduce los niveles del antioxidante paraoxonasa. Diario Médico, mayo 2000.
25- Narayan, A. et al. –Dissimilar cell cicle responses alter y-irradiation and cisplatin. Treatment are induced by p53 in head and neck squamous cell carcinomas. In Lppert-Metast. in Head and Neck Cancer. Proc. In 2nd Intern. Symposium. January 25-27, 2001. Marburg, Germany.
26- Mochon, A. et al. –La mutación p53: un fenómeno tardío en la oncogénesis de cabeza cuello. Anales ORL.Iber-Amer. 1998; 25:433-771.
27- Bier, H. et al. –Assesment of p53 mutations in squamous cell carcinomas of the head and neck: the critical impact of applied methods In Lippert, -Metastases in Head and Neck Cancer. Proceed. of the 2nd International Symposium. January 25-27, 2001, Marburg, Germany.
28- Gottschlich, S. et al. –p53 gene analysis cancer of unknown primary in the head and neck. In Lippert, BM. Metastases in Head abd Neck Cancer. Proceeding of the 2nd Intern. Symposyum. January 25-27, 2001, Marburg, Germany.
29- Altamar, J. –The role of Lysozime on etiopathogenesis and treatment on Juvenile laryngeal papillomatosis. Otolaringol. Torino, Italy; 1998; 44: 17-22.
30- Altamar, J. –Acalasia esofágica y mongolismo, papilomatosis laríngea y dermatomiositis. ¿Un origen común? Revisión. Anales ORL-Iber-Amer, 1997, 24: 551-562.