La farmacocinética es la relación que se establece entre el fármaco y el paciente e incluye los procesos de absorción, distribución, metabolismo y eliminación. Esta puede verse afectada por diversos factores demográficos: edad, sexo, genero; fenotípicos; ambientales: tabaquismo y dieta etc. Por eso es necesario un adecuado monitoreo en la terapia farmacológica del paciente, teniendo en cuenta siempre los efectos adversos que se puedan generar. Se revisa información para dar a conocer la aplicación de la farmacocinética en el monitoreo de fármaco. La farmacocinética ha mejorado la terapia individualizadas reduciendo los efectos adversos y mejorando su acción terapéutica, es necesario implementar programas de educación al profesionista de la salud para tratar de que las interacciones farmacológicas no sea una limitante y llevar a la necesidad de individualizar los tratamientos farmacológicos, adaptándolos a las características de cada paciente.
Importancia de la monitorización farmacocinética en fármacos
Gilberto Quiñonez P., María de los R. Sanchez D., María de los Ángeles Leal A.
MC. Gilberto Quiñonez Palacio
Centro de Ciencias de la Salud. Edificio CISALUD. Universidad Autónoma de Baja California. Unidad Académica Valle Las Palmas. Valle Las Palmas. Tijuana B.C.
Médico Investigador Instituto de Seguridad y Servicio Sociales del Estado de Baja California (ISSSTECALI). Carretera Federal Tecate –Tijuana y Blvd. Encinos S/N. Col. El Encanto. Tecate B.C.
MC. María de los Remedios Sanchez Diaz
Edificio CISALUD. Universidad Autónoma de Baja California. Unidad Académica Valle Las Palmas. Valle Las Palmas. Tijuana B.C.
ME. María de los Ángeles Leal Ávila
Edificio CISALUD. Universidad Autónoma de Baja California. Unidad Académica Valle Las Palmas. Valle Las Palmas. Tijuana B.C.
Resumen:
La farmacocinética es la relación que se establece entre el fármaco y el paciente e incluye los procesos de absorción, distribución, metabolismo y eliminación. Esta puede verse afectada por diversos factores demográficos: edad, sexo, genero; fenotípicos; ambientales: tabaquismo y dieta etc. Por eso es necesario un adecuado monitoreo en la terapia farmacológica del paciente, teniendo en cuenta siempre los efectos adversos que se puedan generar. Se revisa información para dar a conocer la aplicación de la farmacocinética en el monitoreo de fármaco. La farmacocinética ha mejorado la terapia individualizadas reduciendo los efectos adversos y mejorando su acción terapéutica, es necesario implementar programas de educación al profesionista de la salud para tratar de que las interacciones farmacológicas no sea una limitante y llevar a la necesidad de individualizar los tratamientos farmacológicos, adaptándolos a las características de cada paciente.
Palabras clave: Farmacocinética, monitorización
Abstract:
Pharmacokinetics is the relationship established between the drug and the patient and includes the processes of absorption, distribution, metabolism and elimination. This can be affected by demographic factors: age, sex, gender, phenotypic,environmental: smoking and diet etc. So we need an adequate monitoring patient drug therapy, while taking into account the adverse effects that may arise. We analyze information for the application of pharmacokinetic in drug monitoring. Pharmacokinetics has improved individualized therapy to reduce side effects and improving its therapeutic action, is necessary to implement educational programs for health professional to treat drug interactions and carry out individualize drug therapies, adapted to the characteristics of each patient.
Keywords: Phramacokinetics, monitorization
INTRODUCCIÓN
La farmacocinética es la relación que se establece entre el fármaco y el paciente e incluye los procesos de absorción, distribución, metabolismo y eliminación [2-3]. Dentro de los parámetros farmacocinéticas más relevantes son la concentración máxima, la vida media del antimicrobiano en el plasma y el área bajo la curva.
La absorción gastrointestinal, subcutánea o muscular de un fármaco es relevante. La disminución en la perfusión gastrointestinal, subcutánea y muscular se observa en pacientes sépticos y pueden reducir significativamente la absorción de los fármacos generando concentraciones plasmáticas insuficientes [3].
En estos pacientes debe priorizarse la administración por vía intravenosa en cuyo caso se alcanza 100% de absorción. La eliminación de fármacos (antimicrobianos) como B-lactámicos, vancomicina, aminoglucósidos pueden reducirse significativamente en casos de insuficiencia renal, generando concentraciones plasmáticas más elevadas. El volumen de distribución de un antimicrobiano es variable entre personas por factores como disfunción de óranos excretores u obesidad, en cuyo caso puede superar largamente el volumen extracelular para fármacos con alta unión a grasas, pero también puede tener severas variaciones en un mismo individuo, como consecuencia del aumento de la permeabilidad que acompaña a enfermedades graves, quemaduras, etc. [3].
Las características de absorción, distribución y eliminación en cada paciente determinan la curva de concentración-tiempo en el plasma [3]. A su vez la farmacocinética también tiene su aplicación en la variabilidad interindividual asociada con parámetros obtenidos en pacientes de la práctica clínica rutinaria. Esta variabilidad de respuesta farmacológica se basa en diferentes características que se llegan a relacionar con alguna fisiopatología de los pacientes dentro de las cuales llegan a influir: edad, género, peso, factores genéticos, factores ambientales, estados patológicos, situación clínica, etc. Dentro de los factores farmacocinéticas se encuentran los siguientes: Demográficos: edad, peso corporal, genero, raza. Fenotipo genético al afectar el metabolismo hepático de los fármacos debido a polimorfismos o isoformas del citocromo CYP450. Ambientales: tabaquismo, dieta
Fisiológicas-fisiopatológicas: insuficiencia renal, insuficiencia hepática, hipertensión arterial sistémica. Otros factores: variación circadiana Ahora se describirá de forma breve por qué cada uno de estos factores se ve relacionado con la interacción del paciente y el fármaco.
La edad. El proceso de la absorción muestra cambios con la edad, durante el periodo neonatal se producen cambios. Fisiopatológicos que pueden afectar la absorción de fármacos. En este periodo se producen un incremento del pH gástrico que favorece la absorción de las bases débiles. Además de que con la edad hay cambios significativos en la composición corporal, como incremento de la grasa corporal en 20 a 40%.
Género. Las diferencias en la farmacocinética de los medicamentos entre géneros se han reportado en 28%, de acuerdo con estudios realizados con: fluconazol, ranitidina y en algunos antipsicóticos se ha observado que el género femenino requiere menor dosis con respecto al masculino; estas diferencias podrían deberse al contenido de agua y grasa.
Peso. La obesidad es un problema ya que esos pacientes tienen por lo general enfermedades cardiovasculares, alteraciones renales, diabetes, depresión etc., Por lo cual estos pacientes tienen alteraciones fisiológicas que modifican los procesos farmacocinéticas especialmente la distribución lo que obliga a realizar ajustes en la dosificación de algunos fármacos [2].
Alimentación. Algunos alimentos pueden interaccionar con fármacos como ciertos antimicrobianos se inactivan al ingerirse con alimentos ricos en calcio como la leche, por otro lado las grasas abundantes o las comida muy caliente retrasa el vaciamiento del contenido gástrico disminuyendo la absorción de medicamentos [4].
RESPUESTA TERAPÉUTICA.
Una respuesta terapéutica o tóxica a los fármacos varía de unos pacientes a otros en función de las características del fármaco, de la forma en que se administre, de las características del paciente y de su enfermedad y de las interacciones con otros fármacos que se administren simultáneamente. Estos factores hacen que la dosis «habitual» o «estándar» pueda ser insuficiente en unos pacientes y tóxicas en otros [1]. Sólo será adecuada para todos los pacientes cuando el índice terapéutico del fármaco sea tan grande que puedan utilizarse dosis altas (eficaces en todos los pacientes) sin efectos tóxicos, como sucede con algunas vitaminas y penicilinas (Fig. 1.1).
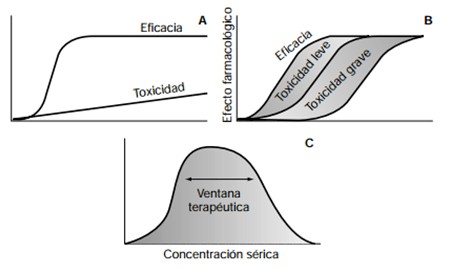
Fig. 1.1 Relación nivel-efecto. Las penicilinas alcanzan su máxima eficacia con escasa toxicidad y no requieren monitorización (A). Con digoxina, teofilina, aminoglucósidos o antiepilépticos empieza a observarse toxicidad leve antes de alcanzar la máxima eficacia, pero hay un intervalo óptimo en que se consigue una buena eficacia con escasa toxicidad (B). Intervalo óptimo (C).
Con los demás fármacos debe individualizarse el tratamiento para mejorar la eficacia y evitar la toxicidad.
El intervalo terapéutico es el intervalo de niveles séricos en que la mayor parte de los pacientes tienen una buena respuesta sin toxicidad.
Por debajo de este intervalo es frecuente que el tratamiento sea ineficaz y por encima es frecuente que se observen efectos tóxicos. Sin embargo, hay pacientes que pueden responder a niveles por debajo de este intervalo y otros precisan niveles por encima de éste. Para que la determinación de los niveles séricos de un fármaco esté justificada es preciso que exista un método analítico fiable que permita su determinación, que haya una pobre relación entre dosis administradas y niveles alcanzados y que exista una buena relación entre los niveles séricos del fármaco y sus efectos terapéuticos y/o tóxicos, es decir, un intervalo óptimo. La variabilidad en la respuesta a los fármacos depende de múltiples factores farmacocinéticos, que modifican los niveles plasmáticos, y de factores farmacodinámicos, que alteran la sensibilidad a un determinado nivel. Además, la dosis prescrita puede ser distinta de la tomada por el paciente por errores en la administración o incumplimiento terapéutico [1,3].
La determinación de los niveles séricos de los fármacos permite diferenciar las causas debidas a incumplimiento de las farmacocinéticas y de las farmacodinámicas y tomar las medidas adecuadas: si la causa de un fracaso reside en que los niveles son bajos debe aumentarse la dosis, pero si se debe a resistencia hay que cambiar de medicación
La farmacogenética estudia de qué manera el perfil genético de un individuo afecta la respuesta a los fármacos y pretende ajustar las dosis y predecir, a través de la asociación entre la respuesta farmacológica y las variantes genéticas, cuáles pacientes serán beneficiados y cuáles no, con el uso de un fármaco, ya que las diferencias genéticas condicionan la farmacodinamia y la farmacocinética de los mismos, su metabolismo, excreción y, por lo tanto, sus niveles sanguíneos. Cuanto peor sea la relación entre la dosis y el nivel sérico, y mejor la relación entre el nivel sérico y el efecto, tanto más útil resultará la determinación de los niveles en el control del tratamiento. La relación entre niveles séricos y efectos terapéuticos o tóxicos es una curva sigmoidea: a partir de un determinado nivel comienzan a observarse los efectos, aumentando con los niveles hasta llegar a un límite por encima del cual no se consigue mayor eficacia o, incluso, puede disminuir.
Una de las mayores dificultades del tratamiento en la práctica clínica es la respuesta individual a los fármacos. Así, no sólo varían en su eficacia, que en general es de alrededor del 50%, sino que, además, mientras que en algunos individuos son seguras, en otros pueden ocasionar reacciones adversas de diferente magnitud.
Una de las mayores dificultades del tratamiento en la práctica clínica es la respuesta individual a los fármacos. Así, no sólo varían en su eficacia, que en general es de alrededor del 50%, sino que, además, mientras que en algunos individuos son seguras, en otros pueden ocasionar reacciones adversas de diferente magnitud. deseada, la cual se presenta a las dosis empleadas en el hombre para la profilaxis, el diagnóstico, la terapéutica o la modificación de una función. Algunas de las reacciones adversas son:
a.) Exageraciones del efecto terapéutico, como la hipoglucemia por hipoglucemiantes orales.
b.) Obedecen a la acción farmacológica que da lugar al efecto terapéutico en un sitio diferente del sitio de acción, como la carcinogénesis por estrógenos.
c.) Pueden ocurrir debido a la naturaleza no selectiva de algunos medicamentos, como sucede con los AINES, que producen irritación del tracto gastrointestinal.
d.) Por el espectro de su acción farmacológica, como los antidepresivos que producen efectos anticolinérgicos.
Se caracterizan por ser generalmente dependientes de la dosis, ser predecibles con base en las acciones farmacológicas del medicamento, tener tasas elevadas de morbilidad y tasas de mortalidad bajas. Desde 1950 se conoce la existencia de "metabolizadores rápidos" y "metabolizadores lentos" en respuesta a un fármaco, causando respectivamente que el fármaco sea ineficaz o resultar en una exagerada acumulación del mismo en el organismo. El transporte de los fármacos representa un lugar fundamental, ya que los fármacos se mueven de un compartimiento a otro del organismo a través de un rango especializado de transportadores. Para modular su efecto, las drogas se deben unir físicamente a sus blancos de acción: sus receptores o bien las proteínas involucradas en la respuesta farmacológica (transducción de señales, etc). Los genes involucrados en este proceso también determinan las diferencias individuales en la respuesta farmacológica [9-10].
En consecuencia, los genes candidatos que podrían estar involucrados en la respuesta a fármacos se podrían agrupar en aquellos que controlan:
1) las propiedades farmacocinéticas de los fármacos (incluyendo la disponibilidad de los mismos), y
2) la farmacodinamia (mediante los genes que codifican los blancos de acción y los elementos intermedios del mecanismo de acción). Sin embargo puede ocurrir una inefectividad terapéutica que se define como la ausencia, disminución o cambios del efecto que aparecen de manera inesperada, es decir, respuestas débiles o ausentes, de inicio retardado, de corta duración o que disminuyan o desaparezcan después de un período de uso satisfactorio. Las respuestas terapéuticas dependen en cierta medida de la utilidad del programa de farmacovigilancia [9,10].
FARMACOVIGILANCIA
Todos los fármacos pueden tener efectos negativos. Cuando llegan al mercado son razonablemente seguros, no obstante siguen sometidos a un control permanente, la farmacovigilancia [7]. La farmacovigilancia describe las actividades para la detección, valoración, comprensión y prevención de las reacciones adversas a medicamentos (RAM), las cuales son respuestas nocivas y no intencionadas, que pueden producir los medicamentos a las dosis normalmente prescritas [6].
El impacto de las reacciones adversas a medicamentos (RAM) sobre los costos en salud es evidente, ya que cerca del 5% de las hospitalizaciones son resultado de reacciones adversas a medicamentos (RAM). Los medicamentos más comunes causantes de reacciones adversas a medicamentos (RAM) son: antibióticos, anticoagulantes, anticonvulsivantes, agentes cardiovasculares, respiratorios y los analgésicos [6,8]
Entender el riesgo asociado al uso de medicamentos, medirlo y sopesar sus consecuencias, puede ser un catalizador de la industria farmacéutica, parafraseando a Bernstein. La atención está dirigida a observar el impacto de los medicamentos y de las vacunas en la población, con el objetivo de emprender las acciones que permitan mantener la relación riesgo-beneficio de estos; es una situación favorable, es decir, debemos ajustar la prescripción y anotar las contraindicaciones de uso en grupos especiales, o bien suspender su uso cuando esto no sea posible [5].
Fármacos Monitoreados
Algunos fármacos comúnmente monitoreados son: digoxina, antipléjicos (carbamazepina, ácido valproico, fenitoína, fenobarbital); antirretrovirales (indavir, neflinavir, ritonavir, saquinavir); ciclosporina, tracolimus, imipramina, litio, haloperidol, teofilina, vancomicina, lidocaína, entre otros. Además del monitoreo de fármacos con fines de optimizar la terapéutica en un paciente, el monitoreo también aplica para muestras de toxicología forense y, en caso de sustancias de abuso, así como en la evaluación de biodisponibilidad y bioequivalencia de fármacos.
En este último caso, los estudios garantizan que la biodisponibilidad de los medicamentos comercializados bajo denominación genérica y la de los innovadores sea equivalente, proporcionando seguridad al paciente. Un punto importante que considerar al monitorear el fármaco es el conocimiento de su farmacocinética y de su farmacodinamia [7].
La información recolectada en las fases previas al registro no basta para perfilar la seguridad de los medicamentos y las vacunas, pues es obtenida sobre muestras relativamente pequeñas y una selectiva recolección de datos en un tiempo limitado y fuera de la práctica clínica habitual. La biografía del producto se inicia con el registro y se concreta en la fase IV del desarrollo del fármaco, durante el cual se detectan eventos adversos raros y el efecto de interacciones o condiciones clínicas coexistentes. El campo de competencia de la farmacovigilancia incluye: Productos sanguíneos, biológicos, dispositivos médicos, vacunas, cosméticos, aditivos de alimentos, medicamentos falsificados, herbolarios, errores de medicación, entre otros [5].
Vista desde la industria farmacéutica esta actividad permite que se cumpla el principio de la bioética: “primum non nocere”. Solo así se podrá proteger a los usuarios de sus productos mediante la pronta identificación de riesgos propios del medicamento, detección de factores predisponentes, descubrir errores programáticos, descartar falsas señales, estimar la causalidad por medio de algoritmos y cuantificar la magnitud del riesgo con relación al beneficio [5,8].
El fin de establecer un Programa de Farmacovigilancia Hospitalaria, es el de procurar la mayor seguridad posible en el uso de medicamentos, y por lo tanto sus objetivos fundamentales son:
1. Lograr la detección lo más oportuna posible de las reacciones adversas a medicamentos (RAM) y prioritariamente de aquellas que revistan mayor gravedad. Prestar especial atención a los medicamentos recientemente introducidos en terapéutica.
2. Describir las nuevas reacciones adversas a medicamentos (RAM) que puedan detectarse y evaluar su gravedad y significancia clínica.
3. Confirmar relación de causalidad entre reacciones adversas a medicamentos (RAM) y el medicamento.
4. Establecer incidencia de las reacciones adversas a medicamentos (RAM).
5. Determinar y evaluar los factores predisponentes a la aparición de reacciones adversas a medicamentos (RAM), tales como edad, sexo, enfermedades, factores genéticos, etc.
6. Impulsar la formación e información en materia de reacciones adversas a medicamentos (RAM), dirigidas a los profesionales sanitarios, en general. Así también a los pacientes.
7. Adoptar medidas encaminadas al tratamiento farmacológico eficaz y a la posible prevención de las reacciones adversas a medicamentos (RAM), que en definitiva es el objetivo al que van encaminados todos los anteriores.
Un programa de Farmacovigilancia, puede justificarse sobre la base de mejorar el cuidado presente y futuro del paciente. Se ha demostrado que la monitorización de reacciones adversas a medicamentos (RAM), disminuye su incidencia y gravedad, así como el tiempo de estancia hospitalaria. Como resultado mejora el cuidado individual del paciente. Los sistemas de farmacovigilancia, deben de adaptarse a las características de cada hospital y a los medios disponibles [8].
En los hospitales mexicanos pueden emplearse todos los métodos generales de farmacovigilancia, siempre y cuando se adapten eficazmente a las características de las unidades hospitalarias. Es importante, tomar en cuenta, que cuando se inician las actividades de Farmacovigilancia o monitorea de fármacos, es utópico encontrar una excelente aceptación del Programa y que éste va a despertar, un interés general e inmediato por colaborar en ellos. Por esta razón, es aconsejable introducir los Programas de forma gradual, actuando por etapas y si es necesario, estableciendo programas piloto, que permitan asegurar la viabilidad de una metodología de trabajo antes de generalizar a todo el hospital.
Antes de iniciar a desarrollar cualquier programa concreto son necesarias dos acciones previas:
a) De ser posible, crear un grupo de farmacovigilancia, que será el encargado de promover y coordinar todo el control de las reacciones adversas a medicamentos (RAM) que se presenten en el hospital, de los contrario nombrar un responsable que coordine las actividades.
b) Realizar una campaña de información dirigida al personal sanitario, sobre la necesidad e importancia de los programas de farmacovigilancia en los hospitales, con la finalidad de fomentar, desde un inicio, la colaboración de los médicos y enfermeras del hospital, puesto que de ellos depende la obtención de los recursos necesarios para llevar a la práctica los programas correctos.
El desarrollo de estas actividades en hospitales mexicanos, permitirá tener datos de incidencia y frecuencia de reacciones adversas a medicamentos (RAM) en pacientes mexicanos, con la finalidad de prevenirlas y si es posible, minimizarlas y permitirán apoyar el uso racional de los medicamentos. El éxito del programa establecido dependerá en gran medida del grado de concientización de las autoridades sanitarias, los profesionales de la salud y de los propios pacientes, sobre la importancia de conseguir detección oportuna de las reacciones adversas y ejercer sobre ellas una vigilancia racional y sistematizada, que permita actuar eficazmente cuando sea preciso [5, 6, 8].
TERAPIAS INDIVIDUALIZADAS
En la actualidad el estilo de vida acelerada de la población, su forma de alimentación desequilibrada que conduce a una desnutrición y la cases de incidencias de las enfermedades afectan de forma directa la interacción de los medicamentos en el cuerpo, pero en esto se debe de tener en cuenta que tanto factores externos como internos de igual forma afectan como es el caso de los genes. La combinación de fármacos puede traer tanto beneficios como riesgos, los fármacos que son más propensos a presentar. El grado de presentar un efecto adverso como lo es la toxicidad o una ineficacia terapéutica farmacológica es resultado de la acción entre los genes de cada ser humano y a factores ambientales como dieta, edad, adicción al tabaco, ingestión de alcohol, además de otros medicamentos que consuma.
En general, la eficacia de una terapia farmacológica dista mucho de ser óptima; de hecho, se ha calculado que la respuesta a los medicamentos de la práctica clínica actual, varía de 30 a 60% [9].
Las enzimas metabolizadoras de fármacos (EMF) desempeñan un papel muy importante en la biotransformación de fármacos o xenobióticos. En la población, los citocromos P450 son una súper familia de enzimas implicada en más de 90% del metabolismo de los fármacos CYP2C9, CYP2C19, y CYP2D6 son las enzimas más polimórficas y metabolizan cerca de 40% de los medicamentos que actualmente se encuentran en el mercado. El gen CYP2D6 se localiza en el cromosoma 22 y tiene más de 70 polimorfismos, este gen depende de variantes poblacionales así como demográficas, este se puede dividir en cuatro grupos principales:
a. Metabolizador ultra rápido (MU)
b. Rápido (MR)
c. Intermedio (MI)
d. Lento (ML)
Se ha encontrado que las personas con un ML presentan una baja o nula actividad de la enzima CYP2D6, lo que da como consecuencia una alteración del metabolismo y eliminación de muchos fármacos, por lo que presentan más probabilidad de mostrar RAF a estos medicamentos. En comparación, los sujetos que presentan MU tienen una mayor probabilidad de presentar ineficacia al tratamiento farmacológico, por lo que son necesarias dosis más altas que las normalmente prescritas para conseguir concentraciones terapéuticas. De acuerdo ha esto se han realizado estudios para valorar la frecuencia de estos paramentos en la población mundial en el que se ha encontrado que la frecuencia de individuos ML es de 1-2% en asiáticos, 5% en afroamericanos, y de 6-10% en poblaciones caucásicas. Los etíopes presentan 29% de individuos MU, los árabes sauditas 20%, los caucásicos de 1-2%, a excepción de los españoles (7-10%).
En algunas patologías se ha recurrido a la farmacogenómica para la identifica los genes de susceptibilidad a enfermedades que representen blancos terapéuticos potenciales. A partir del blanco terapéutico se diseñan ensayos clínicos para tamizar los compuestos químicos posibles y determinar su valor [9].
DISCUSIÓN.
La farmacocinética clínica se ocupa de la aplicación de los parámetros farmacocinéticos, al control terapéutico individualizado y a la optimización de regímenes de dosificación de los tratamientos farmacológicos. La respuesta al tratamiento farmacológico depende en gran parte del régimen de dosificación que se utilice, el cual puede verse influenciado por variaciones del perfil farmacocinético y/o farmacodinámico, del fármaco. Las interacciones que ocurren cuando hay administración concurrente de varios fármacos, pueden deberse a variaciones genéticas que afectan su metabolismo y producen diferencias significativas en la respuesta farmacológica de los pacientes.
CONCLUSIÓN.
Para comprender las interacciones entre la farmacología y el cuidado a la salud, es necesario implementar programas de educación al profesionista de la salud, ya que principalmente ellos son los responsables del cuidado de los pacientes. En la práctica clínica todo el personal que labore en un hospital o en consultorios privados, deben de tener conocimiento adecuado para implementar terapias combinadas en el que las interacciones farmacológicas no sean una limitante adaptándolos a las características de cada paciente.
Por lo cual los desafíos de nuevas enfermedades y la reemergencia de las viejas, el fortalecimiento de la farmacovigilancia permiten a las autoridades sanitarias acortar los planes de aprobación del registro medico sanitario para los nuevos medicamentos, por la seguridad que aportan los sistemas de vigilancia poscomercializados. Todo esto se lleva gracias a los avances de la farmacocinética que influyen en gran medida a una eficacia en el tratamiento farmacológico.
BIBLIOGRAFÍA
1. Hernández, M.; Juárez, H. (2010) Farmacovigilancia en pediatría Acta Pediatr Mex. 31 (5) 227 – 232.
2. Garza, L. (2011) Aplicación de la farmacocinética clínica en el monitoreo de fármacos Ciencia Conocimiento Tecnología. 115 (1) 4 – 6.
3. Gómez, L. M.; Téllez, A.M.; López, M. (2005) Importancia de establecer programas de farmacovigilancia en los hospitales mexicanos Revista Mexicana de Ciencias Farmacéuticas. 36 (2) 41 – 48.
4. López M, Guerrero J. (2007) Farmacogenómica Medicina a la medida. Ciencia y desarrollo el conocimiento a tu alcance. 15: 128-183.
5. Rodríguez, J.L.; García, J.L.; Giral, C.; Hernández, D.; Jasso, L. (2004). Farmacovigilancia II. Las reacciones adversas y el Programa Internacional de Monitoreo de los Medicamentos. IMSS-UAEM, 42(5) 419-423.
6. Sookoian, S., & Pirola, C.J. (2004). Farmacogenética/farmacogenómica en la práctica clínica. Medicina Buenos Aires, 64(6) 563-567. ISSN 1669-9106.
7. Hernández, M.; Juárez, H. (2010) Farmacovigilancia en pediatría Acta Pediatr Mex. 31 (5) 227 – 232.
8. Garza, L. (2011) Aplicación de la farmacocinética clínica en el monitoreo de fármacos Ciencia Conocimiento Tecnología. 115 (1) 4 – 6.
9. Gómez, L. M.; Téllez, A.M.; López, M. (2005) Importancia de establecer programas de farmacovigilancia en los hospitales mexicanos Revista Mexicana de Ciencias Farmacéuticas. 36 (2) 41 – 48.
10. López M, Guerrero J. (2007) Farmacogenómica Medicina a la medida. Ciencia y desarrollo el conocimiento a tu alcance. 15: 128-183.
11. Rodríguez, J.L.; García, J.L.; Giral, C.; Hernández, D.; Jasso, L. (2004). Farmacovigilancia II. Las reacciones adversas y el Programa Internacional de Monitoreo de los Medicamentos. IMSS-UAEM, 42(5) 419-423.
12. Sookoian, S., & Pirola, C.J. (2004). Farmacogenética/farmacogenómica en la práctica clínica. Medicina Buenos Aires, 64(6) 563-567. ISSN 1669-9106.
13. Chow FS, Sharma A, Jusko WJ Modeling interactions between adrenal suppression and T-helper lymphocyte trafficking during multiple dosing of methylprednisolone. [Journal Article, Research Support, U.S. Gov't, P.H.S.]J Pharmacokinet Biopharm 1999 Dec; 27(6):559-75
14. CallréusT,Odeberg J,Lundin S,et al. Indirect-response modeling of desmopressin at different levels of hydration. [ClinicalTrial, Journal Article Randomized Controlled Trial] J Pharmacokinet Biopharm 1999 Oct; 27(5):513-29.
15. Bauer RJ, Dedrick RL, White ML, et al. Population pharmacokinetics and pharmacodynamics of the anti-CD11a antibody hu1124 in human subjects with psoriasis. [Clinical Trial, Clinical Trial, Phase I, Journal Article] J Pharmacokinet Biopharm 1999 Aug; 27(4):397-420.
16. Korman B, Jennings LS. Rapid attainment of steady-state plasma drug concentrations within precise limits in multicompartment mammillary systems. [Journal Article, Research Support, Non-U.S. Gov't]. J Pharmacokinet Biopharm 1999 Jun; 27(3):325-8.
17. Singer J, Vereczkey L. Predicting the time needed to achieve steady state if absorption and elimination constants are equal. [Journal Article]. J Pharmacokinet Biopharm 1999 Jun; 27(3):297-300.
18. Weiss M. Cellular pharmacokinetics: effects of cytoplasmic diffusion and binding on organ transit time distribution. [Journal Article]. J Pharmacokinet Biopharm 1999 Jun; 27(3):233-56.
19. Meibohm B, Hochhaus G, Möllmann H, et al. A pharmacokinetic/pharmacodynamic approach to predict the cumulative cortisol suppression of inhaled corticosteroids. [Journal Article, Research Support, Non-U.S. Gov't]. J Pharmacokinet Biopharm 1999 Apr; 27(2):127-47.
20. Lalonde RL, Ouellet D, Kimanani EK, et al. Comparison of different methods to evaluate population dose-response and relative potency: importance of interoccasion variability. [Clinical Trial, Comparative Study, Journal Article, Randomized Controlled Trial]. J Pharmacokinet Biopharm 1999 Feb; 27(1):67-83.