Clasificación, mecanismo de acción, efectos indeseables más frecuentes y usos. Objetivos: relacionar el uso de los antivirales en la práctica médica teniendo en cuenta su principal mecanismo de acción y efectos indeseables.
SUMARIO.
Clasificación, mecanismo de acción, efectos indeseables más frecuentes y usos.
OBJETIVOS.
Relacionar el uso de los antivirales en la práctica médica teniendo en cuenta su principal mecanismo de acción y efectos indeseables.
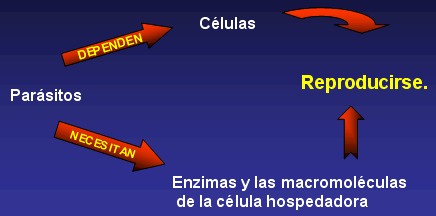
Los virus son los parásitos más pequeños; dependen por completo de las células (bacterianas, vegetales o animales) para reproducirse. Están compuestos por una cubierta externa de proteínas y a veces de lípidos, y un centro (core) de ácido nucleico ARN o ADN. En muchos casos, ese centro penetra en las células susceptibles e inicia la infección.
Los virus son parásitos intracelulares obligados que necesitan las enzimas y las macromoléculas de la célula hospedadora para su replicación. Esta absoluta dependencia de las funciones metabólicas de la célula hospedadora constituye la principal dificultad para el desarrollo de la terapia antiviral. Conseguir el bloqueo de la actividad viral sin lesionar el metabolismo celular no es un problema de fácil solución.
Existen varios cientos de virus diferentes capaces de infectar a los humanos. Puesto que muchos de ellos se han descubierto hace poco tiempo, no se conocen bien sus efectos clínicos. Numerosos virus infectan a las personas sin producir síntomas; a pesar de todo, debido a su amplia prevalencia, a veces universal, crean importantes problemas médicos y de sanidad pública.
Los virus que infectan de modo primario a los humanos se contagian sobre todo a través de las excreciones respiratorias e intestinales. Estos virus se encuentran en todo el mundo, pero su diseminación se ve limitada por la resistencia congénita, la inmunidad proporcionada por vacunas o infecciones previas, las medidas de control sanitario y el empleo profiláctico de fármacos antivíricos.

Principios de Terapéutica y Quimioprofilaxis antiviral
El desarrollo de fármacos contra el VIH ha conducido a una notable expansión de nuevos agentes quimioterapéuticos antivirales. Está claro que la monoterapia conduce a resistencia y pérdida de eficacia como resultado de la enorme carga de virus, la breve semivida del virus y su tendencia a mutar.
_Los Fármacos Antivirales deben poseer un elevado grado de Selectividad.
_Su evaluación farmacodinámica “in vitro” o sobre modelos experimentales es compleja.
_La información sobre sus características farmacocinéticas es a menudo escasa.
_Su eficacia (y a veces su toxicidad) están relacionadas con la competencia inmunológica del paciente.
_Su actividad es restringida al actuar sobre un “órgano diana” muy específico.
_Desarrollo de Resistencias.
_La mayoría solo son eficaces durante la fase de Replicación viral y no sobre los virus Latentes.
_La utilización óptima de los antivirales precisa de la realización de un diagnóstico clínico correcto.
Clasificación de los Antivirales
Agentes Antivirales ( NO RETROVIRALES)
Agentes contra
Agentes contra influenza
Otros Agentes antivirales
Existen dos tipos de virus del herpes simple (VHS) el VHS-1 y el VHS-2. El VHS-1 causa habitualmente herpes labial, estomatitis herpética y queratitis; el VHS-2 suele producir herpes genital, es transmitido sobre todo por contacto directo (habitualmente sexual), y conduce a lesiones cutáneas. Muchas veces no se conoce el momento en el que se produjo la infección inicial por VHS. Después de la erupción inicial, el virus permanece latente en los ganglios nerviosos. Se pueden producir erupciones herpéticas recurrentes precipitadas por exposición excesiva a la luz solar, enfermedad febril, sobrecarga emocional o física, o inmunosupresión. Muchas veces, se desconoce el estímulo desencadenante. La enfermedad recurrente es en general menos intensa que la primaria.
La actuación quimioterapéutica puede ocurrir antes o en el momento de la adherencia de la partícula vírica a las membranas de las células huéspedes, durante la pérdida de la cubierta de los ácidos nucleicos víricos, mediante inhibición de un factor o receptor celular necesario para la replicación de virus o por bloqueo de enzimas y proteínas específicas codificadas por el virus en las células del huésped, esenciales para la replicación vírica pero no para el metabolismo de la célula huésped normal.
Agentes contra herpesvirus
Aciclovir Idoxuridine
Cidofovir Penciclovir
Foscarnet Trifluridine
Fomivirsen Valaciclovir
Ganciclovir Valganciclovir
Famciclovir
Aciclovir
El aciclovir (acicloguanosina, 9-[2-hidroxietoximetil]-guanina), tiene una potente acción antiviral frente a muchos Herpesvirus, Es especialmente activo frente al virus del herpes simple (VHS) de los tipos 1 y 2 (CI50 0,1-1,6 µM) y el virus de la varicela zoster (VVZ). Su acción antiviral se manifiesta únicamente en virus en fase de replicación.
La administración tópica oftálmica puede producir ocasionalmente queratopatía punctata superficial, quemadura y escozor local, aunque generalmente es bien tolerada. Las cremas tópicas alguna vez se han asociado a sensación de quemadura, prurito y eritema, muy raramente dermatitis alérgica de contacto. La tolerancia por vía oral es muy buena, pero en menos del 5 % de los pacientes se han descrito náuseas, vómitos, afectación renal y la neurotoxicidad son las reacciones adversas más importantes con el uso intravenoso
Ganciclovir
Su actividad frente a CMV es de
Es un antivírico de amplio espectro frente a los virus de la familia Herpesviridae. Es activo frente a VHS-1, VHS-2 , CMV, VVZ, VEB y VHH-6.
Como cualquier antivírico análogo de los nucleósidos, penetra por difusión pasiva en el interior de la célula diana y debe ser fosforilado hasta su forma activa, el ganciclovir- trifosfato . En el caso de los virus VHS y VVZ, la primera fosforilación se cataliza por la enzima viral timidín-cinasa (como el aciclovir) de la que no dispone el CMV. La depresión medular es el efecto adverso más importante.
La toxicidad del ganciclovir restringe su utilización a procesos con morbimortalidad importante, por lo que no se considera indicado, normalmente, en infecciones por Herpesvirus en personas inmunocompetentes. La infección por CMV en inmunodeprimidos, tanto el tratamiento como su profilaxis, es su principal indicación.
Idoxuridina
La idoxuridina (IDU o yododesoxiuridina) es también un análogo halogenado de la timidina, activo frente a la mayor parte de Herpesvirus y Poxvirus. Aunque fue el primer agente antiviral aprobado para uso clínico, es uno de los fármacos con menor índice terapéutico (< 2) lo que, unido a su inaceptable toxicidad y a la desventaja respecto a la trifluridina (menos soluble, menos eficaz y más tóxica), ha relegado su uso. Como efectos adversos se han descrito conjuntivitis, edema palpebral, dolor, fotofobia, oclusión del conducto lacrimal y lesión corneal en uso prolongado.
Foscarnet.
Es un antiviral de amplio espectro tanto para virus del ADN como del ARN. Tiene actividad frente a los virus herpéticos (VHS-1, VHS-2, VVZ, CMV, VEB, VHH-6), VIH-1, VIH-2, otros retrovirus, virus de la hepatitis B y virus de la influenza. Además es activo frente a CMV resistentes al ganciclovir y frente a VHS resistentes al aciclovir. A diferencia del ganciclovir, aciclovir y zidovudina, no requiere fosforilación intracelular por enzimas virales o celulares para ser activo. La absorción oral es escasa, por lo que únicamente se administra por vía parenteral
El principal efecto secundario es la nefrotoxicidad con aparición de necrosis tubular aguda.
Agentes Anti-influenza
Amantadina
Oseltamivir
Rimantadina
Zanamivir
Amantadina
La amantadina con una actividad selectiva frente al virus influenza de tipo A; no es activa frente al tipo B ni frente a los parainfluenza.
Su mecanismo de acción no ha sido aclarado. Al parecer no tiene efecto sobre la fijación del virus ni sobre su capacidad de penetración en la célula. Se absorbe bien oralmente (85-95 %), no se metaboliza y se excreta lentamente por orina en el 90 % (filtrado glomerular y secreción tubular). Los efectos adversos suelen aparecer en las primeras 48 horas y son menos frecuentes si se fracciona la dosis en dos tomas diarias. En el 5-10 % puede aparecer toxicidad neurológica (dificultad de concentración, confusión, ansiedad, insomnio, temblores, depresión y, excepcionalmente, alucinaciones). Su única indicación es la profilaxis y tratamiento de la infección por virus influenza de tipo A.
La dosis debe reducirse en los niños y en los mayores de 65 años.
Rimantadina.
Sólo es activa frente al virus de la influenza de tipo A, sobre el que tiene una eficacia similar, pero menor potencial tóxico.
El mecanismo de acción es similar al de la amantadina. A diferencia de ésta, se metaboliza en el hígado y sólo se elimina por orina entre el 10 y el 25 %, como fármaco inalterado. Su semivida plasmática es el doble de la de la amantadina (1-1,5 días). En caso de insuficiencia renal debería ajustarse su dosificación, así como en el caso de disfunción hepática grave.
Se tolera bastante bien y los efectos adversos son similares a los de la amantadina, aunque menos frecuentes y más suaves. Está contraindicadaen caso de hipersensibilidad a la amantadina. Las indicaciones son las mismas que para la amantadina aunque se prefiere la rimantadina en personas mayores por su menor toxicidad.
Adefovir dipivoxil
Interferón-alfa
Lamivudine
Interferon alfa pegilado
En la actualidad, con el empleo de técnicas de cultivo celular y de ingeniería genética, se pueden obtener para su uso en la práctica clínica
Interferón a. Denominado también interferón leucocitario o linfoblastoide, es producido por diversas células entre las que destacan los monocitos/macrófagos, linfocitos nulos y linfocitos B, en respuesta a virus y otros estímulos antigénicos.
No tienen una acción antiviral directa, actúan provocando en la célula hospedadora la elaboración de proteínas con actividad antiviral con lo que, de forma indirecta, inhiben la replicación viral.
Estos interferones no tienen biodisponibilidad oral y se administran fundamentalmente por vía IM o SC.
Durante el tratamiento, los efectos adversos son muy frecuentes (70-90 %). Su gravedad se relaciona con las dosis empleadas
En más del 75 % de los pacientes aparece un síndrome «gripal» que comienza a las 2-6 horas de la administración y persiste durante 6-12 horas,
La principal indicación actual de este tipo de interferón la constituye el tratamiento de las hepatitis crónicas virales por VHB, VHC y VHD.
El interferón a es eficaz administrado dentro de la lesión (1 millón U en cada lesión, 3 veces por semana durante 3 semanas), en el tratamiento de los condilomas acuminados refractarios a otros tratamientos. También se utiliza por vía sistémica en la papilomatosis laríngea juvenil.
En ambos procesos, asociados a papilomavirus, las recurrencias son altas al cesar el tratamiento.
Ribavirina
Imiquimod
Ribavirina
La ribavirina in vitro se muestra activo frente a virus del ADN y del ARN. Inhibe la replicación de virus, como el respiratorio sincitial (VRS), influenza A y B, parainfluenza, adenovirus y de algunos togavirus (rubéola), bunyavirus (Hantavirus) y arenavirus (fiebre de Lassa). También tiene acción in vitro sobre los virus de las hepatitis B y C, VHS e incluso VIH.
Su mecanismo de acción todavía no está bien establecido; probablemente varíe según el tipo de virus. Utiliza las enzimas celulares para fosforilarse en el interior de la célula.
Tiene buena absorción oral (biodisponibilidad del 35- 50 %). La administración oral y en aerosol provocan concentraciones séricas similares, mientras que por vía intravenosa son 10 veces superiores. En forma de aerosol, se concentra bien en las secreciones bronquiales
En la actualidad se usa en forma de aerosol en el tratamiento de las infecciones por VRS en niños (bronquiolitis y neumonías), especialmente en aquellos con especial riesgo (inmunodeprimidos, enfermedad pulmonar o cardíaca subyacente) o en situaciones graves (PO2 < 65 mmHg, ventilación mecánica, etc.). También ha mostrado eficacia, por vía inhalatoria, en el tratamiento de la infección por virus influenza A y B siempre que se inicie en las primeras 24 horas.
Clasificación de los Agentes Antirretrovirales
Inhibidores nucleósidos de
Inhibidores no nucleósidos de
Inhibidores de las proteasas.
Inhibidores de las integrasas
Inhibidores nucleósidos de
Zidovudina, Abacavir, Didanosina, Estavudina, Lamivudina y Zalcitabina.
Inhibidores no nucleósidos de
Efavirenz, Nevirapina y Delavirdina.
Inhibidores de las proteasas.
Indinavir, Amprenavir, Nelfinavir, Ritonavir, , Saquinavir, Fosamprenavir, Atazanavir.
Inhibidores nucleósidos de
Zidovudina, Abacavir, Didanosina, Estavudina, Lamivudina, Zalcitabina.
Zidovudina (AZT).
La zidovudina fue el primer agente antiviral que mostró efectos clínicos beneficiosos sobre la infección por VIH.. Es activa frente al VIH-1, VIH-2, HTLV-I, lentivirus animales y retrovirus humanos. Se absorbe bien por vía digestiva con una biodisponibilidad del 65-70 % tras una dosis oral . La absorción gástrica aumenta con el estómago vacío; así, una comida rica en grasas puede disminuir al 50 % sus niveles séricos. Se metaboliza en el hígado por glucuronidación en el 75 % y los metabolitos se eliminan por orina.
La toxicidad más importante de
Didanosina
La didanosina, aprobado para el tratamiento de la infección por VIH en
Sus principales efectos adversos son la afectación pancreática y la neurotoxicidad. No tiene toxicidad hematológica.
Zalcitabina
La zalcitabina tiene una potencia intrínseca superior a
Es activa frente al VIH-1 y al VIH-2, incluyendo cepas resistentes a
Efavirenz
Nevirapina
Delavirdina
Estos fármacos se unen directamente a la enzima transcriptasa inversa en lugares distintos del sitio de unión de los nucleósidos. En general, los virus desarrollan resistencia a estos fármacos con rapidez, por lo que no se deben usar como monoterapia salvo en casos específicos.
La nevirapina se une directamente a la transcriptasa inversa vírica y bloquea la actividad ADN polimerasa dependiente tanto del ARN como del ADN al alterar el sitio catalítico de la enzima. La monoterapia conduce a un rápido desarrollo de resistencia. En pacientes con enfermedad por VIH moderadamente avanzada que no han recibido antes tratamiento antivírico, la combinación de nevirapina, ZDV y ddI es más eficaz que
La delavirdina inhibe el VIH-1 mediante unión directa a la transcriptasa inversa y bloqueo de las actividades ADN polimerasa dependientes del ARN y del ADN. La administración en forma de monoterapia conduce al rápido desarrollo de resistencia, y es posible la resistencia cruzada frente a otros inhibidores no nucleósidos de la transcriptasa inversa. La administración conjunta de delavirdina y ciertos antihistamínicos no sedantes, hipnóticos sedantes, antiarrítmicos, bloqueantes del canal del calcio, ergotamínicos, anfetaminas y cisapride puede conducir a efectos adversos en potencia graves o letales, lo que requiere el empleo de fármacos alternativos.
Inhibidores de las proteasas
Indinavir
Amprenavir
Nelfinavir
Ritonavir
Saquinavir
Atazanavir
La proteasa del VIH desempeña un papel importante en su ciclo replicativo. A partir del ARN viral se forman las poliproteínas o precursores proteicos gag y gag-pol, derivados de la traducción de dichos genes.
Saquinavir encaja en los puntos activos de las proteasas VIH-1 y VIH-2 y actúa, in vitro, como un inhibidor reversible y selectivo con una afinidad por las proteasas humanas cerca de 50.000 veces más baja.
Posee una escasa biodisponibilidad oral (4 %) que mejora por la existencia de alimentos, especialmente con alto contenido en grasas. Presenta un alto grado de unión a proteínas (98 %) y se difunde extensamente en los tejidos. Las concentraciones que alcanza en LCR son muy bajas y no se dispone de datos precisos sobre el paso de la barrera placentaria. Se metaboliza fundamentalmente en el hígado a través del sistema del citocromo P-450 Sufre metabolismo de primer paso, se eliminan por heces (88 %) y mínimamente por la orina. Es un fármaco muy bien tolerado.
Ritonavir
Se trata de otro de los inhibidores de la proteasa ya comercializados, diseñados también como peptidomimético y competitivos que se fija al lugar activo de la proteasa del VIH. Posee mejor biodisponibilidad oral (60-70 %) y se une en proporción elevada a proteínas (98 %). Se distribuye bien al tejido linfoide, pero atraviesa mal la barrera hematoencefálica. En su metabolismo interviene el citocromo P-450 se elimina en las heces (86 %), en parte de forma inalterada (34 %) y sólo el 11 % por orina.
Indinavir
Potente inhibidor de la proteasa, en terapia combinada logra descensos mantenidos del ARN viral plasmático por encima de los 2 logs.
Muestra mayor selectividad por la proteasa del VIH-1 que por la del VIH-2. Se absorbe bien por vía oral (biodisponibilidad superior al 30 %) y los alimentos disminuyen su absorción. Tiene menor unión a proteínas plasmáticas, metabolismo hepático (CYP3A4) y una eliminación renal de menos del 20 %.
Inhibidores de
GEM91
GPS0193
La doble cadena de ADN viral, formado en el citoplasma celular por la acción de
Bibliografía
1- Malgor - Valsecia. Farmacología General.
3- Flores J. Farmacología Humana.2004, Masson.
4- Goodman y Gilman. Las Bases Farmacológicas de la terapéutica, Oncena Edición, 2006.
5- Rang HP, Dale. Pharmacology. 4ta edic, 1999.
6- Formulario OMS, 1994.
7- Formulario Nacional de Medicamentos. Editorial Ciencias Médicas. 2006
8- Mark H. Beers, M.D., Y Robert Berkow, M.D. El Manual Merck de Diagnóstico y Tratamiento. Décima Edición.
Autores:
1- Dr. Marco J. Albert Cabrera.
Master en Ciencias. Especialista de Primer y Segundo Grados en Medicina Interna Profesor Auxiliar del ISCM-Habana
2- Dra. Lina Martínez Acosta.
Especialista de 1er Grado en Medicina General Integral. Profesor Instructor del ISCMH.
3- Dra. Sirsi Guilarte Díaz.
Especialista de 1er Grado en Medicina General Integral. Profesor Instructor del ISCMH.
4- Lic. Arelys Reyes Expósito.
Licenciada en Ciencias Farmacéuticas. Profesor Instructor del ISCMH.
Instituto Superior de Ciencias Médicas de la Habana.
Facultad de Ciencias Médicas Comandante Manuel Fajardo.
Policlínico Universitario Vedado (15 y 18).