Se trata de un heterogéneo grupo de síndromes clínicos, anatomopatológicos, imagenológicos y genéticos que tienen en común la existencia de quistes en ambos riñones y que constituyen cerca del 12 % de los casos de insuficiencia renal terminal.
Las enfermedades renales quísticas pueden presentarse esporádicamente como una anormalidad del desarrollo o pueden ser adquiridas en la vida del adulto, pero la mayoría de las formas son hereditarias.
Dr. Borgatello, Carlos José, Dra. Borgatello, Carolina Mariana
Se trata de un heterogéneo grupo de síndromes clínicos (2), anatomopatológicos, imagenológicos y genéticos que tienen en común la existencia de quistes en ambos riñones y que constituyen cerca del 12 % de los casos de insuficiencia renal terminal.
Las enfermedades renales quísticas pueden presentarse esporádicamente como una anormalidad del desarrollo o pueden ser adquiridas en la vida del adulto, pero la mayoría de las formas son hereditarias.
Entre las formas adquiridas, los quistes simples pueden desarrollarse en los riñones como consecuencia del envejecimiento, diálisis, drogas, hormonas, etc.
Los quistes renales múltiples son a menudo una manifestación secundaria de síndromes proliferativos genéticos.
Las enfermedades renales quísticas hereditarias que son por mutación embrionaria de genes simples, se heredan como rasgos mendelianos, e incluyen la enfermedad renal poliquística autonómica recesiva (PQRAR) y autonómica dominante (PQRAD), nefronoptisis y enfermedad quística medular.
La edad de inicio, la severidad de los síntomas y los grados de progresión al fallo renal Terminal varían ampliamente en este grupo de enfermedades.
Las enfermedades renales quísticas (3) mas frecuentes son:
Displasia renal
• Displasia renal multiquística
Enfermedad renal poliquística
• Autosómica recesiva (tipo infantil)
• Autosómica dominante (tipo adulto)
Quistes renales asociados a síndromes hereditarios
Enfermedad renal quística medular juvenil
• Nefronoptisis juvenil
Riñón con médula en esponja
Enfermedad renal Quística adquirida
Enfermedades sistémicas asociadas con Quistes renales
Síndrome de Von Hippel-Lindeau
Esclerosis tuberosa
Quistes renales simples
DISPLASIAS RENALES
Son una diferenciación anormal del tejido metanéfrico junto con la desestructuración renal de varios grados. Su diagnóstico es histológico (4) y se caracteriza por la presencia de túbulos primarios, rodeados de anillos fibromusculares en los que se aprecia cartílago. También hay glomérulos primarios y se observan quistes.
Pueden ser unilaterales o bilaterales, segmentarias o difusas, y asociarse o no con malformaciones urológicas. Los riñones son sólidos o quísticos, grandes o pequeños, con forma renal conservada o no. Desde el punto de vista histológico se caracteriza por las anomalías descriptas. Los túbulos colectores tienen un epitelio columnar indiferenciado.
Displasia Obstructiva
La obstrucción urológica causa con frecuencia displasia renal. Se observan quistes de la zona periférica de la corteza renal donde las pirámides están mal diferenciadas. Si la obstrucción es bilateral la displasia también y, si es unilateral solo afecta a ese lado. También hay formas segmentarias. La clínica es la infección y el tratamiento que se aplica es la desobstrucción.
Displasia Multiquística
Es la causa mas común (5) de presencia de una masa abdominal en el recién nacido y también la mas común malformación quística de la infancia. Es una forma de displasia renal caracterizada por la presencia de múltiples quistes de tamaño variado en el riñón (Fig. 1) y la ausencia de un sistema pielocalicial normal. Se asocia con atresia ureteral o ureteropelvica, con alteración de la función renal.
Embriología: el blastema metanéfrico forma los componentes del nefrón desde los glomérulos hasta el túbulo contorneado distal. Los brotes ureterales surgen desde los conductos Wolffianos y forman los componentes distales del nefrón, incluyendo los túbulos colectores, los cálices y la pelvis. El blastema metanéfrico es generalmente aceptado para diferenciarse dentro del parénquima renal bajo la influencia de una ampolla del brote ureteral.
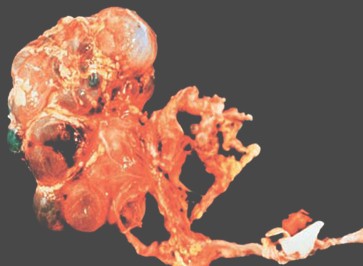
Fig. 1 Displasia renal quística unilateral. Esta imagen muestra un riñón quisticamente alterado con múltiples quistes. Se evidencia obstrucción del uréter. El uréter distal está dilatado sugiriendo también una obstrucción.
La Displasia Multiquística (MCDK) resulta de una inducción anormal del blastema metanéfrico por el brote ureteral. Esta inducción anormal podría ser debida a un problema con la formación del ducto metanéfrico, malformación del brote ureteral o degeneración del ducto ureteral en estadio temprano.
El brote ureteral comienza su división ampollar en las primeras 8 a 10 semanas de vida fetal. La MCDK resulta cuando pocas porciones terminales de las pequeñas divisiones aumentan. La estructura final del riñón depende en el tiempo de la injuria del brote ureteral y del defecto de la injuria en la división de la ampolla (Fig. 2).
Etiología: La MCDK usualmente se desarrolla como un problema esporádico. La existencia de condiciones mendelianas y cromosómicas y la exposición a teratogénicos son señaladas como causas. Se lo destacó como parte de un síndrome renal displásico hereditario. La herencia autosómica dominante fue descripta en un niño cuya madre y tía materna tenían agenesia unilateral renal y un primo materno tenía obstrucción de la unión ureteropelvica; también se informó en una madre y sus dos hijos y fue descripta en mellizos. Es una de las malformaciones urinarias que se presenta en chicos nacidos de madres que ingirieron cocaína durante el embarazo.

Fig. 2. Displasia Multiquística. El corte muestra obstrucción de la unión de la pelvis uretral con dilatación de la pelvis y muchos quistes relacionados con la corteza residual. (Cistyc diseases of the kidney – Brenner et al.)
Evolución: los quistes podrían persistir sin ningún cambio, tener aumento de tamaño o involucionar espontáneamente. En los adultos podrían calcificarse.
Muchos casos de MCDK unilateral tuvieron involución espontánea, con reabsorción del líquido de los quistes.
En algunos casos de MCDK diagnosticada prenatalmente, el seguimiento hasta el nacimiento demostró un aumento inicial del tamaño, seguido por involución.
Muchos casos son diagnosticados por ecografía fetal a las 15 semanas de gestación. Previo a la ecografía, una masa abdominal en el costado de un recién nacido sano fue la presentación mas común de MCDK unilateral. En el diagnóstico prenatal de MCDK, el riñón anormal se palpa en 13-22 % de los pacientes. La masa usualmente es móvil, redondeada, de forma irregular, no dolorosa y que podría transiluminar (Fig. 3).
Usualmente son asintomáticos y pueden ser detectados en la adolescencia. El dolor abdominal o del flanco y el distrés respiratorio no son comunes, porque son por el efecto de la compresión del riñón anormal.
MCDK bilateral se encontró en recién nacidos muerto o fallecido en los primeros días de vida, siendo asociada con oligohidramnios, amnium nodosum, hipoplasia pulmonar y cara de Potter
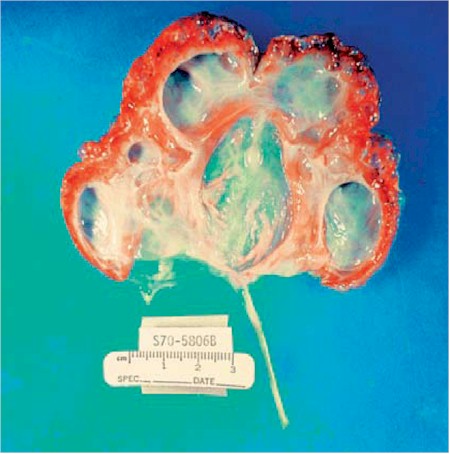
Fig. 3. Displasia Renal. Intersticio inmaduro mesenquimatoso. Los quistes de variados tamaños están distribuidos al azar en todo el riñón. Los glomérulos están vistos diseminados en el intersticio. (H&E, 200). (Cistyc diseases of the kidney-Brenner et al.)
Causas: MCDK ha sido reportado en varios síndromes, incluidos los siguientes:
*Síndrome 49, XXXXX: los pacientes con este síndrome se presentan con hipertelorismo, epicanto doblado, microcefalia, cuello corto, clinodactilia del quinto dedo, manos y pies pequeños y retraso mental.
*Síndrome de Beckmith-Wiedemann: se manifiestan con macrosomía, microcefalia, macroglosia, visceromegalia, onfalocele e hipoglucemia.
*Síndrome Branquio-oto-renal: es una condición autosómica dominante; usualmente los pacientes presentan pérdida de la audición, malformación de las orejas incluidos los pozos auriculares, fístulas partidas de las branquias o quistes y agenesia o displasia renal (esta última es más común).
*Síndrome de Joubert: es una condición autosómica recesiva caracterizada por la hipoplasia de la vermis cerebelosa, hipotonía y desarrollo psicomotor dañado y patrón respiratorio anormal.
*Trisomía 18: los pacientes tienen el occipital prominente, micrognatia, baja implantación de las orejas, deformidad en flexión de los dedos, enfermedad cardiaca congénita y retraso mental.
*Asociación de VACTERL: es la combinación de defectos vertebrales (V), atresia del ano (A), defectos cardiovasculares (C), fístula traqueo-esofágica (TE), anomalías renales ® y defecto límbico (L).
*Síndrome de Waardenburg tipo 1: los pacientes tienen anomalía del desarrollo de los párpados, de las cejas y de la raíz de la nariz; defectos de pigmentación del iris y de los pelos y sordera congénita.
*Síndrome de Williams: este síndrome se caracteriza por presentar la cara pequeña y delicada, retraso mental, estenosis supravalvular aórtica e hipercalcemia neonatal.
*Las malformaciones no renales reportadas en pacientes con MCDK son:
º Gastrointestinales
• Atresia duodenal
• Atresia esofágica
• Enfermedad de Hirschsprung
• Ano imperforado
• Hernia inguinal
• Onfalocele
• Fístula traqueoesofágica
º Neurológicas
• Anencefalia
• Agenesia caudal
• Síndrome de regresión caudal
• Sordera congénita
• Hidrocefalia
• Retraso mental
• Microcefalia
• Microftalmia
• Mielomeningocele
• Espina bífida
° Cardiovasculares
• Estenosis aórtica
• Coartación de la aorta
• Ductus arterial evidente
• Estenosis pulmonar
• Tronco arterioso
• Defecto del septum ventricular
º Musculoesqueléticas
• Clinodactilia del quinto dedo
• Luxación congénita de la cadera
• Deformidades en flexión de los dedos
• Sindactilia
• Equinovarus
° Misceláneas
• Útero bipartito
• Paladar hendido
• Epicanto doblado
• Atresia del himen
• Hipertelorismo
• Baja implantación de las orejas
• Macroglosia
• Macrosomía
• Micrognatia
• Defecto de pigmentación del iris y de los cabellos
• Agujero preauricular
• Cuello corto
° Malformaciones urinarias asociadas con MCDK:
• Divertículos de la pared vesical
• Agenesia renal
• Displasia
• Hipoplasia
• Displasia quística de los testículos
• Riñón ectópico
• Displasia fibromuscular
• Riñón en herradura
• Persistencia del uraco
• Anomalías de la vesícula seminal
• Ureterocele
• Reflujo vesicoureteral
• Obstrucción urinaria.
Estudio por imágenes: La ecografía renal es el recomendado para el diagnóstico preliminar; revela al riñón que contiene múltiples quistes de tamaño variado, que están ordenados al azar y separados por parénquima pequeño o no ecogénico. No se identifica la pelvis renal.
El scanning renal con ácido dimercaptosucccínico podría ser necesario si la ecografía no revela la figura clásica de MCDK, porque demuestra ausencia de función renal en los riñones quísticos.
Cuando la ultrasonografía revela un sistema pielocalicial o un quiste central dominante, severa obstrucción urinaria y displasia secundaria a la obstrucción podría ser difícil diferenciarlo; en esos casos es importante en el scanning renal, utilizar Tecnesio 99 con lavado de furosemida.
En casos de severa hidronefrosis, podría ser observado un borde periférico de actividad, seguido por una notable excreción en las imágenes retardadas.
Estas sólo demuestran retención del tecnesio en el sistema pielocalicial con estrechez, aún en el lavado con furosemida.
Con displasia renal secundaria a la obstrucción, los grados de disminución de la función renal son variables.
Frecuencia: la incidencia reportada de MCDK unilateral resultó ser de 1 en 4300 nacidos vivos y la bilateral de 1 en 3600 nacidos vivos. El riñón izquierdo se afectó en 55 % de los casos y el riñón derecho en 45 %. La bilateral ocurre en cerca del 20 % de casos de diagnóstico prenatal de MCDK.
La mortalidad en niños ha sido reportada a los tres meses de edad y la incidencia reveló una relación masculino/femenino de 1,48 a 1.
Displasia Aplásica
Es una falta de desarrollo normal pielocalicial (fig. 4); la organización lobular está alterada. En la multiquística, el riñón es muy grande y está distorsionado por los quistes. En la aplásica es pequeño y sólido. Ambos tipos son afuncionantes, con atresia pieloureteral o ausencia de uréter. Pueden ser unilaterales o bilaterales. El diagnóstico es ecográfico. La clínica es de masa abdominal, con dolor, y raramente, hipertensión arterial. La nefrectomía, hasta hace algunos años considerada el tratamiento de elección, ya no se considera tan necesaria.
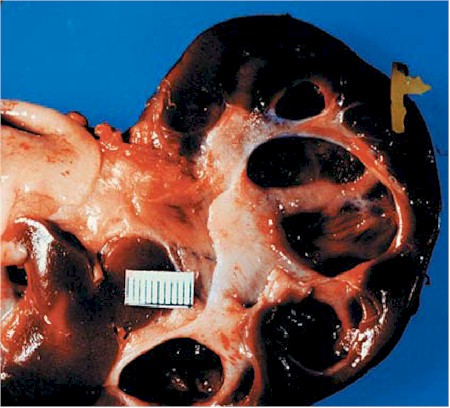
Fig. 4. Enfermedad quística medular (MCD). El corte está conservado y la medulla aparece un tanto apagada. Los quistes están presentes en la unión de la corteza y la medula y en este ejemplo miden encima de 4 cm. de diámetro (5). (Cistyc diseases of the kidney-Brenner et al.)
Displasia Difusa
No se asocia a obstrucción. Los riñones son grandes y esponjosos (Fig.4). La causa es un desarrollo medular deficiente, con elementos ductales dilatados que constituyen los quistes. En los recién nacidos provocan compresión pulmonar y pueden cursar con insuficiencia renal precoz. Por lo general se asocia a síndromes malformativos.
ENFERMEDAD RENAL POLIQUÍSTICA
Enfermedad Renal Poliquística Autosómica Recesiva
Es un trastorno del desarrollo embrionario en la ramificación del sistema tubular del riñón y de los conductos biliares del hígado. Se considera (6) la enfermedad quística renal más frecuente en la edad pediátrica; la incidencia aproximada es de 1/6.000-1/55.000.
Está causada por un defecto genético diferente de la PQRAD. Los padres que no tienen poliquistosis renal, pueden tener un niño con la enfermedad si ambos padres llevan el gen anormal y ambos transfieren el gen a su hijo. La posibilidad de que esto ocurra es de uno a cuatro. Si solo uno de los padres lleva el gen anormal, el niño no podrá tener la enfermedad.
Genética: su carácter de enfermedad autosómica recesiva implica que los padres no están afectados, pero tienen un 25 % de posibilidades de transmitir la enfermedad. Recientemente (5) se ha localizado un gen para esta enfermedad en el brazo corto del cromosoma 6 (región 6p21); no se ha observado hasta el momento heterogeneidad genética.
Biología celular: el tamaño de los quistes es más pequeño que en PQRAD; son derivados desde los túbulos colectores y mantienen contacto con sus nefrones de origen.
Anatomía patológica: se constata un mayor tamaño de los riñones (7) y conservación de la estructura general. Debajo de la cápsula se visualizan múltiples microquistes distribuídos irregularmente. El hígado, también de mayor tamaño, se muestra duro y de superficie lisa. Microscópicamente aparecen dilataciones quísticas recubiertas por un epitelio aplanado. Las lesiones hepáticas son de fibrosis congénita y fibroadenomatosis de las vías biliares.
Modalidades de presentación clínica: Los síntomas de la PQRAR pueden comenzar antes del nacimiento. Los niños con los peores casos mueren a las pocas horas o días de su nacimiento.
La enfermedad afecta el hígado, bazo y páncreas (Fig. 5), y además presenta anemia, venas varicosas y hemorroides. Porque la función renal está disminuida y es crucial para el desarrollo físico temprano, los niños con PQRAR son mas pequeños que la talla normal.
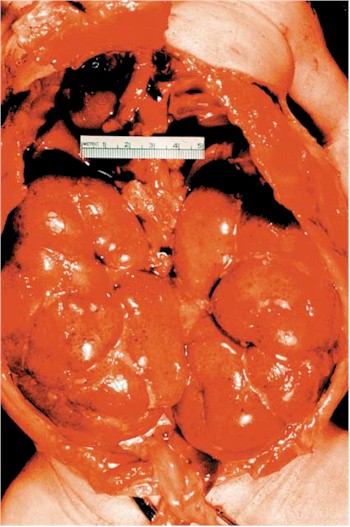
Fig. 5. Poliquistosis renal autosómica recesiva (PQRAR). Los riñones están mostrando in situ que ocupan casi la cavidad abdominal completa de un niño recién nacido. Cistyc diseases of the kidney-Brenner et al.
Modalidades de presentación clínica: Los síntomas de la PQRAR pueden comenzar antes del nacimiento. Los niños con los peores casos mueren a las pocas horas o días de su nacimiento.
La enfermedad afecta el hígado, bazo y páncreas, y además presenta anemia, venas varicosas y hemorroides. Porque la función renal está disminuida (fig. 6) y es crucial para el desarrollo físico temprano, los niños con PQRAR son más pequeños que la talla normal.
La enfermedad renal poliquística autosómica recesiva (PQRAR) se manifiesta clínicamente a cualquier edad (8), suele hacerlo en fases tempranas de la vida (forma perinatal), durante la infancia (forma infantil) o en el transcurso de la adolescencia (forma juvenil). La clínica inicial (9) depende de la edad. Así, en el período de recién nacido aparece como una gran masa abdominal y distrés respiratorio importante. Aunque la insuficiencia renal no es frecuente en esta etapa de la vida, ya se observa hipertensión portal. A partir del primer año (Fig. 7) , la nefromegalia y los signos clínicos de fibrosis hepática se constatan en uno de cada dos pacientes, hipertensión arterial en el 70 % e infección urinaria en el 30 %. Uno de cada cuatro enfermos presenta retraso del crecimiento.
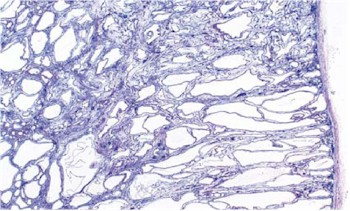
Fig. 6. PQRAR. El examen microscópico muestra los quistes que están agrandando las estructuras tubulares, que llegan de la superficie cortical y se extienden dentro de la medula (H&E, 200).
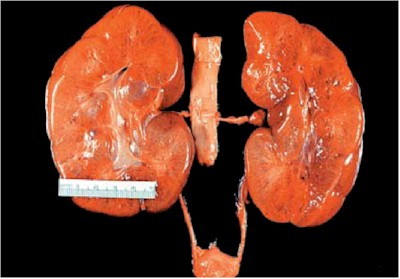
Fig. 7. PQRAR. Corte de la superficie de los riñones que muestra en ambos que la corteza y la médula están completamente reemplazados por una apariencia como esponja. Cistyc diseases of the kidney-Brenner et al.
Diagnóstico: se establece mediante técnicas de imagen, sobre todo la ecografía. En fetos y en recién nacidos permite detectar los quistes renales que no pueden diferenciarse entre PQRAD y PQRAR. También permite detectar la fibrosis hepática en los sujetos afectados y confirmar la normalidad de los progenitores. En situaciones especiales está indicada la biopsia renal y/o hepática. A pesar de ello, el diagnóstico diferencial durante la infancia entre la PQRAD y la PQRAR es muy difícil y sólo el estudio genético molecular es definitivo a este respecto.
Pronóstico: se ha establecido una supervivencia global a los 15 años del 46 %, que alcanza al 79 % si se tienen en cuenta exclusivamente los enfermos que superan el primer año de vida.
Tratamiento: depende de la secuencia de las complicaciones y la insuficiencia renal. El trasplante, una vez instaurada la insuficiencia renal terminal, es el tratamiento de elección.
Enfermedad Renal Poliquística Autosómica Dominante
La enfermedad renal poliquística autosómica dominante (PQRAD) (10) es una enfermedad multiorgánica que se caracteriza por un progresivo crecimiento y desarrollo de los quistes renales que destruyen el parénquima funcional y conducen a la insuficiencia renal crónica terminal a los 40–50 años (Fig. 8).
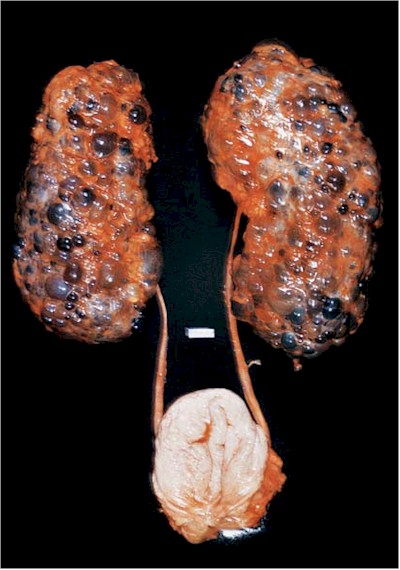
Fig. 8 - Enfermedad poliquística de un adulto. Obsérvese la conservación de la forma normal, la configuración esférica de los quistes y los signos de hemorragia en algunos de los quistes. Cistyc diseases of the kidney-Brenner et al.
Es la enfermedad hereditaria más frecuente (58), ya que el uno por mil de la población es portadora del gen mutante. Afecta a 500.000 personas en Estados Unidos (donde el costo de los cuidados médicos supera los 200 millones de dólares al año) y de 4 a 6 millones en el mundo y representa el 10 % de los pacientes en diálisis. Es rara en África y menos común en negros americanos que en blancos, aunque la incidencia de IRC por PQRAD es similar en negros y blancos.
En el momento actual, no existe tratamiento ni posibilidades de prevención del proceso de formación y crecimiento de los quistes. Es la cuarta causa principal de fallo renal.
Los factores de riesgo (11) para la evolución hacia la enfermedad renal progresiva son: edad temprana del diagnóstico, raza, sexo, anomalías genéticas, episodios de hematuria macroscópica, hipertensión, y aumento del tamaño renal.
Los pacientes diagnosticados antes de los 30 años tienen una sobrevida renal media de 10 años menos que aquellos diagnosticados después de los 30 años.
El crecimiento de los quistes (12) es continuo y cuantificable y se asocia con el fallo renal por compresión del parénquima renal adyacente. Un actual trabajo publicado por el Dr. Jared J. Grantham de la Universidad de Kansas, determinó que cuanto mas grande es el volumen de los riñones, se produce un deterioro más rápido de la función renal. La apoptosis (muerte celular programada) en glomérulos no quísticos y células tubulares, podría jugar un rol importante.
La causa incierta de la progresión acelerada de enfermedad renal en hombres se relacionaría con niveles elevados de testosterona.
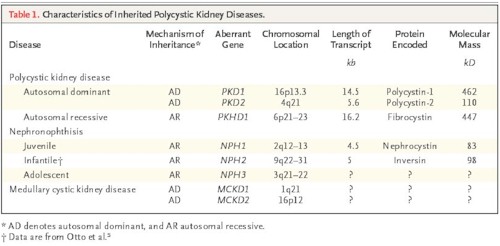
Genética: el estudio de Dalgaard (12) en 1957 aclaró el patrón autosómico dominante de la enfermedad. En 1985 se localizó el gen causante de un brazo corto del cromosoma 16.
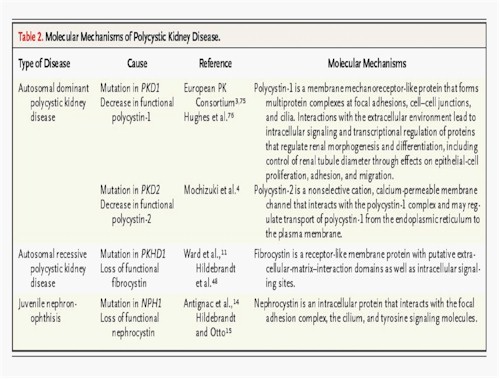
La enfermedad hereditaria se produce por mutaciones en al menos dos genes. En el tipo I, el gen PKD1 localizado en el cromosoma 16 (16p13.3) es responsable de la enfermedad en el 85 % de las familias (13). En el Tipo II, el gen PKD2 localizado en el cromosoma 4 (4q21-23), se considera responsable de ésta en el 10 % de las familias. La enfermedad hereditaria se produce por mutaciones en al menos dos genes (Tabla 2).
Hay una posible tercera forma no hereditaria asociada con trastornos renales de larga data, diálisis o edad avanzada, no ligada al cromosoma 16 ni al 4. Esta heterogeneidad genética tiene una correspondencia fenotípica: la forma PKD1 es mas grave (edad media en diálisis a los 56 años) que la PKD2 (edad media en diálisis a los 71 años) (Tabla 1).
El gen PKD1, de 46 exones, se extiende sobre 52 k.o. de ADN genómico. La proteína PKD1, la poliquistina, parece implicada en interacciones célula-célula y célula-matriz celular.
Los productos proteicos de estos dos genes, Policistina 1 y Policistina 2, se establecen en el epitelio tubular renal. La Policistina 1 es un receptor de membrana capaz de comprometer e interactuar con muchas proteínas, carbohidratos y lípidos y provocar una respuesta celular a través de canales de fosforilación, mientras se pensó que la Policistina 2 actuaría como un canal permeable al calcio.
En el Tipo I, el gen (58) responsable de ésta en el 10 % de las familias. Hay una posible tercera forma no hereditaria asociada con trastornos renales de larga data, diálisis o edad avanzada, no ligada al cromosoma 16 ni al 4. Esta heterogeneidad genética tiene una correspondencia fenotípica: la forma PKD1 es mas grave (edad media en diálisis a los 56 años) que la PKD2 (edad media en diálisis a los 71 años) (Tabla 1).
El gen PKD1, de 46 exones, se extiende sobre 52 k.o. de ADN genómico. La proteína PKD1, la poliquistina, parece implicada en interacciones célula-célula y célula-matriz celular.
Los productos proteicos de estos dos genes, Policistina 1 y Policistina 2, se establecen en el epitelio tubular renal. La Policistina 1 es un receptor de membrana capaz de comprometer e interactuar con muchas proteínas, carbohidratos y lípidos y provocar una respuesta celular a través de canales de fosforilación, mientras se pensó que la Policistina 2 actuaría como un canal permeable al calcio. Los dos tipos de PQRAD tienen características similares, pero el Tipo II tiene un inicio tardío de los síntomas y un menor grado de progresión al fallo renal; así que los pacientes Tipo II tienen una expectativa de vida mas larga (69 años) que aquellos con Tipo I (53 años). Algunos pacientes con con mutaciones en PKD1 y PKD2 tienen un curso clínico más severo que aquellos con mutaciones en uno solo de los genes (Tabla 1).
Biología celular: los cientos de quistes esféricos (14) de varios tamaños en todas las partes de la corteza y de la médula son derivados desde todos los segmentos del nefrón n (Fig. 5). La pared tubular que está alineada con una capa simple de células epiteliales se dilata y luego rápidamente al final se cierra (Fig. 9).
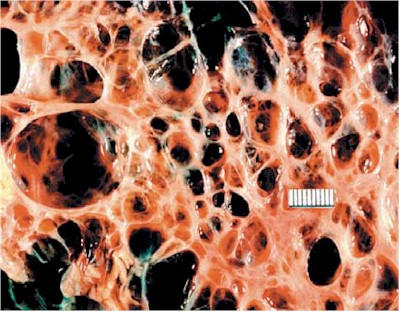
Fig.9. PQRAD. La superficie del corte muestra que los quistes están interpuestos por tejido fibroso. Cistyc diseases of the kidney-Brenner et al.
Proliferación y Apoptosis: un preciso balance controlado entre la proliferación celular y la apoptosis es esencial para el crecimiento normal y la diferenciación del riñón y la estructura renal normal antes del nacimiento. En PQRAR y PQRAD, la apoptosis persiste anormalmente y puede destruir mucho el parénquima renal, permitiendo proliferar al epitelio del quiste.
La importancia de la apoptosis ha sido destacada en las ratas, en quienes la inactivación de los inhibidores de la apoptosis (bcl-2 o AP-2b) causó enfermedad renal quística.
La proliferación de las células del epitelio tubular termina antes del nacimiento, pero la proliferación anormal del epitelio quístico continúa a lo largo de la vida en pacientes con PQRAD (58) (Fig.10).
Sobre todo, el cultivo de células epiteliales de estos pacientes tiene una capacidad intrínseca aumentada para proliferar y sobrevivir. Diversas manipulaciones genéticas que causan proliferación de células epiteliales en ratas solo conducen hacia la enfermedad renal poliquística.
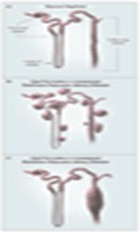
Figura 10. Mecanismos de formación de quistes en PQR.
Los quistes se originan como expansiones del túbulo renal (Panel A). En la PQRAD, los quistes surgen por compresión externa en todo el segmento tubular y rápidamente cierran el nefrón de origen (Panel B). En contraste, en PQRAR, los quistes son derivados de los túbulos colectores, que quedan conectados con el nefrón de origen (Panel C).
El factor de crecimiento epidérmico (EGF) tiene un rol importante en la expansión de los quistes renales. Las células epiteliales de quistes de pacientes con PQRAD y PQRAR no son usualmente susceptibles al estímulo de la proliferación de EGF. Sin embargo, el líquido quístico contiene EGF que es secretado dentro del quiste en una cantidad que puede inducir la proliferación celular.
La sobrecompresión y la posición anormal de los receptores de EGF en la superficie luminar del epitelio quístico adjunto, crean un ciclo sostenido de estimulación hormonal de la proliferación en los quistes (Fig. 2).
Experimentos genéticos en ratas solo han mostrado la importancia de la sobrecompresión de los receptores de EGF en la formación de los quistes renales y este trabajo establece que el desarrollo de inhibidores específicos de EGF-receptor tirosina quinasa podría reducir el número de quistes y prolongar el período de vida de las ratas con enfermedad renal poliquística. Esta clase de inhibidores moleculares pequeños está ahora bajo investigación clínica en fases 1 y 2 en adultos con enfermedad renal poliquística, para determinar si ellos aminoran la expansión de los quistes y disminuyen la función renal.
Los receptores EGF están solo contenidos en las membranas apicales del epitelio de los túbulos colectores en riñones normales de fetos. Por el contrario, los receptores EGF basales en el epitelio de adultos normales son aglomerados de homodímeros, y los son aglomerados de homodímeros, y los receptores EGF apicales consisten en aglomerados de heterodímeros de EGF receptor y erb-b2. La importancia de esta variante de EGF receptor, erb-b2, se destacó por el hecho de la formación de quistes renales en las ratas transgénicas que sobrecomprimen erb-b2 y de que los inhibidores erb-b2 tienen un efecto protector en células in Vitro de pacientes PQRAD. Estas observaciones sugieren que los inhibidores erb-b2 podrían tener valor terapéutico.
Otros factores de crecimiento adicionales, como citoquinas y factores lipídicos, al igual que ATP y AMPc en el líquido quístico, tienen un efecto de proliferación de células epiteliales in Vitro. Estos factores podrían estimular EGF dependiente del crecimiento de los quistes.
Secreción: La reabsorción neta de fluido en el riñón normal es causada por los gradientes de sodio establecidos por la bomba de sodio (NA/K/ATPasa) en las células de las membranas basolateral tubular y por múltiples transportadoras de iones y fluidos y canales en sitios apicales y basolaterales. En los riñones de pacientes con PQR, la bomba NA/K/ATPasa está anormalmente situada en la luz apical de la membrana celular del epitelio tubular y el transportador de NA+, K+ y 2CL- está desplazado a la superficie basal del epitelio.
Otros estudios moleculares de las subunidades alfa y beta del complejo Na/K/ATPasa han mostrado que los riñones normales de adultos contienen complejos alfa 1 beta 1, que están localizados en la región basolateral del túbulo, donde los riñones de pacientes con PQR contienen complejos alfa 1 beta 2 en la membrana apical. En el feto normal, la Na/K/ATPasa está solo compuesta de complejos alfa 1 beta 2 y se establecen en la membrana apical de los túbulos renales. Parece que en PQRAD, un fallo por baja regulación de la transcripción de la isoforma beta 2 después del nacimiento, facilitaría un emplazamiento erróneo de la Na/K/ATPasa en la membrana apical.
La característica adicional del transporte en quistes de la misma familia, incluye la presencia de canales de acuaporina 1 y acuaporina 2 en el epitelio de los quistes y de acuaporina 2 sola en quistes de pacientes con PQRAR. Niveles elevados de ATP liberados por la membrana apical en pacientes con PQRAD podrían favorecer una secreción exacerbada. Los niveles de AMPc intracelular, son también importantes reguladores de la secreción en los quistes y asimismo, de la conductancia transmembrana de la fibrosis quística del regulador de los canales de cloro en la membrana apical del epitelio quístico de pacientes con PQRAD.
Interacciones en la matriz celular: Las anormalidades en la estructura de la membrana basal, la composición de la matriz intersticial, los niveles de metaloproteasas de la matriz y sus inhibidores y la compresión de receptores integrales, ocurren en pacientes con PQR. El engrosamiento de la membrana basal, las alteraciones en la matriz celular y un número anormal de receptores integrales son frecuentes en PQRAD, tanto como en PQRAR y en la Nefronoptisis juvenil. Estas alteraciones causan marcados disturbios funcionales. Por ejemplo, el epitelio de pacientes con PQRAD está más pegado a la matriz formadora de colágeno tipo I o IV, que es del epitelio normal y que ha disminuido su capacidad migratoria contra EGF. Por lo cual, los defectos podrían impedir los movimientos celulares requeridos para la morfogénesis del riñón.
Los experimentos en ratas, han mostrado que la inactivación de varios receptores de adhesión a la matriz y el complejo de adhesión focal asociado con proteínas causa la formación de los quistes.
Polaridad: El nefrón adulto normal es una estructura segmentada alineada por al menos 15 distintos tipos de epitelio altamente polarizado (Fig. 11).
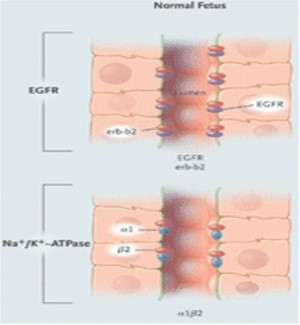
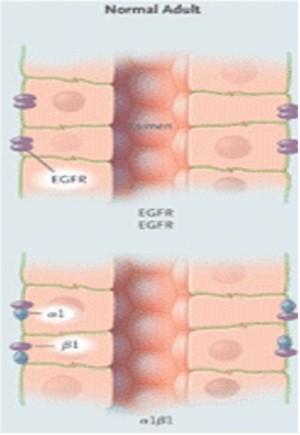
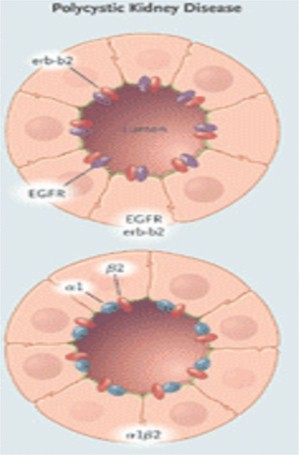
Figura 11. Polarización del Factor Receptor de Crecimiento Epidérmico (EGFR) y Na+/K+–ATPasa en el epitelio de un feto normal, un adulto normal, y un paciente con PQR.
La distribución polarizada de enzimas, iones transportadores, canales, poros, factor de crecimiento y receptores de la matriz, facilitan la función vectorial normal (transporte dirigido) y el control de la división celular, la diferenciación y la maduración. En PQRAD y PQRAR, las alteraciones en la polaridad de las proteínas de la membrana incluyen ubicaciones aberrantes de Na/K/ATPasa, receptores EGF, catepsina B, metaloproteasa 2 de la matriz y caderina E en la membrana basal apical antes que la membrana basolateral. La polarización de las proteínas ocurre durante la maduración de los nefrones en el útero y sigue adelante para significar la interrupción regulada de la compresión genética.
La Policistina 1 tiene defectos en la polaridad y se establece con PQRAD. En el epitelio renal normal, la policistina 1 está confinada a la membrana celular lateral para sitios de adhesión célula-célula y contactos célula-matriz, mientras que en el epitelio del quiste la mayoría de estas proteínas son intracelulares. Los complejos Policistina 1 son encontrados en la interfase célula-matriz, en los contactos célula-célula y en la luz ciliar, donde ellos son pensados para funcionar como sensores del medio extracelular e interactuar con proteínas de la membrana celular y la actina del citoesqueleto tubular, con señales conductoras para significar las cascadas de fosforilación intracelular y regular los genes de transcripción en los núcleos.
Indicadores de transducción: muchas vías con indicadores de transducción han sido implicadas en los procesos etiológicos de PQR. Los productos genéticos PKD1, PKD2 y NPH1 pueden asimismo activar cascadas que regulan la proliferación, la migración y la diferenciación.
La integración de estas vías es esencial para los movimientos celulares de morfogénesis subrayados y la formación y mantenimiento de los túbulos renales con diámetro luminal correcto.
La policistina inicia estas vías a través de interacciones de varias proteínas con complejos de adhesión unidos célula-célula y célula-matriz focal.
La pérdida de la función adhesiva focal en la policistina mutada, resulta del fallo para recuperar la kinasa de adhesión focal en pacientes con PQRAD y en la mutación de la nefrocistina en la nefronoptisis, que causan la formación de quistes. La regulación adicional de la función de la policistina ocurre por influencia de G proteínas, la fosforilación por kinasas séricas o la tirosina kinasa, la defosforilación por la proteína receptora tirosina fosfatasa y el segundo mensajero intracelular de calcio y AMPc.
Los complejos de Policistina 1 son encontrados en la interfase célula-matriz, en los contactos célula-célula y en la luz ciliar, donde son pensados para que funcionen como sensores del medio extracelular e interactúen con las proteínas de la membrana celular, la actina y el citoesqueleto tubular y con los indicadores de transducción para entender las cascadas de fosforilación intracelular de la regulación de los genes de transcripción en los núcleos. La Policistina 1 interactúa con la Policistina 2, la alfa 2 beta 2 integrina, el receptor de la proteína tirosina fosfatasa (RPTP) y la cadherina E para las membranas celulares, en adhesiones focales para las uniones adherentes y en la cilia central del túbulo colector. En la fase intracelular, la Policistina 1 interactúa con las proteínas de adhesión focal talina (TAL), la paxillina (PAX), la vinculina (VINC), la kinasa de adhesión focal (FAC), la c-src (SRC), la p130-cas (CAS), la nefrocistina (NPH1), la kinasa rica en prolina pyk-2 (Py), la tensina (TEN) y con las proteínas de unión adherentes alfa 2 y beta 2 y la alfa cedenina y la cadherina E, que podrían regular la adhesión focal célula-matriz y la adhesión célula-célula respectivamente.
La Policistina 2 y el receptor pasajero potencial de los canales de calcio (TRPC-1) pueden facilitar la entrada de calcio, que podría actuar como un segundo mensajero intracelular. El segundo mensajero AMPc, tanto como las proteínas G, podrían regular la función de las policistinas a través de las interacciones con los sitios definidos de Policistina 1 C-terminal.
La Policistina 1 C-terminal contiene sitios para fosforilación en serie, como las proteínas A y X y las tirosinas como c-src y la kinasa de adhesión focal, tanto como la prolina enriquecida src homóloga 3 (SH) y los sitios supuestos WW. Las cascadas de los indicadores de transducción inducidas por el complejo de policistina, incluyen aquellos de las vías W [beta catenina y células T (TCF)], los factores de transcripción de mejoramiento linfoideo, las vías de adhesión ocal (la MAP kinasa y JUN kinasa), los activadores de transcripción proteica 1 (AP-1) y la vía de regulación transcripcional de proliferación, apoptosis, diferenciación epitelial, polaridad, adhesión, migración, formas celulares y diámetro tubular, que son todos componentes de la morfología renal.
En el epitelio normal, la Policistina 1 (Fig. 12) interactúa en un complejo de multiproteínas, con proteínas integras y de adhesión focal, incluyendo la kinasa de adhesión focal (FAK). En el epitelio de pacientes con PQRAD, aunque la policistina 1 y los complejos de adhesión focal están formados, ellos carecen de FAK, TAL, Talina, paxicilina, vinculina, CAS p130-cas, SRC c-src, tensina y nefrocistina.
Actualmente las evidencias sugieren que la línea de complejos de señalamiento de policistinas, segundos mensajeros intracelulares y factores de crecimiento coordinan la proliferación, diferenciación y morfogénesis de las células tubulares renales, a través de interacciones con complejos de proteínas conectados a la actina del citoesqueleto, a cascadas de indicadores intracelulares y a la regulación de los genes de transcripción. Las alteraciones de estos mecanismos reguladores por mutaciones en PKD1, PKD2 o NPH1 descomponen estos procesos.
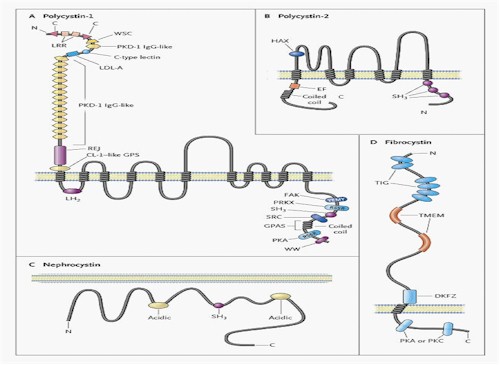
Fig. 12. Estructura de las proteínas del quiste.
Cilias: las principales células de los túbulos renales tienen una cilia solitaria central, cuya función es obscura. Intrigantemente, los ratones afectados con PQRAD tienen una estructura y función ciliar anormal y ello afecta a las proteínas que coexisten con la policistina de las cilias en los túbulos colectores. Sin embargo, se desconocen donde estas anormalidades se aplican en PQRAD en humanos, que involucran al gen PKDH1 mutado. Estudios genéticos en un gusano (Caenorhabditis elegans) y estudios funcionales en punciones celulares y en un ratón con PKD1 mutado, sugieren un rol sensible de la cilia en PQRAD.
Biología Molecular: Un amplio rango de mutaciones en PKD1 o PKD2 puede causar enfermedad renal poliquística. Estas mutaciones se extienden atravesando la secuencia entera de estos genes e incluyen supresiones, inclusiones, cambios de estructura y uniones absurdas, sin sentido, en lugares de mutación. En parientes, las mayores mutaciones incluyen una proteína truncada y son únicamente para a una sola familia.
PKD1 es el más largo con 46 exones e incluye un transcriptor de 14,5 kb. La existencia de PKD1 adicional como genes homólogos de la región 5 de PKD 1, complica considerablemente el análisis de la mutación. Más de 100 mutaciones han sido identificadas.
En contraste, PKD2, un gen con 15 exones simples, incluye un transcriptor más pequeño de 5,6 kb. Más de 75 mutaciones han sido identificadas, en contra principalmente del tipo inactivado.
Los pacientes con PQRAD son heterocigotos, teniendo heredado un alelo mutante y uno normal (tipo grande) de PKD1. Un mecanismo “dos golpes” ha sido propuesto para explicar como crecen los quistes. Este mecanismo no solo requiere una mutación de la línea germinal de PKD1 y 2, sino una mutación somática adicional en el gen tipo grande para iniciar la formación de los quistes. Aunque tales segundos golpes (lugares de mutación) ocurren con los quistes individuales solamente, las frecuencias son bajas (17 % en PKD1 y encima del 43 % en PKD2) y la policistina es vista en muchas de las células del epitelio del quiste de riñones de pacientes con PQRAD. La evidencia sugiere que la mayoría de los lugares de mutación somática, permiten la transcripción del alelo tipo grande mutado o del bloque de la producción de policistina 1 y 2.
Aunque la pérdida completa de PKD1 o PKD2 claramente causan formación masiva de quistes renales; este es un efecto de dosis genética, donde cualquier PKD pequeño (con ausencia completa de haploinsuficiencia) o PKD1 grande (con sobrecompresión transgénica), también causan formación de quistes.
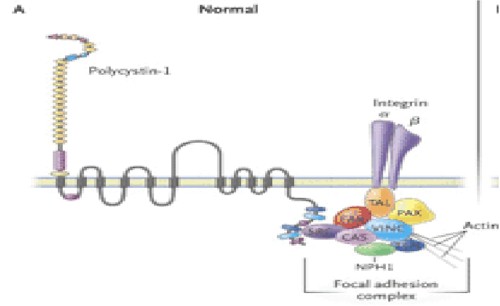
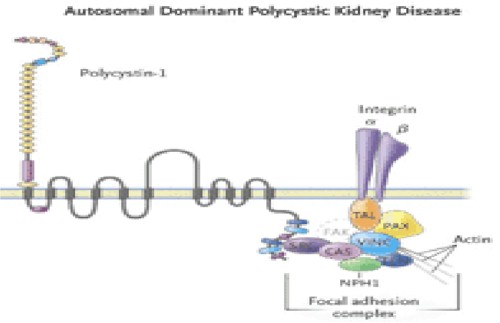
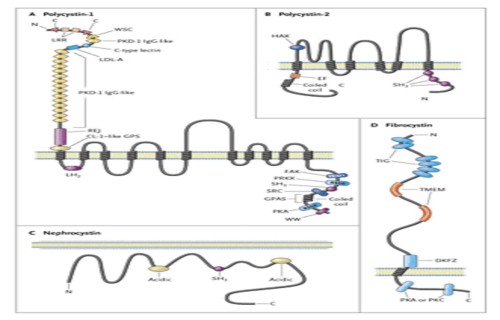
Fig. 13: Estructura de las proteínas de la Poliquistosis renal (PQR).
El gen de PQRAR, PKHD1, tiene 67 exones e incluye un transcriptor grande de 16,2 KB. Existen múltiples variables unidas y varias mutaciones diferentes han sido detectadas a lo largo de la región entera codificada. La mayoría de las mutaciones predicen la traslación de una proteína truncada.
Proteínas de la Enfermedad Poliquística Renal:
Policistina 1: es una proteína grande de la membrana (mayor de 460 kD) con un N-terminal extracelular largo, 11 áreas transmembrana y un C-terminal intracelular corto (Fig.13). Esta porción contiene motivos estructurales para comprometer a las proteínas de la matriz y a las células de la membrana en el medio del epitelio tubular renal. La porción intracelular de la proteína tiene muchos sitios de fosforilación y responde a los reguladores de los señaladores de transducción. La Policistina 1 interactúa y forma complejos con muchas otras proteínas en el plano de las células de la membrana y en la fase intracelular de la membrana que conecta el medio extracelular al citoesqueleto de actina intracelular.
Policistina 2: la proteína policistina 2 PKD2-codificada es una proteína de la membrana de 110-kD, con seis zonas transmembrana y áreas transmembrana con un N- y un C-terminal intracelular, con estructuras similares a los canales de sodio y calcio activadores de voltaje tipo L (Fig.13). El análisis estructural del sitio de la policistina 2 en el familiar potencial receptor pasajero de los canales de proteínas, muestra juntos también a la reciente identificada policistina para canales de calcio PKDL y PKD2L2.
Aunque la policistina 2 puede funcionar como un canal de catión no selectivo que es permeable al calcio, esto es incierto, porque sola y únicamente puede formar un complejo con policistina 1 para la membrana celular o en el retículo endoplásmico.
Fibrocistina: aunque poco se conoce sobre la proteína larga (447-kD) involucrada en PQRAD, la fibrocistina (solo conocida como poliductina), la estructura sugiere que es un receptor integral con sitios de interacción proteica intracelular y sitios de fosforilación intracelular. Las mutaciones causantes de la enfermedad de PKHD1 con C-terminal truncado de fibrocistina, remueven o inactivan a los sitios de señalamiento putativos. La fibrocistina es abundante en los túbulos colectores de riñones fetales, pero está ausente en los riñones de varios pacientes con PQRAR. Tomándolas juntas, estas propiedades sugieren que como la policistina 1, la fibrocistina podría actuar como un receptor de membrana, interactuando con proteínas extracelulares ligadas y con señaladores de transducción intracelular en el núcleo.
Nefrocistina: diferente a la policistina y fibrocistina, la nefrocistina es una completa proteína intracelular pequeña (83-kD). La policistina y nefrocistina probablemente interactúan con las proteínas del complejo de adhesión focal, en quienes la fosforilación activa las vías de señalamiento intracelular. Las evidencias apoyan la existencia de un rol central para el complejo de adhesión policistina- nefrocistina en puntos de adhesión focal en la matriz celular para la regulación de la geometría tubular.
Funciones de las Policistinas: un amplio rango de análisis ha concluido que las funciones de la policistina 1 como receptor de la membrana capaz de ligarse e interactuar con muchas proteínas, carbohidratos y lípidos, provoca una respuesta intracelular a través de las vías de fosforilación y que la policistina 2 actúa como un canal permeable de calcio. La policistina 1 es encontrada entre los tres sitios principales de las células renales tubulares: el complejo de adhesión focal matriz-célula, las uniones célula-célula, y la cilia; cada uno de ellos relaciona el medio extracelular de la membrana celular al citoesqueleto intracelular actina-tubulina.
Como las múltiples interacciones con otras proteínas y las modificaciones por fosforilación, los complejos de policistina estimulan a las cascadas de señalamiento intracelular que influyen en los genes de transcripción. Las evidencias sugieren que el complejo de policistina actúa como un sensor mecánico, recibiendo señales de la matriz celular (principalmente de adhesiones focales), células vecinas (a través de uniones celulares) y la luz tubular (a través de la cilia) y transductores con respuesta intracelular que regulan la proliferación, adhesión, migración, diferenciación, y maduración esencial para el control del diámetro de los túbulos renales y la morfología renal.
Fuente de información: Department of Medicine, Division of Nephrology, Mount Sinai School of Medicine, New York.
Clínica: La presencia de tremendos quistes agrandados es característica de PQRAD (Fig.14).
Varían desde unos milímetros a muchos centímetros y son de color claro o chocolate que sugiere hemorragia. Los riñones pueden exceder los 40 cm. de tamaño y pueden pesar hasta 8 kg.
La enfermedad es asintomática (14) en el 50 % de los casos. En general, los primeros síntomas aparecen en la tercera o cuarta décadas, y el mas temprano es la disminución de la concentración de la orina (Fig.15). En ausencia de Insuficiencia renal, la máxima osmolaridad urinaria es 16 % menor en adultos afectados que en miembros de la familia no afectados.
Fig. 14. PQRAD. En algunas áreas, los quistes pueden ser vistos como estructuras tubulares desplazadas (H&E, 200).
La hipertensión es la manifestación mas frecuente y el factor al que se le atribuye el deterioro de la función renal y el agravamiento de la insuficiencia renal ya establecida.
Otras manifestaciones clínicas (15) a considerar son la infección urinaria, hematuria macroscópica, cefaleas, poliuria, cólico renal, litiasis renal, pielonefritis, infección del quiste.
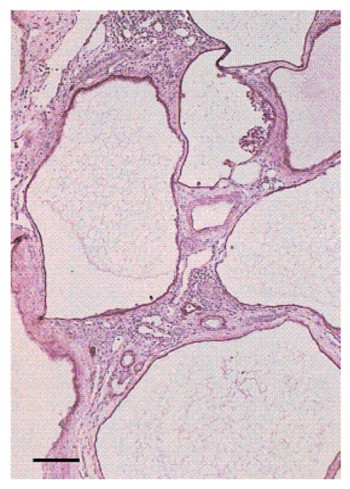
Figura 15. Pérdida del tejido renal en PQR. Se observan muchos glomérulos y túbulos (A). En contraste, se observan túbulos y glomérulos y múltiples quistes en riñones de pacientes con IRCT (B).
Las cefaleas que son severas o que parecen sentirse diferentes de otras cefaleas, podrían ser causadas por aneurismas o vasos sanguíneos dilatados en el cerebro. También podrían ser causadas por elevación de la presión arterial.
La infecciones del tracto urinario deberán ser tratadas con antibióticos porque podrían infectar a los quistes; siendo dificultoso su tratamiento a posteriori porque muchos antibióticos no penetran dentro de los quistes.
Ciertas funciones endocrinas solo parecen estar alteradas, con aumento de la renina y la eritropoyetina. El aumento de renina se relaciona con la hipertensión arterial.
Aunque la Policitemia es rara, el Hematocrito se mantiene mucho mejor en pacientes con fallo renal por PQRAD que en pacientes con otras formas de enfermedad renal, reflejando la presencia de altos niveles de eritropoyetina.
Existen anomalías quísticas (23) asociadas a esta enfermedad, como quistes hepáticos, pancreáticos, aracnoideos y ováricos; y no quísticas como divertículos en el colon, prolapso de la válvula mitral, aneurisma de la aorta abdominal o aneurismas intracraneales (que producen muerte súbita).
La presencia de poliquistosis hepática, agrega síntomas diversos que complican el cuadro.
Diagnóstico: Se realiza mediante ecografía. En caso de historia familiar positiva, el diagnóstico se establece (10) en función de la edad y del número de quistes.
En personas de menos de 30 años (26): dos quistes (unilaterales o bilaterales); pacientes entre 30 y 59 años: dos quistes en cada riñón; mayores de 60 años: al menos cuatro quistes en cada riñón.
Consejo genético: cada hijo de un padre afectado tiene el 50 % de probabilidades de presentar la enfermedad a lo largo de la vida. En general, padres convenientemente informados mediante consejo genético no alteran sus planes reproductivos por una enfermedad de comienzo tardío. Si embargo, en otros casos, no hay un adecuado conocimiento de la enfermedad y sus implicaciones y, como existe un largo período presintomático, el diagnóstico se realiza cuando ya tienen descendientes. Se recomienda el diagnóstico precoz en adultos con historia familiar mediante ecografía.
Tratamiento: Si el crecimiento de los quistes (16) juega un rol central en la progresión del fallo renal, cuando disminuimos el tamaño en quienes esto ocurre, podría preservar la función renal. Los bloqueadores de los canales de sodio como amiloride minimizarían la entrada de sodio y disminuirían o detendrían el crecimiento quístico. La colchicina, vinblastina y taxol pueden prevenir la formación de quistes in vitro. La metilprednisolona, la alcalinización urinaria y el lovastatin detienen el curso de la enfermedad renal, pero no se hicieron estudios significativos evaluables.
Debe instaurarse precozmente el tratamiento antihipertensivo para mantener cifras de presión arterial inferiores a 130-140/80-85 mmHg. Los fármacos de elección son los inhibidores de la enzima conversora de la angiotensina o los antagonistas de los receptores AT2 de la angiotensina.
Se debe indicar una dieta baja en proteínas (0,6 a 0,7 g/kg por día)
El efecto del embarazo (28) en mujeres con enfermedad renal poliquística adquirida (ERPQA) es variable, siendo la fertilidad similar a lo normal, las normotensas tienen embarazos no complicados, las hipertensas tienen un riesgo aumentado con fetos de bajo peso y preeclampsia.
Cuando existe fallo renal terminal, las opciones son hemodiálisis o trasplante renal porque la diálisis peritoneal es menos usada.
Mostramos el caso de una mujer de 45 años de edad con PQRAD con clínica urológica para consideración de nefrectomía bilateral por severo dolor y distensión abdominal (fig. 16). La RMN del abdomen (panel A) mostró un gran agrandamiento y reemplazo completo del hígado (flecha de arriba) y de los riñones (flecha de abajo) por quistes. Se realizó nefrectomía bilateral (panel B), con remoción del riñón izquierdo que midió 29 cm. por 20 cm. por 14 cm. (peso 3.100 g) y el riñón derecho midió 28 cm. por 14 cm. x 11 cm. (peso 1.600 g). Los riñones contenían quistes con 5 cm. de diámetro de tamaño. La paciente notó una inmediata mejoría en el dolor abdominal y una marcada disminución de la distensión abdominal.
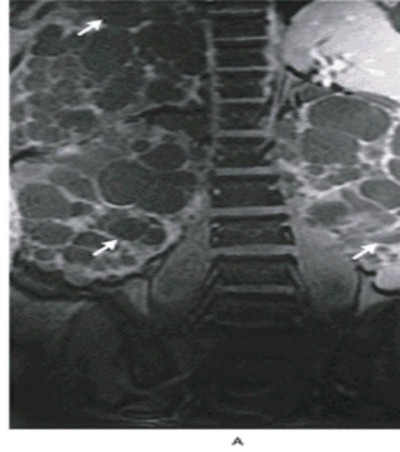
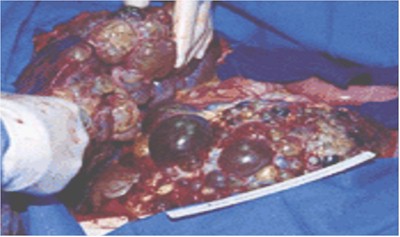
Figura 16. Panel A: Tomografía axial computada. Panel B: Nefrectomía bilateral.
NEFRONOPTISIS JUVENIL
Se trata de una nefritis (19) túbulo intersticial crónica hereditaria de carecer autosómica recesiva, caracterizada por quistes en la médula renal, trastorno del crecimiento y que progresa a la Insuficiencia Renal crónica terminal durante la adolescencia, que se distribuye por igual en hombres y mujeres.
La incidencia de esta enfermedad ha sido estimada ser de 9/8.3 millones de nacidos vivos en Estados Unidos de América y 1/50.000 nacidos vivos en Canadá, y fue descripta por primera vez en l945 y 1951.
Como en otras enfermedades renales genéticas (como PQRAD o nefritis hereditaria), la rapidez de la progresión al fallo renal está probablemente determinada en parte por el tipo y la severidad del defecto genético. Sin embargo, algunos datos sugieren que ocurre un fenotipo clínico e histológico claramente similar entre parientes con defectos genéticos diferentes. Porque no han sido identificados marcadores específicos, el diagnóstico se hace por inferencia de la historia familiar (si presenta), la poliuria y la disminución de la capacidad de concentración, análisis de orina relativamente normales, y la presencia de un contorno renal liso y riñones de tamaño normal o pequeños en la ecografía, en el urograma o en la TAC. En suma, La pruebas mas tardías a menudo muestran quistes múltiples pequeños y ocasionalmente grandes en la unión corticomedular.
Clínica:
Las manifestaciones clínicas son causadas por la injuria tubular principalmente, con disminución de la capacidad de concentración renal y pérdida de sodio. Estas anomalías preceden la disminución del filtrado glomerular y solo pueden ser demostradas en hermanos asintomáticos.
Los primeros síntomas aparecen en el 50 % de los casos entre los 3 - 7 años de vida, con trastorno de la concentración urinaria como poliuria debido a la pérdida progresiva de la capacidad de concentración renal y a consecuencia de la localización de los quistes en la región medular y polidipsia consecuente, seguido por un progresivo desarrollo de anemia y en los chicos retardo del crecimiento y un progresivo deterioro de la función renal con signos de enfermedad glomerular que se desarrolla entre los 13 y 20 años de edad. La hipovolemia, la hiponatremia y el aumento de la creatininemia, pueden resultar si la natremia está severamente disminuida.
La polidipsia que acompaña a la poliuria es tan importante que obliga al niño a levantarse por las noches a beber y explica la importante anorexia que presentan estos enfermos. La enuresis secundaria es el síntoma mas temprano presente en mas del 80 % de los casos en alrededor de los 4 a 6 años de edad. El retraso en el crecimiento es un hallazgo frecuente. Analíticamente se constata incremento en la excreción urinaria de sodio y acidosis metabólica. La anemia aparece una vez instalada la insuficiencia renal, aunque es frecuente que el fracaso renal se produzca en la adolescencia. Típicamente el edema, la hematuria y las infecciones del tracto urinario están ausentes en la Nefronoptisis. La hipertensión arterial es rara. La recurrencia de la enfermedad nunca ha sido reportada en pacientes trasplantados.
El análisis molecular genético es el único procedimiento (20) donde el diagnóstico del NPHP1 puede ser hecho con certeza. Se deberá priorizar el consejo genético, con análisis familiares para distinguir la forma temprana (recesiva) de la forma tardía (dominante), donde es mandatorio excluir el compromiso de los órganos extrarenales. El diagnóstico prenatal solo deberá hacerse por un test genético directo. Aproximadamente un 66 % de chicos con Nefronoptisis juvenil guarda defectos homocigotos grandes (290 –kb) del gen NPHP1, mientras otras llevan puntos de mutación en combinación con defectos heterocigotos. Los análisis de orina generalmente revelan pocas células o depósitos; la proteinuria puede ser tardía; la tendencia a perder sodio ocurre por la ausencia típica de hipertensión en este desorden.
La anemia, acidosis metabólica y síntomas como náuseas, anorexia y debilidad son hallazgos tardíos de insuficiencia renal.
Se estima que la Nefronoptisis es responsable de aproximadamente el 2,4 % de los casos de IRC en chicos en USA, mientras que en Europa se reveló una frecuencia elevada de 15 %.
La ecografía renal muestra riñones de tamaño normal y en estadios avanzados, quistes renales. Las lesiones histológicas afectan a la membrana basal tubular, que está engrosada y con muchas capas o adelgazada, como una fibrosis intersticial asociada.
Algunos chicos se presentan con síntomas extrarenales, como Pielonefritis crónica, obstrucción del tracto urinario y enfermedad renal poliquística.
La Nefronoptisis y retinitis pigmentaria puede estar asociada con la degeneración tapetoretiniana como en el Síndrome de Senior-Loken, donde en la forma temprana aparece nistagmo congénito y ceguera de nacimiento o a los dos primeros años de vida; presente en el 18 % de los casos.
La forma tardía de Senior-Loken se caracteriza por el desarrollo de ceguera en la edad escolar después de una ceguera nocturna precedente.
También la Amaurosis congénita temprana de Leber afecta a chicos que son ciegos de nacimiento, tienen electroretinograma plano y retinitis pigmentaria; en las formas tardías, la ceguera ocurre durante la infancia.
Otras asociaciones son con el Síndrome de Joubert tipo B, que presenta coloboma del nervio óptico o degeneración retiniana, cataratas, ambliopía, nistagmus, retinitis pigmentaria, retraso mental, ataxia cerebelosa. También con el Síndrome de Meinzer-Saldino que presenta anomalías esqueléticas como epífisis con forma de cono y/o fibrosis hepática.
El Síndrome de Sensenbrenner podría estar asociado con displasia craneoectodérmica, nefropatía tubulointersticial y anomalías electroretinográficas.
Finalmente, el Síndrome de Jeune o displasia torácica asfixiante, el Síndrome de Ellis van Creveld, el Síndrome de RHYNS (retinitis pigmentaria, hipopituitarismo, nefronoptisis y displasia del esqueleto medio), y el Síndrome de Laurence-Moon-Bardet-Biedl han sido reportados con hallazgos histológicos similares de Nefronoptisis.
Genética:
El gen involucrado con la enfermedad (NPHP) ha sido identificado como cromosoma 2q13, entre D2548 y D2551. Defectos homocigotos han sido detectados en el 70 % de los niños afectados. Este gen, NPHP1, incluye una proteína interna, la nefrocistina. Las mutaciones en este gen están asociadas en el 50 al 85 % de los casos. Le heterogeneidad genética fue demostrada y un nuevo gen, NPHP4 ha sido mapeado en el cromosoma 1p36. Este gen incluye la nefrocistina 4 (Tabla 3).
Las mutaciones en el gen NPHP3, localizadas en el cromosoma 3q21-q22, causan una forma adolescente de Nefronoptisis (alrededor de 19 años de edad), que podría estar relacionada con la degeneración tapetorretinial o la fibrosis hepática.
Un segundo locus genético (NPHP2) ha sido localizado por mapeo homocigoto como cromosoma 9q22-q31 (Tabla 3). Estas mutaciones son responsables de una forma infantil de Nefronoptisis que progresan al fallo renal terminal antes de los cinco años de edad. Existen dos formas de transmisión hereditaria; la autosómica dominante es mas frecuente en el adulto joven y se asocia a manifestaciones extrarenales. La autosómica recesiva, mas habitual en el niño, se observa acompañando a otras anomalías extrarenales: degeneración tapetoretiniana (síndrome de Senior-Loken), retraso mental, ataxia cerebelosa, anomalías esqueléticas y fibrosis hepática.
El gen de la forma juvenil, NPH1, mide 83 kb, tiene 20 exones e incluye un pequeño transcriptor rna-mensajero de 4,5 kb. Está flanqueado por dos duplicaciones grandes invertidas (330-kb).
Es la causa genética mas frecuente de Insuficiencia Renal crónica en niños y en adultos jóvenes. El 70 al 80 % de los pacientes afectados tiene homocigotos suprimidos, en donde el remanente son heterocigotos. Una variante de inactivadores, uniones sin sentido, sitios corporales y lugares de mutación han sido identificados.
En los últimos años se ha localizado un gen para esta enfermedad en el cromosoma 2p, aunque no se ha constatado ninguna relación entre esta región y las familias portadoras del síndrome de Senior-Loken.
Se ha descripto otra forma fenotípica de nefronoptisis en lactantes con rápida progresión hacia la enfermedad renal terminal, lo cual sugiere heterogeneidad genética.
Anatomía patológica: Los riñones son de pequeño tamaño, aspecto pálido y superficie granulosa; la nefronoptisis muestra quistes de tamaño variable que están irregularmente distribuidos en la unión corticomedular y en la medula. Los quistes medulares aparecen tardíamente durante el curso de esta enfermedad y están a menudo ausentes en las biopsias renales realizadas en el estadio temprano.
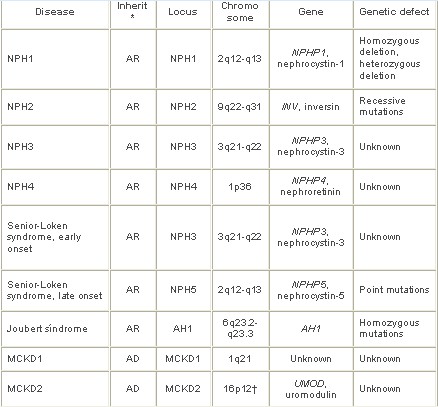
Tabla 3. *AD indicates autosomal dominant; AR, autosomal recessive.
†Co-localizes with familial juvenile hyperuricemic nephropathy.
Severos daños tubulares son vistos en la microscopía de luz, donde grupos de túbulos atróficos con membrana basal engrosada alternan con grupos de túbulos colapsados y dilatados. Los cambios en las membranas basales tubulares son altamente sugestivos de Nefronoptisis: el engrosamiento homogéneo o en capas de las membranas basales es muy prominente, aunque puede ocurrir solo la desintegración de las membranas basales, con una moderada fibrosis y pocas células inflamatorias. Los glomérulos a menudo son normales, pero la esclerosis segmentaria no es infrecuente en la enfermedad avanzada.
Pronóstico: la evolución a la insuficiencia renal terminal es la norma tras un seguimiento medio de 6 años desde la aparición de los primeros síntomas.
Tratamiento: no existe una terapia específica. Para evitar un disbalance hidroelectrolítico, hay que mantener un adecuado estado de hidratación, mediante aporte de agua y sal a demanda, así como corregir la acidosis metabólica y la hiponatremia. Una vez que se instaura la insuficiencia renal terminal, el trasplante es el tratamiento de elección, ya que no se han descrito recidivas.
RIÑÓN CON MÉDULA EN ESPONJA
La introducción del Urograma intravenoso en 1930 (34) permitió el descubrimiento del Riñón con médula en esponja, que es una malformación renal caracterizada por anomalías quísticas de los túbulos precaliciales, que está frecuentemente asociada con nefrocalcinosis y cálculos renales. Recientes descubrimientos sugieren que la enfermedad podría ser consecuencia de la interrupción de la interfase brote ureteral/blastema metanéfrico.
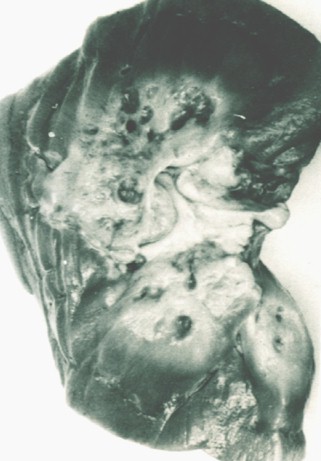
Fig. 17. Riñón esponjoso. Obsérvese los quistes esféricos en los extremos de las papilas renales. (De Ekstrom, T.; Engfeldt, B.; Lagergen, C., y Lindvall, N. Medullary Sponge Kidney. Almquist & Wiksells, 1959).
Esta lesión fue descripta (35) en 1939 por Guerrino Leonarducci (1902-1985), quién fue Jefe del Servicio de Radiología del Hospital Universitario de Padua (Italia) y describió la lesión típica radiológica. Trabajó en ese Hospital Universitario de Padua en equipo junto a Roberto Cacchi (Urólogo) y Vincenzo Ricci (Anatomopatólogo) en 1949 (Fig. 17), quienes establecieron (36) los aspectos clínicos, radiológicos y morfológicos.
Es una lesión que se presenta en la cuarta y quinta década de la vida y no parece tener transmisión genética familiar. Se caracteriza (37) por la dilatación quística múltiple y progresiva de los conductos colectores y tubulares de la región papilar y el diagnóstico se hace por una urografía excretora al exhibir una imagen en esponja de la papila (Fig.18).
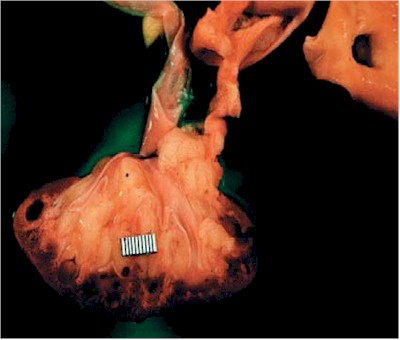
Fig. 18 . Riñón en esponja en estadio terminal. La corteza está groseramente atrófica y el hallazgo prominente es la presencia de papilas con focos de calcificación. Cistyc diseases of the kidney-Brenner et al.
Clínicamente, esta lesión (34) es generalmente asintomática, pero también presenta cólicos, disuria, hematuria o arenillas en la orina; se complica con litiasis en el 20 % de los pacientes y la asociación de hipercalciuria, hipocitraturia, nefrocalcinosis con la formación de cálculos de fosfato y oxalato de calcio, se ha relacionado con el hiperparatiroidismo primario.
Macroscópicamente el riñón está agrandado, normal o retraído; en la corteza tiene cicatrices; en la médula, una, varias o todas las papilas renales contienen quistes; que son pequeños (0,5 mm. de diámetro) y rodeados por una cápsula blanco grisácea y contienen cálculos esféricos.
Microscópicamente, los quistes están cubiertos en su interior por epitelio alto y columnar o plano y cuboideo o raramente de transición. Se comunican mayormente con los túbulos colectores. Presentan cálculos de hidroxiapatita. Los quistes corticales no son un componente del riñón en esponja.
La mayoría de estos pacientes evolucionan bien y en raras ocasiones llegan a la IRCT, y la gravedad de esta se relaciona con las infecciones renales y los cálculos de estruvita.
Aunque la patogénesis no fue dilucidada (36), su asociación con diferentes malformaciones, apoyan la idea de un trastorno del desarrollo. Las mas importantes son la Hemihipertrofia y el Síndrome de Beckwith-Wiedemann, que se asocian con el tumor de Wilms; haciendo una suerte de trilogía relacionada con un locus del cromosoma 11p15, con alteración del gen WT-1 hasta el cromosoma 11p13.
Un segundo grupo de condiciones asociadas con la enfermedad quística medular incluye la dilatación congénita de los conductos biliares intrahepáticos y la fibrosis hepática, y la PQRAD.
En la embriogénesis renal (30), a través de la síntesis de moléculas quimiotácticas, como es el factor neurotrófico derivado de glial (GDNF), el blastema metanéfrico apunta la división del brote ureteral del conducto metanéfrico de Wolff, que se aproxima e invade el blastema. El tope del brote es un receptor GDNF, llamado RET (reordenador durante la transición). El compromiso del uno hacia el otro entre RET y GNF es esencial, no solo para la correcta formación de los uréteres y de los túbulos colectores (que son Wolffianos en su origen), sino para la morfogénesis, nefrogénesis y el crecimiento renal. En particular, la transición de células metanéfricas a células mesenquimáticas del metanefros, a células nefrogénicas. La polarización correcta de las células tubulares y la especialización de los diferentes tractos tubulares del nefrón, necesitan mensajes diferentes desde la interfase brote ureteral/blastema metanéfrico.
Una teoría podría explicar que la interrupción de esta interfase (37) provocaría la ocurrencia concomitante de alteraciones en los túbulos precaliciales y colectores. Sin embargo, si esto depende de la función RET; solo podría explicar la función paratiroidea anormal en vista del rol oncogénico de la proliferación de las células paratiroideas y la asociación con el desarrollo del sistema excretor hepático.
La interfase anormal del brote ureteral con el blastema, podría ser secundaria a influencias ambientales durante el embarazo (drogas, virus, etc.). Esto podría solo estar manejado genéticamente, a pesar de los casos raros de riñón en esponja medular familiar.
La tendencia del uso de la ecografía, TAC y MRN con disminución de uso del Urograma de excreción, probablemente significará que un menor número de casos no serán diagnosticados en el futuro, porque estos no producen imágenes típicas de la enfermedad.
ENFERMEDAD RENAL QUÍSTICA ADQUIRIDA
La Insuficiencia Renal crónica (particularmente pacientes en hemodiálisis de mantenimiento o diálisis peritoneal), está frecuentemente (22) asociada con el desarrollo de quistes pequeños bilaterales múltiples. Estos quistes son usualmente menores a 0,5 cm. de diámetro (14) pero pueden ser tan grandes como 2 a 3 cm.
La edad avanzada, el sexo (mayor en hombres) y la combinación del tamaño renal con cada uno de ellos, son variables que juntas acontecen en un 33 % en la incidencia de quistes renales.
En pacientes con Insuficiencia renal crónica en estadio terminal, se observó un frecuente desarrollo (22) (Kidney vol. 64, Pág. 1019-1064) de quistes y esto es un factor de riesgo de carcinoma de células renales.
A pesar de que se identificó a los genes responsables de la mayoría de los desórdenes quísticos genéticos, la fisiopatología de la formación de quistes está pobremente sobreentendida (54).
Específicamente, no es conocido donde los quistes adquiridos se asocian con algún otro cambio en el parénquima renal (Fig.19). La hipertrofia compensadora (23) y la estimulación hiperplástica resultante de la pérdida de nefrones, podría inducir a la formación de quistes a través del crecimiento tubular aberrante. La incidencia de quistes aumenta marcadamente con la edad, pero donde esto se relaciona con la pérdida de parénquima renal que ocurre con el envejecimiento, es desconocido.
El diagnóstico de esta enfermedad renal quística adquirida (ERQA) se establece por Ecografía y/o Tomografía computada, aunque cada procedimiento tiene algunos resultados negativos falsos. Se distingue de la PQRAD porque no tiene historia familiar y los riñones son más pequeños del tamaño normal.
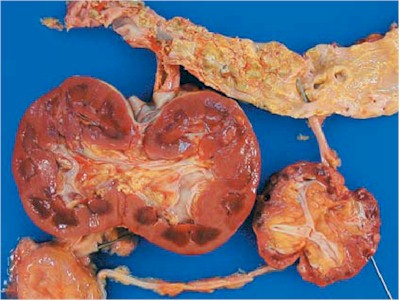
Fig. 19. ERQA: Esta imagen muestra ambos riñones en estado nativo y riñones trasplantados de un paciente con fallo renal prolongado. Los riñones nativos están atróficos y demuestran enfermedad quística adquirida comprometiendo la corteza
ERQA puede empezar antes de ingresar a diálisis, pero su grado de incidencia aumenta progresivamente con el mayor tiempo en diálisis. Entre el 50 al 80 % Estas observaciones sugieren que la duración del fallo renal severo es el mayor factor de riesgo para el desarrollo de los quistes.
Complicaciones: la mayoría son asintomáticos o con episodios de hematuria. En pacientes asintomáticos (Fig. 20), asimismo, estudios radiológicos secuenciales demostraron un aumento progresivo en el número y tamaño de los quistes que pueden complicarse con sangrado o carcinoma renal (17).
La ruptura de un vaso sanguíneo dentro del quiste puede ocurrir en el 50 % de los casos al mismo tiempo; menos frecuentemente la hemorragia puede extenderse dentro de la cavidad peritoneal.
Una revisión de trabajos estimó una incidencia de 0,18 % por año de carcinoma renal. Los carcinomas (21) están usualmente limitados a los riñones, y en aproximadamente la mitad de los casos, son múltiples y bilaterales, un hallazgo que coincide con la naturaleza difusiva de la enfermedad. La asociación de malignidad con ERQA solo ocurriría después del trasplante.
El seguimiento con TAC es más sensible que la ecografía en la detección y características de los quistes, pero generalmente se empieza el estudio con ecografía.
La nefrectomía (17) está indicada en pacientes con tumores grandes (3 cm. de diámetro) o que han aumentado de tamaño con estudios seriados.
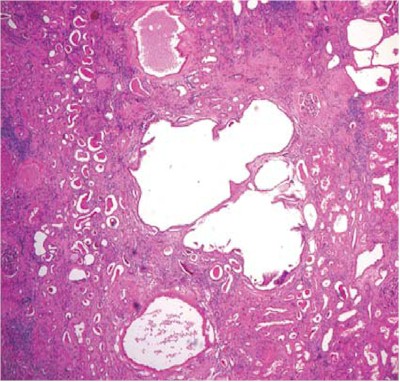
Fig. 20. ERQA: Estos son quistes distribuidos al azar de forma irregular limitados por epitelio aplanado (H&E, 100).
ENFERMEDADES SISTÉMICAS ASOCIADAS CON QUISTES RENALES
Síndrome de Von Hippel-Lindeau
El Síndrome de Von Hippel-Lindeau (SVHL) se transmite (35) en forma hereditaria autosómico dominante con penetrancia variable. Entre las manifestaciones clínicas se incluyen hemangiomas cerebral y retiniano, quistes pancreáticos y carcinomas, poliquistosis renal y feocromocitoma.
El gen responsable está en el cromosoma 3, que funciona normalmente como supresor tumoral. La edad media de comienzo del SVHL es de 26 años.
Mutaciones específicas del gen productor de SVHL (36) pueden estar asociadas con diferente susceptibilidad de desarrollo del feocromocitoma.
La degeneración maligna, que es a menudo multicéntrica y bilateral, se desarrolla con frecuencia y aumenta con la edad de los pacientes. Se estima que el carcinoma renal se desarrollará en aproximadamente el 70 % de los pacientes que sobreviven los 60 años, siendo rara antes de los 20 años.
La enucleación de las lesiones sólidas renales (37) está usualmente indicada para preservar la función renal. Todos los quistes deberán ser examinados para excluir malignidad oculta que podría no aparecer con procedimientos radiológicos.
David Goldsmith del Guy´s Hospital de Londres (40) y Philip Thomas del Royal Sussex County Hospital de Brighton, Inglaterra, publicaron el caso de un hombre de 35 años de edad con cefalea e inestabilidad para deambular y ceguera reciente del ojo izquierdo, presión arterial y función renal normales, una concentración de hemoglobina de 18 g/dl. y Hematocrito 59 %. La resonancia nuclear magnética del cráneo mostró un tumor cerebral que fue extirpado y resultó ser un Hemangioblastoma benigno. Después que el tumor fue removido, la concentración de hemoglobina cayó a 14,5 g/dl. El examen ocular mostró hemangioblastomas de la retina que fué tratado con ablación por láser y mostró el diagnóstico de enfermedad de von Hippel-Lindau. El paciente no conocía tener historia familiar de la enfermedad. Debido al diagnóstico, se hizo una ecografía renal que mostró áreas quísticas en ambos riñones. Meses después, se le realizó TAC abdominal que mostró lesiones quísticas complejas en polo superior renal izquierdo y en polo inferior renal derecho. La angiografía renal mostró un ovillo de vasos que definían la enfermedad, con grupos venosos en el polo superior renal derecho que sugirió una circulación de tumor. Durante la nefrectomía radical, una gran parte del quiste y una parte del tumor sólido fué encontrado en el polo superior del riñón izquierdo. El examen histológico mostró un carcinoma de células renales, sin evidencia de invasión o de metástasis locales. Un año mas tarde se le realizó nefrectomía parcial derecha, encontrándose un carcinoma de células renales encapsulado y se removió el polo inferior. La creatininemia fue de 1,2 mg/dl. en el preoperatorio y de 2,1 mg/dl. en el postoperatorio. En la evolución a tres años, el paciente continuaba con vida.
Esclerosis Tuberosa
La Esclerosis tuberosa (ET) se transmite (38) solo con característica autosómica dominante, aunque esto puede tener una historia familiar igual de penetrancia variable y de mutación espontánea.
La Esclerosis tuberosa se caracteriza por la formación de angiomiolipomas o tubérculos en la piel (llamados adenomas sebáceos), cerebro, retina, piel, corazón, riñones, hígado pulmón y en huesos. Estas masas (39) están compuestas de cúmulos de tejido adiposo maduro, músculo liso y paredes de vasos sanguíneos. Un número pequeño de pacientes solo tiene múltiples lesiones quísticas, similar a las vistas en PQRAD.
Muchos pacientes con Esclerosis tuberosa no tienen síntomas relacionados a los riñones. El carcinoma (39) de células renales es otra potencial complicación. Los angiomiolipomas son benignos.
QUISTE RENAL SIMPLE
Los quistes renales simples son las masas renales mas comunes (65-70 %), son bolsas anormales que contienen líquido. Aunque su causa no está completamente entendida, no se conoce que los quistes simples tengan una condición hereditaria.
Se presentan (44) con mas frecuencia en pacientes mayores de 50 años (Fig.21). Pueden ser solitarios unilaterales, o múltiples y bilaterales.

Fig. 21. Quiste Simple típico. Los quistes simples asintomáticos de este tamaño constituyen con frecuencia hallazgos fortuitos de la ecografía y de la TC
La incidencia de quistes renales bilaterales es poco común y son raros en sujetos menores de 50 años (Fig. C).
El promedio que el quiste renal simple necesita (48) es de 10 años para alcanzar los 2 cm. de diámetro.
Lo mas frecuente es que no causen síntomas o perjuicio en los riñones. En algunos casos, sin embargo, el dolor puede ocurrir cuando los quistes se agrandan y presionan a otros órganos.
Algunas veces pueden llegar a infectarse o romperse de repente con sangrado. Lo menos frecuente es que dañe la función renal, pero puede ser causa de hipertensión arterial.
En pacientes de edad, los quistes simples de varios tamaños pueden ser encontrados en cerca de un tercio de incidencia. Dos tercios de los quistes renales simples son de aproximadamente 2 cm. o menos de diámetro (46).
Como hemos dicho, generalmente son asintomáticos y son descubiertos accidentalmente por un examen radiológico o ecográfico, aunque en algunos casos pueden ocurrir la ruptura, hemorragia, e infección del quiste o la hipertensión angiotensina dependiente por compresión del parénquima afectado.
El tamaño varía desde algunos milímetros hasta varios centímetros de diámetro y puede contener mucha cantidad de líquido en su interior; tiene característica de masa y es palpable con facilidad.
Un estudio con ultrasonografía renal (55) realizado por Jafar Al-Said y W. Charles O´Neill sobre 2526 pacientes seleccionados, demostró que la magnitud renal de ambos riñones fue significativamente menor en pacientes con quistes, independiente del contenido de los mismos. Concluyó que la magnitud renal se redujo en pacientes con quistes renales simples diagnosticados por ecografía, y que estos quistes podrían estar asociados con una reducción de la función renal. Esto sugiere que los quistes aislados son un síntoma de la pérdida de nefrones en pacientes con anomalías renales.
Los quistes simples de categoría I de acuerdo a la clasificación de Bosniak, usualmente son asintomáticos, no producen daño renal y no requieren tratamiento una vez diagnosticados.
Sin embargo, una ocasional expansión del quiste causa una progresiva obstrucción del flujo pélvico y calicial, asociándose frecuentemente con hipertensión arterial, porque los quistes simples pueden producir una isquemia renal segmentaria y a su turno activar el sistema renina angiotensina.
La aspiración percutánea o la remoción quirúrgica, podrían causar descenso de la presión arterial.
Bosniak (46) sugirió una clasificación en un intento de separar las diferentes clases de quistes en categorías: no quirúrgicas (categorías I y II) y quirúrgicas (Categorías III y IV); el límite entre las lesiones quísticas tipo II y III no es de corte claro, pero las lesiones tipo IV son claramente carcinoma de células renales quístico.
Diagnóstico: con el uso extendido de métodos de diagnóstico no invasivos, tales como la ultrasonografía y la tomografía computada, los quistes renales (48) son diagnosticados con gran frecuencia.
En pacientes de edad, los quistes simples de varios tamaños pueden ser encontrados en cerca de un tercio de ellos. Dos tercios de los quistes renales simples son de 2 cm. de diámetro o menos de diámetro.
La mayor preocupación con el quiste simple es diferenciarlo con muchos desórdenes serios, como la enfermedad poliquística renal y masas sólidas como el carcinoma renal y/o el abceso (47).
Los tres criterios mayores para el diagnóstico de un quiste simple (45) por ecografía que, si están presentes, permiten diferenciarlo de un carcinoma o de un abceso son:
1- La masa está rodeada y claramente demarcada por paredes lisas,
2- No se presentan ecos con la masa (anecoica),
3- el líquido interior es homogéneo (similar al agua).
La ecografía o el scanning con Tienen una pared posterior fuerte y buena transmisión de los ecos a través del quiste porque Tomografía computada pueden ser utilizados para un diagnóstico correcto. Por ejemplo, los quistes bilaterales son raros en sujetos jóvenes; de manera que este hallazgo en un paciente estudiado con historia de enfermedad renal poliquística, es altamente sugestivo de esta enfermedad.
Bosniak describe un esquema de clasificación para el diagnóstico de quites renales basado en los hallazgos de la Tomografía computada.
Ellos son:
1. Categoría I (Quiste simple): paredes finas sin septum, no ensanchadas, con calcificaciones o componentes sólidos (<2% de posibilidad de malignidad).
2. Categoría II (Quiste mínimamente complejo): pared fina (<1mm), no ensanchada; podría contener 1 o 2 líneas delgadas septales, fina calcificación o un segmento corto de calcificación escasamente complicado; incluye lesiones muy atenuadas y menores de 3 cm. (rango de índice de malignidad de 0 a 14 %).
3. Categoría IIF (Indeterminado): mínimo aumento y/o espesamiento de las líneas delgadas lisas o paredes, engrosamiento leve o calcificación nodular, componentes tisulares blandos no aumentados; incluye lesiones muy atenuadas que son de 3 cm. o más grandes (aproximadamente 20 % de probable malignidad).
4. Categoría III (Indeterminado sospechoso): lesiones multiloculares con múltiples septos aumentados, paredes uniformemente engrosadas, nodularidad, o calcificación gruesa o irregular (30-60 % de probabilidad de malignidad).
5. Categoría IV (Maligno): contiene aumento (>10) de nódulos grandes o componentes claramente sólidos (>90 % de probabilidades de malignidad).
La Resonancia Nuclear Magnética podría ayudarnos para evaluar lesiones renales no aclaradas. Sugiere una más alta calificación para valorar áreas de las paredes engrosadas o ensanchadas.
Tratamiento: en la Universidad de Umea, Suecia (48), se efectuó en un grupo la punción percutánea del quiste con evacuación del líquido quístico solamente y en otro grupo se hizo el mismo procedimiento más la instilación de fosfato de bismuto dentro del mismo. Los quistes tratados en el último grupo desaparecieron o disminuyeron de tamaño con muy pocas excepciones; en cambio en el otro grupo no hubo diferencias de tamaño entre los que habían sido punzados y evacuados y los que no habían recibido la intervención.
En Rusia utilizaron escleroterapia por punción transcutánea del quiste con el uso de alcohol al 96 % para tratamiento de los quistes sintomáticos o que eran muy grandes, con una recurrencia del 16 %, debiendo repetirse la punción de esos casos.
En la Universidad de Mansoura de Egipto (50), para aquellos casos donde el quiste simple tiene síntomas que no pueden ser controlados médicamente, 60 pacientes con 64 quistes renales simples sintomáticos (31 hombres y 29 mujeres) fueron tratados con aspiración percutánea e inyección de etanol 95 %; donde 34 pacientes presentaban dolor renal, 9 tenían efecto de masa renal, 11 cursaban hipertensión arterial severa y 6 cursaban con hematuria.
Se definió que el éxito era completo cuando existiera la escisión total de los quistes y cuando tuvieran una recidiva de menos de la mitad del volumen original del quiste con resolución de los síntomas. El fracaso se definió como la recurrencia de más de la mitad del volumen del quiste y/o la persistencia de los síntomas.
Los pacientes fueron evaluados después de 19 meses promedio por seguimiento clínico, ecografía y urograma excretor. El resultado fue la escisión de 54 quistes y la resolución parcial en 10, apareciendo solo hematuria microscópica y fiebre en 2 pacientes; hubo mejoría y desaparición del dolor en todos los pacientes, la hipertensión arterial se controló sin medicación en todos los afectados y la hematuria desapareció en los 6 afectados. Se concluyó que la escleroterapia para el quiste renal simple es sencilla, mínimamente invasiva y muy efectiva, siendo recomendada como terapia de primer orden.
En el Departamento de Urología de la Universidad Médica de Shangai (53), estudiaron y utilizaron el método cerrado de laparoscopía retroperitoneal con resección de los quistes simples en 35 casos; con edades de 36 a 72 años y con tamaño de los quistes entre 4.0 y 9.3 cm. El procedimiento duraba pocos minutos. Después de 1 a 18 meses de seguimiento, se observó desaparición de todos los quistes renales. Concluyeron que el procedimiento es poco traumático y no es incómodo para el paciente y estaba indicado como el mejor para tratar los quistes renales simples sintomáticos.
En el Departamento de Urología del Instituto de Ciencias Médicas de Nueva Delhi, India (46), utilizan la laparoscopía para el tratamiento de los quistes renales. Refieren que es altamente efectiva, simple y una alternativa mínimamente agresiva a la cirugía abierta. Los quistes pueden ser accedidos por vía transperitoneal o retroperitoneal, siendo muy eficaz, tiene mínimas complicaciones, emplea un corto tiempo, tiene mínima pérdida de sangre y poco tiempo de internación y recuperación.
La decorticación laparoscópica de los quistes parapiélicos se hace con métodos propios por su proximidad a los vasos renales y al sistema colector. Si el quiste no es totalmente escindido, se deberá cortar y añadir la grasa perirrenal dentro del quiste para prevenir la recurrencia y facilitar el drenaje. Esta cirugía podría ser considerada como un avanzado procedimiento endoscópico.
Tefekli A et al. evaluaron en el Departamento de Urología del Haseki Hospital de Estambul (47), Turquía, el tratamiento con decorticación laparoscópica retroperitoneal de los quistes renales simples usando tijeras bipolares plasmacinéticas sin fulguración adicional de la base o del límite de la resección. Estudiaron 19 casos, 14 casos (73,7 %) tenían un quiste, 3 casos (15,8 %) tenían un quiste, 1 caso con tres quistes (5,2 %) y 1 caso con quistes múltiples por PQRAD. Estaban localizados periféricamente en 13 casos, en la zona peripélvica en 3 casos y en el parénquima en 2 casos. Observaron en el seguimiento un éxito del 89,5 % de desaparición de los síntomas y un éxito radiológico de 88.2 %. En un caso se observó la recurrencia de un quiste asintomático y en otro caso reapareció el dolor residual pero se debió a la formación de un nuevo quiste en otro lugar del riñón tratado.
Los quistes renales esporádicos no asociados con trastornos genéticos son comunes y generalmente se pensaba que no tenían significancia clínica.
Desde que se comprobó que los quistes múltiples frecuentemente desarrollan Insuficiencia renal crónica, en Emory University, Atlanta (55) , estudiaron 561 pacientes internados con la hipótesis de que los quistes solitarios o en escaso número, son una temprana manifestación de reducción de la función renal.
Concluyeron que la presencia de quistes renales simples se asoció con una reducción de la función renal en pacientes internados más jóvenes de 60 años. Esta relación empeoró por la alta incidencia de quistes en pacientes ancianos, sugiriendo que los quistes adquiridos podrían iniciar temprano el curso de la enfermedad, sobreentendiendo que podría ser considerada en individuos con quistes renales a priori tener 60 años de edad.
BIBLIOGRAFÍA
1- Borgatello, Carlos José, Manual de Medicina Primera Edición, Sección Nefrología, Enfermedades Renales Quísticas. Servicio de Clínica Médica, Unidad de Nefrología y Hemodiálisis, Hospital Domingo Funes, Santa María de Punilla, Provincia de Córdoba, Argentina.
2- Málaga Guerrero, S., Gallego Cobo, N, Gonzalo Fonrodona, A., Torra Balcells, R., Sociedad Española de Nefrología, Normas de Actuación clínica, Nefrología clínica, Nefropatías Congénitas y Hereditarias, Cáp. 20, Pág. 165-172, actualizado al 16/08/2003.
3- Bernstein J., A classification of renal cysts. Gardner Kd, ed. Diseases of the kidney, Nueva York: J Willey Biomedical publication, 1976; 7-30.
4- Berstein J., Renal Hyplasia and dysplasia. Edelmann CM Jr, ed. Pediatric Kidney Disease. Boston; Little Brown and Company, 1992; 1121-1137.
5- Wm Lane M. Robson, Chair, Department of Pediatrics, Taiwan Hospital, United Arab Emirates. Multicystic Renal Dysplasia. Medicine from Web MD. Enero 30, 2006
6- Kaplan BS, Fay J, Shah V et al. Autosomal recessive polycystic kidney disease. Pediatric Nephrology 1989; 3: 43-49.
7- National Kidney and Urologic Diseases Information Clearinghouse. Polycystic Kidney Disease.
8- Zerres K, Mücher G, Bachner I. et al. Mapping of the gene for autosomal recessive polycystic kidney disease (ARPKD) to chromosome 6p21-cen. Nature genet 1994; 7: 429-432.
9- Zerres K, Rudnik-Schöneborn S, Deget F et al. Autosomal recessive polycystic kidney disease in 115 children; clinical presentation, course and influence of gender. Acta Paediatr 1996; 85: 437-445.
10- Genetic Home Reference, Polycystic Kidney Disease. Last Comprehensive Review, Marzo 2005, Publicado Mayo 2006.
11- Grantham Jared J., Torres Vicente, Chapman Arlene et al, Volume Progression in Polycystic Kidney Disease, NEJM volume 354: 2122-2130, Mayo 2006, Number 20. Kidney Institute, Kansas University Medical Center, Kansas City.
12- Dalgaard OZ. Polycystic disease of the kidney. Strauss MB & Welt LG, eds. Diseases of the kidney. Boston: Little Brown and Co., 1971; 1223-1258.
13- Martin Rodolfo S., Iglesias Diana, Manrique Mariana, Arrizurieta Elvira. Poliquistosis Renal Autosómica Dominante, detección de una nueva mutación en el gen PKD1. Medicina, Volumen 59, N° 2, 1999. Instituto de Investigaciones Médicas Alfredo Lanari, Facultad de Medicina. Buenos Aires.
14- Wilson Patricia, Ph. D. Polycystic Kidney Diseases. Review Article. Mechanisms of Disease. NEJM. Volume 350; 151-164. Enero 2004.
15- Gonzalo A, Gallego A, Orte L, Rivera M, Ortuño J. Asymptomatic complications of autosomal dominant polycystic kidney disease. J Nephrology 1995; 8: 202-205.
16- Gonzalo A, Gallego A, Rivero M, Orte L, Ortuño J. Influence of hypertension on early renal insufficiency in Autosomal dominant polycystic kidney disease. Nephron 1996; 72: 225-230.
17- Zeier M, Geberth S, Ritz E, Jaeger T, Waldherr R. Adult dominant polycystic kidney disease. Clinical problems. Nephron 1988; 49: 177-183.
18- Resnik J, Vernier RL. Renal cystic diseases and renal dysplasia. Holliday MA, Barrat TM, Vernier RL, eds. Pediatric Nephrology. Baltimore: Williams & Wilkins, 1987; 371-383.
19- Niaudet Patrick, Professor. Service de nephrology p’ediatrique, Hôpital Necker, Enfants University Children‘s Hospital, Freiburg, Germany. Pediatric Nephrology (2001) 16:168-176. Malades, Paris, France. Nephronoptisis; Orphanet encyclopedia, Mars 2004.
20- Hildebrandt F, Omram H. New insights: Nephronoptisis-medullary cystic kidney disease.
21- Bennett William M, Rose Burton D, Acquired cystic disease of the kidney, Up to Date 2000, vol. 8 Nº 1.
22- Grantham, JJ. Acquired cystic kidney disease. Kidney Int 1991; 40: 143.
23- Levine E, Slusher SJ, Grantham JJ, Wetzel LH. Natural history of acquired renal cystic disease in dialysis patients: A prospective longitudinal CT study. AJR Am J Roentgenol 1991; 156: 501.
24- Terasawa Y, Susuki Y, Morita M, et al. Ultrasonic diagnosis of renal cell carcinoma in hemodialysis patients. J Urol 1994; 152: 846.
25- Chandhoke PS, Torrence RJ, Clayman RV, Rothstein M. Acquired cystic disease of the kidney: Management dilemma. J Urol 1992; 147: 969.
26- Gabow PS, Johnson AM, Kachny WD, et al. Factors Affecting the prognosis of renal disease in autosomal-dominant polycystic kidney disease. Kidney Int 1992; 41: 1311.
27- Woo, D. Apoptosis and loss of renal tissue in polycystic kidney diseases. N England Journal Med 1995; 333: 18.
28- Elzinga LW, Barry JM, Torres VE, et al. Cyst decompression surgery for autosomal dominant polycystic kidney disease. J Am Soc Nephrol 1992; 2: 1219.
29- Chapman AB, Schrier RW. Pathogenesis of hypertension in autosomal dominant polycystic kidney disease. Semin Nephrol 1991; 11: 653.
30- Chapman AB, Johnson AM, Gabow PA. Pregnancy outcome and its relationship to progression of renal failure in autosomal dominant polycystic kidney disease. J Am Soc Nephrol 1994; 5: 1178.
31- Choile PL, Siegel MJ, Oz O et al. Nonmalignant renal disease in pediatric patients with Beckwith-Wiedemann syndrome. Am J Roentgen 1998; 171: 733-737.
32- Schedl A, Hastie N. Croos-talk in kidney development. Curr Opin Genet Dev 2000; 10: 543-549.
33- Gambado G, Fabris F, Citron L et al. An unusual association of contralateral congenital small kidney, reduced renal function and hyperparathyroidism in sponge kidney patients: on the track of the molecular basis. Nephrol Dial Transplant 2005; 1042-1047.
34- Cacchi, R. And Ricci, V. Sur une rare malade kystique multiple des pyramides rénales, le “rein en éponge”. J. Urol. Nephrol. 55:497, 1949.
35- G. Gambaro, GP Feltrin, A Lupo, L Bonfante, A DÁngelo and A Antonello. Medullary sponge kidney (Leonarducci-Ricci disease): A Padua Medical School discovery in th e 1930s. Kidney International, volume 69, issue 4, 663-670. February 2006.
36- Abeshouse, BS and Abeshouse, GA. Sponge kidney: Review of literature and report of five cases. J. Urol. 84:252, 1960.
37- Ekström, T., Engfeldt, B., Lagergren, C., and Lindvall, N. Medularry Sponge Kidney: A Roentgenolic, Clinical, Histopathologic and Biophysical Study. Stockholm: Almqvist & Wiksells, 1959.
38- Maher ER, Yates JR, Harries R, et al. Clinical features and natural history of von Hippel-Lindau disease. Q J Med 1990; 77:1151.
39- Annanth S, Knebelmann B, Gruning W, et al. Transforming growth-factor-beta 1 is a critical growth factor for renal carcinoma (RCC) and is a direct target for the von Hippel-Lindau (VHL) tumor suppressor. J Am Soc Nephrol 1998; 9:433 A.
40- Miller DL, Choyke PL, Walther MM, et al. Von Hippel-Lindau disease: Inadequacy of angiography for identification of renal cancers. Radiology 1991; 179:833.
41- Kwiatkowska J, Wigowska-Sowinska J, Napierala D, et al. Mosaicism in tuberous sclerosis as a potential cause of the failure of molecular diagnosis. N Engl J Med 1999; 340:703.
42- Steiner MS, Goldman SM, Fishman EK, et al. The natural history of renal angiomyolipoma. J Urol 1993; 150:1782.
43- Shapiro RA, Skinner DG, Stanley P, Edalbrock, HH. Renal tumors associated with tuberous sclerosis: The case for aggressive surgical management.. J Urol 1984; 132:1170.
44- Caglioti A, Esposito C, Fuiano G, et al. Prevalence of symptoms in patients with simple renal cyst. BMJ 1993; 306:430.
45- Ravine D, Gibson RN, Donlan J, Sheffield LJ. An ultrasound renal cyst prevalence surgery: Specificity data for inherited renal cystic diseases. Am J Kidney Dis 1993; 22:803.
46- Hemal AK et al, Laparoscopic management of Urology, All India Institute of Medical Sciences, New Delhi, India, Urol Clin North Am, 2001 Feb 28 (1):115-26.
47- Tefekli A, Altunrende F, Baykal M, Sarilar O, Kabay S, Muslumanoglu AY. Retroperitoneal laparoscopic decortication of simple renal cysts using the bipolar Plasma Kinetic scissors, Department of Urology, Haseki Teaching and Research Hospital, Istambul, Turkey, Int J Urol. 2006 Apr; 13 (4): 331-6.
48- Holmberq G. et al, Diagnostic aspects, functional significance and therapy of simple renal cysts, clinical, radiologic and experimental study, Department of Urology and Andrology, University of Umea, Scand J Urol Nephrol Suppl, Sweden1992; 145:1-48..
49- Jasuda M, Masai M, Shimazaki J, A simple renal cyst. Department of Urology, School of Medicine, Chiba University, Japan; Nippon Hinyokika Gakkai Zasshi 1993 Feb; 84 (2): 251-7.
50- Mohsen T, Gomha M.A., Treatment of symptomatic simple renal cysts by percutaneus aspiration an ethanol sclerotherapy, Department of Radiology, Mansoura Urology and Nephrology Center, Mansoura University, Egypt, BJU Int., 2005 Dec; 96: 1369-72.
51- Ba UR, Urenkov SB et al, The diagnosis and treatment of simple kidney cysts, Urol Nefrol (Mosk.), 1996 May-Jun; (3): 8-12.
52- Altarac S. et al, Simple renal cysts, Lijec Vjesn, 2004 Sep-Oct.; 126 (9-10): 260-3.
53- Wang G, Sun L, Xu G, Guo J, Zhang Y, Retroperitoneal laparoscopic unroofing of renal cyst: use of close method, Department of Urology, Zhongshan Hospital, Shanghai Medical University, Shanghai 200032, Zhonghua Wai Ke Za Zhi, 1998 Mar; 36 (3): 146-8.
54- Siegal Justin, Corman John, Mason Virginia et al, Medical Center, University of Washington at Seattle. Cystic diseases of the kidney. March 8, 2006.
55- Al-Said J, Brumback MA, Moghazi S, Baumqarten DA, O’Neill WC. Reduced renal function in patients with simple renal cysts, Renal Division, Department of Medicine, Emory University School of Medicine, Atlanta, Georgia 30322, USA, Kidney Int 2004, Jun ; 65 (6): 2303-8.
56- Grantham Jared, Torres Vicente, Chapman Arlene, Guay-Woodford et al, Volume progression in Polycystic Kidney Disease, The New England Journal of Medicine, May 18, 2006, Volume 354: 2122-2130, Number 20.
57- Gabow Patricia, Autosomal Dominant Polycystic Kidney Disease, Review Article, NEJM, Volume 329:332-342, July 29, 1993, Number 5.
58- Gabow Patricia, Autosomal Dominant Polycystic Kidney Disease, Mechanism of Disease, NEJM, Volume 350: 151-164, January 8, 2004.
Autores:
Dr. Borgatello, Carlos José, Dra. Borgatello, Carolina Mariana.
Unidad de Nefrología y Hemodiálisis, Servicio de Clínica Médica, Hospital Domingo Funes. Santa María de Punilla, Córdoba, ARGENTINA.