Enfermedades quisticas renales 4.
Clínica:
Las manifestaciones clínicas son causadas por la injuria tubular principalmente, con disminución de la capacidad de concentración renal y pérdida de sodio. Estas anomalías preceden la disminución del filtrado glomerular y solo pueden ser demostradas en hermanos asintomáticos.
Los primeros síntomas aparecen en el 50 % de los casos entre los 3 - 7 años de vida, con trastorno de la concentración urinaria como poliuria debido a la pérdida progresiva de la capacidad de concentración renal y a consecuencia de la localización de los quistes en la región medular y polidipsia consecuente, seguido por un progresivo desarrollo de anemia y en los chicos retardo del crecimiento y un progresivo deterioro de la función renal con signos de enfermedad glomerular que se desarrolla entre los 13 y 20 años de edad. La hipovolemia, la hiponatremia y el aumento de la creatininemia, pueden resultar si la natremia está severamente disminuida.
La polidipsia que acompaña a la poliuria es tan importante que obliga al niño a levantarse por las noches a beber y explica la importante anorexia que presentan estos enfermos. La enuresis secundaria es el síntoma mas temprano presente en mas del 80 % de los casos en alrededor de los 4 a 6 años de edad. El retraso en el crecimiento es un hallazgo frecuente. Analíticamente se constata incremento en la excreción urinaria de sodio y acidosis metabólica. La anemia aparece una vez instalada la insuficiencia renal, aunque es frecuente que el fracaso renal se produzca en la adolescencia. Típicamente el edema, la hematuria y las infecciones del tracto urinario están ausentes en la Nefronoptisis. La hipertensión arterial es rara. La recurrencia de la enfermedad nunca ha sido reportada en pacientes trasplantados.
El análisis molecular genético es el único procedimiento (20) donde el diagnóstico del NPHP1 puede ser hecho con certeza. Se deberá priorizar el consejo genético, con análisis familiares para distinguir la forma temprana (recesiva) de la forma tardía (dominante), donde es mandatorio excluir el compromiso de los órganos extrarenales. El diagnóstico prenatal solo deberá hacerse por un test genético directo. Aproximadamente un 66 % de chicos con Nefronoptisis juvenil guarda defectos homocigotos grandes (290 –kb) del gen NPHP1, mientras otras llevan puntos de mutación en combinación con defectos heterocigotos. Los análisis de orina generalmente revelan pocas células o depósitos; la proteinuria puede ser tardía; la tendencia a perder sodio ocurre por la ausencia típica de hipertensión en este desorden.
La anemia, acidosis metabólica y síntomas como náuseas, anorexia y debilidad son hallazgos tardíos de insuficiencia renal.
Se estima que la Nefronoptisis es responsable de aproximadamente el 2,4 % de los casos de IRC en chicos en USA, mientras que en Europa se reveló una frecuencia elevada de 15 %.
La ecografía renal muestra riñones de tamaño normal y en estadios avanzados, quistes renales. Las lesiones histológicas afectan a la membrana basal tubular, que está engrosada y con muchas capas o adelgazada, como una fibrosis intersticial asociada.
Algunos chicos se presentan con síntomas extrarenales, como Pielonefritis crónica, obstrucción del tracto urinario y enfermedad renal poliquística.
La Nefronoptisis y retinitis pigmentaria puede estar asociada con la degeneración tapetoretiniana como en el Síndrome de Senior-Loken, donde en la forma temprana aparece nistagmo congénito y ceguera de nacimiento o a los dos primeros años de vida; presente en el 18 % de los casos.
La forma tardía de Senior-Loken se caracteriza por el desarrollo de ceguera en la edad escolar después de una ceguera nocturna precedente.
También la Amaurosis congénita temprana de Leber afecta a chicos que son ciegos de nacimiento, tienen electroretinograma plano y retinitis pigmentaria; en las formas tardías, la ceguera ocurre durante la infancia.
Otras asociaciones son con el Síndrome de Joubert tipo B, que presenta coloboma del nervio óptico o degeneración retiniana, cataratas, ambliopía, nistagmus, retinitis pigmentaria, retraso mental, ataxia cerebelosa. También con el Síndrome de Meinzer-Saldino que presenta anomalías esqueléticas como epífisis con forma de cono y/o fibrosis hepática.
El Síndrome de Sensenbrenner podría estar asociado con displasia craneoectodérmica, nefropatía tubulointersticial y anomalías electroretinográficas.
Finalmente, el Síndrome de Jeune o displasia torácica asfixiante, el Síndrome de Ellis van Creveld, el Síndrome de RHYNS (retinitis pigmentaria, hipopituitarismo, nefronoptisis y displasia del esqueleto medio), y el Síndrome de Laurence-Moon-Bardet-Biedl han sido reportados con hallazgos histológicos similares de Nefronoptisis.
Genética:
El gen involucrado con la enfermedad (NPHP) ha sido identificado como cromosoma 2q13, entre D2548 y D2551. Defectos homocigotos han sido detectados en el 70 % de los niños afectados. Este gen, NPHP1, incluye una proteína interna, la nefrocistina. Las mutaciones en este gen están asociadas en el 50 al 85 % de los casos. Le heterogeneidad genética fue demostrada y un nuevo gen, NPHP4 ha sido mapeado en el cromosoma 1p36. Este gen incluye la nefrocistina 4 (Tabla 3).
Las mutaciones en el gen NPHP3, localizadas en el cromosoma 3q21-q22, causan una forma adolescente de Nefronoptisis (alrededor de 19 años de edad), que podría estar relacionada con la degeneración tapetorretinial o la fibrosis hepática.
Un segundo locus genético (NPHP2) ha sido localizado por mapeo homocigoto como cromosoma 9q22-q31 (Tabla 3). Estas mutaciones son responsables de una forma infantil de Nefronoptisis que progresan al fallo renal terminal antes de los cinco años de edad. Existen dos formas de transmisión hereditaria; la autosómica dominante es mas frecuente en el adulto joven y se asocia a manifestaciones extrarenales. La autosómica recesiva, mas habitual en el niño, se observa acompañando a otras anomalías extrarenales: degeneración tapetoretiniana (síndrome de Senior-Loken), retraso mental, ataxia cerebelosa, anomalías esqueléticas y fibrosis hepática.
El gen de la forma juvenil, NPH1, mide 83 kb, tiene 20 exones e incluye un pequeño transcriptor rna-mensajero de 4,5 kb. Está flanqueado por dos duplicaciones grandes invertidas (330-kb).
Es la causa genética mas frecuente de Insuficiencia Renal crónica en niños y en adultos jóvenes. El 70 al 80 % de los pacientes afectados tiene homocigotos suprimidos, en donde el remanente son heterocigotos. Una variante de inactivadores, uniones sin sentido, sitios corporales y lugares de mutación han sido identificados.
En los últimos años se ha localizado un gen para esta enfermedad en el cromosoma 2p, aunque no se ha constatado ninguna relación entre esta región y las familias portadoras del síndrome de Senior-Loken.
Se ha descripto otra forma fenotípica de nefronoptisis en lactantes con rápida progresión hacia la enfermedad renal terminal, lo cual sugiere heterogeneidad genética.
Anatomía patológica: Los riñones son de pequeño tamaño, aspecto pálido y superficie granulosa; la nefronoptisis muestra quistes de tamaño variable que están irregularmente distribuidos en la unión corticomedular y en la medula. Los quistes medulares aparecen tardíamente durante el curso de esta enfermedad y están a menudo ausentes en las biopsias renales realizadas en el estadio temprano.
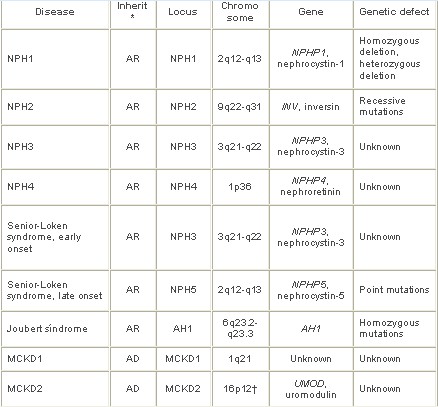
Tabla 3. *AD indicates autosomal dominant; AR, autosomal recessive.
†Co-localizes with familial juvenile hyperuricemic nephropathy.
Severos daños tubulares son vistos en la microscopía de luz, donde grupos de túbulos atróficos con membrana basal engrosada alternan con grupos de túbulos colapsados y dilatados. Los cambios en las membranas basales tubulares son altamente sugestivos de Nefronoptisis: el engrosamiento homogéneo o en capas de las membranas basales es muy prominente, aunque puede ocurrir solo la desintegración de las membranas basales, con una moderada fibrosis y pocas células inflamatorias. Los glomérulos a menudo son normales, pero la esclerosis segmentaria no es infrecuente en la enfermedad avanzada.
Pronóstico: la evolución a la insuficiencia renal terminal es la norma tras un seguimiento medio de 6 años desde la aparición de los primeros síntomas.
Tratamiento: no existe una terapia específica. Para evitar un disbalance hidroelectrolítico, hay que mantener un adecuado estado de hidratación, mediante aporte de agua y sal a demanda, así como corregir la acidosis metabólica y la hiponatremia. Una vez que se instaura la insuficiencia renal terminal, el trasplante es el tratamiento de elección, ya que no se han descrito recidivas.
RIÑÓN CON MÉDULA EN ESPONJA
La introducción del Urograma intravenoso en 1930 (34) permitió el descubrimiento del Riñón con médula en esponja, que es una malformación renal caracterizada por anomalías quísticas de los túbulos precaliciales, que está frecuentemente asociada con nefrocalcinosis y cálculos renales. Recientes descubrimientos sugieren que la enfermedad podría ser consecuencia de la interrupción de la interfase brote ureteral/blastema metanéfrico.
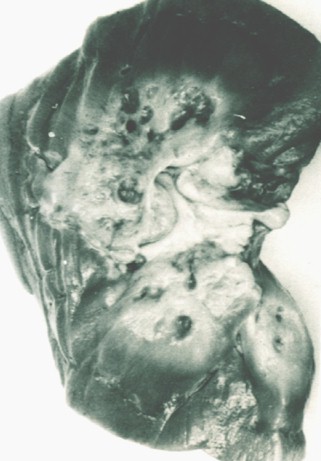
Fig. 17. Riñón esponjoso. Obsérvese los quistes esféricos en los extremos de las papilas renales. (De Ekstrom, T.; Engfeldt, B.; Lagergen, C., y Lindvall, N. Medullary Sponge Kidney. Almquist & Wiksells, 1959).
Esta lesión fue descripta (35) en 1939 por Guerrino Leonarducci (1902-1985), quién fue Jefe del Servicio de Radiología del Hospital Universitario de Padua (Italia) y describió la lesión típica radiológica. Trabajó en ese Hospital Universitario de Padua en equipo junto a Roberto Cacchi (Urólogo) y Vincenzo Ricci (Anatomopatólogo) en 1949 (Fig. 17), quienes establecieron (36) los aspectos clínicos, radiológicos y morfológicos.
Es una lesión que se presenta en la cuarta y quinta década de la vida y no parece tener transmisión genética familiar. Se caracteriza (37) por la dilatación quística múltiple y progresiva de los conductos colectores y tubulares de la región papilar y el diagnóstico se hace por una urografía excretora al exhibir una imagen en esponja de la papila (Fig.18).
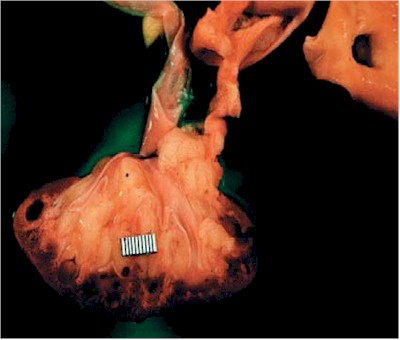
Fig. 18 . Riñón en esponja en estadio terminal. La corteza está groseramente atrófica y el hallazgo prominente es la presencia de papilas con focos de calcificación. Cistyc diseases of the kidney-Brenner et al.
Clínicamente, esta lesión (34) es generalmente asintomática, pero también presenta cólicos, disuria, hematuria o arenillas en la orina; se complica con litiasis en el 20 % de los pacientes y la asociación de hipercalciuria, hipocitraturia, nefrocalcinosis con la formación de cálculos de fosfato y oxalato de calcio, se ha relacionado con el hiperparatiroidismo primario.
Macroscópicamente el riñón está agrandado, normal o retraído; en la corteza tiene cicatrices; en la médula, una, varias o todas las papilas renales contienen quistes; que son pequeños (0,5 mm. de diámetro) y rodeados por una cápsula blanco grisácea y contienen cálculos esféricos.
Microscópicamente, los quistes están cubiertos en su interior por epitelio alto y columnar o plano y cuboideo o raramente de transición. Se comunican mayormente con los túbulos colectores. Presentan cálculos de hidroxiapatita. Los quistes corticales no son un componente del riñón en esponja.
La mayoría de estos pacientes evolucionan bien y en raras ocasiones llegan a la IRCT, y la gravedad de esta se relaciona con las infecciones renales y los cálculos de estruvita.
Aunque la patogénesis no fue dilucidada (36), su asociación con diferentes malformaciones, apoyan la idea de un trastorno del desarrollo. Las mas importantes son la Hemihipertrofia y el Síndrome de Beckwith-Wiedemann, que se asocian con el tumor de Wilms; haciendo una suerte de trilogía relacionada con un locus del cromosoma 11p15, con alteración del gen WT-1 hasta el cromosoma 11p13.
Un segundo grupo de condiciones asociadas con la enfermedad quística medular incluye la dilatación congénita de los conductos biliares intrahepáticos y la fibrosis hepática, y la PQRAD.
En la embriogénesis renal (30), a través de la síntesis de moléculas quimiotácticas, como es el factor neurotrófico derivado de glial (GDNF), el blastema metanéfrico apunta la división del brote ureteral del conducto metanéfrico de Wolff, que se aproxima e invade el blastema. El tope del brote es un receptor GDNF, llamado RET (reordenador durante la transición). El compromiso del uno hacia el otro entre RET y GNF es esencial, no solo para la correcta formación de los uréteres y de los túbulos colectores (que son Wolffianos en su origen), sino para la morfogénesis, nefrogénesis y el crecimiento renal. En particular, la transición de células metanéfricas a células mesenquimáticas del metanefros, a células nefrogénicas. La polarización correcta de las células tubulares y la especialización de los diferentes tractos tubulares del nefrón, necesitan mensajes diferentes desde la interfase brote ureteral/blastema metanéfrico.
Una teoría podría explicar que la interrupción de esta interfase (37) provocaría la ocurrencia concomitante de alteraciones en los túbulos precaliciales y colectores. Sin embargo, si esto depende de la función RET; solo podría explicar la función paratiroidea anormal en vista del rol oncogénico de la proliferación de las células paratiroideas y la asociación con el desarrollo del sistema excretor hepático.
La interfase anormal del brote ureteral con el blastema, podría ser secundaria a influencias ambientales durante el embarazo (drogas, virus, etc.). Esto podría solo estar manejado genéticamente, a pesar de los casos raros de riñón en esponja medular familiar.
La tendencia del uso de la ecografía, TAC y MRN con disminución de uso del Urograma de excreción, probablemente significará que un menor número de casos no serán diagnosticados en el futuro, porque estos no producen imágenes típicas de la enfermedad.
ENFERMEDAD RENAL QUÍSTICA ADQUIRIDA
La Insuficiencia Renal crónica (particularmente pacientes en hemodiálisis de mantenimiento o diálisis peritoneal), está frecuentemente (22) asociada con el desarrollo de quistes pequeños bilaterales múltiples. Estos quistes son usualmente menores a 0,5 cm. de diámetro (14) pero pueden ser tan grandes como 2 a 3 cm.
La edad avanzada, el sexo (mayor en hombres) y la combinación del tamaño renal con cada uno de ellos, son variables que juntas acontecen en un 33 % en la incidencia de quistes renales.
En pacientes con Insuficiencia renal crónica en estadio terminal, se observó un frecuente desarrollo (22) (Kidney vol. 64, Pág. 1019-1064) de quistes y esto es un factor de riesgo de carcinoma de células renales.
A pesar de que se identificó a los genes responsables de la mayoría de los desórdenes quísticos genéticos, la fisiopatología de la formación de quistes está pobremente sobreentendida (54).
Específicamente, no es conocido donde los quistes adquiridos se asocian con algún otro cambio en el parénquima renal (Fig.19). La hipertrofia compensadora (23) y la estimulación hiperplástica resultante de la pérdida de nefrones, podría inducir a la formación de quistes a través del crecimiento tubular aberrante. La incidencia de quistes aumenta marcadamente con la edad, pero donde esto se relaciona con la pérdida de parénquima renal que ocurre con el envejecimiento, es desconocido.
El diagnóstico de esta enfermedad renal quística adquirida (ERQA) se establece por Ecografía y/o Tomografía computada, aunque cada procedimiento tiene algunos resultados negativos falsos. Se distingue de la PQRAD porque no tiene historia familiar y los riñones son más pequeños del tamaño normal.
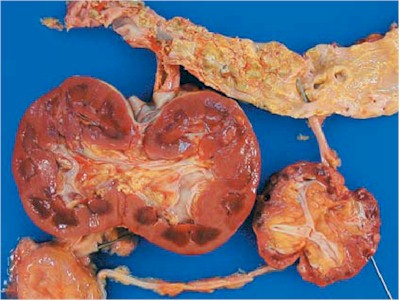
Fig. 19. ERQA: Esta imagen muestra ambos riñones en estado nativo y riñones trasplantados de un paciente con fallo renal prolongado. Los riñones nativos están atróficos y demuestran enfermedad quística adquirida comprometiendo la corteza
ERQA puede empezar antes de ingresar a diálisis, pero su grado de incidencia aumenta progresivamente con el mayor tiempo en diálisis. Entre el 50 al 80 % Estas observaciones sugieren que la duración del fallo renal severo es el mayor factor de riesgo para el desarrollo de los quistes.
Complicaciones: la mayoría son asintomáticos o con episodios de hematuria. En pacientes asintomáticos (Fig. 20), asimismo, estudios radiológicos secuenciales demostraron un aumento progresivo en el número y tamaño de los quistes que pueden complicarse con sangrado o carcinoma renal (17).
La ruptura de un vaso sanguíneo dentro del quiste puede ocurrir en el 50 % de los casos al mismo tiempo; menos frecuentemente la hemorragia puede extenderse dentro de la cavidad peritoneal.
Una revisión de trabajos estimó una incidencia de 0,18 % por año de carcinoma renal. Los carcinomas (21) están usualmente limitados a los riñones, y en aproximadamente la mitad de los casos, son múltiples y bilaterales, un hallazgo que coincide con la naturaleza difusiva de la enfermedad. La asociación de malignidad con ERQA solo ocurriría después del trasplante.
El seguimiento con TAC es más sensible que la ecografía en la detección y características de los quistes, pero generalmente se empieza el estudio con ecografía.
La nefrectomía (17) está indicada en pacientes con tumores grandes (3 cm. de diámetro) o que han aumentado de tamaño con estudios seriados.
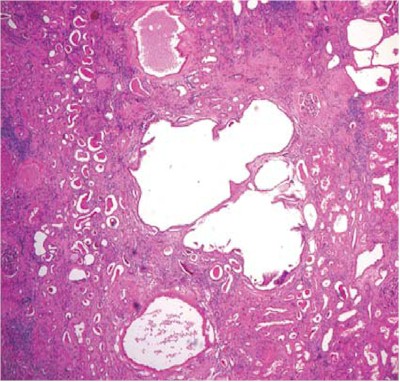
Fig. 20. ERQA: Estos son quistes distribuidos al azar de forma irregular limitados por epitelio aplanado (H&E, 100).