La Leptospirosis en una enfermedad infecto-contagiosa, aguda y febril, causada por una bacteria del género Leptospira que afecta sobre todo a los animales salvajes y domésticos, que sirven como fuente de infección para el hombre, presenta una epidemiología compleja y de distribución cosmopolita. Las prevalencias y tasas de incidencias publicadas para esta enfermedad en el mundo varían notablemente según la zona y pueden llegar a alcanzar valores elevados en tiempos de inundaciones y en los países tropicales y subtropicales.
Dr. Gerardo Álvarez, Dr. Elvys Pérez Bada, Dr. Mario B. Díaz Cabrera, Juan Roly Condori Jamachi.
RESUMEN
La Leptospirosis en una enfermedad infecto-contagiosa, aguda y febril causada por una bacteria del género Leptospira que afecta sobre todo a los animales salvajes y domésticos, que sirven como fuente de infección para el hombre, presenta una epidemiología compleja y de distribución cosmopolita. Las prevalencias y tasas de incidencias publicadas para esta enfermedad en el mundo varían notablemente según la zona y pueden llegar a alcanzar valores elevados en tiempos de inundaciones y en los países tropicales y subtropicales.
A pesar de la existencia del Programa Nacional de Control de la Leptospirosis Humana en Cuba, y de ser una enfermedad fácil de prevenir en su comportamiento, desde 1990 se ha manifestado una tendencia ascendente de la morbilidad y la mortalidad, la leptospirosis se distribuye por todo el país, y el número de casos diagnosticados, que venía en descenso hasta 1987, a partir de ese año se ha incrementado y alcanza tasas de morbilidad de 5,3; 7,2 y 9,8 x 100 000 habitantes en los años 1992, 1993 y 1994, respectivamente. Las provincias más afectadas son: Villa Clara, Ciego de Ávila, Camagüey y Cienfuegos. (1)
Se presenta un trabajo de revisión del tema mortalidad por leptospirosis por constituir un problema de salud en nuestro país y en gran parte del mundo. estudio descriptivo con los datos disponibles en el departamento de estadística del Hospital Arnaldo Milian Castro sobre los 25 fallecidos por leptospirosis en ese centro de salud durante el período comprendido entre 1999 y 2006. Se tabularon según grupos etareos, sexo, lugar de residencia, síntomas que presentaron, tratamiento aplicado, complicación que presentaron, fecha de defunción, realización de la necropsia y ocupación al fallecer.
Existió un predominio de pacientes del grupo etareo entre los15-59 años, seguido por los mayores de 60 años, y en la mayor parte de los pacientes con tratamientos de penicilina y una pequeña cantidad con ceftriaxone, hubo 12 necropsias, entre los que existen 9 casos fueron confirmados por anatomía patológica de leptospirosis ictero-hemorrágica.
OBJETIVOS
Objetivo General
• Identificar algunos aspectos clínicos relacionados con la mortalidad por leptospirosis.
Objetivos específicos
• Describir las principales características de la enfermedad producida por la leptospirosis.
• Revisar y describir los factores que influyeron en la mortalidad por leptospira.
INTRODUCCION
La Leptospirosis es una zoonosis de distribución mundial, producida por una espiroqueta de las cepas patógenas del género Leptospira, que afecta tanto a los animales silvestres y domésticos así como al hombre (Thiermann, 1984). El período de incubación varía entre 2 y 30 días para luego establecerse la enfermedad clínica clásica con 2 fases: la leptospirémica que comienza con la entrada del germen por la piel cortada o las mucosas expuestas, dura aproximadamente 7 días y se caracteriza por comienzo brusco, cefaleas, mialgias intensas, escalofríos, fiebre, sufusión conjuntival y, aunque raro, hepatoesplenomegalia, la segunda fase comienza con la aparición de anticuerpos específicos. Aquí suele desaparecer la fiebre, pero pueden haber recaídas. Después de la primera semana puede encontrarse pleocitosis en el líquido cefalorraquídeo. También son hallazgos: iridociclitis, neuritis óptica y neuropatía periférica. (1,2) La principal lesión orgánica suele ser una nefritis intersticial, seguida en frecuencia por el daño hepático y meningitis aséptica.1-3 Entre las formas graves está la enfermedad de Weil, con falla renal aguda (FRA) y daño hepático, usualmente leve. A ésta se le atribuye la mortalidad por esta entidad nosológica.1-4 Recientemente se ha descrito una variante de la afección que comienza con hemoptisis y síndrome de dificultad respiratoria del adulto (SDRA).
Los países tropicales y subtropicales son los más afectados pues las condiciones climáticas como: precipitación, temperatura, humedad relativa así como el pH, estructura y la composición de suelo) más favorables a su presentación.
En la ganadería su importancia radica sobre las pérdidas económicas que produce en la reproducción donde puede aparecer, mortinatos, abortos y/o nacimientos de animales débiles e infertilidad. Resulta difícil estimar las pérdidas por este concepto, en gran parte por las dificultades inherentes al diagnóstico de la enfermedad. También, se debe añadir los gastos en medicamentos referentes a las personas que enferman por leptospira.
La OMS ha estimado una tasa de incidencia en humanos entre 4-100 casos por 100 000 habitantes en casos de países tropicales y subtropicales y ha descrito un brote en China con una incidencia de 1300 casos por 100 000 habitantes (OMS., 1998). En el continente americano, ha sido publicado la prevalencia en algunos países como: México 14,1 %, Argentina 38 %, Brasil 9,8 %. Cuba 12 %, Salvador 17,5 %, y Colombia 18,5 % .(2). Pero se debe saber que ni el tamaño de muestra ni el grupo de alto riesgo se tomó en cuenta. En octubre de 1995, en Achuapa, Nicaragua, se registraron 2 000 casos y 40 defunciones en humanos que representaban una enfermedad febril hemorrágica; inicialmente se estableció un diagnóstico de dengue hemorrágico, pero las pruebas serológicas fueron negativas para esta enfermedad y posteriormente se confirmó el diagnóstico de Leptospirosis (3). En este mismo país, en el período posterior al huracán Mitch se registraron 523 casos sospechosos de Leptospirosis, con 7 personas muertas por esta causa, lo cual representa una tasa de letalidad de 1,3 % (4).
En Cuba, la mayor tasa de incidencia en la población humana fue en 1994 cuando el país obtuvo una tasa de 25,6 por cada 100 000 habitantes, siendo en 2003 1,9 por cada 100 000 habitantes (5).
A pesar de la existencia del Programa Nacional de Control de la Leptospirosis Humana en Cuba, y de ser una enfermedad fácil de prevenir en su comportamiento, desde 1990 se ha manifestado una tendencia ascendente de la morbilidad y la mortalidad, la leptospirosis se distribuye por todo el país, y el número de casos diagnosticados, que venía en descenso hasta 1987, a partir de ese año se ha incrementado y alcanza tasas de morbilidad de 5,3; 7,2 y 9,8 x 100 000 habitantes en los años 1992, 1993 y 1994, respectivamente. Las provincias más afectadas son: Villa Clara, Ciego de Ávila, Camagüey y Cienfuegos. (1)
Se presenta un trabajo de revisión del tema mortalidad por leptospirosis por constituir un problema de salud en nuestro país y en gran parte del mundo. Estudio descriptivo con los datos disponibles en el departamento de estadística del Hospital Arnaldo Milian Castro sobre los 25 fallecidos por leptospirosis en ese centro de salud durante el período comprendido entre 1999.
DESARROLLO
Antecedentes
Aunque desde hace décadas se sabe que en Cuba existen casos de Leptospirosis, no se conoce la magnitud del problema debido a que esta enfermedad no formaba parte de las Enfermedades de Declaración Obligatoria y a que el Ministerio de Salud Pública no contaba con la técnica de laboratorio para identificar su agente.
La notificación de Enfermedades de Declaración Obligatoria emanado del Ministerio de Salud establece que la Leptospira sp., agente de la Leptospirosis, será objeto de Vigilancia de Laboratorio, bajo la responsabilidad del Ministerio Salud Pública. Esta Vigilancia permitirá investigar los riesgos a que estuvieron expuestas las personas que enfermaron, a fin de adoptar las medidas de intervención ambiental tendientes a prevenirlos o corregirlos.(6).
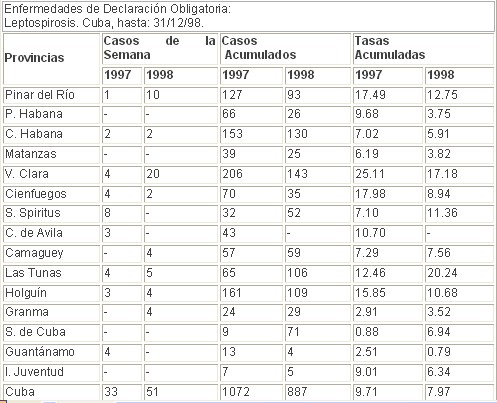
Fuente: EDO.GIE/IPK. Tasa x 100 000 Hbts no ajustada al período
La identificación de las situaciones de riesgo, dadas principalmente por problemas de saneamiento ambiental y concentración de animales susceptibles de transmitir la enfermedad, así como el análisis integrado de toda la información recopilada permitirán determinar medidas de intervención efectivas.
Las medidas de Salud Pública requieren de la participación de variados actores y, en ocasiones, involucran el accionar de toda la comunidad. Este documento entrega algunas herramientas básicas para la identificación de la enfermedad y la prevención de la infección por Leptospira sp.
La leptospirosis es una enfermedad febril aguda, que afecta a algunos animales y al ser humano. Es producida por una bacteria espiroqueta, del género Leptospira. La enfermedad puede ser leve o mortal, especialmente cuando compromete el hígado, riñones o sistema nervioso. El primer caso humano de Leptospirosis fue descrito en 1886, como una enfermedad con ictericia severa y fue referida como enfermedad de Weil. De ahí que a menudo se utilice también este nombre, fundamentalmente durante la segunda fase de la enfermedad. Sin embargo, la enfermedad no siempre se presenta con ictericia o complicaciones orgánicas e incluso puede no presentar síntomas o semejar una gripe.


Espiroqueta, debe su nombre a su forma de espiral Leptospira interrogans icterohaemorrhagiae.
Las espiroquetas son células helicoidales flexibles, que miden de 0,1 um de diámetro y 6 a 24 um de largo. La Leptospira es una bacteria estrechamente enrollada, aeróbica, que vive por largo tiempo en agua fresca, estiércol, barro y ambientes marinos, en asociación con animales y seres humanos.
Se conocen dos tipos de Leptospira: L. interrogans, patógena para el hombre y animales y L. biflexa, que no provoca enfermedad.
La L. interrogans tiene a su vez más de 200 variantes serológicas, que se asocian con distintos animales y afectan a diferentes órganos, siendo cada una responsable de estados mórbidos más o menos benignos. Sin embargo, estudios genéticos de la Leptospira han demostrado que en un mismo grupo genético pueden haber varios serotipos diferentes.(7).
FUENTES DE INFECCIÓN
La principal fuente de contagio para el hombre constituye, la orina de animales enfermos, reservorios naturales así como el contacto directo con estos animales. También las aguas contaminadas, leche cruda, descarga vaginal, feto de animales infectados y fetos abortos etc. Siendo considerada como enfermedad profesional. La infección en granjeros, veterinarios, trabajadores de mataderos, médicos de inspección de carne, trabajadores de control de roedores.
Ocupaciones que requieren contactos con animales. El contacto directo y/o indirecto es importante para alcantarillados, mineros, soldados, trabajadores de higiene y de pesca, trabajadores de ferias de animales y de canal, arroceros, trabajadores de platanales y cortadores de caña de azúcar.
Para los animales, constituye la orina de animales infectados, asintomáticos y portadores; también el agua, leche, forrajes, pastos, tejidos de animales, descargas posparto, saliva, semen, instrumentos quirúrgicos así como vectores siendo los roedores (ratas y ratones) los más importantes por su condición de reservorio natural. Algunos autores han considerado las garrapatas, aves e insectos como; moscas, mosquitos, etc.
AGUA: Para que ocurra la infección en el medio, las Leptospiras necesitan una supervivencia en este medio primero, la cual tiene una vinculación tremenda con la humedad relativa alta y la temperatura a su punto óptimo en el lugar de aparición. La temperatura del agua tiene un efecto beneficioso, ya sea baja o alta. Las bajas diminuyen la multiplicación de los microorganismos, pero el tiempo de supervivencia aumenta y las altas temperaturas favorecen la multiplicación, pero con menos tiempo de supervivencia. Esto permite que las Leptospiras puedan sobrevivir y mantener sus capacidades infectantes en el agua durante 22 días y en el barro 5-6 días. Como las infecciones por este agente ocurren principalmente en zonas con abundante cantidad de agua; en áreas pantanosas o de campo anegado, los brotes son frecuentan en épocas de lluvia y en climas templados. A pesar de todo esto, no todas las aguas son favorables para la supervivencia de las Leptospiras, ya que éstas también se ve afectados por el pH y la salinidad.
ORINA: Muchas infecciones en última instancia se deben a la contaminación con la orina de los animales enfermos, portadores o reservorios; siendo el pH el factor determinante de la supervivencia de las Leptospiras en la orina. Ellas no pueden sobrevivir en pH ácido, por eso, algunos autores plantean que la orina del hombre y la de los ratones y ratas no son fuentes de excelencia para la infección al no ser que sean diluidas por agua. La orina de los bovinos se considera como la de mayor excelencia para una fuente de infección ya que su orina es de pH alcalino lo que favorece la supervivencia del germen y en 1 ml de orina puede contener hasta 100 millones de microorganismos de Leptospira. Además, la orina de muchos animales presenta aglutininas y lisinas especificas, cuya presencia causan una disminución en el tiempo y del número de microorganismos.
LECHE: Los animales infectados, muchos eliminan Leptospiras a través de la leche. Debido a la presencia de sustancias antimicrobianas, la supervivencia en la leche cruda es muy corta. La infección humana por el consumo de la leche cruda de animales infectados y/o convalecientes hasta tres días después del ordeño ha sido notificada.
TEJIDO ANIMAL: El tiempo de supervivencia de las Leptospiras en los tejidos es dependiente del pH postmortem y el efecto antagónico que supone la contaminación con otras bacterias. Lo que avala la capacidad infectante de los tejidos del animal principalmente en los mataderos y al parto.
DESCARGAS POSPARTO: Ellis (1983) demostró que las descargas posabortos pueden mantener sus capacidades infectantes pasado 8 días de éste, mientras Ellis, (1983); Prescott, (1993); Ellis, (1994); Guijarro y Calvo, (1999) diagnosticaron la posibilidad de infección por contacto con las descargas uterinas posparto y pos- abortos.
SALIVA: Desde que fue comprobada la infección en el humano tras mordeduras de animales como la rata o el perro, la saliva ha sido considerada como posible fuente de infección. También se sospecha los lamidos de los perros a los niños, con la lengua contamina mecánicamente, podría ser una forma más.
AVES: Desde que en algunas zonas de España y Francia ocurrieron brotes de Leptospira en humanos en los años 50 del siglo XX del, serovar ballum y con la coincidencia de que ciertas aves cuya ruta migratoria afectaba tanto al Delta del Ebro en España, como al Delta de Ródano en Francia, dio lugar para que algunos científicos las consideren como posible fuente de infección. Por la posibilidad de que estas aves consumieran ratones infectados y probablemente, se convirtieran ellas mismas en vectores mediante la eliminación de las Leptospiras en sus fluidos. Algunos han considerado que podría ser las garrapatas que funcionaron como posibles transmisores hacia los lugares.
FACTORES ASOCIADOS A LA INFECCIÓN
DEPENDIENTES DEL AGENTE ETIOLÓGICO
A) Resistencia a condiciones medioambientales, la supervivencia del agente depende de la existencia de una humedad relativa alta, temperatura óptima entre 24-25 0C, pH neutro o ligeramente alcalino y presencia de materia orgánica. Siendo estas condiciones indispensables para la existencia de la infección en una región geográfica. Por ello, las áreas con lagunas, riachuelos (bebederos en general) donde se congregan un gran número de animales, son las que más frecuentemente están implicadas en los focos de Leptospirosis. En este sentido, existen diferencias entre serogrupos o serovares como pomona que es más capaz de sobrevivir mejor en zonas áridas.
Estos factores ambientales propicia la existencia de una cierta estacionalidad en la presencia de la enfermedad, siendo más frecuente en otoño en países templados y en invierno en los países tropicales y subtropicales; épocas ambas de lluvias.
B) Capacidad infectante: los estudios han demostrado que la capacidad infectante y la patogenicidad varían en función del serogrupo o serovar en cuestión.
DEPENDIENTE DEL HOSPEDERO
A). EDAD: Los estudios realizado por Ellis y Michna, (1976) revelaron un 40 % de seropositividad con anticuerpos leptospirales en terneros hasta un año de edad y 72 % en los adultos de hasta tres años de edad, donde ésta ha sido relacionada con el estado de portador renal en la última; mientras los animales pequeños se caracterizan por eliminar mayor cantidad de Leptospiras en su orina. En bovino, la morbilidad se calcula hasta 75 % en los adultos y hasta 100 % en los terneros, donde en este último la letalidad es de 5 %. En los seres humanos la presentación se frecuenta en las edades entre 20-40 años mientras López et al., (2002) pronostican entre 20- 49 años. En humano la mayoría de los autores platean que entre 90-95 % de los casos de Leptospirosis corresponde a la forma anicterica y de 5-10 % representa la forma ictérica (Síndrome de Weil).
B). GESTACION: Las publicaciones disponible demuestra que el aborto por Leptospirosis se produce principalmente en los últimos estadio de la gestación entre los 6 y 9 meses, además, se supone que la infección parece producirse varias semanas antes, ya que el período de incubación en los casos de abortos suele ser largo, además el aborta casi siempre en la mayoría de las especies es provocado por serovares accidentales.
C). ESTADO INMUNITARIO: En sentido general, un animal expuesto previamente, es refractario a la reinfeccion de este mismo serovar aunque los niveles de anticuerpos en sangre hayan bajado. También tiene relación con el nivel se inmunoglobulina (IgA e IgG) ya que aumento de estos en la orina hace disminuir la cantidad de Leptospira que se elimina en ella.
D). FACTORES GENETICOS: Van der Hoeden, (1958) plantea que algunas cepas de ratones parecen tener más resistencia a la infección siendo la letalidad baja en este grupo y la protección que se desarrolla es más duradera. También esta conclusión fue hecha en terneros de diferentes grupos donde algunos mostraron signos benignos transitorios mientras hubo letalidad en los otros.
DEPENDIENTES DEL MEDIO
A. ALIMENTACION: Algunos autores han considerado este factor, ya Leonard et al., (1992a, 1993) demostraron que, en los animales alimentados con ensilaje de grano como suplemento, provocaba que el pH bajara más al nivel ácido, reflejando en la orina la eliminación de poca cantidad de leptospira.
B. INFECCIONES CONCURRENTES: Ha quedado demostrado que después de una infección cualquiera, aumenta la receptividad de estos animales en contraer al leptospirosis, lo que Van der Hoeden, (1958) descubrió en un brote grave de Leptospirosis por L. canicola en cerdos, de los que se aisló simultáneamente Salmonella suipestifer.
C. APTITUD Y MANEJO: En la explotación ganadera, se plantea que por la separación temprana de los terneros de sus madres en la industria lechera hace que en estos animales la Leptospirosis sea más frecuente que en los de carne, una vez introducida en la explotación, convierten en alto factor de riesgo para ellos. Además el sistema intensivo que se practica favorece la transmisión entre ellos por el hacinamiento.(2)
TRANSMISION
La Leptospirosis es catalogada como zoonosis, pues forma parte del grupo de enfermedades que se transmite entre animales y seres humanos. La Leptospira se asocia con animales domésticos y silvestres, como perros, gatos, bovinos, caprinos, porcinos, caballos, roedores y mamíferos marinos (lobos de mar), entre otros.
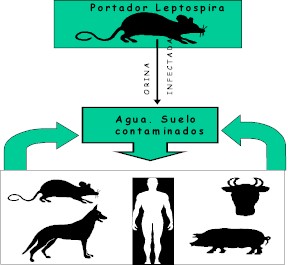
La bacteria se transmite fundamentalmente a través de la orina de animales infectados, aunque puede encontrarse también en otros fluidos corporales. Los animales infectados, especialmente los roedores y animales silvestres, generalmente no presentan síntomas. La Leptospira se elimina rápidamente de todos los tejidos, excepto del cerebro, los ojos y los riñones, donde sobrevive y se multiplica para luego eliminarse a través de la orina. La bacteria permanece en el huésped por semanas o meses y, en el caso de los roedores, puede reproducirse y ser eliminada durante toda la vida.
Una vez que es excretada viva por el huésped, sobrevive por semanas o meses en el agua y en el suelo. Tanto el ser humano como los animales adquieren la infección por contacto directo con agua contaminada, desde donde penetra en el cuerpo a través de erosiones o cortes en la piel y de las mucosas de ojos, nariz y boca. El ser humano también puede contraer la enfermedad por contacto directo con sangre, tejidos, órganos y orina de animales infectados. Aunque es infrecuente, es posible infectarse al ingerir agua o alimentos contaminados. La transmisión persona a persona es extremadamente rara.
Los roedores son los principales reservorios de la bacteria y, por lo tanto, los animales que la transmiten con mayor frecuencia al hombre. Las ratas, son reservorios del serovar icterohemorrhagiae, que provoca ictericia y causa una de las formas más graves de la enfermedad. (8,9)
VIAS DE TRANSMISION
Las principales vías de transmisión se clasifican en: Directa e Indirecta.
HORIZONTAL DIRECTA:
Esta forma de transmisión es la más frecuente en los casos de serovares adoptados como arrijo.
A. Contacto directo: Esta vía es la más estudiada además de tener diversas formas. La forma venérea fue tomada en consideración después que fue demostrada la presencia de Leptospira el en semen de un toro. Se considera como la fundamental en algunas especies cuyos habitats se encuentran en áreas de condiciones climáticas favorables o de densidad poblacional desfavorables para la transmisión de la enfermedad de otra manera como ocurre con la musaraña común en zonas de Polonia o Rusia, donde se han observados varia epizootias de Leptospirosis en estos animales; asociadas a las épocas más secas del año, que por lo general, coincide con la época de la reproducción. En humanos se diagnosticó la infección de una mujer luego de contacto sexual con su pareja durante la fase de leptospiruria . Además de la venérea, la costumbre de los bovinos y perros de lamer los genitales y/o otras áreas corporales de sus compañeros, puede permitir también la transmisión de la infección.
B. Núcleos goticulares: Tienen importancia ya que las gotas de orina dispersan a varios metros del animal que orina, pudiendo penetrar las Leptospiras procedentes de animales con leptospiruria, tanto por inhalación como por vía conjuntival.
HORIZONTAL INDIRECTA:
Esta desempeña un papel fundamental en las infecciones accidentales ya que se produce tras la exposición al ambiente contaminado con material infectante.
A. Fomites: El agua, alimentos, pastos y suelos contaminados pueden facilitar el contacto entre el animal- humano y el agente. La forma importante y más frecuente para la infección humana y animal es el contacto de la piel o las mucosas con aguas o barro contaminados con orina y el contacto con órganos de animales enfermos en el matadero. Los pastos contaminados juegan un papel importante para la transmisión intra e interespecie.
B. Vectores: Diversos autores han evaluado la hipótesis de que los artrópodos podrían jugar un papel relevante en la transmisión mecánica del agente.
VERTICAL
A. Transplacentaria: El agente puede atravesar la placenta durante el período de leptospiremia, tal y como se ha demostrado tanto en el ganado bovino, el cerdo y en el ser humano. Un caso especial sería la posibilidad de la infección del feto en el momento del parto, si esto no ha ocurrido anteriormente durante la gestación.
B. Galactófora: Puesto que la infección por L. hardjo y L. pomona pueden producir una mastitis clínica , los microorganismos presentes en la glándula mamaria podrian ser excretada con la leche e infectar al ternero por vía oral. En caso de ser humano, esta forma de transmisión es poco estudiado, pero sí hay informes al respecto.
C. Vía oral: En humano, por la ingestión de alimentos contaminados con la orina de animales enfermos o de reservorios. Antes se consideraba como una vía importante, pero hoy se le da poco valor como modo de transmisión (2)
CUADRO CLÍNICO
La forma más común y leve en que se presenta la enfermedad es la leptopirosis anictérica y con frecuencia es bifásica. La fase inicial o "septicemia" se inicia con fiebre repentina de 39 a 40° C, escalofríos, dolor abdominal, cefalea intensa y mialgias (principalmente en las pantorrillas). Existe sufusión conjuntival intensa.
Después de uno a 3 días de mejoría de los síntomas y ausencia de fiebre da comienzo la segunda fase o "inmunológica", en este momento la leptospira solo se encuentra en riñón y aparecen anticuerpos específicos. En la primera fase de la enfermedad, y en el inicio de la meningitis, se observa una recurrencia de los síntomas. Puede haber uveítis. Exantema y adenopatía.
La enfermedad suele curar espontáneamente, durando de 4 a 30 días y como regla la recuperación es completa.
La leptopirosis ictérica (enfermedad de Weil, causada por icterohaemorrhagiae) es la forma más grave de la enfermedad y su sintomatología se caracteriza por un deterioro de las funciones mentales. Renales y hepáticas, hipotensión y mortalidad de 5 a 10%.
Los signos y síntomas son continuos y no bifásicos.
Durante la segunda guerra mundial se presentó una forma de leptopirosis leve, causada por Leptospira antummalis y se caracterizo por provocar un eritema en placa en la piel de las piernas o exantemas generalizados con fiebre.
La leptopirosis sin ictericia casi nunca es mortal, y cuando esta aparece la mortalidad es del 5% en menores de 30 años y de 30% en mayores de 60 años.
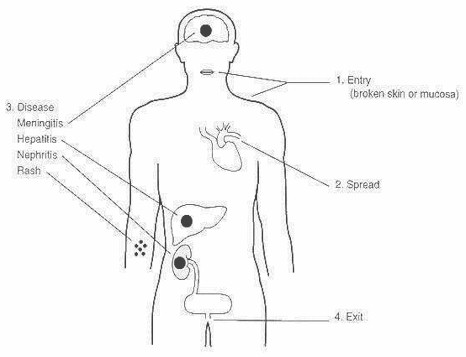
En el ser humano, la bacteria sigue un ciclo similar al que realiza en los otros huéspedes.
La bacteria penetra al cuerpo por la piel o mucosas, se disemina por la sangre atacando diversos órganos y se elimina por la orina.
El tiempo de incubación, es decir, desde que la bacteria penetra al cuerpo hasta que aparecen los primeros síntomas va de 2 días a 4 semanas. La enfermedad se presenta en forma brusca, con síntomas similares a los de la gripe:
- fiebre,
- dolor de cabeza,
- mialgia (principalmente de pantorrillas y región lumbar)
- malestar general o postración,
- náuseas o vómitos,
- dolor abdominal,
- diarrea y
- artralgia.
Luego de esta primera fase y de un período sin molestias se puede presentar una segunda fase de mayor gravedad, dependiendo del serogrupo de la bacteria infectante. Este segundo período es llamado también enfermedad de Weil. Entre sus síntomas, se pueden dar:
- irritación conjuntival,
- irritación meníngea y rigidez de nuca,
- insuficiencia renal,
- ictericia,
- manifestaciones hemorrágicas intestinales o pulmonares,
- arritmia o insuficiência cardíaca o disnea,
La enfermedad dura desde unos pocos días hasta tres o más semanas, dependiendo de su gravedad. La mayor parte de las personas presentan sólo una primera fase, con síntomas moderados o sin ningún malestar. La segunda fase puede ser grave y, si no es tratada en forma adecuada y a tiempo, puede tener una recuperación lenta, de hasta varios meses, y dejar secuelas renales o derivar en la muerte (10)
PATOGENIA
La leptospirosis es una zoonosis con amplia distribución mundial. El hombre la puede adquirir usualmente al entrar en contacto la piel lesionada o las mucosas, con aguas contaminadas con la orina de animales portadores de la bacteria, principalmente roedores.(11)
Desde hace muchos años se conoce que esta infección en el hombre tiene generalmente una evolución bifásica (11,12) correspondiendo los primeros días a la fase septicémica caracterizada por fiebre alta, cefalea intensa, dolores osteomusculares, ataque al estado general, para luego pasar lentamente, a la fase denominada de compromiso inmunológico. Durante la fase septicémica, puede aislarse la bacteria de la orina, sangre y otros fluidos. Durante la segunda fase aparece un compromiso de múltiple órganos y sistemas y es poco frecuente el aislamiento de la bacteria de líquidos corporales. Dados estos hechos clínicos, todavía no se ha demostrado una "toxina bacteriana" responsable de estos fenómenos, por lo que se han investigado exhaustivamente diversos ángulos del problema.
Es conocido que en la leptospirosis se compromete el sistema nervioso en la forma de meningoencefalitis y neuritis periférico, el hígado por la presencia de hepatomegalia dolorosa con aumento de las bilirrubinas totales, tanto de la fracción directa como indirecta y clásicamente, con aumentos leves a moderados de las transaminasas, con elevación en los valores de la fosfatasa alcalina, lo que ha sido interpretado como una alteración en los mecanismos excretores hepáticos más que una verdadera lesión necrótica tisular como se observa generalmente en las hepatitis virales. En los pulmones se ha demostrado desde una neumonitis leve hasta hemorragia pulmonar masiva y síndrome de distress respiratorio del adulto. Es frecuente la insuficiencia renal severa que en ocasiones amerita tratamiento con hemodiálisis y que es de una alta mortalidad. Las mialgias severas así como aumentos importantes en las enzimas creatinfosfokinasa y la deshidrogenasa láctica y la demostración de mioglobinuria, son datos que indican un compromiso importante de los músculos esqueléticos, en la forma de rabdomiolisis.
La trombocitopenia es una complicación de gran relevancia (13).
Algunos pacientes pueden cursar con alteraciones electrocardiográficas importantes (14).
Este compromiso multisistémico es difícil de explicar desde un punto de vista "unicausal".
Las leptospiras son espiroquetas que presentan una gran movilidad, lo que les permite un rápido desplazamiento. Poseen diversa enzimas como hemolisinas (15), esfingomielinasa, fosfolipasa y hemaglutininas (16) las que facilitarían su ingreso al hospedero. Son más fácilmente fagocitadas al ser opsonizadas por Ig G específicas (17)
Se ha demostrado que el lipopolisacárido (LPS) de las leptospiras patógenas, activa los macrófagos, linfocitos B y en menor medida a linfocitos T y células NK. Se ha observado una disminución transitoria de los linfocitos T CD4+ así como una expansión policlonal de los linfocitos B (18), lo que sugiere una causa autoinmune por mimetismo molecular. En animales de laboratorio, los cambios morfológicos en riñones y en pulmones inducidos por variedades patógenas de leptospiras, son más severos en sujetos depletados de linfocitos T CD4+ y CD8+, lo que sugiere un papel protector importante de los mecanismos inmunológicos dependientes de células. (19)
Los macrófagos estimulados producen interleucina 1 e interferón y tienen una mayor actividad bactericida, medida por la prueba del NBT y la quimioluminiscencia. (20) Masuzawa et al (21) demostraron que el LPS era el componente inmunodominante. No obstante, se ha establecido, in vitro, que el LPS de las leptospiras es menos activo biológicamente que el de algunas enterobacterias (22)
Se ha demostrado la producción de factor de necrosis tumoral en pacientes con leptospirosis y se ha asociado a la reacción de Jarisch-Herxheimer (23), pero principalmente se ha relacionado la presencia de este factor con la severidad y con la mortalidad de la enfermedad. (24)
L. interrogans muestra in vitro la capacidad de adherirse a la membrana y de penetrar al citoplasma de células eucarióticas, lo que puede ser inhibido por proteasas, suero inmune de conejo y por el calor (25), lo que demuestra la capacidad invasora de las leptospiras patógenas. L. biflexa no muestra capacidad invasora in vitro.
En algunos pacientes con leptospirosis severa se ha logrado identificar altas concentraciones de anticuerpos anticardiolipina de la clase Ig G. (26) Esto sugiere que la leptospira podría ocasionar una lesión endotelial, con la exposición de antígenos "crípticos" o con la producción de cambios conformacionales en los fosfolípidos por acción de fosfolipasas propias.
Galli (27) demostraron complejos inmunes en vasos sanguíneos, músculo esquelético, corazón, riñones y en el hígado de pacientes con leptospirosis. Nicodemol (28), en un excelente estudio lograron demostrar en pacientes con leptospirosis fallecidos con hemorragia pulmonar o con síndrome de distress respiratorio del adulto, antígenos de la bacteria adheridos a la membrana endotelial de capilares pulmonares así como dentro del citoplasma de los mismos, además, lesiones importantes de la células endoteliales pulmonares y agregación plaquetaria endotelial. Los autores proponen que la trombocitopenia da origen a los fenómenos hemorrágicos encontrados en un gran porcentaje de pacientes con leptospirosis. Esta trombocitopenia no es causada por una destrucción periférico ni por déficit en su producción medular(13), sino por la activación, adhesión y agregación plaquetarias, estimulado todo esto por la lesión endotelial de múltiples causas, (probablemente por complejos inmunes) ya sugerida por la presencia de anticuerpos antifosfolípidos anteriormente citada.
Younes-ibrahim (29) demostraron en animales de laboratorio que una fracción glicoproteica de L.interrogans (endotoxina) exhibe una potente actividad inhibitorio sobre la Na-KATPasa renal. Los autores especulan que si esto se lograse demostrar para otras Na-K-ATPasas en humanos, podríamos estar en la presencia del primer evento fisiopatológico en la leptospirosis que explicaría alteraciones tales como la insuficiencia renal y los cambios en el funcionamiento hepático.
En la figura 1 (30) se esquematiza una propuesta de los eventos patogenicos en la leptospirosis, con el fin de entender mejor esta entidad clínica.
En resumen, se han realizado grandes avances en los últimos años para la comprensión de la patogénesis de la leptospirosis; no obstante, deben estudiarse con mayor profundidad los mecanismos de adhesión a las células eucariotas hospederas, los receptores celulares involucrados, los mecanismos por medio de los cuales se produce la lesión endotelial y celular en general así como los antígenos bacterianos involucrados en estos fenómenos, entre otras cosas.
Diagnóstico
Se debe realizar la confirmación de la entidad basándose en el diagnóstico epidemiológico, clínico y de laboratorio. Además, a todo fallecido con síndrome febril prolongado, de origen desconocido, con sospecha o diagnóstico clínico, serológico y/o epidemiológico de leptospirosis, debe realizársele estudio anatomopatológico. (31)
Diagnóstico epidemiológico
Los verdaderos reservorios de la infección son los animales que tienen leptospiruria prolongada y generalmente no sufren ellos la enfermedad, siendo los múridos (ratas y ratones) ejemplos fehacientes de albergar icterohemorragiae y rara vez sufrir lesiones (32,33,34).
Los perros podrían tener una importancia epidemiológica similar debido a su estrecha relación con el hombre. Cada serovars tiene su o sus huéspedes animales, pero cada animal puede ser huésped de uno o varios serovars. El conocimiento de las variables relacionadas con la adquisión de la infección en los animales tiene gran importancia para el diseño de políticas de control a nivel local (35)
La vía más común es la directa, por medio del agua, suelo y alimentos contaminados por orina de animales infectados (32,36,37)
La transmisión interhumana resulta rara y excepcionalmente ha ocurrido a través del coito. Sin embargo, cuando ocurre en una gestante puede producirse la infección fetal por la vía transplacentaria, lo que da lugar a abortos, prematuridad, y muy raras veces a formas congénitas de la enfermedad.4,8 El hombre es huésped accidental, y sólo en condiciones muy especiales puede contribuir a mantener un brote epidémico.
Los grupos de mayor riesgo son los hombres jóvenes. Las personas que trabajan con ganado están expuestas a la orina de los animales, al igual que los trabajadores de arrozales, pues los roedores infectan los campos. Los cañeros igualmente constituyen otro grupo de alto riesgo, conjuntamente con los trabajadores del alcantarillado, los mineros, los plomeros, los veterinarios, los empelados de mataderos, los militares, y en condiciones accidentales, los bañistas, los excursionistas expuestos a agua dulce y manipuladores de pescado (32,37)
El actual deterioro de las condiciones higiénico sanitarias debido a la difícil situación socioeconómica, unido a la tendencia y crianza de los animales en zonas urbanas y suburbanas sin cultura para estos cuidados, han constituido condiciones favorables para la explosión epizoótica y epidemiológica en estas zonas. (38)
La no identificación de estos como nuevos grupos de riesgo, y la no inmunización de ellos, los hace más vulnerables a esta entidad y ha originado que la morbilidad y la mortalidad se inclinen hacia jubilados, amas de casa y otras ocupaciones que, después del cumplimiento de su jornada laboral, se dedican a estas labores. Es sobre estos nuevos grupos de riesgo donde se deben centrar todas las acciones educativas, la dispensarización y aplicación de la inmunización antileptospirósica para intervenir y modificar el cuadro epidemiológico.
Según un estudio reciente de Chami-zo, Cruz de la Paz y Borroto, la posibilidad que tiene el agente de vivir en el medio exterior aumenta enormemente la probabilidad que tiene de pasar al huésped accidental, ya que no requiere la coincidencia espacio temporal de ambos si el ambiente es favorable,(39).Por consiguiente, para que se constituya un foco de leptospirosis es necesario que además de los animales portadores, existan condiciones ambientales idóneas para la supervivencia del agente causal en el medio exterior. Entre estos factores podemos citar un alto grado de humedad ambiental, pH neutro o ligeramente alcalino, una temperatura elevada, la composición fisicoquímica y biológica del suelo (población microbiana), precipitaciones abundantes, así como también terrenos bajos, anegadizos, receptáculos naturales o artificiales de agua dulce (arroyo, lagunas, embalses y otros) que son favorables para que prolifere la contaminación; el agua salina, sin embargo, le resulta deletérea. Todo esto contribuye a que las regiones tropicales sean áreas endémicas de leptospirosis (40).
Diagnóstico clínico
Esta enfermedad tiene un período de incubación promedio de 1 ó 2 semanas con límites entre 2 y 20 días. Es de curso bifásico y se caracteriza por una fase bacteriémica o septicémica que desarrolla un cuadro infeccioso agudo durante 7 a 10 días; y otra fase llamada leptospirúrica o inmune que se prolonga desde semanas a algunos meses.(32,34,41,42). Las manifestaciones clínicas son variables y presentan diferentes grados de severidad. La gravedad depende de las variedades serológicas de que se trate. Numerosos casos transcurren de forma inaparente, y en las zonas de leptospirosis endémica, la mayor parte de las infecciones no se manifiestan por signos clínicos, o son demasiado leves como para diagnosticarse de manera definitoria.1 Puede producirse una infección aguda, subaguda y crónica, y en general se distinguen 2 tipos clínicos; el ictérico y el anictérico (43,44)
El tipo ictérico o hepatonefrítico (enfermedad de Weil) es mucho menos frecuente que el anictérico. Los síntomas se instalan bruscamente con fiebre, cefalea, mialgias, conjuntivitis, postración, siendo comunes las petequias en la piel, gastro-intestinales, insuficiencia hepática y renal. Son marcadas la oligoanuria y el desequilibrio electrolítico. Si evoluciona a la curación, la convalencencia pude durar 1 ó 2 meses, período en que pueden reaparecer los síntomas (41,42)
Los casos anictéricos son más frecuentes, su sintomatología es más leve, a veces se diagnostica erróneamente como meningitis o influenza. La leptospirosis puede continuar por unas semanas o varios meses después de desaparecer los síntomas.
Diagnóstico de laboratorio
En nuestro país el diagnóstico de laboratorio se realiza fundamentalmente por la técnica de hemoglutinación pasiva que tiene una sensibilidad del 92 % y una especificidad de 95 %, es rápida y de bajo costo, detectándose IgM a través de ella, lo cual permite el diagnóstico de las infecciones recientes. También se efectúa por la hemólisis pasiva que es más sensible que la anterior, pero más complicada; además por la microaglutinación que no es realizada en todos los laboratorios, pues requiere de cultivo de leptospira (44)
Durante la primera fase de la enfermedad, el paciente aún no ha elevado los títulos de anticuerpos. A partir de los 6 ó 7 días es que comienzan a incrementarse, por lo que el diagnóstico se realiza observando las leptospiras en sangre en los primeros 7 días, o en el líquido cefalorraquídeo entre el 4to. y 10mo. días por microscopia del campo oscuro, tomándose las muestras para realizar el cultivo del microorganismo que dura días o semanas.
Este método es muy costoso y difícil, y no se realiza en todos los laboratorios,(45). En la segunda fase, el diagnóstico se confirma observando la leptospira en la orina al microscopio de campo oscuro, lo que se dificulta por la acidez de la orina en el hombre que no permite la supervivencia del microorganismo (46).
Serológicamente se diagnostica por el suero pareado. El primero debe ser tomado en los primeros 7 días de la infección, y la segunda muestra a los 10 ó 15 días de la primera. Si ésta es negativa o de título bajo y la segunda acusa un aumento apreciable de 4 veces o más por encima, el diagnóstico es evidente
Tratamiento
El tratamiento que a continuación se señala es el nombrado por el Programa Nacional de Control de la Leptospirosis Humana. Siempre se indicará de inmediato, y en correspondencia al estado que presente el caso en el momento de su ingreso.
Esquema de tratamiento de casos graves:
En adultos: Administrar en las primeras 72 h, 10 millones de UI de penicilina cristalina por vía EV en dosis fraccionadas cada 4 ó 6 h. Continuar posteriormente con penicilina rapilenta 1 millón de UI por vía IM cada 6 h durante 7 días.
En niños: Se seguirá igual esquema que en adultos, pero utilizando solamente 50 000 a 10 000 UI de penicilina cristalina.
Esquema de tratamiento para casos benignos:
En adultos: Admistrar 1 millón de penicilina G cada 6 h durante las primeras 72 h y continuar posteriormente con 1 millón de UI de penicilina procainica cada 12 h durante 7 días.
En niños: Se aplicará el mismo esquema y las mismas dosis establecidas para casos graves.
Esquema para cada caso de alergia a la penicilina:
En adultos: Se administran 500 g de tetraciclina por vía oral cada 6 h durante 7 días.
En niños mayores de 7 años: Se indicará de igual forma que en adultos, pero a razón de 25 a 40 mg/kg de peso.
También se utilizarán otros tratamientos:
- Doxicilina 100 mg por vía oral 2 veces al día durante 7 días.
- Cefalosporina 1 g por vía EV cada 4 h durante las primeras 72 h, y continuar posteriormente con 1 g diario por vía IM durante 7 días.
- Otros antibióticos que pudieran utilizarse serían amoxacilina, cloranfenicol y eritromicina.
Estudios anatomopatológicos
De manera particular, el Programa Nacional de Control de la Leptospirosis Humana (PNLH) plantea que a todo fallecido debe realizársele estudio anatomopatológico para confirmar o corroborar la enfermedad.
Resulta sensato llevar a cabo estudios clínico patológicos adecuados para determinar la cantidad de errores de los diagnósticos clínicos, y controlar su calidad, siempre y cuando estos estudios estén avalados y reconocidos certeramente,(47)
A pesar que el PNLH señala la técnica de Levaditti como electivo para los estudios necrópsicos, investigaciones recientes han señalado lo contrario, exhibiéndose la técnica de Warthin Starry como más precisa, sensible y menos costosa que la anterior, aunque no se ha extendido su aplicación a los hospitales por la necesidad de tener reservas de productos argénticos, imprescindibles para su aplicación, concentrándose estos estudios en el Centro de Referencia Nacional de Anatomía Patológica en el Hospital "Hermanos Ameijeiras". Todo esto indica que el diagnóstico de certeza debe emitirse de forma colegiada, analizando criterios clínicos, epidemiológicos, serológicos e histológicos. Aunque las tinciones no se realicen o den negativas, este aspecto no excluye la enfermedad. (48)
BIBLIOGRAFÍA
1. Rev. Cubana Medicina Tropical U.S.O. Ciudad Habana, Comportamiento de la leptospirosis en Cuba 1987-1993.
2. Centro de estudios, prevención y mitigación de desastres, Facultad de medicina Granma –Cuba.Monogarafías.com
3. El Nuevo diario, Managua-Nicaragua, Para enfrentar brote de leptosoirosis, jueves,24 de junio 1999
4. Leptospirosis.www.ops.org.ni/desastre/civil/1998/mitch/opsnic/leptospirosis_new.html
5. Rev. Cubana Medicina General integral 2001:17(1) (21-6)
6. MINSAP.BOLIPK Vol 9/mun.03. pag.24 23/1/99 La Habana –Cuba.
7. Leptospira, Russell C. Johnson. http://gsbs.utmb.edu/microbook/ch035.htm
8. El Control de las Enfermedades Transmisibles. Decimoséptima edición, 2001. Publicación Científica y Técnica N° 581. OPS, OMS.
9. Leptospirosis. New York State Department of Health. www.health.state.ny.us/nysdoh/consumer/lepto.htm
10. Leptospirosis. Serie de Documentos Técnicos. Página Web Depto. Epidemiología, MINSAL.
11. Solano A, Boza R, Sáenz E. Leptospirosis en Humanos. Rev Cost Cienc Med 1996; 17: 41-60
12. Wesley Farr H. Leptospirosis. Clin Infect. Dis 1995; 21:1-8
13. Nicodemo AC, Del Negro G, Amato Neto V. Thrombocytopenia and leptospirosis. Rev Inst Med Trop Sao Paulo 1990;.32:252-259
14. Watt G Padre, LP Tuazon M, Calubaquib C. Skeletal and cardiac muscle involvement in severe, late leptospirosis. J Infect Dis 1990;162:266-269
15. Real G, Segers RPAM, Van der Zeijst B, Gaastra W. Cloning of a Hemolysin Gene from Leptospira interrogans. lnfec Immun 1989; 57:2588-2590
16. Volina EG, Levina LF, Soboleva GL. Phospholipase activity and viruience of pathogenic leptospira. J Hyg Epidemiol Microb Immunol 1986; 30:163-169
17. Wang B, Sullivan JA, Sullivan G, Mandell G. Role of specific antibody in interaction of leptospires with human monocytes-derived macrophages. lnfect Imm 1984; 46:809- 813
18. Yamashiro-Kanashiro EH, Benard G, Sato MN, Seguro AC. Cellular lmmune. Response Analysis in Patients with Leptospirosis. Am J Trop Med Hyg 1991;45:138-145
19. Pereira MM, Andrade J, Marchevsky R, Ribeiro dos Santos R. Morphologic caracterization of lung and kidney lesions in C3H/HeJ mice infected with Leptospira interrogans serovar icterohemorrhagiae: defect of CD4+ and CD8+ T celis are prognosticators of the disease progression. Exp Toxicol Pathol 1998; 50:191-198
20. Isogai E, Isogai H, Fujii N, Oguma K. Macrophage activation by leptospiral lipopolyssacharide. lnt J Med Microbiol 1990;273: 200-208
21. Mazuzawa T, Nakamura R, Shimizu T et al. lmmunological Characteristics of the Glycolypid Antigen of Leptospira interrogans Serovar lai. Infect lmm 1989; 57:2502-2506
22. Vinh T, Adler B, Faine S. Glycoprotein Cytotoxin from Leptospira interrogans serovar copenhageni. J Gen Microbiol 1986; 132:111-123
23. Friedland JS, Warrel DA. The Jarisch-Herxheimer reaction in leptospirosis: possible pathogenesis and review. Rev Infect Dis 1991; 13:207-21 0
24. Tajiki MA, Salomao R. Association of Plasma Tumor Necrosis Factor alfa with Severity of Disease and Mortality Among Patients with Leptospirosis. Clin lnfect Dis 1996; 23:1177-1178
25. Thomas DD, Higbie LM. In vitro association of leptospira with host cells. Infect Immun 1990; 58:581-585
26. Rugman FP, Pinn G, Palmer MF, Waite M, Haig CR. Anticardiolipin antibodies in leptospirosis. J Clin Pathol 1991; 44: 517-519
27. Galli M, Esposito R, Crocchinio P, Chemoti M. lmmune Complexes in Leptospirosis. Infection 1985; 13:156
28. Nicodemo AC, Duarte MIS, Alves VAF, Takakura C, Santos RTM, Nicodemo E. Lung Lesions in Human Leptospirosis: Microscopic, lmmunohistochemical and Ultrastructural Features Related to Thrombocytopenia. Am J Trop Med Hyg 1997; 56:181-187
29. Younes-Ibrahim M, Buffin-Meyer B, Cheval L, Burth P, Castro-Faria M, Barlet Bas C, Marsy S Doucet A NAK-ATPase: a molecular target for Leptospira interrogaos endotoxin. Braz J Med Biol Res 1997; 30: 213-223
30. Ricardo Boza. Rev. Costarricense ciência y medicina U.20 n1 San José , junio 1999.Servicio de infectologia Hospital San Juan de Dios. Editorial nacional de salud y seguridad social Apdo. 75-10100. San José-Costa Rica.
31. Programa nacional de control de la leptospirosis humana, ciuda La Habana. MINSAP. 1997.
32. Rubel D, Seijo A, Cemugor B, Viale A, Winivesky-Colli C. Leptospira interrogans en una población canina del Gran Buenos Aires: variables asociadas con la positividad. Rev Panam Salud Pública 1997;2(2):102-5.
33. Chamizo García H, Cruz de la Paz R, Borroto Ponce R. Estudio geoepidemiológico de leptospirosis humana en Cuba. Rev Cubana Hig Epidemiol 1996;34(1):15-22
34. Majalov YA, Alejin RM. Leptospirosis del cerdo. La Habana: Editorial Científico Técnica, 1989:6.
35. Roca Goderich R. Temas de medicina interna en leptospirosis. La Habana: Editorial Pueblo y Educación,4 Ed. 2002
36. Majalov YA, Alejin RM. Leptospirosis del cerdo. La Habana: Editorial Científico Técnica, 1989:6.
37. Acha Pedro N, Szyfres B. Zoonosis y enfermedades transmisibles comunes al hombre y a los animales. 2 ed. Washington DC: OPS, 1989:112-20.
38. Torriente Abreu B. Algunos aspectos clínicos y epidemiológicos de la leptospirosis humana. Ciudad de La Habana. Trabajo para optar por el título de Especialista de I Grado en Higiene y Epidemiología. La Habana. Facultad de Salud Pública, 1996
39. Cumbá Abreu C, Centelles BL, Más Bermejo P, Diez Córdova JP, García Roche RG. Ambiente y enfermedades transmisibles. Municipio Centro Habana 1993-1995. Rev Cubana Hig Epidemiol 1997;35(1):14-7.
40. Arambulo III Primo. Situación de la leptospirosis en América Latina. Presentado en el II Taller Internacional sobre Control de la Leptospirosis. La Habana, Cuba, 1997;3-5 diciembre
41. Benenson AS. El control de las enfermedades transmisibles en el hombre. En: OPS. Informe Oficial de la Asociación Estadounidense de la Salud Pública. Washington DC, 1997:294-7.
42. Martone WJ. Infecciones producidas por leptospiras (Leptospirosis). En: Stein HL. Tratado de Medicina Interna. La Habana: Editorial Científico Técnica, 1998;1794-96.
43. Mc Crumb FR Jr, Woodward TE. Infecciones debidas a leptospiras. En: Harrinson TR. Tratado de medicina interna. La Habana: 1996:1082-85. Edición Revolucionaria.
44. Szyfres B. La leptospirosis como problema de salud humana y animal en América Latina y el Caribe, Washington DC: OPS, 1976:8-14.
45. Ginebra González OA. Leptospirosis. Estudio seroepidemiológico en humanos. Trabajo para optar por el título de Especialista de I Grado en Microbiología. Ciudad de La Habana. INHEM, 1974
46. Cruz Acosta Ana M. Diagnóstico de la leptospirosis en Ciudad de La Habana. Trabajo para optar por el título de Doctora en Medicina Veterinaria. Ciudad de La Habana: 1990
47. Saracci R. Problemas que representan el uso de los resultados de la autopsia como referencia de la auditoría médica y epidemiológica. Rev Esp Calidad Asistencial 1995; 10(5): 294-9.
48. Álvarez R. Comunicación personal. Experto del Centro de Referencia Nacional de Anatomía Patológica. Hospital "Hermanos Ameijeiras
49. Revista Cubana Medicina General Integral 2001 17 (1) : 67-73. Trabajo de revisión de Diagnóstico y tratamiento.
Autores:
Dr. Gerardo Álvarez Álvarez.
Master en Psicología Médica.
Especialista en 2do grado en Medicina Interna.
Profesor Auxiliar del Instituto Superior de Ciencias Médicas de Villa Clara
J” de Catedra clínica Medica Hospital Universitario Arnaldo Milian Castro
Presidente Sociedad Cubana de Medicina Interna de Villa Clara.
J” del Grupo Provincial De HTA Villa Clara. Cuba.
Dr. Elvys Pérez Bada.
Especialista de 1er grado en Medicina Interna.
Profesor Instructor Instituto Superior de Ciencias Medicas Villa Clara
Responsable de Residencia de Medicina Interna. Hospital Universitario Arnaldo Milian
Asesor de Extensión Universitaria. Departamento Docencia
J” Sala Medicina B. Hospital Arnaldo Milian Castro
Dr. Mario B. Diaz Cabrera.
Especialista de 1er grado en Medicina General Integral
Residente de 2do año de Medicina Interna
Estudiante: Juan Roly Condori Jamachi.
Estudiante 3er año de Medicina