Nos propusimos comprobar el efecto del Sulfato de Zinc en el crecimento óseo en crías de ratas con crecimiento intrauterino retardado. Se induce el crecimiento intrauterino retardado, por ligadura de la arteria uterina en ambos cuernos en el día 16 de la gestación, en ratas de la línea Sprague Dawley. Se agruparon en tres grupos: Grupo I al cual se le administró placebo y el Grupo II y III a los cuales se les dio una dosis de 5 mg/kg/dia y 10 mg/kg/dia respectivamente de Sulfato de Zinc. A todos se les realizó mediciones de la longitud del fémur, húmero y media de mandíbula, el diámetro anteroposterior y biparietal y el ancho del hueso a los dias 7 y 21 del nacimiento. En los que se les administró el Sulfato de Zinc se encontró un aumento en el crecimento óseo, siendo mayor a los que se les dio 10mg/kg/dia y se les prolongó por 21 dias el tratamiento.
Dra. Beatriz de
Resumen:
Nos propusimos comprobar el efecto del Sulfato de Zinc en el crecimento óseo en crías de ratas con crecimiento intrauterino retardado. Se induce el crecimiento intrauterino retardado, por ligadura de la arteria uterina en ambos cuernos en el día 16 de la gestación, en ratas de la línea Sprague Dawley. Se agruparon en tres grupos: Grupo I al cual se le administró placebo y el Grupo II y III a los cuales se les dio una dosis de 5 mg/kg/dia y 10 mg/kg/dia respectivamente de Sulfato de Zinc. A todos se les realizó mediciones de la longitud del fémur, húmero y media de mandíbula, el diámetro anteroposterior y biparietal y el ancho del hueso a los dias 7 y 21 del nacimiento. En los que se les administró el Sulfato de Zinc se encontró un aumento en el crecimento óseo, siendo mayor a los que se les dio 10mg/kg/dia y se les prolongó por 21 dias el tratamiento.
Introducción
Se reportan en la varios modelos experimentales para inducir el crecimiento intrauterino retardado o CIUR en animales de laboratorio. En el año 1964, Wiglesworth1 obtuvo un modelo de crecimiento intrauterino retardado en ratas, el cuál se sustentaba en la ligadura de la arteria de uno de los cuernos uterino en el día 17 de la gestación y la obtención de las crías mediante cesáreas en el día 21 de la preñez comparando las crías de ambos cuernos, observándose una alta incidencia de muerte fetal en el cuerno experimental. El mismo modelo fue empleado por Hoohenauer y Oh 2 y un más tarde por Chung y colaboradores3 con el propósito de estudiar las diferencias en la composición corporal entre crías experimentales y controles obteniéndose siempre las crías por cesáreas lo cuál implicaba entre otras cosas la muerte de la madre y además estos modelos muestran un elevado numero de reabsorciones en el cuerno manipulado. Algunos de los autores antes mencionados emplean controles pseudoperados, demostrando que no presentan diferencias con las crías controles. Nitzan y colaboradores 4 modificaron el modelo realizando la ligadura en el día 18 de la gestación, y más tarde Hayashi y Dorko 5 realizaron la ligadura de la arteria uterina a mitad del cuerno obteniendo las crías por cesárea y comparando los fetos de la parte superior del cuerno con los de la porción inferior. En todos estos modelos se produce un disminución del flujo útero-placentario que se manifiesta por un fracaso funcional de la placenta como órgano respiratorio y/o nutricional proporcionando también crías con crecimiento intrauterino retardado, sin embargo al realizarse la ligadura de forma general entre los días 17 y 18 de la preñez el retardo que se obtiene no es tan severo y además la disminución en la camada no es significativa 2
Las investigaciones biomédicas proponen la utilización de animales de laboratorio como biomodelos naturales o inducidos de diversas enfermedades los cuales ayudan al estudio y la comprensión de la patogenia, fisiología y posibilidades de tratamiento 25,28s modelos de retardo en el crecimiento intrauterino desempeñan un papel importante ya que estas crías pueden desarrollar en la vida adulta alteraciones tales como: hipertensión arterial 32–diabetes tipo II hipercolesterolemia 15,16, obesidad 22 osteoporosis enfermedades cardiovasculares en general 1516 lo cual ofrece un camino en las investigaciones biomédicas al contar con modelos que reproduzcan de una manera sencilla situaciones patológicas presentes en el humano que constituyen serios problemas de salud en la sociedad 25 28
Se reportan en la literatura varios modelos experimentales para inducir el crecimiento intrauterino retardado en animales de laboratorio los cuales son generalmente provocados por interferencia con la función placentaria o con el flujo sanguíneo uterino, por hipoxia materna, administración de drogas o limitaciones del consumo de energía y/o de proteínas por la madre 25
Numerosos modelos de Crecimiento Intrauterino Retardado se han desarrollado sometiendo a la rata gestada a distintos niveles de hipoxia en la segunda mitad de la gestación. Algunos estudios han demostrado que los efectos de estos modelos provocan un crecimiento intrauterino más severo que los modelos de restricción alimentaria 14
Wiglesworth obtuvo un modelo de crecimiento intrauterino retardado en ratas, el cual se basaba en la ligadura de la arteria de uno de los cuernos uterinos en el día 17 de la gestación y la obtención de las crías mediante cesárea en el día 21 de la preñez comparando las crías de ambos cuernos, observándose una alta incidencia de muerte fetal en el cuerno experimental .
El mismo modelo fue empleado por Hoohenauer y Oh y un año más tarde por Chung y colaboradores con el propósito de estudiar las diferencias en la composición corporal entre crías experimentales y controles obteniéndose siempre las crías por cesárea lo cual implicaba la muerte de la madre y un elevado número de reabsorciones en el cuerno manipulado. Los autores antes mencionados emplean controles pseudoperados, demostrando que no presentan diferencias con las crías controles.
Nitzan y colaboradores modificaron el modelo realizando la ligadura en el día 18 de la gestación. Hayashi y Dorko realizaron la ligadura de la arteria uterina a mitad del cuerno obteniendo las crías por cesárea y comparando los fetos de la parte superior del cuerno con los de la porción inferior.
En todos estos modelos se produce una disminución del flujo útero-placentario que se manifiesta por un fracaso funcional de la placenta como órgano respiratorio y/o nutricional proporcionando también crías con crecimiento intrauterino retardado sin embargo al realizarle la ligadura entre los días 17 y 18 de la preñez, el retardo que se obtiene no es tan severo 30
Sustentados en estas experiencias se propuso un nuevo modelo de retardo en el crecimiento intrauterino en el que se realiza la ligadura en el día 16 de la gestación, en las arterias de ambos cuernos uterinos 23esto obedece a que el riego sanguíneo útero placentario se incrementa aproximadamente en el día 14 de la preñez así como el paso de nutrientes a través de la placenta .
Las ventajas de este modelo es que se pueden obtener por vía vaginal entre 5 y 9 crías en cada camada, las que presentan un retardo severo en el crecimiento intrauterino, el número de la camada no se afecta significativamente con respecto a otras experiencias y las crías al obtenerse por parto fisiológico son amamantadas por sus madres permitiendo estudiar su comportamiento postnatal así como, el de algunos órganos o sistemas sobre los cuales pudieran existir evidencias de afectaciones.
En la actualidad diversos estudios relacionados con el tema, independientemente del modelo utilizado, plantean que en el crecimiento intrauterino retardado hay déficit de Factores de Crecimiento Similares a
Numerosos estudios han señalado que las crías obtenidas producto de alguno de los modelos anteriormente descritos tienen una expresión disminuida de ILGF I en suero, que puede mantenerse incluso hasta el día 9 de vida postnatal lo que puede inhibir la proliferación celular estimulada por él, destacando de esta manera la importancia del eje fetal de los factores de crecimiento similares a la insulina en la regulación del crecimiento fetal ..
El crecimiento intrauterino retardado continúa siendo un problema de salud que afecta a un gran número de recién nacidos a pesar de que se hacen grandes esfuerzos por disminuir su incidencia, por lo que se ha convertido en un tema de preocupación para casi todos los sistemas de salud en el mundo 15Aproximadamente la cuarta parte de los recién nacidos con bajo peso se consideran como portadores de esta afección, por lo que se han dirigido las investigaciones hacia vías que permitan incidir en el problema de manera directa 1
Funciones del Zinc
Estudios demuestran que el Zinc tiene múltiples funciones, existen algunos donde se demuestra que es un elemento esencial requerido tanto para el crecimiento tisular como para el desarrollo neurológico. Este oligoelemento estabiliza las estructuras del DNA y RNA, y su deficiencia compromete la integridad funcional de las células. El Zinc es requerido para la producción de más de 200 métalo enzimas involucrados en la síntesis de proteínas, ácidos nucleicos, la función inmune y la prevención de la lesión oxidativa por radicales libres.
Es un componente estructural de diversas proteínas, hormonas y nucleótidos. Participa también en la estructura ósea y en colaboración con el IGF-I incrementa el contenido proteico óseo. El Zinc es también uno de los elementos traza más prevalentes en el cerebro y cerebelo.
Este tiene múltiples acciones fisiológicas ya que es componente de 300 enzimas, participando de su estructura y mecanismos regulatorios de su acción. Además es un componente estructural en las membranas celulares y participa en la síntesis de diferentes proteínas.
Por otra parte participa en la síntesis y acción de hormonas como Somatomedina C, osteocalcina, testosterona, hormonas tiroideas e insulinas todas ellas anabólicas y estrechamente vinculadas con el crecimiento del hueso y por ende de la talla de los niños.
El Zinc es necesario para la actividad de la fosfatasa alcalina, enzima producida principalmente por los osteoblastos y cuya función primordial es facilitar el depósito del calcio sobre la matriz ósea, está presente en productos de origen marino (ostras, crustáceos), carnes rojas, derivados lácteos, huevos y cereales integrales La homeostasis del Zinc está controlada a nivel intestinal y hepático, mediante cambios en la excreción fecal (87%) y urinaria (8%).
Teniendo en cuenta todo lo anterios en nuestra investigación nos propusimos describir el efecto de la suplementación con Sulfato de Zinc en el desarrollo óseo en crias de ratas con crecimiento intrauterno retardado y conocer si existen variaciones en el crecimiento oseo dependiente de la dosis administrada y el tiempo de tratamiento con Sulfato de Zinc.
Material y metodo:
Se realizó un estudio experimental en 15 ratas de la línea Sprague Dawley, vírgenes, con una edad promedio de 12 semanas, cuyo peso aproximado osciló entre 180 y
Se determinó con anterioridad su ciclo estral, mediante la observación al microscopio del exudado vaginal o smear con suero fisiológico. Al microscopio se observaron los diferentes estadios del ciclo dándose como posible para la monta cuando estuvo en la fase de estro caracterizado por células queratinizadas y sin núcleo. En horas de la tarde se realizó el apareamiento a razón de una hembra por macho. Al día siguiente en horas bien temprano de la mañana se comprobó la cópula mediante exudado vaginal con suero fisiológico, tomándose la presencia de espermatozoides en la lámina como día cero de la gestación y posibles gestante.
Las hembras gestadas se colocaron en cajas individuales en condiciones convencionales, teniendo libre acceso al agua y recibiendo como alimento pienso para roedores producido en el CENPALAB. Se mantuvieron las condiciones normales y fisiológicas para la especie.
Diseño de la investigación
A todas las ratas gestantes se les practicó una intervención quirúrgica el día 16 de la gestación previa anestesia con éter y en condiciones aséptica, donde se les realizó la ligadura de las arterias uterinas en su punto más bajo empleando seda quirúrgica 00, siguiendo el modelo descrito por Alfonso y colaboradores 10
El parto se produjo de forma fisiológica en todas las ratas gestantes y se formaron los grupos siguientes:
Grupo I.- Placebo (suministro de agua por vía oral).
Grupo II.- Dosis de 5mg/Kg. de peso por día de Sulfato de Zinc.
Grupo III.- Dosis de 10mg/Kg. de peso por día de Sulfato de Zinc.
Las crías de los grupos II y III (experimentales), se les suministró Sulfato de Zinc a una dosis de 5mg/Kg. por día y 10 mg/Kg. por día respectivamente a través de cánula esofágica de 0,5mm de poliuretano, material bien flexible dada la edad de las ratas, en el horario de la mañana y al grupo I (control) el placebo. La asignación a los tratamientos se realizó de forma aleatoria.
Al término de la lactancia (7 días) se practicó eutanasia a 10 lactantes de los grupos I, II y III y a los 21 días, correspondiendo este tiempo al paso de la niñez a la adolescencia se practicó eutanasia a 10 crías de los mismos grupos.
Se le tomaron las siguientes medidas:
· Longitud de fémur
· Longitud de húmero.
· Longitud media de la mandíbula.
· Diámetro Biparietal y Anteroposterior
· Ancho del hueso en el punto medio de las epífisis
Estas medidas se tuvieron en cuenta como patrón de referencia del efecto de la suplementación con Sulfato de Zinc en ratas CIUR y el posterior crecimiento óseo de los grupos experimentales y el grupo placebo, para ello utilizamos un pie de rey, que para el diámetro biparietal se colocará sobre un plano imaginario y paralelo al borde superior de las orejas y el anteroposterior se determinó colocando el pie de rey desde la cresta supranasal hasta el borde superior del agujero occipital.
Para la longitud media de la mandíbula se utilizó también el pie de rey tomando como referencia anatómica la distancia entre el cóndilo y para las longitudes de los huesos largos la distancia entre las epífisis. Todas ellas son expresadas en milímetros (mm)
Resultados:
La crías estudiadas en los grupos experimentales mostraron crecimiento óseo al suministrarles Sulfato de Zinc en dosis de 5mg/kg/dia y 10 mg/kg/dia respectivamente, tomando el valor de las longitudes de los huesos, ancho del hueso y los diámetros craneanos a los 7 dias y a los 21 dias, encontrando diferencias significativas entre los dos grupos experimentales y entre ellos y el grupo control al cual solo se le administro un placebo
Tabla 1: Comportamiento de la longitud del fémur.
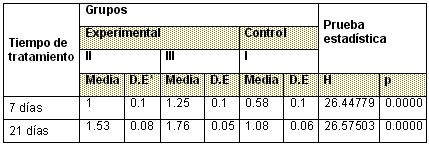
Tabla 2: Comportamiento de la longitud del húmero
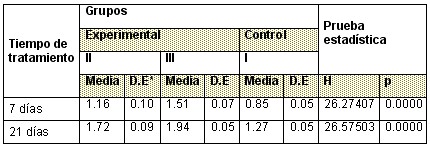
De igual manera se comportaron los valores medios en la longitud de húmero donde las medidas realizada 7 días en el grupo control son inferiores con respecto a los grupos experimentales, mostrando diferencia significativa, así mismo fue el resultado obtenido con los valores de la media a los 21 días.(Tabla 2 )
Tabla 3: Comportamiento del diámetro anteroposterior
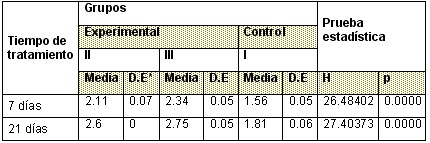
Tabla 4: Comportamiento del diámetro biparietal
En relación con los diámetros craneanos anteroposterior y biparietal el estudio evidenció diferencias estadisticamente significativas entre el grupo control y los grupos experimentales, si tenemos en cuenta el valor de la media y el valor del estadigrafo de prueba. (Tablas 3 y 4)
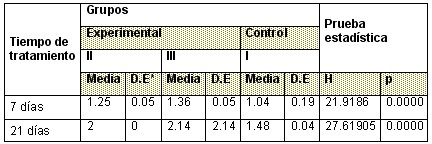
Tabla 5: Comportamiento de la longitud media de Mandíbula
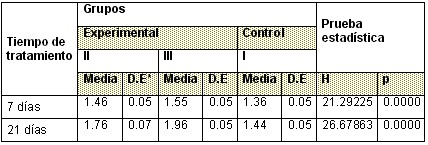
Con respecto a la longitud media de
Tabla 6: Comportamiento del Ancho del Hueso
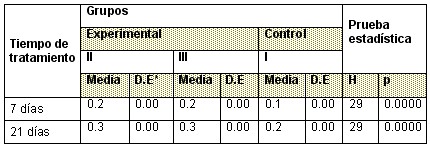
El Ancho del Hueso se comportó de igual manera que las medidas de los huesos largos y los diámetros craneanos donde se encontraron diferencias en los tres grupos con respecto a los valores de la media y el valor del estadígrafo el cual resulta significativo. (Tabla 6)
Conclusiones:
1- Existe efecto favorable al crecimiento óseo en las ratas nacidas con crecimiento intrauterino retardado, a las que se le administro Sulfato de Zinc.
2- El crecimiento óseo fue mayor en las crías que se les administró una dosis de Sulfato de Zinc de 10mg/kg/día y a las que se les prolongo el tratamiento por un período de 21 días.
Bibliografia consultada:
1 Wiglesworth, J. S (1964). Experimental Growth retardation in the fetal rat J. Pathol. And Bacteriology. 88 (1): 1-13.
2 Hoohenauer, L and W. Oh (1969) Body Composition in experimental growth retardation in the rat. J. Nutr. 99:23-26.
3 Chung-Ja, M. et al (1987). Growth and cellular composition in the rat with intrauterine growth retardation: Effect of postnatal nutrition. J. Nutr.117:1463-1468.
4 Nitzan , M., S. Orloff and J. Schullman (1979). Placental transfer of analogs of glucose and amino acid in experimental intrauterine growth retardation. Ped. Res. 13:100-103.
5 Hayashi, T.T. and M. E. Dolks (1988). A rat model for the study of intrauterine growth retardation. Am, J. Obstetric Gynecol 158: 1203-1207.
6 Arias G, Torres MR, Pérez N, Milián M. Factores prenatales relacionados con la prematuridad. Rev. Cub. Pediatría 2001; 73: 11-5.
7 Peraza G, Pérez SC, Figueroa ZA. Factores asociados al bajo peso al nacer. Rev. Cub. Med. Gen. Integr. 2001; 17: 490- 6.
8 Castro M, Sánchez IL, Medina C, Padrón R. Evolución del niño con bajo peso al nacer en su primer año de vida. MEDISAN 2000; 4: 20-26.
9 Peraza G, Gil JY, Arce A, Gil J. Factores de riesgo en el bajo peso al nacer. Rev Cub Med Gen Integr 2000; 16: 68-72.
10 Chaviano J, López D. Edad materna, riesgo nutricional preconcepcional y peso al nacer. Rev Cub Aliment Nutr 2000; 14: 949.
11 Goldenberg RL, Cliver SP. Small for gestational age and intrauterine growth restriction: Definitions and standards. Clin Obste. Gynecol 1997 ; 40: 704-14.
12 Fernandez-Twinn DS, Ozanne SE, Ekizoglou S, Doherty C, James L, Gusterson B, Hales CN. The maternal endocrine environment in the low-protein model of intra-uterine growth restriction. Br J Nutr 2003; 90: 815-22.
13 Longo ID. Hypoxia-ischaemia and the developing brain: hypothesis regarding the path physiology of fetal-neonatal brain damage. J Obstet Gynaecol 1997; 104: 652–662.
14 Schwartz JE, Kovach A, Meyer J, McConnell C. Brief, intermittent hypoxia restricts fetal growth in Sprague- Dawley rats. Biol Neonate 1998; 73: 313-319.
15 Peraza G, Pérez SC, Figueroa ZA. Factores asociados al bajo peso al nacer. Rev. Cub. Med Gen Integr 2001; 17: 490-6.
16 Álvarez R, Urra LR, Aliño M. Repercusión de los factores de riesgo en el bajo peso al nacer. RESUMED 2001; 14: 115-21.
17 Robinson JS, Moore VM, Owens JA, McMillen IC. Origins of fetal growth restriction. Eur Obstet Gynecol Reprod Biol 2000; 92(1): 13-9.
18 Sibbley CP, Nelson DM, Powell T. Mechanisms of materno fetal exchange across the human placenta. Biochem Soc Trans 1998; 26: 86–90.
19 Pardi GA, Marconi AM, Cetin I. Placental-fetal Interrelationship in IUGR Fetuses. Placenta 2002; 23 (1): 136-141.
20 Hafner E, Metzenbauer M, Dillinger-Paller B, Hoefinger D, Schuchter K, Sommer-Wagner K, Philipp K. Correlation of first trimester placental volume and second trimester uterine artery Doppler flow. Placenta 2001; 22: 729–734.
21 Dashe JS, McIntire D, Lucas MJ, Leveno KJ. Effects of symmetric and asymmetric fetal growth on pregnancy outcomes.
Obstet Gynecol 2000; 96(3): 321-7.
22 Bauer RB, Walter B, Gaser E, Rosel T, Kluge H, Zwiener U. Cardiovascular function and brain metabolites in normal weight and intrauterine growth restricted newborn piglets--effect of mild hypoxia. Exp Toxicol Pathol 1998; 50(4-6): 294-300.
23 Tomé O, Alfonso C. Comportamiento postnatal de variables somatométricas en crías de rata con crecimiento intrauterino retardado experimental. Rev Cub Cienc Vet 2001; 27(1): 15-17.
24 Morales-Rosello J. Physiologic restriction versus genetic weight potential: Study in normal fetuses and in fetuses with intrauterine growth retardation. J Ultrasound Med 1999; May; 18: 343.
25 Haggard C, Bauer MK. Rodent model of intrauterine growth restriction. Scand J Lab Anim Sci 2001; 28 (1).
26 Peleg D, M. Kennedy C, Hunter SK. Intrauterine growth restriction: Identification and management. Am J Obstetric Gynecol 1998; 159: 1303-1308.
27 Luo R, Mao M, Xiao X. Level of nerve growth factor protein in cerebellar cortex of rat pups in intrauterine growth retardation model by clamping the uterine vasculature of pregnant rat. Hua Xi Yi Ke Da Xue Bao 2001; Mar; 32(1): 89-91
28 Pan SL, Yu YH . Establishment of a new rat model of intrauterine growth retardation. Di Yi Jun Yi Da Xue Bao 2002; Apr; 22(4): 339-43.
29 Peterside I, Selak EM, Simmons RA. Impaired oxidative phosphorylation in hepatic mitochondria in growth-retarded rat. Am J Physiol Endocrinol Metab 2003; Dec; 285(6): E1258-66.
30 Cruz MA. Estudio morfológico del intestino delgado en ratas con crecimiento intrauterino retardado. Instituto Superior de Ciencias Médicas de
31 Gordon PV, Marshal D, Stiles AD, Price WA. The clinical, morphologic and molecular changes in the ileum associated with early postnatal dexamethasone administration: from the baby's bowel to the researcher's bench. Mol Genet Metab 2001; Feb; 72(2): 91-103.
32 Pham TD, MacLennan NK, Chiu CT, Laksana GS, Hsu JL, Lane R. Uteroplacental insufficiency increases apoptosis and alters p53 gene methylation in the full-term IUGR rat kidney. Am J Physiol Regul Integr Comp Physiol 2003; Nov; 285(5): R933-4.
33 Bauer R, Walter R, Bauer K, Klupsch R, Pattf S, Zwiener U. Intrauterine growth restriction reduces nephron number and renal excretory function in newborn. Acta Physiologica Scandinavica 2002; 176 (2): 83.
34 Jackson JA, Wailoo MP, Peterson SA. Early physiological development of infants with intrauterine growth retardation. Arch Dis Child Fetal Neonatal 2004; 89: 46-50.
35. Sallout B, Walker M. The fetal origin of adults diseases. J Obstet Gynecol 2003; 23: 555-60.
Autores:
1- Dra. Beatriz de
Especialista de Primer Grado en Embriología. Especialista de Primer Grado en Medicina General Integral. Profesor Instructor. Instituto Superior de Ciencias Médicas de
Máster en Ciencias. Especialista de Primer y Segundo Grados de Medicina Interna. Especialista de Segundo Grado de Medicina General Integral Profesor Auxiliar. Instituto Superior de Ciencias Médicas de