Linfoma de células del manto y afectación intestinal
El linfoma de células del manto (LCM) es un subtipo de linfoma no Hodgkin (LNH) de fenotipo B que representa entre un 2,5 y un 10% de todos los linfomas. La forma de manifestarse más frecuente de la localización gastrointestinal es la poliposis linfomatosa múltiple, siendo un diagnóstico endoscópico infrecuente, que se caracteriza por la presencia de múltiples pólipos de aspecto tumoral. La localización difusa es excepcional.
Linfoma de células del manto y afectación intestinal
Menduiña Guillén, Manuel; Alaminos García, Pilar; González Montoro, María Luisa.
Complejo Hospitalario Universitario de Granada.
RESUMEN
La evolución natural es muy agresiva, con una supervivencia media de 3 a 5 años. La edad media de presentación suele ser en torno a los 60 años y predominantemente en varones. Suele presentarse de forma diseminada y con frecuente afección extranodal. Para la caracterización histológica es imprescindible el estudio inmunofenotípico: Antígenos CD20, CD5 y ciclina D1, presencia de translocación t (11;14). La quimioterapia es el tratamiento de elección, incluyendo regímenes con CHOP, ciclofosfamida, vincristina y prednisona (COP) y doxorrubicina, tenipósido, ciclofosfamida y prednisolona (AVmCP).
Palabras clave: linfoma de células del manto, ciclina D1, Helicobacter pilorii
CASO CLÍNICO
Paciente de 56 años de edad con antecedentes de dispepsia no ulcerosa de más de un año de evolución, síndrome de colon irritable, apendicectomizado a los 17 años de edad. Entre los antecedentes familiares destaca: madre con diabetes mellitus tipo 2, muerta por ictus isquémico cerebral y padre fallecido por cáncer de colon.
El paciente acude a la consulta de MI refiriendo cuadro de 15 de días de evolución de anorexia y dolor abdominal cólico postprandrial, que cede parcialmente con analgesia, acompañado ocasionalmente de vómitos alimenticios 2 a 3 horas tras ingesta. Cuenta pérdida de peso de unos 5-6 Kg en estos 15 días, así como sudoración profusa por las noches.
En la exploración física destaca abdomen blando y depresible, doloroso a la palpación profunda en hipogastrio, sin palparse masas y sin signos de peritonismo. Se palpa polo de bazo a 3 cm del reborde costal. En la exploración de cuello y resto de cadenas linfáticas axilares e inguinales, no se palpan adenopatías de entidad patológica.
Las pruebas complementarias que se llevaron a cabo fueron las siguientes:
– Hemograma: Hemoglobina: 10.2 gr/dl, Hematocrito: 38%, VCM: 68.5 fl. Leucocitos: 3480 ul (PMN: 68%, Linfocito s:780 ul Reticulocitos del 2.5%. VSG: 23 mm/hora.
– Bioquímica: Normalidad de función renal y de electrolitos. Destaca úrico de 8.2 mg/dl, LDH: 986 UI/L. PT de 5.9 gr/dl, Albúmina: 3.2 gr/dl. Perfiles lipídicos y Hepático: sin alteraciones significativas.
– Ferrocinética: Fe 17 ug/dl, Ferritina: 3.3 ng/ml. Transferrina: 265 mg/dl, Indice sat transferrina: 5.2%.
– Marcadores tumorales: destaca Ca 125: 153U/L. B2 microglobulina: 4.95 UI/L
-Serología: VHA Ac IgG + IgM-. HBsAg -, HBsAc>100000mUI/ml, HBcAc y BeAc+. VEBAcIgG>750 IgM -. CMVIgG>22,IgM-. VIH-. VHC-. Ac H Pylori+,IgA 181.
– Rx de tórax: sin alteraciones.
– Rx de abdomen simple: escasa cantidad de aire en tramos bajos del tubo digestivo. No hay datos de obstrucción intestinal
– TC toraco-abdómino-pélvico con contraste IV: derrame pleural izquierdo moderado que causa atelectasia compresiva de LI izdo. Hepato-esplenomegalia homogénea. Ocupación de espacio gastro-esplénico por masa de densidad de partes blandas que impronta en cuerpo gástrico, dejando luz gástrica irregular. Extensión de dicha masa a hilio esplénico y cola pancreática que se encuentran engrosados, sin afectación vascular. Múltiples adenopatías en región de ligamento gastro-hepático de 3 cm, rodeando al tronco celíaco de 1,5 cm y en mesenterio de 2cm con importante afectación de “Omentum”. Engrosamiento y realce parietal de yeyuno, tanto en su porción media como distal. No adenopatías ambas regiones axilares, en retroperitoneo ni en ambas zonas inguinales.
– Endoscopia digestiva alta: esófago bien configurado, sin lesiones. Transición mucosa a 39 cm de arcada dentaria. Estómago en el cuerpo gástrico con pliegues algo engrosados, pero que distiende bien. Biopsia de pliegues gástricos: gastritis crónica con signos de actividad, hiperplasia linfoide y linfocitosis intraepiteliales (ByT), asociada a Helicobacter Pylori. Ausencia de linfoma tras estudio inmunohistoquímico. Antro sin lesiones. Píloro centrado y permeable. Duodeno: sin lesiones hasta segunda porción de éste.
– Tránsito intestinal con contraste baritado oral: dilatación parcial de segmentos yeyunales de intestino delgado con engrosamiento focal de pliegues en varios segmentos de estos; asa fija aumentada de tamaño en pelvis de unos 80×50 mm, que no evacua el contenido ni en placas tardías y que se sitúa entre los segmentos estenóticos de contorno espiculado. Se aprecia también segmentación del material baritado, zonas de dilución y algunos signos de floculación. El íleon no parece afectado de forma importante.
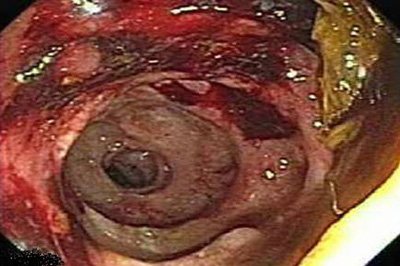
– Enteroscopia digestiva baja: se explora hasta 1.5 m del margen anal, donde se aprecia zona estenótica, endurecida, eritematosa y muy friable que impide el paso de endoscopio. Se toma biopsia de esta zona de yeyuno; resultado de ésta: infiltrado inflamatorio. (Ver imagen)
EVOLUCION
Dado el resultado tan inespecífico de la biopsia intestinal y puesto que las adenopatías existentes no son accesibles, se plantea tomar biopsia de la grasa del “Omentum” que presentaba una importante afectación. Se llevó a cabo una punción-biopsia guiada por TAC cuyo resultado fue: Linfoma B del área marginal, positivo para CD20. Negativo CD3, CD5, CD23 y ciclina D1. Y con un índice de proliferación bajo.
Se administra tratamiento erradicador para H. Pylori (amoxicilina/clavulánico, claritromicina + IBP), con test de aliento post tratamiento: negativo.
Se pautó nutrición parenteral y se dió quimioterapia: CHOP (ciclofosfamida, doxorrubicina, vincristina y prednisona) + Rituximab, según protocolo. A las 2 semanas de tratamiento la estenosis desapareció, restableciéndose el transito gastrointestinal normal.
Desgraciadamente, unos meses más tarde el paciente fallece a consecuencia de un shock séptico secundario a infección respiratoria y neutropenia.
DIAGNÓSTICO:
Linfoma B del área marginal CD20+ intestinal, estadio IIB. Gastritis crónica con hiperpalsia linfoide asociada a infección por H pylori. Anemia microcítica hipocrómica por pérdidas digestivas.
DISCUSIÓN:
El linfoma de células del manto (LCM) es un subtipo agresivo de linfoma no Hodgkin de fenotipo B que representa entre un 2’5 y un 10% de todos los linfomas.
Histológicamente puede presentar un patrón de crecimiento en la zona del manto, nodular o difuso. Proliferación heterogénea de linfocitos de la zona marginal (centrocitoides), células B monocitoides, linfocitos pequeños, escasas células grandes tipo inmunoblasto y centroblasto y diferenciación plasmocitoide en el 40% de los casos. Crecimiento en la zona marginal de los folículos reactivos, extendiéndose a la región interfolicular.
Se diferencian dos variedades, típica y blastoide.
Clínicamente, suele presentarse en varones mayores de 60 años con frecuencia de forma diseminada y con afección extranodal (afecta la médula ósea, los ganglios linfáticos, el bazo y el aparato gastrointestinal (esófago, estómago, intestinos) y se identifica por la expresión de una proteína llamada ciclina D1 (aunque esta puede expresarse pobremente).
Debe excluirse un linfoma MALT pre o coexistente. Historia de proceso inflamatorio o autoinmune: gastritis crónica asociada a Helicobacter pylori, síndrome de Sjögren o tiroiditis de Hashimoto. Curso indolente y a veces Localizado.
Inmunofenotípicamente se caracteriza por la presencia de una población monoclonal de línea B conS y CIg +, CD5 -, CD10 -, CD19,20,22,79a +, CD23 -. sobreexpresión de ciclina D1 asociada a la presencia inconstante (11;14). Trisomía 3 (60%) y t(11;18). No reordenamiento de bcl-2 y/o bcl-1. Genes de IgH y IgL reordenados
En las formas típicas y blastoides se han identificado frecuentemente alteraciones en el gen ATM. Las formas blastoides presentan además alteraciones genéticas adicionales que incluyen inactivación de los genes supresores tumorales p53 y p16INK4a. La supervivencia media de linfoma de células del manto (LCM) oscila entre 3 y 5 años. La supervivencia a los 10 años es menor del 8%.
Es frecuente que este tumor se diagnostique a raíz de una laparotomía, por lo que en algunos casos, tras el estudio de la muestra quirúrgica y de extensión, podemos encontrarnos ante estadios I y II en los que se ha extirpado completamente el tumor.
En la actualidad, ante histologías muy favorables, se recomienda completar el tratamiento quirúrgico con radioterapia (20-25 Gy totales).
Si se trata de histología agresiva, se recomienda asociar quimioterapia seguida de radioterapia. Esto se debe a que la aplicación de radioterapia local puede ir seguida de hasta un 60 % de recidivas fuera del campo radiado. En estos casos, los regímenes más comúnmente usados son: CHOP (ciclofosfamida, doxorrubicina, vincristina y prednisona)+ Rituximab (Ac AntiCD20) en primera línea y, en segunda línea ipofosfamida, MESNA, MITOXANTRON, VP – 16 y trasplante de médula ósea.
La mejor recomendación que se puede hacer es que estos pacientes queden incluidos en ensayos clínicos multicéntricos que permitan consolidar resultados y conocimientos
IMAGEN: A 1,5 m del margen anal se aprecia zona estenótica, endurecida, eritematosa y muy friable.
BIBLIOGRAFÍA
1.-C. Poves Francés, W. Baki, J. M. Loscos Valerio, S. Izquierdo Rubio, F. Sánchez Ceballos, S. Fernández Díez, J. M. Esteban López-Jamar y M. Díaz-Rubio García. Afectación de tracto digestivo por linfoma de células del manto: aspecto endoscópico. Rev esp enferm dig 2010; 102 (6): 393-95.
2.- Balagué O, Colomo L, Campo E. Linfoma de células del manto. Rev Esp Patol 2004; 37: 159-72.
3.- Tamura S, Ohkawauchi K, Yokohama Y, Higashidani Y, Daibata M, Hirió M, et al. Non-multiple lymphomatous poliposis form of mantle cell lymphoma in the gastrointestinal tract. J Gastroenterol 2004; 39: 995-1000.
4.- Stein H, et al. Classical Hodgkin lymphoma. Jaffe ES, Harris NL, Stein H, Vardiman JW. Tumors of haematopoietic and lymphoid tissues. Lyon: IARCP Press; 2001: 244-53.
5.- Kanehira K, Braylan RC, Lauwers GY. Early phase of intestinal mantle cell lymphoma: a report of two cases associated with advanced colonic adenocarcinoma. Mod Pathol 2001; 14: 811-7.
6.- Romaguera JE, et al. Frecuency of gastrointestinal involvement and its clinical significance in mantle cell lymphoma. Cancer 2003; 97(3): 586-91.
7.- Salar A, et al. Gastrointestinal involvement in mantle cell lymphoma: a prospective clinic, endoscopic and pathologic study. Am J Surg Pa-thol 2006; 30(10): 1274-80.
8.- Paola Quintas Lorenzo, Inés Castro Novo, Andrés Dacal Rivas, María Francisco González, Joaquín Cubiella Fernández y Javier Fernández Seara. Linfoma de células del manto con afectación intestinal. Rev esp enferm dig 2012; 104(3): 142-43.
9.- Olga Balagué, Lluis Colomo, Elías Campo. Linfoma de células del manto. Rev Esp Patol 2004; 37(2): 159-72.