Se realizó un estudio prospectivo, experimental, tipo ensayo clínico, controlado, no ciego, donde el universo estuvo constituido por 95 pacientes adultos que acudieron a la consulta externa con síntomas dispépticos, en el período de Julio a Diciembre de 2006. A los pacientes se les realizó esofagogastroduodenoscopia con toma de biopsias para estudio histológico. La muestra quedó conformada por 40 pacientes con gastritis crónica activa asociada a Helicobacter pylori, divididos en dos grupos de 20 pacientes, distribuidos aleatoriamente. El grupo A se trató con lansoprazol 60 miligramos diarios, amoxicilina 2 gramos diarios durante siete días y azitromicina 500 miligramos día por 3 días; el grupo B, llevó tratamiento con lansoprazol 60 miligramos diarios, tetraciclina 2 gramos al día ambos por siete días y tinidazol 500 miligramos al día por 3 días.
Erradicación del Helicobacter pylori: efecto de dos terapias triples alternativas.
Dr. Norlan de la Cruz Alfonso. Especialista de Primer grado en Medicina General Integral y en Gastroenterología. Profesor Instructor. Máster en Enfermedades Infecciosas.
Dr. Ramón Yero Rodríguez. Especialista de Primer grado en Gastroenterología.
Dra. Nadia del Rosario Blanco Figueredo. Especialista de Primer grado en Anatomía Patológica.
República Bolivariana de Venezuela. Misión Médica Cubana. Coordinación Nacional de Docencia Médica. Clínica Popular “Simón Bolívar”.
Tesis para optar por el título académico de máster en enfermedades infecciosas. 2008
Resumen.
Se realizó un estudio prospectivo, experimental, tipo ensayo clínico, controlado, no ciego, donde el universo estuvo constituido por 95 pacientes adultos que acudieron a la consulta externa con síntomas dispépticos, en el período de Julio a Diciembre de 2006. A los pacientes se les realizó esofagogastroduodenoscopia con toma de biopsias para estudio histológico. La muestra quedó conformada por 40 pacientes con gastritis crónica activa asociada a Helicobacter pylori, divididos en dos grupos de 20 pacientes, distribuidos aleatoriamente. El grupo A se trató con lansoprazol 60 miligramos diarios, amoxicilina 2 gramos diarios durante siete días y azitromicina 500 miligramos día por 3 días; el grupo B, llevó tratamiento con lansoprazol 60 miligramos diarios, tetraciclina 2 gramos al día ambos por siete días y tinidazol 500 miligramos al día por 3 días.
La tasa de erradicación del grupo A (85%) fue superior a la del grupo B (75%). En los pacientes que se erradicó el Helicobacter pylori hubo una mejoría histológica evidente. Las reacciones adversas encontradas fueron escasas en el grupo A, mientras en el grupo B casi un tercio de los pacientes (35%), presentó algún tipo de reacción, aunque en ambas fueron leves. Se recomienda que en pacientes en los que el tratamiento de erradicación del Helicobacter pylori está indicado y en ausencia de otras opciones terapéuticas, puede iniciarse tratamiento con Azitromicina en esquema de triple terapia, asociado a la Amoxicilina y un inhibidor de la bomba de protones en los diferentes consultorios de Barrio Adentro I.
Introducción.
El descubrimiento del Helicobacter pylori (H. pylori) en 1982, por Warren y Marshall constituyó una revolución en el campo de la gastroenterología y en especial en el estudio de la gastritis al demostrar que dicha bacteria representa más del 80% de las causas de gastritis crónica. (1) Se ha demostrado que el Helicobacter pylori es el agente causal de la gastritis crónica y el factor etiológico fundamental en las úlceras gástrica y duodenal e involucrándose como agente promotor en la patogenia de la atrofia gástrica, metaplasia intestinal, cáncer gástrico y del linfoma MALT (2) (3) (4) (5) (6) (7) (8).
La metaplasia intestinal es el reemplazo de las células gástricas normales por células que semejan al epitelio intestinal. La metaplasia puede ser de dos tipos, tipo I o completo, que semeja el epitelio del intestino delgado y la metaplasia tipo II o incompleta, que a su vez se subdivide en IIa, cuando es por células caliciales, y la IIb, en la que se aprecia un mayor grado de diferenciación celular y que es la asociada en mayor grado con el cáncer gástrico (9). La gastritis crónica se define como una entidad esencialmente histológica, caracterizada por un incremento en el infiltrado a expensas de células inflamatorias crónicas de tipo mononucleares, con o sin presencia de células polimorfonucleares, pudiendo comprometer la mucosa del antro, cuerpo gástrico o ambas al mismo tiempo (10) (figura 1).
Figura 1. Fragmento de mucosa gástrica con moderado infiltrado inflamatorio crónico y presencia de Helicobacter pylori. Tinción de H-E x 400
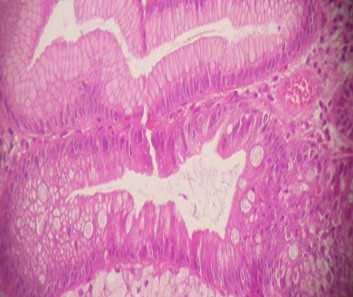
Aunque aparecen determinados factores que predisponen a la infección por Helicobacter pylori, la bacteria posee bien definido factores de virulencia capaces de permitir dicha infección: coloniza la mucosa gástrica por acción de la ureasa, los flagelos, adhesinas, proteínas inhibidoras de la acidez, evade la defensa del paciente por catalasas, superóxido dismutasa y reacción de lipopolisacáridos, además hay daño tisular por citotoxinas, proteasas, inducción de citoquinas y quimiotaxis. Todos estos juntos persisten en el paciente estableciendo la infección crónica (1).
La infección por Helicobacter pylori puede diagnosticarse por métodos invasivos y no invasivos. Los métodos invasivos (incluyen histología, cultivo, test de ureasa, tinción de Gram, prueba de biología molecular – PCR -) requieren de biopsias tomadas por endoscopia. Los métodos no invasivos (incluyen el test respiratorio buscando expulsión de C13 o C14 en el aire espirado, y el estudio serológico, así como las pruebas de biología molecular) no requieren de endoscopia (11). Las pruebas de aliento utilizan la abundante actividad ureásica de Helicobacter pylori, el paciente ingiere urea marcada con un isótopo del carbono (carbono 13 o 14), si el paciente es portador de Helicobacter pylori, la actividad de su ureasa hidroliza la urea y se libera anhídrido carbónico marcado con el isótopo, que es absorbido y espirado. La sensibilidad y especificidad son superiores al 90%.
Las pruebas serológicas utilizadas con mayor frecuencia se basan en el método ELISA, la sensibilidad y especificidad de muchas de estas pruebas superan el 90%. La prueba de ureasa se basa, al igual que la prueba del aliento, en la actividad ureásica que posee el Helicobacter pylori. Consiste en introducir una biopsia endoscópica en un caldo de urea, produciéndose un cambio cromático del amarillo a rosa o rojo, si la actividad ureásica es elevada. Es un examen sencillo, económico y rápido, con una sensibilidad y especificidad superior al 90%.
El método histológico permite la observación del germen en las muestras de biopsias de la mucosa gástrica (figura 2). Es una prueba que permite informar sobre los cambios morfológicos de la mucosa. Su sensibilidad es alta, pero su especificidad es algo baja (70%), probablemente debido a la distribución irregular de Helicobacter pylori o al escaso número de microorganismos (12).
Figura 2. Fragmento de mucosa gástrica con abundantes Helicobacter pylori en el mucus. Tinción Warthin-Starry x 400.

La tinción con Gram es sencilla y económica, sin embargo, tiene baja sensibilidad (60%) por lo que no se utiliza con frecuencia. La tinción con hematoxilina-eosina tiene una sensibilidad y especificidad que varía en un rango de 90-98%. El cultivo es la técnica básica para identificar al microorganismo, pero su uso se reserva para aquellos enfermos en los que ha fallado el tratamiento, permitiendo conocer la aparición de cepas resistentes.
Algunos autores sugieren que más de un método diagnóstico debe ser utilizado para verificar la erradicación del Helicobacter pylori y que la eficacia de los test diagnósticos es significativamente mayor en pacientes positivos vírgenes de tratamiento para Helicobacter pylori. La infección por Helicobacter pylori es muy frecuente considerándose que aproximadamente la mitad de la población mundial la presenta en algún momento de su vida por lo que se puede afirmar sin lugar a dudas que se trata de la infección bacteriana más difundida y prevalente en todo el mundo.
La frecuencia de infección aumenta con la edad para alcanzar un máximo de prevalencia entre la quinta y sexta década para después disminuir con el avance de la edad por posible atrofia de la mucosa gástrica (13).
Las posibles indicaciones de erradicación de la infección por Helicobacter pylori (H. pylori) en la enfermedad no ulcerosa se centran, básicamente, en 4 temas altamente controvertidos: la prevención del cáncer gástrico, la enfermedad por reflujo gastroesofágico (ERGE), la dispepsia - tanto la funcional como la no investigada - y, finalmente, el papel del tratamiento de erradicación en los pacientes que reciben un antiinflamatorio no esteroideo (AINE) de forma crónica.
En los últimos años, la mayoría de las conferencias de consenso coinciden en recomendar a la terapia triple como tratamiento inicial de la infección por Helicobacter pylori: la combinación de un inhibidor de la bomba de protones (IBP), claritromicina y un segundo antibiótico (amoxicilina o metronidazol) administrados a dosis plenas, cada 12 h y durante 7-10 días en Europa (14) y 10-14 días en Estados Unidos (15) (16) (17). Sin embargo, el tratamiento de la infección por Helicobacter pylori sigue siendo un tema controvertido. Surgen nuevas interrogantes que deberán responderse y probablemente nos obligarán a modificar las recomendaciones actuales en un futuro no muy lejano.
En primer lugar, el aumento progresivo de la resistencia antibiótica del Helicobacter pylori merma la eficacia de la terapia triple. Así, aunque las resistencias a la amoxicilina y tetraciclina siguen siendo infrecuentes, han aumentado considerablemente las resistencias a metronidazol y claritromicina (18); el Helicobacter pylori es resistente a metronidazol en 15-66% y en 8-30% a claritromicina (19). La presencia de resistencia a este último antibiótico es especialmente relevante, ya que reduce la eficacia terapéutica de las pautas triples a menos del 25%. Algunos estudios recientes en nuestro medio demuestran tasas de curación superiores al 80% con terapia triple (20). Sin embargo, otros estudios obtienen unas tasas de erradicación mucho más bajas (21).
En segundo lugar, el tratamiento de la infección por Helicobacter pylori debe plantearse como una «estrategia terapéutica» global. Dado que no hay ningún tratamiento que nos asegure el 100% de curaciones, el tratamiento inicial debe escogerse en función no sólo de su eficacia sino también de que se disponga de un tratamiento de segunda línea eficaz. Dicha eficacia no ha de verse afectada por la aparición de resistencias a los antibióticos tras el fracaso terapéutico. En otras palabras, no debemos agotar todos los recursos terapéuticos en el tratamiento inicial y debe preverse una segunda opción válida tras un hipotético fracaso (22).
La mayoría de los estudios se han realizado con un número limitado de fármacos que incluyen: amoxicilina, metronidazol, tetraciclina, claritromicina, las sales de bismuto y los IBP. Se están utilizando nuevos antibióticos en el tratamiento de la infección por Helicobacter pylori, entre ellos destacan las nuevas quinolonas (levofloxacino) (23), la furazolidona (24) y los derivados de la rifampicina, en especial la rifabutina (25) (26) (27) (28) (29). Cómo y dónde introducir estos nuevos fármacos en las actuales estrategias terapéuticas (pautas triple o cuádruple, en el tratamiento de primera línea, de segunda línea o de rescate en pacientes multitratados, etc.) representa una nueva interrogante que deberá ser resuelta en un futuro. La resistencia bacteriana a los nitroimidazoles y el incremento de la resistencia a la claritromicina ha motivado la realización de investigaciones en las terapias alternativas, además de esto, el régimen óptimo depende fuertemente de muchos factores locales, así un régimen efectivo en un área geográfica puede no ser efectivo o práctico en otra área. El costo de los medicamentos es un factor importante que complica las opciones, especialmente en países subdesarrollados y en vías de desarrollo.
Venezuela es un país en vías de desarrollo y se comporta similar al resto del mundo en relación a la alta frecuencia de gastritis y úlcera péptica asociada al Helicobacter pylori, además el costo de algunos medicamentos como por ejemplo la claritromicina es elevado, muchas veces no alcanzable la compra del mismo por gran parte de la población. La azitromicina es un agente potencialmente atractivo para la erradicación de la infección por Helicobacter pylori, dado la excelente concentración inhibitoria en el organismo y una vida media biológica larga (30).
En la misión Barrio Adentro los médicos de las comunidades cuentan con un gran arsenal de medicamentos entre los cuales se encuentran el omeprazol, la amoxicilina y la azitromicina, aunque aquí en Venezuela no se reporta ningún trabajo en la literatura que haga referencia a este régimen terapéutico. Por tal razón nos sentimos motivados para la realización de esta investigación e identificar si en Venezuela y específicamente en este estado es efectiva la combinación de estos medicamentos, toda vez que sería muy útil la aplicación del mismo a nivel de las comunidades como terapia alternativa.
Marco teórico.
El Helicobacter pylori es una bacteria ligeramente curva, con 4 o 6 flagelos envainados en sus polos, Gram negativa, su tamaño oscila de 0.5 a 1.0 um de ancho y de 2.5 a 4.0 um de longitud. Es movible y microaerofílico. Presenta una fuerte capacidad de producción de ureasa y su medio natural es la mucosa gástrica o las áreas donde se ha producido metaplasia gástrica. La bacteria crece en medios de cultivo enriquecidos y en condiciones generalmente alcalinas a una temperatura entre 33 y 40° C (9). Su genoma es circular y su secuencia fue completada por Tomb y cols en 1997. Dicho genoma tiene 1, 667,867 pares de bases, un tercio de las cuales tiene aún funciones desconocidas (1).
La prevalencia de la infección por Helicobacter pylori varía con el status socioeconómico de la población. Es muy alta en África, Asia y muchas partes de América Central y del Sur, mientras es relativamente baja en el Norte y Oeste de Europa, Norteamérica y Australia. Los países subdesarrollados poseen tasas de prevalencia más altas que los países desarrollados. Esta infección se adquiere temprano en la vida; a la edad de 10 años, más del 50% de los niños de todo el mundo están infectados. La prevalencia de la infección por Helicobacter pylori en los adultos de cualquier edad en los países occidentales desarrollados oscila entre el 20 y el 40% y alcanza cifras del 60 al 80% en los países del Tercer Mundo. Estos datos indican, sin lugar a dudas, que la infección por esta bacteria ocupa el primer lugar, por su frecuencia, entre todas las infecciones bacterianas que afectan al género humano (31).
En Cuba se realizó un estudio de prevalencia de la infección por el Helicobacter pylori donde se obtuvo un resultado de 99.9% en los pacientes con úlcera duodenal, un 91.0% en los que presentaban úlcera gástrica, mientras que en los pacientes con gastritis crónica fue de 94%. En pacientes con histología normal la infección tuvo una prevalencia de 68.0% (32). La palabra dispepsia (etimológicamente confusa) significa “dificultad para la digestión”, citada en los diccionarios de castellano como “empacho”, y poco empleada por pacientes e incluso médicos. Se refiere a un conjunto de síntomas originados en el tractus digestivo superior como dolor, ardor o malestar en el epigastrio, distensión en el abdomen superior, saciedad precoz y náuseas. No entran en su definición las manifestaciones clínicas de enfermedad por reflujo gastroesofágico predominante ( pirosis, regurgitaciones ácidas), ni las de aerofagia ( distensión epigástrica con sensación de alivio al eructar).Según los criterios de consenso realizados en la tercera reunión internacional efectuada en Roma, la dispepsia funcional es aquella alteración con dolor o más bien malestar abdominal alto crónico o recurrente, sin evidencia de enfermedad orgánica - incluye panendoscopia - que pueda explicar los síntomas, que dichos síntomas no se alivien exclusivamente con la evacuación o se asocien con cambios en la frecuencia y consistencia de las deposiciones (descarta razonablemente el Síndrome de Intestino Irritable), y la duración debe ser al menos durante 12 semanas no necesariamente consecutivas y dentro de los 12 meses precedentes (33).
La dispepsia no investigada es aquella que presenta los síntomas de dispepsia pero que aún no se ha estudiado (34). El concepto de gastritis ha sido muy difícil de establecer de forma unánime y general dada su heterogeneidad. La presencia de múltiples criterios clínicos, endoscópicos, radiológicos e histológicos han atentado contra una definición integral de la misma. Una de las definiciones más aceptadas es la de Paula Castro, quien considera la gastritis como “un grupo heterogéneo de alteraciones macro – microscópicas de la mucosa gástrica, secundario a una injuria de origen variado, frecuentemente asociada a una respuesta inflamatoria aguda, crónica o mixta” (35) y donde el Helicobacter pylori juega un papel de primer orden en la forma crónica (1).
El segundo reporte del consenso europeo (Maastricht II), formuló indicaciones sobre el manejo de la infección por Helicobacter pylori. En esa reunión de consenso se recomendó, fuertemente, el empleo de la terapia de erradicación del Helicobacter pylori en los siguientes casos: pacientes con úlcera gástrica o duodenal, linfoma tipo MALT, gastritis atrófica, después de resección gástrica por cáncer, familiares de primer grado de pacientes con cáncer gástrico y todos aquellos pacientes que desearan ser tratados. Como indicaciones aconsejables de tratamiento se incluyeron: la dispepsia funcional —sobre la base de que la erradicación puede conducir a una mejoría de los síntomas a largo plazo en un subgrupo de pacientes. En este consenso se señaló, que debido a que la erradicación del Helicobacter pylori no ocasiona enfermedad por reflujo gastroesofágico ni exacerba esta enfermedad cuando ya se ha desarrollado, el Helicobacter pylori debe ser erradicado en pacientes que requieren supresión ácida a largo plazo. También consideraron aconsejable la erradicación del Helicobacter pylori antes de la administración de drogas antiinflamatorias no esteroideas, aunque esta medida, aisladamente, puede ser insuficiente para reducir sangramientos digestivos recurrentes o incrementar la curación de úlceras en pacientes que reciben terapia antisecretora, pero que continúan tomando antiinflamatorios no esteroideos, También Maastricht II introdujo el concepto de “tratamiento en paquete” que considera el empleo de tratamiento de erradicación de primera y segunda línea juntos (36).
Las guías clínicas difieren en sus recomendaciones: Maastricht 2000 recomienda la opción de erradicar el Helicobacter pylori en pacientes con dispepsia funcional (18) y otros autores recomiendan tratar la dispepsia no investigada (37), una guía escocesa reciente deja la puerta abierta tanto al tratamiento erradicador como al tratamiento antisecretor (38) y finalmente, la guía realizada conjuntamente por la Sociedad Española de Medicina de Familia y Comunitaria y la Asociación Española de Gastroenterología recomienda explícitamente no realizar erradicación (39). En la segunda conferencia de Consenso Española, sobre la infección por Helicobacter pylori, se llegó al criterio de indicar erradicación en la úlcera péptica, linfoma MALT de bajo grado, neoplasia gástrica resecada, familiares de primer grado de pacientes con neoplasia gástrica y dispepsia no investigada, en el caso del tratamiento con AINE y dispepsia funcional, los pacientes deben ser seleccionados. No se debe indicar tratamiento de erradicación en la enfermedad por reflujo gastroesofágico, manifestaciones extradigestivas y como prevención del cáncer gástrico poblacional.
Con relación a los tratamientos erradicadores de elección, así como de rescate, concluyeron: como tratamiento de primera línea, la combinación de un inhibidor de la bomba de protones (IBP), o ranitidina-citrato de bismuto (RCB) más claritromicina y amoxicilina durante 7 días, en el caso de fracaso, se utilizaría como segunda línea, la cuádruple terapia con un IBP, subcitrato de bismuto, tetraciclina y metronidazol o una triple terapia con RCB, más tetraciclina y metronidazol, ambos esquemas por espacio de 7 días, tras fallo de este régimen terapéutico se acudiría a la tercera línea o terapia de rescate empleando un IBP, amoxicilina y levofloxacino o un IBP, amoxicilina más rifabutina o un IBP, subcitrato de bismuto, tetraciclina, más furazolidona, todos los esquemas con una duración de 7-14 días (40) (41) (42).
En Maastricht III se plantea que parece razonable investigar y tratar la infección por Helicobacter pylori en pacientes dispépticos cuando se muestran refractarios al tratamiento antisecretor. Teniendo en cuenta, además, que se trata de un tratamiento puntual de una semana de duración, la erradicación sería también una opción razonable antes de establecer un tratamiento prolongado con antisecretores, procinéticos o antidepresivos en los pacientes con síntomas recidivantes (43) (44). El tratamiento de la infección por Helicobacter pylori es cada vez más complicado porque existen pocos tratamientos nuevos y porque ha aumentado la resistencia a los antimicrobianos habituales. La resistencia a metronidazol y a claritromicina es frecuente actualmente en la mayoría de los países desarrollados. Por lo tanto las tasas de erradicación son más bajas, tanto en ensayos clínicos como en la práctica clínica. En un estudio multicéntrico realizado en el periodo 1998-2002 encuentran una tasa de resistencia a metronidazol del 25,1%, a claritromicina de 12,9% y 0,9% a la amoxicilina (45)
El alto costo y complejidad de esquemas terapéuticos para la erradicación de la infección por Helicobacter pylori han estimulado la búsqueda de opciones de tratamiento más simples y más baratas (46). Una propuesta de terapia ultracorta incluye, lansoprazol, bajas dosis de azitromicina por 3 días y una sola dosis de tinidazol con una baja incidencia de efectos adversos y una tasa de erradicación de 85-95% (47) (48). Así, existen varios trabajos que utilizan la azitromicina en la terapia de erradicación en varias partes del mundo, en Rusia, Ivashkin utilizando azitromicina, amoxicilina y omeprazol obtuvo un 72% de erradicación, superior al grupo comparativo de omeprazol, amoxicilina y metronidazol (49).
En Cuba, el doctor Roberto Pérez obtuvo con el empleo de una terapia corta utilizando omeprazol, azitromicina y tinidazol un 80% de erradicación del Helicobacter pylori, mientras que el grupo que utilizó metronidazol además del omeprazol y la azitromicina logró un 70% de erradicación (50). Otros reportes informan rangos de erradicación con el empleo de la azitromicina como uno de los dos antibióticos en la triple terapia que varían entre 22% y 93% (51) (52).
En la Clínica Popular “Simón Bolívar” del Estado Carabobo, el número de pacientes vistos con síntomas dispépticos y diagnóstico de infección por Helicobacter pylori es elevado en las consultas de medicina interna y gastroenterología, además en Barrio Adentro I dicho problema de salud es igualmente frecuente en la práctica médica diaria. En Venezuela no se han reportado trabajos relacionados con el empleo de la azitromicina como antibiótico en el uso de una triple terapia alternativa en la erradicación del Helicobacter pylori y creemos que sería una opción a tener en cuenta dada la posibilidad de que los pacientes en Barrio Adentro pueden adquirir de forma gratuita los medicamentos y dentro de ellos están incluidos el inhibidor de la bomba de protones (omeprazol), la amoxicilina y la azitromicina, esto facilita una terapia inicial no costosa en los pacientes que requieran la erradicación del mismo y se aseguraría el uso de otros medicamentos para segunda línea o terapia de rescate en aquellos donde persista la infección.
Objetivos.
Objetivo General:
Determinar el efecto de la terapia con azitromicina y amoxicilina contra tetraciclina y tinidazol asociados a lansoprazol en la erradicación del Helicobacter pylori. Clínica Popular Simón Bolívar.2006.
Objetivos Específicos:
1.- Determinar la frecuencia de erradicación de la infección por Helicobacter pylori al mes de concluido el tratamiento.
2.- Identificar el comportamiento histológico al mes de concluido el tratamiento.
3.- Describir las reacciones adversas a los medicamentos.
Material y método.
Se realizó un estudio prospectivo, experimental, tipo ensayo clínico, controlado, no ciego, donde el universo estuvo constituido por 95 pacientes adultos que acudieron a la consulta externa de gastroenterología, con síntomas dispépticos sugestivos de gastritis crónica en el periodo comprendido de Julio a Diciembre del 2006 en la Clínica Popular “Simón Bolívar”, municipio Diego Ibarra, Estado Carabobo.
Criterios de Inclusión.
- Gastritis crónica antral activa con Helicobacter pylori positivo diagnosticada histológicamente con 4 biopsias del antro gástrico a más de 5 cm. del píloro, 2 de cara anterior y 2 de cara posterior.
- Consentimiento por escrito de los pacientes. (Anexo 1)
Criterios de Exclusión.
- Edad menor de 15 y mayor de 60 años.
- Haber llevado tratamiento con antiinflamatorios no esteroideos (AINES), tratamiento con antibióticos o antidepresivos en el último mes.
- Embarazadas y puérperas.
- Pacientes nefrópatas.
- Gastritis con signos recientes de sangramiento.
- Lesión ulcerosa asociada.
- Operado de estómago.
- Alergia conocida a los medicamentos a utilizar.
- Pacientes con diagnóstico anterior de alguna de las formas especiales de gastritis (enfermedad de Menetrier, etc.).
Una vez que fueron aplicados estos criterios la muestra quedó conformada por 40 pacientes que se dividieron en dos grupos de 20 pacientes cada uno distribuidos aleatoriamente según la tabla de números aleatorios (Anexo 2). El tamaño de la muestra estuvo limitado a este número de pacientes por la cantidad de medicamento disponible que se le administró gratuitamente.
Grupos de tratamiento y esquema terapéutico.
Grupo A- Llevó tratamiento con lansoprazol 30 miligramos (laboratorios ELTER, República Bolivariana de Venezuela) 1 cápsula cada 12 horas, amoxicilina 500 miligramos (GENVEN República Bolivariana de Venezuela) 2 cápsulas cada 12 horas, ambos medicamentos por una duración de 7 días y azitromicina 500 miligramos (NOVATEC, República de Cuba) 1 cápsula al día durante 3 días.
Grupo B- Se trató con Lansoprazol 30 miligramos (laboratorios ELTER, República Bolivariana de Venezuela) 1 cápsula cada 12 horas, tetraciclina 250 miligramos (IMEFA, República de Cuba) 2 cápsulas cada 6 horas, ambos medicamentos durante 7 días y tinidazol 500 miligramos (laboratorios ELTER, República Bolivariana de Venezuela) 2 cápsulas una vez al día durante 3 días. Se les informó a los pacientes que la tetraciclina debía ser ingerida sin leche, para evitar interferencia en su absorción.
Una vez visto el paciente en consulta externa se citó para realizar la primera endoscopia diagnóstica con toma de 4 biopsias del antro para histología, el frasco con la muestra se rotuló y se llevó por el autor del trabajo al departamento de anatomía patológica para realizarle los cortes necesarios y análisis por el método de tinción de Hematoxilina y Eosina. Los pacientes que presentaron gastritis crónica antral activa diagnosticada histológicamente asociados a Helicobacter pylori fueron incluidos en el estudio. Los datos del paciente se obtuvieron por medio de un modelo de vaciamiento de datos (Anexo 3).
Se les entregó los medicamentos a los pacientes conjuntamente con una planilla de control de cumplimiento del tratamiento (Anexo 4) que se chequeó al concluir el mismo a los 7 días, se le dio cita para un mes después de terminado el tratamiento y se realizó la endoscopia de control con toma de muestras para estudio histológico. Se utilizó un equipo de endoscopia vídeo Olympus Evis Exera GIF Q-145, el cual se desinfectó y esterilizó con una solución ácida acuosa de Glutaraldehído (sonacida), antes de realizar la prueba para la toma de biopsias.
Criterios de Salida del Ensayo Clínico.
- Incumplimiento en el tratamiento.
- Negativa a continuar en el estudio.
- Ausentarse a alguno de los exámenes endoscópicos o seguimiento evolutivo.
- Reacciones de intolerancia o inmunoalergia a los medicamentos.
Ningún paciente salió de la investigación, todos culminaron el estudio satisfactoriamente. Las variables utilizadas fueron divididas en variable microbiológica, histológica y clínica. La variable microbiológica empleada fue la erradicación del Helicobacter pylori. La erradicación del Helicobacter pylori se definió como la ausencia del mismo en la mucosa gástrica antral, lugar donde habita con mayor frecuencia (18), un mes después de terminado el tratamiento. El diagnóstico fue por el método histológico.
La variable histológica fue dividida en categorías, las cuales fueron informadas por el patólogo como: mucosa gástrica normal, gastritis crónica ligera, gastritis crónica moderada y gastritis crónica severa. Esta clasificación fue hecha según la descripción morfológica del sistema de Sydney (53) (54).
Mucosa gástrica normal: se observaron las glándulas gástricas de forma, número y disposición normal, sin presencia de células inflamatorias en la lámina propia.
Gastritis crónica ligera (G.C.L.): se observó un escaso infiltrado inflamatorio crónico constituido por linfocitos y plasmocitos, localizados en la porción más superficial de la mucosa, sin observarse disminución del número de glándulas.
Gastritis crónica moderada (G.C.M.): se caracterizó por un infiltrado inflamatorio crónico compuesto por linfocitos y plasmocitos que se extendió a todo el grosor de la mucosa uniformemente, con escasa pérdida de glándulas.
Gastritis crónica severa (G.C.S.): existió un extenso infiltrado inflamatorio crónico integrado por linfocitos y plasmocitos que ocupa todo el grosor de la mucosa, con moderada pérdida de glándulas.
En cualquiera de estos tres grados de afección inflamatoria, se observó la presencia o no de Helicobacter pylori en el mucus que recubre la superficie de la mucosa y las foveolas gástricas, éstas últimas son invaginaciones del epitelio formando estructuras tubulares. Se determinó el comportamiento histológico antes del tratamiento y al mes de concluido el mismo en ambos grupos de estudio, teniendo en cuenta la erradicación del Helicobacter pylori. Para hacer la evaluación de la respuesta histológica al mes de terminado el tratamiento la dividimos en mejor, igual y peor.
Mejor: cuando se pasó de una categoría histológica a otra inferior (más leve).
Igual: cuando se mantuvo en igual categoría histológica.
Peor: cuando pasó a una categoría histológica superior (más severa).
La variable clínica valorada incluyó las reacciones adversas a los medicamentos de la triple terapia usada (sabor metálico, mareos, cefalea y diarreas). Estas reacciones adversas las dividimos en leves cuando no fue necesario suspender el tratamiento pues el paciente las toleraba, así como que regresaban espontáneamente y moderadas cuando fue necesaria la suspensión de la terapia. A los pacientes que no erradicaron la infección por Helicobacter pylori una vez concluida la investigación se les indicó tratamiento erradicador con otras terapias de segunda línea.
Criterio de Eficacia. Microbiológico: Erradicación del Helicobacter pylori al mes de concluido el tratamiento.
Recolección de la Información. La información se recolectó en un modelo (Anexo 3) donde se registraron las respuestas de las variables a medir.
Procesamiento de la Información. La información se procesó de forma manual utilizando una calculadora de mesa y se analizó utilizando el programa MICROSTAT en una computadora Pentium 4.
Análisis Estadístico. Se realizó un análisis descriptivo y se calcularon las frecuencias absolutas y relativas (%) de las categorías de las variables medidas. Los resultados se presentan en tablas y gráficos.
Resultados y discusión.
Tabla nš 1. Distribución de pacientes según erradicación del Helicobacter pylori en ambos grupos de estudio. Clínica Popular “Simón Bolívar”. 2006. Fuente: Planilla de vaciamiento de datos.
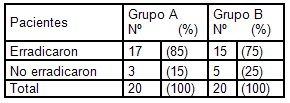
Tabla nš 1: Al analizar el efecto de la triple terapia con Lansoprazol, Amoxicilina y Azitromicina (LAAz) en la erradicación del Helicobacter pylori un mes después de concluido el tratamiento, pudimos observar que de los 20 pacientes tratados con esta terapia, 17 (85%) erradicaron el Helicobacter pylori, mientras que en el grupo tratado con Lansoprazol, Tetraciclina y Tinidazol (LTT) se obtuvo la erradicación en 15 pacientes para un 75%. Gráfico nš 1 (Anexo 5).
La infección por Helicobacter pylori es común en el estómago humano y está relacionada con varias enfermedades del aparato digestivo como la gastritis, la enfermedad ulcerosa péptica, el linfoma y el cáncer gástrico. Generalmente se acepta que algunas de las enfermedades relacionadas con esta infección son curables si la erradicación es efectiva. La antibioticoterapia, actualmente, a pesar de sus inconvenientes que incluyen el costo, los efectos colaterales y la resistencia a los antibióticos, es el procedimiento de elección para la erradicación de esta infección, hasta tanto no se disponga de una vacuna de administración oral con propiedades terapéuticas (55).
La resistencia al metronidazol y a otros antibióticos, inclusive a la claritromicina, es un problema emergente para lograr una erradicación eficaz de la bacteria. Regímenes de erradicación con tres o cuatro drogas anti Helicobacter pylori son los más eficaces (56). La otra opción es utilizar nuevos fármacos que constituyan una alternativa válida a los ya existentes y la azitromicina es uno de ellos, macrólido con mayor vida media que la claritromicina (57). Nosotros utilizamos, para la realización de este trabajo una triple terapia que incluyó un inhibidor de la bomba de protones (lansoprazol), amoxicilina y azitromicina y la de control con lansoprazol, tetraciclina y tinidazol, aunque sabemos que existen esquemas de tratamiento que presentan mejores resultados (14) (15).
En este estudio se obtuvo una erradicación de la infección por Helicobacter pylori de 85%, en el grupo de LAAz, superior al del grupo tratado con LTT con 75%.Gráfico # 1 (Anexo 5). En el primer grupo el porcentaje de erradicación en estos momentos es considerada eficaz, pues por encima de 80% es una cifra aceptada como indicador eficaz en la terapia de erradicación (29). Este resultado obtenido es superior al logrado en Chile por autores como Flores y colaboradores, donde su terapia con azitromicina, amoxicilina y omeprazol fue considerada por ellos como poco efectiva, al obtener sólo un 55% de erradicación (45), además es superior al de Cidrao Frota y colaboradores quienes obtuvieron un porciento erradicador de 26,9% en Brasil(57).
Igualmente nuestro resultado fue superior al reportado por Chahine C y colaboradores, quienes obtuvieron resultados de erradicación de 36% y 26% en dos grupos de tratamientos donde emplearon esquemas de erradicación con tres días y cinco días de duración respectivamente (58). Ivashkin, en un estudio realizado en Rusia, reportó un porciento de erradicación de 72% y concluye que la azitromicina es un componente efectivo como régimen basado en una triple terapia erradicadora, nuestro resultado fue algo superior a dicho estudio (49). Sin embargo en este trabajo se obtuvo un porciento de erradicación inferior al reportado por otros autores, citando incluso cifras de efectividad de hasta un 93%(51) (52).
En determinados pacientes, en que los hallazgos histológicos comporten signos de alarma tales como gastritis crónica atrófica, presencia de focos de metaplasia intestinal o displasia y en aquellos con síntomas clínicos muy severos, que no encuentren mejoría después de ensayar otras modalidades terapéuticas, estaría justificado iniciar tratamiento de erradicación del Helicobacter pylori en el curso de una dispepsia no ulcerosa (43) (44). Desde hace algún tiempo, hay consenso en cuanto a tratar los pacientes Helicobacter pylori positivos con ulcera gástrica y duodenal, más recientemente, se ha indicado la terapia de erradicación en los pacientes con linfoma tipo MALT (59).
Teniendo en cuenta que en Venezuela no se reportan estudios relacionados con terapias de erradicación del Helicobacter pylori, donde se emplee la azitromicina asociado a la amoxicilina en triple terapia, y nosotros obtuvimos un 85% de erradicación, cifra superior a la admitida en consensos como efectiva (80%), la consideramos una opción terapéutica, sobre todo a nivel primario de salud, donde la misión médica de Barrio Adentro proporciona de forma gratuita dichos medicamentos y donde acude el mayor por ciento de la población excluida, con menos recursos económicos, que en muchas ocasiones se ven imposibilitados de adquirir medicamentos que oscilan con elevados precios como es el caso de la claritromicina.
Tabla # 2. Distribución de pacientes en el grupo A y su comportamiento histológico antes y después del tratamiento según erradicación del Helicobacter pylori.
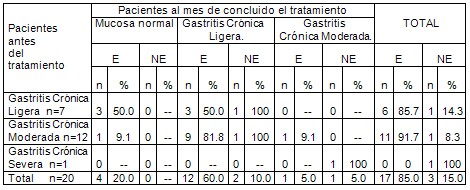
Fuente: Planilla de vaciamiento de datos. E: erradicaron. NE: no erradicaron. Nota: Los porcentajes de las casillas internas fueron hallados por filas.
Tabla Nš 2: Al analizar el comportamiento histológico antes del tratamiento y al mes de concluido el mismo, en el grupo LAAz encontramos que de los 7 pacientes con gastritis crónica ligera antes del tratamiento, 3 pacientes (50.0%) de los 6 pacientes que erradicaron al mes de concluido el tratamiento pasaron a una histología normal, los otros 3 pacientes (50.0%) se mantuvieron con gastritis crónica ligera y de los que no erradicaron, 1 (14.3%), se mantuvo en gastritis crónica ligera En los 12 pacientes con gastritis crónica moderada antes del tratamiento, 1 (9.1%) de los 11 pacientes que erradicaron el Helicobacter pylori normalizó la histología, 9 pacientes (81.8%) pasaron a una categoría histológica inferior: gastritis crónica ligera, y 1 paciente (9.1%) se mantuvo con el mismo diagnóstico de gastritis crónica moderada. El paciente que no erradicó el Helicobacter pylori (8.3%) mejoró al pasar a gastritis crónica ligera El paciente que antes del tratamiento presentaba una gastritis crónica severa no erradicó el Helicobacter pylori al mes de concluido el tratamiento, sin embargo, mejoró histológicamente pasando a una gastritis crónica moderada. Ningún paciente al concluir el tratamiento tuvo gastritis crónica severa.
En la tabla 2 se aprecia cómo los pacientes a los que se les administró triple terapia con LAAz y erradicaron la infección por Helicobacter pylori, tuvieron una mejoría histológica importante, incluso, se alcanzó la normalidad histológica en el 20%, en contraste con aquellos pacientes que no erradicaron, en que ninguno alcanzó la categoría histológica normal. En el Gráfico 2 (Anexo 5) se ilustra la mejoría histológica de los pacientes que erradicaron la infección por Helicobacter pylori un mes después de terminado el tratamiento, tanto en el grupo de LAAZ como en el de LTT, sin una diferencia estadística importante.
Tabla # 3. Distribución de pacientes en el grupo B y su comportamiento histológico antes y después del tratamiento según erradicación del Helicobacter pylori.
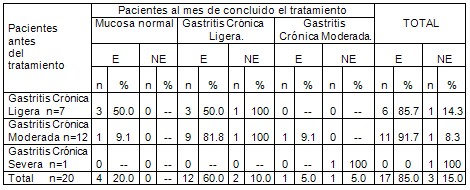
Fuente: Planilla de vaciamiento de datos. E: erradicaron. NE: no erradicaron. Nota: Los porcentajes de las casillas internas fueron hallados por filas.
Tabla # 3. En esta tabla se describe el comportamiento histológico antes del tratamiento y al mes de concluir el mismo en el grupo LTT. De los 8 pacientes que iniciaron el estudio con gastritis crónica ligera, 2 pacientes (33.3%) de los 6 que erradicaron al mes de concluir el tratamiento, lograron pasar a la histología normal, los otros 4 pacientes (66.7%), se mantuvieron con la misma histología, de los dos que no erradicaron el Helicobacter pylori, un paciente (50.0%) se mantuvo en gastritis crónica ligera y el otro (50.0%) empeoró al pasar a gastritis crónica moderada.
En los 10 pacientes que antes del tratamiento tenían gastritis crónica moderada, uno (14.3%) de los 7 que erradicaron pasó a histología normal, otros 5 (71.4%) pasaron a gastritis crónica ligera, el otro paciente que erradicó, se mantuvo histológicamente igual; de los 3 pacientes (30%) que no erradicaron, 2 (66,7%) pasaron a la categoría histológica inferior, o sea, gastritis crónica ligera, y uno (33.3%) mantuvo igual condición histológica. De los dos casos que comenzaron antes del tratamiento con gastritis crónica severa, uno (50%) erradicó la bacteria y mejoró histológicamente al pasar a gastritis crónica ligera, el otro paciente (50%), mejoró al lograr la categoría histológica de gastritis crónica moderada. Ningún paciente al mes de concluir el tratamiento tuvo gastritis crónica severa.
Gráfico # 2. Se presenta la evaluación de la respuesta histológica observada en la tabla No. 2 y No. 3 en los pacientes que erradicaron el Helicobacter pylori al mes de concluido el tratamiento, observándose que la mayor proporción de los pacientes que erradicaron el Helicobacter pylori mejoraron histológicamente en el grupo A con un 76,5%, mientras en el grupo B mejoró histológicamente el 66,6% de los casos. (Anexo 5)
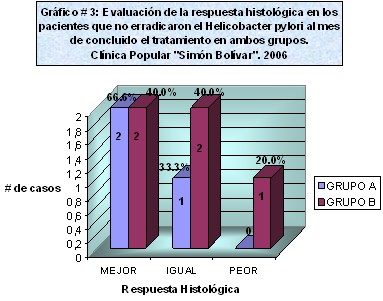
Gráfico # 3. Al evaluar la respuesta histológica en los pacientes que no erradicaron el Helicobacter pylori en el grupo LAAz, al mes de concluido el tratamiento, no se observaron diferencias significativas respecto al comportamiento histológico del grupo LTT, pues en ambos sólo se logró la mejoría histológica en dos pacientes. (Anexo 5)
Al analizar el comportamiento histológico en el grupo de LTT, se observó mejoría en forma general en aquellos pacientes que lograron la erradicación del Helicobacter pylori, algunos alcanzando la categoría normal (15%) y otros pasando a una categoría histológica inferior o más leve. (Ver Tabla # 3).
Estos resultados concuerdan con la literatura revisada que señala la mejoría y la restauración de la normalidad histológica en los pacientes con gastritis crónica después de la erradicación de la infección por Helicobacter pylori, aún, en aquellos con gastritis crónica atrófica (60) (61) (62). Por otra parte, en nuestros resultados se observó que 4 pacientes (dos de cada grupo) que no erradicaron la infección por Helicobacter pylori mejoraron histológicamente, pero ninguno de ellos restauró hasta la normalidad la mucosa y solo se observaron cambios de una categoría histológica a la inmediata inferior. Esta mejoría histológica discreta pudiera estar en relación con una disminución de la densidad de las bacterias como resultado del tratamiento antibiótico empleado. En estos pacientes, al producirse un probable aclaramiento de la infección, aunque no llegue a erradicarse, se puede esperar que se produzca una leve mejoría histológica (Ver tabla # 2 y 3)
Tabla # 4. Reacciones adversas a los medicamentos. Fuente: Encuesta Realizada.
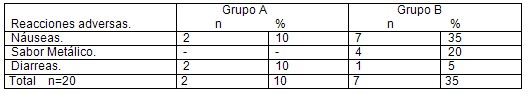
En la tabla # 4 se observa que sólo dos pacientes (10%) del grupo A (LAAz) presentaron reacciones adversas a los medicamentos, en este caso náuseas y diarreas, el grupo B (LTT) presentó más reacciones adversas a los medicamentos, y donde las náuseas fueron las más frecuentes, presentes en 7 pacientes (35%), seguida en frecuencia por el sabor metálico con 4 pacientes (20%) y diarreas en 1 paciente (5%).
Las reacciones adversas a los medicamentos se presentaron más frecuentemente en el grupo de LTT, donde las náuseas (35%) y el sabor metálico (20%) fueron las que predominaron, en ambos grupos dichas reacciones fueron leves y no fue necesario suspender el tratamiento. (Tabla #4) Nuestro resultado es similar al reportado por Flores y colaboradores donde las náuseas (32%) y las diarreas fueron leves. Igualmente es similar a un estudio en Grecia reportado por Anagnostopoulos (63). El esquema de tratamiento con LAAZ propuesto en nuestro estudio es bien tolerado, sencillo, sin efectos adversos importantes y más eficaz que el grupo de LTT, por lo tanto podría formar parte de las terapias alternativas en la erradicación del Helicobacter pylori.
Conclusiones.
La triple terapia con Lansoprazol, Amoxicilina y Azitromicina en la erradicación del Helicobacter pylori al mes de concluido el tratamiento fue eficaz y superior a la terapia con Lansoprazol, Tetraciclina y Tinidazol.
En los pacientes que se erradicó el Helicobacter pylori al mes de concluido el tratamiento se observó una mejoría histológica evidente en ambos grupos. Las reacciones adversas encontradas fueron más frecuentes en el grupo de Lansoprazol, Tetraciclina y Tinidazol, aunque en ambas terapias fueron leves.
Recomendación.
En pacientes en los que el tratamiento de erradicación del Helicobacter pylori está indicado y en ausencia de otras opciones terapéuticas, puede iniciarse tratamiento con Azitromicina en esquema de triple terapia asociado a la Amoxicilina y un inhibidor de la bomba de protones en los diferentes consultorios de Barrio Adentro I.
ANEXOS.
Anexo 1. Consentimiento por escrito del paciente.
Clínica Popular “Simón Bolívar”. Departamento de Gastroenterología.
Trabajo de Investigación. Erradicación del Helicobacter pylori.
Consentimiento Informado. Fecha:
Yo, ---------------------------------------------------------------------------, paciente mayor de edad, portador de cédula de identidad número ----------------------- con residencia en: ---------------------------------------------------------------------------------------------------------- declaro que he recibido del médico tratante la información necesaria sobre el padecimiento y el tratamiento a emplear para la erradicación del Helicobacter pylori. En base a la información recibida doy consentimiento amplio, válido y legítimamente manifestado a través de este documento para participar en el ensayo clínico.
FIRMAS:
PACIENTE:
ACOMPAÑANTE:
MEDICO:
Anexo 2. Tabla de distribución aleatoria de pacientes por grupos durante el ensayo clínico.
Anexo 3. Modelo de vaciamiento de datos. Clínica Popular “Simón Bolívar”. Consulta externa. Datos generales.
Primer apellido
Segundo apellido
Nombre
Edad: __________
Dirección: ______________________________________________
Teléfono: _________________
Variable histológica.
Categorías Antes del tratamiento Al mes de concluido el tratamiento
Gastritis crónica ligera _____________ _____________
Gastritis crónica moderada _____________ _____________
Gastritis crónica severa _____________ _____________
Variable clínica.
Reacciones adversas a los medicamentos: P: presente A: ausente
Diarreas: P: presente A: ausente
Sabor metálico: P: presente A: ausente
Cefalea: P: presente A: ausente
Erupción en la piel: P: presente A: ausente
Mareos: P: presente A: ausente
Otros (Cuáles): P: presente A: ausente _______________
Variable microbiológica
Erradicación del Helicobacter pylori (al mes de concluido el tratamiento): SI: __ NO: __
Anexo 4.1. Planilla de control de cumplimiento del tratamiento.
Planilla de información y control individual del cumplimiento del tratamiento. GRUPO A
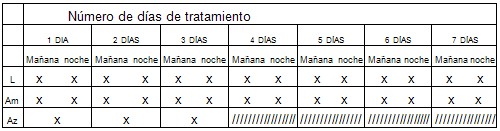
Circular cada X a medida que ingiera el medicamento del día.
Lansoprazol (30 miligramos) 1 cápsula cada 12 horas durante 7 días. En la mañana en ayunas, en la noche al acostarse.
Amoxicilina (500 miligramos) 2 cápsulas cada 12 horas durante 7 días. En la mañana y al acostarse.
Azitromicina (500 miligramos) 1 cápsula al día durante 3 días. En la mañana en ayunas.
Firma del paciente
Anexo 4.2. Planilla de control de cumplimiento del tratamiento.
Planilla de información y control individual del cumplimiento del tratamiento. GRUPO B
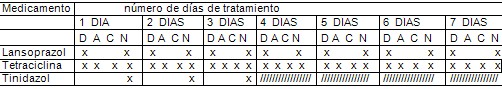
Circular cada X a medida que ingiera el medicamento del día.
Lansoprazol (30 miligramos) 1 cápsula cada 12 horas durante 7 días.
Tetraciclina (250 miligramos) 2 cápsulas cada 6 horas durante 7 días. No ingerirla con leche.
Tinidazol (500 miligramos) 2 cápsulas una vez al día durante 3 días.
D- antes del desayuno. A- almuerzo. C- cena
___________________
Firma del paciente.
Anexo 5.
Gráfico nš 1: distribución de pacientes según erradicación del Helicobacter pylori en ambos grupos.
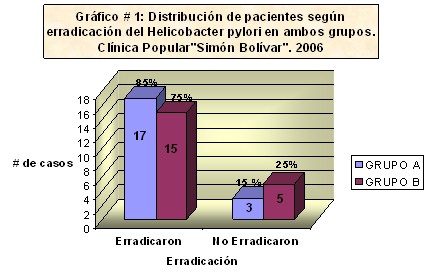
Gráfico nš 2: evaluación de la respuesta histológica en los pacientes que erradicaron el Helicobacter pylori al mes de concluido el tratamiento en ambos grupos.
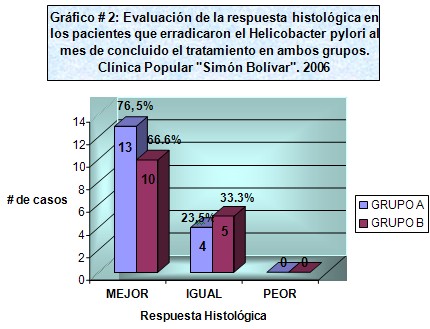
Gráfico nš 3: evaluación de la respuesta histológica en los pacientes que no erradicaron el Helicobacter pylori al mes de concluido el tratamiento en ambos grupos.
Bibliografía.
1.- Orellana I y Poniachik J. Infección por Helicobacter pylori. Medwave. Mayo 2003. No 4.
2.- Piqué Badía JM. Relación entre Helicobacter pylori, gastritis crónica y cáncer gástrico. Medicine. 2004; 09:93-9.
3.- Bardají Ruiz A. Helicobacter pylori y cáncer gástrico. GH Continuada. 2006; 5:31-2.
4.- Benito Bartolomé F, Sánchez Fernández-Bernal C y Torres Meced V. Helicobacter pylori y enfermedades relacionadas. Epidemiología y factores de riesgo. GH Continuada. 2004; 3:25-5.
5.- Feu Caballé F. Linfoma gástrico tipo MALT. Medicine.2004;09:112-8.
6.- Morales Chamorro R, Méndez Vidal MJ y Aranda Aguilar E. Cáncer de estómago. Medicine. 2005; 09: 1613-20.
7. - Correa P. The biological model of gastric carcinogenesis. IARC Sci Pub 2004; 157:301-310.
8. - You W-C, Brown LM and Zhang L. Randomized Double-blind factorial trial of three treatments to reduce the prevalence of precancerous gastric lesions. Journal of the National Cancer Institute.2006; 98: 974-83.
9. - Salas Sánchez WA, Benítes Galvez MR y Salinas Cerquin C. Asociación de Helicobacter pylori y patología gástrica no neoplásica en una clínica privada de Lima Norte. Rev Med Hered 16(2).2005.89.
10.- Gisbert J y Pajares García J. Gastritis aguda y crónica. Sección II: estómago. En tratamiento de las enfermedades gastroenterológicas. AEG. 2001; 82-91.
11.- Viscaíno A A, Fochesatto N A, Guayán V A y Moran E L. Helicobacter pylori y enfermedad gastroduodenal. Bases para el diagnóstico y tratamiento. Revista de postgrado de la VIa Cátedra de medicina. Oct 2004; 138: 11-17.
12. - Suerbaum S and Michetti P. Helicobacter pylori infection. N Engl J Med 2002; 347: 1175-1186.
13.- Kamada T, Sugiu K, Hata J, Kusunaki H, Hamada H, et al. Histological findings in the Helicobacter pylori positive Japanese young adults. J Gastroenterol Hepatol 2006; 21(1): 258-61.
14. - Gisbert JP, Khorrami S, Calvet X, Pajares JM. Pantoprazole based therapies in Helicobacter pylori eradication: systematic review and meta-analysis. Eur J Gastroenterol Hepatol 2004; 16: 89-99.
15- Martínez JD, Henao SC y Granados C. La gastritis crónica atrófica corporal y la edad. Rev Col Gastroenterol 2007; 22 (1).
16.- Acosta R, Franchi N, Franchi M, Maidana L, Gularte GP y Gómez Rinesi JF. Terapéutica de alta eficacia en la erradicación del Helicobacter pylori. Revista de Postgrado de la VIa Cátedra de Medicina. 127-mayo 2003. 11-13.
17.-Gisbert JP, Calvet X, Gomollon F, Sainz R. Tratamiento erradicador de Helicobacter pylori. Recomendaciones de la Conferencia Española de Consenso. Med Clin (Barc) 2000; 114:185-95
18.-Malfertheiner P, Megraud F, O’Morain C, Hungin AP, Jones R, Axon A, et al.. Current concepts in the management of Helicobacter pylori infection the Maastricht 2-2000 Consensus Report. Aliment Pharmacol Ther 2002; 16:167-80.
19. - Buzás GM and Józan J. First-line eradication of Helicobacter pylori infection in Europe: A meta-analysis based on congress abstracts, 1997-2004. World J Gastroenterol 2006. September 7; 12 (33): 5311-5319.
20.- Díaz Regañón J, Alarcón T, Domingo D y López Brea M. Sensibilidad de 36 aislamientos de Helicobacter pylori a cuatro antibióticos de primera línea y características de virulencia. Rev Esp Quimioterap Marzo 2006; Vol. 19, No 1:34-38.
21.-Mégraud F. Helicobacter pylori antibiotic resistance: prevalence, importance, and advances in testing. Gut 2004; 53:1374-84. [Medline]
22.-Calvet X, Ducons J, Guardiola J, Tito L, Andreu V, Bory F, et al. One-week triple vs. Quadruple therapy for Helicobacter pylori infection a randomized trial. Aliment Pharmacol Ther 2002; 16:1261-7
23.-Palmas F, Pellicano R, Massimetti E, Berrutti M, Fagoonee S, Rizzetto M.. Eradication of Helicobacter pylori infection with proton pump inhibitor-based triple therapy. A randomised study. Panminerva Med 2002; 44: 145-7.
24.-X Calvet y E Gené. Erradicar Helicobacter pylori. ¿Terapia triple o cuádruple?, ¿corta o larga? Gastroenterol Hepatol 2003; 26: 325 – 329.
25.-Cammarota G, Cianci R, Cannizzaro O, Cuoco L, Pirozzi G, Gasbarrini A, et al. Efficacy of two one-week rabeprazole/levofloxacin-based triple therapies for Helicobacter pylori infection. Aliment Pharmacol Ther 2000; 14:1339-43. [Medline]
26. - Isakov V, Domareva I, Koudryavtseva L, Maev I, Ganskaya Z. Furazolidone-based triple «rescue therapy» vs. quadruple «rescue therapy» for the eradication of Helicobacter pylori resistant to metronidazole. Aliment Pharmacol Ther 2002; 16:1277-82. [Medline]
27.-Gisbert JP, Calvet X, Bujanda L, Pajares J. Rescue therapy with rifabutin after multiple Helicobacter pylori treatment failures. Helicobacter 2002.
28.-Calvet X. Helicobacter pylori infection: teatment options. PubMed Medline 2006; 73 suppl 1:119-28.
29. - Di Mario F, Cavallaro LG and Scarpignato C. Rescue Therapies for the management of Helicobacter pylori infection. Digestive Diseases 2006; 24: 113-130.
30.- Mensa J, Gatell JM, Jiménez de Anta JM, Prats G y Domínguez-Gil A. Guia de Terapêutica antimicrobiana. Masson, Barcelona 13 Edición. 2003.
31.- González-Carbajal M. Aspectos epidemiológicos de mayor relieve de la infección por Helicobacter pylori. En: González-Carbajal M. y cols. Helicobacter pylori ¿El tercer dogma? Autores Productores Asociados, S.L. Madrid, España. Capítulo V; 2003. p. 83-112.
32.- González-Carbajal P, Grá Oramas B y Avalos García R. Prevalencia de la Infección por Helicobacter pylori en pacientes dispépticos. Rev Panam Infevtol 2004; 6(4):8-14.
33.- Drossman DA. The functional gastrointestinal disorders and the Rome III process. Gastroenterology. 2006; 130: 1377-1390.
34.- Bixquert Jiménez M y Monés Xiol J. Dispepsia funcional. En: Tratamiento de las Enfermedades Gastroenterológicas. 2 Š edición. 2006. 69-74.
35.- Paniagua Estévez M, Grá Oramas B, González Carbajal M, Pereiras Costa R, Piñol Jiménez F, Valdés Alonso L. Historia, concepto y clasificación de la gastritis crónica. Gastrum 1997; 141: 10 – 15
36.-Bazzoli F. Key points from the revised Maastrich Consensus Report: The impact on general practice. Eur J Gastroenterol Hepatol 2001; 13 (Suppl 2): 3-7.
37.- Pablo L, Fitch K y Martin Y. Abordaje de la dispepsia. Estrategias de abordaje diagnóstico y terapéutico de la dispepsia no investigada. GH continuada. 2006; 5: 155-161.
38. - Timoney A, McKay T, Balfour R, Bancroft J, Bell G, Crozier A, et al. Dyspepsia. A national clinical guideline. Scottish Intercollegiate Guidelines Network. Disponible en: http://www.sign. ac.uk/pdf/sign68.pdf. 2003.
39.- Calvet X. Tratamiento erradicador de Helicobacter pylori en la enfermedad no ulcerosa. Gastroenterol Hepatol 2005; 28: 40 – 46.
40.- Gisbert JP y Calvet Calvo X. Infección por Helicobacter pylori: indicaciones de tratamiento y pautas erradicadoras. En tratamiento de las Enfermedades Gastrointestinales. 2Š edición AEG. 2006: 101-109.
41.- Gisbert JP, Calvet X, Gomollón F, Monés J y grupo de conferencia Española de Consenso sobre Helicobacter pylori. Tratamiento erradicador de Helicobacter pylori. Recomendaciones de la II Conferencia Española de consenso. Mdc Clin (Barc) 2005. En Prensa.
42- Monés J, Gisbert JP, Borda F y Domínguez Muñoz E. Indications, diagnostic test and Helicobacter pylori eradication therapy. Recomendations by the II Spanish Consensus Conference. Rev Esp Enf Dig. Vol 97 may 2005.
43.- Malfertheiner P, Megraud F, Omorain C, Bazzoli F, El-Omar E, Graham D, Hunt R, Rokkas T, Vakil N and Kuipers E. Current concepts in the management of Helicobacter pylori infection. The Maastrich III consensus Report. Gut 2006 Dec 14, PubMed.
44.- Mascort JJ, Marzo M, Alonso-Coello P, Barenys M, Carballo F, Fernandez M, et al. Clinical guideline on the management of the patient with dyspepsia. Gastroenterol Hepatol. 2003; 26:571-613. [Medline]
45.-Vakil N. Helicobacter pylori Treatment: A Practical Approach. Am J Gastroenterol 2006; 101:497– 499.
46.- Flores S., Opazo H., Valderrama D., Aguilera R., Marchese A., Valderrama S. Terapia triple de corto tiempo con azitromicina, amoxicilina y omeprazol para la erradicación del Helicobacter pylori. Rev Med Chil. 2000 May; 128(5):509-12.
47.-Herszeuyi L, Pronal L, Juhasz M. Evaluation of a short term and a seven days lanzoprazole based triple therapies in the treatment of Helicobacter pylori infection. Gut 2000; 47 (suppl lll):A127.
48. - Gisbert JP, González L, Calvet X. Helicobacter pylori eradication proton pump inhibitor vs. Ranitidine bismuth citrate plus two antibiotics for 1 week a meta analysis of efficacy. Aliment Pharmacol Ther 2000; 14(9):1141 - 50.
49.- Ivashkin VT, Lapina TL, Bondarenko OY, Sklanskaya OA, Grigoriev PY, Vasiliev YV, Yakovenko EP, Gulyaev PV, Fedchenko VI. Azithromycin in a triple therapy for Helicobacterpylori eradication in active duodenal ulcer. World J Gastroenterol. 2002 Oct; 8(5):879-82.
50.- Pérez Menéndez R, García Ayala JM, Astrid Cañas Vera Z, González Torres MJ, Hernández Mulet H, Más Páez J y Domínguez Álvarez C. Omeprazol y terapia corta con tinidazol-azitromicina antihelicobacter pylori en pacientes con úlcera duodenal. Rev Cub Med 2004; 43: 2-3.
51.- Trevisani L, Sartori S, Galvani F, Ruina M, Caseli M, Verdianelli G and Abbascianor. Evaluation of a new ultrashort triple therapy for Helicobacter pylori disease. Am J. Gastroenterol 1998; 93: 390-3.
52. - Vcev A. Omeprazole, azithromycin and either amoxicillin or metronidazole in eradication of Helicobacter pylori in duodenal ulcer patients. Aliment Pharmacol Ther 1998; 12: 453-6.
53. - Dixon MF, Geuta RM, Yardley JH and Correa P. Classification and grading of gastritis. The update Sydney System. Houston 1994. Am J Surg Pathol 1996; 20: 1161-1181.
54. - Van Ijzendoorn MC, Laheij RJF, de Boer WA and Jausen JBMJ. The importance of corpus biopsies for the determination on Helicobacter pylori infection. Netherlands The Journal of Medicine. 2005; 63(4): 141-145.
55.- Barroso Relingue N. Tratamiento erradicador en el año 2000. Gastroenterología Integrada 2001; 2(1):24-32.
56.- Malfertheiner P y cols. Gut 2007 (online).
57.- Cidrao Frota L, Saldanhada da Cunha MPS, Lima Luz CRL, Araujo-Filho AH, Frota LA and Campelo Braga LLB. Helicobacter pylori eradication using tetracycline and furazolidone versus amoxicillin and azithromycin in lansoprazole based triple therapy: an open randomized clinical trial. Arg Gastroenterol 2005, 42 (2).
58. - Chahine C, Moukhachen O, Chedid M, Araj GF, Sharara AI. Ultrashort regimen of lansoprazole-amoxicillin-azithromycin for eradicating Helicobacter pylori. Am J Health Syst Pharm; 2001 Oct 1; 58(19): 1819-23.
59.- Quintero Carrión E y Nicolás Pérez E. Tumores Gástricos. En: Tratamiento de las Enfermedades Gastroenterológicas. AEG. 2° edición. 2006: 132-134.
60.- Tucci A, Poli L, Tosetti C, Biasco G, Grigioni W, Varoli O, et all. Reversal of fundic atrophy after eradication of Helicobacter pylori . AM J Gastroenterology 1998; 93: 1425 – 1431.
61. - Di Mario F, Moussa AM, Dal Bo N, Caruana P, Pilotto A, Cavallaro LG, Cavestro GM, Iori V, Merli R, Franze A and Ruqque M. Recovery of gastric function after Helicobacter pylori eradication in subjects with body atrophic gastritis: prospective 4-year study. J Gastroenterol Hepatol. 2005 Nov; 20(11): 1661-6.
62.- Kokkola A, Sipponen P, Rautelin H, Harkonen M, Kosunen TU, Haapiainen R and Puolakkainen P. The effect of Helicobacter pylori eradication on the natural course of atrophic gastritis with dysplasia. Aliment Pharmacol Ther. 2002 Mar; 16(3):515-20.
63.- Anagnostopoulos GK, Kostopoulos P, Margantinis G, Tsiakos S, Arvanitidis D. Omeprazole plus azithromycin and either amoxicillin or tinidazole for eradication of Helicobacter pylori infection. J Clin Gastroenterol, 2003 Apr; 36(4):325-8.