Generalmente se requiere un injerto o un sustituto de hueso para ayudar o completar la reparación de una deficiencia esquelética debida a trauma, tumores o desarrollo anormal, y así restaurar la función normal del tejido. Los biomateriales pueden utilizarse como sustitutos del injerto de hueso antólogo. Dentro de las cerámicas utilizadas se encuentra la hidroxiapatita, Ca10-x (PO4) x (HPO4) 6-x (OH) 2-, principal componente inorgánico del hueso de los vertebrados; también la encontramos en la dentina y el esmalte dental.
Hidroxiapatita como sustituto del tejido óseo.
Dr. Yovanny Ferrer Lozano*, Dr. Julio Jorge Vergara Pages **, Dr. Pablo Oquendo Vázquez **
* Especialista de Segundo Grado en Ortopedia y Traumatología. Profesor Instructor FCM Matanzas. Profesor Adjunto Universidad de Matanzas. Investigador agregado FCM Matanzas
** Especialista de Primer Grado en Ortopedia y Traumatología.
Hospital Clínico-quirúrgico Territorial Docente de Cárdenas Julio M Aristegui Villamil.
Resumen
Generalmente se requiere un injerto o un sustituto de hueso para ayudar o completar la reparación de una deficiencia esquelética debida a trauma, tumores o desarrollo anormal, y así restaurar la función normal del tejido. Los biomateriales pueden utilizarse como sustitutos del injerto de hueso antólogo. Dentro de las cerámicas utilizadas se encuentra la hidroxiapatita, Ca10-x (PO4) x (HPO4) 6-x (OH) 2-, principal componente inorgánico del hueso de los vertebrados; también la encontramos en la dentina y el esmalte dental. La biocompatibilidad de la Hidroxiapatita sintética ha sido sugerida no solo por su composición sino por los resultados obtenidos en su implantación in vivo, los cuales han demostrado ausencia de toxicidad local o sistémica, no provocando inflamación o respuesta a cuerpo extraño
Palabras clave: injerto óseo, biomaterial, hidroxiapatita, biocompatibilidad.
Introducción
Generalmente se requiere un injerto o un sustituto de hueso para ayudar o completar la reparación de una deficiencia esquelética debida a trauma, tumores o desarrollo anormal, y así restaurar la función normal del tejido. El primer simposio de Biomateriales celebrado en 1969 en la Universidad de Clemson, Carolina del Sur, Estados Unidos marca el punto de partida de la necesaria integración de las disciplinas complementarias a la ingeniería y a la medicina para el desarrollo de materiales biomédicos. Conceptualmente un Biomaterial no es más que una sustancia (diferente de una droga o medicamento) o una combinación de sustancias que puede ser usada por un período de tiempo como un todo o formando parte de un sistema que trata, aumenta o sustituye un tejido, órgano o función del cuerpo. Es decir, un material no vivo usado como dispositivo médico dirigido a interactuar con el sistema biológico (1).
Sobre la base de la duración y la forma del contacto que se establece con el organismo, los biomateriales suelen clasificarse como de uso temporal o permanente y de localización intra o extracorpórea. Desde el punto de vista de su función se pueden distinguir entre ellos los dispositivos destinados al soporte, al diagnóstico o al tratamiento (2). Algunos biomateriales contienen drogas y son considerados medicamentos, otros pueden incluir células vivas y construir los llamados biomateriales híbridos. También hay biomateriales que incluyen compuestos capaces de responder a señales provenientes del medio biológico, estos reciben el nombre de materiales inteligentes.
Existen cuatro grandes grupos de materiales sintéticos usados para implantación: metálicos, cerámicos, poliméricos y compuestos de ellos (3). Para el desarrollo de nuevos biomateriales implantológicos deben tenerse en cuenta algunos factores como:
- Ser biocompatible, es decir, debe ser aceptado por el organismo, no provocar que éste desarrolle sistemas de rechazo ante la presencia del biomaterial
- Tener un tiempo de fatiga adecuado. Ser capaz de soportar cargas cuando sea necesario. Esto permite el mantenimiento de la estructura de tal forma, que el hueso formado pueda remodelarse adquiriendo cualidades que el hueso original.
- Ser químicamente estable (no presentar degradación en el tiempo) e inerte.
- Ser osteoactivo, es decir, debe estimular la formación de nuevo hueso. La osteoactividad se manifiesta en el carácter osteoinductor y/o osteoconductor del implante. Alternativamente un material puede estimular la sustitución por pasos, es decir, al mismo tiempo que se reabsorbe se produce un nuevo hueso en su lugar.
- El implante no debe causar molestias o dolor, refractura, sangramiento excesivo, respuesta a cuerpo extraño, deformidad o transmisión de enfermedades. No debe reabsorberse antes de la formación de hueso nuevo, ya que puede provocar formación de cavidades y/o formación de tensiones.
- No ser tóxico, ni carcinógeno.
- Tener un diseño de ingeniería perfecto; esto es, el tamaño y la forma del implante deben ser los adecuados.
- Ser relativamente barato, reproducible y fácil de fabricar y procesar para su producción en gran escala.
Su característica dinámica es esencial, se encuentra en constante transformación.
Desarrollo
El descubrimiento de factores de crecimiento óseo, sustancias naturales presentes en el hueso y que pueden promover su formación, inicialmente llamados osteogénicos o, desde entonces, conocidos como BMP (por Bone Morphogenetic Proteins), se debe a Urist (4).
Los injertos más utilizados actualmente son hueso del mismo paciente (autólogo) o hueso de cadáver (alogénico). Se han realizado investigaciones con diferentes materiales incluyendo biológicos, polímeros, cerámicos y combinaciones de estos; el objetivo es encontrar el producto ideal que reemplace y elimine los problemas relacionados con la disponibilidad, la biocompatibilidad y la transmisión de enfermedades. El sustituto óseo ideal debe ser estéril, no tóxico, aceptable inmunológicamente y disponible en cantidades suficientes. El sustituto óptimo debería ser capaz de inducir la diferenciación de células locales a células formadoras de hueso y al mismo tiempo proporcionar un andamio conductivo, gradualmente reabsorbible para la formación de nuevo hueso. Adicionalmente, el material debe actuar como una barrera mecánica para el crecimiento de tejido fibroso o la interposición de músculo en el defecto óseo.
Los Biomateriales, desde el punto de vista de su comportamiento biológico se clasifican en: bioinertes, biotolerados y bioactivos y esto, está en correspondencia con la actividad biológica que se produce en la interfase implante-tejido óseo.
Son bioinertes el titaniun y las fibras de carbón y en la interfase no hay reacción entre ambos elementos. Biotolerados son una larga lista de elementos como metales, polietileno, cemento óseo, etc., y en estos se observa una reacción del tejido vivo ante él implante. Son bioactivos las cerámicas, los cristales biológicos, el fosfato tricálcico, la Hidroxilapatita, etc. y en estos hay una reacción y unión entre ambas superficies (tejido vivo- implante). Esta interacción biológica entre ambos tejidos se conoce como osteointegración.
Hidroxiapatita (HAP)
Dentro de las cerámicas utilizadas se encuentra la hidroxiapatita, Ca10-x (PO4) x (HPO4) 6-x (OH) 2-x con 0
En presencia de flúor los cristales de hidroxiapatita se transforman a cristales de flúorapatita.
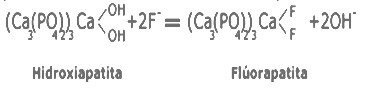
La Hidroxiapatita, con gran similitud físico química al tejido óseo, se comporta como una estructura osteoconductiva que permite ser invadida por tejido conectivo proveniente del hueso circundante para posteriormente osificarse, manteniendo en su interior las características de su origen.
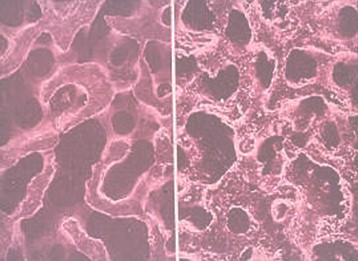
Figura 1. Obsérvese a la Izquierda un corte histológico de un hueso esponjoso humano y a la derecha un corte de Hidroxiapatita HAP-200, nótese la similitud de su estructura física y de su porosidad.
La Hidroxiapatita se puede obtener sintéticamente (5), por calcinación de hueso, o de origen natural como la proveniente de la transformación hidrotermal del carbonato cálcico (Aragonito) de los corales en Hidroxiapatita.
Hasta el siglo XVII, se decía que los corales eran flores marinas. Fue el médico-cirujano, y naturalista marsellés Jean André Peysonnel quien después de varios años de estudio, estableció que los corales eran animales, el pólipo coralino, el cual vive en simbiosis con un alga unicelular el Zooxanthellae, y este sintetiza los compuestos esenciales para su alimentación y elimina los productos de desecho que facilitan la construcción del exoesqueleto cálcico, por lo que este es una muestra de unión de los 3 reinos naturales.
Existen más de 2.500 variedades, las más usadas en la cirugía son las Gonioporas del Atolón del Pacifico y los Porites de la Reserva Coralífera del Caribe (6). Los corales son en su estructura química fundamentalmente Carbonato Cálcico (CaCo3) que es el Aragonito y para obtener la Hidoxilapatita (Ca10 (PO4) 6(OH) 2) a partir de estos, es necesario someterlos a un proceso de transformación hidrotermal.
La velocidad de biodegradación está en función de la microporosidad de la cerámica. La Hidroxiapatita no tiene propiedades osteogénicas ni osteoinductoras sino que demuestra actividad osteoconductora cuando es implantada en el defecto óseo. La formación de hueso nuevo comienza desde el borde del defecto y es conducido a través del implante formando un puente hueso-Hidroxiapatita (9). Este hueso inmaduro será remodelado.
Eventos que suceden durante la interacción Hidroxiapatita - célula
Los eventos que suceden al interactuar la Hidroxiapatita con el tejido óseo durante el proceso de implantación y consolidación se describen en el siguiente esquema:
Eventos que suceden durante la interacción Hidroxiapatita - célula
Implantación de Hidroxiapatita - macrófagos
- Infiltración sitio quirúrgico
- Fagocitosis residuos celulares
- Ataque a la superficie de la Hidroxiapatita
- Formación capa de apatita en la superficie del implante
- Osteoblastos: Migración hacia el borde del defecto óseoà Depósito de osteoides sobre superficie Hidroxiapatita
- Vascularización a través de los poros
- Formación de apatita biológica
Discusión
Para la utilización de injertos óseos, hay muchos materiales que cumplen con esta función. Hay tres propiedades distintas en materiales del injerto, y cada propiedad tiene un papel específico en la curación del hueso. El primero es la osteogenicidad que señala la presencia de osteoblastos o células formadoras que directamente depositan hueso. Sólo injertos del hueso autógenos fresco o la médula del hueso aspirado contiene estas células. La segunda propiedad es la osteoconductividad que es la habilidad del material de actuar como andamiaje pasivo que apoya la nueva formación del hueso y crecimiento del hueso, varios materiales inertes, como injertos cerámicos, hidroxiapatita tienen esta propiedad, permitiendo, que el hueso vecino haga la substitución reptante (creeping substitution) La tercera propiedad es osteoinductividad. Primeramente descrito por Urist a mitad de los años 60, y que se define como la presencia de factores de diferenciación que facilitan el reclutamiento y diferenciación de células mesenquimales y específicamente las que inducen la formación de osteoblastos. Estos factores de diferenciación son denominados BMPs.
La utilización de hueso fresco de cresta iliaca, cumple con estas 3 funciones pero es necesaria una cirugía extra para obtener el injerto, lo que no está libre de peligros y complicaciones, por eso la búsqueda referida para la obtención de otros materiales. La Hidroxilapatita cumple con la segunda función de osteoconductividad a la que pueden añadírseles BMPs y tener también la capacidad osteoinductora, estos últimos son muy costosos y escasos en nuestro medio.
Las indicaciones del bioimplante, como injerto de interposición y/o relleno, como aposición su uso debe ser limitado pues es reabsorbido gran cantidad del biomaterial por los líquidos tisulares, al no estar toda su superficie en contacto con tejido óseo, las contraindicaciones de su utilización son en la sepsis del área quirúrgica, necrosis de la zona receptora, y las implantaciones intrarticulares, pues el liquido sinovial favorece la reabsorción del bioimplante (7).
Deben tenerse las siguientes precauciones: zona receptora vascularizada, implante comprimido y estable, uso de impactadores de teflón. La biocompatibilidad de la Hidroxiapatita sintética ha sido sugerida no solo por su composición sino por los resultados obtenidos en su implantación in vivo, los cuales han demostrado ausencia de toxicidad local o sistémica, no provocando inflamación o respuesta a cuerpo extraño (8).
Entre las desventajas de la Hidroxiapatita se encuentran su débil resistencia mecánica y fragilidad, aunque altos niveles iniciales de resistencia pueden lograrse controlando el grado de porosidad y el grosor del implante, ofreciendo la ventaja de una fijación biológica por crecimiento óseo dentro de los poros interconectados (10). La combinación de ésta, con alguna sustancia osteoinductora como las proteínas morfogenéticas óseas, mejoran sus características. La Hidroxiapatita-200 ha demostrado ser un material biocompatible con una excelente integración al tejido óseo circundante.
Bibliografía
1. González R., Blardoni F., Maestre H., Pereda O., Pancorbo E., Cienaga M. Long-terms results of the Coralline Porous Hydroxyapatite HAP-200 as bone implant´s biomaterial in Orthopedics and Traumatology Revista Ciencias Biológicas CENIC, 2001
2. Gimeno M. Sustitutivos óseos en fracturas de radio distal. Patología Aparato locomotor. 5 (S2) : 82-90, 2007
3. Angermann P: Commercially avaible substitutes for transplants of human bone. Ugeskr-laeger. 154(6) : 333-6, 1992
4. Urist MR, Lietze A, Mizutani H, Katsumatsa T, Triffit T, et al. Bovine low molecular weight bone morphogenetic protein (BMP) fraction. Clinical Orthop and Related Research. 162: 219 – 232., 1982
5. Giordano V, Albuquerque R, Rezende R, Senna L, Pompei A, Amaral N, Giordano M, Bastos, J. Histomorphological study of fresh and hydroxyapatite, high-porosity allografts in a bone defect from femora of rats Rev. bras. ortop. 41(9) : 384-391, 2006
6. Riaño C, Echevarría A, Noreña A. Hidroxiapatita sintética de porosidad inducida-comparación con el hueso calcinado. Rev Facultad de Ingeniería. Universidad de Antioquia 19: 56 – 64, 1999
7. Giraldo AE. Caracterización de muestras de coral tratadas con fosfato de amonio por vías hidrotermal y pirotérmica. Proyecto de grado, Universidad de Antioquia, Facultad de Ingeniería, Medellín, 1997; 407
8. Delgado R, Urbizo J, Rodríguez V, García R, Cabaleiro Z, Iglesias E. Evaluación anatomopatológica experimental de la implantación en hueso de la hidroxiapatita sintética (apafil-G). Rev. habanera cienc. méd; 5(4), 2006
9. Ferrer Y, Jorge Vergara J, Oquendo P, Reguera R. Osteocoral en el tratamiento de lesiones pseudotumorales o tumorales benignas del tejido óseo. Cinco años de evolución. Rev méd electrón. 27 (1), 2005.
10. Inoue K. Ohgushi H, Yoshikawa T, et al. The effects of aging on bone formation in porous hydroxyapatite: biochemical and histologic analysis. J Bone Miner Res 12:989-994, 1997