Desde su inicio, el Síndrome de Inmunodeficiencia Adquirida (SIDA) fue identificado por la presencia de importantes alteraciones a nivel cutáneo-mucoso, entre las cuales se destacaron una forma particularmente agresiva del Sarcoma de Kaposi e infecciones oportunistas crónicas de etiología variada, como la candidiasis oral y el herpes virus. El examen clínico prolijo y minucioso de la piel, con el inestimable auxilio de los estudios complementarios (biopsia, examen histopatológico, citodiagnóstico, cultivo micológico y/o bacteriológico) resultan fundamentales para la detección de las alteraciones tegumentarias de estos enfermos. La aparición y forma de presentación de estas afecciones suele correlacionarse íntimamente con la depleción inmunitaria progresiva, monitoreable a través de ciertos exámenes de laboratorio como el hemograma, la fórmula leucocitaria y sobre todo, la cuantificación de la subpoblación linfocitaria CD4 + y la carga viral. Por la importancia y frecuencia de estas manifestaciones clínicas, así como por su forma de presentación atípica y su correlación con la evolución de esta enfermedad, resulta de inestimable importancia el conocimiento de las diferentes manifestaciones cutáneo-mucosas, infecciosas y no infecciosas, de la población pediátrica que padece el Síndrome de Inmunodeficiencia Adquirida. Por lo mencionado anteriormente, este fue el tema elegido para el desarrollo de la presente monografía.
Manifestaciones cutáneo-mucosas en niños y adolescentes con HIV- SIDA.
Clemente, Damián Andrés
Médico Pediatra Certificado por Sociedad Argentina de Pediatría y la Universidad de Buenos Aires
Buenos Aires, Argentina, Febrero de 2009
Resumen
Introducción: Desde su inicio el Síndrome de inmunodeficiencia adquirida (SIDA) fue identificado por la presencia de importantes alteraciones cutáneo-mucosas, entre las que se encuentran infecciones oportunistas, enfermedades inflamatorias y neoplasias. Estas dermopatías pueden, por su frecuencia y precocidad, brindar una aproximación diagnóstica inicial. Su presentación se encuentra relacionada con el grado de inmunodepresión del paciente, basada en los niveles de LTCD4+.
Objetivos: Describir las diferentes formas de presentación de las manifestaciones cutáneo-mucosas en el HIV pediátrico.
Material y métodos: Se utilizaron libros de texto con desarrollo completo del tema, agregándose información actualizada de revistas de publicación científica nacionales e internacionales. Se amplió el material con artículos originales publicados en la red Medline. Se eligieron libros y trabajos científicos publicados en los últimos cinco años.
La selección de los trabajos se realizó sobre la base que los mismos presentaran objetivos explícitos, con la población en estudio bien definida y con una muestra representativa.
Discusión: Se observó en todas las publicaciones y libros de texto recopilados, que las manifestaciones mucocutáneas en el paciente HIV positivo, son entidades muy frecuentes, de presentación atípica, con mayor duración y severidad y de manejo terapéutico más hostil que en personas inmunocompetentes. Su forma de presentación se relaciona con el grado de inmunosupresión de los pacientes.
Conclusión: hay un incremento en la prevalencia de las manifestaciones mucocutáneas en los pacientes pediátricos HIV positivos, que es mayor a medida que disminuye el estado inmunitario.
Introducción
Desde su inicio, el Síndrome de Inmunodeficiencia Adquirida (SIDA) fue identificado por la presencia de importantes alteraciones a nivel cutáneo-mucoso, entre las cuales se destacaron una forma particularmente agresiva del Sarcoma de Kaposi e infecciones oportunistas crónicas de etiología variada, como la candidiasis oral y el herpes virus.
El examen clínico prolijo y minucioso de la piel, con el inestimable auxilio de los estudios complementarios (biopsia, examen histopatológico, citodiagnóstico, cultivo micológico y/o bacteriológico) resultan fundamentales para la detección de las alteraciones tegumentarias de estos enfermos.
La aparición y forma de presentación de estas afecciones suele correlacionarse íntimamente con la depleción inmunitaria progresiva, monitoreable a través de ciertos exámenes de laboratorio como el hemograma, la fórmula leucocitaria y sobre todo, la cuantificación de la subpoblación linfocitaria CD4 + y la carga viral.
Por la importancia y frecuencia de estas manifestaciones clínicas, así como por su forma de presentación atípica y su correlación con la evolución de esta enfermedad, resulta de inestimable importancia el conocimiento de las diferentes manifestaciones cutáneo-mucosas, infecciosas y no infecciosas, de la población pediátrica que padece el Síndrome de Inmunodeficiencia Adquirida. Por lo mencionado anteriormente, este fue el tema elegido para el desarrollo de la presente monografía.
Reseña histórica
Los primeros casos de Síndrome de Inmunodeficiencia Adquirida (SIDA) fueron reconocidos en los Estados Unidos a mediados de 1981. En ese año, el Centers for Diseases Control and Preventions (CDC) informó de un síndrome, hasta entonces desconocido, cuya característica era la inmunosupresión asociada a enfermedades oportunistas. Desde un principio la evidencia epidemiológica sugirió que un agente infeccioso, transmisible a través del contacto sexual, la drogadicción endovenosa y las transfusiones de hemoderivados, podría ser el responsable de esta enfermedad.
Alrededor de 1984 el descubrimiento del Virus de la Inmunodeficiencia Humana (HIV) permitió un detallado conocimiento de su biología molecular, la consecuente aparición de pruebas diagnósticas y la investigación de una terapéutica antirretroviral. Después de intensas investigaciones, las combinaciones terapéuticas condujeron a una espectacular mejoría de la evolución clínica de los pacientes, lo que ha permitido actualmente categorizar a esta enfermedad como una enfermedad crónica.
La primera notificación de un caso de SIDA en un paciente de sexo femenino fue en 1987, cinco años después del primer registro de un paciente de sexo masculino. La aparición de la infección en la mujer, introduce entonces, el concepto de la infección en los niños a través de la transmisión vertical (TV).
En los últimos años la prevención durante el embarazo y el tratamiento del recién nacido, ha producido cambios trascendentales. La implementación del uso de la Zidovudina (AZT) se ha asociado con una disminución notoria de la transmisión vertical. Sin embargo, aún hoy, sólo el 1% de las mujeres embarazadas tienen acceso a servicios de prevención de la transmisión vertical en los países más afectados (1-2). Estudios previos revelaron que la infección perinatal tiene cuadros clínicos muy variados y un peor pronóstico comparado con la infección adquirida en un período más tardío de la niñez. Alrededor de un tercio de los niños nacidos de madres HIV+ tendrán evidencia de infección alrededor de los 18 meses de vida y se calcula que cerca de un quinto de estos niños morirán. Por otro lado, la enfermedad progresa más lentamente y los niños se mantienen más estables durante el segundo año de vida (3).
La infección por HIV en pediatría puede tener varias formas de presentación clínica:
- Progresores rápidos: es el grupo de recién nacidos infectados en forma intrauterina (15-20%) que de no recibir tratamiento antirretroviral, presentarán síntomas de enfermedad en los primeros seis meses de vida, con retraso pondoestatural y madurativo, infecciones severas, neumonitis por Pneumocistis jiroveci (nueva nomenclatura), candidiasis oral persistente y descenso precoz de los linfocitos T CD4+ (LTCD4+). La sobrevida promedio se calcula en alrededor de los cuatro años.
- Progresores lentos: es el grupo de recién nacidos infectados en el período perinatal (70-80%) que de no recibir tratamiento antirretroviral, desarrollarán síntomas entre el segundo y tercer año de vida, con manifestaciones clínicas tales como infecciones recurrentes respiratorias, parotiditis y neumonía intersticial linfoidea. Los LTCD4+ descienden lentamente y la sobrevida de los pacientes se calcula en un promedio de ocho años.
- Sobrevivientes a largo plazo: es el grupo de niños infectados por vía perinatal (5%) que permanecen asintomáticos, sin alteraciones de su sistema inmune y con una carga viral muy baja por un período de doce a quince años, sin recibir tratamiento específico.
Epidemiología
“La Organización Mundial de la Salud (OMS) calculó que a fines de 1997 estaban infectadas por el HIV más de 30 millones de personas en todo el mundo y que, de ellas, 1.1 millones eran niños menores de 15 años. Sólo en 1997, 5.8 millones de personas adquirieron el HIV y 2.3 millones murieron por su causa, entre ellas 500.000 niños. Más del 90% de las personas infectadas viven en países en vías de desarrollo, donde se calcula que 350.000 lactantes se infectan por transmisión perinatal todos los años. El África subsahariana es la zona epidémica de crecimiento más rápido, pues concentra casi el 90% del total de la población mundial infectada por el HIV. En el sudeste asiático, la epidemia domina en India y Tailandia, con expansiones más recientes hacia Vietnam, China y Camboya (4).
Gráfico 1. Prevalencia mundial de HIV.
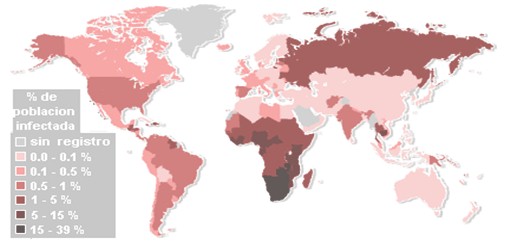
Fuente: UNAIDS (Fines del Año 2003)
SIDA en Argentina.
La epidemia de SIDA en la Argentina ha evolucionado en forma irregular. Puede ser considerada como el resultado de la suma de subepidemias que se han ido definiendo de acuerdo a los diferentes mecanismos de transmisión y tiempo de desarrollo (transmisión entre usuarios de drogas intravenosas, sexo hombre con hombre, transmisión heterosexual y perinatal).
Desde el primer caso en el año 1982 y hasta septiembre de 2004, hay un total de 26.000 casos de SIDA y 26.887 infectados por el HIV, según lo notificado al Programa Nacional de SIDA.
Se estima que hay un total de 120.000 (110.000-130.000) personas viviendo con el virus del HIV, lo cual marca dimensiones preocupantes de la magnitud de la epidemia en la Argentina.
La razón hombre/mujer en el total de casos acumulados notificados de enfermos de SIDA es de 3/1. Sin embargo, en la actualidad, esta razón ha cambiado a 1.5/1 y a 1/1 en la población adolescente de 13 a 19 años (datos del año 2004).
La mayoría de las mujeres adquiere la infección tempranamente en la adolescencia, casi siempre por contacto heterosexual con hombres consumidores de drogas, bisexuales o promiscuos o por vía sanguínea a través del consumo de drogas intravenosas.
“En la Argentina, los casos pediátricos representan el 7.2% del total, la mayor incidencia comunicada en América Latina.” (2)
La infección por HIV en pediatría afecta a dos grupos principales: los recién nacidos y los adolescentes. Los primeros se infectan por transmisión vertical y los adolescentes por los mismos mecanismos que la población adulta (contacto sexual sin protección y drogadicción endovenosa) (5).
Estructura viral
El virus de la Inmunodeficiencia Humana pertenece a la familia Retroviridae, subfamilia Lentiviridae. Es un virus RNA que presenta las siguientes características principales:
- Requiere para su replicación una enzima específica: la Transcriptasa Reversa, que invierte el flujo de la información genética, realiza la transcripción del RNA del virión en DNA para iniciar el ciclo de replicación viral.
- El virión es un parásito intracelular obligado, se integra al DNA (núcleo) de la célula huésped.
- Puede dar síndromes clínicos con un largo período de incubación y en muchos casos con inmunodeficiencia
El virión tiene una estructura esférica y su core con forma de cono está rodeado por una doble capa lipídica. El ácido nucleico viral consiste en dos moléculas de RNA de cadena simple que están encapsidadas y protegidas por la cápside viral. El genoma típico contiene genes estructurales básicos gag, pol y env, y otros regulatorios (CCR5, CXCR4) (6).
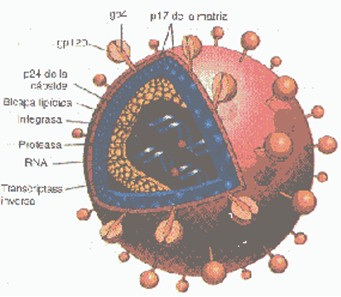
Estructura viral. Adaptado de Patología Funcional y Estructural. Robbins 6° ed. Ed: Mc Graw Hill
Criterios de infección por HIV en Pediatría
Niño infectado
- Niño menor de 18 meses, que presenta: resultados positivos en dos determinaciones separadas (excluyendo sangre de cordón) de una o más de las siguientes pruebas de detección del virus HIV: reacción en cadena de polimerasa (PCR), antígeno p24 o cultivo viral.
- Niño de 18 meses o más, que tiene anticuerpos detectados en dos pruebas de ELISA y pruebas confirmatorias (Western Blot o inmunofluorescencia indirecta - IFI), o cumple con los criterios del punto “a”.
Niño expuesto en forma perinatal “E” (E de expuesto o en estudio)
Niño que no cumple los criterios anteriores pero:
- Es HIV positivo por ELISA y Western Blot y tiene menos de 18 meses en el momento del estudio. En general toda muestra de ELISA HIV positiva se debe confirmar con Western Blot. En este caso puede ser anticuerpos maternos o ya la propia producción de anticuerpos.
- No se conoce su estado serológico, pero es hijo de madre HIV positiva.
Niño negativizado serológicamente
Niño nacido de una madre HIV positiva que presenta:
- Dos muestras negativas de detección de antígeno viral realizada entre 1 a 6 meses de edad. La primera muestra debe ser realizada después de los 15 días de vida y la segunda con más de 4 meses de edad. Se indica el alta con serología HIV negativa.
- Serología HIV negativa en dos o más pruebas de ELISA efectuadas entre los 6 y 18 meses de edad con un intervalo mínimo de un mes entre ambos o una prueba de ELISA negativa después de los 18 meses de vida.
- No cumple con los criterios clínicos para la definición de SIDA (7).
Estudios recientes sugieren que las determinaciones de la carga viral en plasma, en conjunto con el porcentaje de linfocitos TCD4+, son predictores más fidedignos de pronóstico y supervivencia que cada marcador por separado. La carga viral >5log10 por ml antes de los 30 meses de vida y >4,3log10 después de los 30 meses, está asociada con un riesgo incrementado de la progresión de la enfermedad (3).
Características inmunológicas en el SIDA enfermedad
Aunque el virus HIV-1 tiene un trofismo particular por las células que contienen receptores CD4+, principalmente los LTCD4+ (helper cells), algunos macrófagos, monocitos y células del sistema nervioso central, ciertas anormalidades en la inmunidad humoral pueden preceder al desarrollo de las otras alteraciones mediadas por la inmunidad celular.
Los linfocitos B de niños infectados con el virus del HIV suelen presentar una activación policlonal con hipersecreción de inmunoglobulinas, dando lugar a la clásica hipergamaglobulinemia presente en el SIDA enfermedad. Pero pese a esta activación policlonal de los linfocitos B, los niños HIV+ pueden aparecen funcionalmente como hipogamaglobulinémicos, con células B incapaces de responder eficientemente a antígenos específicos, lo que conlleva al desarrollo de infecciones bacterianas devastadoras. Las alteraciones de la inmunidad celular comienzan a manifestarse como una disminución progresiva, tanto in vivo como in vitro, de la funcionalidad de los linfocitos T, además de anormalidades en el número total de los LTCD4+.
Los linfocitos TCD8+ inicialmente aumentan en número, resultando en una alteración de la relación linfocitos TCD4+/TCD8+, pero no aparecen deplecionados hasta las últimas etapas de la enfermedad (3).
La piel y las membranas mucosas, por su situación anatómica, son las primeras barreras en ser alteradas por la infección, por lo tanto, los signos de afectación cutáneo-mucosos son importantes marcadores de la progresión de la enfermedad.
En un estudio realizado en Nigeria se ha estimado que las manifestaciones en piel pueden ser la forma de presentación en alrededor de un 37% de los niños HIV+. La ocurrencia de ciertas manifestaciones cutáneas se ha correlacionado con los niveles de linfocitos TCD4+. También se sabe que la depleción de dichos linfocitos trae aparejada manifestaciones cutáneas más severas y en mayor número, con menor respuesta a la terapéutica convencional.
El valor absoluto normal de los linfocitos TCD4+ (LTCD4+) es relativamente alto en niños normales y declina gradualmente hasta los seis años de edad, mientras que el porcentaje de estos linfocitos se mantiene constante (8).
Tabla 1: valores normales de linfocitos y subpoblaciones linfocitarias según la edad.
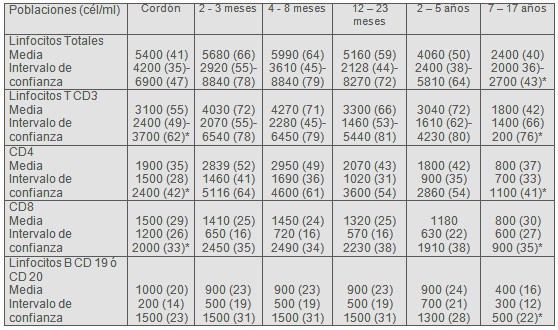
Entre paréntesis porcentajes. Intervalo de confianza: percentilo 5 y 95, salvo indicado con * 25 y 75. Según fuente proveniente del Hospital de Pediatría Prof. Dr. Juan P. Garrahan.
Tabla 2. Categorías inmunológicas basadas en recuento y porcentaje de linfocitos TCD4+.
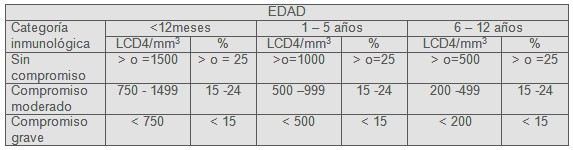
Cuadro extraído de “INFECCIÓN HIV/SIDA. GUÍA PARA PEDIATRAS. Diagnóstico, tratamiento y conductas clínicas”. Comité Nacional de Infectología Pediátrica 2004. Sociedad Argentina de Pediatría, según referencia proveniente del CDC.
La prevalencia de manifestaciones cutáneo-mucosas en niños con severa, moderada o sin inmunosupresión fue de 62%, 43% y 20%, respectivamente.
Estas manifestaciones fueron significativamente más comunes en niños con alteraciones moderada y severa de su inmunidad que en niños sin inmunosupresión (p<0,001).
En el 11% de pacientes con inmunosupresión moderada se hallaron por lo menos dos manifestaciones mucocutáneas, mientras que en el 21% de pacientes con alteraciones severas de su inmunidad se observaron dos o más de estos hallazgos. La candidiasis oral fue la manifestación hallada con más frecuencia (33%), teniendo una correlación directa significativa con el descenso en el porcentaje de LTCD4+ (11,3%). Por otra parte, el herpes zoster fue hallado en el 6% de los pacientes con bajo porcentaje de LTCD4+ (13,5%) y la estomatitis herpética en el 3% de pacientes que presentaban inmunosupresión severa (LTCD4+=3%). Las infecciones fueron las manifestaciones cutáneo-mucosas más comunes, con una frecuencia del 55%. Las infecciones micóticas, virales y bacterianas fueron halladas en el 44%, 10%, y 8% de los pacientes, respectivamente (8).
Dermatología e infección por HIV
Con fines didácticos, las alteraciones tegumentarias en estos enfermos pueden dividirse en tres grandes grupos: infecciones oportunistas, procesos neoplásicos y afecciones inflamatorias no infecciosas, debiendo agruparse como miscelánea un cuarto grupo de dermatosis de infrecuente observación.
Características de las infecciones tegumentarias por HIV
- Severidad.
- Apariencia clínica atípica.
- Persistencia- severidad.
- Respuesta nula o lenta a los tratamientos convencionales.
- Coexistencia, en ocasiones, en una lesión de diversos agentes etiológicos.
Infecciones virales en HIV
Los procesos infecciosos cutáneos en pacientes HIV se caracterizan por una presentación clínica atípica y florida, la tendencia a la cronicidad y la resistencia a los tratamientos convencionales. En el caso de las infecciones virales debe enfatizarse el hecho de su proclividad a la diseminación y de presentar un gran polimorfismo lesional que dificulta frecuentemente el diagnóstico diferencial.
SINDROME RETROVIRAL AGUDO (SRA)- Sindrome de Seroconversión.
Es más común en la población HIV adulta. La primoinfección por el virus de la inmunodeficiencia humana habitualmente pasa desapercibida, sin embargo, en algunos enfermos puede acompañarse de una signosintomatología llamativa, con un florido compromiso cutáneo-mucoso, fácilmente confundible con otros procesos virales.
Las manifestaciones tegumentarias están presentes en un 50-75% de los casos.
La aparición y características del brote se hallan condicionadas por:
- Dosis de inoculación del virus.
- Virulencia de la cepa.
- Otras infecciones virales concomitantes.
- Historia de infecciones virales anteriores.
- Eficacias de la respuesta inmune del afectado.
Patogenia: Las células dendríticas mieloides (CDMl) constituyen las células presentadoras de antígeno responsables de endocitar el virus y presentar el mismo a los linfocitos TCD4+. Revisiones actuales presuponen que la infección de las células dendríticas mieloides, que ocurriría cuando el virus utiliza determinados correceptores presentes en ellas (CD SIGN) sería otro de los mecanismos responsables de la diseminación indeseable del virus al LTCD4+, además de la entrada habitual por el correceptor CD4+ del LTCD4+.
Clínica: El síndrome retroviral agudo (SRA) es una manifestación cada vez más frecuente de la infección primaria en el HIV. Luego de un período de incubación que puede ser corto (6 días), pero que generalmente es de tres a cinco semanas, aparecen los síntomas que incluyen fiebre, faringitis no exudativa, linfoadenopatía y síndromes sistémicos como artralgia, mialgia y letargia. Hay un rash maculopapular eritematoso generalizado, predominante en tronco, en el 40 al 50% de los pacientes. Con escasa frecuencia pueden presentarse neumonitis, hepatitis, alteraciones electrocardiográficas y síntomas neurológicos.
La enfermedad a veces se asemeja a la mononucleosis infecciosa pero su inicio es más agudo. La ausencia de exudado, de hipertrofia amigdalina y la frecuente aparición de un rash (infrecuente en la mononucleosis infecciosa a menos que reciba ampicilina) con la ulceración mucocutánea, permiten efectuar el diagnóstico diferencial.
Las pruebas para anticuerpos HIV suelen ser negativas en la etapa aguda de la enfermedad, pues el paciente se encuentra en el período ventana de esta patología, pero la búsqueda de ARN tipo 1 de HIV o el antígeno p24 confirmará el diagnóstico. La mayoría de los expertos prefieren la iniciación de un tratamiento supresivo con combinación de drogas antirretrovirales (terapia HAART) en esta etapa de la infección por HIV.
HERPES SIMPLE (HS)
Es la virosis cutánea más frecuente en pacientes HIV positivos. Generalmente se debe a la reactivación de una infección herpética previa.
Clínica: Las formas clínicas de herpes simple más frecuentemente observadas en estos pacientes son:
- Perianal.
- Genital.
- Oral y perioral.
- Nasal.
- Diseminado.
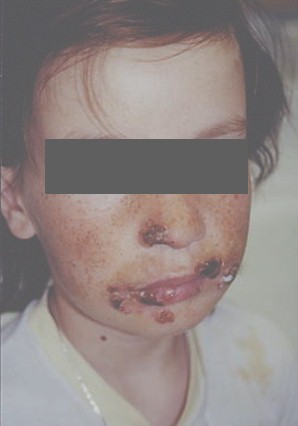
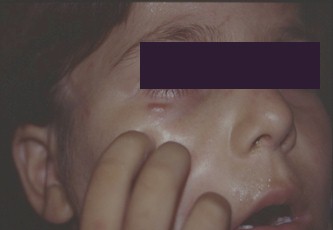
Foto 1. Herpes virus
Las úlceras perianales con bordes circinados de aspecto necrobiótico, persistentes y muy dolorosas, eran de común observación en pacientes homosexuales en las etapas iniciales de la epidemia, llegando a alcanzar 10 cm o más de diámetro. Con frecuencia se extienden a la mucosa rectal, con la consecuente proctitis, con intenso dolor perianal y tenesmo o se diseminan a sitios no habituales para el herpes virus ll, como los miembros inferiores, donde puede provocar úlceras crónicas.
Las localizaciones genitales también son de consideración; en pene produce la clásica imagen multivesicular que rápidamente tiende a extenderse con persistentes y molestas erosiones, sobre las que se instalan infecciones bacterianas y micóticas secundarias.
Ambas localizaciones son de observación más frecuente en adolescentes y adultos jóvenes. Fuente: www.bayloraids.org/atlas/20.htm
El herpes tipo l produce lesiones orales y periorales de gran atipicidad. La gingivoestomatitis herpética suele presentar pródromos como fiebre, malestar y adenopatías cervicales dolorosas tras las cuales se instalan lesiones en paladar duro, encías y en cualquier otra localización de mucosa y semimucosa, presentándose como úlceras dolorosas y persistentes. Las lesiones labiales y periorales pueden impetiginizarse, dificultando el diagnóstico con el verdadero impétigo. También puede coexistir en la misma lesión el citomegalovirus produciendo importantes úlceras faciales semejantes a las descriptas en región perianal o extenderse a cara y cuello simulando una foliculitis. La diseminación a la mucosa faríngea, esofágica y traqueobronquial puede agravar considerablemente el cuadro. También puede observarse panadizo herpético por autoinoculación desde las lesiones existentes en cavidad oral hacia los dedos.
Diagnóstico:
- Citodiagnóstico.
- Biopsia.
- Cultivo.
- Microscopia electrónica.
- Búsqueda de anticuerpos.
La estomatitis recurrente en niños es indicativo de enfermedad sintomática moderada en la “Clasificación Sistémica del CDC para la infección por HIV”. Esta infección se correlaciona primariamente con el porcentaje de LTCD4+. Cuando dichas células exceden a 400 célulasl/mm3, solamente 13% de las lesiones ulcerativas están asociadas a herpes simple, sin embargo cuando los valores de linfocitos TCD4+ son menores a 50 células/mm3, entonces el 58% de las ulceraciones son de esta etiología.
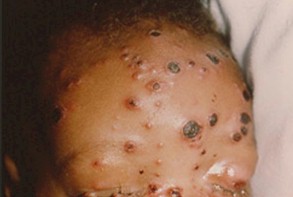
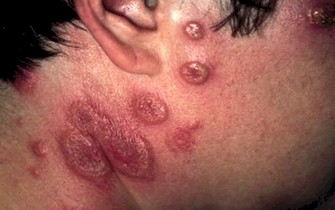
HERPES ZOSTER (HZ)
El herpes zoster puede en el 50% de los casos, ser la primera manifestación clínica de la infección por HIV, con el clásico compromiso vesicular de un neurodermatoma o adquirir características de severidad desde el inicio. La típica varicela puede ocurrir en cualquier estadio de la enfermedad por HIV. Se puede observar la clásica erupción vesicular, pero en formas más atípicas, ulcerativas, profusas, hemorrágicas o diseminadas. Esta infección con sus diversas variantes puede aparecer con niveles normales de LTCD4+, aunque las complicaciones de esta enfermedad son mucho más frecuentes que en los niños inmunocompetentes, con lesiones que tienden a ser más profundas, extensas y dolorosas.
Cuando se acentúa la inmunosupresión pueden afectarse varios dermatomas e incluso diseminarse tornándose indistinguible de la varicela y del herpes simple diseminado.
Diagnóstico:
- Clínica.
- Citodiagnóstico.
- Biopsia.
- Cultivo.
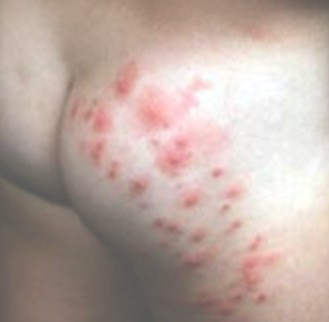
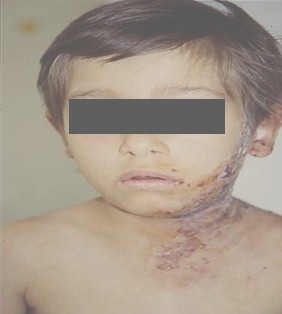
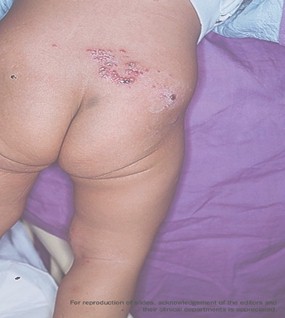
Fotos 2, 3 y 4. Herpes zoster
Fuentes: www.bayloraids.org/ atlas/ 20.htm, www.vaccineinformation.org /varice/ photos.asp
CITOMEGALOVIRUS (CMV)
Es un agente que se asocia frecuentemente con el SIDA. Las manifestaciones cutáneas de este virus son inespecíficas e incluyen erupciones pápulo-vesiculosas, lesiones purpúricas, lesiones nodulares o de tipo prurigo nodular y lesiones ulceradas.
El hallazgo del citomegalovirus (CMV) se efectúa muchas veces en etapas terminales asociado con otros agentes infecciosos como el Pneumocistis carinii, Criptococcus neoformans o el aspergillus. También puede presentarse:
- citomegalovirus (CMV) asociado a otros agentes etiológicos en la misma lesión ocasionando infecciones mixtas con herpes virus en piel y mucosas.
- citomegalovirus (CMV) oral, clínicamente indistinguible de una enfermedad periodontal asociada a HIV.
- citomegalovirus (CMV) asociado a vasculitis cutánea, observándose una evolución fulminante de la enfermedad.
- citomegalovirus (CMV), produciendo infartos cutáneos digitales, asociada a una corta sobrevida.
Más del 30% de las coriorretinitis en pacientes HIV+ son producidas por citomegalovirus (CMV).
Diagnóstico:
- Citodiagnóstico.
- Biopsia.
- Dosaje de anticuerpos.
PAPILOMA VIRUS HUMANO (HPV)
Las lesiones que más frecuentemente produce el papilomavirus humano (HPV) en enfermos portadores del HIV, son las verrugas vulgares planas, filiformes y las genitales o condilomas acuminados. Ocasionalmente puede observarse la papulosis bowenoide.
Las verrugas generalmente son múltiples. Las vulgares, algunas veces voluminosas y diseminadas, localizan preferentemente en manos y pies.
Foto 5. Verrugas por papilomavirus humano (HPV)
Fuente: www.bayloraids.org/atlas/20.htm
Las verrugas filiformes y las planas predominan en la cara y se presentan en gran número. La papulosis bowenoide se caracteriza por elementos papulosos, múltiples (rara vez únicos), en zona genitoinguinal, de tamaño y pigmentación variables, con imágenes histológicas semejantes a la enfermedad de Bowen. No obstante, las lesiones son benignas y regresan con tratamientos conservadores o en forma espontánea, pero pueden persistir por años. Los papilomas virus serotipo 16 y 18 son el agente causal de esta afección (9).
Diagnóstico:
- Clínica.
- Biopsia de las lesiones.
- Microscopía electrónica.
- Reacción en cadena de polimerasa (PCR).
- Hibridización del ADN viral.
MOLUSCO CONTAGIOSO
La infección por poxvirus la observamos con una frecuencia considerable (5-10%) de los pacientes HIV+.
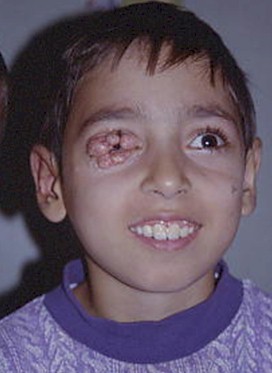
Foto 6. Molusco contagioso. Fuente:www.bayloraids.org/atlas 20.htm
Las pápulas umbilicadas se presentan a veces en número y extensión extraordinarias, localizándose preferentemente en cara y tronco. En otras oportunidades se han visto diminutas pápulas en región anoperineogenital o elementos aislados, solitarios y de gran tamaño en miembros inferiores y superiores y en cara, a veces simulando verrugas o simulando una foliculitis de la barba.
La presencia de molusco contagioso, con predilección por cabeza y cuello, que no involuciona a los 3-4 meses en forma espontánea y que recidiva pese a reiterados tratamientos debe hacer pensar en infección por HIV.
La histoplasmosis y la criptococosis pueden, en pacientes HIV+, adoptar el aspecto de molusco contagioso.
LEUCOPLASIA VELLOSA ORAL (LVO):
Actualmente se atribuye la etiología de esta enfermedad el virus de Epstein- Barr.
Se caracteriza por la presencia de lesiones irregulares en la lengua, que se localizan habitualmente en uno o ambos bordes laterales, aunque pueden extenderse hacia la superficie dorsal y ventral. Se presentan como pliegues o corrugaciones finas de color blanquecino, paralelas entre sí y perpendiculares el eje mayor de la lengua que dan al borde de las mismas un aspecto característico.

Fuente: www.bayloraids.org/atlas/20.htm
A veces tienden a confluir conformando pequeñas placas. En general se trata de lesiones asintomáticas que en ocasiones se entremezclan con candidiasis de la lengua. Se comporta como marcador clínico de inmunosupresión y es altamente predictiva del desarrollo del SIDA.
INFECCIONES MICÓTICAS EN HIV
MICOSIS SUPERFICIALES
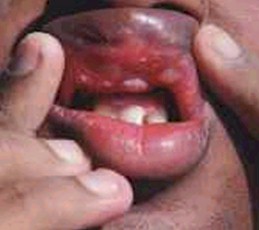
CANDIDIASIS
Foto 8: Candidiasis cutánea
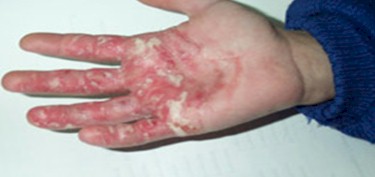
Fuente: www.bayloraids.org/atlas/20.htm
Se considera a la candidiasis oral una de las enfermedades más importantes para el seguimiento y control de los pacientes HIV+, ya que un 90% de estos la padecen en alguna etapa de su enfermedad. Episodios recurrentes de candidiasis oral generalmente ocurren en pacientes con un recuento de LTCD4+ por debajo de 300 por mm3, considerándosela un factor de progresión. Es la manifestación más frecuente en niños HIV+, siendo su incidencia de entre el 20 – 72%.
Aunque puede ocurrir sin depleción severa de los LTCD4+, es mucho más común en chicos con conteo bajo de los mismos o con enfermedad sintomática por HIV.
La candidiasis oral adopta diferentes formas clínicas:
- Eritematosa o atrófica: son placas rojizas en paladar y dorso de la lengua, con atrofia de las papilas.
- Pseudomembranosa: son exudados blanquecinos o amarillentos sobre un fondo eritematoso o normal, que se desprenden con facilidad, localizados en mucosa yugal, lingual y en paladar duro y blando.
- Hiperplasia: son placas o vegetaciones blanquecinas.
- Queilitis angular: son grietas o fisuras recubiertas por costras sobre las comisuras labiales.
- Candidiasis oral a focos múltiples: cuando coexisten dos o más de las formas antedichas.
Foto 9: Candidiasis oral + Herpes virus
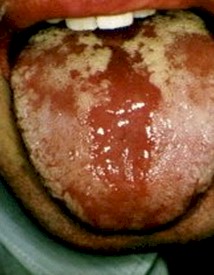
Fuente: www.bayloraids.org/atlas/20.htm
Foto 10: Candidiasis oral
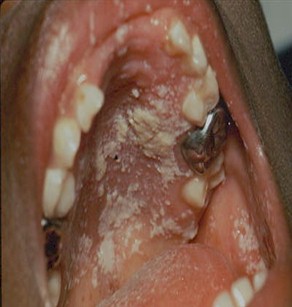
Todas las formas clínicas son de distribución focal, múltiples o extendidas a toda la mucosa oral, pudiendo ser asintomáticas o producir ardor y trastornos en el gusto.
Se las puede hallar contaminando lesiones de leucoplasia vellosa oral. De no mediar tratamiento, pueden extenderse a esófago y al resto del aparato digestivo produciendo dolor y disfagia. También al aparato respiratorio, constituyéndose en la puerta de entrada para la diseminación hematógena.
A nivel de las uñas, la cándida puede ocasionar una característica onixis y perionixis, con deformación y alteración de la coloración ungueal, con la particularidad de ser refractarias, muchas veces, a los tratamientos antimicóticos, siendo más frecuente su presentación en niños de los 2 a los 6 años y en algunos casos está asociada a distrofias severas de las uñas (10).
Foto 11: Candidiasis oral
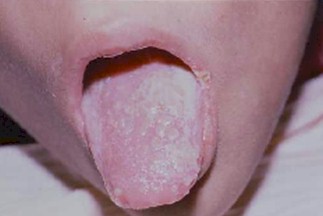
Fuente: www.bayloraids.org/atlas/20.htm
Diagnóstico:
- Clínica.
- Examen micológico directo: presencia de hifas en muestras examinadas con hidróxido de potasio, con PAS o coloración Gram.
- Cultivo: medios de cultivo específicos, Sabouraud.
DERMATOFITOSIS
Los dermatofitos pueden producir lesiones sumamente diseminadas y de aspecto clínico atípico en pacientes HIV positivos.
Agentes etiológicos. Lesiones – Localización
Foto 12: Tinea corporis
Fuente: www.bayloraids.org/atlas/20.htm
Trichophyton rubrum:
Agente etiológico del eccema marginado de hebra, excede los límites del intertrigo inguinal pudiendo extenderse a miembros inferiores, abdomen e incluso tórax, siendo los límites de las lesiones no tan netos ni inflamatorios como en las clásicas dermatoficias, o el prurito, poco intenso.
Epidermophyton floccosum:
Puede producir lesiones papulosas en cara y parte superior del tronco que a veces adoptan una disposición anular y hasta pueden confundirse con una dermatitis seborreica, con la que pueden coexistir.
Es común en estos pacientes la presencia de onicomicosis con extensión de la afección al dorso de los pies. La onicomicosis subungueal proximal blanca es un signo clásico, pudiendo comprometer las veinte uñas. El Tricophyton rubrum es el agente más comúnmente involucrado.
Diagnóstico:
- Clínica.
- Examen micológico directo y cultivo.
MICOSIS PROFUNDAS
HISTOPLASMOSIS
Es una afección micótica causada por un hongo dimorfo, el Histoplasma capsulatum (HC).
La mayoría de las infecciones ocurren luego de la inhalación de los esporos del hongo dando una gran variedad de manifestaciones clínicas o subclínicas, o presentándose con deterioro del estado general, fiebre, disnea y hepatoesplenomegalia. Reiteradamente ha sido descripta en pacientes con SIDA, especialmente en su forma diseminada con una incidencia del 0,5 al 2,7% en áreas no endémicas y con un 10% o más en áreas endémicas. De las histoplasmosis diseminadas en pacientes con SIDA, más del 10%, presentan lesiones cutáneas. Con la actual terapéutica antirretroviral combinada, la frecuencia de la histoplasmosis diseminada ha decrecido notoriamente.
Lesiones
El Histoplasma capsulatum (HC) puede producir lesiones cutáneo-mucosas primarias y secundarias.
Primarias: raras; provienen de la inoculación del hongo en el área afectada. Se han reportado muy pocos casos en pacientes con SIDA.
Secundarias: se producen por la diseminación hematógena de un foco pulmonar.
Manifestaciones cutáneas - Localización
Las manifestaciones cutáneas son inespecíficas, numerosas y de distribución generalizada. Se localizan preferentemente en cara, brazos y tronco, con la particularidad, que en muchos casos la diseminación se superpone a la infección primaria, a diferencia de lo que ocurre en el paciente inmunocompetente donde suelen transcurrir años entre una etapa y la otra. Pueden presentarse como:
- Pápulas con centro queratósico y tendencia a la ulceración semejando moluscos contagiosos.
- Pápulas necróticas.
- Nódulos.
- Pústulas tipo foliculitis.
- Úlceras.
- Exantema maculopapuloso descamativo.
Se afecta generalmente la mucosa oral palatina y laríngea. Suele ser una lesión única en forma de úlcera de bordes sobreelevados e indurados.
Cuando se ve en piel la súbita aparición de algunos de estas lesiones en pacientes con síndrome febril de varios días de evolución, neumopatía y severo deterioro del estado general se debe pensar en una histoplasmosis diseminada.
Diagnóstico:
- Clínica.
- Estudio micológico directo: la escarificación permite visualizar en forma directa el Histoplasma capsulatum. Es un elemento diagnóstico de gran rapidez y utilidad que se verifica con el cultivo.
- Cultivo.
- Hemocultivo.
- Biopsia: se observa un proceso inflamatorio variable, a nivel de la dermis que puede llegar a tejido celular subcutáneo, infiltrado constituido por macrófagos, pocos linfocitos y algunas células plasmáticas, conformando focalmente acúmulos granulomatosos mal definidos. Dentro de los macrófagos se observan abundantes esporos micóticos, aunque también pueden encontrarse sueltos, constituyendo acúmulos libres en dermis vinculados a la inmunosupresión. Se tiñen con PAS y Grocott y se identifica al Histoplasma como un elemento redondo u ovoide en su característica pseudocápsula (11).
CRIPTOCOCOSIS
La criptococosis es una micosis profunda causada por un hongo encapsulado, el Criptococcus neoformans. Es una infección oportunista marcadora de SIDA.
Es la micosis sistémica más frecuente y grave en los pacientes con SIDA, observándosela entre un 10 y un 30%.
El tracto respiratorio constituye la puerta de entrada con compromiso inicial del parénquima pulmonar y posterior diseminación hematógena, que afecta especialmente al sistema nervioso central. La diseminación ocurre en un 50% de los pacientes con SIDA, comparado con el escaso porcentaje de diseminación en pacientes con inmunosupresión sin SIDA.
Afecta múltiples órganos: hígado, bazo, ganglios linfáticos, miocardio, pleura, próstata (que puede ser una reserva del hongo) y raramente piel, teniendo como presentación inicial y más frecuente síntomas de meningitis o meningoencefalitis.
Las manifestaciones dermatológicas de la criptococosis son muy variadas y diseminadas:
- Pequeñas pápulas.
- Pústulas.
- Pápulas con umbilicación central, semejando al molusco contagioso.
- Ulceras.
Foto 13: Criptococosis
Fuente: www.bayloraids.org/atlas/20.htm
Diagnóstico:
- Clínica.
- Examen micológico: escarificación y examen directo (tinción con tinta china para visualizar la cápsula).
- Cultivo.
- Biopsia: con tinción de Gomori y PAS tiñe las levaduras, y con Mucicarmín de Mayer la cápsula.
Puede hallarse al hongo dentro de los macrófagos o células gigantes o bien libres en los tejidos.
Detección del antígeno capsular criptococóccico en sangre o detección en el líquido cefalorraquídeo (LCR) por el test de aglutinación con partículas de látex sensibilizadas (12).
OTRAS INFECCIONES MICÓTICAS
Dos nuevos patógenos relativamente nuevos y con raro compromiso cutáneo-mucoso se han identificado:
- Aspergillus fumigatus
- Penicillum marneffei
Ambos pueden manifestarse con fiebre de origen desconocido o como neumonitis necrotizante y hepatoesplenomegalia.
El Penicillum marneffei es del sudeste de Asia donde es endémico, puede dar úlceras mucosas. Su diagnóstico diferencial es con la histoplasmosis y leishmaniasis.
INFECCIONES BACTERIANAS EN HIV
Los niños HIV+ presentan una susceptibilidad aumentada a las manifestaciones cutáneas bacterianas.
Los síndromes clínicos incluyen por orden de frecuencia: bacteriemia, infección del tracto urinario, neumonía e infecciones en piel y tejidos blandos. Los gérmenes más comúnmente hallados son Streptococcus pneumoniae, Haemophilus influenza tipo B y especies de Salmonella, aunque diferentes patógenos bacterianos han sido rescatados.
MICOBACTERIOSIS
Los pacientes con SIDA tienen una mayor incidencia de padecer infecciones por micobacterias.
Las más frecuentemente observadas son las producidas por Micobacterium tuberculosis (MT) y por Micobacterium avium intracelular (13).
TUBERCULOSIS CUTÁNEA
Foto 14: Escrofuloderma
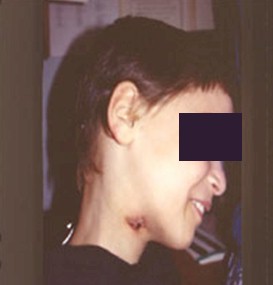
Fuente: www.bayloraids.org/atlas/20.htm
La epidemia por HIV contribuyó al resurgimiento de la tuberculosis (TBC), aumentando la susceptibilidad de los individuos infectados para padecer una tuberculosis primaria o una reactivación tuberculosa.
La tuberculosis es la infección oportunista más común, y la principal causa de muerte en pacientes infectados por HIV en el mundo.
En los pacientes infectados por HIV y por Micobacterium tuberculosis, la inmunosupresión está asociada a:
- Incremento de la diseminación de la tuberculosis (TBC),
- Incremento en el número y la severidad de los síntomas,
- Rápida progresión a la muerte si no se instaura un tratamiento inmediato.
- Los tests de sensibilidad cutánea a la tuberculina muestran anergia cutánea o son débilmente positivos.
La tuberculosis (TBC) cutánea es una forma relativamente rara de tuberculosis (TBC).
Puede ser el resultado de la inoculación por una fuente exógena, por la reactivación de un foco endógeno diseminado por contigüidad o por autoinoculación, o diseminarse por vía hematógena.
Tabla 3: clasificación de tuberculosis cutáneas
Fuente - manifestación clínica
Exógena
- Chancro tuberculoso
- Tuberculosis verrugosa
Endógena. Contigüidad
- Lupus vulgar
- Escrofuloderma
Endógena. Autoinoculación
- Tuberculosis periorificial, Goma tuberculoso,
- Hematógena, Lupus vulgar,
- Tuberculosis miliar.
Fuente: elaborado por los autores
Tabla 4: relación entre la clínica y el estado inmunológico
Estado inmunitario - Forma clínica
BUENO
- Complejo cutáneo primario
- TBC verrugosa
MODERADO
- Lupus vulgar
- Goma tuberculoso
POBRE
- TBC periorificial
- Escrofuloderma
- TBC miliar
Fuente: elaborada por los autores
En estos pacientes se pueden observar formas de tuberculosis (TBC) cutánea más severas, con manifestaciones inusuales e infecciones mixtas. Con frecuencia son formas multibacilares y resistentes al tratamiento.
Se observan manifestaciones de escrofuloderma como lesiones ulcerosas profundas, de bordes despegados, netos, con poca tendencia a la curación.
Con mayor frecuencia se está presentando la tuberculosis (TBC) miliar aguda expresándose como pequeñas pápulas eritematosas de 3 por 4 mm de diámetro. Otras son brillantes sugiriendo papulovesículas, generalmente distribuyéndose en tronco, raíz de miembros y cara apareciendo por brotes sucesivos (14).
Diagnóstico: En las biopsias de piel con técnica de Ziehl-Nielsen se identifican numerosos bacilos, pero la necrosis de caseificación y la vasculitis fibrinoide están presentes en grado variable.
MICOBACTERIUM AVIUM INTRACELULAR (MAI)
La enfermedad cutánea es menos común en niños que en adultos, ocurriendo en al 6 al 14% de los pacientes infectados con HIV, estando más comúnmente asociada con transfusiones de sangre y estadíos avanzados de la enfermedad donde el número de LTCD4+ es menor a 100 mm3. La enfermedad cutánea primaria es rara, pudiendo presentarse como úlceras o abscesos.
Diagnóstico:
- Clínica.
- Bacteriológico: con técnicas de Ziehl-Nielsen, en sangre, hígado, médula ósea, esputo, líquido cefalorraquídeo (LCR) y piel.
- Cultivo.
- Técnicas de biología molecular por PCR.
- Histopatología.
BARTONELOSIS
La bartonelosis o Angiomatosis Epitelioide Bacilar (AEB) fue descripta por Stolen en 1983, en pacientes HIV positivos, en los que se observó pápulas o nódulos angiomatosos semejantes al granuloma piógeno.
El agente etiológico es una Rickettsia de las especies de Bartonella Quintana o Bartonella Henselae.
Las lesiones cutáneas se presentan en forma solitaria, o múltiple con multitud de micropápulas que pueden progresar hasta formar nódulos, tumores o placas vegetantes, generalmente friables y de fácil sangrado.
Las pápulas son las lesiones más frecuentes, redondeadas, semejando al granuloma piógeno, de color rojo, a veces violáceas que varían de pocos milímetros a algunos centímetros de diámetro. Pueden estar rodeadas por un collarete escamoso periférico.
Otro tipo de presentación más profunda, aparece generalmente en extremidades, semejando una placa celulítica o tumor subcutáneo.
La bartonelosis puede afectar la mucosa oral, anal y conjuntiva. Con la técnica de Warthin Starry o con tinciones argénticas se visualiza el agente causal como conglomerados de bacilos.
OTRAS INFECCIONES BACTERIANAS
- Foliculitis estafilocócica: Estas pústulas foliculares pueden tener aspecto y distribución acneiforme, localizando en cara, dorso, tórax superior, axilas, nalgas y extremidades.
- Impétigo estreptocócico: abarcando zonas periorales, perinasales y a veces el cuello en forma mucho más extendida que lo habitual.
- Síndrome estafilocócico de la piel escaldada: causada por toxinas epidermolíticas de distintas cepas de Staphylococcus aureus.
- Ectima gangrenoso: piodermitis producida por el agente causal Pseudomona aeruginosa. Suele localizar en el ángulo perirrectal o perigenital, caracterizado por úlceras extendidas y socavadas.
Sífilis y HIV
El treponema pallidum y el virus de HIV son agentes de enfermedades transmitidas sexualmente, con epidemiología similar, por lo tanto el Síndrome de Inmunodeficiencia Adquirida por su principal mecanismo de contagio debe considerarse una enfermedad de transmisión sexual (ETS). Estudios multicéntricos demuestran un aumento en la incidencia de sífilis secundaria y terciaria en pacientes portadores de HIV.
Considerando la vía sexual como una de las puertas de entrada del virus del SIDA compartida por el Treponema pallidum, se postula la necesidad de realizar en todo paciente HIV positivo el test serológico para sífilis y en todo paciente luético investigar la presencia de HIV. Esto último sería de considerar en la población infectada adolescente.
PARASITOSIS EN HIV
ENDOPARASITOSIS
LEISHMANIASIS
La leishmaniasis cutánea post Kala-Azar, aparece como secuela de la infección por Leishmania donovani.
La forma cutánea se caracteriza por la presencia de lesiones nodulares alrededor de la boca y nariz, que pueden también aparecer en el tronco y los miembros, además de lesiones maculosas hipopigmentadas, que preceden o coinciden con la aparición de los nódulos, especialmente en dorso. Algunas veces el primer signo es un eritema facial en alas de mariposa que empeora con el sol.
Generalmente la infección por Leishmania donovani puede ser controlada por la respuesta inmune del huésped y la adquisición de la enfermedad se debería a cierto grado de inmunodeficiencia.
AMEBIASIS
Foto 15: Acanthamoeba
Fuente:www.bayloraids.org/atlas/20.htm
La amebiasis cutis es una forma excepcional de la enfermedad en la cual se desarrollan lesiones cutáneas.
ECTOPARASITOSIS
ESCABIOSIS
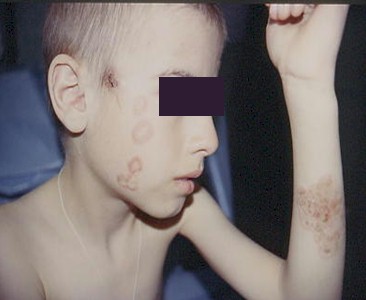
Los pacientes con SIDA, los portadores de HIV y especialmente aquellos grupos de alto riesgo, donde las condiciones higiénicas son deficientes, pueden verse afectados de sarna, infección producida por el Sarcoptes scabiei. Esta resulta de un contacto íntimo con la piel enferma y presenta un síntoma característico que es el prurito severo, tal como ocurre con la población general.
Foto 16: Escabiosis
Fuente: www.bayloraids.org/atlas/20.htm
Foto 17: Sarna Noruega
Fuente:www.bayloraids.org/Atlas/20.htm
Reviste gran importancia una forma rara y severa llamada sarna noruega, descripta en 1848 por Danielssen y Boeck, en Noruega. Esta rara forma fue detectada en pacientes con vasculitis sistémica, tratamientos inmunosupresores, tabes dorsal, siringomielia, lepra, diabetes, malnutrición y síndrome de Down. Pacientes con conteo de LTCD4+ menores a 150 células/mm3 pueden presentar este tipo de sarna.
La sarna noruega es conocida como escabiosis costrosa o hiperqueratósica, ya que, debido a la deficiencia del sistema inmunitario del huésped y la falta de rascado por déficit mental o por prurito escaso, se forman grandes costras hiperqueratósicas repletas de parásitos que localizan especialmente en cabeza, cuello, tronco, manos, pies y espacios subungueales.
El cuadro clínico se completa con la presencia de adenopatías, eosinofilia, títulos elevados de IgE y bajos de IgA. Debe diferenciarse de otras dermatosis como psoriasis, dermatitis seborreica, eritrodermia exfoliativa, eccema, ictiosis (15).
NEOPLASIAS CUTÁNEO-MUCOSAS EN HIV
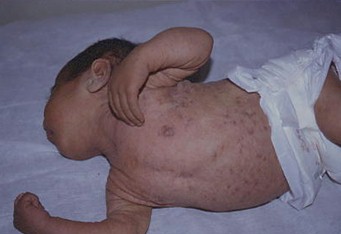
SARCOMA DE KAPOSI (SK)
Hasta el advenimiento del Síndrome de Inmunodeficiencia Adquirida se lo consideraba una enfermedad poco frecuente, restringida a tres presentaciones diferentes: el sarcoma de Kaposi Clásico, el sarcoma de Kaposi Endémico y el sarcoma de Kaposi Iatrogénico asociado a inmunosupresión.
Puede considerarse al sarcoma de Kaposi como un tumor multifocal compuesto por la proliferación de vasos capilares y células fusiformes del tejido perivascular.
Foto 18: Sarcoma de Kaposi
Fuente: www.bayloraids.org/atlas/20.htm
El riesgo de sarcoma de Kaposi es mucho mayor entre los que han adquirido el HIV por contacto sexual con respecto a los que lo han recibido por vía parenteral o vertical y entre las mujeres con HIV adquirido heterosexualmente. Las parejas de hombres bisexuales tienen un riesgo de contraer SK cuatro veces mayor que las mujeres con otros tipos de pareja sexual.
Se pueden distinguir cuatro formas de presentación de sarcoma de Kaposi:
Sarcoma de Kaposi clásico: generalmente se lo observa en hombres de origen mediterráneo o judío, edad promedio: 60 años, curso crónico.
Sarcoma de Kaposi endémico africano: prevalece en África (Uganda, Zaire y Zambia). Se distinguen dos grupos:
- Jóvenes (edad promedio: 35 años), más frecuente en hombres. Generalmente es una enfermedad benigna, raramente agresiva.
- Niños (edad promedio: 5 años). Típicamente fatal en dos o tres años.
Sarcoma de Kaposi iatrogénico: se observan en pacientes inmunosuprimidos, receptores de órganos trasplantados o en aquellos que reciben drogas inmunosupresoras en forma crónica.
Sarcoma de Kaposi epidémico: es el sarcoma de Kaposi asociada a SIDA.
Foto 18: Sarcoma de Kaposi
Fuente: www.bayloraids.org/atlas/20.htm
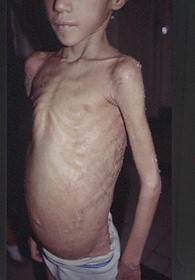
Se lo considera como un proceso multicéntrico, que afecta el tejido linfático. En aproximadamente un 80% de los casos se inicia en piel.
El sarcoma clásico y el endémico comparten características clínicas. Las lesiones son inicialmente maculosas, color azul oscuro o púrpura. Comienza generalmente en piernas y en raras ocasiones en manos, orejas o nariz. Durante su evolución, las áreas afectadas tienden a fusionarse y formar una placa o tumor. Pueden involucrar y dejar pigmentación residual, erosionarse o ulcerarse.
Las lesiones tienden a ser simétricas en ambos miembros inferiores y luego involucrar ganglios linfáticos y raramente mucosas.
El diagnóstico de certeza se obtiene por biopsia y estudio histopatológico (16)
LINFOMA NO HODGKIN
Esta neoplasia tiende a ser más común en niños y adolescentes con SIDA. La frecuencia de la misma tiende a incrementarse significativamente con la edad, siendo más común en niños que en niñas. Se le atribuye un rol importante al Epstein Barr y al descenso de LTCD4+.
El pronóstico de los casos que presentan compromiso cutáneo parece ser más favorable, como también sucede en la población general, sobre todo si sólo presentan lesiones en la piel sin compromiso sistémico (17).
Foto 20: Linfoma No Hodgkin
Fuente:www.bayroraids.org/atlas/20.htm
DERMATOSIS INFLAMATORIAS NO INFECCIOSAS EN HIV
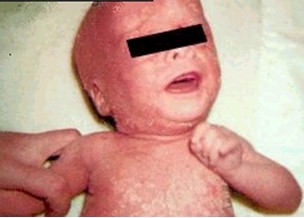
DERMATITIS SEBORREICA (DS)
Foto 21: Dermatitis seborreica
Fuente:www.bayroraids.org/atlas/20.htm
La dermatitis seborreica es una dermopatía eritrodescamativa que habitualmente se distribuye en cara, en especial surcos nasogenianos, zona del entrecejo y cuero cabello, en la que se reconocen formas secas y untuosas, acompañada de prurito variable. En los casos severos, observables en SIDA se afectan barba, bigote, cejas mejillas, frente, surco retroauricular y orejas, región preesternal, en ocasiones axilas, ingle, zona perigenital y área del pañal. El brote se torna a veces secretante, por el contrario otras adoptan una imagen facial en alas de mariposa semejante a la del lupus eritematoso.
Constituye la dermatosis no infecciosa que con mayor frecuencia presentan los pacientes HIV+; la incidencia varia del 40% en algunas series al 83% en otras.
El pityrosporum parece ser el agente etiológico, particularmente en los pacientes con deficiencias inmunológicas. Su severidad está relacionada con el grado de inmunocompromiso. En la infancia el desorden se manifiesta en forma de un severo eritema, afectando cara, cuero cabelludo, zona del pañal, progresando en algunos casos a una eritrodermia generalizada, quedando alopecia como secuela. Niños de cinco años y mayores desarrollan la forma de presentación que se observa en los adultos.
En algunos casos, la atipicidad de su localización y la severidad de la descamación e hiperqueratosis pueden hacer pensar en una psoriasis (sebopsoriasis). Precede en aproximadamente dos años a la aparición de otra signo-sintomatología y suele ser la primera manifestación de la enfermedad.
PSORIASIS
El 3% de los pacientes con HIV la padecen, contra un 2% de la población general, pudiendo resultar de la exacerbación de una psoriasis antigua o de comienzo; en este último caso reviste una gran importancia como marcador de infección por HIV.
Foto 22: Psoriasis

Fuente:www.bayroraids.org/atlas20.htm
Puede iniciarse en cualquiera de sus variantes clínicas, aunque generalmente se ve con más frecuencia la forma inversa o guttata, para agravarse luego adoptando la forma en placa o queratodérmica (similar al Síndrome de Reiter), evolucionando en los casos más severos hasta la eritrodermia, siendo con frecuencia refractaria a los tratamientos convencionales.
PROCESOS VASCULOPURPÚRICOS
TELANGIECTASIAS
Se ha demostrado estadísticamente que las telangiectasias son cuatro veces más frecuentes en sujetos HIV positivos, apareciendo característicamente en tórax, de hombro a hombro y por encima de las clavículas. A veces se extienden a los costados del cuello. En oportunidades se localizan en dedos de manos y en palmas.
VASCULITIS
Se observa ocasionalmente vasculitis purpúrica (púrpura palpable) que por lo general predomina en miembros inferiores.
La imagen microscópica corresponde a una vasculitis leucocitoclástica, en la que los estudios de inmunofluorescencia demuestran el depósito de complemento.
PÚRPURA TROMBOCITOPÉNICA IDIOPÁTICA (PTI)
A diferencia de la púrpura trombocitopénica idiopática (PTI) clásica que predomina en el sexo femenino (3 a 1), la que acompaña al SIDA se ha observado exclusivamente en varones jóvenes. La trombocitopenia es severa (promedio 16.000-3.000 plaquetas/mm3) y se acompaña, como en la forma clásica, de megacariocitos y proliferación megacariocítica medular.
Clínicamente se exterioriza por petequias y equimosis cutaneomucosas. Suelen observarse epistaxis, hemorragias gingivales y bucales y en la piel predominan los hematomas espontáneos o provocados.
FARMACODERMIAS
Los pacientes infectados con el virus de la inmunodeficiencia humana se encuentran particularmente predispuestos a desarrollar reacciones cutáneas adversas a fármacos, habiéndose pretendido explicar dicho fenómeno por diversas reacciones.
Foto 23: Rash por trimetroprim-sulfametoxazol (TMS)
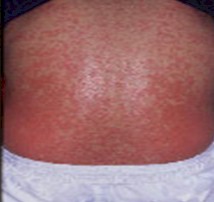
Fuente:www.bayroraids.org/atlas/20.htm
La prevalencia de reacciones adversas a las sulfamidas en los HIV+ varía entre 70 y 83%, en contraste con el 2-4% de la población general. Resulta importante consignar que la frecuencia de farmacodermia por sulfamidas en imnunosupresiones no relacionadas con la infección por HIV, es similar a la de la población general, por lo tanto la elevada incidencia de estas reacciones parece ser específica de la infección por HIV.
La prevalencia de Síndrome de Lyell en pacientes HIV+ tratados con sulfamidas es alta: 15%. La extensión del cuadro es, en estos pacientes, mayor y la cicatrización más lenta, con elevada mortalidad.
La aparición de un brote cutáneo en pacientes con SIDA que recibe sulfamidas debe hacer sospechar farmacodermias, que puede ser grave sobre todo si existe compromiso inicial o precoz de mucosas y alteración importante del estado general. De inmediato deben adoptarse medidas de orden general y suprimir el fármaco.
Tabla 5. Farmacodermias en HIV
Drogas desencadenantes. Sulfamidas (TMS)
- Eritromicina
- Dicloxacilina
- Rifampicina
- Isoniacida
- Tetraciclina
- Penicilina
- Cotrimoxazol
- Difenilhidantoína
Manifestaciones clínicas. Rash eritematoso maculo-papular
- Síndrome de Steven Johnson
- Necrolisis epidérmica tóxica (Lyell)
- Erupciones eccematoideas
- Urticaria
- Vasculitis
- Púrpura
Fuente: elaborada por los autores
MANIFESTACIONES MISCELÁNEAS EN HIV
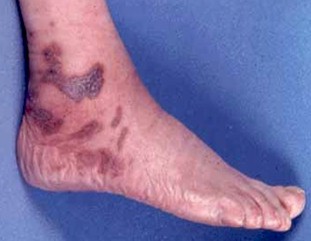
SÍNDROME SWEET
Aunque raro en pediatría, el Síndrome Sweet debería ser considerado en niños que presentan nódulos o placas múltiples, dolorosas y rojo-violáceas.
En 1986, Su y Lui, propusieron dos criterios mayores y cuatro menores para su diagnóstico. Requiriéndose para un diagnóstico definitivo ambos criterios mayores y al menos dos criterios menores.
Criterios mayores:
- Aparición abrupta de placas o nódulos eritematosos.
- Infiltración neutrofílica de la dermis sin vasculitis leucocitoclástica.
Criterios menores:
- Síntomas prodrómicos de fiebre o infección.
- Coexistencia de conjuntivitis, fiebre, artralgias.
- Leucocitosis.
- Buena respuesta a los esteroides sistémicos.
Foto 24. Síndrome Sweet.
Fuente: www.lqb.es/dermatologia/atlas/sweet/sweet02.htm
En 1989, Driesch y col propusieron añadir como criterio menor una eritrosedimentación elevada.
Las manifestaciones clínicas de este síndrome son inespecíficas por lo cual debería tenerse en cuenta otras manifestaciones cutáneas. Entre los diagnósticos diferenciales se incluyen: celulitis, secundarismo sifilítico, farmacodermias, pioderma gangrenoso, vasculitis, eritema multiforme, eritema nodoso, enfermedad de Behçet. Ocasionalmente, este síndrome se puede presentar en forma de vesículas y edema, resultando indispensable realizar un diagnóstico diferencial con herpes virus y varicela zoster.
La etiología de este síndrome es desconocida, sin embargo su asociación con síndromes paraneoplásicos e inflamatorios sugieren una hipersensibilidad a antígenos bacterianos, virales, tumorales o a una reactivación de estos (18).
CONCLUSIONES
Resulta innegable que el advenimiento de la epidemia de SIDA, repercutió hondamente en todas las ramas de la medicina, pero en algunas especialidades, como la Dermatología, lo hizo muy especialmente. De acuerdo a la recopilación de los datos obtenidos, queda claramente demostrado que hay un incremento en la prevalencia de las manifestaciones mucocutáneas en los pacientes pediátricos HIV positivos, que a su vez es mayor en aquellos que presentan inmunodepresión moderada y severa.
La mayoría de estas manifestaciones son de etiología infecciosa, con predominio de las infecciones micóticas, siendo la Candidiasis la más comúnmente encontrada.
Según el estado de inmunodepresión, los pacientes podrán presentar más de una manifestación cutánea, presentaciones atípicas, recurrencias, mayor severidad en las manifestaciones clínicas y una mayor resistencia a los tratamientos realizados. Las enfermedades de la piel y de las mucosas pueden ser o un signo de presentación de la infección por HIV o un marcador pronóstico del grado de inmunodepresión, por eso es de gran importancia realizar un diagnóstico precoz de las mismas.
Bibliografía
- Luzuriaga K. Early Therapy of Vertical Human Inmunodeficiency Virus Tipe 1 Infection: Control of Viral Replication and Absence of Persistent of HIV 1 Specific Inmune Responses. J Virology.2000;74:6984
- Moreno R. VIH Transmisión Vertical. PRONAP. Módulo 1; 2005: 11-35
- Stefanaki C, Stratigos A., Stratigos J., Skin Manifestations of HIV-I Infection in Children Clin Dermatol. 2002 Jan-Feb;20 (1):74-86.
- Behrman R., Kliegman R., Jenson H. Nelson Tratado de Pediatría. 16o Edición. México D.F. McGraw-Hill Interamericana Editores, S.A. de C.V. 2001: 1121-1132
- Paganini H. Tratamiento Antimicrobiano de las Infecciones en Pediatría. 1o Edición. Buenos Aires. Editorial Científica Interamericana S.A.C.I. 2005: 195-204
- Cotran R., Kumar V.Collins T. Robbins Patología Estructural y Funcional. 6o Edición. Madrid McGraw-Hill-Interamericana de España, S.A.U 2000
- Meneghello R., Fosta N, Paris M, Puga T.F. Pediatría. 5o Edición. Buenos Aires. Editorial Panamericana, 1999: 1020-1031.
- Wananukul S, Deekajorndech T, Panchareon C, Thisyakorn U. Mucocutaneous Findings in Pediatric AIDS Related to Degree of Immunosuppression. Pediatr Dermatol. 2003 Jul-Aug; 20 (4): 289-294.
- Allen Al, Siegfried Ec; What’s New in Human Papillomavirus Infection. Curr op in Pediatr 2000; 12:365
- Larralde de Luna M. Dermatología Neonatal y Pediátrica. 1o Edición. Buenos Aires. Editorial EDIMED, 1995: 159
- Wheat J. Practice Guidelines for the Management of Patients with Histoplasmosis.Clin Infec Dis. 2000; 30:688.
- Saag M. Practice Guidelines for the Management of Criptococcal Disease. Clin Infect Dis. 2000;30:710.
- Chaves A. Primary Cutaneous Mycobacterium Kansaii Infection in a Child. Pediatr Dermatol. 2001;18:131.
- Pandhi D, Reddy B, Chowdhary S, Khurana N. Cutaneous tuberculosis in Indian children: the importance of screening for involvement of internal organs.J Eur Acad Dermatol Venereolo 2004 Sep;18 (5):546-51.
- Angel TA, Nigro J, Levy ML.. Infestations in the Pediatric Patient. Pediatr Clin Noth AM. 2000; 47:921.
- Pollock B, Jenson H, Leach C, et al. Risk Factors for Pediatric Human Inmunodeficiency Virus-Related Malignancy. JAMA.2003;289:2393-2399.
- Knowles DM. Etiology and Pathogenesis of AIDS Related non- Hodgkin’s Lymphoma. Hematol Oncol Clin Noth Am.2003;17:785-820.
- Malone JC, Slones P. Sweet Syndrome: a Disease in Histologic Evolution? Arch Dermatol.2005 Jul; 141 (7):893-5.
