La transmisión vertical es el modo dominante de adquisición de la infección por VIH en los niños. La transmisión madre a hijo sin ninguna intervención médica, ha variado, en diferentes estudios internacionales entre un 16.4% a un 40%, dependiendo del lugar donde se realizó el estudio. En nuestro país algunos estudios realizados ubican dicha tasa en alrededor del 35%. La transmisión madre – hijo puede ocurrir durante el embarazo, el parto y/o por la lactancia materna. La perinatal ha sido la vía de transmisión para el 95% de los 1379 niños enfermos notificados al 31 de junio de 2001, representando el 6.9% del total de personas con SIDA de la Argentina.
Prevención de la transmisión vertical del HIV en la mujer embarazada VIH positiva. Revisión Bibliográfica.
Dr. Damián Andrés Clemente. Médico Pediatra
Buenos Aires, Argentina
Introducción
La transmisión vertical es el modo dominante de adquisición de la infección por VIH en los niños. La transmisión madre a hijo sin ninguna intervención médica, ha variado, en diferentes estudios internacionales entre un 16.4% a un 40%, dependiendo del lugar donde se realizó el estudio. En nuestro país algunos estudios realizados ubican dicha tasa en alrededor del 35%.
La transmisión madre – hijo puede ocurrir durante el embarazo, el parto y/o por la lactancia materna. La perinatal ha sido la vía de transmisión para el 95% de los 1379 niños enfermos notificados al 31 de junio de 2001, representando el 6.9% del total de personas con SIDA de la Argentina.
Sin ninguna intervención, un 20% de los niños se infectan antes de nacer (infección prenatal o intrauterina), mientras que un 50 – 80% lo hacen durante el parto (infección intraparto); la lactancia materna puede incrementar el 15-20% el riesgo de transmisión.
El protocolo de estudio 076 realizado en EE.UU. y Francia en 1994, demostró la utilidad del uso de Zidovudina (AZT) para prevenir la transmisión vertical del VIH. La tasa de transmisión pasó del 25% sin tratamiento, al 8% con la administración de Zidovudina (AZT) durante el embarazo, parto y al recién nacido durante las primeras 6 semanas de vida. El AZT fue bien tolerado y los efectos colaterales a corto plazo fueron raros y reversibles. A partir de esta demostración cobró relevancia el diagnóstico prenatal de la infección por VIH.
A partir de la incorporación de los tratamientos antirretrovirales de alta eficiencia a las futuras madres y la utilización de diferentes métodos de prevención se redujo aún más la transmisión vertical, llegando a menos de un 2%, en algunos estudios.
Epidemiología
El número de casos de infección por VIH, en el mundo, ha aumentado significativamente desde que se reportó el primer caso el 5 de mayo de 1981. Según la Organización Mundial de la Salud (OMS), se calcula que hasta diciembre de 1999 alrededor de 33.600.000 personas estaban infectadas por el VIH, de las cuales 32.400.000 era adultos y 1.200.000 eran menores de 15 años. Las muertes por causa del SIDA reportadas ascienden a 16.300.000 (3.600.000 corresponden a menores de 15 años).
Aproximadamente la mitad de las personas adquiere la infección por VIH antes de cumplir los 25 años y muere de SIDA antes de cumplir 35 años(1).
El 95% de los pacientes con VIH/SIDA vive en países en vías de desarrollo. África es el continente más seriamente afectado por la epidemia, con 34.000.000 de personas infectadas. El 70% de las personas infectadas vive en este continente; en el 90% de los casos la infección se produce por contacto heterosexual, y este es el único continente con mayor cantidad de mujeres infectadas por el virus.
En América Latina se ha visto un aumento significativo del número de casos de VIH en general, particularmente entre las mujeres; en 1984 había 25 hombres por cada mujer infectada, mientras que en 1997 la relación fue de 3,5 a 1.
En EE.UU., la transmisión heterosexual aumentó del 1% en 1984 al 13% en 1997. Este mecanismo de transmisión pasará a ser el más frecuente, en un futuro próximo, en el resto de los continentes. Se estima que 11 personas por minuto se infectan en el mundo por el VIH, y se producen alrededor de 16.000 casos nuevos de infección por día.
Las regiones del mundo más afectadas, en orden decreciente, son: África, Asia, América del Sur y Central, América del Norte, Europa y Oceanía(1).
El primer caso pediátrico de infección por VIH reportado al CDC de Estados Unidos fue en noviembre de 1992 y a partir de ahí el número de casos fue aumentando de forma progresiva en todo el mundo. El 90% de los niños menores de 14 años infectados por VIH viven en África. En la Argentina el 6,9% de los casos de SIDA corresponde a niños menores de 13 años (2). A principios del año 2000 se registraron 11.200.000 niños huérfanos en el mundo a causa del virus.
La prevalencia de la infección por VIH perinatal se ha incrementado en forma exponencial en la última década, a partir del aumento significativo de la infección por VIH en la mujer. La seroprevalencia de VIH en mujeres embarazadas varía en los distintos continentes. Mientras que en África es del 6 al 30%, en la Argentina oscila entre el 1 el 2% (estadísticas de hospitales públicos) y en los EE.UU. es del 0,17%. Por otra parte, en los países desarrollados el número de casos pediátricos de VIH ha comenzado a disminuir a partir de 1994, debido al uso de terapias antirretrovirales durante el embarazo y el período neonatal. En los países en vías de desarrollo nacen entre 300.000 y 350.000 chicos con infección por VIH por año. En Latinoamérica, la Argentina ocupa el tercer lugar, luego de Brasil y México, en cuanto al número de casos de SIDA.
En los países donde se estudia la sangre se considera que el 100% de las infecciones por VIH en los recién nacidos y niños pequeños se deben a la transmisión vertical de madre a hijo, la cual puede producirse por vía transplacentaria (20-35%) o intraútero a partir de la octava semana de gestación, durante el parto o intraparto (65-80%) y a través de la lactancia materna. La transmisión vertical sin tratamiento antirretroviral de la madre varía entre el 35 el 40% en África, entre el 12 al 15% en Europa y es del 25% en América (2).
A comienzos del año 2000, fueron reportados 20.000 casos de sida en la Argentina. La epidemia de VIH/SIDA en nuestro país tiene las siguientes características:
- Es concentrada, dado que la prevalencia del VIH es mayor del 5% en la población con conductas de riesgo y menor del 5% en las mujeres embarazadas.
- Presenta una concentración urbana con marginación y pauperización. Se considera urbana porque la mayoría de los infectados reside en ciudades con más de 50.000 habitantes. Se habla de marginación cuando la infección afecta a personas con escaso acceso a la educación y a los sistemas de salud y con signos de exclusión sociocultural. La pauperización se refiere al bajo nivel socioeconómico y educativo de las personas afectadas.
- La provincia de Buenos Aires, incluida la Ciudad de Buenos Aires, concentra el 66% de los casos de SIDA, la provincia de Santa Fe, el 66% de los cuales el 81% vive en Rosario, la provincia de Córdoba, el 4,5% de los cuales el 46% vive en la capital.
- Sufre un proceso de feminización; es el mayor crecimiento del número de casos de SIDA en mujeres que en hombres. Este aumento ejerce un impacto muy importante en el número de casos pediátricos de SIDA por transmisión vertical.
- Aumento en la velocidad de transmisión heterosexual.
- Alto número de transmisión vertical.
Manifestaciones Clínicas
La infección en pediatría tiene una presentación bimodal:
1. Los recién nacidos infectados en forma intrauterina, si no reciben tratamiento, presentan los primeros síntomas de la enfermedad en los primeros seis meses de vida, y la sobrevida promedio es de cuatro años.
2. Los recién nacidos infectados en el período perinatal, que no reciben tratamiento antirretroviral, desarrollan síntomas entre el segundo y tercer año de vida, y tienen una sobrevida promedio de ocho años. El 5% de los niños permanece asintomático, sin alteraciones de su sistema inmune y con una carga viral muy baja por un período de doce a quince años, sin recibir tratamiento específico. A estos últimos se los llama “sobrevivientes a largo plazo”.
En los primeros meses de vida, los niños infectados de forma intrauterina pueden presentar síntomas precoces que deben hacer sospechar la posibilidad de una infección por VIH:
• Pobre crecimiento de peso y talla.
• Retraso del desarrollo madurativo sin causa clara (infección del SNC por el virus).
• Linfadenopatía generalizada.
• Hepatomegalia.
• Esplenomegalia.
• Candidiasis oral severa y de difícil tratamiento (por déficit funcional de linfocitos CD4).
• Bacteriemia por Streptococcus pneumoniae (por disfunción de los linfocitos CD4).
• Neumonitis intersticial por Pneumocystis carinii (más frecuente en niños que adquieren la infección en forma intrauterina).
Las infecciones más frecuentes que padecen los niños en la Argentina son:
• Infecciones bacterianas severas.
• Neumonía por Pneumocystis carinii.
• Encefalopatía por VIH.
• Neumonitis intersticial linfoidea.
• Síndrome de adelgazamiento.
• Esofagitis candidiásica.
• Infección por citomegalovirus (CMV) diseminada.
• Toxoplasmosis cerebral.
• Criptosporidiosis.
• Criptococosis.
• Infecciones por micobacterias.
Los niños con infecciones por el VIH se agrupan en distintas categorías clínicas. El CDC de EE.UU. estableció cuatro categorías clínicas diferentes de acuerdo al grado de afección empírica:
Categoría N: Asintomáticos (2).
Son niños que no presentan signos ni síntomas relacionados con la infección por VIH o que sólo tienen una condición de la categoría A.
Categoría A: Síntomas leves (2).
Son niños con dos o más de las siguientes condiciones pero sin ninguna de las que pertenecen a las categorías B y C:
• Linfadenopatía (> o igual a 0,5 cm en más de dos sitios, o en un sitio pero bilateral).
• Hepatomegalia.
• Esplenomegalia.
• Dermatitis.
• Parotiditis.
• Infección respiratoria alta recurrente o persistente, sinusitis u otitis media.
Categoría B: Síntomas moderados (2).
Son niños con síntomas no incluidos en las categorías A y C, atribuibles al VIH:
• Anemia (Hemoglobina < 8 gr/dl), neutropenia (leucocitos < 1.000/mm3) o plaquetopenia (plaquetas < 100.000/mm3) que persisten más de 30 días.
• Meningitis bacteriana, neumonía o sepsis (episodio único).
• Candidiasis orofaríngea de más de dos meses de duración en niños mayores de 6 meses.
• Cardiomiopatía.
• Infección por citomegalovirus con inicio antes del mes de edad.
• Diarrea crónica o recurrente.
• Hepatitis.
• Estomatitis por herpes simples recurrente (más de dos episodios en un año).
• Bronquitis, neumonía o esofagitis por herpes simples en un niño menor de un mes.
• Herpes zoster que involucra más de un dermatoma o es recurrente (más de dos episodios).
• Leiomiosarcoma.
• Neumonía intersticial linfoidea.
• Neuropatía.
• Nocardiosis.
• Fiebre de más de un mes de duración.
• Toxoplasmosis con inicio antes del mes de edad.
• Varicela diseminada.
Categoría C: Síntomas severos (2).
• No se incluye en esta categoría a la Neumonitis intersticial linfoidea.
• Infecciones bacterianas severas, múltiples o recurrentes (combinación de por lo menos dos infecciones confirmadas por cultivos: septicemia, meningitis, neumonía, abscesos de órgano interno, osteoartritis e infecciones de catéteres).
• Candidiasis esofágica o pulmonar.
• Coccidioidomicosis diseminada.
• Criptococosis extrapulmonar.
• Criptosporidiosis o isosporidiosis con diarrea de más de un mes de duración.
• Infección por citomegalovirus (CMV) en mayores de un mes de edad (en otros sitios diferentes al hígado, bazo o ganglios linfáticos).
• Encefalopatía por más de dos meses sin otra causa justificable, con síntomas progresivos.
• Infección por virus herpes simple (VHS) con úlceras mucocutáneas de más de un mes de duración o compromiso bronquial, pulmonar o esofágico en mayores de un mes de edad.
• Histoplasmosis diseminada (fuera del pulmón y ganglios hiliares y cervicales).
• Sarcoma de Kaposi.
• Linfoma primario de cerebro.
• Linfoma de Burkitt o inmunoblástico o de células grandes o células B o de celularidad desconocida.
• Tuberculosis diseminada o extrapulmonar.
• Infección diseminada por micobacterias avium complex o kansassii.
• Neumonía por Pneumocystis carinii.
• Leucoencefalopatía multifocal progresiva.
• Septicemia recurrente por Salmonella notyphi.
• Toxoplasmosis cerebral en niños mayores de un mes.
• Síndrome de desgaste en la ausencia de enfermedades concurrentes
Se pueden agrupar los niños infectados en distintas categorías inmunológicas, en base al recuento de linfocitos CD 4 (tabla 1).
Métodos diagnósticos.
Las pruebas de HIV no solamente son importantes a nivel individual, sino que también se usan en gran número en el escrutinio de los donadores de sangre, en los productos sanguíneos y en el trasplante de órganos para garantizar su seguridad, así como para la vigilancia epidemiológica.
La conciencia de la infección por HIV es el prerrequisito para hacer el diagnóstico oportuno y mejorar así el uso de las opciones terapéuticas. La disponibilidad actual de las diversas drogas antirretrovirales y la evidencia de la mejor evolución de la enfermedad con la terapéutica precoz, ha hecho necesario disponer de métodos rápidos de diagnóstico en la población pediátrica. Es por eso que hay que estudiar a todos los hijos de madres con diagnóstico de HIV, con factores de riesgo para la misma y a todos aquellos con signos y/o síntomas compatibles con la enfermedad.
El diagnóstico de la infección por HIV puede hacerse de una forma indirecta y de una forma directa. La primera se basa en la demostración de anticuerpos específicos contra el virus mientras que segunda mediante la demostración del virus.
Dentro de los métodos serológicos hay que diferenciar las técnicas de tamizaje y las muestras de confirmación. La mayoría de las pruebas de escrutinio se basan en el principio del inmunoensayo ELISA (Enzyme Linked Immuno sorbent Assay). Estas pruebas deben ser lo suficientemente sensibles como para minimizar la posibilidad de obtener un resultado falso negativo y también deben poder detectar anticuerpos dirigidos contra todos los subtipos diferentes de HIV (HIV-1, HIV-2) y los subtipos (HIV-1-N, HIV-1-O, HIV-1-M). Si el resultado de esta prueba de escrutinio es positivo debe confirmarse mediante al menos un ensayo confirmativo (3).Las técnicas de tamizaje como la aglutinación de partículas de gelatina o ELISA tienen una sensibilidad y especificidad del 99% pero pueden observarse falsos positivos, por ejemplo, en mujeres embarazadas. Las pruebas de ELISA actualmente utilizadas detectan anticuerpos específico; las pruebas de última generación también detectan combinan la detección de anticuerpos de HIV y del antígeno p24 intentando así reducir el período de “ventana”.
El otro método serológico utilizado es el Western blot. Generalmente se utiliza como método confirmatorio de las muestras que dieron positivas en el screening. El Western blot detecta anticuerpos contra las diferentes proteínas virales y se dividen en 3 grupos, las glucoproteínas env o de envoltura (gp41, gp120, gp160), las proteínas gag o del núcleo (p18, p24/25, p55) y las proteínas pol o de endonucleasa-polimerasa (p34, p40, p52, p68). Para definir un resultado como positivo se requieren al menos de tres bandas, según la recomendación de la OMS, un Western blot se considera positivo sólo si se encuentran dos bandas env.
Además de la seguridad obligatoria mediante pruebas confirmativas, por ejemplo mediante Western blot, el diagnóstico serológico de una infección por HIV siempre requiere que se pruebe una segunda muestra de sangre del paciente tomada de manera independiente. De ser posible, sólo entonces se le informará al paciente sobre el diagnóstico.
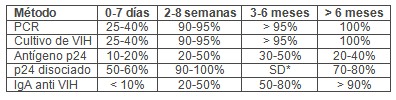
Los test virológicos disponibles actualmente son la detección del HIV por PCR, cultivo y el test de Antígeno p24. La mayor sensibilidad de los tests virológicos corresponde al cultivo viral y a la PCR, siendo la misma del 40% dentro de las primeras 48 horas de vida y 93% a los 14 días de vida. Un test virológico positivo indica presunción de infección y debe ser confirmado con la repetición del mismo en una segunda muestra. Actualmente la prueba más empleada es la detección del genoma viral puesto que no requiere un laboratorio de alta seguridad, es más sensible que la detección del antígeno y permite la cuantificación, es decir, la “carga viral”, herramienta indispensable para la terapia antirretroviral.
El test de detección del antígeno p24 es muy específico pero la sensibilidad es menor que las otras técnicas virológicas por lo que no se recomienda como técnica aislada para descartar o diagnosticar la infección o en los menores de 1 mes de edad por la posibilidad de falsos positivos. (Tabla 3).
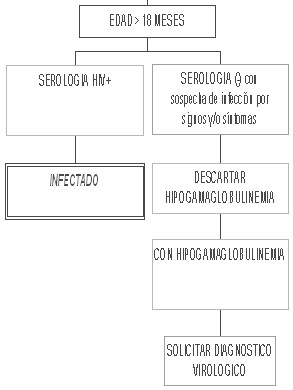
Diagnóstico de infección por VIH en el niño
En el niño mayor de 18 meses y en los adultos los métodos serológicos permiten realizar el diagnóstico de la infección. Sin embargo, en el niño menor de 18 meses los métodos serológicos no son útiles ya que pueden dar positivo al detectar la presencia de anticuerpos maternos. Las inmunoglobulinas G (IgG) maternas atraviesan la placenta hacia el feto a partir de la semana 32 de gestación y estas IgG son detectadas por el test de Elisa y el Western blot dando un resultado falsamente positivo. Los anticuerpos maternos pueden persistir en la sangre del niño por un período máximo de 18 meses (el 90% de los niños no infectados son «seronegativos» para el VIH a los 12 meses de edad), por lo cual el diagnóstico en los casos de niños menores de 18 meses debe realizarse con tests que detectan directamente la presencia del virus.
Los métodos directos se basan en la demostración del virus, de los antígenos virales o del genoma viral.
Actualmente la prueba más empleada es la detección del genoma viral puesto que no requiere un laboratorio de alta seguridad, es más sensible que la detección del antígeno y permite la cuantificación de la infección, hecho fundamental para monitorear la terapia y calcular la infectividad. El aislamiento del virus en los cultivos celulares se reserva para casos especiales puesto que es exigente, implica un cierto riesgo y por tanto requiere del uso de un laboratorio de alta seguridad. La detección del ácido nucleico viral puede efectuarse buscando el cDNA proviral en leucocitos o RNA viral en la fracción que no contiene células (en plasma). Además, el análisis cualitativo del genoma viral sirve como marcador de la infección, siendo un complemento o un sustituto de la prueba de anticuerpos para el diagnóstico de la infección por HIV cuando se sospecha de infección primaria reciente (Ej. Durante el período de ventana o en los recién nacidos de madres infectadas). Las pruebas más sensibles pueden detectar aproximadamente 50 copias/ml.
Es probable que varios métodos para la detección de ácidos nucleicos de HIV no tengan éxito en caso de subtipos "exóticos" de HIV-1 (es decir, que no sean del subtipo B) (y de HIV-2) y que den resultados falsos negativos. Para excluir esta posibilidad también deberá probarse una muestra materna a fin de asegurar la capacidad de la prueba para detectar la cepa viral en cuestión. Si las pruebas de la madre son positivas para PCR con el mismo ensayo, se podría usar un resultado negativo de la prueba para el bebé, de otro modo habrá que elegir un método apropiado en un laboratorio especializado o habrá que recurrir a la prueba de anticuerpos sola con sus limitaciones el diagnóstico temprano de la infección neonatal es importante para la profilaxis de Pneumocystis y para la terapia antirretroviral temprana durante los primeros meses de vida.
El primer test diagnóstico virológico debería realizarse entre el nacimiento y los primeros dos días de vida dado que un resultado positivo puede indicar que el niño se infectó por VIH en forma intrauterina. La confirmación diagnóstica de la infección intrauterina por VIH es fundamental ya que en estos niños la evolución es más acelerada y tienen un pronóstico reservado (1). En los niños hay que evitar tomar sangre del cordón umbilical, ya que puede existir contaminación con sangre materna y dar un resultado falso positivo.
Los tests virológicos deben repetirse entre el mes y los 2 meses, y entre los 3 y los 6 meses de vida. Si la PCR o el cultivo viral son negativos en los 2 primeros días de vida y se vuelven positivos en muestras posteriores, se trata de una infección perinatal.
Un primer test virológico con resultado positivo define una infección presuntiva, mientras que la infección es confirmada cuando se obtiene un segundo test virológico positivo en una segunda muestra sanguínea.
El test de PCR, que permite la amplificación de los ácidos desoxirribonucleicos (ADN) específicos, es el preferido para el diagnóstico de la infección por VIH durante la infancia. La sensibilidad del mismo en las primeras 48 horas de vida es del 38%, lo que refleja el porcentaje de niños que han sido infectados en forma intrauterina. A los 14 días de vida, la sensibilidad del método se incrementa al 93%, y refleja al VIH adquirido en el período perinatal.
El 100% de los niños infectados por VIH tendrán una PCR positiva a los 6 meses de edad. La PCR para la detección del ácido ribonucleico (ARN) mide la presencia de viriones libres en el plasma y es más costosa que la PCR para ADN pero, debido a su alta sensibilidad y especificidad, también puede ser utilizada para el diagnóstico temprano de la infección. El cultivo viral específico para el VIH tiene la misma sensibilidad que la PCR pero es más costoso, complejo y lento, ya que se debe esperar hasta veintiocho días para obtener el resultado definitivo (4).
A partir de los 18 meses, la detección de anticuerpos IgG por ELISA y la confirmación por Western blot es suficiente para el diagnóstico de infección por VIH. Si el estado serológico materno es desconocido, puede realizarse un test de ELISA al recién nacido. Si es positivo, debe confirmarse la presencia de infección materna por VIH y, en consecuencia, se requiere una evaluación completa del niño para descartar infección por VIH.
Los test rápidos de diagnósticos se utilizan en situaciones en las que se necesita realizar profilaxis medicamentosa para evitar la infección; por ejemplo en las salas de urgencias, antes de las operaciones de emergencia, después de los accidentes por punción con agujas o en mujeres en trabajo de parto que no hayan realizado la prueba durante el embarazo. La positividad de un test rápido es indicación del tratamiento para reducir la transmisión perinatal, suspender la lactancia y realizar los estudios necesarios para la confirmación diagnóstica. La negatividad de un test rápido se maneja según la sospecha diagnóstica.
En la ciudad de Buenos Aires el screening para VIH debe realizarse a toda embarazada previo consentimiento escrito y asesoramiento. Se realiza la solicitud de serología por medio de un sistema que combine el sexo, las iniciales del nombre (dos primeras letras), apellido (dos primeras letras), día, mes y año de nacimiento (Ejemplo: FAnPe16/05/1975).
La "ventana de tiempo" para el diagnóstico.
Un problema importante para la prueba de anticuerpos contra HIV es la ventana de tiempo. Este es el período que transcurre entre la adquisición de la infección por HIV y la presencia de concentraciones detectables de anticuerpos. Las pruebas de escrutinio que se usan actualmente tienen la capacidad de detectar la infección por HIV a las 6 y a las 12 semanas de la infección primaria en aproximadamente el 80% y casi en el 100% de los casos respectivamente. En los casos muy raros sólo es posible diagnosticar la infección después de tres o hasta seis meses. Con los ensayos de escrutinio de la 4ª generación se pretende reducir la duración de la "ventana de diagnóstico" mediante la detección simultánea de anticuerpos contra HIV y de anticuerpos contra el antígeno p24 de HIV. No obstante, estas pruebas de la 4ª generación presentan algunos problemas: Aunque dan un resultado positivo tempranamente, debido a razones metodológicas, es probable que haya una segunda fase de ventana de diagnóstico durante la cual las pruebas sean negativas otra vez.
Durante la seroconversión la prueba de escrutinio dará resultados dudosos o de reactividad débil. Es probable que en el Western blot de confirmación durante esta etapa no se observen bandas o que se observe un patrón de bandas incompleto en el que la primera banda visible suele ser la de p24. Los resultados obtenidos en estos casos con frecuencia son indistinguibles de los observados en las personas no infectadas que en ocasiones muestran cierto grado de reactividad inespecífica en bandas aisladas de p24. Estos casos con frecuencia no se aclaran en el momento, pero se resuelven con pruebas de seguimiento al poco tiempo. Si en realidad se trata de una seroconversión, la serorreactividad incrementará significativamente tan sólo unos días después y en unas cuantas semanas se encontrará un patrón completo de bandas en el Western blot. En función de las circunstancias individuales se recomienda la detección directa del virus al inicio, por ejemplo mediante PCR.
Un tema a tener es cuenta es que es probable que la profilaxis antirretroviral posterior a la exposición dificulte la detección directa del virus y potencialmente podría retardar la seroconversión. El incremento gradual de serorreactividad durante la seroconversión puede utilizarse para el diagnóstico: Las estrategias de prueba "desensitised" o "detuned" pueden usarse para medir la incidencia del HIV (es decir, la tasa de infecciones nuevas; en contraste con las pruebas habituales de anticuerpos que miden la prevalencia del HIV, es decir, las infecciones establecidas): Mediante la combinación intencional de pruebas de anticuerpos de alta sensibilidad y de baja sensibilidad, es posible calcular la proporción de muestras positivas que son de infección reciente (5).
Algoritmo diagnóstico de infección por HIV en niños Menores de 13 años (6).
NIÑO INFECTADO:
A) NIÑO < DE 18 MESES DE EDAD, HIV+ O NACIDO DE MADRE INFECTADA QUE PRESENTA:
• resultados positivos en dos determinaciones separadas (excluyendo sangre de cordón) de uno o más de los siguientes tests para detección de HIV: cultivo viral, PCR (reacción en cadena de polimerasa), antígeno p24
• o, que cumple criterios para el diagnóstico de SIDA basados en la definición de caso de 1987 (5)
B) NIÑO DE 18 MESES O MÁS, NACIDO DE MADRE HIV+, O CUALQUIER NIÑO INFECTADO POR SANGRE O DERIVADOS U OTROS MODOS CONOCIDOS DE TRANSMISIÓN (POR EJEMPLO, CONTACTO SEXUAL):
• que tiene Anticuerpos por test de Elisa repetidamente positivos y test confirmatorio (Western Blot o Inmunofluorescencia)
• o, cumple cualquiera de los criterios del punto A).
NIÑO EXPUESTO EN FORMA PERINATAL (“E”).
Niño que no cumple los criterios anteriores, pero:
• es HIV+ por Elisa y Western Blot y tiene < de 18 meses de edad en el momento del test,
• o, no se conoce su estado serológico, pero es hijo de madre HIV positiva.
NIÑO NEGATIVIZADO SEROLÓGICAMENTE (SR)
Niño nacido de madre HIV positiva que:
• es HIV negativo en 2 ó más tests de Elisa efectuados entre los 6 y 18 meses de edad, o con un test de Elisa negativo después de los 18 meses de edad
y
• no tiene otra evidencia de laboratorio de infección (tests de detección viral negativos)
y
• no cumple con los criterios clínicos para la definición de SIDA.
ENFERMEDADES MARCADORAS DE SIDA: CDC 1987.
- Candidiasis esofágica, *
- Candidiasis traqueal, bronquial o pulmonar *
- Criptococosis extrapulmonar *
- Criptosporidiasis intestinal crónica *
- Enfermedad por Citomegalovirus, de inicio posterior al mes de vida (excepto si compromete hígado, bazo y ganglios) *
- Retinitis por Citomegalovirus (con pérdida visual) *
- Ulcera por Herpes simplex, crónica (más de un mes de duración), o neumonitis o esofagitis, con inicio posterior al mes de vida *
- Sarcoma de Kaposi *
- Linfoma encefálico primario *
- Complejo Mycobacterium avium o kansasii, diseminada o extrapulmonar *
- Mycobacterium tuberculosis diseminada o extrapulmonar
- Leucoencefalopatía multifocal progresiva
- Toxoplasmosis encefálica en niños mayores de 1 mes de edad *
- Neumonía por Pneumocystis carinii *
- Coccidioidomicosis, diseminada o extrapulmonar ©
- Encefalopatía por HIV ©
- Histoplasmosis diseminada o extrapulmonar ©
- Isosporiasis intestinal crónica (de más de 1 mes de duración) ©
- Linfoma de Burkitt o sarcoma inmunoblástico ©
- Infecciones bacterianas múltiples o recidivantes ©
- Síndrome de caquexia causado por el HIV ©
* Si la enfermedad marcadora se diagnostica definitivamente (por ej. biopsia o cultivo), y no existen otras causas de inmunodeficiencias, no se requiere documentación de la infección por HIV en el laboratorio.
Se acepta el diagnóstico presuntivo de la enfermedad indicadora si existe evidencia de HIV en el laboratorio.
© Requiere evidencia de infección por HIV en el laboratorio.
Madre HIV +. Factores de riesgo. Signos – síntomas compatibles.
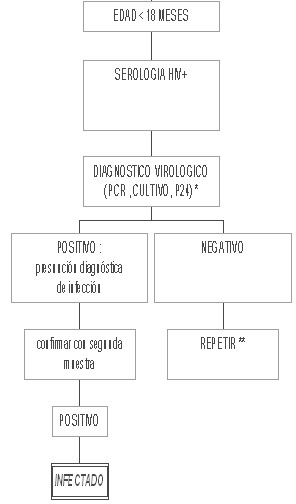
* No utilizar sangre de cordón umbilical
** En niños con tests virológicos negativos al nacimiento deben ser retesteados a la edad de 1-2 meses y 4-6 meses.
- Para la realización en los niños de los tests serológicos, se deberá solicitar a los padres el consentimiento informado por escrito (ley 23.798).
PREVENCIÓN DE LA TRANSMISIÓN VERTICAL EN LA MUJER EMBARAZADA VIH POSITIVA
Antes de iniciar el tratamiento informar a la paciente en forma clara y sencilla, sobre:
• La probabilidad de transmisión del VIH a la descendencia,
• La eficacia obtenida a partir de la administración de antirretrovirales,
• Y los efectos, aún en estudio, del tratamiento.
Es importante, al finalizar la entrevista, consignar en la historia clínica tanto la aceptación como la negativa.
El tratamiento a instituir, en aquellas mujeres sin tratamiento previo, podrá comenzar en cualquier momento del embarazo posterior a las 14 semanas, incluso en el trabajo de parto. El esquema más ampliamente utilizado es el protocolo ACTG 076. La dosis de AZT a utilizar durante el embarazo será de 600 mg/día (300 mg c/12 h), administrada por vía oral hasta el momento del parto. El mismo requiere un control hematológico mensual. En caso de descenso de la hemoglobina por debajo de 7,5 mg/dl y/o descenso plaquetario por debajo de 50.000 /mm3, el tratamiento deberá reevaluarse.
Al iniciarse el trabajo de parto, o en la inducción de la anestesia en el caso de una intervención quirúrgica, tanto en el caso de haber seguido el esquema con Zidovudina (AZT) como cualquier otro esquema antirretroviral, o sin tratamiento previo, se administrará Zidovudina (AZT) endovenoso. La dosis será de 2 mg/Kg. peso en la primera hora como dosis de ataque y de 1 mg/Kg/h. en las horas subsiguientes como dosis de mantenimiento hasta finalizar el parto. Las necesidades son aproximadamente 4 frascos/ampollas de Zidovudina (AZT) por parto. Si no estuviera disponible Zidovudina (AZT) en ampollas, podrá utilizarse la vía oral: 600 mg al comienzo del trabajo de parto, seguido de 300 mg. oral c/3 hs. antes del parto y luego suspender.
PROFILAXIS DE LA TRANSMISIÓN PERINATAL DEL VIH CON ZIDOVUDINA PROTOCOLO ACTG 076 (7)
ADMINISTRACIÓN DURANTE EL EMBARAZO (PRIMER COMPONENTE)
Iniciar Zidovudina (AZT) a partir de la semana 14 de gestación y continuar hasta iniciado el trabajo de parto.
Cápsulas de 100 mg.: 300 mg. c/12 horas
ADMINISTRACIÓN DURANTE EL TRABAJO DE PARTO (SEGUNDO COMPONENTE)
Iniciar Zidovudina (AZT) endovenoso con el trabajo de parto.
Dosis de carga de 2 mg/kg, diluida en dextrosa 5%. Infundir en una hora.
Dosis de mantenimiento: 1 mg/kg/hora hasta el parto.
Las ampollas son de 200 mg, por lo que pueden requerirse 4 ó 5 ampollas.
ADMINISTRACIÓN AL NEONATO (TERCER COMPONENTE)
Iniciar entre las 8 y 12 horas postparto, Zidovudina (AZT) oral en jarabe, 2 mg/kg. Cada 6 horas durante 6 semanas. Para aquellos que no toleran la vía oral, debe administrarse 1,5 mg/kg, vía intravenosa, cada 6 horas.
La vía del parto debe ser elegida de acuerdo a las condiciones obstétricas de la paciente y de la carga viral que presente en ese momento. Es importante, por lo tanto, la solicitud de la carga viral a las mujeres embarazadas VIH positivas en las semanas previas al parto, en la medida de lo posible, dado que en estos casos, se deben tomar decisiones que implican diferentes alternativas terapéuticas.
Debe considerarse que:
La cesárea de emergencia es aquella que se realiza por una indicación obstétrica. No tiene ningún efecto protector, por el contrario incrementa la transmisión vertical del VIH. La cesárea electiva es aquella que se realiza sin trabajo de parto y con bolsa íntegra:
• Cuando la carga viral de la paciente es inferior a las 1000 copias, no está indicada ya que no aporta ningún beneficio en lo que a la transmisión del VIH se refiere.
• Cuando la carga viral es superior a 1000 copias o la misma no ha sido realizada, es de elección programar la cesárea para la semana 38.
La cesárea electiva, en mujeres embarazadas no infectadas por el VIH, tiene por lo menos 2 veces más complicaciones que el parto normal. Tomando en cuenta las indicaciones obstétricas, el estado de la paciente, la carga viral y los riesgos del procedimiento, se deberá decidir la conducta a seguir. Las cesáreas electivas siempre deben ser realizadas en condiciones sanitarias adecuadas a fin de reducir significativamente los riesgos de morbimortalidad materna y perinatal.
Los equipos de atención deberán coordinar la referencia para el parto en acuerdo con los equipos de las maternidades, estableciendo previamente los mecanismos relacionados con la admisión de la mujer. Las madres que reciben sólo Zidovudina (AZT) para la prevención de la transmisión vertical no deben continuar con esta medicación en el post parto y deben ser derivadas a un centro de referencia de atención del VIH/SIDA de su zona para evaluación y seguimiento. Si la embarazada recibía tratamiento antirretroviral previo al embarazo, deberá continuarlo de acuerdo a las indicaciones de su médico tratante.
Lactancia materna: deberá recomendarse evitar la lactancia materna y proponer la inhibición de la misma, asegurando al recién nacido alternativas alimentarias adecuadas (leche maternizada).
ESCENARIOS POSIBLES
Hay recomendaciones generales que están avaladas por estudios controlados y/o por seguimientos a mediano plazo. Sin embargo no está definida aún la mejor estrategia para cada situación en particular.
CONSIDERACIONES GENERALES
1. la posibilidad de transmisión vertical, según la historia natural de la infección, es del 35%.
2. entre los factores que influyen en la transmisión vertical se destacan la magnitud de la carga viral y la situación inmunológica y clínica de la mujer, aspectos relacionados con el virus, patología placentaria, modalidad del parto, uso de profilaxis con tratamiento antirretroviral antes, durante y después del parto, entre otras.
3. todas las acciones a proponer, se harán dentro del marco del consejo pre y postest.
4. debe desaconsejarse la lactancia materna para todo hijo de madre VIH positiva.
5. los efectos adversos de las drogas antirretrovirales sobre el feto, especialmente a largo plazo, no han sido aún completamente establecidos.
6. no se conoce el umbral de carga viral por debajo del cual la transmisión vertical no se produce aunque niveles de carga viral < 1000 copias se relacionan con muy bajas tasas de transmisión.
ESCENARIO 1 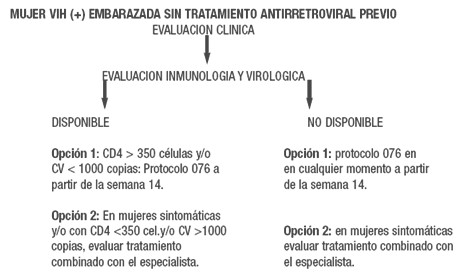
Cualquiera de los tratamientos elegidos deben comenzarse después de la semana 14 de embarazo; si no es posible deben administrarse durante el parto o, luego del mismo, al recién nacido.
No deben usarse Efavirenz, DDC (Zalcitavine) ni Hidroxiurea. No existe hasta el momento evidencia acerca de la seguridad en el uso de Abacavir, Amprenavir y Lopinavir/Ritonavir en embarazadas.
ESCENARIO 2
MUJER VIH+ EN TRATAMIENTO ANTIRRETROVIRAL EN EL MOMENTO DEL DIAGNOSTICO DE EMBARAZO
• Si el embarazo es reconocido durante el primer trimestre, evaluar con la paciente potenciales riesgos y beneficios de continuar la terapéutica. Si se decide suspender, debe hacerse con todas las drogas en forma simultánea y completa. Lo mismo si se decide reintroducirla.
• En el embarazo reconocido después del primer trimestre, continuar con el tratamiento antirretroviral, informando sobre riesgos y beneficios.
• Tratar de que Zidovudina (AZT) forme parte del esquema utilizado.
ESCENARIO 3
MUJER VIH+ EN TRABAJO DE PARTO SIN TRATAMIENTO ANTIRRETROVIRAL PREVIO
Las siguientes opciones están validadas por ensayos clínicos aleatorizados.
• Opción 1: Ofrecer segundo y tercer componente del 076: Zidovudina (AZT) endovenosa 2 mg/Kg. peso en la primer hora como dosis de ataque y 1 mg/Kg/hora en las horas subsiguientes como dosis de mantenimiento hasta finalizar el parto. Si no estuviera disponible la medicación endovenosa, puede utilizarse vía oral Zidovudina (AZT) 600 mg. al comienzo y 300 mg. cada 3 horas.
En el recién nacido, comenzar Zidovudina (AZT), 2mg/Kg/dosis cada 6 hs. vía oral ó 1,5 mg/Kg/ dosis EV cada 6 hs. (en prematuros 1,5 mg./Kg/dosis) dentro de las 6 a 12 hs. de vida.
• Opción 2: Dosis única de Nevirapina en el comienzo del trabajo de parto: 200 mg. (1 comprimido) y dosis única de Nevirapina: 2 mg/Kg entre las 48 y 72 horas al recién nacido. Si el parto tuvo una duración mayor de 1 hora, administrar 2 mg/Kg al recién nacido tan pronto como sea posible y otra dosis entre las 48-72 horas.
• Opción 3: Zidovudina (AZT) 600 mg. oral al comienzo del trabajo de parto, seguido de 300 mg. cada 3 horas antes del parto más 3TC 150 mg. oral al comienzo del trabajo de parto, seguido de 150 mg. oral cada 12 horas antes del parto.
En el recién nacido: Zidovudina (AZT) 4 mg/Kg oral cada 12 horas y 3TC 2 mg/Kg cada 12 horas durante 7 días.
Toda la medicación debe suspenderse después del parto y reevaluarse a la paciente para el futuro seguimiento.
ESCENARIO 4
RECIÉN NACIDO DE MUJER VIH+ QUE NO RECIBIÓ TRATAMIENTO ANTIRRETROVIRAL PREVIO
• Realizar tercer componente del 076: comenzar Zidovudina (AZT) 2 mg/Kg/dosis cada 6 horas vía oral ó 1,5 mg/Kg/dosis endovenosos cada 6 horas (en prematuros 1,5 mg/Kg/dosis) dentro de las 6 a 12 horas de vida y durante 6 semanas. No se ha demostrado efectividad si Zidovudina (AZT) se inicia luego de las 48 horas de producirse el nacimiento.
• Estudio precoz del recién nacido para el diagnóstico de infección
• Derivación de la madre al especialista para su evaluación, seguimiento y eventual tratamiento.
TRANSMISIÓN VERTICAL Y MODO DE PARTO (8)
ESCENARIO A
MUJER CON TEST POSITIVO PARA VIH QUE LLEGA DESPUÉS DE LA SEMANA 36 SIN TRATAMIENTO ANTIRRETROVIRAL NI DATOS DE LABORATORIO DISPONIBLES
1. Recomendar tratamiento antirretroviral de acuerdo al protocolo 076.
2. Ofrecer cesárea electiva a las 38 semanas.
Al iniciarse el trabajo de parto, o en la inducción de la anestesia en el caso de una intervención quirúrgica, se efectuará Zidovudina (AZT) endovenoso. La dosis será de 2 mg/Kg. peso en la primera hora como dosis de ataque y de 1 mg/Kg/h. en las horas subsiguientes como dosis de mantenimiento hasta finalizar el parto. Las necesidades son aproximadamente 4 frascos/ampollas de Zidovudina (AZT) por parto. Si no estuviera disponible el Zidovudina (AZT) en ampollas, podrá utilizarse la vía oral: 600 mg. Al comienzo del trabajo de parto, seguido de 300 mg. oral c/3 hs. antes del parto y luego suspender. Administrar al recién nacido Zidovudina (AZT) jarabe 2 mg/Kg cada 6 horas, a partir de las 6 a 12 horas de vida, durante 6 semanas.
Recomendar evitar la lactancia materna y asegurar al recién nacido alternativas alimentarias adecuadas (leche maternizada).
3. Suspender tratamiento antirretroviral a la madre postparto, esperar resultados y reevaluar con el equipo especializado en VIH conductas futuras.
ESCENARIO B
MUJER VIH + QUE REALIZA TRATAMIENTO ANTIRRETROVIRAL DE ALTA EFICACIA, PERO CON CARGA VIRAL > 1000 COPIAS EN SEMANA 36
1. Continuar con el tratamiento antirretroviral
2. Proponer cesárea electiva para reducir riesgos. Si acepta, programarla para la semana 38.
3. Ofrecer Zidovudina (AZT) al iniciarse el trabajo de parto, o en la inducción de la anestesia en el caso de una intervención quirúrgica, se administrará Zidovudina (AZT) endovenosa. La dosis será de 2 mg/Kg peso en la primera hora como dosis de ataque y de 1 mg/Kg/h. en las horas subsiguientes como dosis de mantenimiento hasta finalizar el parto. Las necesidades son aproximadamente 4 frascos/ampollas de Zidovudina (AZT) por parto. Si no estuviera disponible el AZT en ampollas, podrá utilizarse la vía oral: 600 mg. al comienzo del trabajo de parto, seguido de 300 mg oral c/3 hs antes del parto y luego suspender.
Administrar al recién nacido Zidovudina (AZT) jarabe 2 mg./Kg cada 6 horas, a partir de las 6 a 12 horas de vida, durante 6 semanas
4. Recomendar evitar la lactancia materna y asegurar al recién nacido alternativas alimentarias adecuadas (leche maternizada).
5. Reevaluar el tratamiento antirretroviral de la madre en el postparto y decidir con el equipo especializado en VIH conducta a seguir en el futuro.
ESCENARIO C
MUJER CON TRATAMIENTO ANTIRRETROVIRAL DE ALTA EFICACIA CON CARGA VIRAL < 1000 copias o NO DETECTABLE EN SEMANA 36
1. Proponer parto vaginal si las condiciones obstétricas lo permiten.
2. Continuar con el mismo esquema antirretroviral y proponer segundo y tercer componente del protocolo 076: al iniciarse el trabajo de parto, o en la inducción de la anestesia en el caso de una intervención quirúrgica, se administrará Zidovudina (AZT) endovenoso. La dosis será de 2 mg/Kg peso en la primera hora como dosis de ataque y de 1 mg/Kg/hs en las horas subsiguientes como dosis de mantenimiento hasta finalizar el parto. Las necesidades son aproximadamente 4 frascos/ampollas de Zidovudina (AZT) por parto. Si no estuviera disponible Zidovudina (AZT) en ampollas, podrá utilizarse la vía oral: 600 mg Al comienzo del trabajo de parto, seguido de 300 mg oral c/3 hs antes del parto y luego suspender. Administrar al recién nacido Zidovudina (AZT) jarabe 2 mg/Kg cada 6 horas, a partir de las 6 a 12 horas de vida, durante 6 semanas,
3. Recomendar evitar la lactancia materna y asegurar al recién nacido alternativas alimentarias adecuadas (leche maternizada).
4. Continuar el tratamiento antirretroviral a la madre en el postparto por su equipo tratante.
ESCENARIO D
MUJER VIH+ QUE ELIGIÓ CESÁREA PERO LLEGA CON TRABAJO DE PARTO TEMPRANO O POCO TIEMPO DESPUÉS DE LA RUPTURA PREMATURA DE MEMBRANAS
1. Iniciar segundo componente del protocolo 076: al iniciarse el trabajo de parto, o en la inducción de la anestesia en el caso de una intervención quirúrgica, se administrará Zidovudina (AZT) endovenoso. La dosis será de 2 mg/Kg peso en la primera hora como dosis de ataque y de 1 mg/Kg/h. en las horas subsiguientes como dosis de mantenimiento hasta finalizar el parto. Si no estuviera disponible Zidovudina (AZT) en ampollas, podrá utilizarse la vía oral: 600 mg al comienzo del trabajo de parto, seguido de 300 mg oral c/3 hs antes del parto y luego suspender.
2. Trabajo de parto en rápido progreso con ruptura prematura de membranas: conducir para parto vaginal tratando de que no pasen más de 4 horas de bolsa rota.
3. Trabajo de parto en lento progreso: realizar cesárea en el caso de mínima dilatación. Las necesidades son aproximadamente 4 frascos/ampollas de Zidovudina (AZT) por parto
4. Ofrecer tercer componente del protocolo 076 para el recién nacido: administrar al recién nacido Zidovudina (AZT) jarabe 2 mg/Kg cada 6 horas, a partir de las 6 a 12 horas de vida, durante 6 semanas.
5. Recomendar evitar la lactancia materna y asegurar al recién nacido alternativas alimentarias adecuadas (leche maternizada).
RECOMENDACIONES PARA EL RECIÉN NACIDO HIJO DE MADRE VIH POSITIVA (9)
La atención del parto y la recepción del RN, deben efectuarse con las medidas de bioseguridad habituales (técnicas de barrera). Es importante bañar meticulosamente al bebe para quitarle todos los restos de sangre y secreciones maternas. De ser necesarias maniobras de aspiración y resucitación no deben ser intempestivas, para evitar laceraciones que puedan ser puertas de entrada del virus. Aplicar la vacuna de hepatitis B y Vitamina K según norma, luego del baño del recién nacido. Si el niño tiene peso adecuado al nacer y es asintomático, se administrará la vacuna BCG.
La profilaxis antirretroviral se inicia entre las 8 y las 12 horas de vida con Zidovudina (AZT) jarabe, con una dosis de 2 mg/Kg/dosis cada 6 hs en recién nacidos de término o 1,5 mg/kg/dosis en prematuros. En aquellos que no pueda indicarse por vía oral, debe medicarse con 1,5 mg/kg/dosis cada 6 hs por vía endovenosa hasta que pueda utilizarse la vía oral.
Se solicitará un hemograma y un hepatograma, al nacer y cada 2 semanas mientras dure el tratamiento con Zidovudina (AZT). Este se suspenderá con hemoglobina menor a 8 mg./dl, neutrófilos totales menores a 750 por ml o plaquetas menores a 50.000 por ml.
Si se utiliza nevirapina deberá administrarse al recién nacido una dosis de 2 mg/kg dentro de las 48/72 horas de producirse el nacimiento.
AL NACER
• Evitar maniobras intempestivas.
• Baño meticuloso
• Examen clínico completo
• Vacuna hepatitis B y vitamina K
• Evaluar exposición a drogas e infecciones intrauterinas
• Comenzar con Zidovudina (AZT), 2mg/Kg/dosis cada 6 horas vía oral ó 1,5 mg/Kg/ dosis EV cada 6 horas (en prematuros 1,5 mg./Kg/dosis) dentro de las 6 a 12 horas de vida.
• Ofrecer alternativas adecuadas a la lactancia materna.
0 A 6 SEMANAS
• Evaluación clínica y signos de infección
• Hemograma quincenal
• Inmunizar con BCG si el recién nacido está asintomático
• Evaluación de diagnóstico de infección por VIH
• Evaluación conjunta con un centro especializado
A PARTIR DE LA 7ª SEMANA
• Suspender Zidovudina (AZT)
• Iniciar Profilaxis para Pn Carinii: 150 mg Trimetoprima/750 mg. sulfametoxazol/m2/día cada 12 horas, 3 veces por semana o a diario si el diagnóstico es aún incierto
RIESGOS POTENCIALES DE LOS MEDICAMENTOS ANTIRRETROVIRALES
El potencial daño al feto a partir de la administración a la madre de una droga depende no sólo de la droga en sí misma, sino de la dosis, de la edad de la gestación, de la duración de la exposición, de la interacción con otros agentes a los cuales el feto está expuesto y al factor incierto o desconocido genético y materno-fetal. Existen pocos datos relacionados al pasaje placentario y el riesgo de las drogas antirretrovirales aprobadas por la FDA.
Evidencia de la eficacia de las drogas antirretrovirales aplicables al uso durante el embarazo
1.- Inhibidores nucleósidos de la transcriptasa inversa: Zidovudina (AZT) y Lamivudina (3TC) han sido evaluadas en la mujer embarazada.
a.- Zidovudina (AZT):
Distintos estudios efectuados a partir de 1991 demostraron que el uso de la Zidovudina en pacientes embarazadas podía reducir el riesgo de transmisión vertical. Zidovudina (AZT) es bien tolerada por la mujer embarazada en dosis iguales a las dosis utilizadas en adultos. La dosis estudiada es de 500 mg por día, vía oral. Sin embargo la dosis estándar para adultos de 200 mg tres veces al día o 300 mg dos veces al día, podría ser igualmente usada en el embarazo. Datos de distintos estudios indican que Zidovudina (AZT) también es efectiva en mujeres con enfermedad avanzada, baja cifra de CD4 y terapia previa con Zidovudina (AZT). En el neonato la dosis es de 2 mg/kg., vía oral, cada 6 hs, durante las primeras seis semanas. Dicha recomendación surge de estudios farmacocinéticos realizados con niños nacidos a término. Zidovudina (AZT) se metaboliza en el hígado. El sistema metabólico hepático es inmaduro en los neonatos, produciendo una vida media más prolongada. Debido a que los neonatos prematuros tienen una mayor inmadurez metabólica hepática que los recién nacidos a término, puede esperarse una prolongación en el aclaramiento de la droga.
b.- Lamivudina (3TC):
Existe escasa experiencia. Sin embargo, la seguridad de su utilización sola o combinada con AZT ha sido evaluada después de la administración a las 38 semanas de gestación, durante el parto y a los niños en la primera semana. El 3TC atraviesa la placenta, la concentración en el plasma materno, cordón umbilical y en el neonato es la misma. No fueron observados efectos adversos a corto plazo en neonatos. No hay datos de farmacocinética en niños de dos a seis semanas de vida y la edad exacta en que el aclaramiento de 3TC se aproxima al de los niños mayores es desconocida. Basado en estos datos limitados 3TC está siendo evaluado en un estudio de prevención de fase perinatal III en Africa y en combinación con Zidovudina (AZT) T y otras drogas en varios estudios de fase I en Estados Unidos de América.
c.- Didanosina (ddI):
El pasaje placentario es escaso. Los estudios son limitados.
d.- Zalcitabina (ddC):
Altas dosis en los roedores han sido asociadas con el desarrollo de linfomas del timo.
e.- Estavudina (d4T):
Los estudios no se completaron.
2.- Inhibidores de la proteasa:
No hay datos del pasaje de estas drogas, a través de la placenta, de la madre al feto en el humano.
En la XII Conferencia Internacional de SIDA (Ginebra, 1998) se presentaron datos de una experiencia limitada en la que se evaluaron 37 pacientes embarazadas que recibieron tratamiento combinado. La combinación más utilizada fue AZT + 3TC + Indinavir. En un tercio de los recién nacidos se observó prematurez, en dos niños se constató hemorragia cerebral y atresia de vías biliares extrahepáticas en un niño.
Sobre la base de estos datos, no obstante que la experiencia es muy limitada, se ha hecho un llamado a la cautela en la utilización de inhibidores de proteasa en el embarazo, fuera de la situación en que la mujer embarazada requiera tratamientos potentes por su situación clínica, inmunológica o virológica, en cuyo caso deberá valorarse, junto con ella los riesgos y los beneficios para ella y el feto.
3.- Inhibidores no nucleósidos de la transcriptasa inversa:
Nevirapina, Delavirdina y Efavirenz han sido aprobadas por el ANMAT (Administración Nacional de Medicamentos, Alimentos y Tecnología Médica).
a.- Nevirapina:
La Nevirapina atraviesa la placenta y se encuentra en sangre del neonato a concentraciones iguales a las plasmáticas de la madre. No se observaron efectos adversos a corto plazo ni en la madre ni en el niño. Nevirapina dada en dosis única a la madre en el momento del comienzo del trabajo de parto y al neonato en dosis también única a los dos o tres días (2 mg/kg) sería suficiente para mantener los niveles de actividad antirretroviral la primera semana de vida. En este estudio, realizado por Uganda y NIAID de EE.UU., se comparó la administración de Nevirapina en dosis única al comienzo de trabajo de parto y al recién nacido, con la administración de Zidovudina (AZT) (600 mg al comienzo del trabajo de parto y 300 mg cada 3 hs. durante el mismo y al RN se la administro la droga a 4mg / kg durante la primer semana de vida) obteniéndose mejores resultados con Nevirapina (un 47% de la reducción de la transmisión del VIH comparándola con la de Zidovudina (AZT)). Se desconoce la seguridad y la farmacocinética en tratamientos prolongados antes de las 38 semanas y aún se está realizando el seguimiento a largo plazo de las madres y de los RN para evaluar la toxicidad tardía de la droga y la sobreviva de los que la recibieron.
b.- Efavirenz:
No existen estudios adecuados ni bien controlados en mujeres embarazadas.
• No existen estudios de carcinogénesis a largo plazo con ninguna de las tres drogas.
• Las tres disminuyen la fertilidad en los roedores y con altas dosis tienen efectos teratogénicos en animales.
Conclusiones
El objetivo de esta revisión bibliográfica es conocer las distintas terapias disponibles para prevenir y reducir la transmisión del VIH de la madre al hijo basándose en los recientes avances en esa área del conocimiento científico y en la factibilidad de su implementación en el país.
La posibilidad de transmisión vertical, según la historia natural de la infección, es del 35%. Los factores que influyen en la transmisión son la carga viral y la situación inmunológica y clínica de la mujer, aspectos relacionados con el virus, patología placentaria, modalidad del parto, uso de profilaxis con tratamiento antirretroviral antes, durante y después del parto, entre otras. Cualquiera de los tratamientos elegidos debe comenzarse después de la semana 14 de embarazo.
Las consideraciones relativas al asesoramiento de la embarazada positiva para VIH en cuanto al riesgo de transmisión perinatal y el cuidado obstétrico incluyen los siguientes puntos:
• Lograr el mejor estado de salud posible en la embarazada mediante el uso de terapias antirretrovirales combinadas. Como mínimo, utilizar zidovudina para reducir la transmisión perinatal, a menos que la paciente no la tolere.
• El tratamiento a instituir, en aquellas mujeres sin tratamiento previo, podrá comenzar en cualquier momento del embarazo posterior a las 14 semanas, incluso en el trabajo de parto. El esquema más ampliamente utilizado es el protocolo ACTG 076
• Hay que realizar el monitoreo periódico de los niveles plasmáticos de carga viral, con el conocimiento de sus valores al momento del parto para elegir el modo en que éste se realizará.
• Si la carga viral es desconocida en el momento del parto, se realizará cesárea electiva y se dará zidovudina para disminuir la transmisión.
• A las pacientes cuya carga viral sea mayor a 1.000 copias/mL se les ofrecerá la realización de cesárea abdominal electiva.
• En aquellas que tengan carga viral por debajo de 1.000 copias/mL, la cesárea electiva ha demostrado no ser de beneficio adicional, por lo que se realizará parto vaginal si las condiciones obstétricas lo permiten.
• El manejo de las pacientes que presentarán trabajo de parto prolongado con ruptura prematura de membranas ovulares deberá individualizarse según el caso, clínica, ARN VIH circulante y terapias recibidas. No está claro que la cesárea disminuya el riesgo de transmisión. Si han pasado más de 4 h de bolsa rota, es habitual la elección de cesárea abdominal. Se le explicará a la pareja los riesgos y beneficios en el caso de la realización de la cesárea abdominal.
• Se respetará la opinión de la paciente y ella debe dar su consentimiento sobre el modo de parto, que se llevará a cabo una vez informada de manera adecuada.
La lactancia materna exclusiva se asoció con un mayor riesgo de transmisión vertical del VIH-1, un 14% en el caso de las mujeres con enfermedad y en un 29% entre las que contraen el VIH durante la lactancia. El riesgo de infección por esta vía se incrementa con el tiempo de duración del amamantamiento y la alternativa de la lactancia mixta no reduce este riesgo. No se recomienda amamantar en las mujeres positivas para VIH. Actualmente, la droga de elección para inhibir la lactancia es la cabergolina, por la menor frecuencia de eventos adversos y menor dosis necesaria.
Antes de iniciar el tratamiento siempre es importante informar a la paciente sobre los riesgos y beneficios de cada una de las opciones terapéuticas.
Resumen.
El modo dominante de adquisición de la infección por VIH en los niños es la transmisión vertical. Con el fin de realizar una revisión bibliográfica sobre la prevención de la misma y sobre las distintas terapias antirretrovirales y vías del parto se consultaron libros de texto, revistas científicas y archivos publicados en la red Medline y PubMed en los últimos 5 años.
Se presentaron los datos epidemiológicos, el número de casos de infección por HIV en el mundo y la situación en Argentina.
En pediatría hay que diferenciar la infección intrauterina de la perinatal ya que el pronóstico y la sobrevida son diferentes. Luego, hay que clasificar a los niños infectados de acuerdo a las categorías clínicas del CDC.
El diagnóstico de la infección depende de la edad del paciente. En los mayores de 18 meses los métodos serológicos permiten realizar el diagnóstico, pero en el menor de 18 meses éstos no son útiles ya que pueden dar positivo al detectar la presencia de anticuerpos maternos. Se realizó un algoritmo diagnóstico de infección por HIV en menores de 13 años planteando las distintas posibilidades clínicas. La prevención de la transmisión vertical puede realizarse siguiendo distintos protocolos, el más utilizado es el ACTG 076. Se describen los distintos componentes del mismo así como los diferentes escenarios posibles y el modo del parto de acuerdo a los antecedentes.
Por último se describen las recomendaciones para el recién nacido hijo de madre HIV positiva y los riesgos potenciales de los medicamentos utilizados.
Tabla 1. Categorías inmunológicas basadas en el recuento absoluto y el porcentaje de linfocitos CD 4.
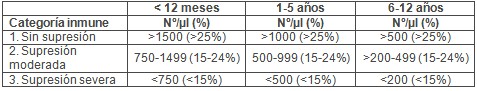
En base a la combinación de las categorías previas surge la clasificación definitiva de los niños infectados por el VIH (tabla 2).
Tabla 2. Clasificación de la infección por el VIH en niños que incluye la categoría clínica e inmunológica de los pacientes.
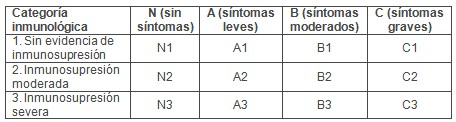
Tabla 3. Sensibilidad de los métodos diagnósticos directos de VIH en pediatría
Bibliografía
1. Curso de educación a distancia. Infectología Pediátrica. FUNCEI; Módulo 5:19.
2. Hugo R. Paganini. Tratamiento Antimicrobiano de las Infecciones en Pediatría. 1era ed. Buenos Aires:Editorial Científica Interamericana, 2005;150-151.
3. http://www. hivmedicine. com/textbook_es.htm
4. World Health Organization (WHO), Department of Essential Health Technologies: http://www.who. int/bct/ Main_ areas _of_work/ BTS/ HIV _Diagnostics/ HIV _Diagnostics.htm
5. Parekh 2001; Constantine y cols 2003. Centers for Disease Control and Prevention (CDC), USA, Division of HIV/AIDS Prevention: http://www. cdc. gov/ hiv/ testing.htm, http://www. cdc.gov/ hiv/ rapid_testing/
6. Vera Girando, Graciela Barboni, Claudio Cantisano, Marcela Candi. Criterios de Diagnóstico y Tratamiento en Pediatría. Hospital General de Niños Dr. Pedro de Elizalde. Hiv, seguimiento de pacientes pediátricos con serología positiva. 1era ed. Bueno Aires: Journal, 2006; 249-282.
7. Recomendaciones para la prevención de la transmisión perinatal del HIV. Ministerio de Salud de la Nación, 2001.
8. Recomendations for use of antiretroviral drugs in pregnant HIV-1 infected women for maternal health and interventions to reduce perinatal HIV-1 transmission in the United Status, July 2006.
9. Alejandro Hakim, Marcelo Losso, et al. Prevention of mother to child HIV trnsmission. Medicina (Buenos Aires) 2006; 66:24-30.