Se explora la relación existente entre ausencia de remisión de depresión tardía tratada con antidepresivos y alteraciones de la conexión córtico-estriado-límbica explorada mediante anisotropía fraccional de sustancia blanca. Método: se seleccionaron 20 pacientes con depresión mayor tardía según criterios diagnósticos de DSM IV no dementes. Se evaluaron en línea basal con escala de depresión geriátrica de Yesavage y evaluación de función ejecutiva con WCST. Después de un periodo de wash-out de 2 semanas se administro a los pacientes que tenían un puntaje en Escala de Yesavage >14 una dosis de 100 mg de sertralina diaria durante 24 semanas.
Depresión refractaria y alteración vías fronto-límbicas
Daniel Serrani
Rosario. Santa Fe. Argentina.
Objetivo:
Se explora la relación existente entre ausencia de remisión de depresión tardía tratada con antidepresivos y alteraciones de la conexión córtico-estriado-límbica explorada mediante anisotropía fraccional de sustancia blanca. Método: se seleccionaron 20 pacientes con depresión mayor tardía según criterios diagnósticos de DSM IV no dementes. Se evaluaron en línea basal con escala de depresión geriátrica de Yesavage y evaluación de función ejecutiva con WCST. Después de un periodo de wash-out de 2 semanas se administro a los pacientes que tenían un puntaje en Escala de Yesavage >14 una dosis de 100 mg de sertralina diaria durante 24 semanas.
Se definió la remisión como un puntaje de Yesavage < de 10 durante 2 semanas consecutivas. Las imágenes de Tensor por difusión se obtuvieron con scanner de 1.5 Tesla, y se llevo a cabo un análisis basado en voxels de la anisotropía fraccional usando la edad como covarianza. Resultados: los pacientes con ausencia de remisión (N=9) tenían menor anisotropía fraccional en áreas de lóbulo frontal y límbico, en particular en cingulado anterior y posterior así como en córtex pre-frontal dorso-lateral, rodilla de cuerpo calloso, para-hipocampo y sustancia blanca insular comparados con los que alcanzaron remisión (N=11). También se detecto anisotropía fraccional en cerebro medio y áreas de lóbulo parietal y temporal. Conclusiones: anisotropía fraccional reducida se distribuye en redes cerebrales y se asocia con menor respuesta a tratamiento antidepresivo en depresión tarida representando un marcador somático de predisposición y mal pronóstico de este tipo de depresión.
La depresión tardía constituye una enfermedad muy frecuente en la población de adultos mayores y representa un desafío para el tratamiento. En parte por una alta tasa de recaídas y en parte también por la pobre respuesta al tratamiento con una tasa tres veces mayor de recaídas en comparación con los otros tipos de depresión, quedando en ocasiones con síntomas residuales a pesar de las respuestas parciales (1). Incluso si remiten presentan a menudo déficits en la calidad de vida (2). Las alteraciones presente en el cerebro senescente pueden ser e parte responsable de este pronóstico sombrío en la depresión tarida impidiendo la regulación emocional subyacente a la depresión. En parte los estudios de neuroimágenes sugieren que la depresión se asocia con metabolismo aumentado en regiones límbicas, en la amígdala y cíngulo pre y subgenual en la corteza orbito-frontal posterior y en cíngulo anterior y medio. La corteza dorso-lateral, cíngulo posterior y caudado tienen disminución de flujo en la depresión (3, 4). Hay una disminución de la activación de cíngulo dorsal anterior e hipocampo en depresivos adultos mayores en tareas de activación lexical (5). Dado que existen conexiones entre estructuras límbicas y frontales con estructuras para-límbicas y estriatales, se han intentado terapias de control de depresión de tipo (6) “top down” intentando influir mediante la corteza sobre las estructuras subcorticales (7), junto con terapias farmacológicas, que tienen efectos “bottom-up”, ya que actúan en rafe dorsal y locus ceruleus (8). La hipótesis subyacente es que la alteración de las conexiones reciprocas entre estriado ventral y corteza dorso-lateral pueden intervenir de manera crítica en la génesis de la depresión (3, 4). En particular las conexiones de sustancia blanca entre las estructuras límbicas y corticales dorsales pueden interferir en el balance límbico cortical y prolongar la depresión.
Las imágenes de difusión por tensor ofrecen información acerca de la integridad de la sustancia blanca en relación con la remisión de la depresión mediante la detección de la difusión de agua en los tejidos cerebrales, mediante la fórmula de que cuando no existe barrera a la difusión esta es igual en todas las direcciones (isotropía) y cuando hay barreras la difusión sigue los ejes de esas barreras (anisotropía), el grado de la misma depende de la integridad estructural de membranas y fibras axonales. La anisotropía fraccional es una medida de esos cambios (9). La idea principal es que las alteraciones micro-estructurales de sustancia blanca pueden interferir la comunicación límbica y dorso-cortical perpetuando así la depresión impidiendo el rebalance de la modulación emocional en el anciano (10). Concordantemente la falta de remisión en la depresión tratada con antidepresivos puede ser un indicador más en el sentido de una alteración de las conexiones fronto-límbicas evidenciándose por anisotropía fraccional reducida en esas áreas.
Método
Sujetos
Se reclutaron mayores de 60 años de una muestra consecutiva de pacientes asistentes a servicio de consultorio externo que aceptaron participar del estudio mediante consentimiento informado y que cumplían con criterios del DSM-IV para depresión mayor sin rasgos psicóticos y alcanzaron un score de 14 o > en escala de depresión geriátrica de Yesavage (11) y que no evidenciaron alteraciones en función ejecutiva (tabla 2) ni demencia evaluada mediante Minimental de Folstein, constituyendo estos criterios de exclusión, junto con historia de consumo de sustancias, otros trastornos del eje I, enfermedades medicas concomitantes como hipotiroidismo, insuficiencia renal o cardiaca, hepática, stroke, diabetes, linfoma, tratamiento con esteroides o con medicamentos como alfa-metil-dopa, clonidina, reserpina, tamoxifeno o cimetidina; enfermedades neurológicas como demencia, esclerosis múltiple, delirio o Parkinson y con minimental >24.
Medidas
Se administro la escala de Yesavage a todos los pacientes participantes en el estudio así como la entrevista estructurada clínica para DSM IV, se evaluaron estado basal mediante el minimental y la WCST (12) para descartar disfunción ejecutiva y la capacidad funcional mediante la escala de calidad de vida de la OMS (13).
Tratamiento
Se efectuó un wash-out de dos semanas previo a comenzar el tratamiento con sertralina dosis 100 mg diarios durante 24 semanas. Durante un seguimiento mensual se evaluaron Yesavage y WCST, signos vitales y adherencia al tratamiento junto con evaluación de síntomas indeseables. Se evito la psicoterapia formal durante los encuentros aceptándose solo orientación de apoyo. La remisión se considero si el paciente tenía un valor de Yesavage <10 durante 2 semanas consecutivas o más.
MRI
Se obtuvieron los slides mediante equipo de 1.5T Siemens administrando a los pacientes un eco-planar de gradiente de adquisición rápida (EPGAR) con valores de TR=11.6 mseg, TE=4.9 mseg, matriz=256×256, campo de visión =320 mm, numero de excitaciones=1, grosor de corte =1.25 mm, 172 cortes, sin gap, junto con un scan ecospin turbodual (TES) de TR= 5000 mseg, TE=22/90 mseg, matriz=256×256, campo de visión =240 mm, grosor de corte=5 mm, 26 cortes, sin gap; y imágenes de difusión por tensor de TR=6000 mseg, TE=100 mseg, matriz=128×128, campo de visión =320 mm, número de excitaciones=7, grosor de corte =5 mm, 19 cortes, sin gap. Para obtener las imágenes de difusión por tensor su usaron 8 direcciones de sensibilización de difusión (b=1000 segundos/mm2), junto con imágenes sin peso de difusión (b= 0 segundos/mm2). El TES y los exámenes de difusión por tensor se adquirieron en un plano oblicuo axial paralelo al plano de la comisura anterior-comisura posterior. La anisotropía fraccional se computo mediante algoritmos no lineares (3dDWItoDT). Las imágenes de difusión por tensor se ubicaron dentro del espacio de Talairach. Se uso el último eco del scan TES para corregir la distorsión inducida por susceptibilidad.
El molde para T1-weighted usado para registro se derivo de un sujeto cuyo volumen intracraneal era el más cercano a la media de los primeros 5 sujetos mientras que los volúmenes fueron computados después de stripping de cráneo mediante software FMRIB para extracción de imágenes cerebrales (http://www.fmrib.ox.ac.uk/ analysis/research/bet/). Las imágenes fueron enmascaradas para sustancia blanca usando el computo del promedio del mapa de anisotropía fraccional de un grupo mayor de pacientes incluyendo los pacientes seleccionados para el estudio y realizando una segmentación no paramétrica de histograma. El umbral de sustancia blanca asi obtenido fue aplicado al mapa de anisotropía fraccional promedio, y la máscara resultante se aplico al mapa de anisotropía fraccional normalizado de cada sujeto.
El análisis basado en voxels de los datos de anisotropía fraccional con respecto a cada grupo de remitentes vs no remitentes se proceso mediante un modelo general linear con la edad como covarianza. Se ubican clusters de voxels contiguos (100 mm3) con diferencias significativas entre grupos (p<0.05) y se aplica un proceso de constricción mediante el cual se deduce que cada uno de los voxels en el cluster sea significativo a p<0.005. Los mapas se sobreimpusieron en una imagen de Talairach mediante una imagen de eco planar de gradiente de rápida adquisición.
Resultados
Los 20 sujetos seleccionados cumplieron los criterios y siguieron el periodo de wash-out de 2 semanas y con scores de Yesavage >14 (score: 14–17; media=16.1) después de este periodo; y continuaron con el tratamiento con setalina 100 mg/dia durante 24 semanas. Uno presento hiponatremia durante el tratamiento y fue tratado con corrección de sodemia sin necesidad de interrumpir el tratamiento antidepresivo, 3 presentaron vómitos y diarrea que tampoco requirió suspensión del tratamiento mejorando espontáneamente. No hubo diferencias significativas en edad o genero, educación, edad al comienzo de la depresión, número de episodios previos, severidad de la depresión o deterioro en línea de base entre los pacientes que remitieron y los no remitentes (Tabla 1).
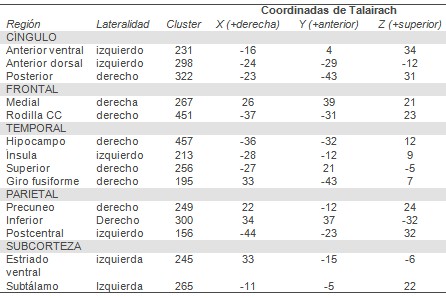
En el final de la prueba los remitentes tenían menores puntajes en Yesavage que los no remitentes 8 (media: 2.1 [DE]=1.9) versus 15.1 (media: 1.7 [DS=2.3], t=4.0, df=11.6, p<0.0001). Con relación a los remitentes (N=9), los no remitentes (N=11) tenían menor anisotropía fraccional en áreas límbicas, cíngulo anterior dorsal y ventral, corteza prefrontal dorso-lateral, rodilla de cuerpo calloso, sustancia blanca para-hipocámpica, cíngulo posterior y región insular (Figura 1). También hubo menor anisotropía fraccional en sustancia blanca subcortical estriada. Algunas áreas seleccionadas de sustancia blanca en regiones temporal (superior, media y fusiforme) y parietal (precuneo y postcentral) también tenían < anisotropía fraccional en no remitentes, especialmente en giro parietal inferior izquierdo (Figura 1, Tabla 3).
TABLA 1. Datos basales demográficos y clínicos de los participantes
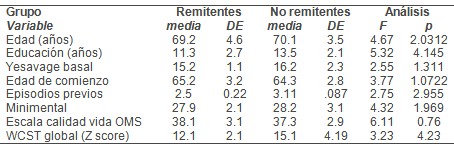
TABLA 2. Valores de WCST en los pacientes remitentes y no remitentes
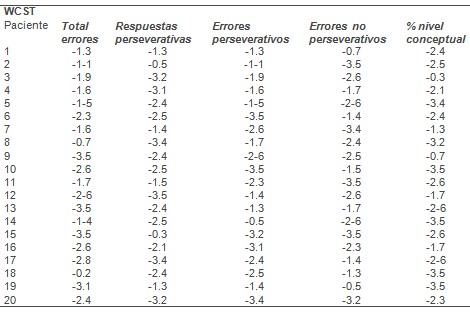
Figura 1. Diferencias de anisotropía fraccional entre remitentes y no remitentes.
Las diferencias tienen un umbral de modo tal que se señalan los cluster de 100 mm3 de voxels contiguos significativos en nivel de p>0.5. La figura muestra un modelo T1 wighted de alta resolución.
Discusión
El principal hallazgo es que los sujetos depresivos tardíos no remitentes a pesar del tratamiento tenían < anisotropía fraccional en áreas cortico-estriado-límbicas con respecto a remitentes. Las hiperintensidades de sustancia blanca son comunes en depresión tardía principalmente en regiones subcorticales (14). Las imágenes de difusión por tensor revelan compromiso de sustancia blanca en corteza singular anterior y frontal y temporal (15, 16). La transferencia de imágenes por eco-planar muestra anormalidades en las redes córtico-estriado-límbicas, incluyendo estriado ventral y sustancia blanca occipital y cuerpo y rodilla del cuerpo calloso (17). Estos hallazgos concuerdan con otras investigaciones (18, 19, 20). Las neuroimágenes funcionales también han demostrado mejoría de depresión asociada a cambios cortico-estriado-límbicos.
La remisión de depresión está asociada con aumento metabólico en región dorso-lateral (dorsal anterior, cíngulo anterior [área de Brodmann 24b], cíngulo posterior [área de Brodmann 23/41], corteza dorso-lateral [área de Brodmann 46/9], y parental inferior [área de Brodmann 40]) (3, 21, 22). La no remisión se asocia con < metabolismo en límbico ventral y para-límbico (cíngulo subgenual [área de Brodmann 25]), ínsula ventral, hipocampo e hipotálamo) (23). La remisión de la depresión se asocia con normalización del metabolismo del cíngulo anterior durante los episodios depresivos (23).
El hipermetabolismo del cíngulo anterior remite después de la respuesta a los antidepresivos (24), TEC (25), o deprivación del sueño (26), aunque la normalización depende de la modalidad de tratamiento (ISRS vs TCC) (27). El hipermetabolismo aumentado de la amígdala durante la remisión de depresión se asocia con recaída (3). Hipometabolismo del cíngulo anterior ventral predice Resistencia a tratamiento, y el hipermetabolismo cingulado predice remisión persistente (24). El aumento metabólico del cíngulo anterior izquierdo se encuentra en no remitentes (28). Un denominador común de estos hallazgos es que las anormalidades de los circuitos córtico-estriado-límbicos interfieren con la regulación entre corteza dorso-lateral y límbico ventral produciendo una desconexión y < respuesta antidepresiva. Las dificultades del estudio son ausencia de comparación con grupo doble-ciego, poca cantidad de sujetos, dosis fija del antidepresivo, batería restringida de evaluación de funciones neurocognitivas. Ventajas: el largo seguimiento de los pacientes.
El origen de las alteraciones micro-anatómicas en no remitentes no está claro del todo, pudiendo deberse a cambios vasculares subcorticales ya que hipocampo es particularmente sensible a los efectos del envejecimiento. La reducción del volumen de hipocampo correlaciona con duración de depresión (28). Como factor común de todas estas alteraciones esta el cambio en conexiones fronto-límbico-estriatales a nivel de fibras de sustancia blanca dando una vulnerabilidad para la depresión tarida y menor respuesta o remisión.
TABLA 3. Diferencias de anisotropía fraccional entre remitentes y no remitentes
Referencias
1. Judd LL, Akiskal HS, Maser JD, Zeller PJ, Endicott J, Coryell W, Paulus MP, Kunovac JL, Leon AC, Mueller TI, Rice JA, Keller MB: Major depressive disorder: a prospective study of residual subthreshold depressive symptoms as predictor of rapid relapse. J Affect Disord 1998; 50:97–108
2. Lecrubier Y: How do you define remission? Acta Psychiatr Scand 2002; 415(suppl):7–11
3. Drevets WC: Neuroimaging studies of mood disorders. Biol Psychiatry 2000; 48:813–829
4. Mayberg H: Depression and frontal-subcortical circuits: focus on prefrontal-limbic interactions, in Frontal-Subcortical Circuits in Psychiatric and Neurological Disorders. Edited by Lichter D, Cummings J. New York, Guilford Press, 2001, pp 177–206
5. de Asis JM, Stern E, Alexopoulos GS, Pan H, Van Gorp W, Blumberg H, Kalayam B, Eidelberg D, Kiosses D, Silbersweig DA: Hippocampal and anterior cingulate activation deficits in patients with geriatric depression. Am J Psychiatry 2001; 158:1321–1323
6. Rolls E: A theory of emotion, and its application to understanding the neural basis of emotion. Cogn Emot 1990; 4:161–190
7. Beck AT, Rush AJ, Shaw BF, Emery G: Cognitive Therapy of Depression. New York, Guilford Press, 1979
8. Hyman SE, Nestler EJ: Initiation and adaptation: a paradigm for understanding psychotropic drug action. Am J Psychiatry 1996; 153:151–162
9. Hoptman MJ, Gunning-Dixon FM, Murphy CF, Lim KO, Alexopoulos GS: Structural neuroimaging research methods in geriatric depression. Am J Geriatr Psychiatry 2006; 14:812–822
10. Alexopoulos GS: Depression in the elderly. Lancet 2005; 365: 1961–1970
11. Yesavage, J.A., Brink, T.L., Rose, T.L., Lum, O., Huang, V., Adey, M.B., & Leirer, V.O. (1983). Development and validation of a geriatric depression screening scale: A preliminary report. Journal of Psychiatric Research, 17, 37-49.
12. Kongs, S.K.; Thompson, L.L, PhD, Iverson, G.L, PhD and Heaton, R.K, PhD. (2000). Wisconsin Card Sorting Test - 64 Card Version Professional Manual. USA: Psychological Assesment Resources, Inc
13. Lingjaerde O, Ahlfors UG, Bech P, Dencker SJ, Elgen K: The UKU Side Effect Rating Scale: a new comprehensive rating scale for psychotropic drugs and a cross-sectional study of side effects in neuroleptic-treated patients. Acta Psychiatr Scand Suppl 1987; 334:1–100
14. Taylor WD, MacFall JR, Payne ME, McQuoid DR, Steffens DC, Provenzale JM, Krishnan RR: Greater MRI lesion volumes in elderly depressed subjects than in control subjects. Psychiatry Res 2005; 139:1–7
15. Nobuhara K, Okugawa G, Sugimoto T, Minami T, Tamagaki C, Takase K, Saito Y, Sawada S, Kinoshita T: Frontal white matter anisotropy and symptom severity of late-life depression: a magnetic resonance diffusion tensor imaging study. J Neurol Neurosurg Psychiatry 2006; 77:120–122
16. Taylor WD, MacFall JR, Payne ME, McQuoid DR, Provenzale JM, Steffens DC, Krishnan KR: Late-life depression and microstructural abnormalities in dorsolateral prefrontal cortex white matter. Am J Psychiatry 2004; 161:1293–126
17. Kumar A, Gupta RC, Albert Thomas M, Alger J, Wyckoff N, Hwang S: Biophysical changes in normal-appearing white matter and subcortical nuclei in late-life major depression detected using magnetization transfer. Psychiatry Res 2004; 130: 131–140
18. Hickie I, Scott E, Mitchell P, Wilhelm K, Austin M, Bennett B: Subcortical hyperintensities on magnetic resonance imaging: clinical correlates and prognostic significance in patients with severe depression. Biol Psychiatry 1995; 37:151–160
19. Patankar TF, Baldwin R, Mitra D, Jeffries S, Sutcliffe C, Burns A, Jackson A: Virchow-robin space dilatation may predict resistance to antidepressant monotherapy in elderly patients with depression. J Affect Disord 2007; 97:265–270
20. Steffens DC, Pieper CF, Bosworth HB, MacFall JR, Provenzale JM, Payne ME, Carroll BJ, George LK, Krishnan KR: Biological and social predictors of long-term geriatric depression outcome. Int Psychogeriatr 2005; 17:41–56
21. Bench CJ, Frackowiak RS, Dolan RJ: Changes in regional cerebral blood flow on recovery from depression. Psychol Med 1995; 25:247–261
22. Mayberg HS, Liotti M, Brannan SK, McGinnis S, Mahurin RK, Jerabek PA, Silva JA, Tekell JL, Martin CC, Lancaster JL, Fox PT: Reciprocal limbic-cortical function and negative mood: converging PET findings in depression and normal sadness. Am J Psychiatry 1999; 156:675–682
23. Mayberg H, Brannan S, Mahurin R, Jerabek P, Brickman J, Tekell J, Silva J, McGinnis S, Glass T, Martin C, Fox P: Cingulate function in depression: a potential predictor of treatment response. Neuroreport 1997; 8:1057–1061
24. Nobler MS, Oquendo MA, Kegeles LS, Malone KM, Campbell CC, Sackeim HA, Mann JJ: Decreased regional brain metabolism after ECT. Am J Psychiatry 2001; 158:305–308
25. Smith GS, Reynolds CF 3rd, Pollock B, Derbyshire S, Nofzinger E, Dew MA, Houck PR, Milko D, Meltzer CC, Kupfer DJ: Cerebral glucose metabolic response to combined total sleep deprivation and antidepressant treatment in geriatric depression. Am J Psychiatry 1999; 156:683–689
26. Goldapple K, Segal Z, Garson C, Lau M, Bieling P, Kennedy S, Mayberg H: Modulation of cortical-limbic pathways in major depression: treatment-specific effects of cognitive behavior therapy. Arch Gen Psychiatry 2004; 61:34–41
27. Schneider F, Grodd W, Weiss U, Klose U, Mayer K, Nagele T, Gur R: Functional MRI reveals left amygdala activation during emotion. Psychiatry Res 1997; 76:75–82 28. Sheline Y: 3D MRI studies of neuroanatomic changes in unipolar major depression: the role of stress and medical comorbidity. Biol Psychiatry 2000; 48:791–800