El mieloma múltiple constituye el paradigma de las denominadas gammapatías monoclonales (GMs). Las gammapatías monoclonales son un conjunto de enfermedades caracterizadas por la proliferación de células plasmáticas (CPs) y la presencia en suero de una inmunoglobulina homogénea denominada componente monoclonal en la región gamma o beta en el 80% de los casos. Engloban a un espectro de entidades clínicas, desde entidades benignas como la gammapatía monoclonal de significado incierto (GMSI) hasta entidades malignas como el mieloma múltiple.
Mieloma múltiple
Dr. Hildebrando Romero Sandoval
El mieloma múltiple constituye el paradigma de las denominadas gammapatías monoclonales (GMs). Las gammapatías monoclonales son un conjunto de enfermedades caracterizadas por la proliferación de células plasmáticas (CPs) y la presencia en suero de una inmunoglobulina homogénea denominada componente monoclonal en la región gamma o beta en el 80% de los casos. Engloban a un espectro de entidades clínicas, desde entidades benignas como la gammapatía monoclonal de significado incierto (GMSI) hasta entidades malignas como el mieloma múltiple.
El mieloma múltiple (MM) es una neoplasia clonal en el último estadio de maduración de las células linfoides B (células plasmáticas) originando una proliferación de las mismas en la médula ósea (MO); éstas producen inmunoglobulinas, generalmente IgG, IgA, y en menor frecuencia IgE e IgM, denominadas paraproteínas o proteína M (monoclonal) que funcionan anormalmente y son detectadas en el proteinograma del suero (inmunoelectroforesis sérica) y orina (inmunoelectroforesis urinaria). Los 3 criterios que definen al mieloma múltiple son:
1. Componente monoclonal en suero y/o orina.
2. Presencia de células plasmáticas clonales en médula ósea o presencia de Plasmocitoma en biopsia de médula ósea.
3. Sintomatología derivada de la afectación de órganos o tejidos por el mieloma (síntomas CRAB)*
* Hipercalcemia. Calcio corregido >11.5 mg/dl o 1mg por encima del valor normal. Insuficiencia Renal. Creatinina < 2 mg/dl
Anemia. Hemoglobina < 2 g/dl por debajo del límite inferior normal o Hb <10g/dl
Bone lessions (lesiones óseas) lesiones líticas o osteoporosis con fracturas que produzcan compresión.
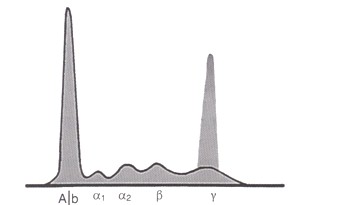
Figura: Gammapatía monoclonal (mieloma múltiple)
En líneas generales, la gammapatía monoclonal se pueden clasificar en
1. Gammapatías monoclonales malignas
a. Mieloma múltiple y formas especiales de mieloma múltiple (mieloma indolente, mieloma quiescente, no secretor, biclonal, osteoesclerótico), síndrome de POEMS y el mieloma con mielofibrosis
b. Plasmocitoma localizado óseo solitario y extramedular
c. Enfermedades linfoproliferativas malignas macroglobulinemia de Waldenström, linfoma no Hodgkin con gammapatía monoclonal, leucemia linfoide crónica con gammapatía monoclonal.
d. Enfermedades de las cadenas pesadas gamma, alfa, mu, delta.
2. Gammapatías monoclonales de significado incierto.
a. Gammapatía monoclonal idiopática o esencial
b. Proteinuria de Bence-Jones
c. Gammapatía monoclonal asociada a carcinoma (pulmón, colon, próstata).
3. Gammapatías monoclonales reactivas como las crioaglutininas, crioglobulinemias mixta esencial, síndrome de Sjögren, artritis reumatoide, enfermedad de Gaucher, sarcoidosis, cirrosis hepática, psoriasis. Enfermedades infecciosas: Mycobacterium tuberculosis, Citomegalovirus, SIDA.
4. Gammapatías monoclonales transitorias por trasplante de médula ósea e infecciones vírales, bacterianas, fúngicas y parasitarias.
El mieloma múltiple es una enfermedad de la edad media y avanzada de la vida, con el mayor promedio alrededor de los 60 años; un 15% tienen menos de 50 años y un 2% son menores de 40 años. En USA tiene una prevalencia de 4 por 100.000 habitantes, predomina en la raza negra y en el sexo masculino, raro en la raza asiática. Constituye el 1% de todas las neoplasias malignas y el 10% de las enfermedades malignas hematológicas.
Las células plasmáticas y las células del estroma medular se relacionan entre sí mediante una serie de citocinas y factores de crecimiento que regulan la proliferación y diferenciación celular .Se ha identificado la interleucina 6 (IL-6) como el factor crucial para la proliferación de las células del mieloma, tanto in vitro como in vivo, además de estimular la actividad osteoclástica. De hecho, los anticuerpos anti- IL-6 bloquean el crecimiento de las células plasmáticas in vitro, y la proliferación tumoral.
Otras citocinas implicadas en la patogénesis del mieloma múltiple son el factor de necrosis tumoral alfa (TNT-α), LA IL-10, el factor de crecimiento de la insulina-1 (IGF-1). El factor de crecimiento vascular (VEGF) es un potente factor angiogénico responsable de la angiogénesis observada en el mieloma múltiple, la cual además de ser un factor pronóstico adverso, constituye una diana terapéutica para nuevos agentes con propiedades antiangiogénicas (talidomida).
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas del mieloma múltiple dependen del estadio en que se encuentre la enfermedad. El estadio preclínico oscila generalmente entre 2 y 5 años, es progresivo y el tiempo de duplicación de la población celular oscila entre 3 a 10 meses. La gran variabilidad proliferativa de las células plasmáticas y el componente monoclonal, son los dos elementos que explican la fisiopatología y clínica de esta enfermedad.
1. Proliferación tumoral de células plasmáticas. Estas células invaden el hueso adyacente donde ocasionan destrucción esquelética, osteoporosis y lesiones osteolíticas cuya manifestación usual son los dolores óseos y las fracturas patológicas (IL-6). La proliferación de las células plasmáticas en la médula ósea desplaza las diferentes líneas celulares (eritrocitos, leucocitos y plaquetas); lo cual explica las manifestaciones resaltantes de esta enfermedad: anemia, leucopenia, hemorragias por trombocitopenia.
Otros signos y síntomas serían los secundarios a estados de hipercalcemia (osteolisis). Todo paciente mayor de 40 años con dolores óseos y anemia se debe descartar mieloma múltiple hasta que no se demuestre lo contrario.
2. Producción de inmunoglobulina monoclonal. Conlleva a infecciones bacterianas a repetición, defectos en la activación del complemento, síndrome de hiperviscosidad, crioglobulinemia, amiloidosis e insuficiencia renal.
Las manifestaciones clínicas del mieloma múltiple más importantes son:
Síntomas generales. Cursan con un síndrome de afectación del estado general (pérdida de peso, astenia y anorexia), fiebre, trastornos circulatorios por el síndrome de hiperviscosidad, edema.
Anemia. Se observa en un 60% de los pacientes; se debe a la supresión de la médula ósea por las citocinas (interleucinas y el factor de necrosis tumoral) y la sustitución medular por las células malignas; contribuyen otros factores como la insuficiencia renal (anemia de la enfermedad renal). Cursa con debilidad, fatiga e intolerancia al ejercicio.
Dolor óseo. Se presenta en el 60 a 80% de los pacientes; generalmente es dorsolumbar, costal y en menor frecuencia en la extremidades inferiores, de características mecánicas, es decir, se agrava con los movimientos y aumenta progresivamente de intensidad hasta hacerse insoportable. Es frecuente el aplastamiento súbito de una vértebra o la fractura patológica de un hueso largo, al menor movimiento.
Insuficiencia renal. Es frecuente en los pacientes con enfermedad avanzada, su etiopatogenia es multifactorial; se puede desencadenar por la hipercalcemia, el síndrome de hiperviscosidad, infecciones, deshidratación y por el uso de contrastes yodados. También se puede producir una nefropatía por cilindros de inmunoglobulinas de cadenas ligeras monoclonales (proteína de Bence-Jones), que sumadas a la glicoproteína de Tamm-Horsfall se depositan, desencadena una reacción inflamatoria tubular y finalmente atrofia del túbulo contorneado distal (riñón del mieloma).
En el MIELOMA MÚLTIPLE los glomérulos están preservados, excepto en dos situaciones: 1. cuando existe amiloidosis, predominantemente asociadas a cadenas ligeras lambda, y 2. en la enfermedad de depósito de cadenas ligeras, de tipo kappa. En ambos casos suele existir proteinuria de tipo glomerular y de rango nefrótico a diferencia del patrón tubular, que se observa en el típico riñón del mieloma. Es factible considerar la infiltración plasmocitaria del parénquima renal en estadios avanzados de la enfermedad.
Otros. síntomas relacionados con hipercalcemia (vómitos, nauseas, poliuria, polidipsia, estreñimiento y confusión mental), trastornos hemorrágicos (epistaxis, hematuria, equimosis) secundario a la sustitución medular por las células malignas o una púrpura disproteinémica (las inmunoglobulinas monoclonales recubren las plaquetas presentando una reacción de liberación plaquetaria anormal y una defectuosa polimerización de la fibrina), amiloidosis (hiperpigmentación cutánea y edema en la zona periorbitaria, macroglosia, síndrome del túnel carpiano), neurológicas (neuropatías periféricas, paraparesia espástica o un cuadro radicular), infección (secundaria a la disminución de las inmunoglobulinas policlonales) de preferencia pulmonares por neumococos y urinarias por bacilos gran negativos.
DIAGNÓSTICO
1. Hematología. Cursan con anemia, morfológicamente normocítica normocrómica, reticulocitos bajos, leucopenia, trombocitopenia y aumento de la VSG (>100 mm/h). Pueden observarse células plasmáticas en el frotis de sangre periférica. En caso de que el valor absoluto sea mayor de 2.000/mm3 se debe considerar el diagnóstico de leucemia de células plasmáticas. Además, el frotis muestra apilamiento de los eritrocitos, semejando pilas de monedas llamadas “rouleaux”; esto se debe a la hipergammaglobulinemia circulante.
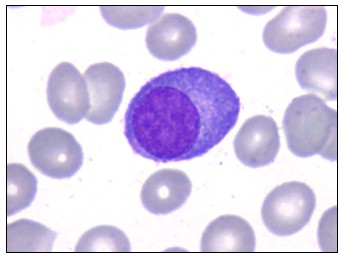
Figura: Célula plasmática
2. Médula ósea. El aspirado de la MO confirma el diagnóstico; en pacientes con la enfermedad se observa de un 10 a 95% de células plasmáticas maduras e inmaduras, y algunas de sus variantes morfológicas (células en flama, células de Mott, cuerpos de Russell, cuerpos de Dutcher, cuerpos de inclusión). La realización de la biopsia de médula ósea, es importante ya que nos permite definir: 1 .La presencia de plasmocitoma y 2. La realización de estudios inmunohistoquímicos, los cuales son de utilidad ya que determinan células plasmáticas (CPs) que expresan inmunoglobulinas en el citoplasma, pero no en la superficie de la célula (CD38+.CD138+, CD56+, CD19-, CD45-)
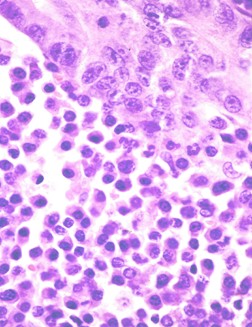
Figura: Médula ósea
3. Electroforesis de proteínas séricas. Se encuentra un patrón electroforético de gammaglobulina monoclonal o componente M, la gráfica muestra una curva de altura importante, con una base angosta en la región gamma. La inmunoelectroforesis sérica determina las inmunoglobulinas del componente M (kappa o lambda) y en la orina se pueden identificar las cadenas ligeras (kappa o lambda) denominada proteína de Bence-Jones. El estudio cualitativo de las inmunoglobulinas por inmunofijación es importante para identificar la clase de inmunoglobulina que se produce en exceso, y confirmar su monoclonalidad, en orden de importancia serian: IgG (53%), IgA (25%) e IgD (1%). Un 15% de los casos el componente monoclonal no está formado por Ig completas, sino sólo por cadenas ligeras, que son filtradas por el riñón y por lo tanto se detectan en orina y no en suero, son los llamados mieloma de Bence -Jones (no confundir con proteinuria de Bence-Jones).
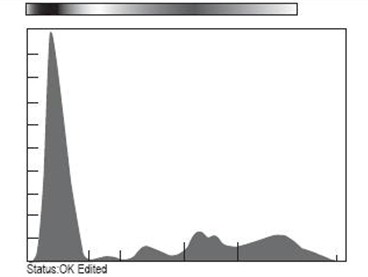
Figura: Electroforesis de proteínas séricas
4. Química sanguínea. Es frecuente encontrar hipercalcemia hasta en un 30% de los pacientes, como consecuencia de las citocinas que tienen actividad osteoclástica; hiperuricemia (en ausencia de insuficiencia renal); hipoalbuminemia; hiperproteinemia a expensas de las globulinas; alteración de las pruebas renales y del funcionalismo hepático (aumento de la LDH). La elevación de la fosfatasa alcalina y fosfatasa acida habla más en favor de enfermedad metastásica con lesiones osteolíticas, Igualmente son importantes la VSG, PCR (IL-6) y beta-2 microglobulina sérica.
5. Estudios imagenológicos. Las radiografías muestran imágenes osteolíticas o en sacabocado en los huesos del cráneo, costillas, pelvis, vértebras y huesos largos. También puede observarse osteopenia, osteoporosis generalizada, fracturas espontáneas y aplastamiento vertebrales. Las lesiones osteoescleróticas se observan en 1% de los casos. Se dice que el sourvey óseo es positivo en un paciente con mieloma múltiple, cuando existe afectación de la masa trabecular > 30%, de allí que lo hace menos sensible para seguimiento de la enfermedad. En estos casos se recomienda la resonancia magnética (determina compromiso de médula ósea) y/o TAC. La gammagrafía ósea no es de utilidad en el estudio de los pacientes con mieloma múltiple. El mieloma múltiple se debe diferenciar de las lesiones osteolíticas que se observan en las metástasis ósea y en el hiperparatiroidismo.
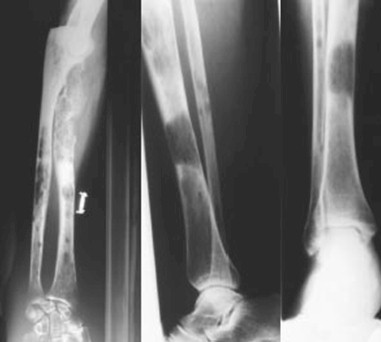
Figura: Lesiones osteolíticas
6. Estudios citogenéticos. Mediante estudios citogenéticos empleando la hibridación in situ fluorescente (FISH) y la hibridación genómica comparada (HGC), se han reportado alteraciones cromosómicas tanto numéricas como estructurales. Las alteraciones numéricas más frecuentes son la ganancia de los cromosomas 3,5, 7, 9, 11,15 y 19, en general asociadas a cariotipos hiperdiploides y buen pronóstico. Por el contrario, la hipodiploidía y las pérdidas cromosómicas comportan mal pronóstico.
La delección total o parcial del cromosoma 13q, se detecta en un 50% de los pacientes con mieloma múltiple y le confiere mal pronóstico. Las alteraciones estructurales de mayor frecuencia, detectadas hasta en el 75% de los pacientes con mieloma múltiple, afectan el gen de la cadena pesada de la inmunoglobulina (IgH) situado en el cromosoma 14q32, y constituye probablemente el evento oncogénico más temprano en el mieloma múltiple. La t (14q32) puede traslocarse a cualquier cromosoma, siendo los más frecuentes 11q12 (disregulación de la ciclina D1), 4p16 (desregulación de fgfr3) y 16q23 (c-maf). Las mutaciones del oncogén ras pueden detectarse en el 30% de los pacientes con mieloma múltiple y está asociado con fases avanzadas de la enfermedad. Las mutaciones de p53 se encuentran en el 3-20% de los casos. También se ha reportado hipermetilación de proteínas reguladoras del ciclo celular, como p15 y p16, que comportan una inactivación de genes.
En base a las alteraciones cromosómicas numéricas y estructurales, podemos hablar de mieloma múltiple hiperdiploide y mieloma múltiple no hiperdiploide, así tenemos:
Mieloma múltiple hiperdiploide. Se presenta alrededor del 50-60% de los pacientes que cursan con mieloma múltiple y presentan alteraciones cromosómicas numéricas, tipo: trisomías de los cromosomas impares: 2, 5, 7, 9, 11, 15, 19,21.
Mieloma múltiple no hiperdiploide. Se presenta alrededor del 40-50% de los pacientes que cursan con mieloma múltiple y presenta alteraciones estructurales, es decir, translocaciones que afectan el locus de la cadena pesada de las inmunoglobulinas en el cromosoma 14.
Pacientes con mieloma múltiple hiperdiploide y t (11:14) tiene buen pronóstico.
7. Inmunofenotipo. El mieloma múltiple es una proliferación clonal de células linfoides B maduras que han pasado por el centro germinal del folículo linfoide. La finalidad de realizar estudios de citometría de flujo en estos pacientes es para:
1. Realizar diagnóstico diferencial entre las células plasmáticas (CPs) tumorales de las reactivas y de las sanas y estimar marcadores de valor pronóstico. El fenotipo de la célula plasmática mielomatosa es IgS-,IgC+, CD38+,CD138+ (Syndecan-1), CD19-,CD56+, a diferencia de la célula plasmática normal, que expresa el fenotipo CD19+,CD56-. La proporción de células plasmáticas de fenotipo normal (CD19+, CD56-) o patológico (CD19-, CD56+) contribuye a diferenciar el mieloma múltiple de la gammapatía monoclonal de significado incierto (GMSI).
2. Evaluar marcadores de valor pronóstico. El análisis del ciclo celular de las CPs mediante citometría de flujo facilita la identificación de anormalidades cromosómicas numéricas (aneuploidia) y la estimación del índice de proliferación de las células plasmáticas (CPs). Los índices de proliferación elevados (fase S >3%) están asociados a pronósticos adversos. El índice de apoptosis de las células plasmáticas (CPs) estimado mediante tinción con anexina-V y CF es un factor predictivo de valor pronóstico, también para tratamientos con talidomida o bortezomib. El uso del índice de proliferación de células plasmáticas (CPs) más las alteraciones citogenéticas presentes en estos pacientes, ha servido para plantear nuevas clasificaciones con valor pronóstico, tomando como base 3 pruebas: hibridación in situ fluorescente (FISH), citogenética de metafase y el índice de rotulación de células plasmáticas (PcLI).
3. Identificar el riesgo de progresión de gammapatía monoclonal de significado incierto (MGUS) y mieloma múltiple-quiescente (ratio células plasmáticas (CPs) sanas/patológicas)
4. Evaluar respuesta al tratamiento
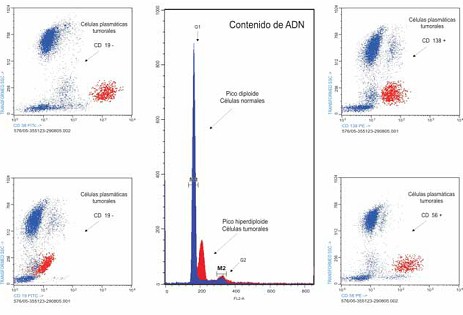
Figura: Citometría de flujo compatible con mieloma múltiple
CRITERIOS DIAGNÓSTICOS
Criterios mayores
1. Plasmocitoma diagnosticado por biopsia.
2. Células plasmáticas en la médula óseas > 30%.
3. Paraproteína monoclonal: IgG mayor de 3.5 g/dl; IgA mayor de 2 g/dl y proteína de Bence Jones (kappa o lambda) mayor de 1 g en orina de 24 horas.
Criterios menores
1. Células plasmáticas en la médula ósea, alrededor de 10 a 30%.
2. Nivel de paraproteína como en el punto 3 de los criterios mayores, pero en menor cuantía.
3. Inmunoglobulinas con niveles normales o disminuidas (IgG < de 600 mg/dl, IgA < de 80 mg/dl e IgM < de 50 mg/dl.
4. Lesiones osteolíticas.
El diagnóstico de mieloma múltiple se hace cuando se presenta un criterio mayor más uno menor, o al menos 3 menores.
ESTADIO DEL MIELOMA MÚLTIPLE (Durie/Salmon)
El estadio se establece con las manifestaciones clínicas y la masa tumoral de las células plasmáticas.
Estadio I (< 0.6 x 1012 células/m2)
1. Hemoglobina mayor de 10 g/dL.
2. Calcio sérico menor de 12 mg/dL.
3. Componente monoclonal de baja producción: IgG menor de 5 g/dl; IgA menor de 3 g/dl y cadenas livianas en orina menor de 4 g en 24 horas o presencia de proteína de Bence-Jones.
4. Plasmocitoma solitario.
5. Ausencia de lesiones óseas.
Estadio II (no cumple los criterios del estadio I y II y una masa tumoral 0.6 a 1.2 x 1012 células/m2)
Estadio III (> 1.2 x 1012 células/m2)
1. Hemoglobina menor de 8.5 g/dL.
2. Calcio sérico mayor de 12 mg/dL.
3. Componente monoclonal de alta producción: IgG mayor de 7 g/dL; IgA mayor de 5 g/dL y cadenas livianas en orina mayor de 12 g en 24 horas.
4. Lesiones osteolíticas severas (escala 3)*.
* Escala 3. Lesiones líticas en 4 o más regiones óseas y/o fractura patológica no vertebral no costal. Se definen 6 regiones óseas: cráneo, columna, extremidades superiores e inferiores, pelvis, caja torácica (cintura escapular, costillas)
Existe una subclasificación de los estadios en:
A: cuando la creatinina sérica es menor de 2 mg%, o
B: cuando es mayor de 2 mg/dL.
FACTORES PRONÓSTICOS
Existen varios factores de relativa importancia para evaluar el pronóstico en pacientes con diagnóstico de mieloma múltiple, ya que permiten predecir la evolución de los mismos y así brindar una adecuada terapéutica Se consideran factores adversos:
1. Aumento de beta-2-microglobulina sérica. Un aumento de esta globulina se asocia a una sobrevida corta, no es de utilidad cuando existe insuficiencia renal y no predice la respuesta al tratamiento.
2. Aumento del índice de proliferación de células plasmáticas. El valor del corte es 1 a 2% (citometría de flujo).
3. Proteína C reactiva. Su reactividad es directamente proporcional con el aumento de la IL-6 sérica, un importante factor de crecimiento tumoral.
4. Aumento de creatinina sérica
5. Edad avanzada (mayor de 60 años) al momento del diagnóstico
6. Bajos niveles de albúmina sérica (< de 3.5 g/dl) y β2-microglobulina >5.5 mg/dl (ISS)
7. Hallazgos de plasmoblastos en médula ósea
8. Células plasmáticas en sangre periférica
9. Aumento de LDH sérica está asociado con fenotipo mieloma múltiple agresivo, sobrevida corta y presencia de adenopatías retroperitoneales
10. Alteraciones citogenéticas. La presencia de cromosoma 13 se asocia a sobrevida corta; igualmente, la presencia del cromosoma 11q13 sugiere mal pronóstico. La mutación del oncogén p53 y ras están presentes en 20 a 30% de pacientes con enfermedad avanzada. Mieloma múltiple no hiperdiploide.
ÍNDICE DE ESTADIAJE INTERNACIONAL (ISS)
Estadio Definición - Sobrevida (meses)
I albúmina > 3.5 g/dL + beta -2- microglobulinas < 3.5 mg/dL - 62 meses
II albúmina < 3.5 g/dL + beta -2- microglobulinas < 5 mg/dL o beta -2- microglobulina 3.5-5.5mg/dl – 44 meses
III beta -2-microglobulinas > 5.5 mg/dL - 29 meses
Grupos de riesgo y sobrevida en meses del mieloma múltiple
Riesgo bajo (ningún factor de riesgo): 79 meses.
Riesgo bajo intermedio (1 factor de riesgo): 48 meses.
Riesgo alto intermedio (2 factores de riesgo): 32 meses.
Riesgo alto (3 factores de riesgo): 13 meses.
CLASIFICACIÓN INTERNACIONAL (IMWG)
El Internacional Mieloma Working Group (IMWG) decidió que los criterios para el diagnóstico de las gammapatías monoclonales debieran ser simples, fáciles de utilizar y basados en pruebas. A continuación se describe esta clasificación.
Gammapatía monoclonal de significado incierto (GMSI)
1. Proteína M sérica < 3 g/L
2. Plasmocitos clonales en M/O < 10%
3. Ausencia de daño de tejido u órgano terminal (insuficiencia renal, anemia, hipercalcemia, lesiones óseas, hiperviscosidad, amiloidosis, infecciones bacterianas recurrentes
Mieloma asintomático (indolente “smouldering”)
1. Proteína M en el suero > 3 g/L
2. Infiltración en médula ósea > 10% de células plasmáticas
3. Ausencia de síntomas o daño de órgano terminal
Mieloma múltiple sintomático
1. Proteína M en el suero y/o orina
2. Infiltración en médula ósea > 30% de células plasmáticas o Plasmocitoma
3. Daño de órgano terminal (CRAB)
Mieloma no secretor
1. Ausencia de paraproteína en el suero y/o en la orina por inmunofijación
2. Células plasmáticas mayor o igual al 10% en médula ósea
3. Daño de órgano terminal(CRAB)
Plasmocitoma óseo solitario
1. Ausencia de paraproteína en el suero y orina
2. Área única de destrucción ósea secundario a las células plasmáticas
3. MO no infiltrada por células plasmáticas
4. Sourvey óseo normal
5. Ausencia de compromiso terminal de órganos (CRAB)
Plasmocitoma extramedular
1. Ausencia de paraproteína en suero y orina
2. Tumor extramedular de células plasmáticas
3. MO normal
4. Sourvey óseo normal
5. Ausencia de compromiso terminal de órganos (CRAB)
Plasmocitomas solitarios recurrentes
1. Ausencia de paraproteína en el suero y orina
2. Más de una lesión ósea destructiva o tumor extramedular de células plasmáticas
3. MO normal
4. Gammagrafía ósea normal
5. Ausencia de compromiso terminal de órganos. (CRAB)
TRATAMIENTO
Tratamiento general
Dolor. En la práctica para evaluar el cuadro álgido y realizar una evaluación de la severidad de su estado se utilizan escalas de autoevaluación que permiten una estimación global de la intensidad del dolor (ordinal de Keele, escala de Huskinsson, escala visual/analógica). De igual modo, debe existir un uso racional de los analgésicos, por lo cual se recomienda utilizar la escalera analgésica de la OMS (modificada), que consta de 5 peldaños, y pasa de manera escalonada, desde los fármacos no opioides y opioides (menores y mayores) hasta la vía espinal y el bloqueo nervioso, en función de la intensidad del dolor. Se recomienda la utilización de los corsés para estabilizar la columna. La radioterapia local alivia el dolor, sobre todo en casos de aplastamiento de vértebras, fracturas patológicas y en el plasmocitoma solitario. Es recomendable la deambulación racional para evitar la desmineralización y el debilitamiento de las estructuras óseas. Las fracturas patológicas deben ser tratadas por un traumatólogo (vertebroplastia y cifoplastia).
Anemia. Lo fundamental es el tratamiento de la enfermedad y la resolución del compromiso renal, sin embargo no olvidar de descartar déficit de hierro, folato y vitamina B12. Muchas veces son necesarias las transfusiones de concentrado globular, las cuales deben hacerse con mucha precaución por el síndrome de hiperviscosidad producto de las paraproteínas séricas. Cuando estos elementos han sido considerados y persiste la anemia, está planteado el uso de eritropoyetina a dosis de 150 U/Kg por semana.
Hipercalcemia. El tratamiento inicial consiste en una generosa hidratación con solución salina y forzar la diuresis con furosemida. Los esteroides son muy efectivos en controlar la hipercalcemia, debido a sus efectos antitumorales, actividad anti-osteoclástica y disminución de la absorción intestinal de calcio. Si estas medidas no son suficientes se pueden utilizar fármacos con actividad anti-osteoclástica parenterales tales como el pamidronato o el ácido zoledrónico en y en casos de resistencia está indicado el uso de la calcitonina y la mitramicina.
Síndrome de hiperviscosidad. Ocurre con mayor frecuencia en el mieloma con IgA porque esta proteína tiende más a polimerizarse; puede tratarse con plasmaféresis para eliminar una gran parte de estas proteínas, reducir el volumen plasmático y la viscosidad relativa hasta menos de 4 cp (VN: 3.5 a 5.5 cp); se recomienda un recambio plasmático de 1 a 1.5 de la volemia por 3 días. Mejora la insuficiencia renal porque depura las proteínas de cadena ligera.
Bifosfonatos. Son fármacos con actividad anti-osteoclástica. Previenen la diferenciación osteoclástica al inducir apoptosis lo cual limita su efecto sobre el tejido óseo. Estos fármacos también poseen actividad antitumoral ya que inducen apoptosis en las células mielomatosas in vitro, reducen la secreción de IL-6 y causan la expansión de células gamma, δ y T con actividad anti-mieloma. Son recomendados en todo paciente con mieloma múltiple que estén cursando con lesiones óseas establecidas (escala 3). Los más usados son el ácido zoledrónico a la dosis de 4 mg EV en 15 minutos mensualmente; el clodronato a la dosis de 800 a 3.200 mg vía oral diarios o 100 a 600 mg EV al día en forma continua; o el pamidronato, 90 mg EV en infusión de 4 horas, mensual por 21 ciclos; también se han usado el residronato e ibandronato.
Todo paciente con diagnóstico de mieloma múltiple, previo al inicio del uso de bifosfonatos debe indicarse una evaluación dental, ya que una vez que comience el tratamiento con los mismos, no deben realizarse extracciones dentales, implantes o cirugía de mandíbula, por el riesgo de desarrollar osteonecrosis de la mandíbula. Cuando existe compromiso renal, se debe vigilar el empleo de estos fármacos, y se recomienda utilizar el pamidronato (mayor tiempo de infusión) en vez del ácido zoledrónico, y si existe mayor deterioro de la función renal (filtración glomerular < 30ml/minuto) está indicado la reducción de la dosis a la mitad y/ o suspensión de la dosis hasta la recuperación de la función renal.
Insuficiencia renal. Evitar el uso de AINES, la deshidratación, hipercalcemia, hiperuricemia, infecciones y el uso de contraste yodados. Cuando es secundaria a la enfermedad, el paciente debe ser tratado con dexametasona o Tal/Dex para reducir la masa tumoral lo más rápido posible.
Infecciones. Deben ser investigadas y controladas oportunamente. Los pacientes deben recibir la vacunación para neumococo e influenza. Está indicada la infusión de gammaglobulina en casos de infecciones recurrentes asociadas a severa hipogammaglobulinemia. La profilaxis de Pneumocystis Jirovec debe indicarse en pacientes que reciben tratamiento con altas dosis de esteroides.
Tratamiento antineoplásico
El tratamiento de estas patologías se limita exclusivamente a pacientes con mieloma múltiple sintomático con alteraciones en la esfera hematológica y, se debe iniciar lo más pronto posible. Se ha de considerar que pacientes son candidatos o no para trasplante de MO, ya que se debe evitar el uso de agentes alquilantes (melfalán) en los pacientes elegibles para trasplante. Los pacientes asintomáticos con patrón monoclonal deben ser observados cuidadosamente y no recibir tratamiento hasta que no se demuestre la evolución de la enfermedad. En los pacientes no candidatos a trasplante de MO en estadios iniciales, con el uso de la quimioterapia se ha logrado una sobrevida de 3 a 4 años en un 30 a 50% y en los estadios avanzados la duración es de 6 a 12 meses, sobrevida que se ha prolongado con el empleo de las nuevas modalidades de tratamiento, por lo que podemos inferir que con los nuevos fármacos disponibles (no quimioterapia) convertimos una neoplasia maligna en una enfermedad criónica, lo que se traduce en una mejor calidad de vida. A continuación se describirán los fármacos disponibles para el tratamiento de los pacientes con mieloma múltiple.
Melfalán/ Prednisona. Con esta combinación se logra una sobrevida de 3 años, aunque con un porcentaje alto de recaídas el primer año. Se deben hacer recuentos hematológicos semanales y repetir el ciclo cada 4 a 6 semanas, al menos por 1 año. Los ciclos se continúan mientras siga disminuyendo la proteína monoclonal y, se mantiene en forma indefinida.
Una vez alcanzada una respuesta estable (plateau) de la carga tumoral de paraproteína, que generalmente se logra a los 6-12 meses y se extiende por 20 meses, se puede prolongar hasta por 48 meses con la administración de interferón-β2b recombinante; éste tiene un efecto citorreductor sobre las células tumorales, aunque no es concluyente que mejore la sobrevida global. La dosis utilizada es de 3 millones mu/m2 subcutánea 3 veces por semana, combinada con prednisona y melfalán a las dosis convencionales. Actualmente se utiliza en pacientes mayores de 65 años, no candidatos a trasplante de MO, con buena respuesta clínica (> 3 años), hemoperiférica y serológica (paraproteína).
Es importante recordar los efectos beneficiosos adicionales de los corticosteroides es a través de múltiples acciones: descienden la hipercalcemia por disminución de la resorción ósea, provocan descenso de las proteínas séricas, incluyendo el patrón monoclonal y la proteinuria; además, tienen un efecto antineoplásico (actividad linfolítica).La monoterapia con dexametasona ofrece un 43% de respuesta en pacientes con mieloma múltiple de novo; resultados similares a los reportados con quimioterapia combinada.
Melfalán: 0.25 mg Kg (9 mg por m2) vía oral durante 4 días
Prednisona: 100 mg vía oral durante 4 días
Interferón: 3 mu/m2 S.C/ 3 veces por semana cada 4 semanas
y/o Revlimid o bortezomid.
Vincristina/Doxorrubicina (adriamicina)/Dexametasona (VAD). Se utiliza como esquema de inducción particularmente en pacientes con indicación de trasplante de médula. Se alcanzan respuestas de un 55 a 65% en pacientes con mieloma múltiple de novo. Esta combinación es excelente para recaídas, pero produce muchas infecciones y toxicidad gastrointestinal. Con el objeto de reducir la cardiotoxicidad de la doxorrubicina se ha empleado la doxorrubicina liposomal (esquema DVD)
Vincristina: 0.4 mg vía intravenosa diarios durante 4 días.
Doxorrubicina (adriamicina): 9 mg/m2 vía intravenosa diarios por 4 días.
Dexametasona: 40 mg vía oral diarios durante 10 días.
Talidomida. Ha demostrado ser efectiva en la enfermedad avanzada; induce una respuesta notable y duradera, inclusive en recaídas después de la quimioterapia a altas dosis. Debido a sus propiedades antiangiogénicas (el mieloma múltiple tiene una angiogénesis aumentada) es útil para el tratamiento de esta enfermedad y lo hace a través de:
1. Inhibición directa en el crecimiento de las células del mieloma, mediante el daño oxidativo del ADN mediado por radicales libres.
2. Modula el perfil de las moléculas de adhesión, alterando la secreción y la actividad biológica de algunas citocinas (como la interleucina-6, 1-beta y 10, y factor de necrosis tumoral- α), las cuales modulan el crecimiento y la supervivencia de las células del mieloma.
3. Inhibe el factor de crecimiento vascular endotelial y el factor de crecimiento fibroblástico básico 2, los cuales estimulan la angiogénesis.
4. Induce la separación de interferón gamma e interleucina-2 por células T CD8+.
5. Disminuye el factor de necrosis tumoral-α provocando ganancia de peso en los pacientes.
6. Altera la expresión de moléculas de adhesión
7. Modula la respuesta inmune a través de: es un fuerte coestimulante de la respuesta inmune de los linfocitos ThA, incrementa el contaje leucocitario total (CD4, CD8), modifica la expresión molecular de la superficie celular de los granulocitos e inhibe la angiogénesis (bFGF y VEGF).
Los efectos secundarios por el uso prolongado de la talidomida son teratogenicidad importante (contraindicado en embarazadas), sedación, fatiga, estreñimiento, trombosis venosa profunda (usar aspirina profiláctica) y neuropatía periférica; estos efectos ceden al reducir la dosis o suspender el medicamento. Se inicia con 200 mg VO diarios, alternada con dexametasona (dosis altas) 40 mg vía oral diarios los días 1-4, 9-12, 17-20 y 24-28 cada 4 semanas o dosis bajas de dexametasona (días 1,8,15 y 22, cada 4 semanas) esta combinación (Tal/Dex) ofrece una respuesta de 52% en pacientes previamente tratados y de 71% en pacientes diagnosticados de novo. La monoterapia con talidomida ofrece un 37% de respuesta con reducción de más de 25% del nivel de paraproteína.
Inhibidores de proteosomas (Bortezomib). Es el primer inhibidor específico del proteosoma S26, una proteasa dependiente de ATP intracelular, responsable del catabolismo proteico de todas las células eucarióticas. Su acción sobre el mieloma múltiple es por citotoxicidad directa y sobre el microambiente de la médula ósea. Los mecanismos de acción del bortezomib como antitumoral son los siguientes: induce directamente apoptosis en las células tumorales, inhibe la activación de NF-KB por la inhibición del I-KB en células y microambiente tumoral ( complejo ubicuitina IKB + NF-KB), interfiere en la adherencia de células plasmáticas mielomatosas a las células estromales de la MO, bloquea la producción de IL-6 en las células plasmáticas malignas, bloquea la producción y expresión de mediadores pro-angiogénicos, repara defectos en reguladores apoptóticos como sobreexpresión de bcl-2 y p53, posee actividad independiente del ciclo celular y posee actividad en condiciones de hipoxia.
Produce una respuesta parcial en un 27% y completa en un 5%, generalmente rápida después del segundo ciclo, con una duración media de 12 meses. La respuesta va asociada a mejoría clínica y hemoperiférica y de la función renal (si está comprometida). Los efectos colaterales más comunes son los gastrointestinales, fatiga, neuropatía periférica y citopenias. La dosis es de 1.3 mg /m2 EV infusión rápida, en 3 a 5 segundos, los días 1, 4, 8 y 11, cada 21 días por 8 ciclos, y si existe neuropatía grado 4 se indica la misma dosis, pero semanal. Actualmente es la terapia de inducción gold-standard especialmente para menores de 65 años.
Fármacos inmunomoduladores. Son derivados de la talidomida, pero más potente que esta y con menos efectos secundarios. En estos momentos se están utilizando en la práctica clínica dos fármacos: Revlimid (lenalidomida o CC-5013) Y Actimid (CC-4047). En pacientes con enfermedad avanzada se ha obtenido una tasa de respuesta del 38% con un 6% de respuestas completas con Revlimid y del 54% con un 17% de repuestas completas con Actimid respectivamente. Dicha tasa de respuesta se ve incrementada con el uso de dexametasona. Su mecanismo de acción se basa en sus propiedades antineoplásicas, antiangiogénicas, proeritropoyéticas e inmunomoduladores. Combinado con dexametasona mejora la sobreviva en pacientes con mieloma múltiple en recaída o refractaria. Los efectos adversos más frecuentes son: citopenias periféricas, insomnio, trombosis, palpitaciones, visión borrosa.
Fármacos inhibidores de HDAC (inhibidor de la histona deacetilasa). Consisten en un grupo de medicamentos que afectan el crecimiento de las células cambiando la transcripción de las proteínas celulares, lo que conlleva a desenredar el hilo del ADN de modo que algunos genes antitumorales se activen con la finalidad de que células resistentes al tratamiento se vuelvan más sensibles a la terapia. El fármaco que se está utilizando es Vorinostat, el cual ha demostrado poseer actividad citotóxica sinérgica con inhibidores del proteosoma (bortezomib) en las células del mieloma.
Trasplante de médula ósea. Los pacientes que son candidatos a trasplante (edad < 60 años, mieloma de novo; sin insuficiencia renal terminal; con un índice de proliferación de células plasmáticas mayor del 3% y con alteraciones cromosómicas adversas como presencia de delección del cromosoma 13, hipodiploidía, t (4; 14) y t (4; 16)), se utilizan tratamientos más intensivos que incluye quimioterapia a dosis elevadas, seguidas de rescate con progenitores hematopoyéticos. El trasplante alogénico tiene como limitaciones la edad y la disponibilidad de un donante compatible, lo cual lo hace accesible a una minoría de los pacientes. El porcentaje de remisiones completas se sitúa alrededor del 40-60%, sin embargo la mortalidad durante el primer año postrasplante es de un 30 y 50%, con una probabilidad de recaída del 45% a los 5 años del trasplante. Estos resultados han mejorado con el denominado “mini-alotrasplante” o trasplante con acondicionamiento de intensidad reducida (TIR), lográndose remisiones completas de un 73% y una mortalidad asociada al procedimiento del 20%. La principal complicación de este tipo de trasplante es la enfermedad injerto contra huésped (EICH) aguda o crónica, que afecta al 45 y al 55% de los pacientes respectivamente.
La otra modalidad de trasplante es el trasplante autólogo; realizado a partir de progenitores hematopoyéticos obtenidos de sangre periférica, con la ventaja que puede aplicarse a un mayor número de pacientes, ya que no precisa de donantes compatibles, la edad se amplía hasta 65 años y no cursan con enfermedad injerto contra huésped (EICH). Se logran tasas de respuestas alrededor de 80% y lo más importante remisiones completas de un 25-40% y una menor mortalidad asociada al procedimiento (<5%), por lo que se considera este tipo de trasplante como el tratamiento estándar del mieloma múltiple en primera línea. De hecho, con la finalidad de mejorar los resultados, se ha propuesto la realización de dos autotransplante consecutivos (trasplante en tándem), logrando incrementar la sobrevida libre de progresión y sobrevida global cuando es comparado con pacientes que recibieron un solo trasplante.
CRITERIOS DE RESPUESTA (IMWG)
El internacional working myeloma Group, ha establecido como criterios de respuesta en mieloma múltiple, los siguientes:
Respuesta completa rigurosa
1. Cumple criterios de respuesta completa (RC)
2. Ratio de cadenas ligeras libres (FLC) normal
3. Ausencia de células clonales en MO por inmunohistoquímica o inmunofluorescencia.
Respuesta completa
1. Inmunofijación negativa en suero y orina
2. Desaparición de cualquier plasmocitoma en tejidos blandos
3. Número de células plasmáticas en médula ósea <5%.
Respuesta parcial muy buena
1. Componente M detectable en suero y orina por inmunofijación pero no en electroforesis.
2. Educción de > 90% del componente monoclonal sérico y nivel de componente monoclonal en orina <1mg/24 horas.
Respuesta parcial
1. Reducción > 50% de componente monoclonal en suero y del componente monoclonal en orina de 24 horas >90% o <200 mg/24 horas
2. Si el componente monoclonal es suero y orina no es medible, se requiere una disminución > 50% en la diferencia entre los niveles de cadenas ligeras libres (FLC) en sustitución del criterio de componente monoclonal.
3. Si el componente monoclonal en suero y orina no es medible, y el nivel de cadenas ligeras libres (FLC) tampoco es medible, se requiere una disminución < 50% de las células plasmáticas (CPs) si el valor basal fue > 30% en MO, en sustitución del criterio del componente monoclonal, si existían plasmocitomas se requiere una reducción < 50% de su tamaño.
Respuesta estable
No cumple criterios de: respuesta completa, muy buena respuesta parcial, respuesta parcial o enfermedad progresiva.
Enfermedad progresiva .Requiere uno o más de los siguientes criterios:
1. Incremento de > 25% del valor basal en:
2. Componente monoclonal en suero > 0.5 g/dl
3. Componente monoclonal en orina > 200 mg/24 h
4. Pacientes sin niveles de proteína monoclonal en suero y orina: la diferencia entre el nivel de cadenas ligeras libres (FLC). El valor absoluto >10 mg/dl.
5. Porcentaje de células plasmáticas (CPs) de médula ósea: el valor absoluto deberá ser > 10%
6. Desarrollo de nuevas lesiones óseas o plasmocitoma de tejido blando o incremento en el tamaño de las lesiones óseas o de los plasmocitomas.
7. Desarrollo de hipercalcemia (calcio corregido >11.5 mg/dl o 2.65 mmo/l que pueda ser atribuido únicamente a enfermedad).
Recaída clínica. Requiere uno o más de los siguientes criterios:
1. Indicadores directos de incremento de la enfermedad y/o disfunción de órganos (CRAB):
Desarrollo de nuevos plasmocitomas de tejidos blandos o lesiones óseas
Incremento en el tamaño de plasmocitomas o lesiones óseas, definido como un aumento del 50% o al menos un (1) cm medido seriadamente por la suma del producto de los diámetros de la lesión.
Hipercalcemia >11.5 mg/dl (2.65 mmo/l
Descenso de la cifra de hemoglobina de > 2g/dl
Creatinina sérica > 2.
2. Uno o más de los siguientes criterios: reaparición de la proteína monoclonal en orina o suero por inmunofijación o electroforesis, desarrollo de > 5% de células plasmáticas (CPs) en médula ósea, aparición de cualquier otro signo de progresión.
Otras medidas. Los plasmocitomas solitario óseo y extraóseo se tratan con radioterapia local, dosis de aproximadamente 40 Gy. Si cursa con plasmocitomas múltiples está indicada terapia inmunomoduladora, antiangiogénica y/o antineoplásica. No se recomienda el uso de antineoplásicos en pacientes con gammapatía monoclonal de significado incierto o mieloma indolente.
BIBLIOGRAFÍA
Aquatella G de, Rojas M G, Arrededondo G A y Noguera M C. Manual de quimioterapia. 1a ed. Caracas: Editorial Arte, 1982.
Anagnostopoulus et al. Prognostic factors for elderly myeloma patients. Eur J Haematology 2005; 75: 370-5
Bertrand C, Kimby E. Hematologic malignancies from clinical science to clinical practice. Le Meridien Park Atlantic Lisboa. 2005
D´Sa S, Harousseau JL, Miguel J. International uniform response criteria for multiple myeloma. Br J Haematol 2007; 137(1):49-63
Durie BGM. A clinical staging system for multiple myeloma. Cancer 1975; 36: 842-54
Durie BG, Harousseau JL, Miguel JS, Blade J, Barlogie B, Anderson K, Gertz M, Dimopoulus M et al. International uniform response criteria for multiple myeloma. Leukemia. 2006 Dec; 20(12):2220.
Grezegonz S, Nowakoski; Thomas E. Witzig; David Dingli et al. Blood 2005; 106; (7): 2276-9
Hippe et al. Nordic myeloma study group, 15 years. Review article. Eur J Haematology 2005; 74: 185-93
Jerome M, Bernard K, Regis B, Geraldine D. A high-risk signature for patients with myeloma established form the molecular classification of human myeloma cell lines. Haematologica 2011; 96: 574-582
Minarik J, Scudla V, Ordeltova M. Prognostic significance of apoptotic index in multiple myeloma patients treated by convencional therapy and novel agents, thalidomide and bortezomib. Eur J Haematol 2009; 83: 528-34
Nohai Sahara, Michio Hiara, Takaaki Ono et al. Multiple myeloma expressing CD19, CD56-phenotype. Am J Haematology 2000; 64:311-33
Palumbo et al. Thali-Dex as salvage regimen. Eur J Haematology 2005; 75: 391-5
Roodman DG. Skeletal Imaging and Management of Bone Disease. Hematology 2008; 2008:313-319
Raja KRM, Kovorova L, Hajek R. Review of phenotypic markers used in flow cytometric analysis of MGUS and MM, and applicability of flow cytometric in other cell disordes. Br J Heamatol 2010; 149:3-351
Reece DE. Management of multiple myeloma: the changing Landscape. Blood 2007; Reviews; 21(6):301-14
Schütt et al. Thalidomide and VED for myeloma patients. Eur. J Haematology 2005; 74: 40-6
Sarasquete M, Gutierrez N, Paiva B,Chillón M et al. Upregulation of Dicer is more frequent in monoclonal gammaopathies of undertemined significance than in myeloma multiple patients and is associated with longer survival in symptomatic myeloma patients. Haematologica 2011; 96: 468-471
Tohami T, Drucker E, Shapiro H, Radnay J, Lishner M. Overexpression of tetraspanins affects multiple myeloma cell survival and invasive potential. The FASB Journal 2007; 2:691-99
Yuan X, Tiedemann, Chang X, Yin H, Bruins L, Braggio E et al. RNAa screen druggable genome identifies modulators of proteasome inhibitor sensitivity in myeloma inclunding CDK5. Blood 2011; 117: 3847-3857
Zangari M, Yaccoby S, Pappa L, Cavalo F et al. A prospective evaluation of the biochemical, metabolic, hormaonal and structural bone changes associated with borteomib response in multiple myeloma patients. Hematologica 2011; 96: 333-336