La cetoacidosis diabética es una situación clínica producida por un déficit absoluto o relativo de insulina, que implica un alto riesgo de mortalidad en pacientes diabéticos. La enfermedad presenta elementos fisiopatológicos característicos y esenciales para el adecuado tratamiento y control de esta entidad. Se presenta una revisión del tema dirigida al personal de la salud con el propósito de contribuir al conocimiento general sobre el tema.
En ausencia de insulina, el acetato es convertido predominantemente en ácido acetoacético y beta-hidroxibutírico. Durante el metabolismo normal, la relación beta-hidroxibutirato/acetato es de 1:1, existiendo muy poca cantidad de acetona. En la deficiencia de insulina, el nivel de los tres cuerpos cetónicos puede aumentar dramáticamente, y la relación beta-hidroxibutirato/acetato cambiar a más de 10:1.
Las células del organismo, excepto las del sistema nervioso central, pueden metabolizar los ácidos grasos y los cuerpos cetónicos. Normalmente, la grasa es la mayor fuente de energía del organismo. En la cetoacidosis diabética, sin embargo, la producción de cetoácidos excede la capacidad de su metabolización. Tal incremento de producción es el factor más importante en el desarrollo de la cetoacidosis.
Puesto que el pK del ácido acetoacético es 3,58 y el pK del ácido β-hidroxibutírico de 4,39, estos ácidos están completamente ionizados en los fluidos orgánicos. Por cada molécula formada, se libera un catión hidrógeno para ser neutralizado. La cantidad de catión hidrógeno que se forma oscila entre 1.000 y 2.000 nanomoles por día. Esto se refleja en una progresiva reducción del bicarbonato y del pH sanguíneo. Se produce hiperventilación compensadora que origina respiración de Kussmaul. El umbral renal para los cuerpos cetónicos es aparentemente bajo y el incremento de los niveles hemáticos determina una rápida excreción de estas sustancias en la orina, que se pueden eliminar a razón de 60 gramos o más por día.
La acetona, formada por descarboxilación no enzimática del ácido acetoacético, también circula en gran cantidad (más de 12 mmol/l), y aunque es responsable del característico olor a manzana podrida del aire espirado por el paciente, no contribuye al descenso del pH.
Trastornos hidroelectrolíticos
El desarrollo de deshidratación y depleción de sodio en los estados hiperglucémicos es el resultado de un aumento del volumen urinario y de la pérdida de electrolitos. La hiperglucemia produce una diuresis osmótica en la cetoacidosis diabética. En esta situación, la excreción de cetoaniones urinarios sobre una base equimolar es generalmente menos de la mitad de la glucosa. La excreción de cetoaniones, que obliga a la excreción de cationes urinarios tales como sodio, potasio y sales de amonio, también contribuye a la diuresis de solutos.
Otros factores que pueden contribuir a la excesiva pérdida de volumen incluyen el uso de diuréticos, fiebre, diarrea y nauseas y vómitos. La diuresis osmótica promueve la pérdida neta de múltiples minerales y electrolitos (Na, K, Ca, Mg, Cl, y PO4). Aunque algunos de estos pueden ser reemplazados rápidamente durante el tratamiento, otros requieren días o semanas para restaurar las pérdidas y obtener un adecuado balance.
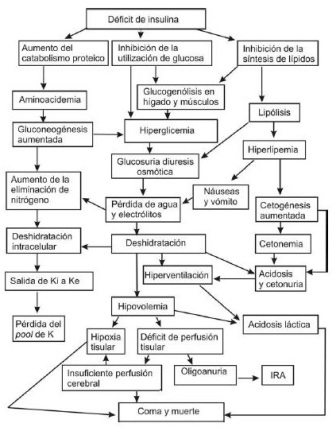
ESQUEMA GENERAL DE LA FISIOPATOGENIA DE LA CAD:
CUADRO CLÍNICO:
El cuadro clínico de la CAD, sustentada sobre las descompensaciones metabólicas previamente dichas, se desarrolla en un periodo de horas a unos pocos días. Los pacientes afectos de CAD grave clásicamente se presentan con letargia y un patrón de hiperventilación característica consistente en respiraciones profundas y lentas (respiración de Kussmaul) asociado con un característico olor a manzanas podridas (aliento cetónico). El paciente presenta un estado de deshidratación e hipovolemia (secundaria a diuresis osmótica inducida por la hiperglicemia), por lo que al inicio hay polidipsia (puede estar ausente en los ancianos), poliuria, anorexia y vómitos.
El dolor abdominal es menos frecuente, pero puede adquirir tal intensidad que justifique la sospecha de abdomen agudo, sobre todo en niños. Como puede observarse sensibilidad anormal, defensa, disminución de los ruidos hidroaéreos y leucocitosis, sin padecimiento intraabdominal manifiesto, es obligada la evaluación ininterrumpida de la causa del dolor durante el curso del tratamiento. Aunque la causa no ha sido dilucidada, la deshidratación del tejido muscular, el enlentecimiento del vaciamiento gástrico y el íleo inducido por los disturbios electrolíticos y la acidosis metabólica se han implicado como causas posibles del dolor abdominal.
Importa destacar la frecuencia de pancreatitis aguda en adultos con cetoacidosis diabética, posibilidad que debe ser considerada. Otras causas de abdomen agudo quirúrgico en diabéticos descompensados son la apendicitis y el empiema vesicular. Se cita también como origen del dolor abdominal el agrandamiento hepático secundario a una diabetes prolongada y no controlada. El hígado está habitualmente infiltrado por grasa y glucógeno, y la causa presumible del dolor es la distensión de la cápsula hepática. Las pruebas de función hepática están mediana o considerablemente alteradas y tanto la función como el volumen hepáticos retornan a lo normal solo gradualmente después de la terapéutica.
En general, la mayoría de los pacientes presentan taquicardia, pero la presión arterial habitualmente es normal. La hipotensión es un signo de mal pronóstico y en general se asocia con oliguria. La hipotermia puede estar presente de forma que las infecciones pueden no manifestar fiebre.
Lentamente se evidencian somnolencia y progresión a un estado precomatoso por edema cerebral. Ese estado de obnubilación es entrecortado por episodios de agitación. Posteriormente se instala el coma. Los cambios neurológicos se correlacionan con el grado de hiperosmolaridad. Se asume que los pacientes obnubilados o comatosos tienen una osmolaridad plasmática superior a 330 mosm/l. Cuando un paciente con una osmolaridad plasmática de alrededor de 300 mosm/l está obnubilado o en coma, la alteración del sensorio debe atribuirse a otra causa neurológica más que a la cetoacidosis. El diagnóstico diferencial de la encefalopatía de la cetoacidosis diabética incluye: síndromes tóxicos (etanol, metanol, salicilatos, narcóticos, sedantes), traumatismo de cráneo, otros trastornos metabólicos (hipoglucemia, uremia, coma hiperosmolar), infecciones del sistema nervioso central y accidentes cerebrovasculares.
DIAGNÓSTICO DE LABORATORIO
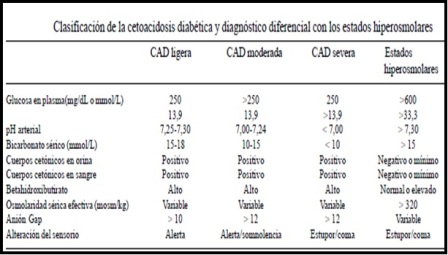
Glucemia. La hiperglucemia define al coma cetoacidótico. En general oscila entre 250 (13,9 mmol/L) y 800 mg/dl, pero en circunstancias extremas alcanza valores de hasta 1.500 mg/dl. Aproximadamente el 15% de los pacientes con cetoacidosis diabética tienen valores de glucosa < 350 mg/dl al ingreso. Esto se observa cuando la gluconeogénesis está dificultada (enfermedad hepática, ayuno prolongado, intoxicación alcohólica aguda) o cuando la utilización de la glucosa es muy alta (embarazo). La determinación de la hemoglobina glicosilada puede brindar una información útil sobre el grado de control metabólico.
Osmolaridad. Es característico del coma cetoacidótico un aumento de la osmolaridad plasmática. La osmolaridad efectiva normal de los líquidos biológicos es de 285 mOsm/l. La osmolaridad efectiva se calcula con la fórmula = 2(Na+) + (glucosa mg/dl)/18. Si la osmolaridad de un paciente con cetoacidosis diabética es de 314 mOsm/l (o sea 29 mosm/l por encima de lo normal), esto representa un incremento del 10% en la concentración de solutos, o aproximadamente un 10% de decremento en el agua total del organismo. Si el agua total calculada normal es de 40 litros, una pérdida del 10% equivale a cuatro litros, asumiendo que no se ha producido ninguna pérdida de solutos, lo cual obviamente no es así en la cetoacidosis. Otra variante es calcular de forma directa el déficit de H2O = 0,6 x Kg (1-140/ Na paciente).
Cuerpos cetónicos. Se puede obtener una determinación semicuantitativa de cuerpos cetónicos en suero o plasma en forma rápida con el empleo de tabletas de nitroprusiato o con tiras reactivas. Una fuerte reacción positiva para cuerpos cetónicos en suero no diluido en un paciente con pH por debajo de 7,25 y glucosuria franca es suficiente evidencia de cetoacidosis diabética. Debe recordarse, sin embargo, que la reacción del nitroprusiato permite detectar ácido acetoacético y acetona, pero no ácido beta-hidroxibutírico.
En situaciones en las cuales la cetoacidosis diabética se acompaña de acidosis láctica, una reacción escasamente positiva puede no reflejar la magnitud de la cetonemia, puesto que la alteración del potencial redox favorece la conversión del ácido acetoacético en beta-hidroxibutírico. Valores diagnósticos de cetonemia grave pueden determinarse con un ácido beta-hidroxibutírico > 3mmol/l. La determinación de la cetonuria se realiza con el reactivo de Imbert (++ a ++++) mide la reacción del ácido acetoacético con nitroprusiato, con falsos positivos cuando se usan medicamentos como captopril, n-acetilcisteína y penicilamina, y falsos negativos cuando se usa vitamina C.
Hemograma. Frecuentemente existe leucocitosis con desviación a la izquierda, incluso sin infección. La elevación del hematocrito y de la hemoglobina son concordantes con la magnitud de la deshidratación.
Sodio. Habitualmente el coma diabético cetoacidótico cursa con hiponatremia, la cual puede ser secundaria a:
1. Elevación significativa de la glucosa en el plasma. Puesto que la glucosa está restringida al espacio extracelular, un incremento de su concentración moviliza agua desde el interior de la célula, por efecto osmótico, generando una dilución del espacio extracelular. Se ha estimado que por cada 100 mg/dl de aumento de la glucosa por encima de 100 mg/dl, se debe prever un descenso de 1,6 mEq/l del sodio. Se debe tener presente que el grado de hiponatremia causado por un determinado nivel de hiperglucemia es dependiente del volumen previo del espacio extracelular, siendo mayor la hiponatremia en los pacientes previamente deshidratados.
2. Seudohiponatremia por hiperlipidemia. La hipertrigliceridemia puede desarrollarse en el coma cetoacidótico como consecuencia de la disminución de la actividad de la lipoproteinlipasa secundaria a los bajos niveles de insulina. El aumento de los lípidos en el plasma provoca un desplazamiento del agua, que de su valor normal del 94,5% puede descender hasta el 75%. En presencia de altas concentraciones de una sustancia que desplaza el agua existen discrepancias importantes y variables entre la medida obtenida y la concentración real de sodio en la fase acuosa, cuando la misma se determina por fotometría de llama. En estos casos se puede obtener el valor real utilizando un electrodo ión-específico para la medición, o utilizando la fórmula: Na corregido = Na medido +0,016 x (glucosa en mg/dl-100).
3. Hiponatremia verdadera, atribuible a una pérdida significativa de sodio con la orina por la diuresis osmótica. Si, a pesar de la hiperglucemia, la concentración de sodio es normal o aún elevada, esto indica un grado mayor de pérdida de agua. Esto es más característico del coma diabético hiperosmolar no cetogénico.
Potasio. A pesar de la gran depleción de potasio, la concentración plasmática del catión es normal o está elevada en el momento del ingreso. La presencia de hiperosmolaridad secundaria a la hiperglucemia en el fluido extracelular conduce a la derivación de agua y de potasio desde el espacio intracelular al espacio extracelular. Esta salida de potasio está exagerada por la acidosis y por la presencia de catabolismo proteico. Por otra parte, la entrada de potasio a la célula está disminuida como consecuencia de la insulinopenia. El resultado neto de todos estos factores es un cambio marcado en el balance interno de potasio. La pérdida excesiva de potasio con la orina es responsable del desarrollo de depleción de potasio. La pérdida urinaria de potasio se produce como consecuencia de los efectos de la diuresis osmótica que conduce a un aumento de la oferta de fluidos y de sodio a los sitios secretores de potasio en el nefrón distal.
El hiperaldosteronismo secundario consecuente a la depleción de sodio y la presencia de cetoaniones cargados negativamente en el fluido tubular aumentan aún más las pérdidas de potasio. Inmediatamente después de iniciar una terapéutica adecuada, el potasio sérico disminuye, en algunas ocasiones en forma brusca, a causa de la pérdida urinaria continuada del catión, la dilución del espacio extracelular, la corrección de la acidosis y la reentrada de potasio al interior de la célula producida por la insulina.
En informes previos se admitía que el déficit de potasio era de aproximadamente 5 mEq/kg en la cetoacidosis diabética. Estudios más recientes indican que en ciertos casos puede existir un déficit mucho mayor, del orden de los 10 mEq/kg. Durante el tratamiento de la cetoacidosis diabética se debe realizar la determinación seriada de las concentraciones de potasio sérico. Aunque el electrocardiograma no refleja cuantitativamente su nivel, el monitoreo continuo así como la respuesta de los reflejos tendinosos profundos son una manera adecuada de seguir los cambios del catión durante el tratamiento.
Fosfato. Al igual que el potasio, el nivel inicial de fosfato en la cetoacidosis diabética puede ser alto o normal-bajo, a pesar de la depleción del fosfato total. Las complicaciones potenciales de la hipofosfatemia severa incluyen disminución del volumen minuto cardiaco, debilidad de los músculos respiratorios, rabdomiolisis, depresión del sistema nervioso central, convulsiones, coma, insuficiencia renal aguda y anemia hemolítica. Como resultado de la hipofosfatemia, se produce una marcada deficiencia del 2,3- DPG intraeritrocitario, lo cual puede alterar la liberación de oxígeno hacia los tejidos.
Urea y creatinina. La mayoría de los pacientes con CAD presentan una elevación de la tasa de urea en sangre en el momento de la internación, lo cual refleja un incremento en el catabolismo proteico y una disminución de la función renal secundaria a la deshidratación y al compromiso circulatorio. Algunos autores otorgan valor pronóstico al nivel de urea plasmática y consideran que niveles por encima de 80 mg/dl son un índice desfavorable. Los niveles de creatinina se encuentran falsamente elevados debido a la deshidratación y a la interferencia de los cuerpos cetónicos con la técnica habitual de determinación de creatinina (Jaffe).
Estado ácido base. En la cetoacidosis diabética, el origen de los iones hidrógeno en exceso son los cetoácidos formados durante el proceso del metabolismo intermedio en ausencia de insulina. El grado de acidemia, determinado por el descenso del pH, depende por una parte de la gravedad del trastorno metabólico y por otra de la eficiencia de los mecanismos de compensación. En la acidosis moderada, el bicarbonato plasmático está por debajo de 15 mmol/l y en la acidosis grave puede ser menor de 2 mmol/l. La hiperventilación compensadora desciende los niveles de la PaCO2 a valores comprendidos entre 10 y 25 mm Hg.
Anión gap. Aunque la cetoacidosis diabética es una típica acidosis metabólica con anión gap elevado en la cual el incremento en los aniones no mensurados es habitualmente equivalente a la reducción en la concentración de bicarbonato, muchos pacientes pueden desviarse de esta patente y desarrollar una hipercloremia. Recientemente la acidosis metabólica de la cetoacidosis diabética se ha visto asociada con acidosis metabólica hiperclorémica y, en casos extremos, puede ir acompañada de un anión gap normal. El grado variable de hipercloremia en la cetoacidosis parece estar determinado por la magnitud del déficit de fluidos que se desarrolla. Aquellos pacientes que mantienen una buena volemia y filtración glomerular, excretan los aniones cetoácidos en la orina con sodio y potasio, y aumentan la reabsorción de cloruro, produciendo hipercloremia.
Otros mecanismos que contribuyen al desarrollo de acidosis hiperclorémica incluyen:
1) infusión de fluidos endovenosos que contienen cloro en concentraciones que exceden la concentración plasmática del anión,
2) expansión de volumen con líquidos que no contienen bicarbonato,
3) pasaje intracelular del bicarbonato durante la corrección de la cetoacidosis. La administración de fluidos conteniendo cloruro de sodio puede contribuir a la acidosis metabólica sólo por un efecto dilucional sobre la concentración plasmática de bicarbonato.
Muchos pacientes con CAD presentan un anión gap superior a 20 mEq/l, aunque en algunos puede ser superior a 40 mEq/l. Sin embargo, en algunos sujetos puede aparecer una acidosis metabólica hiperclorémica sin un anión gap significativamente alto. Habitualmente los niveles de cloro no son útiles, indicando los niveles de cloro elevados una situación de cetoacidosis más crónica o en fase de recuperación. Habitualmente se utiliza la siguiente fórmula para calcular el Anión GAP = (Sodio + potasio) - (Cloro + Bicarbonato)
El diagnóstico diferencial se realiza con pacientes que presentan acidosis con anión gap aumentado:
1. Cetosis de ayuno.
2. Cetoacidosis alcohólica.
3. Acidosis láctica.
4. Uremia.
5. Ingestión de tóxicos.
COMPLICACIONES
En muchos casos, la evolución fatal de la cetoacidosis diabética debe atribuirse a una enfermedad de base grave, tal como el infarto de miocardio, la sepsis o la pancreatitis aguda. Fuera de estas condiciones, se han descripto otras complicaciones específicas del coma cetoacidótico.
Shock. Puede desarrollarse como consecuencia de la hipovolemia acentuada, la reducción de la contractilidad miocárdica secundaria a la acidosis y, probablemente, la disminución de la resistencia periférica. En pacientes con hipotensión arterial se debe colocar un catéter intravenoso, a través del cual se infundirán cantidades elevadas de solución salina isotónica, plasma, sangre o expansores plasmáticos. La corrección de la acidosis es indicación formal en pacientes con cetoacidosis y shock.
Edema cerebral. Se ha destacado la evolución particular de ciertos comas cetoacidóticos en pacientes jóvenes, en los cuales se desarrolla un edema cerebral fatal a pesar de la terapéutica correcta y de una evolución inicial en apariencia favorable. Particularmente susceptibles a las complicaciones intracerebrales son los pacientes sin diagnóstico previo y los niños menores de cinco años. El coma cetoacidótico que preludia este accidente no tiene ningún carácter particular. Se ha comprobado que en los niños que el desarrollo de edema cerebral luego del tratamiento del coma cetoacidótico, es más frecuente cuando exista al ingreso un nivel de urea elevado y una PaCO2 baja.
El tratamiento con bicarbonato sería otro factor predisponente para el desarrollo de edema cerebral. El proceso se desarrolla en el curso del tratamiento, en general seis a 12 horas después de iniciado, en el momento en que la evolución parece favorable y las anomalías biológicas se encuentran en regresión. Las células cerebrales mantienen el volumen en la etapa de hiperosmolaridad extracelular por la producción enzimática de osmoles ideogénicos, que evitan una mayor deshidratación celular. Estos osmoles no pueden ser disipados rápidamente, de modo que si se produce una disminución rápida de la osmolaridad intravascular, se produce un brusco paso de agua al interior de las células. Durante el tratamiento del coma cetoacidótico, la reducción de la glucemia lleva a un progresivo decremento de la osmolaridad plasmática que favorece el pasaje de agua al espacio intracelular.
La insulina por su parte facilita la entrada de partículas osmóticamente activas al interior de las células. Una ulterior reducción de la osmolaridad plasmática por un excesivo reemplazo de agua también puede contribuir al desarrollo de edema cerebral. Se debe tener en cuenta, por otra parte, que el edema cerebral puede estar relacionado con isquemia cerebral. Esto explica porque el edema cerebral es más común en niños que en adultos, ya que el cerebro infantil tiene mayores requerimientos de oxígeno y es más susceptible a la isquemia.
El cuadro se traduce por una agravación, a veces extrema, de los trastornos de conciencia en un paciente en el que no existe colapso cardiovascular, hipoglucemia ni alteraciones hidroelectrolíticas mayores. El contraste entre la mejoría de los signos biológicos y la agravación del estado clínico representa un elemento dominante. Los signos neurológicos reflejan un sufrimiento cerebral difuso. A veces precedido de cefaleas y de obnubilación, el coma se acompaña habitualmente de signos de lesión del tronco cerebral: trastornos pupilares bilaterales con midriasis paralítica y signo de Babinski bilateral. La ligera rigidez de nuca y el edema de papila bilateral expresan cierto grado de hipertensión endocraneana.
Los trastornos neurovegetativos, ligados al sufrimiento del tronco cerebral, llaman la atención por su extrema gravedad: edema agudo de pulmón, paro respiratorio, colapso cardiovascular secundario, trastornos del ritmo cardíaco, diabetes insípida y trastornos de la regulación térmica.
El hallazgo anatomopatológico más importante es la presencia, en todos los casos, de un edema cerebral importante, asociado a grados variables de lesión neuronal degenerativa. Los procedimientos preventivos que pueden disminuir el riesgo de edema cerebral son un reemplazo gradual de los déficits de agua y de sodio en los pacientes que presentan hiperosmolaridad, y la adición de glucosa a la solución de hidratación cuando la glucosa en sangre alcanza los 250 mg/dl. En presencia de signos de edema cerebral, se debe administrar en forma inmediata manitol en dosis de 1 g/kg en 20 minutos y mantener una infusión de manitol de 0,25 g/kg/hora para prevenir el aumento por rebote de la presión intracraneana. La infusión de rehidratación debe ser disminuida a la mitad hasta que la situación mejore. Al mismo tiempo puede ser necesario instalar asistencia respiratoria mecánica.
Infecciones. La infección es un acompañante común de la diabetes descompensada, pero sólo el 2% de los pacientes diabéticos con cetoacidosis mueren de esta complicación. Se debe realizar una investigación exhaustiva en búsqueda de un foco primario, en particular si existe fiebre. La neumonía, pielonefritis, colecistitis y septicemia son las formas más comunes de infección. Una infección rara que se asocia particularmente con la cetoacidosis es la mucormicosis, que es causada por un hongo del género Rhizopus. La mucormicosis comienza con dolor facial que es similar a la sinusitis, acompañado de descarga nasal sanguinolenta. Los síntomas subsecuentes incluyen edema orbital, visión borrosa y alteraciones de la conciencia. La muerte es segura si no se realiza tratamiento inmediato con anfotericina y resección quirúrgica de los tejidos involucrados.
Síndrome de dificultad respiratoria aguda (SDRA). El SDRA es una complicación rara pero potencialmente fatal del coma cetoacidótico. El SDRA ocurre durante el tratamiento del coma con reemplazo de fluidos y electrolitos y la administración de insulina, sugiriendo que el mismo es una complicación de la terapéutica más que de la diabetes por sí misma. La infusión rápida de cristaloides aumenta la presión capilar pulmonar y disminuye la presión oncótica. Ambos cambios favorecen la formación de edema en el pulmón, aun en presencia de una función cardíaca normal. En pacientes en los cuales se dispone de datos hemodinámicos, el Síndrome de dificultad respiratoria aguda (SDRA) se ha asociado con presiones de lleno normales o altas, volumen minuto cardíaco normal y disminución de la presión oncótica. Debido a que el factor más importante asociado con el desarrollo de Síndrome de dificultad respiratoria aguda (SDRA) es la excesiva infusión de fluidos, es prudente utilizar ritmos lentos de administración o reemplazo con albúmina en los pacientes con alto riesgo.
Trombosis vascular. La diabetes por si se asocia con varias anormalidades protrombóticas, incluyendo disfunción del endotelio vascular, elevación de los marcadores de activación de la coagulación y de los factores de coagulación, aumento en el PAI1, disminución de las proteínas anticoagulantes C y S e hiperactividad plaquetaria. En las crisis hiperglucémicas, la combinación de deshidratación severa, aumento de la viscosidad de la sangre, bajo volumen minuto cardiaco y estimulación de los mediadores protrombóticos por la hiperglucemia puede conducir a un estado hipercoagulable y a fenómenos tromboembólicos. Estudios de hace 30 años sugerían un aumento de la incidencia de enfermedad vascular oclusiva incluyendo infarto cerebral, infarto de miocardio, embolismo pulmonar, trombosis mesentérica y coagulación intravascular diseminada en el coma cetoacidótico. Con la introducción de la anticoagulación profiláctica con bajas dosis de heparina, y la agresiva hidratación inicial, la incidencia de estos fenómenos ha disminuido significativamente.
Rabdomiolisis. La rabdomiolisis es un síndrome clínico y bioquímico resultante de la destrucción de los miocitos y la liberación de su contenido celular en el plasma. Es un hallazgo frecuente pero poco conocido de las crisis hiperglicémicas. Los pacientes que se presentan con rabdomiolisis tienen niveles mayores de glucosa en sangre y de osmolalidad sérica en el momento de su ingreso. También presentan evidencias de disminuida función renal, con niveles elevados de urea, creatinina y beta2-microglobulina. En los ancianos, la presencia de rabdomiolisis se asocia con una mortalidad más elevada.
Pancreatitis. Se ha reconocido la existencia de pancreatitis aguda en el 10 al 15% de los casos de cetoacidosis diabética. La pancreatitis aguda en las crisis hiperglucémicas en general se asocia con una hipertrigliceridemia severa transitoria. La deficiencia de insulina promueve la lipolisis, con liberación de ácidos grasos libres. Con la inhibición de la lipoprotein-lipasa en los tejidos periféricos y el aumento de la liberación de ácidos grasos libres al hígado, se produce una severa hipertrigliceridemia. La pancreatitis aguda se reconoce más frecuentemente en pacientes con acidosis metabólica severa y altos niveles de glucosa en el momento de la presentación.
Fracaso renal agudo. Las causas más frecuentes sin duda son los factores prerrenales. Sin embargo factores postrenales también pueden verse, tales como la obstrucción al flujo urinario por atonía vesical, producida en pacientes comatosos además de poder presentar diversos grados de neuropatía diabética. En ocasiones pacientes con pielonefritis pueden desarrollar una necrosis papilar y un fracaso renal en el contexto de una necrosis tubular aguda.
CONDUCTA TERAPÉUTICA
I. Establecer el diagnóstico.
Si es incierto, administrar 50 ml de solución de dextrosa al 50% en agua después de obtener una muestra de sangre para los estudios de laboratorio.
Colocar una línea venosa para suministro de fluidos y obtención de muestras de sangre. Si el paciente está hipotenso o hipertenso, o si es un cardiópata o un anciano, conviene colocar un catéter en vena cava superior.
Realizar las siguientes pruebas de laboratorio: glucosa sérica, cuerpos cetónicos, sodio, potasio, cloro, calcio, estado ácido base, urea y creatinina, hematocrito, hemoglobina, recuento de glóbulos blancos, estudio de coagulación, hemocultivo y urocultivo, osmolalidad sérica, lactato y piruvato en sangre, amilasemia y amilasuria. Se deberán obtener, además, una radiografía de tórax y un electrocardiograma.
Si el paciente es un diabético conocido, establecer:
Dosis previa de insulina, momento de administración, tipo de insulina.
Episodios previos de cetoacidosis, cantidad de insulina requerida para su tratamiento.
Factores precipitantes posibles: omisión de insulina, infarto de miocardio, pancreatitis, infección.
Tiempo transcurrido desde la instalación del coma. Cuanto mayor es la duración del coma, peor es el pronóstico.
II. Establecimiento de una rutina de seguimiento.
Glucosa en sangre cada hora.
pH, PaCO2, potasio y sodio sanguíneo cada 2-4 horas.
Ingresos y egresos horarios.
Signos vitales, tan seguido como sea necesario.
Inserción de una sonda de Foley en caso de no existir diuresis espontánea. Realizar uroanálisis completo, urocultivo y determinación horaria de glucosa y cuerpos cetónicos.
Colocar sonda nasogástrica para descompresión del estómago.
La hipotermia o la temperatura normal es lo deseable en el paciente en coma cetoacidótico. Si existe hipertermia, se debe investigar la existencia de un foco infeccioso. Una vez obtenidas las muestras necesarias para los estudios bacteriológicos pertinentes, puede estar indicado el empleo de antibióticos.
III. Administración de fluidos y electrolitos.
1. Si hay hipotensión o shock, se administrará rápidamente un expansor plasmático, como dextrán, albúmina humana o sangre.
2. Si no existe hipotensión, y según el grado de deshidratación, la edad y el estado cardiovascular, se debe comenzar la infusión de una solución isotónica de cloruro de sodio. El uso de solución salina isotónica o hipotónica en el tratamiento de la cetoacidosis diabética continua controvertido, pero existe una opinión uniforme que el primer litro de solución de hidratación debe ser solución salina normal al 0,9%; administrada tan pronto como sea posible dentro de la primera hora, y seguida por 500-1.000 ml/h de solución al 0,45 o 0,9%, dependiendo del valor de sodio sérico corregido, durante la próximas dos horas. A partir de allí se continuará con un ritmo de 4 a 14 ml/kg/hora, dependiendo del estado de hidratación. El estado de hidratación puede ser estimado calculando la osmolaridad total y efectiva del plasma y calculando la concentración de sodio corregida.
En los niños se recomienda administrar 20 ml/kg de solución fisiológica en la primera una o dos horas para restaurar la perfusión periférica. El mantenimiento ulterior, para las próximas 22-23 horas, será de 1.000 ml para los primeros 10 kg, más 500 ml para los próximos 10 kg, más 20 ml/kg por encima de 20 kg. La ventaja principal de la rehidratación agresiva inicial es la restauración de un volumen circulante normal. Una ventaja adicional de este modo de terapéutica es que la rehidratación disminuye la concentración de numerosas hormonas contrarreguladoras, lo cual conduce a un aumento de la sensibilidad a la insulina. La rehidratación por sí disminuye la concentración de glucosa en sangre, por aumento de la excreción en orina así como por la dilución del espacio extracelular.
En pacientes con insuficiencia renal con oliguria o anuria, y en los pacientes que desarrollan el coma cetoacidótico en el curso de un infarto agudo de miocardio, se debe realizar un aporte muy controlado de fluidos, siendo recomendable en estos casos el control con catéter de arteria pulmonar.
3. Una vez obtenidos los datos de osmolalidad plasmática, se condicionará a ellos la administración de fluidos. Si no existe hiperosmolaridad, la solución salina normal se puede administrar sin riesgo. En presencia de hiperosmolaridad, se utilizará solución salina hipotónica (0,45%). En los pacientes estables hemodinámicamente, es recomendable utilizar soluciones hipotónicas para evitar el desarrollo de hipercloremia. En este sentido, cabe recordar que la concentración de cloruro en plasma es de 101 mEq/L, mientras que la solución fisiológica contiene 154 mEq/L.
4. El empleo de agentes alcalinizantes en pacientes con cetoacidosis diabética ha sido motivo de grandes controversias. Las mayores desventajas del tratamiento con bicarbonato incluyen la aceleración o el desarrollo de hipopotasemia, edema cerebral, aumento de la afinidad del oxígeno por la hemoglobina, con consiguiente hipoxia periférica y sobrecarga hídrica.
En adición, se ha postulado que produce una acidosis paradójica del líquido cefalorraquídeo (LCR), y una eliminación más lenta de los cetoaniones séricos. Algunos autores recomiendan no utilizar bicarbonato si el pH es mayor de 7,0. Para rangos de pH entre 6,9 y 7,0, recomienda administrar 44 mEq de bicarbonato de sodio, y cuando el pH es menor de 6,9, 88 mEq de bicarbonato. Debido a la hiperosmolaridad de la solución, se aconseja que el bicarbonato se administre diluido (100 mEq en 400 ml de H2O a 200 ml/hora). No es recomendable la administración en bolo rápido. En niños, el empleo de bicarbonato debe basarse en la condición de cada paciente en particular. Otras investigaciones recomiendan el empleo de bicarbonato sólo para la corrección de la acidosis metabólica con anión gap no aumentado, que se desarrolla como resultado de la pérdida de cetoácidos en la orina o por la excesiva administración de fluidos conteniendo cloruro. Este proceso sólo se desarrolla después de las primeras 24 horas de tratamiento y es razonable administrar bicarbonato cuando el pH permanece por debajo de 7,30 luego de la resolución del componente de cetoacidosis.
5. En algunos pacientes muy deshidratados, cuando la glucemia desciende a valores de 200 a 300 mg/dl, puede aparecer hipotensión y oliguria, a pesar de una hidratación aparentemente adecuada. Esto depende de un estado de shock latente, encubierto por la hiperosmolaridad, y se corrige con la infusión de coloides o expansores de volumen. El reemplazo de fluidos en la cetoacidosis diabética debe ser guiado por los mismos principios que son aplicables en otros estados de depleción de volumen, incluyendo la estimación del déficit inicial, las necesidades de mantenimiento y las pérdidas concomitantes de fluidos durante el tratamiento. Habitualmente, estos pacientes requieren la infusión de 6 a 10 litros de fluidos en las primeras 24 horas. El control clínico debe ir asociado a la determinación de la presión venosa central y a la evaluación de la diuresis horaria, que debe ser al menos de 30-60 ml/h, realizándose los ajustes necesarios en la magnitud de la infusión.
6. Se ha destacado la enorme pérdida de potasio en la cetoacidosis diabética y en el coma hiperosmolar, y la frecuencia con la cual se desarrolla hipopotasemia. De existir hiperpotasemia, la infusión precoz de potasio debe ser evitada. Las indicaciones para la infusión precoz de potasio, posible en presencia de un adecuado volumen minuto urinario, son: a) potasio sérico normal en el momento de la admisión, b) potasio sérico bajo, c) disminución del tamaño y la agudeza del pico de la onda T en ECG sucesivos o la aparición de ondas U positivas, d) debilidad muscular, en especial de los músculos respiratorios, e) arbitrariamente, al final de la tercera o cuarta hora de tratamiento adecuado, f) tan pronto como los niveles séricos de glucosa experimenten un descenso significativo, o g) cuando desaparece la glucosuria.
Se sugiere que si el valor inicial de potasio sérico es de 4 a 5 mmol/l, deben administrarse 20 mEq de potasio por hora; si el valor del catión es menor de 4 mmol/l inicialmente, se deben infundir 40 mEq por hora en las primeras dos horas y luego 20 mEq por hora; si el potasio desciende por debajo de 3,5 mmol/l al final de la primera hora de tratamiento, deben administrarse por lo menos 40 mEq por hora; y si el potasio es menor de 2,5 mmol/l, se deben suministrar 60 mEq por hora. En casos de hipopotasemia al ingreso, la terapéutica con insulina debe posponerse hasta que los niveles de potasio superen los 3,3 mmol/l. El objetivo es mantener el nivel de potasio sérico dentro de su rango normal de 4 a 5 mmol/l.
7. El fósforo, si es necesario, se puede administrar como sal de potasio. El déficit puede tener implicancia clínica dado el papel del fosfato en la síntesis celular de compuestos de alta energía. Secundariamente a la depleción de fosfato puede ocurrir hemólisis, y además el fosfato es necesario para restaurar los niveles de 2,3-DPG. Se ha descripto un síndrome de depleción de fosfato, asociado con debilidad, anorexia y malestar general.
El fosfato sérico aparece elevado tempranamente en la cetoacidosis, y sólo disminuye después que la reposición hidroelectrolítica y la insulina ejercen su efecto, por lo que no es necesario su empleo en la etapa inicial de rehidratación. Aunque el reemplazo de rutina de fosfato es innecesario en la cetoacidosis diabética, se debe realizar reemplazo en pacientes con una concentración sérica <1,5 mg/dl y en pacientes con hipofosfatemia moderada e hipoxia, anemia o compromiso cardiorrespiratorio concomitante.
La excesiva administración de fosfato puede producir hipocalcemia con tetania y calcificación de tejidos blandos. Si se requiere reemplazo de fosfato, se debe administrar fosfato de potasio 20-30 mEq/l en varias horas. En estos pacientes, debido al riesgo de hipocalcemia e hipomagnesemia, se debe realizar un control adecuado de los niveles de fosfato, magnesio y calcio durante la infusión.
8. Cuando la concentración de glucosa en sangre disminuye por debajo de 250 mg/dl, se debe adjuntar dextrosa a la solución de fluido de reemplazo. Esto se realiza con una solución de dextrosa al 5% en la mayoría de los casos. Ello permite la administración continua de insulina hasta que se controle la cetogénesis, evitando a su vez la rápida corrección de la hiperglucemia, que se puede asociar con el desarrollo de edema cerebral, en particular en los niños.
IV. Administración de insulina intravenosa.
Aunque la resucitación con fluidos permite tratar prácticamente todas las anormalidades metabólicas del coma cetoacidótico, incluyendo la hiperglucemia, sólo la insulina permite corregir la acidosis con anión gap elevado. El objetivo primario de la terapéutica con insulina es revertir la cetogénesis, suprimir la lipolisis, e inhibir la gluconeogénesis hepática. La insulina también disminuye la osmolaridad plasmática efectiva aumentando la permeabilidad celular a la glucosa. Se deben tener varias precauciones, sin embargo, al iniciar la terapéutica con insulina. La terapéutica con insulina no se debe iniciar en pacientes con hipotensión y severa hiperglucemia hasta no haber logrado la resucitación volumétrica.
La insulina aumenta el transporte intracelular de glucosa con el resultante pasaje de líquidos desde el espacio extracelular al intracelular. Pueden pasar de dos a tres litros hacia el compartimento intracelular, aumentando el riesgo de shock hipovolémico y tromboembolismo en presencia de una resucitación inadecuada. Debido a que la insulina media la reentrada de potasio hacia el compartimento intracelular, la misma puede producir hipokalemia grave y debe ser evitada en pacientes que están hipokalémicos a la presentación (potasio inferior a 3,3 mEq/L) hasta que el reemplazo de potasio sea adecuado. La administración de insulina en estos casos puede producir arritmias, deterioro de la función cardiovascular, debilidad muscular e insuficiencia ventilatoria.
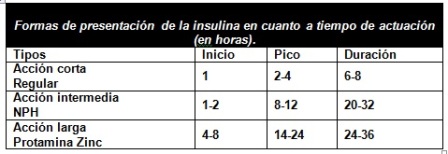
La terapia con insulina se inicia con un bolo intravenoso de 0,15 U/Kg o 10 U de insulina corriente, seguido por una infusión intravenosa de insulina a un ritmo de 0,1 U/kg/h. (5 a 10 U/hora en adultos). Esto resulta en concentraciones de insulina séricas suprafisiológicas, lo cual es adecuado para suprimir la cetogénesis, la gluconeogénesis y la lipolisis. Como la sensibilidad a la insulina disminuye con la edad, los ancianos tienden a requerir más insulina durante el manejo agudo de la hiperglucemia.
Los regímenes de infusión continua por vía intravenosa de dosis bajas de insulina son tan efectivos como las dosis altas de insulina para reducir la glucemia y corregir la acidosis en la cetoacidosis. En adultos, no se ha comprobado que este régimen se asocie con una menor incidencia de hipoglucemia, hipopotasemia, hipofosfatemia y edema cerebral, cuando se comparó con los regímenes de dosis altas intermitentes. La principal ventaja del método es que requiere un contacto frecuente con el paciente y la determinación horaria de la glucemia. En las unidades de cuidados intensivos, la insulina se debe administrar en forma intravenosa en la fase inicial de la terapéutica. Las inyecciones intramusculares o subcutáneas pueden ser mal absorbidas en pacientes deshidratados y pueden producir depósitos tisulares.
En adición, en presencia de complicaciones (hipoglucemia, hipopotasemia), la infusión intravenosa puede ser detenida, con rápida reversión de su efecto, ya que la vida media de la insulina es de tres a cinco minutos. La administración intravenosa debe ser realizada por infusión continua y no por bolos intermitentes, ya que estos determinan una estimulación de la liberación de las hormonas contrarreguladoras. La dosis de carga de insulina también es innecesaria en vista de la rapidez con que la misma alcanza un nivel estable con la infusión. Sin embargo, es recomendable administrar una dosis inicial de 10 a 20 U de insulina cristalina para saturar los receptores; continuando con una infusión continua con las dosis preestablecidas. En niños, la dosis a utilizar es de 0,1 U/kg/hora. Se debe establecer el valor de glucosa en sangre en forma horaria. Si la glucosa no disminuye al menos 50 mg/dl en la primera hora se debe duplicar la dosis de insulina en forma horaria hasta que se verifique el descenso a un ritmo horario de 50 a 70 mg/dl.
Los pacientes con cetoacidosis rara vez tienen resistencia insulínica. La incapacidad para responder a dosis de 5 a 7 U/hora debe sugerir infección asociada o persistencia del estado de deshidratación o hipovolemia. El error que más frecuentemente se comete en el tratamiento de la cetoacidosis diabética es la discontinuación prematura de la insulina cuando los niveles de glucosa disminuyen a 200- 250 mg/dl. Como ya se ha descrito, el propósito principal de la terapéutica con insulina no es disminuir los niveles de glucosa sino corregir la acidosis. Por lo tanto, los pacientes deben seguir recibiendo insulina intravenosa hasta que hayan resuelto el anión gap. Esto puede requerir la adición de glucosa a los fluidos de hidratación, o disminuir levemente la infusión de insulina, a fin de que no se produzca hipoglucemia. Puesto que en estas circunstancias la utilización de glucosa es de 5 a 10 g/hora, se debe administrar a esta concentración para evitar los descensos. Si con ello la concentración de glucosa tiende a aumentar, conviene reducir la administración; si por el contrario continúa disminuyendo, es que se requiere una cantidad adicional de la misma. B. Administración de insulina por vía intramuscular en dosis bajas.
Se ha establecido la eficacia de la administración de dosis bajas de insulina por vía intramuscular en el tratamiento de la cetoacidosis diabética. El régimen sugerido consiste en la administración de 10 UI de insulina cristalina por vía intramuscular en forma inmediata al diagnóstico, seguida por 0,1 U/kg/hora intramuscular hasta que desaparezcan la hiperglucemia y la cetoacidosis. Se debe tratar de lograr un descenso de la glucemia de aproximadamente 100 mg/dl/hora. Este método ha demostrado ser útil, seguro y eficiente, muy fácil de realizar por equipos no entrenados en las salas de guardia, y los resultados actuales no establecen dudas respecto de su efectividad.
Con los nuevos análogos de insulina de acción rápida, la administración subcutánea también permite un pico rápido sin los riesgos de la mionecrosis inherentes a la administración intramuscular. La eficacia de la insulina de acción rápida por vía subcutánea se ha demostrado comparable con la de la insulina regular administrada por vía intravenosa. Se sugiere la administración de una insulina de acción rápida, tal como la Lispro o el Aspart, por vía subcutánea cada dos a cuatro horas si no se dispone de administración intravenosa. La administración subcutánea debe ser evitada en pacientes con evidencia de hipotensión o hipovolemia severa debido a que la absorción es menos predecible.
La administración repetida frecuente debe ser evitada, especialmente en presencia de insuficiencia renal, debido a que la administración a intervalos cortos puede producir un efecto acumulativo con hipoglucemia subsecuente. En pacientes con función renal normal, el efecto biológico de los análogos de la insulina de acción rápida persiste por tres a cuatro horas.
V.- En presencia de insulina y adecuada hidratación, la concentración plasmática de glucosa habitualmente disminuye a una velocidad de 75 a 100 mg/dl/hora, y alcanza una concentración de 250-300 mg/dl en seis horas. El bicarbonato plasmático y el pH aumentan más lentamente, y alcanzan valores de 15 a 18 mEq/l y 7,30, respectivamente, en aproximadamente 8 a 12 horas. La discrepancia entre la velocidad de corrección de la hiperglucemia y de la academia tiene importancia clínica. En efecto, el objetivo fundamental en el tratamiento de la cetoacidosis es el clearance completo de los cuerpos cetónicos del plasma y de la orina; por lo tanto, la administración de insulina debe ser continuada hasta que se alcancen niveles satisfactorios de bicarbonato y de pH, a despecho de una normoglucemia relativa.
En general, se estima que un paciente con deterioro de conciencia por cetoacidosis diabética con elevada osmolaridad, requiere el mismo número de horas para aclarar el sensorio que las que necesita para la normalización de la concentración de bicarbonato o el pH sérico. En estos pacientes, se aconseja no disminuir bruscamente los niveles de glucosa, y mantener un nivel de alrededor de 300 mg/dl con la infusión de soluciones de glucosa e insulina, hasta que el paciente esté alerta y orientado.
VI. Administración de somatostatina. En base a los hallazgos fisiopatológicos sobre el rol del glucagón y otras hormonas contrarreguladoras en la génesis de la cetogénesis del coma cetoacidótico, se ha propuesto el empleo de la somatostatina, en dosis de 500 mg/h/EV asociada a la insulina (4 a 8 U/h) para el tratamiento del mismo. Si bien en los estudios reportados los pacientes presentaron una mejoría más rápida de la acidosis, aunque no resulta práctica habitual en el tratamiento de la cetoacidosis.
VII. Una vez que el paciente está lúcido y es capaz de ingerir fluidos, se debe retirar la sonda nasogástrica, el catéter venoso y el catéter urinario, y se realizará al mismo tiempo un urocultivo.
VIII. Un error frecuente en el tratamiento de la cetoacidosis diabética se comete en el momento de la transición de la insulina de la forma intravenosa a la forma subcutánea. La vida media de la insulina intravenosa se mide en minutos y los pacientes pueden presentar una deficiencia rápida de la hormona cuando se discontinúa la terapéutica intravenosa. Esto puede llevar a la recurrencia de la cetoacidosis. Para evitar este problema, el paciente debe recibir una dosis de insulina de efecto prolongado subcutánea dos o tres horas antes de discontinuar la infusión intravenosa.
BIBLIOGRAFÍA CONSULTADA
1. Magee MF, Bhatt BA. Management of descompensated diabetes. Diabetic ketoacidosis and hyperglycemic hyperosmolar syndrome. Critical Care Clinics 2001; 17(1): 75–106
2. Kitabchi AE, Umpierrel GE, Murphy MB, Barrett EJ, Kreisberg RA, Malone JI, Wall BM. Management of hyperglycemic crises in patients with diabetes (technical review). Diabetes Care 2001; 24(1): 131–153
3. Garber AJ. Diabetes Mellitus. In: Stein JH (Editor in Chief). Internal Medicine. Fourth Edition. Mosby; 1994,1391–1424,
4. Pallárdo Sánchez LF. Alteraciones del metabolismo de los hidratos de carbono. En Teixidor RJ, Guardia MJ. Medicina Interna. MASSON SA. 1997,
5. Dagas Ruiz D. Complicaciones agudas de la diabetes mellitus. En: Principios de urgencias, emergencias y cuidados críticos. SAMIUC.
6. Wagner A, Risse A, Brill HL et al. Therapy of severe diabetic ketoacidosis. Diabetes Care 1999,22:674 – 677,
7. Delaney MF, Zisman A, Kettyle WM. Diabetic ketoacidosis and hyperosmolar nonketotic syndrome. Endocrinol Metab Clin North Am 2000; 29(4): 683–705
8. Kitabchi AE, Wall BM. Management of diabetic ketoacidosis. Am Fam Physic 1999; 60: 455 –464
9. Umpierrel GE, Khajavi M, Kitabchi AE. Review: Diabetic ketoacidosis and hyperglycemic hyperosmolar nonketotic syndrome. Am J Med Sci 1996; 311:225–233
10. Kitabchi AE, Wall BM. Diabetic ketoacidosis. Med Clin North Am 1995; 79(1): 9–37
11. Rucker DW. Diabetic ketoacidosis. Medicine Journal 2001; 2(4)
12. American Diabetes Association. Hyperglycemic crises in patients with diabetes mellitus. Diabetes Care 2001; 24 (Suppl 1): S83– S90
13. Laffel L. Sick–day management in type 1 diabetes. Endocrinol Metab Clin North Am 2000; 29 (4): 707–723
14. Laffel L. Ketone bodies: a review of phisiology, pathophisiology and application of monitoring to diabetes. Diabetes Metab Res Rev 1999; 15 (6): 412–426
15. Adrogué HJ, Barrero J, Eknoyan G: Salutary effects of modest fluids replacement in the treatment of adults with diabetic ketoacidosis. Use in patients without extreme volume deficit. JAMA 1989; 262:2108-13.
16. Adrogué HJ, Eknoyan G, Suki WN: Diabetic ketoacidosis: role of the kidney in the acid-base homeostasis re-evaluated. Kidney Int 1984; 25: 591-8.
17. Adrogué HJ, Lederer DE, Suki WN, et al: Determinants of plasma potassium levels in diabetic ketoacidosis. Medicine (Baltimore) 1986; 65: 163-72.
18. Adrogué HJ, Madias EN: Management of life-threatening acid-base disorders (First of two parts). N Engl J Med 1998; 338: 26-34.
19. Adrogué HJ, Tannen RL: Ketoacidosis, hyperosmolar states, and lactic acidosis. In: Kokko JP, Tannen RL, (eds). Fluids and electrolytes. 3rd ed. Philadelphia: W.B. Saunders, 1996; 643-74.
20. Adrogué HJ, Wilson H, Boyd AE, et al: Plasma acid-dase patterns in diabetic ketoacidosis. N Engl J Med 1982; 307: 1603-10.
21. Alberti KGMM, Hockaday TDR, Turner RC: Small doses of intramuscular insulin in the treatment of diabetic "coma". Lancet 1973; 2: 515-22.
22. American Diabetes Association: Hospital admission guidelines for diabetes mellitus. Diabetes Care 1996; 19 (Suppl 1): S37.
23. Baruh S, Sherman L, Markowitz S: Cetoacidosis y coma diabéticos. En: Clínicas Médicas de Norteamérica. Volumen 1/81. México: Nueva Editorial Interamericana, 1981; 115-130.
24. Bazerque F, Caputo D, Kairiyama O: Cetoacidosis diabética. Actualizacion diagnostica y terapéutica. En PROATI. 3º Ciclo. 1º Fascículo. Buenos Aires: Ed. Médica Panamericana, 1998 (En Prensa).
25. Bedalov A, Balasubramanyam A: Glucocorticoid-induced ketoacidosis in gestational diabetes: sequela of the acute treatment of preterm labor. A case report. Diabetes Care 1997; 20: 922-4.
26. Bell DS, Alele J: Diabetic ketoacidosis. Why early detection and aggressive treatment are crucial. Postgrad Med 1997; 101:193-204.
27. Burge MD, Hardy KJ, Schade DS: Short term fasting is a mechanism for the development of euglycemic ketoacidosis during periods of insulin deficiency. J Clin Endocrinol Metab 1993; 76: 1192-98.
28. Caputo DG, Villarejo F, Valle GB, et al: Hidratación en la cetoacidosis diabética. ¿Cómo influye la velocidad de infusión? Medicina (Buenos Aires) 1997; 57: 15-20.
29. Chauhan SP, Perry KG Jr: Management of diabetic ketoacidosis in the obstetric patient. Obstet Gynecol Clin North Am 1995; 22: 143-55.
30. Davis S, Granner D: Insulina, fármacos hipoglucemiantes orales y propiedades farmacologicas del páncreas endocrino. En: Goodman & Gilman Las bases farmacológicas de la terapéutica. 9º ed. Vol II. México: Ed. McGraw-Hill Interamericana, 1996; 1581-613.
31. Gonzalez-Campoy JM, Robertson RP: Diabetic ketoacidosis and hyperosmolar nonketotic state. Gaining control over extreme hyperglycemic complications. Postgrad Med 1996; 99: 143-52.
32. Hammond P, Wallis S: Cerebral edema in diabetic ketoacidosis. Still puzzling and often fatal. BMJ 1992; 305: 203-4.
33. Javor KA, Kotsanos JG, McDonald RC, et al: Diabetic ketoacidosis charges relative to medical charges of adult patients with type I diabetes. Diabetes Care 1997; 20: 349-54.
34. Jenkins D, Close CF, Krentz AJ, et al: Euglycemic diabetic ketoacidosis: does it exist? Acta Diabetolog 1993; 30: 251-53.
35. Kitabchi AE, Wall BM: Diabetic ketoacidosis. Med Clin North Am 1995; 79: 9-37.
36. Kreisberg RA: Diabetic ketoacidosis: revisited again. Mayo Clin Proc 1988; 63: 1144-6.
37. Lebovitz HE: Diabetic ketoacidosis. Lancet 1995; 345: 767-72.
38. Lever E, Jaspan JB: Sodium bicarbonate therapy in severe diabetic ketoacidosis. Am J Med 1983; 75: 263-8.
39. Morris LR, Murphy MB, Kitabchi AE: Bicarbonate therapy in severe diabetic ketoacidosis. Ann Intern Med 1986; 105: 836-40.
40. Muro JF, Campbell IW, McCuish AC, et al: Euglycaemic diabetic ketoacidosis. BMJ 1973; 2: 578-80.
41. Oh MS, Carroll HJ, Uribarri J: Mechanism of normochloremic and hyperchloremic acidosis in diabetic ketoacidosis. Nephron 1990; 54: 1-6.
42. Rosenbloom AL, Hanas R: Diabetic ketoacidosis (DKA): treatment guidelines. Clin Pediatr Phila 1996; 35: 261-6.
43. Silver SM, Clark EC, Schoeder BM, et al: Pathogenesis of cerebral edema after treatment of diabetic ketoacidosis. Kidney Int 1997; 51: 1237-44.
44. Smitherman KO, Peacock JE: Urgencias infecciosas en diabéticos. En: Clínicas Médicas de Norteamérica. Volumen 1/95. México: Ed. Interamericana McGraw-Hill, 1995; 57-82.
45. Villarejo F, Caputo D: Cetoacidosis diabética. En: Pacin J, Dubin A, Gallesio A, Laffaire E, Maskin B, San Román E, (Eds). Terapia Intensiva. 2º Ed. Buenos Aires: Ed. Médica Panamericana, 1995; 590-8.
46. Westphal SA: The occurrence of diabetic ketoacidosis in non-insulin-dependent diabetes and newly diagnosed diabetic adults. Am J Med 1996; 101:19-24.
47. Whiteman VE, Homko CJ, Reece EA: Management of hypoglycemia and diabetic ketoacidosis in pregnancy. Obstet Gynecol Clin North Am 1996; 23:87-107.