Hoy sabemos que las manifestaciones clínicas de la aterosclerosis dependen, tanto de las características biológicas de la placa de ateroma, como del grado de afectación de la luz. Este mayor conocimiento de la biología de la placa, permite dilucidar las diversas vías por las que la aterosclerosis se manifiesta clínicamente, y explica por qué la enfermedad puede permanecer silente o estable durante periodos prolongados y presentar complicaciones agudas en momentos concretos. El mayor conocimiento de la aterogénesis, permite profundizar en la forma en que los tratamientos actuales pueden mejorar el resultado final, a la vez que sugiere los nuevos objetivos de las intervenciones futuras.
Marcadores cardiacos. Patogenia de la Arteriosclerosis. Síndromes Clínicos de Aterosclerosis. Recopilación de Datos y Conclusiones.
J. I. A. Soler Díaz, A. Martinavarro Domínguez, I. Balaguer Segura.
Patogenia de la aterosclerosis.
Según Peter Libby. Principios de Medicina Interna. Harrison (15ª edición. Año 2001).
La Arteria Normal consta de tres capas:
La capa íntima, tapizada por una sola hilera de células endoteliales en contacto con la sangre, contiene células del músculo liso incluidas en la matriz extracelular. La lámina elástica interna forma el borde de la íntima y la separa de la capa media subyacente.
La capa media, contiene capas de células del músculo liso dotadas de una matriz extracelular rica en colágeno y elastina. Las arterias elásticas, como la aorta, contienen láminas concéntricas de células musculares lisas, emparedadas entre bandas densas de elastina. Las arterias musculares tienen una organización más laxa de células musculares lisas dispersas dentro de la matriz. La lámina elástica externa forma el borde entre la capa media y la capa adventicia.
La capa adventicia contiene nervios, algunas células cebadas, y es el origen de los vasa vasorum, que nutren de sangre los dos tercios exteriores de la túnica media.
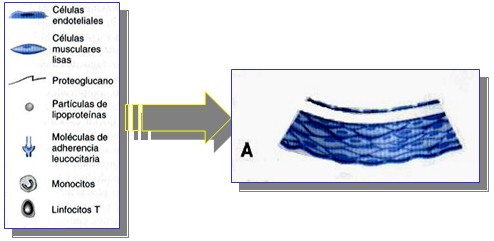
Depósito de Partículas Lipoproteicas.
La lesión inicial de la aterosclerosis es la “estría grasa”. Las partículas lipoproteicas pueden acumularse en la íntima de las arterias, sobre todo cuando su concentración ambiental aumenta, como sucede, por ejemplo, en los estados de hipercolesterolemia, las partículas lipoproteicas suelen asociarse a componentes de la matriz extracelular, en especial a proteoglucanos. Su secuestro dentro de la íntima, separa las lipoproteínas de los antioxidantes del plasma y favorece su oxidación.
Las lipoproteínas de baja densidad (LDL) oxidadas no son homogéneas sino que, en realidad, forman una mezcla variable y mal definida. Estas partículas lipoproteicas modificadas inducen, entonces, una respuesta inflamatoria local que es responsable de los siguientes pasos en el desarrollo de la lesión.
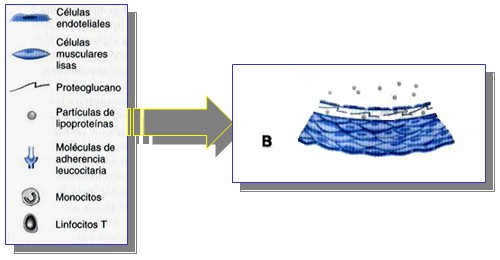
Adherencia de los Leucocitos.
La adherencia al endotelio luminal de los leucocitos mononucleares es un fenómeno precoz de la hipercolesterolemia. La mayor expresión de las distintas moléculas de adherencia para los leucocitos, probablemente pone en marcha el primer eslabón en el reclutamiento de los leucocitos hacia el lugar de la lesión arterial naciente.
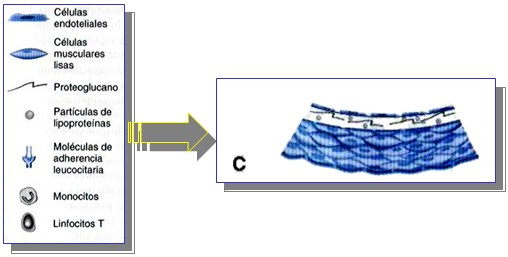
Penetración de los Leucocitos.
Una vez adheridos, algunos leucocitos emigran hacia la íntima. La emigración dirigida de los leucocitos, posiblemente, depende de factores quimiotácticos, entre ellos las propias partículas lipoproteicas modificadas y las citocinas quimiotácticas del tipo de la proteína quimiotáctica de los macrófagos 1, producida en la pared vascular, en respuesta a las lipoproteínas modificadas.
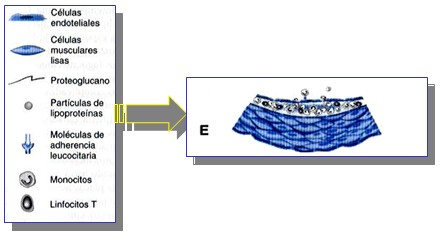
Acumulación de los Leucocitos.
Los leucocitos, residentes en la estría grasa en formación, pueden dividirse y muestran una mayor expresión de los receptores para las lipoproteínas modificadas (receptores encargados de su eliminación). Estos fagocitos mononucleares se embeben de lípidos y se transforman en “células espumosas”, cuyo citoplasma se rodea de gotitas de grasa.
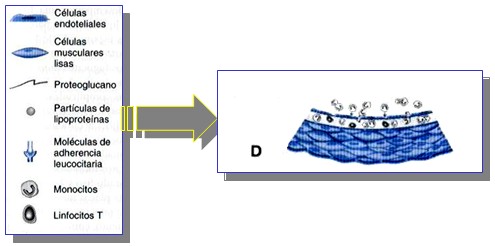
Formación del Casquete Fibroso y Núcleo Lipídico.
A medida que la estría grasa se transforma en una lesión aterosclerótica más compleja, se acumulan células del músculo liso en la íntima en expansión y aumenta la cantidad de matriz extracelular.
El casquete fibroso, formado por la matriz extracelular, elaborado a partir de las células del músculo liso de la íntima. Recubre de manera característica el núcleo lipídico lleno de macrófagos.
Además de dividirse, éstas células del núcleo pueden perecer y liberar su contenido lipídico al espacio extracelular.
Lesiones arteriales en la aterosclerosis. Según el Instituto Europeo de Educación Sanitaria.
La base de la enfermedad aterosclerótica, son las placas arteriales. Desde la estría grasa a la lesión complicada, el proceso de progresión de la placa se realiza en 5 fases, definidas según una serie de características morfológicas, definidas por la American Heart Association (AHA).
La fase 1, es representada por una lesión pequeña del tipo normalmente encontrada en menores de 30 años. Las placas pueden progresar durante años y pueden categorizarse como lesiones tipo I, II y III.
- Las lesiones de tipo I, consisten en células espumosas derivadas de macrófagos que contienen gotas de lípidos.
- Las lesiones de tipo II, consisten en macrófagos y células de músculo liso con lípidos de depósito extracelular, y
- Las de tipo III, consisten en hipertrofia de las células del músculo liso rodeadas por lípidos extracelulares.
La fase 2, consiste en una placa, que no necesariamente es estenótica, pero que puede tener un volumen de lípidos alto y, por consiguiente, puede estar próxima a la ruptura. Dicha placa representa los estadios o tipos morfológicamente categorizados como IV y Va de la lesión.
- El tipo IV, consiste en lesiones celulares confluentes con mucho lípido extracelular.
- En el tipo Va, el lípido extracelular se encuentra en un núcleo recubierto por una capa fibrosa delgada
La fase 2 puede evolucionar a la fase 3 (aguda) o a la fase 4, y cualquiera de las dos puede evolucionar a la fase fibrótica (5). La fase 3, consiste en una “complicación aguda” del tipo VI, como resultado de la ruptura o fisura de una lesión IV o Va, no severamente estenótica, lo que lleva a la formación de un trombo mural, que puede o no ocluir la arteria completamente. Como resultado de los cambios en la geometría de la placa rota y de la organización del trombo mural por tejido conjuntivo, puede progresar a las lesiones estenóticas o fibróticas de tipo Vb o Vc de fase 5, que se puede manifestar, clínicamente, con angina y puede evolucionar a lesiones oclusivas.
Debido a que la estenosis e isquemia previas pueden reforzar la formación de vasos colaterales, la oclusión final puede ser silente o no clínicamente manifiesta. En contraste con la fase 3, la lesión de tipo VI aguda “complicada” en fase 4, se caracteriza por trombos oclusivos, con el desarrollo clínico de un síndrome coronario agudo (SCA). Los trombos oclusivos, sino son lisados de modo espontáneo (fisiológicamente), o farmacológicamente, pueden transformarse en lesiones fibróticas u oclusivas de tipo Vb y Vc de fase 5 con el transcurso del tiempo.
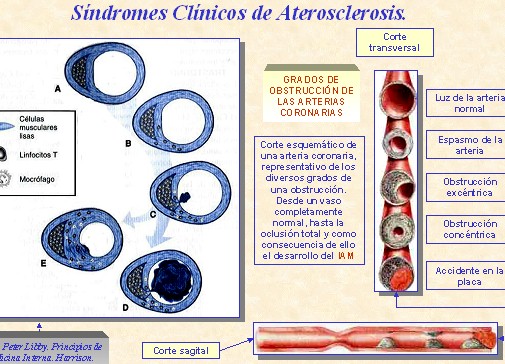
Síndromes clínicos de aterosclerosis.
Según Peter Libby. Principios de Medicina Interna. Harrison (15ª edición. Año 2001).
Las lesiones ateroscleróticas afectan a todo el mundo occidental. La mayoría de los ateromas no producen síntomas y jamás llegarán a causar manifestaciones clínicas. Muchos enfermos con aterosclerosis difusa, fallecen como consecuencia de procesos no relacionados, sin haber experimentado nunca una manifestación clínicamente importante de aterosclerosis.
¿Cuál es la causa de esta variabilidad, de la expresión clínica de la enfermedad aterosclerótica?
La remodelación arterial durante la formación del ateroma (figura A), constituye un aspecto clínicamente importante, pero a menudo despreciado en la evolución de la placa. En las fases iniciales del desarrollo del ateroma, la placa suele crecer alejándose de la luz (crecimiento abluminal). Los vasos afectados por la aterogénesis tienden a aumentar de diámetro, en una especie de remodelación vascular conocida como “agrandamiento compensador”. Hasta que la placa no cubre más del 40% de la circunferencia de la lámina elástica interna, no comienza a estrecharse la luz arterial. Por ello, durante gran parte de su evolución, el ateroma no produce estenosis alguna, con limitación del flujo sanguíneo.
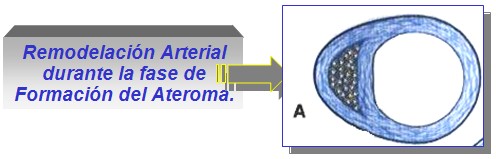
En las fases más avanzadas de la placa, suele aparecer estenosis que dificulta el flujo. Muchas de estas placas se manifiestan, a través de síndromes estables como la angina de pecho inducida por el esfuerzo, o la claudicación intermitente de los miembros. En la circulación coronaria en otros territorios, la oclusión producida por un ateroma no siempre provoca infarto.
El estímulo hipopóxico de las crisis repetidas de isquemia induce de manera característica la formación de vasos colaterales en el miocardio, que mitigan las consecuencias de la obstrucción aguda de una arteria coronaria epicárdica.
Por otro lado, hoy sabemos que muchas lesiones causantes de síndromes ateroscleróticos agudos o inestables, sobre todo en el lecho coronario, se deben a placas de ateroma que no producen una estenosis limitadora de flujo. Estas lesiones, solo ocasionan mínimas irregularidades de la luz en los angiogramas tradicionales y no cumplen los criterios tradicionales de “significación” arteriográfica.
La inestabilidad de estas estenosis no oclusivas, explicaría porque el Infarto de Miocardio constituye la primera manifestación de enfermedad coronaria en cerca de la tercera parte de todos los casos y por qué estos enfermos no refieren antecedentes previos de angina de pecho, un síndrome causado habitualmente por la estenosis que limita el flujo sanguíneo.
Los estudios anatomopatológicos, arrojan mucha luz sobre las causas microanatómicas de la “inestabilidad” de las placas que no provocan estenosis críticas. En general, una erosión superficial del endotelio, o una rotura manifiesta, o fisura de la placa, genera un trombo. Este trombo, puede causar una Angina de Pecho Inestable, o si causa una obstrucción lo bastante prolongada, un Infarto Agudo de Miocardio (figura C).
La rotura del Casquete Fibroso de la Placa (figura C), permite que los factores de coagulación de la sangre entren en contacto con un factor tisular extraordinariamente trombogénico, una proteína procoagulante, expresada por las células espumosas macrófagas, en el núcleo lipídico de la placa. Sí el trombo así formado, no genera oclusión o sólo produce una obstrucción transitoria, el episodio de rotura de la placa puede no causar ningún síntoma, o tan sólo síntomas de isquemia, tales como la Angina en Reposo.
Los trombos oclusivos permanentes, suelen provocar Infarto Agudo de Miocardio, sobre todo en ausencia de una circulación colateral bien desarrollada que irrigue el territorio dañado
Los episodios repetitivos de rotura y cicatrización de la placa, son uno de los mecanismos más probables por los que la “estría grasa” se transforma en una lesión fibrosa más compleja (figura D). El proceso de cicatrización arterial, al igual que el de las heridas cutáneas, se basa en el depósito de nueva matriz extracelular y fibrosis.
No todos los ateromas muestran la misma tendencia a la rotura. Los estudios sobre la anatomía patológica de las lesiones responsables del Infarto Agudo de Miocardio muestran diversos rasgos característicos. Estas placas suelen tener un casquete fibroso fino, un núcleo lipídico bastante grande y un gran contenido de macrófagos. Los análisis morfométricos revelan, que en la zona de rotura de la placa predominan los macrófagos y los linfocitos T, y que estos lugares contienen un número bastante pequeño de células musculares lisas.
Las células que se concentran en las zonas de rotura de la placa, poseen marcadores de activación inflamatoria. La presencia del antígeno HLA-DR de histocompatibilidad o de trasplante, representa un indicador apropiado del grado de inflamación en las células de los ateromas.
Las células en reposo de una arteria normal, rara vez expresan este antígeno de trasplante. Sin embargo, los macrófagos y las células musculares lisas, situados en los lugares de rotura de una placa arterial coronaria humana, sí lo hacen. Por ello, la presencia de macrófagos o de células T con positividad para la HDL-DR, indica una respuesta inflamatoria activa en los lugares de rotura de la placa.
Los mediadores de la inflamación regulan, de hecho, los procesos que controlan la integridad del casquete fibroso de la placa y, por tanto, su tendencia a la rotura. Por ejemplo, la citosina INFg, derivada de las células T, encontrada en las placas de ateroma y necesaria para inducir el HLA-DR presente en los lugares de rotura, puede inhibir el crecimiento y la síntesis de colágeno de las células del músculo liso. Las citocinas derivadas de los macrófagos activados, como el INFa o la IL-1, además del INFg derivado de las células T, facilitan la expresión de las proteinasas que descomponen la matriz extracelular del casquete fibroso de la placa.
Por consiguiente, los mediadores de la inflamación, pueden alterar la síntesis de colágeno necesaria para mantener y reparar el casquete fibroso e inducir la degradación de las macromoléculas de la matriz extracelular, procesos que debilitan el casquete y favorecen su rotura. Por el contrario, las placas con una matriz extracelular densa y un casquete fibroso realmente grueso, sin un núcleo lipídico considerable, parecen bastante resistentes a la rotura y no suelen provocar trombosis.
En conclusión, hoy sabemos que las manifestaciones clínicas de la aterosclerosis dependen, tanto de las características biológicas de la placa de ateroma, como del grado de afectación de la luz. Este mayor conocimiento de la biología de la placa, permite dilucidar las diversas vías por las que la aterosclerosis se manifiesta clínicamente, y explica por qué la enfermedad puede permanecer silente o estable durante periodos prolongados y presentar complicaciones agudas en momentos concretos. El mayor conocimiento de la aterogénesis, permite profundizar en la forma en que los tratamientos actuales pueden mejorar el resultado final, a la vez que sugiere los nuevos objetivos de las intervenciones futuras.