Enriquecimiento inoculo bacterias nitrificantes tratamiento aguas residuales crecimiento .2
Pre inóculo para bacterias nitrificantes
Se preparó con la finalidad de bioestimular al consorcio de bacterias nitrificantes previo a su incorporación a los sistemas de enriquecimiento y consiste en 500 mL de medio mínimo mineral al cual se le incorporó 1 mL del consorcio de bacterias nitrificantes, el medio mínimo mineral contiene 250 mL de solución de sales A con NaH2PO4H2O, K2HPO4 y NH4SO4 y 250 mL de solución de sales B con FeSO4 7 H2O, Mg SO4, ZnCl2 y CaCl2 diluidas en agua destilada estéril para un volumen final de 1 Lt de medio. Posteriormente se separaron 2 alícuotas de este pre inóculo dispensándolo en frascos estériles de vidrio con tapa de rosca para ser incorporados a los sistemas.
Sistemas de enriquecimiento para bacterias nitrificantes
Se instalaron 3 sistemas de reacción conteniendo las siguientes especificaciones:
a) Sistema I: Contiene 3 Litros de agua de laguna esterilizada por filtración en membrana.
b) Sistema II: Contiene 3 Litros de agua de laguna esterilizada por filtración en membrana y 250 mL del pre inóculo del consorcio comercial de bacterias nitrificantes.
c) Sistema III: Contiene 3 Litros de agua de laguna esterilizada por filtración en membrana, enriquecida con 141.6 mg de Sulfato de Amonio [(NH4)2SO4], 26.4 mg de Fosfato Di básico de Potasio (K2HPO4) y 150 mg de Bicarbonato de Sodio (NaHCO3), de acuerdo a lo propuesto por Achuthan et al (2005), además 250 mL pre inóculo descrito anteriormente.
Determinación de Nitritos en los Sistemas de enriquecimiento
Se tomó un 30 mL de agua cada 72 horas en cada uno de los sistemas partiendo del tiempo “cero” del inóculo. La determinación de nitritos se realizó por la metodología colorimétrica comercial, empleando un espectrofotómetro HACH 2700, cada valor se dispuso en tablas de registro y se graficó para el análisis.
Determinación de masa celular
Para evidenciar el crecimiento celular dentro de los sistemas inoculados, se tomaron 100 mL de agua presente en cada sistema, se filtró empleando un sistema de bombeo al vacío con membranas de acetato de celulosa por separado, cada membrana se desecó por un periodo de 90 minutos y se pesó en una balanza analítica previo a la filtración para eliminar las trazas de humedad y determinar su peso inicial. Luego de la filtración se repitió el proceso de secado y pesada para obtener el peso final, la masa celular se calculó por diferencia de los pesos inicial y final dividiendo entre el volumen de muestra filtrada (100 mL).
Masa celular (mg/ml) = (Peso post - desecación (mg) – Peso predesecación) / Volumen de agua filtrado (100 mL)
Las mediciones y cálculos, fueron registradas a través de tablas y representadas en gráficos de curvas de progresión para nitritos y masa celular.
DISCUSIÓN Y RESULTADOS
Tabla 1: Concentración de Nitritos y masa celular en sistemas de enriquecimiento para bacterias nitrificantes
Figura 1: Evolución de la concentración de Nitritos en los sistemas de enriquecimiento para bacterias nitrificantes
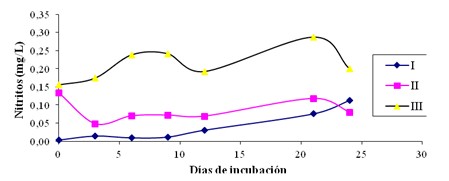
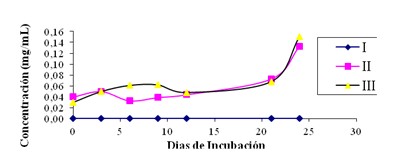
Figura 2: Evolución de la masa celular en los sistemas de enriquecimiento para bacterias nitrificantes
En los sistemas instalados se puede observar que la concentración de nitritos fue superior en el sistema III respecto a los demás sistemas desde el inicio de las mediciones, seguida por los sistemas II y I respectivamente, debe recordarse que el sistema III posee una concentración de sales de amonio superior a la de los demás sistemas, siendo este el sustrato empleado por las bacterias del género Nitrosomonas para oxidarlo y convertirlo en nitrito, en cambio en los sistemas I y II la disponibilidad de sustratos es más limitada ya que los sistemas nitrificantes solo cuentan con la disponibilidad de sales de amonio presentes inicialmente en el agua de laguna.
Si se observa la evolución de estos parámetros tanto en el sistema II como en el sistema III en el día 21 se observa un máximo en la concentración de nitritos seguida de una disminución al día 24, sin embargo se hacen necesarias más mediciones para poder obtener un comportamiento mantenido a través del tiempo. (Figura 1).
Respecto a los valores obtenidos al determinar la masa celular de los sistemas utilizados, se tiene que en el sistema I a lo largo del periodo de incubación, no hubo ningún incremento de la masa celular, contrario a lo que puede visualizarse en los sistemas II y III entre los cuales se mantiene una masa celular relativamente similar que va aumentando de modo ostensible a partir del día 21 de incubación, nuevamente se necesitan períodos más prolongados de incubación que permitan observar el real mantenimiento de este patrón a través del tiempo, esto consecuencia del crecimiento lento que presentan las bacterias nitrificantes autotróficas. (Figura 2).
Por último, se hace necesario diseñar protocolos experimentales más prolongados con modelos estadísticos que permitan definir un medio de enriquecimiento significativamente ideal en los sistemas estudiados que permitan simplificar la incorporación de los consorcios de bacterias nitrificantes aerobias a los sistemas de tratamiento para remover nitrógeno de los efluentes, es de especial importancia incorporar la medición de amonio y nitrato para tener una real estimación del comportamiento de las especies de Nitrobacter que están incorporadas a estas comunidades bacterianas así como del proceso de nitrificación en su totalidad.
REFERENCIAS BIBLIOGRÁFICAS
Achuthan, C., Rejissh, V., Manju, N., Philip, R., Bright, L. (2005). Development of nitrifying bacterial consortia for inmovilizing in nitrifying bioreactors designed for penaeid and non – penaeid larval rearing systems in the tropics. IJMS. 35, 240 – 248.
Avnimelech, Y. (2009). Biofloc Technology: A Practical Guide Book. The World Aquaculture Society, Louisiana.
Bertola N., Ruiz F., Contreras E.M (2004) "Efecto de las condiciones ambientales sobre la velocidad de respiración de microorganismos nitrificantes". 14vo Congreso Argentino de Saneamiento y Medio Ambiente, Buenos Aires. Memorias.
Cervantes – Carrillo, F., Pérez, J., Gómez, J. (2000). Avances en la eliminación biológica del Nitrógeno de las aguas residuales. Rev. L. Microbiol. 42, 73-82.